Method Article
Trasplante de tumores para evaluar la dinámica de las células T CD8+ infiltrantes de tumores en ratones
En este artículo
Erratum Notice
Resumen
Aquí, presentamos un protocolo de trasplante tumoral para la caracterización de linfocitos infiltrados tumorales inherentes y derivados de la periferia en un modelo de tumor de ratón. El rastreo específico de la afluencia de células inmunes derivadas del receptor con citometría de flujo revela la dinámica de los cambios fenotípicos y funcionales de estas células durante las respuestas inmunes antitumorales.
Resumen
La inmunidad mediada por células T desempeña un papel crucial en las respuestas inmunes contra los tumores, con los linfocitos T citotóxicos (CTL) desempeñando el papel principal en la erradicación de las células cancerosas. Sin embargo, los orígenes y la reposición de las células T CD8+ específicas del antígeno tumoral dentro del microambiente tumoral (TME) permanecen oscuros. Este protocolo emplea la línea celular de melanoma B16F10-OVA, que expresa de manera estable el neoantígeno sustituto, la ovoalbúmina (OVA) y los ratones ot-I transgénicos T Tcr, en los que más del 90% de las células T CD8 + reconocen específicamente el péptido derivado de OVAOVA 257-264 (SIINFEKL) unido a la molécula H2-Kb del complejo de histocompatibilidad mayor (MHC) de clase I. Estas características permiten el estudio de las respuestas de las células T específicas del antígeno durante la tumorigénesis.
Combinando este modelo con la cirugía de trasplante tumoral, los tejidos tumorales de los donantes se trasplantaron a ratones receptores singénicos compatibles con tumores para rastrear con precisión la afluencia de células inmunes derivadas del receptor en los tejidos de donantes trasplantados, lo que permitió el análisis de las respuestas inmunes de CD8 + específico del antígeno inherente al tumor y originado en la periferia. Células T. Se encontró que se produjo una transición dinámica entre estas dos poblaciones. En conjunto, este diseño experimental ha proporcionado otro enfoque para investigar con precisión las respuestas inmunes de las células T CD8 + en TME, lo que arrojará nueva luz sobre la inmunología tumoral.
Introducción
La respuesta inmune mediada por células T CD8 + juega un papel fundamental en el control del crecimiento tumoral. Durante la tumorigénesis, las células T CD8+ naïve se activan tras el reconocimiento de antígenos de una manera restringida a MHC clase I y posteriormente se diferencian en células efectoras y se infiltran en la masa tumoral 1,2. Sin embargo, dentro del microambiente tumoral (EMT), la exposición prolongada al antígeno, así como los factores inmunosupresores, llevan a las células T CD8+ infiltradas específicas del tumor a un estado hiporesponesivo conocido como "agotamiento"3. Las células T agotadas (Tex) son distintas de las células T efectoras o de memoria generadas en la infección viral aguda, tanto transcripcional como epigenéticamente. Estas células Tex se caracterizan principalmente por la expresión sostenida y elevada de una serie de receptores inhibitorios, así como por la pérdida jerárquica de las funciones efectoras. Además, la capacidad proliferativa deteriorada de las células T CD8 + agotadas da como resultado una disminución del número de células T específicas del tumor, de modo que las células T CD8 + residuales dentro de la EMT apenas pueden proporcionar suficiente inmunidad protectora contra la progresión tumoral3. Por lo tanto, el mantenimiento o refuerzo de las células T CD8+ específicas del antígeno intratumoral es indispensable para la represión tumoral.
Además, se cree que la terapia de bloqueo del punto de control inmunitario (ICB) revitaliza el Tex en los tumores al aumentar la infiltración de células T y, por lo tanto, el número de células T y rejuvenecer las funciones de las células T para aumentar la represión tumoral. La aplicación generalizada del tratamiento con ICB ha cambiado el panorama de la terapia contra el cáncer, con un subconjunto sustancial de pacientes que experimentan respuestas duraderas 4,5,6. Sin embargo, la mayoría de los pacientes y tipos de cáncer no responden o solo responden temporalmente al ICB. Se ha postulado que la infiltración inadecuada de células T en la EMT es uno de los mecanismos subyacentes que explican la resistencia al ICB 7,8.
Diversos estudios han demostrado la heterogeneidad de las células T CD8+ infiltrantes tumorales (TIL) tanto en pacientes como en modelosde ratón 9,10,11,12. Se ha confirmado que un subconjunto de células T CD8 + que expresan factor 1 de células T (TCF1) en una masa tumoral exhibe propiedades similares a las de las células madre, lo que podría dar lugar a células T agotadas terminalmente y es responsable del estallido de proliferación después de la terapia ICB 12,13,14,15,16,17,18,19,20, 21,22. Sin embargo, se ha demostrado que solo una pequeña proporción de células TCF1 + CD8 + específicas de antígenos existen en la EMT y generan un grupo ampliado de progenie diferenciada en respuesta a ICB 23,24,25,26. Se desconoce si el tamaño limitado de esta población es suficiente para garantizar la persistencia de los linfocitos T citotóxicos (CTL) para controlar la progresión del tumor, y si hay reposición de los tejidos periféricos requiere más investigación. Además, investigaciones recientes sugieren la insuficiente capacidad de revitalización de las células T preexistentes específicas del tumor y la aparición de clonotipos nuevos y previamente inexistentes después del tratamiento antiprogramado con la proteína 1 de muerte celular. Esto indica que la respuesta de las células T al bloqueo del punto de control puede deberse a la nueva afluencia de un repertorio distinto de clones de células T27. Junto con la presencia de una fracción de células T citotóxicas no reactivas al tumor en la EMT, estos hallazgos impulsaron el establecimiento de un modelo de aloinjerto tumoral para estudiar el papel de las células T CD8 + derivadas de la periferia11.
Hasta ahora, varios tipos de implantación tumoral, así como la transferencia adoptiva de células inmunes, se han utilizado ampliamente en el campo de la inmunología tumoral28. Los TIL, las células mononucleares de sangre periférica y las células inmunes reactivas a tumores originadas en otros tejidos se pueden caracterizar bien utilizando estos métodos. Sin embargo, al estudiar las interacciones entre la inmunidad antitumoral sistémica y local, estos modelos parecen inadecuados para examinar las interacciones entre las células inmunes derivadas de la periferia y la EMT. Aquí, los tejidos tumorales se trasplantaron de donantes a ratones receptores compatibles con tumores para rastrear con precisión la afluencia de células inmunes derivadas del receptor y observar las células derivadas de donantes en el TME concomitantemente.
En este estudio, se estableció un modelo singénico murino de melanoma con la línea celular de melanoma B16F10-OVA, que expresa de manera estable el neoantígeno sustituto ovalbúmina. Los ratones OT-I transgénicos TCR, en los que más del 90% de las células T CD8+ reconocen específicamente el péptido derivado de OVA OVA257-264 (SIINFEKL) unido a la molécula MHC de clase I H2-Kb, permiten el estudio de las respuestas de células T específicas de antígeno desarrolladas en el modelo tumoral B16F10-OVA. Combinando este modelo con el trasplante de tumores, se compararon las respuestas inmunes de las células T CD8+ específicas del antígeno inherente al tumor y originadas en la periferia para revelar una transición dinámica entre estas dos poblaciones. En conjunto, este diseño experimental ha proporcionado otro enfoque para investigar con precisión las respuestas inmunes de las células T CD8 + en la EMT, lo que arroja nueva luz sobre la dinámica de las respuestas inmunes de las células T específicas del tumor en la EMT.
Protocolo
Todos los experimentos con ratones se realizaron de acuerdo con los lineamientos de los Comités Institucionales de Cuidado y Uso de Animales de la Tercera Universidad Médica Militar. Use ratones C57BL/6 de 6-8 semanas de edad y ratones transgénicos OT-I ingenuos que pesen 18-22 g. Use tanto hombre como mujer sin aleatorización o "cegamiento".
1. Preparación de medio y reactivos
- Prepare el medio de cultivo celular D10 como se describió anteriormente29 agregando 10% de suero fetal bovino (FBS), 100 U / ml de penicilina, 100 mg / ml de estreptomicina y 2 mM de L-glutamina en el medio águila modificada de Dulbecco.
- Prepare el medio de cultivo celular R10 suplementando RPMI-1640 con 10% de FBS, 100 U/mL de penicilina y 100 mg/ml de estreptomicina.
NOTA: Los medios de cultivo, D10 y R10, pueden permanecer estériles y estables durante al menos 2 semanas cuando se almacenan a 2-4 °C. - Prepare el tampón de clasificación celular activada por fluorescencia (FACS) complementando 1x solución salina tamponada con fosfato (PBS) con 2% de FBS y 0.01% de azida de sodio.
NOTA: Con la adición de azida de sodio, FACS Buffer se puede almacenar a 2-4 ° C durante meses. - Prepare el tampón de lisis de glóbulos rojos (RBL) agregando 155 mM NH4Cl, 10 mM KHCO3 y 0.1 mM de ácido etilendiamina tetraacético (EDTA) en agua de doble destilación, y ajuste su pH a 7.3.
NOTA: El búfer RBL es estable hasta por 3 meses a temperatura ambiente (RT). - Prepare un tampón de clasificación celular activado magnéticamente (MACS) complementando PBS con albúmina sérica bovina (BSA) al 0,5% y EDTA de 2 mM.
NOTA: La solución debe pasarse a través de un filtro de 0,22 μm después de que el reactivo se disuelva y se conserve en asepsia. - Prepare una solución de trabajo de 2,2,2-tribromoetanol.
- Disolver 2,5 g de 2,2,2-tribromoetanol en 5 ml de alcohol terc-amílico (2-metil-2-butanol). Agregue un vibrador de temperatura constante que se bañe con vapor a 180 rpm, a 40 ° C durante la noche.
- Filtre la solución a través de un filtro de 0,22 μm en un recipiente estéril. Agregue agua doble destilada hasta un volumen final de 200 ml y mezcle a fondo y continuamente hasta que la solución se vuelva clara y transparente.
- Determine y ajuste el valor de pH de la solución a 7.3. Envuelva completamente el recipiente con papel de aluminio para excluir la luz y guárdelo a 4 °C.
NOTA: La concentración final de la solución de trabajo de 2,2,2-tribromoetanol es de 12,5 mg/ml. No se recomienda una solución más concentrada porque el material es irritante a concentraciones más altas. Pruebe el valor de pH de la solución de trabajo antes de cada uso y deséchelo si el pH es inferior a 5.
2. Preparación de la suspensión celular B16F10-OVA
NOTA: El cultivo celular debe llevarse a cabo en una campana de bioseguridad bajo estrictas condiciones asépticas.
- Descongelar y cultivar un vial de células B16F10-OVA con D10 en una incubadora de cultivo celular a 37 °C y 5% de CO2.
- Cuando las células alcanzan la confluencia de alrededor del 80-90%, subcultivan las células.
- Retire el medio de cultivo con un pipeteador y enjuague las células dos veces con PBS.
NOTA: No agregue PBS con fuerza contra las células adherentes en el matraz o plato de cultivo celular. En su lugar, pipetee el PBS hacia una pared lateral o agréguelo gota a gota en el matraz o plato. - Retire el PBS y agregue 1-2 ml de solución de tripsina-EDTA al 0.25% en el matraz o plato. Mézclalo hacia adelante y hacia atrás para cubrir toda la superficie celular. Coloque el matraz o plato en una incubadora a 37 °C durante ~1 min o en RT hasta que las células se desprendan.
NOTA: Se puede usar un microscopio invertido para verificar si las células se han desprendido. - Agregue D10 fresco para detener la tripsinización. Pipete la suspensión hacia arriba y hacia abajo para asegurarse de que todas las células estén disociadas de la superficie del matraz o del plato.
- Transfiera la suspensión celular B16F10-OVA a un tubo cónico de 15 ml. Centrifugar las células a 125 × g durante 5-7 min en RT.
- Deseche el sobrenadante y vuelva a suspender el pellet celular con D10. Dispensar la suspensión celular B16F10-OVA en un nuevo matraz o placa de cultivo celular que contenga D10 e incubar en una incubadora de cultivo celular a 37 °C y 5% de CO2.
- Retire el medio de cultivo con un pipeteador y enjuague las células dos veces con PBS.
- El día de la implantación del tumor, recolecte células B16F10-OVA que sean ~ 90% confluentes como se describe en los pasos 2.2.1 a 2.2.4. Deseche el sobrenadante y vuelva a suspender el pellet celular con 1 ml de PBS.
- Cuente las células viables con un hemocitómetro usando azul de tripano al 0,4%. Ajuste la densidad celular a 1 × 106 celdas por 100 μL agregando PBS. Mantenga las células en hielo.
3. Implantación tumoral ectópica de células B16F10-OVA en la región inguinal de ratones
- Use ratones C57BL/6 de 6-8 semanas de edad que pesen 18-22 g. Use tanto hombre como mujer sin aleatorización o "cegamiento".
- Extraiga 100 μL de la suspensión de células B16F10-OVA preparada en una jeringa de tuberculina de 1 ml. Toque el barril para mover las burbujas a la parte superior y empuje suavemente el émbolo para eliminar las burbujas de aire.
- Sujete al ratón y exponga su abdomen. Presione la pata trasera izquierda con el dedo meñique para tensar la piel de la región inguinal izquierda.
- Retire el vello del ratón de su abdomen inferior izquierdo con una afeitadora eléctrica. Use algodón empapado en etanol al 75% para limpiar el cuadrante posterior del abdomen izquierdo.
- Sosteniendo la jeringa en un ángulo muy poco profundo (0-15 °) con el bisel de la aguja hacia arriba, insértela en el sitio de la parte superior izquierda del muslo y avance 0.5-1 cm a través del tejido subcutáneo hacia la región inguinal.
- Tire hacia atrás del émbolo antes de la inyección. Si hay presión negativa, presione el émbolo por completo y observe que emerge un pequeño bolo (formación de bolsa de líquido) en el subcutis.
NOTA: Si se extrae sangre de nuevo en el centro de la aguja, retírese e intente de nuevo en otro sitio. - Retire la aguja después de que se realice la inyección y deséchela adecuadamente. Suelte y coloque el ratón de nuevo en la jaula.
- Mida el tamaño del tumor en los días 6-8 utilizando una escala vernier después de la implantación de B16F10-OVA. Seleccione ratones con un tumor de ~ 3 mm de diámetro (tamaño de frijol mungo) y divídalos por igual y al azar en dos grupos.
NOTA: Los ratones con tumores de tamaño similar se asignan al azar como ratones donantes y receptores; el tejido tumoral compatible extirpado de ratones donantes se trasplantará a los ratones receptores. Además, se deben incluir controles no operados y controles operados simuladamente para evaluar los efectos de la cirugía en la transferencia de células adoptivas y en la salud general de los ratones. Por lo tanto, un grupo de ratones portadores de tumores sirve como controles no operados, recibiendo células CD45.1 + CD45.2 + o CD45.1 + OT-I pero sin cirugía. El otro grupo de ratones sirve como controles operados simuladamente, recibiendo células CD45.1 + CD45.2 + o CD45.1 + OT-I y cirugía posterior similar al grupo experimental, pero sin trasplante de aloinjerto.
4. Transferencia adoptiva de células T OT-I marcadas congénitamente en ratones portadores de tumores
- El día anterior a la transferencia, administrar 4 mg de ciclofosfamida disuelta en 200 μL de PBS mediante inyección intraperitoneal a cada ratón portador de tumor.
NOTA: El tratamiento con ciclofosfamida tiene como objetivo inducir linfopenia en el huésped que produce "espacio" para las células transferidas, promoviendo su supervivencia y la orientación a los órganos linfoides para que funcionen de manera eficiente. - Use ratones transgénicos OT-I ingenuos con marcadores congénicos distintos (6-8 semanas de edad, 18-22 g, del mismo sexo que los ratones portadores de tumores). Utilice ratones CD45.1+ OT-I y ratones CD45.1+CD45.2+ OT-I para transferir adoptivamente células T específicas del antígeno OVA257-264 a ratones donantes y receptores portadores de tumores, respectivamente.
NOTA: El origen de las células OT-I transferidas adoptivamente se puede identificar fácilmente si muestran marcadores congénicos o fluorescentes distintos. Por ejemplo, inyecte células T OT-I CD45.1 + en ratones donantes portadores de B16F10-OVA mientras inyecta células T OT-I CD45.1 + CD45.2 + en ratones receptores portadores de B16F10-OVA. CD45.1 y CD45.2 son isoformas del marcador de panlinfocitos CD45 (Ly5). Otros marcadores congénicos de uso común incluyen diferentes isoformas de CD90 (Thy1). Este protocolo se puede utilizar para ratones portadores de diferentes marcadores congénicos. Los ratones OT-I deben ser del mismo sexo que los ratones que reciben la transferencia de células OT-I para evitar problemas de rechazo. - Aislar los linfocitos del bazo y los ganglios linfáticos del ratón OT-I.
NOTA: Los siguientes procedimientos en este paso deben realizarse en un gabinete de bioseguridad para mantener una asepsia estricta.- Preparar dos placas de Petri de 60 mm × 10 mm. Agregue 3 ml de R10 medio en un plato mientras agrega 3 ml de tampón RBL en otro plato. Coloque un colador de células de nylon de 70 μm en el plato que contenga el tampón RBL.
- Eutanasiar a un ratón OT-I en una cámara isoflurano seguido de dislocación cervical.
- Cosechar los ganglios linfáticos del bazo, inguinal (subiliaco) y axilar del ratón y transferirlos a un plato de 60 mm × 10 mm con 3 ml de R10 en hielo.
NOTA: El número de ratones OT-I sacrificados puede ajustarse dependiendo del número de ratones portadores de tumores que se transferirán. Un rendimiento típico de células T OT-I CD8 + de un bazo y ganglios linfáticos inguinales y axilares bilaterales de células T OT-I CD8 + es de ~ 30-100 × 106 células por ratón. - Usando el barril final de una jeringa de 1 ml, macerar el bazo en 3 ml de tampón RBL a través del colador. Incubar durante 3 min a RT, y terminar la reacción añadiendo 3 mL de medio frío R10.
- Triture los ganglios linfáticos hasta que solo queden tejidos conectivos. Enjuague el filtro con R10. Transfiera la suspensión celular a un nuevo tubo cónico de 15 ml. Centrifugadora a 500 × g, 4 °C durante 6 min.
- Decantar el sobrenadante, y resuspendir las células en 3 mL de tampón MACS. Pase la suspensión celular a través de un nuevo colador celular de 70 μm para eliminar cualquier flóculo.
- Centrifugar la suspensión celular a 500 × g durante 5 min a 4 °C. Decantar el sobrenadante.
- Utilice un kit de aislamiento de células T CD8+ de ratón (consulte la Tabla de materiales) para purificar las células T CD8+ por selección negativa, según el protocolo del fabricante.
NOTA: Cuando utilice kits de otras compañías, siga las instrucciones del fabricante. - Mantenga la suspensión celular purificada en hielo. Tome una pequeña muestra de células y mezcle con azul de tripano para contar las células usando un hemocitómetro.
- Determinar el porcentaje de células OT-I (vivas/muertas-CD8+Va2+) mediante citometría de flujo.
NOTA: Se debe realizar la tinción simultánea de marcadores congénicos y el TCR transgénico para verificar el fenotipo correcto de las células antes de la transferencia.- Agregue 5 × 104-1 × 105 celdas en 1 ml de tampón FACS en un tubo centrífugo de 1,5 ml, y centrífique la suspensión celular a 350 × g, 4 ° C durante 3 min.
- Deseche el sobrenadante y disperse las células moviendo la parte inferior del tubo. Coloque el tubo sobre hielo.
- Preparar las siguientes mezclas de anticuerpos conjugados (diluidos en tampón FACS de 100 μL): anti-CD8, 1:200; anti-TCR Vα2, 1:100; anti-CD45.1, 1:200; anti-CD45.2, 1:200; y vivos/muertos, 1:200 (consulte la Tabla de Materiales).
- Vórtice el cóctel de anticuerpos y centrífuga a 15.000 × g durante 3 min para granular los agregados de anticuerpos. Guarde el cóctel en hielo y protéjalo de la luz.
- Resuspend las células con 100 μL de cóctel de anticuerpos y mezclar bien moviendo el tubo. Incubar en la oscuridad durante 30 minutos sobre hielo.
NOTA: Evite perturbar los agregados de anticuerpos en la parte inferior del tubo. - Lave los gránulos dos veces con 1 ml de tampón FACS. Centrifugadora a 350 × g, 4 °C durante 3 min. Resuspend las células en 200 μL de tampón FACS y transfiera la suspensión celular a un tubo FACS.
NOTA: Para mantener la viabilidad de las células OT-I a transferir, pruebe la muestra lo antes posible. Si las células OT-I teñidas no se pueden probar inmediatamente, mantenga las celdas en la oscuridad sobre hielo o refrigere a 4 ° C hasta el análisis. Alternativamente, las muestras se pueden resuspendir en paraformaldehído al 1-4% para un almacenamiento prolongado (16 h) para evitar el deterioro. - Ejecute la muestra en un citómetro de flujo. Calcule el porcentaje de células vivas/muertas-CD8+Va2+ dividiendo el número de células vivas/muertas-CD8+Vα2+ por el número de células vivas/muertas.
- Determinar el número absoluto de células OT-I (vivas/muertas-CD8+Va2+) multiplicando el porcentaje de células vivas/muertas-CD8+Va2+ por el número de células viables obtenidas en el paso 4.3.9.
- Ajuste la concentración de células OT-I (vivas/muertas-CD8+Va2+) a 1,5 × 106/mL con PBS.
- Inyecte 3 × 105 células OT-I distintas marcadas congénitamente (vivas/muertas-CD8+Va2+) en 200 μL de PBS por vía intravenosa en dos grupos de ratones portadores de B16F10-OVA (ratones portadores de tumores divididos en ratones donantes y receptores a partir del paso 3.8).
- Retire 200 μL de suspensión de células OT-I (CD8+Va2+) vivas/muertas en una jeringa de insulina de 100 U (29 G) y retire las burbujas como en el paso 3.2.
- Coloque el ratón por separado en una jaula con una lámpara infrarroja sobre la jaula durante 5-10 minutos para dilatar la vena de la cola. Inmovilice el ratón con un dispositivo de sujeción del tamaño adecuado. Tire de la cola para enderezarla y rocíe con etanol al 75% para que la vena sea visible.
- Sostenga la jeringa paralela a la vena e insértela en la vena en un ángulo de 0-15°. Tire ligeramente hacia atrás del émbolo y, si la sangre entra en el barril, inyecte lenta y constantemente la suspensión a una velocidad de no más de 1 ml / min.
NOTA: La resistencia o hinchazón en el sitio de inyección indica que la aguja no está dentro de la vena; el sitio de inyección debe moverse proximalmente. - Después de completar la inyección, retire la jeringa y presione el área de inserción suavemente durante 3-5 s para detener el sangrado. Devuelva el ratón a la jaula y obsérvelo de cerca durante unos minutos para detectar reacciones adversas. Si tiene movilidad normal y secreción nasal, colóquelo de nuevo en compañía de los otros ratones.
5. Diseccionar la masa tumoral de ratones donantes portadores de tumores
NOTA: Mantener condiciones estériles durante la cirugía en las secciones 5 y 6. Esterilizar todos los instrumentos quirúrgicos en autoclave antes y después de cada uso. Desinfecte el área de operación en el gabinete de bioseguridad con etanol al 75% seguido de irradiación ultravioleta. Use una bata limpia, gorra, máscara facial y guantes estériles.
- De ocho a diez días después de la transferencia adoptiva, seleccione ratones donantes con una masa tumoral comparable de ~ 5 mm de diámetro (tamaño de soja) para la cirugía de trasplante.
- Prepare un plato de 100 mm × 20 mm en un gabinete de bioseguridad y agregue 10 ml de PBS helado estéril.
- Eutanasiar a un ratón donante portador de tumor en una cámara de isoflurano seguido de dislocación cervical. Sumerja el ratón en etanol al 75% durante 3-5 minutos y transfiéralo al gabinete de bioseguridad.
NOTA: Los siguientes procedimientos en este paso deben realizarse en un gabinete de bioseguridad para mantener una asepsia estricta. - Coloque el ratón sobre una tabla de disección cubierta con papel absorbente limpio en posición supina. Sujete las extremidades del ratón con agujas de disección.
- Corte la piel a lo largo de la línea media desde arriba del orificio uretral hasta el xifoide con tijeras. Estire la piel hacia el lado izquierdo del cuerpo del ratón con pinzas y sujete la piel con agujas de disección.
- Extirpar el tumor, manteniendo su cápsula lo más intacta posible. Extraiga con cuidado y suavidad el tejido conectivo cerca del tumor con tijeras quirúrgicas.
NOTA: Para mantener la integridad del tumor, no despegue la cápsula del tumor ni corte el tejido tumoral en pedazos. - Coloque el tejido tumoral en un plato de 100 mm × 20 mm que contenga 10 ml de PBS helado estéril para su posterior trasplante.
6. Trasplante subcutáneo de tumor derivado de un donante en los ratones receptores compatibles con el tumor
NOTA: Se supone que el aloinjerto se implanta en el flanco inferior del ratón en el mismo lado que el tumor previamente existente para hacer que dos tumores drenen al ganglio linfático idéntico. En el protocolo aquí presentado, como el tumor B16F10-OVA se implantó por vía subcutánea en la región inguinal izquierda del ratón (sección 3), el tejido tumoral derivado del donante se trasplantó en el flanco izquierdo del receptor en este paso. El sitio de trasplante se puede adaptar al sitio del tumor implantado por primera vez.
- Anestesiar a un ratón receptor compatible con el tumor con 250 mg/kg de 2,2,2-tribromoetanol mediante inyección intraperitoneal. Pellizque el dedo del pie de una extremidad extensora del ratón para evaluar el nivel de anestesia y espere la falta de reflejo de dolor, lo que indica la profundidad adecuada de la anestesia para realizar la cirugía. Si se observa vocalización o retirada de las extremidades posteriores, inyecte más 0.01−0.03 mL de 2,2,2-tribromoetanol.
NOTA: El ratón receptor compatible con el tumor debe ser del mismo sexo que el ratón donante que proporciona el aloinjerto para evitar problemas de rechazo. - Use ungüento veterinario en los ojos para prevenir la sequedad. Afeitar el flanco izquierdo del ratón con una afeitadora eléctrica. Aplicar una crema depilatoria para eliminar el vello restante.
NOTA: Evite la desgastación de la piel, lo que puede aumentar el riesgo de contaminación e infección. - Coloque el ratón en el gabinete de bioseguridad. Colóquelo en posición prona sobre un tablero de disección cubierto con papel absorbente limpio, con el eje vertical del ratón paralelo y su cabeza hacia el lado derecho del experimentador.
NOTA: Los siguientes procedimientos en este paso deben realizarse en un gabinete de bioseguridad para mantener una asepsia estricta. - Frote la piel del área afeitada con algodón empapado en povidona yodada.
NOTA: Use povidona yodada en lugar de etanol al 75% para la esterilización para evitar la pérdida de calor corporal. - Levante la piel en el punto central entre las articulaciones de la cadera del ratón con pinzas quirúrgicas. Use las tijeras para hacer una escisión vertical de 5 mm de largo. Extienda el corte rostralmente a lo largo de la línea media dorsal a ~ 10-15 mm.
- Realice una disección aguda insertando las puntas cerradas de las tijeras en la incisión y luego abriéndolas para separar el peritoneo del flanco izquierdo de la piel y el tejido blando.
NOTA: Para evitar causar daño al tejido subcutáneo y al peritoneo, levante la piel en el centro de la incisión y luego inserte las tijeras cerradas lo más cerca posible de la piel. - Haga un bolsillo de piel en el flanco izquierdo realizando una disección aguda varias veces. Deposite la masa tumoral encapsulada e intacta derivada del donante en la cápsula.
NOTA: Los ratones en el grupo de control operado simulado reciben la misma operación de cirugía sin el trasplante de tumor derivado del donante. - Cierre la incisión por sutura interrumpida (consulte lista de materiales). Coloque 2-3 suturas para cada incisión. Desinfecte la piel alrededor del corte con algodón empapado en povidona yodada.
NOTA: Debe haber 5 mm entre dos puntos consecutivos y una distancia de 3 mm de la incisión. - Coloque el ratón en la posición lateral en una jaula limpia y cálida. Monitoréelo continuamente hasta que haya recuperado la conciencia suficiente para mantener la reclinación esternal.
- Administrar buprenorfina por vía subcutánea a una dosis de 0,1 mg/kg de peso corporal cada 8 h tres veces después de la cirugía para aliviar el dolor. Monitoree la comida, la bebida, el movimiento y el área operada por el ratón. Devuelva al receptor del trasplante a la compañía de otros animales solo después de que se haya recuperado por completo.
NOTA: El ratón generalmente se recupera del trauma de la cirugía dentro de los 3 días. Si el ratón no ha vuelto a la alimentación y movilidad normales y muestra alguna manifestación de infección, consulte a un veterinario para las intervenciones o eutanasia. - Sacrificar (sacrificar a los animales como en el paso 4.3.2) los ratones en los puntos de tiempo indicados, y recuperar las células de interés para el análisis citométrico de flujo.
Resultados
El esquema de este protocolo se muestra en la Figura 1. Ocho días después de la inoculación tumoral, se inyectaron células OT-I CD45.1+ y CD45.1+CD45.2+ en ratones C57BL/6 portadores de tumores B16F10-OVA. El tumor se diseccionó quirúrgicamente de ratones implantados con células OT-I CD45.1 + (donante) el día 8 posterior a la transferencia y se trasplantó a ratones implantados con células OT-I CD45.1 + CD45.2 + compatibles con el tumor (receptor) en el flanco dorsal en el mismo lado que el tumor implantado. A través del análisis de citometría de flujo (estrategia de cierre que se muestra en la Figura 2), se pueden identificar fácilmente dos poblaciones de células T específicas de antígeno tumoral CD44 + CD8 + en la EMT, incluidas las TIL derivadas del donante CD45.1 + y CD45.1 + CD45.2 + derivadas del receptor. Posteriormente, las proporciones de estas dos poblaciones dentro de los aloinjertos se analizaron en los puntos de tiempo indicados para estudiar la dinámica de las células T CD8+ específicas del antígeno. En el día 2 después del trasplante, había ~ 83% de células T CD8 + específicas de antígeno derivado del donante dentro del tumor trasplantado, más predominantes que sus contrapartes derivadas del receptor. Sin embargo, la proporción de células OT-I derivadas del receptor se elevó en la etapa tardía de la tumorigénesis, superando las células OT-I inherentes al tumor derivadas del donante. (Figura 3).
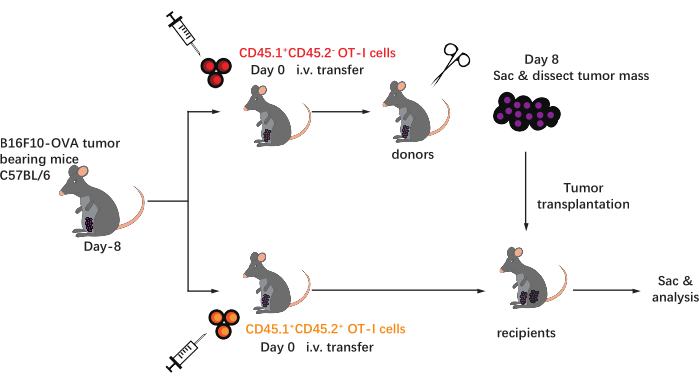
Figura 1: Esquema del diseño experimental. C57BL/6mice son desafiados con tumor B16F10-OVA en el área inguinal. Ocho días después, diferentes células OT-I marcadas congénitamente (CD45.1 + o CD45.1 + CD45.2 +) se transfieren a ratones portadores de tumores. En el día 8 después de la transferencia, el tumor en los ratones implantados con células OT-I CD45.1 + se disecciona quirúrgicamente y se trasplanta por vía subcutánea en receptores implantados con células OT-I CD45.1 + CD45.2 + compatibles con el tumor en el flanco del mismo lado que el tumor existente. Luego, los ratones se sacrifican y las células T específicas del antígeno (células OT-I) dentro de los aloinjertos se analizan en los puntos de tiempo indicados. Abreviaturas: CD = grupo de diferenciación; i.v. = intravenosa; Saco = sacrificio. Haga clic aquí para ver una versión más grande de esta figura.
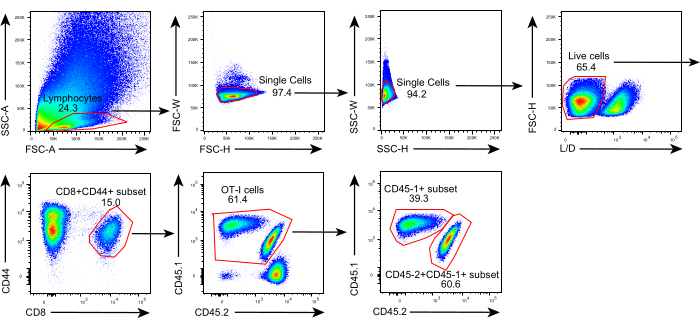
Figura 2: Estrategia de gating del análisis de citometría de flujo. Estrategia de gating utilizada para identificar células T CD44+CD8+ derivadas de donantes (CD45.1+CD45.2+) derivadas de receptores (CD45.1+CD45.2+) dentro de los aloinjertos. Abreviaturas: SSC-A = área de dispersión lateral; FSC-A = área de dispersión hacia adelante; FSC-W = ancho de dispersión hacia adelante; FSC-H = altura de dispersión hacia adelante; SSC-W = ancho de dispersión lateral; SSC-H = altura de dispersión lateral; L/D = vivo/muerto; CD = grupo de diferenciación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: La proporción de células T CD8+ específicas de antígeno derivado del donante y del receptor dentro de los aloinjertos tumorales. Gráficos de citometría de flujo representativos que muestran la expresión de los marcadores congénicos CD45.1 y CD45.2 utilizados para identificar células OT-I derivadas de donantes y receptores dentro de los aloinjertos tumorales en los días 2, 8 y 15 después del trasplante. Los números representan los porcentajes de los dos subconjuntos en la población de células T CD44+CD8+ . Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La inmunidad mediada por células T juega un papel crucial en las respuestas inmunes contra los tumores, con las CTL desempeñando el papel principal en la erradicación de las células cancerosas. Sin embargo, no se han dilucidado los orígenes de las CTL específicas de antígeno tumoral dentro de laEMT 30. El uso de este protocolo de trasplante tumoral ha proporcionado una pista importante de que las células T CD8 + específicas del antígeno intratumoral pueden no persistir durante mucho tiempo, a pesar de la existencia de células T CD8 + progenitoras T TCF1 + similares a tallos. En particular, hay una afluencia continua de células T CD8 + específicas del tumor derivadas de la periferia en la masa tumoral.
Hasta donde sabemos, este es un método relativamente conveniente y convincente que confirma que el mantenimiento de las células T CD8 + específicas del antígeno dentro de la EMT depende predominantemente de la reposición de células T CD8 + específicas del tumor derivadas de la periferia en lugar de la autorrenovación de los TIL residentes en el tumor. Aunque el protocolo presentado aquí solo se centra en las proporciones de TIL derivados de donantes y receptores, las propiedades fenotípicas, funcionales y transcripcionales de estas dos poblaciones se pueden examinar fácilmente con citometría de flujo. Además, es factible combinar anticuerpos ICB para investigar las respuestas de un subconjunto celular específico a la terapia ICB.
En este protocolo, el tejido tumoral derivado del donante se trasplanta al ratón receptor con un tumor original existente. Dos tumores en un ratón receptor conducirán a la distribución de las células T generadas por la periferia en dos masas tumorales. Además, la carga tumoral casi se duplicará en comparación con los animales sin trasplantes. En experimentos piloto, intentamos extirpar el tumor original en ratones receptores antes del trasplante; sin embargo, fue técnicamente difícil eliminar todas las células tumorales mediante cirugía a fondo. Las células tumorales residuales formarían rápidamente un nuevo tejido tumoral pronto. Por lo tanto, existe una limitación para este sistema al comparar las respuestas inmunes de las células T con las de los ratones no trasplantados. Sin embargo, este sistema sigue siendo útil para la comparación de células T recientemente migradas y existentes dentro de la misma EMT que se trasplanta de ratones portadores de tumores de donantes. Además, no se puede negar que el trasplante de tejido tumoral puede conducir a la inflamación, lo que podría influir en la dinámica de las células inmunes dentro del tumor. Aunque el impacto de la cirugía en la infiltración de células OT-I podría excluirse a través de controles no operados y operados simuladamente, no se evaluaron los efectos de las respuestas inflamatorias locales a la dinámica celular OT-I.
Se deben tener en cuenta algunas consideraciones, una de las cuales es el uso de ciclofosfamida. La ciclofosfamida31 es un agente alquilante ampliamente utilizado para tratar neoplasias malignas de órganos sólidos y trastornos linfoproliferativos y autoinmunes. De seis a ocho días después de la inoculación de B16F10-OVA, se administra ciclofosfamida antes de la transferencia adoptiva para inducir la linfodepleción de ratones huésped y mejorar la actividad de las células OT-I transferidas29. Aunque el melanoma no es sensible a este reactivo, algunas líneas celulares tumorales, como EG732, una línea celular de linfoma tímico murino, responden a la ciclofosfamida. El tratamiento de ratones portadores de EG7 con ciclofosfamida da como resultado la erradicación de tumores, lo que sugiere que la ciclofosfamida debe usarse o titularse cuidadosamente para modelos de tumores sensibles. El método alternativo recomendado es una dosis subletal única de radiación (4,5-5,5 Gy) un día antes de la transferencia, y la elección óptima depende de la característica de las líneas celulares tumorales.
Se deben tomar otras medidas con precaución, incluida la selección cuidadosa de ratones donantes portadores de tumores y la delicada operación quirúrgica durante el trasplante de tumores. Los tumores implantados se extirparían quirúrgicamente y se trasplantarían a ratones receptores compatibles con tumores de 8 a 10 días después de la transferencia. Antes del trasplante, se debe elegir un tamaño comparable de masa tumoral de ~ 5 mm de diámetro como aloinjerto para reducir las discrepancias entre ratones individuales y hacer que los datos adquiridos sean más confiables. Además, durante la cirugía, la incisión debe estar cerca de la línea media de la espalda del ratón para mantener el aloinjerto a una distancia del tumor ya existente en el ratón receptor. También se sugiere una disección suave para prevenir lesiones en el ganglio linfático inguinal y los tejidos circundantes.
La matanza efectiva de células cancerosas requiere la coordinación de varios componentes dentro del TME33. El protocolo presentado aquí se puede extender a la investigación de células inmunes adaptativas e innatas, como células asesinas naturales, macrófagos asociados a tumores y células dendríticas. Además, además del B16F10-OVA utilizado aquí, este protocolo se puede aplicar a otros modelos de tumores subcutáneos. Para concluir, el mencionado ensayo de trasplante tumoral ofrece un nuevo enfoque para el estudio de las transiciones interactivas de ciertos tipos de células inmunes durante las respuestas antitumorales y es útil para los investigadores en inmunología tumoral.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este estudio fue apoyado por subvenciones del Fondo Nacional de Ciencias Naturales para Jóvenes Académicos Distinguidos (No. 31825011 a LY) y la Fundación Nacional de Ciencias Naturales de China (No. 31900643 a QH, No. 31900656 a ZW).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore | SLGPR33RB | |
| 1 mL tuberculin syringe | KDL | BB000925 | |
| 1.5 mL centrifuge tube | KIRGEN | KG2211 | |
| 100 U insulin syringe | BD Biosciences | 320310 | |
| 15 mL conical tube | BEAVER | 43008 | |
| 2,2,2-Tribromoethanol (Avertin) | Sigma | T48402-25G | |
| 2-Methyl-2-butanol | Sigma | 240486-100ML | |
| 70 μm nylon cell strainer | BD Falcon | 352350 | |
| APC anti-mouse CD45.1 | BioLegend | 110714 | Clone:A20 |
| B16F10-OVA cell line | bluefbio | BFN607200447 | |
| BSA-V (bovine serum albumin) | Bioss | bs-0292P | |
| BV421 Mouse Anti-Mouse CD45.2 | BD Horizon | 562895 | Clone:104 |
| cell culture dish | BEAVER | 43701/43702/43703 | |
| centrifuge | Eppendorf | 5810R-A462/5424R | |
| cyclophosphamide | Sigma | C0768-25G | |
| Dulbecco's Modified Eagle Medium | Gibco | C11995500BT | |
| EasySep Mouse CD8+ T Cell Isolation Kit | Stemcell Technologies | 19853 | |
| EDTA | Sigma | EDS-500g | |
| FACS tubes | BD Falcon | 352052 | |
| fetal bovine serum | Gibco | 10270-106 | |
| flow cytometer | BD | FACSCanto II | |
| hemocytometer | PorLab Scientific | HM330 | |
| isoflurane | RWD life science | R510-22-16 | |
| KHCO3 | Sangon Biotech | A501195-0500 | |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit, for 633 or 635 nm excitation | Life Technologies | L10199 | |
| needle carrier | RWD Life Science | F31034-14 | |
| NH4Cl | Sangon Biotech | A501569-0500 | |
| paraformaldehyde | Beyotime | P0099-500ml | |
| PE anti-mouse TCR Vα2 | BioLegend | 127808 | Clone:B20.1 |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PerCP/Cy5.5 anti-mouse CD8a | BioLegend | 100734 | Clone:53-6.7 |
| RPMI-1640 | Sigma | R8758-500ML | |
| sodium azide | Sigma | S2002 | |
| surgical forceps | RWD Life Science | F12005-10 | |
| surgical scissors | RWD Life Science | S12003-09 | |
| suture thread | RWD Life Science | F34004-30 | |
| trypsin-EDTA | Sigma | T4049-100ml |
Referencias
- Blank, C. U., et al. Defining 'T cell exhaustion. Nature Reviews Immunology. 19 (11), 665-674 (2019).
- Leko, V., Rosenberg, S. A. Identifying and targeting human tumor antigens for T cell-based immunotherapy of solid tumors. Cancer Cell. 38 (4), 454-472 (2020).
- McLane, L. M., Abdel-Hakeem, M. S., Wherry, E. J. CD8 T cell exhaustion during chronic viral infection and cancer. Annual Review of Immunology. 37, 457-495 (2019).
- Davis, M. M., Brodin, P. Rebooting human immunology. Annual Review of Immunology. 36, 843-864 (2018).
- Sharma, P., Allison, J. P. The future of immune checkpoint therapy. Science. 348 (6230), 56-61 (2015).
- Littman, D. R. Releasing the brakes on cancer immunotherapy. Cell. 373 (16), 1490-1492 (2015).
- Verma, V., et al. PD-1 blockade in subprimed CD8 cells induces dysfunctional PD-1(+)CD38(hi) cells and anti-PD-1 resistance. Nature Immunology. 20, 1231-1243 (2019).
- Hashimoto, M., et al. CD8 T cell exhaustion in chronic infection and cancer: opportunities for interventions. Annual Review of Medicine. 69, 301-318 (2018).
- Dammeijer, F., et al. The PD-1/PD-L1-checkpoint restrains T cell immunity in tumor-draining lymph nodes. Cancer Cell. 38 (5), 685-700 (2020).
- Buchwald, Z. S., et al. Tumor-draining lymph node is important for a robust abscopal effect stimulated by radiotherapy. Journal for ImmunoTherapy of Cancer. 8 (2), 000867(2020).
- Philip, M., Schietinger, A. Heterogeneity and fate choice: T cell exhaustion in cancer and chronic infections. Current Opinion in Immunology. 58, 98-103 (2019).
- Miller, B. C., et al. Subsets of exhausted CD8(+) T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. 20, 326-336 (2019).
- Wu, T. D., et al. Peripheral T cell expansion predicts tumour infiltration and clinical response. Nature. 579, 274-278 (2020).
- Im, S. J., Konieczny, B. T., Hudson, W. H., Masopust, D., Ahmed, R. PD-1+ stemlike CD8 T cells are resident in lymphoid tissues during persistent LCMV infection. Proceedings of the National Academy of Sciences of the United State of America. 117 (8), 4292-4299 (2020).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Myers, L. M., et al. A functional subset of CD8(+) T cells during chronic exhaustion is defined by SIRPalpha expression. Nature Communications. 10 (1), 794(2019).
- Jansen, C. S., et al. An intra-tumoral niche maintains and differentiates stem-like CD8 T cells. Nature. 576, 465-470 (2019).
- Jadhav, R. R., et al. Epigenetic signature of PD-1+ TCF1+ CD8 T cells that act as resource cells during chronic viral infection and respond to PD-1 blockade. Proceedings of the National Academy of Sciences of the United State of America. 116 (28), 14113-14118 (2019).
- Li, H., et al. Dysfunctional CD8 T cells form a proliferative, dynamically regulated compartment within human melanoma. Cell. 176 (4), 775-789 (2018).
- Kurtulus, S., et al. Checkpoint blockade immunotherapy induces dynamic changes in PD-1(-)CD8(+) tumor-infiltrating T cells. Immunity. 50 (1), 181-194 (2019).
- Fransen, M. F., et al. Tumor-draining lymph nodes are pivotal in PD-1/PD-L1 checkpoint therapy. JCI Insight. 3 (23), 124507(2018).
- E, J. F., et al. CD8(+)CXCR5(+) T cells in tumor-draining lymph nodes are highly activated and predict better prognosis in colorectal cancer. Human Immunology. 79 (6), 446-452 (2018).
- Snell, L. M., et al. CD8(+) T cell priming in established chronic viral infection preferentially directs differentiation of memory-like cells for sustained immunity. Immunity. 49 (4), 678-694 (2018).
- Siddiqui, I., et al. Intratumoral Tcf1(+)PD-1(+)CD8(+) T cells with stem-like properties promote tumor control in response to vaccination and checkpoint blockade immunotherapy. Immunity. 50 (1), 195-211 (2019).
- Wang, Y., et al. The transcription factor TCF1 preserves the effector function of exhausted CD8 T cells during chronic viral infection. Frontiers in Immunology. 10, 169(2019).
- Krishna, S., et al. Stem-like CD8 T cells mediate response of adoptive cell immunotherapy against human cancer. Science. 370 (6522), 1328-1334 (2020).
- Yost, K. E., et al. Clonal replacement of tumor-specific T cells following PD-1 blockade. Nature Medicine. 25, 1251-1259 (2019).
- Zitvogel, L., Pitt, J. M., Daillere, R., Smyth, M. J., Kroemer, G. Mouse models in oncoimmunology. Nature Reviews Cancer. 16 (12), 759-773 (2016).
- Li, Y., et al. Bcl6 preserves the suppressive function of regulatory T cells during tumorigenesis. Frontiers in Immunology. 11, 806(2020).
- Yu, D., Ye, L. A portrait of CXCR5(+) follicular cytotoxic CD8(+) T cells. Trends in Immunology. 39 (12), 965-979 (2018).
- Bracci, L., et al. Cyclophosphamide enhances the antitumor efficacy of adoptively transferred immune cells through the induction of cytokine expression, B-cell and T-cell homeostatic proliferation, and specific tumor infiltration. Clinical Cancer Research. 13 (2), 644-653 (2007).
- Salem, M. L., El-Naggar, S. A., Mahmoud, H. A., Elgharabawy, R. M., Bader, A. M. Cyclophosphamide eradicates murine immunogenic tumor coding for a non-self-antigen and induces antitumor immunity. International Journal of Immunopathology and Pharmacology. 32, 1-5 (2018).
- Thorsson, V., et al. The Immune landscape of cancer. Immunity. 48 (4), 812-830 (2018).
Erratum
Formal Correction: Erratum: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice
Posted by JoVE Editors on 4/29/2022. Citeable Link.
An erratum was issued for: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice. The Protocol was updated.
Step 6.10 of the Protocol was updated from:
Administer penicillin every 8-12 h after the surgery for 3 days. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The administration of buprenorphine is suggested to prevent post-surgical pain [delete sentence]. The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
to:
Administer buprenorphine subcutaneously at a dose of 0.1 mg/kg body weight every 8 h three times after surgery to alleviate the pain. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados