Method Article
Transplante de tumor para avaliar a dinâmica das células CD8+ T que se infiltram em tumores em camundongos
Neste Artigo
Erratum Notice
Resumo
Aqui, apresentamos um protocolo de transplante de tumor para a caracterização de linfócitos derivados de tumores inerentes ao tumor e periferia em um modelo de tumor de camundongos. O rastreamento específico do influxo de células imunes derivadas do receptor com citometria de fluxo revela a dinâmica das alterações fenotípicas e funcionais dessas células durante as respostas imunológicas antitumorais.
Resumo
A imunidade mediada por células T desempenha um papel crucial nas respostas imunes contra tumores, com linfócitos T citotóxicos (CTLs) desempenhando o papel principal na erradicação das células cancerosas. No entanto, as origens e a reposição das células CD8+ T específicas do antígeno tumoral dentro do microambiente tumoral (TME) permanecem obscuras. Este protocolo emprega a linha celular de melanoma B16F10-OVA, que expressa de forma estável os camundongos substitutos neoantígeno, ovalbumin (OVA) e TCR transgênicos OT-I, nos quais mais de 90% das células T CD8+ reconhecem especificamente o peptídeo derivado do OVA OVA257-264 (SIINFEKL) ligado à molécula H2-K(S2-K) do complexo de histocompatibilidade (MHC) da classe I. Essas características permitem o estudo de respostas de células T específicas de antígeno durante a tumorigênese.
Combinando este modelo com a cirurgia de transplante de tumores, os tecidos tumorais de doadores foram transplantados em camundongos receptores sinénicos compatíveis com tumores para rastrear precisamente o fluxo de células imunes derivadas do receptor em tecidos transplantados, permitindo a análise das respostas imunes do CD8+ específico para o tumor e da periferia. Células T. Verificou-se uma transição dinâmica entre essas duas populações. Coletivamente, este design experimental forneceu outra abordagem para investigar com precisão as respostas imunes das células T CD8+ em TME, o que lançará uma nova luz sobre a imunologia tumoral.
Introdução
A resposta imune mediada por células T CD8+ desempenha um papel fundamental no controle do crescimento do tumor. Durante a tumorigênese, as células T CD8+ ingênuas são ativadas no reconhecimento de antígeno de forma restrita à classe I do MHC e, posteriormente, se diferenciam em células efetivas e se infiltram na massa tumoral 1,2. No entanto, dentro do microambiente tumoral (TME), exposição prolongada ao antígeno, bem como fatores imunossupressores, conduzem células CD8+ T específicas do tumor infiltradas em um estado hiporesponsivo conhecido como "exaustão"3. As células T exaustas (Tex) são distintas das células T de efeito ou memória geradas em infecção viral aguda, tanto transcrição quanto epigeneticamente. Estas células Tex são caracterizadas principalmente pela expressão sustentada e elevada de uma série de receptores inibitórios, bem como pela perda hierárquica das funções de efeitos. Além disso, a capacidade proliferativa prejudicada de células T CD8+ esgotadas resulta na diminuição do número de células T específicas do tumor, de tal forma que as células T cd8+ residuais dentro do TME mal podem fornecer imunidade protetora suficiente contra a progressão do tumor3. Assim, a manutenção ou reforço das células CD8+ T específicas do antígeno intratumoral é indispensável para a repressão tumoral.
Além disso, acredita-se que a terapia de bloqueio de ponto de verificação imunológica (ICB) revigore Tex em tumores, aumentando a infiltração de células T e, portanto, o número de células T e rejuvenescendo as funções celulares T para aumentar a repressão tumoral. A aplicação generalizada do tratamento de ICB mudou o cenário da terapia oncológica, com um subconjunto substancial de pacientes experimentando respostas duráveis 4,5,6. No entanto, a maioria dos pacientes e tipos de câncer não respondem ou apenas temporariamente ao ICB. A infiltração inadequada de células T no TME foi postulada como um dos mecanismos subjacentes que explicam a resistência ao ICB 7,8.
Vários estudos demonstraram a heterogeneidade das células T CD8+ (TILs) infiltradas em tumores em ambos os pacientes e modelos de camundongos 9,10,11,12. Foi confirmado que um subconjunto de células T CD8+ expressando fator T celular-1 (TCF1) em uma massa tumoral exibe propriedades semelhantes a células-tronco, o que poderia ainda dar origem a células T terminais e é responsável pela explosão de proliferação após a terapia icb 12,13,14,15,16,17,18, 19,20, 21,22. No entanto, foi comprovado que apenas uma pequena proporção de células TCF1+CD8+ específicas de antígenos existem no TME e geram um pool expandido de descendência diferenciada em resposta ao ICB 23,24,25,26. Se o tamanho limitado dessa população é suficiente para garantir a persistência dos linfócitos T citotóxicos (CTLs) para controlar a progressão do tumor permanece desconhecido, e se há reposição dos tecidos da periferia requer uma investigação mais aprofundada. Além disso, pesquisas recentes sugerem a capacidade de revigoração insuficiente de células T pré-existentes específicas do tumor e o aparecimento de clonótipos novos, anteriormente não existentes após o tratamento da proteína de morte celular anti-programada 1. Isso indica que a resposta da célula T ao bloqueio de ponto de verificação pode ser devido ao novo fluxo de um repertório distinto de clones de células T27. Juntamente com a presença de uma fração de célula t citotóxica não-tumora-reativa no TME, esses achados levaram o estabelecimento de um modelo de aoentrato tumoral para estudar o papel das células T CD8+ derivadas da periferia11.
Até agora, vários tipos de implantação tumoral, bem como transferência de células imunes, têm sido amplamente utilizados no campo da imunologia tumoral28. TILs, células mononucleares de sangue periféricos e células imunes tumorais reativas originárias de outros tecidos podem ser bem caracterizados usando esses métodos. No entanto, ao estudar as interações entre imunidade antitumor sistêm e local, esses modelos parecem inadequados para examinar as interações entre células imunes derivadas da periferia e do TME. Aqui, os tecidos tumorais foram transplantados de doadores em camundongos receptores compatíveis com tumores para rastrear precisamente o fluxo de células imunes derivadas do receptor e observar as células derivadas do doador no TME concomitantemente.
Neste estudo, foi estabelecido um modelo síngênico de melanoma murina com a linha celular de melanoma B16F10-OVA, que expressa a facadas o ovalbumina neoantígeno substituto. Camundongos OT-I transgênicos TCR, nos quais mais de 90% das células T CD8+ reconhecem especificamente o peptídeo derivado de OVA OVA257-264 (SIINFEKL) ligado à molécula classe I MHC H2-Kb, permitem o estudo de respostas de células T específicas de antígeno desenvolvidas no modelo de tumor B16F10-OVA. Combinando esse modelo com o transplante de tumores, as respostas imunes das células CD8+ T específicas do tumor e da periferia foram comparadas para revelar uma transição dinâmica entre essas duas populações. Coletivamente, este design experimental forneceu outra abordagem para investigar precisamente as respostas imunes das células T CD8+ no TME, o que lança uma nova luz sobre a dinâmica das respostas imunes de células T específicas do tumor no TME.
Protocolo
Todos os experimentos com camundongos foram realizados em conformidade com as diretrizes dos Comitês Institucionais de Cuidado e Uso de Animais da Terceira Universidade Médica Militar. Use camundongos C57BL/6 de 6-8 semanas de idade e camundongos transgênicos OT-I ingênuos pesando 18-22 g. Use tanto o macho quanto o feminino sem randomização ou "cegueira".
1. Preparação de médios e reagentes
- Prepare a cultura celular média D10 como descrito anteriormente29 adicionando 10% de soro bovino fetal (FBS), penicilina de 100 U/mL, estreptomicina de 100 mg/mL e 2 mM de L-glutamina no Meio Águia Modificada de Dulbecco.
- Prepare a cultura celular média R10 suplementando RPMI-1640 com 10% de FBS, penicilina U/mL e estreptomicina de 100 mg/mL.
NOTA: Os meios de cultura, D10 e R10, podem permanecer estéreis e estáveis por pelo menos 2 semanas quando armazenados a 2-4 °C. - Prepare o tampão de triagem celular ativado por fluorescência (FACS) suplementando 1x salina tamponada com fosfato (PBS) com 2% de FBS e 0,01% de azida de sódio.
NOTA: Com a adição de azida de sódio, o TAMPÃO FACS pode ser armazenado a 2-4 °C por meses. - Prepare o tampão de lise de glóbulos vermelhos (RBL) adicionando 155 mM NH4Cl, 10 mM KHCO3 e 0,1 mM ácido tetraacetic de etilenodiamina (EDTA) em água duplamente destilada, e ajuste seu pH para 7,3.
NOTA: O buffer RBL está estável por até 3 meses à temperatura ambiente (TR). - Prepare o buffer de classificação celular ativado por magnético (MACS) suplementando PBS com albumina de soro bovino de 0,5% (BSA) e 2 mM EDTA.
NOTA: A solução deve ser transmitida através de um filtro de 0,22 μm após a dissolução do reagente e preservada em assepsia. - Prepare uma solução de trabalho de 2,2,2 tribromoetanol.
- Dissolver 2,5 g de 2,2,2-tribromoetanol em 5 mL de álcool tert-amililo (2-metil-2-butanol). Misture um vibrador de vapor, de temperatura constante a 180 rpm, 40 °C durante a noite.
- Filtre a solução através de um filtro de 0,22 μm em um recipiente estéril. Adicione água duplamente destilada até um volume final de 200 mL, e misture completamente e continuamente até que a solução fique clara e transparente.
- Determine e ajuste o valor do pH da solução para 7.3. Enrole completamente o recipiente com papel alumínio para excluir a luz e armazene a 4 °C.
NOTA: A concentração final da solução de trabalho de 2,2,2 tribromoetanol é de 12,5 mg/mL. Uma solução mais concentrada não é recomendada porque o material é irritante em concentrações mais elevadas. Teste o valor do pH da solução de trabalho antes de cada uso e descarte-o se o pH for inferior a 5.
2. Preparação da suspensão celular B16F10-OVA
NOTA: A cultura celular deve ser realizada em um capô de biossegurança sob estritas condições assépticas.
- Degelo e cultura um frasco de células B16F10-OVA com D10 em uma incubadora de cultura celular a 37 °C e 5% de CO2.
- Quando as células atingem a confluência de cerca de 80-90%, subcultura as células.
- Remova o meio de cultura com um pipettor e enxágue as células duas vezes usando PBS.
NOTA: Não adicione PBS com força contra as células aderentes no frasco ou na cultura celular. Em vez disso, pipete o PBS em direção a uma parede lateral ou adicione-o em forma de gota no frasco ou prato. - Retire o PBS e adicione 1-2 mL de solução trypsin-EDTA de 0,25% no frasco ou prato. Arrase para frente e para trás para cobrir toda a superfície celular. Coloque o frasco ou prato em uma incubadora a 37 °C por ~1 min ou no RT até que as células se desprendem.
NOTA: Um microscópio invertido pode ser usado para verificar se as células se separaram. - Adicione D10 fresco para parar a trippsinização. Pipeta a suspensão para cima e para baixo para garantir que todas as células sejam dissociadas do frasco ou superfície do prato.
- Transfira a suspensão da célula B16F10-OVA para um tubo cônico de 15 mL. Centrifugar as células a 125 × g por 5-7 min no RT.
- Descarte o supernatante e resuspenque a pelota celular com D10. Dispense a suspensão da célula B16F10-OVA em um novo prato de cultura de frasco ou célula contendo D10 e incubar em uma incubadora de cultura celular a 37 °C e 5% de CO2.
- Remova o meio de cultura com um pipettor e enxágue as células duas vezes usando PBS.
- No dia da implantação do tumor, colhe células B16F10-OVA que são ~90% confluentes como descrito nas etapas 2.2.1 a 2.2.4. Descarte o supernasce e resuspenque a pelota celular com 1 mL de PBS.
- Conte as células viáveis com um hemócito usando 0,4% de tripano azul. Ajuste a densidade celular para 1 × 106 células por 100 μL adicionando PBS. Mantenha as células no gelo.
3. Implantação de tumor ectópico de células B16F10-OVA na região inguinal de camundongos
- Use camundongos C57BL/6 de 6-8 semanas pesando 18-22 g. Use tanto o macho quanto o feminino sem randomização ou "cegueira".
- Retire 100 μL da suspensão celular B16F10-OVA preparada em uma seringa tuberculina de 1 mL. Toque no barril para mover bolhas para cima e empurre suavemente o êmbolo para remover bolhas de ar.
- Contenha o rato e exponha seu abdômen. Pressione a perna traseira esquerda com o dedo mindinho para apertar a pele da região inguinal esquerda.
- Remova o cabelo do rato do abdômen inferior esquerdo com uma máquina de barbear elétrica. Use algodão encharcado em 75% de etanol para limpar o quadrante posterior do abdômen esquerdo.
- Segurando a seringa em um ângulo muito raso (0-15°) com o bisel da agulha voltado para cima, insira-a no local da coxa superior esquerda e avance 0,5-1 cm através do tecido subcutâneo para a região inguinal.
- Puxe para trás no êmbolo antes da injeção. Se houver pressão negativa, deprime o êmbolo inteiramente, e observe um pequeno bolus (formação de bolso fluido) na subcutia.
NOTA: Se o sangue for retirado de volta para o cubo da agulha, retire-se e tente novamente em outro local. - Remova a agulha após a injeção ser realizada e descarte-a adequadamente. Solte e coloque o rato de volta na gaiola.
- Meça o tamanho do tumor nos dias 6-8 usando uma escala vernier após a implantação de B16F10-OVA. Selecione camundongos com um tumor de ~3 mm de diâmetro (tamanho de feijão mung) e divida-os igual e aleatoriamente em dois grupos.
NOTA: Camundongos com tumores de tamanho semelhante são aleatoriamente atribuídos como doadores e camundongos receptores; o tecido tumoral compatível excisado de camundongos doadores será transplantado para os camundongos receptores. Além disso, controles não operados e controles operados por farsas devem ser incluídos para avaliar os efeitos da cirurgia na transferência de células adotivas e na saúde geral dos camundongos. Assim, um grupo de camundongos portadores de tumores serve como controles não operados, recebendo células CD45.1+CD45.2+ ou CD45.1+ OT-I, mas sem cirurgia. O outro grupo de camundongos serve como controles operados por farsa, recebendo células CD45.1+CD45.2+ ou CD45.1+ OT-I e cirurgia subsequente semelhante ao grupo experimental, mas sem transplante de a allox.
4. Transferência adotiva de células OT-I marcadas congênere em camundongos portadores de tumores
- Na véspera da transferência, administre 4 mg de ciclofosfamida dissolvido em 200 μL de PBS via injeção intraperitoneal em cada rato portador de tumor.
NOTA: O tratamento com ciclofosfameto visa induzir a linfetonia no hospedeiro que produz "espaço" para células transferidas, promovendo sua sobrevivência e se aproximando de órgãos linfoides para funcionar de forma eficiente. - Use camundongos transgênicos OT-I ingênuos com marcadores congênicos distintos (6-8 semanas de idade, 18-22 g, o mesmo sexo que os camundongos portadores de tumor). Use camundongos CD45.1+ OT-I e camundongos CD45.1+CD45.2+ OT-I para transferir adotivamente células T específicas de antígenopara camundongos doadores e receptores de tumores, respectivamente.
NOTA: A origem das células OT-I adotadamente transferidas pode ser facilmente identificada se apresentarem marcadores congênicos ou fluorescentes distintos. Por exemplo, injete células OT-I T CD45.1+ em camundongos doadores portadores de B16F10-OVA enquanto injeta células CD45.1+CD45.2+ OT-I T em camundongos receptores portadores de B16F10-OVA. CD45.1 e CD45.2 são ambos isoforms do marcador de linfócitos pan-lymphocyte CD45 (Ly5). Outros marcadores congênicos comumente usados incluem diferentes isoformas de CD90 (Thy1). Este protocolo pode ser usado para camundongos portadores de diferentes marcadores congênicos. Os ratos OT-I devem ser do mesmo sexo que os camundongos que recebem transferência celular OT-I para evitar problemas de rejeição. - Isole os linfócitos do baço e dos linfonodos do mouse OT-I.
NOTA: Os seguintes procedimentos nesta etapa devem ser realizados em um gabinete de biossegurança para manter a assepsia rigorosa.- Prepare duas placas de Petri de 60 mm × 10 mm. Adicione 3 mL de meio R10 em um prato enquanto adiciona 3 mL de tampão RBL em outro prato. Coloque um coador de célula de nylon de 70 μm no prato contendo tampão RBL.
- Eutanize um rato OT-I em uma câmara isoflurane seguido de deslocamento cervical.
- Colher o baço, inguinal (subilico) e linfonodos axilares do mouse e transferi-los para um prato de 60 mm × 10 mm com 3 mL de R10 no gelo.
NOTA: O número de camundongos OT-I sacrificados pode ser ajustado dependendo do número de camundongos portadores de tumores a serem transferidos. Um rendimento típico de células OT-I CD8+ T a partir de um baço e linfonodos inguinais e axilares de células OT-I CD8+ T é ~30-100 × 106 células por mouse. - Usando o cano final de uma seringa de 1 mL, macerar o baço em 3 mL de tampão RBL através do filtro. Incubar por 3 min no RT, e terminar a reação adicionando 3 mL de meio R10 frio.
- Amasse os linfonodos até que apenas os tecidos conjuntivos permaneçam. Enxágüe o filtro com R10. Transfira a suspensão celular para um novo tubo cônico de 15 mL. Centrifugar a 500 × g, 4 °C por 6 min.
- Decante o supernatante, e resuspense as células em 3 mL de tampão MACS. Passe a suspensão da célula através de um novo coador de células de 70 μm para remover quaisquer flocs.
- Centrifugar a suspensão da célula a 500 × g por 5 min a 4 °C. Decantar o supernatante.
- Use um kit de isolamento celular CD8+ T do mouse (veja a Tabela de Materiais) para purificar as células CD8+ T por seleção negativa, conforme o protocolo do fabricante.
NOTA: Ao utilizar kits de outras empresas, siga as instruções do fabricante. - Mantenha a suspensão celular purificada no gelo. Pegue uma pequena amostra de células e misture com o azul trypan para contar células usando um hemócito.
- Determine a porcentagem de células OT-I (live/dead-CD8+Va2+) por citometria de fluxo.
NOTA: A coloração simultânea de marcadores congênicos e o TCR transgênico deve ser realizada para verificar o fenótipo correto das células antes da transferência.- Adicione 5 × 104-1 × 105 células em 1 mL de tampão FACS em um tubo de centrífugo de 1,5 mL e centrifugar a suspensão da célula a 350 × g, 4 °C por 3 min.
- Descarte o supernatante e disperse as células movendo a parte inferior do tubo. Coloque o tubo no gelo.
- Prepare as seguintes misturas de anticorpos conjugados (diluídas em 100 μL FACS tampão): anti-CD8, 1:200; anti-TCR Vα2, 1:100; anti-CD45.1, 1:200; anti-CD45.2, 1:200; e ao vivo/morto, 1:200 (consulte a Tabela de Materiais).
- Vórtice o coquetel de anticorpos e centrífuga a 15.000 × g por 3 min para pelotas agregados de anticorpos. Guarde o coquetel no gelo e proteja-o da luz.
- Resuspend as células com 100 μL de coquetel de anticorpos e misture completamente movendo o tubo. Incubar no escuro por 30 minutos no gelo.
NOTA: Evite perturbar os agregados de anticorpos na parte inferior do tubo. - Lave as pelotas duas vezes com 1 mL de tampão FACS. Centrifugar a 350 × g, 4 °C por 3 min. Resuspenda as células em 200 μL de tampão FACS e transfira a suspensão celular para um tubo FACS.
NOTA: Para manter a viabilidade das células OT-I a serem transferidas, teste a amostra o mais rápido possível. Se as células OT-I manchadas não puderem ser testadas imediatamente, mantenha as células no escuro no gelo ou leve à geladeira a 4 °C até a análise. Alternativamente, as amostras podem ser resuspendidas em 1-4% paraformaldeído para armazenamento estendido (16 h) para evitar deterioração. - Execute o espécime em um citômetro de fluxo. Calcule a porcentagem de células live/dead-CD8+Va2+ dividindo o número de células live/dead-CD8+Vα2+ pelo número de células vivas/mortas.
- Determine o número absoluto de células OT-I (live/dead-CD8+Va2+) multiplicando a porcentagem de células live/dead-CD8+Va2+ pelo número de células viáveis obtidas na etapa 4.3.9.
- Ajuste a concentração de células OT-I (live/dead-CD8+Va2+) para 1,5 × 106 /mL com PBS.
- Injete 3 × 105 células OT-I distintas (live/dead-CD8+Va2+) em 200 μL de PBS por via intravenosa em dois grupos de camundongos portadores de B16F10-OVA (camundongos portadores de tumores divididos em camundongos doadores e receptores a partir da etapa 3.8).
- Retire 200 μL de célula OT-I (live/dead-CD8+Va2+) em uma seringa de insulina de 100 U (29 G), e remova bolhas como na etapa 3.2.
- Coloque o mouse separadamente em uma gaiola com uma lâmpada infravermelha sobre a gaiola por 5-10 minutos para dilatar a veia da cauda. Imobilize o mouse com um dispositivo de contenção de tamanho apropriado. Puxe a cauda para endireitar e pulverize com 75% de etanol para tornar a veia visível.
- Segure a seringa paralela à veia e insira-a na veia em um ângulo de 0-15°. Puxe ligeiramente o êmbolo, e se o sangue entrar no barril, injete lentamente e firmemente a suspensão a uma taxa de não mais do que 1 mL/min.
NOTA: A resistência ou inchaço no local da injeção indica que a agulha não está dentro da veia; o local da injeção deve ser movido proximicamente. - Depois que a injeção for concluída, remova a seringa e pressione a área de inserção suavemente para 3-5 s para parar de sangrar. Devolva o mouse para a gaiola e observe-o de perto por alguns minutos para reações adversas. Se tiver mobilidade normal e descarga nasal, coloque-o de volta na companhia dos outros ratos.
5. Dissecar a massa tumoral de camundongos doadores portadores de tumores
NOTA: Mantenha condições estéreis durante a cirurgia nas seções 5 e 6. Esterilize todos os instrumentos cirúrgicos autoclavando antes e depois de cada uso. Desinfetar a área de atuação no gabinete de biossegurança com 75% de etanol seguido de irradiação ultravioleta. Use um vestido limpo, boné, máscara facial e luvas estéreis.
- Oito a dez dias após a transferência adotiva, selecione camundongos doadores com massa tumoral comparável de ~5 mm de diâmetro (tamanho de soja) para cirurgia de transplante.
- Prepare um prato de 100 mm × 20 mm em um armário de biossegurança, e adicione 10 mL de PBS gelado estéril.
- Eutanize um rato doador portador de tumor em uma câmara de isoflurano seguido de luxação cervical. Mergulhe o mouse em 75% de etanol por 3-5 min e transfira para o armário de biossegurança.
NOTA: Os seguintes procedimentos nesta etapa devem ser realizados em um gabinete de biossegurança para manter a assepsia rigorosa. - Coloque o mouse em uma placa de dissecção coberta com papel absorvente limpo em uma posição supina. Contenha os membros do rato com agulhas de dissecção.
- Corte a pele ao longo da linha média de cima do orifício uretrais ao xiphoide com uma tesoura. Estique a pele em direção ao lado esquerdo do corpo do rato com pinças e contenha a pele com agulhas de dissecção.
- Extirula o tumor, mantendo sua cápsula o mais intacta possível. Remova cuidadosamente e suavemente o tecido conjuntivo perto do tumor com uma tesoura cirúrgica.
NOTA: Para manter a integridade do tumor, não retire a cápsula do tumor ou corte o tecido tumoral em pedaços. - Coloque o tecido tumoral em uma antena de 100 mm × 20 mm contendo 10 mL de PBS gelado estéril para posterior transplante.
6. Transplante subcutâneo de tumor derivado de doador nos camundongos receptores compatíveis com tumor
NOTA: O aléxalo deve ser implantado no flanco inferior do camundongo no mesmo lado do tumor anteriormente existente para fazer dois tumores drenarem para o linfonodo idêntico. No protocolo aqui apresentado, como o tumor B16F10-OVA foi implantado subcutâneamente na região inguinal esquerda do camundongo (seção 3), o tecido tumoral derivado do doador foi transplantado no flanco esquerdo do receptor nesta etapa. O local do transplante pode ser adaptado ao primeiro local do tumor implantado.
- Anestesia um camundongo receptor compatível com tumor com 250 mg/kg de 2,2,2 tribromoetanol via injeção intraperitoneal. Aperte o dedo do pé de um membro extensor do camundongo para avaliar o nível de anestesia e esperar pela falta de reflexo da dor, o que indica a profundidade adequada da anestesia para a realização da cirurgia. Se observar a vocalização ou a retirada do membro traseiro, injete ainda 0,01-0,03 mL de 2,2,2 tribromoetanol.
NOTA: O camundongo receptor compatível com tumor deve ser do mesmo sexo que o rato doador que fornece o aléxe para evitar problemas de rejeição. - Use pomada veterinária nos olhos para evitar o ressecamento. Raspe o flanco esquerdo do mouse com uma máquina de barbear elétrica. Aplique um creme depilatório para remover o cabelo restante.
NOTA: Evite abradas na pele, o que pode aumentar o risco de contaminação e infecção. - Coloque o mouse no armário de biossegurança. Coloque-o na posição propensa em uma placa de dissecção coberta com papel absorvente limpo, com o eixo vertical do mouse paralelo e sua cabeça para o lado direito do experimentador.
NOTA: Os seguintes procedimentos nesta etapa devem ser realizados em um gabinete de biossegurança para manter a assepsia rigorosa. - Esfregue a pele da área raspada com algodão encharcado em povidone-iodo.
NOTA: Use povidone-iodo em vez de 75% de etanol para esterilização para evitar a perda de calor corporal. - Levante a pele no ponto central entre as articulações do quadril do rato com pinças cirúrgicas. Use a tesoura para fazer uma excisão vertical de 5 mm de comprimento. Estenda o corte rostrally ao longo da linha média dorsal para ~10-15 mm.
- Realize uma dissecção afiada inserindo as pontas fechadas da tesoura na incisão e, em seguida, abrindo para separar o peritônio do flanco esquerdo da pele e tecido mole.
NOTA: Para evitar causar danos ao tecido subcutâneo e ao peritônio, levante a pele no centro da incisão e, em seguida, insira a tesoura fechada o mais próximo possível da pele. - Faça um bolso de pele no flanco esquerdo realizando dissecção afiada várias vezes. Deposite a massa do tumor encapsulado e intacto derivado do doador na cápsula.
NOTA: Camundongos do grupo controle operado por farsa recebem a mesma operação cirúrgica sem o transplante de tumor derivado do doador. - Feche a incisão por sutura interrompida (ver Lista de Materiais). Coloque 2-3 suturas para cada incisão. Desinfete a pele ao redor do corte com algodão encharcado em povidone-iodo.
NOTA: Deve haver 5 mm entre dois pontos consecutivos e uma distância de 3 mm da incisão. - Coloque o mouse na posição lateral em uma gaiola limpa e quente. Monitore-o continuamente até que tenha recuperado a consciência suficiente para manter a recumbência severa.
- Administre a buprenorfina subcutâneamente a uma dose de 0,1 mg/kg de peso corporal a cada 8h três vezes após a cirurgia para aliviar a dor. Monitore a comida, a bebida, a movimentação e a área operada. Devolva o receptor de transplante para a companhia de outros animais somente depois de totalmente recuperado.
NOTA: O rato normalmente se recupera do trauma da cirurgia dentro de 3 dias. Se o camundongo não voltar à alimentação e mobilidade normais e mostrar qualquer manifestação de infecção, consulte um veterinário para intervenções ou eutanásia. - Sacrifício (eutanize os animais como na etapa 4.3.2) os camundongos nos pontos de tempo indicados, e recuperar as células de interesse para análise citométrica de fluxo.
Resultados
O esquema deste protocolo é mostrado na Figura 1. Oito dias após a inoculação do tumor, as células C57BL/6 com tumor de CD45.1+ 1+CD45,2+ foram injetadas em camundongos C57BL/6 portadores de tumor B16F10-OVA. O tumor foi dissecado cirurgicamente a partir de camundongos implantados por células OT-I CD45.1+ (doador) no dia 8 pós-transferência e transplantados em CD45.1+CD45.2+ camundongos implantados por células OT-I (receptor) no flanco dorsal do mesmo lado do tumor implantado. Através da análise de citometria de fluxo (estratégia de gating mostrada na Figura 2), duas populações de células T específicas de antígeno tumoral CD44+CD8+ podem ser facilmente identificadas no TME, incluindo TILs derivados do receptor CD45.1+ e CD45.1+CD45.2+ derivados do destinatário. Posteriormente, as proporções dessas duas populações dentro dos alóxertos foram analisadas em pontos de tempo indicados para estudar a dinâmica das células CD8+ T específicas do antígeno. No dia 2 pós-transplante, havia ~83% das células CD8+ T específicas de antígenos derivados de doadores dentro do tumor transplantado, mais predominantes do que suas contrapartes derivadas do receptor. No entanto, a proporção de células OT-I derivadas do receptor foi elevada no estágio final da tumorigênese, excedendo as células OT-I inerentes ao tumor derivadas do doador. (Figura 3).
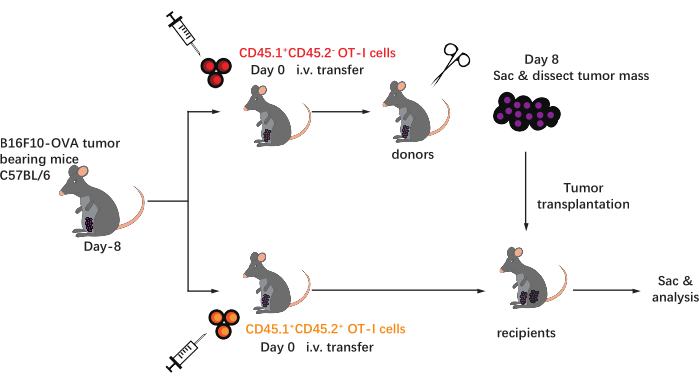
Figura 1: Esquema do projeto experimental. C57BL/6mice são desafiados com tumor B16F10-OVA na área inguinal. Oito dias depois, diferentes células OT-I marcadas congênere (CD45.1+ ou CD45.1+) são transferidas para camundongos portadores de tumores. No dia 8 pós-transferência, o tumor nos camundongos implantados por células OT-I CD45.1+ é cirurgicamente dissecado e subcutâneamente transplantado em CD45.1+CD45.2+ receptores implantados por células OT-I no flanco do mesmo lado do tumor existente. Em seguida, os camundongos são sacrificados, e células T específicas de antígeno (células OT-I) dentro dos alóxeros são analisadas nos pontos de tempo indicados. Abreviaturas: CD = cluster de diferenciação; i.v. = intravenoso; Sac = sacrifício. Clique aqui para ver uma versão maior desta figura.
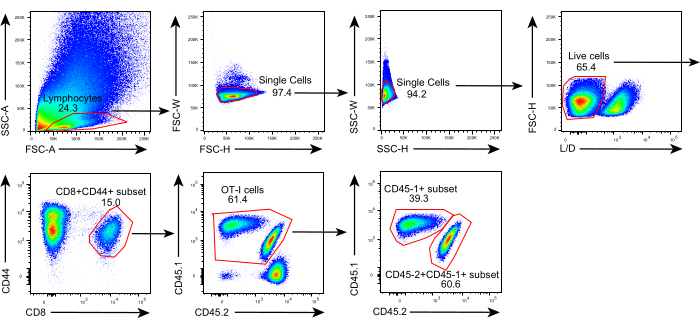
Figura 2: Estratégia de gating da análise de citometria de fluxo. A estratégia gating foi usada para identificar células CD44+CD8+derivadas de doadores (CD45.1+CD45,2+) em células T específicas de antígenos dentro de alóxe. Abreviaturas: SSC-A = área de dispersão lateral; FSC-A = área de dispersão para a frente; FSC-W = largura de dispersão para a frente; FSC-H = altura de dispersão para a frente; SSC-W = largura de dispersão lateral; SSC-H = altura de dispersão lateral; L/D = vivo/morto; CD = cluster de diferenciação. Clique aqui para ver uma versão maior desta figura.

Figura 3: A razão entre as células CD8+ T específicas de antígenos derivados de doadores e receptores dentro de alóxertos tumorais. As parcelas representativas de citometria de fluxo mostrando expressão dos marcadores congênicos CD45.1 e CD45.2 utilizados para identificar células OT-I derivadas de doadores e receptores dentro de alóxeris tumorais nos dias 2, 8 e 15 após o transplante. Os números representam os percentuais dos dois subconjuntos na população de células CD44+CD8+T . Clique aqui para ver uma versão maior desta figura.
Discussão
A imunidade mediada por células T desempenha um papel crucial nas respostas imunes contra tumores, com as CTLs desempenhando o papel principal na erradicação das células cancerosas. No entanto, as origens das TCS específicas do antígeno tumor dentro da TME não foram elucidadas30. O uso deste protocolo de transplante de tumores forneceu uma pista importante de que as células T CD8+ específicas do antígeno intratumoral podem não persistir por muito tempo, apesar da existência de células T8+ progenitoras como troncos. Notavelmente, há um fluxo contínuo de células CD8+ T específicas do tumor derivadas da periferia para a massa tumoral.
Para nosso conhecimento, este é um método relativamente conveniente e convincente confirmando que a manutenção de células T CD8+ específicas de antígeno dentro do TME depende predominantemente da reposição de células T CD8+ específicas do tumor derivadas da periferia em vez da auto-renovação de TILs residentes em tumores. Embora o protocolo aqui apresentado se concentre apenas nas proporções de TILs derivadas de doadores e derivados do destinatário, as propriedades fenotípicas, funcionais e transcricionais dessas duas populações podem ser prontamente examinadas com citometria de fluxo. Além disso, é viável combinar anticorpos icb para investigar as respostas de um subconjunto celular específico à terapia icb.
Neste protocolo, o tecido tumorado derivado do doador é transplantado no camundongo receptor com um tumor original existente. Dois tumores em um rato receptor levarão à distribuição de células T geradas pela periferia em duas massas tumorais. Além disso, a carga tumoral será quase dobrada em comparação com animais sem transplantes. Em experimentos piloto, tentamos extir nosso tumor original em camundongos receptores antes do transplante; no entanto, foi tecnicamente desafiador eliminar todas as células tumorais por cirurgia minuciosamente. As células tumorais residuais rapidamente formariam um novo tecido tumoral em breve. Assim, há uma limitação para este sistema ao comparar as respostas imunes das células T com as de camundongos não transplantados. No entanto, este sistema ainda é útil para a comparação de células T recentemente migradas e existentes dentro do mesmo TME que é transplantado de camundongos portadores de tumores doadores. Além disso, não há como negar que o transplante de tecido tumoral pode levar à inflamação, o que pode influenciar a dinâmica das células imunes dentro do tumor. Embora o impacto da cirurgia na infiltração celular OT-I possa ser excluído através de controles não operados e operados por farsa, não avaliamos os efeitos das respostas inflamatórias locais à dinâmica celular OT-I.
Algumas considerações devem ser levadas em consideração, uma delas é o uso de ciclofosfamida. Ciclofosfamida31 é um agente alquilante amplamente utilizado para tratar malignidades de órgãos sólidos e doenças linfoproliferativas e autoimunes. Seis a oito dias após a inoculação B16F10-OVA, a ciclofosfamida é administrada antes da transferência adotiva para induzir a linfodepleção de camundongos hospedeiros e melhorar a atividade das células OT-Itransferidas 29. Embora o melanoma não seja sensível a este reagente, algumas linhas de células tumorais, como o EG732, uma linha celular de linfoma timiático murina, respondem ao ciclofosfamatto. O tratamento de camundongos portadores de EG7 com ciclofosfamida resulta na erradicação de tumores, o que sugere que o ciclofosfamatto deve ser cuidadosamente utilizado ou titulado para modelos tumorais sensíveis. O método alternativo recomendado é uma única dose subletal de radiação (4,5-5,5 Gy) um dia antes da transferência, e a escolha ideal depende da característica das linhas celulares tumorais.
Outras medidas precisam ser tomadas com cautela, incluindo a seleção cuidadosa de camundongos doadores portadores de tumores e a delicada operação cirúrgica durante o transplante de tumor. Tumores implantados seriam removidos cirurgicamente e transplantados em camundongos receptores com tumores de 8 a 10 dias após a transferência. Antes do transplante, um tamanho comparável de massa tumoral de ~5 mm de diâmetro deve ser escolhido como um aoento para reduzir as discrepâncias entre camundongos individuais e tornar os dados adquiridos mais confiáveis. Além disso, durante a cirurgia, a incisão deve estar perto da linha média do mouse para manter o aléxione a uma distância do tumor já existente no camundongo receptor. A dissecção suave também é sugerida para evitar lesões no linfonodo inguinal e nos tecidos circundantes.
A morte efetiva de células cancerígenas requer a coordenação de vários componentes dentro do TME33. O protocolo aqui apresentado pode ser estendido à investigação de células imunes adaptativas e inatas, como células assassinas naturais, macrófagos associados ao tumor e células dendríticas. Além do B16F10-OVA utilizado aqui, este protocolo pode ser aplicado a outros modelos de tumor subcutâneo. Para concluir, o referido ensaio de transplante de tumores oferece uma nova abordagem para o estudo de transições interativas de certos tipos de células imunes durante as respostas antitumorais e é útil para pesquisadores em imunologia tumoral.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Este estudo foi apoiado por subsídios do National Natural Science Fund for Distinguished Young Scholars (No. 31825011 to LY) e da National Natural Science Foundation of China (No. 31900643 para QH, No. 31900656 à ZW).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore | SLGPR33RB | |
| 1 mL tuberculin syringe | KDL | BB000925 | |
| 1.5 mL centrifuge tube | KIRGEN | KG2211 | |
| 100 U insulin syringe | BD Biosciences | 320310 | |
| 15 mL conical tube | BEAVER | 43008 | |
| 2,2,2-Tribromoethanol (Avertin) | Sigma | T48402-25G | |
| 2-Methyl-2-butanol | Sigma | 240486-100ML | |
| 70 μm nylon cell strainer | BD Falcon | 352350 | |
| APC anti-mouse CD45.1 | BioLegend | 110714 | Clone:A20 |
| B16F10-OVA cell line | bluefbio | BFN607200447 | |
| BSA-V (bovine serum albumin) | Bioss | bs-0292P | |
| BV421 Mouse Anti-Mouse CD45.2 | BD Horizon | 562895 | Clone:104 |
| cell culture dish | BEAVER | 43701/43702/43703 | |
| centrifuge | Eppendorf | 5810R-A462/5424R | |
| cyclophosphamide | Sigma | C0768-25G | |
| Dulbecco's Modified Eagle Medium | Gibco | C11995500BT | |
| EasySep Mouse CD8+ T Cell Isolation Kit | Stemcell Technologies | 19853 | |
| EDTA | Sigma | EDS-500g | |
| FACS tubes | BD Falcon | 352052 | |
| fetal bovine serum | Gibco | 10270-106 | |
| flow cytometer | BD | FACSCanto II | |
| hemocytometer | PorLab Scientific | HM330 | |
| isoflurane | RWD life science | R510-22-16 | |
| KHCO3 | Sangon Biotech | A501195-0500 | |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit, for 633 or 635 nm excitation | Life Technologies | L10199 | |
| needle carrier | RWD Life Science | F31034-14 | |
| NH4Cl | Sangon Biotech | A501569-0500 | |
| paraformaldehyde | Beyotime | P0099-500ml | |
| PE anti-mouse TCR Vα2 | BioLegend | 127808 | Clone:B20.1 |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PerCP/Cy5.5 anti-mouse CD8a | BioLegend | 100734 | Clone:53-6.7 |
| RPMI-1640 | Sigma | R8758-500ML | |
| sodium azide | Sigma | S2002 | |
| surgical forceps | RWD Life Science | F12005-10 | |
| surgical scissors | RWD Life Science | S12003-09 | |
| suture thread | RWD Life Science | F34004-30 | |
| trypsin-EDTA | Sigma | T4049-100ml |
Referências
- Blank, C. U., et al. Defining 'T cell exhaustion. Nature Reviews Immunology. 19 (11), 665-674 (2019).
- Leko, V., Rosenberg, S. A. Identifying and targeting human tumor antigens for T cell-based immunotherapy of solid tumors. Cancer Cell. 38 (4), 454-472 (2020).
- McLane, L. M., Abdel-Hakeem, M. S., Wherry, E. J. CD8 T cell exhaustion during chronic viral infection and cancer. Annual Review of Immunology. 37, 457-495 (2019).
- Davis, M. M., Brodin, P. Rebooting human immunology. Annual Review of Immunology. 36, 843-864 (2018).
- Sharma, P., Allison, J. P. The future of immune checkpoint therapy. Science. 348 (6230), 56-61 (2015).
- Littman, D. R. Releasing the brakes on cancer immunotherapy. Cell. 373 (16), 1490-1492 (2015).
- Verma, V., et al. PD-1 blockade in subprimed CD8 cells induces dysfunctional PD-1(+)CD38(hi) cells and anti-PD-1 resistance. Nature Immunology. 20, 1231-1243 (2019).
- Hashimoto, M., et al. CD8 T cell exhaustion in chronic infection and cancer: opportunities for interventions. Annual Review of Medicine. 69, 301-318 (2018).
- Dammeijer, F., et al. The PD-1/PD-L1-checkpoint restrains T cell immunity in tumor-draining lymph nodes. Cancer Cell. 38 (5), 685-700 (2020).
- Buchwald, Z. S., et al. Tumor-draining lymph node is important for a robust abscopal effect stimulated by radiotherapy. Journal for ImmunoTherapy of Cancer. 8 (2), 000867 (2020).
- Philip, M., Schietinger, A. Heterogeneity and fate choice: T cell exhaustion in cancer and chronic infections. Current Opinion in Immunology. 58, 98-103 (2019).
- Miller, B. C., et al. Subsets of exhausted CD8(+) T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. 20, 326-336 (2019).
- Wu, T. D., et al. Peripheral T cell expansion predicts tumour infiltration and clinical response. Nature. 579, 274-278 (2020).
- Im, S. J., Konieczny, B. T., Hudson, W. H., Masopust, D., Ahmed, R. PD-1+ stemlike CD8 T cells are resident in lymphoid tissues during persistent LCMV infection. Proceedings of the National Academy of Sciences of the United State of America. 117 (8), 4292-4299 (2020).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Myers, L. M., et al. A functional subset of CD8(+) T cells during chronic exhaustion is defined by SIRPalpha expression. Nature Communications. 10 (1), 794 (2019).
- Jansen, C. S., et al. An intra-tumoral niche maintains and differentiates stem-like CD8 T cells. Nature. 576, 465-470 (2019).
- Jadhav, R. R., et al. Epigenetic signature of PD-1+ TCF1+ CD8 T cells that act as resource cells during chronic viral infection and respond to PD-1 blockade. Proceedings of the National Academy of Sciences of the United State of America. 116 (28), 14113-14118 (2019).
- Li, H., et al. Dysfunctional CD8 T cells form a proliferative, dynamically regulated compartment within human melanoma. Cell. 176 (4), 775-789 (2018).
- Kurtulus, S., et al. Checkpoint blockade immunotherapy induces dynamic changes in PD-1(-)CD8(+) tumor-infiltrating T cells. Immunity. 50 (1), 181-194 (2019).
- Fransen, M. F., et al. Tumor-draining lymph nodes are pivotal in PD-1/PD-L1 checkpoint therapy. JCI Insight. 3 (23), 124507 (2018).
- E, J. F., et al. CD8(+)CXCR5(+) T cells in tumor-draining lymph nodes are highly activated and predict better prognosis in colorectal cancer. Human Immunology. 79 (6), 446-452 (2018).
- Snell, L. M., et al. CD8(+) T cell priming in established chronic viral infection preferentially directs differentiation of memory-like cells for sustained immunity. Immunity. 49 (4), 678-694 (2018).
- Siddiqui, I., et al. Intratumoral Tcf1(+)PD-1(+)CD8(+) T cells with stem-like properties promote tumor control in response to vaccination and checkpoint blockade immunotherapy. Immunity. 50 (1), 195-211 (2019).
- Wang, Y., et al. The transcription factor TCF1 preserves the effector function of exhausted CD8 T cells during chronic viral infection. Frontiers in Immunology. 10, 169 (2019).
- Krishna, S., et al. Stem-like CD8 T cells mediate response of adoptive cell immunotherapy against human cancer. Science. 370 (6522), 1328-1334 (2020).
- Yost, K. E., et al. Clonal replacement of tumor-specific T cells following PD-1 blockade. Nature Medicine. 25, 1251-1259 (2019).
- Zitvogel, L., Pitt, J. M., Daillere, R., Smyth, M. J., Kroemer, G. Mouse models in oncoimmunology. Nature Reviews Cancer. 16 (12), 759-773 (2016).
- Li, Y., et al. Bcl6 preserves the suppressive function of regulatory T cells during tumorigenesis. Frontiers in Immunology. 11, 806 (2020).
- Yu, D., Ye, L. A portrait of CXCR5(+) follicular cytotoxic CD8(+) T cells. Trends in Immunology. 39 (12), 965-979 (2018).
- Bracci, L., et al. Cyclophosphamide enhances the antitumor efficacy of adoptively transferred immune cells through the induction of cytokine expression, B-cell and T-cell homeostatic proliferation, and specific tumor infiltration. Clinical Cancer Research. 13 (2), 644-653 (2007).
- Salem, M. L., El-Naggar, S. A., Mahmoud, H. A., Elgharabawy, R. M., Bader, A. M. Cyclophosphamide eradicates murine immunogenic tumor coding for a non-self-antigen and induces antitumor immunity. International Journal of Immunopathology and Pharmacology. 32, 1-5 (2018).
- Thorsson, V., et al. The Immune landscape of cancer. Immunity. 48 (4), 812-830 (2018).
Erratum
Formal Correction: Erratum: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice
Posted by JoVE Editors on 4/29/2022. Citeable Link.
An erratum was issued for: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice. The Protocol was updated.
Step 6.10 of the Protocol was updated from:
Administer penicillin every 8-12 h after the surgery for 3 days. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The administration of buprenorphine is suggested to prevent post-surgical pain [delete sentence]. The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
to:
Administer buprenorphine subcutaneously at a dose of 0.1 mg/kg body weight every 8 h three times after surgery to alleviate the pain. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados