Method Article
肿瘤移植用于评估小鼠肿瘤浸润CD8 + T细胞的动力学
Erratum Notice
摘要
在这里,我们提出了一种肿瘤移植方案,用于表征小鼠肿瘤模型中肿瘤固有和外周来源的肿瘤浸润淋巴细胞。通过流式细胞术特异性追踪受体来源的免疫细胞的流入,揭示了抗肿瘤免疫反应期间这些细胞表型和功能变化的动力学。
摘要
T细胞介导的免疫在针对肿瘤的免疫反应中起着至关重要的作用,其中细胞毒性T淋巴细胞(CTL)在根除癌细胞中起主导作用。然而,肿瘤微环境(TME)内肿瘤抗原特异性CD8 + T细胞的起源和补充仍然模糊不清。该方案采用B16F10-OVA黑色素瘤细胞系,其稳定表达替代新抗原,卵清蛋白(OVA)和TCR转基因OT-I小鼠,其中超过90%的CD8 + T细胞特异性识别OVA衍生的肽OVA257-264(SIINFEKL)与I类主要组织相容性复合物(MHC)分子H2-Kb结合。这些特征使得能够在肿瘤发生期间研究抗原特异性T细胞反应。
将该模型与肿瘤移植手术相结合,将来自供体的肿瘤组织移植到肿瘤匹配的同源受体小鼠中,以精确追踪受体来源的免疫细胞流入移植的供体组织,从而可以分析肿瘤固有和外围起源的抗原特异性CD8 +的免疫应答。 T细胞。发现这两个种群之间发生了动态转变。总的来说,这种实验设计为精确研究TME中CD8 + T细胞的免疫反应提供了另一种方法,这将为肿瘤免疫学提供新的线索。
引言
CD8 + T细胞介导的免疫反应在控制肿瘤生长中起着关键作用。在肿瘤发生期间,幼稚的CD8 + T细胞在抗原识别时以MHC I类限制方式被激活,随后分化为效应细胞并浸润到肿瘤质量1,2中。然而,在肿瘤微环境(TME)内,长期的抗原暴露以及免疫抑制因素会驱动浸润的肿瘤特异性CD8 + T细胞进入低反应状态,称为"疲惫"3。疲惫的T细胞(Tex)与急性病毒感染中产生的效应或记忆T细胞不同,无论是转录还是表观遗传。这些Tex细胞的主要特征是一系列抑制性受体的持续和升高表达以及效应器功能的分层丧失。此外,耗尽的CD8 + T细胞的增殖能力受损导致肿瘤特异性T细胞的数量减少,使得TME内残留的CD8 + T细胞几乎不能提供足够的保护性免疫来对抗肿瘤进展3。因此,维持或加强肿瘤内抗原特异性CD8 + T细胞对于肿瘤抑制是必不可少的。
此外,免疫检查点阻断(ICB)疗法被认为通过增加T细胞浸润来重振肿瘤中的Tex,从而增加T细胞数量并恢复T细胞功能以增强肿瘤抑制。ICB治疗的广泛应用改变了癌症治疗的格局,很大一部分患者经历了持久的反应4,5,6。然而,大多数患者和癌症类型对ICB没有或只是暂时有反应。TME中T细胞浸润不足被认为是导致ICB耐药性的基本机制之一7,8。
几项研究已经证明了肿瘤浸润CD8 + T细胞(TILs)在患者和小鼠模型9,10,11,12中的异质性。已经证实,肿瘤肿块中表达T细胞因子-1(TCF1)的CD8 + T细胞亚群表现出干细胞样性质,这可能进一步产生终末耗尽的T细胞,并负责ICB治疗后的增殖爆发12,13,14,15,16,17,18,19,20,21,22.然而,已经证明,TME中仅存在一小部分抗原特异性TCF1 + CD8 + T细胞,并响应ICB 23,24,25,26产生扩展的分化后代池。该人群的有限规模是否足以确保细胞毒性T淋巴细胞(CTL)的持久性以控制肿瘤进展尚不清楚,并且是否需要从外围组织补充需要进一步研究。此外,最近的研究表明,在抗程序性细胞死亡蛋白1治疗后,预先存在的肿瘤特异性T细胞的重振能力不足,并且出现了新的,以前不存在的clonotypes。这表明T细胞对检查点阻断的反应可能是由于新涌入的T细胞克隆27的不同库。结合旁观者在TME中非肿瘤反应性细胞毒性T细胞组分的存在,这些发现促使建立了肿瘤同种异体移植模型来研究外围来源CD8 + T细胞11的作用。
到目前为止,几种肿瘤植入,以及免疫细胞过继转移,已广泛应用于肿瘤免疫学领域28。TILs,外周血单核细胞和来自其他组织的肿瘤反应性免疫细胞可以使用这些方法很好地表征。然而,在研究全身性和局部抗肿瘤免疫之间的相互作用时,这些模型似乎不足以检查来自外围的免疫细胞与TME之间的相互作用。在这里,将肿瘤组织从供体移植到肿瘤匹配的受体小鼠中,以精确追踪受体来源的免疫细胞的流入,并同时观察TME中的供体来源的细胞。
在这项研究中,用B16F10-OVA黑色素瘤细胞系建立了黑色素瘤的小鼠同源模型,该模型稳定地表达替代物新抗原卵清蛋白。TCR转基因OT-I小鼠,其中超过90%的CD8 + T细胞特异性识别与I类MHC分子H2-Kb结合的OVA衍生肽OVA 257-264(SIINFEKL),能够研究B16F10-OVA肿瘤模型中开发的抗原特异性T细胞反应。将此模型与肿瘤移植相结合,比较肿瘤固有和外围抗原特异性CD8 + T细胞的免疫反应,以揭示这两个群体之间的动态转变。总的来说,这种实验设计为精确研究TME中CD8 + T细胞的免疫反应提供了另一种方法,这为TME中肿瘤特异性T细胞免疫反应的动力学提供了新的线索。
研究方案
所有小鼠实验均按照第三军医大学机构动物护理和使用委员会的指南进行。使用6-8周龄的C57BL / 6小鼠和体重18-22g的幼稚OT-I转基因小鼠。同时使用男性和女性,不要随机化或"盲法"。
1. 培养基和试剂的制备
- 通过将10%胎牛血清(FBS),100 U / mL青霉素,100mg / mL链霉素和2mM L-谷氨酰胺加入Dulbecco的改良鹰培养基中来制备先前描述的细胞培养基D1029 。
- 通过用10%FBS,100 U / mL青霉素和100mg / mL链霉素补充RPMI-1640来制备细胞培养基R10。
注意:培养基D10和R10在2-4°C下储存时可以保持无菌和稳定至少2周。 - 通过用2%FBS和0.01%叠氮化钠补充1x磷酸盐缓冲盐水(PBS)来制备荧光活化细胞分选(FACS)缓冲液。
注意:通过添加叠氮化钠,FACS缓冲液可以在2-4°C下储存数月。 - 通过在双蒸馏水中加入155mM NH4Cl,10mM KHCO3和0.1mM乙二胺四乙酸(EDTA)来制备红细胞裂解(RBL)缓冲液,并将其pH调节至7.3。
注意:RBL缓冲液在室温(RT)下稳定长达3个月。 - 通过补充PBS与0.5%牛血清白蛋白(BSA)和2mM EDTA来制备磁性活化细胞分选(MACS)缓冲液。
注意:在试剂溶解并保持无菌后,溶液应通过0.22μm过滤器。 - 制备2,2,2-三溴乙醇的工作溶液。
- 将2.5克2,2,2-三溴乙醇溶解在5mL 叔戊醇(2-甲基-2-丁醇)中。在蒸汽浴恒温振动器中以180rpm,40°C搅拌过夜。
- 将溶液通过0.22μm过滤器过滤到无菌容器中。加入双蒸馏水,最终体积可达 200 mL,并彻底连续混合,直到溶液变得清澈透明。
- 确定溶液的pH值并将其调整为7.3。用铝箔完全包裹容器以排除光线并储存在4°C。
注:2,2,2-三溴乙醇工作溶液的最终浓度为12.5mg / mL。不建议使用更浓缩的溶液,因为该材料在较高浓度时具有刺激性。每次使用前测试工作溶液的pH值,如果pH值小于5,则丢弃。
2. B16F10-OVA细胞悬浮液的制备
注意:细胞培养应在严格的无菌条件下在生物安全罩中进行。
- 在37°C和5%CO 2的细胞培养箱中用D10解冻并培养一小瓶B16F10-OVA细胞。
- 当细胞达到约80-90%的汇合度时,传代培养细胞。
- 用移液管除去培养基,并使用PBS冲洗细胞两次。
注意:不要在烧瓶或细胞培养皿中的贴壁细胞上强行添加PBS。相反,将PBS移液到侧壁或将其滴入烧瓶或培养皿中。 - 除去PBS,并将1-2毫升0.25%胰蛋白酶-EDTA溶液加入烧瓶或培养皿中。来回摇晃它以覆盖整个细胞表面。将烧瓶或培养皿置于37°C的培养箱中〜1分钟或在室温下直到细胞分离。
注意:倒置显微镜可用于检查细胞是否已分离。 - 加入新鲜的D10以停止胰蛋白酶消化。上下移液悬浮液,以确保所有细胞都与烧瓶或培养皿表面解离。
- 将B16F10-OVA细胞悬浮液转移到15 mL锥形管中。在室温下以125× g 离心细胞5-7分钟。
- 弃去上清液,并用D10重悬细胞沉淀。将B16F10-OVA细胞悬浮液分配到含有D10的新烧瓶或细胞培养皿中,并在37°C和5%CO2的细胞培养箱中孵育。
- 用移液管除去培养基,并使用PBS冲洗细胞两次。
- 在肿瘤植入当天,收获B16F10-OVA细胞,其汇合度约为90%,如步骤2.2.1至2.2.4所述。弃去上清液,并用1mL PBS重悬细胞沉淀。
- 用血细胞计数器使用0.4%台盼蓝计数活细胞。通过添加PBS将细胞密度调节至1×每100μL10个6 个细胞。将细胞保持在冰上。
3.B16F10-OVA细胞在小鼠腹股沟区的异位肿瘤植入
- 使用6-8周龄的C57BL / 6小鼠,体重18-22克。同时使用男性和女性,不要随机化或"盲法"。
- 将100μL制备的B16F10-OVA细胞悬浮液取出到1mL结核菌素注射器中。轻敲枪管将气泡移动到顶部,然后轻轻推动柱塞以去除气泡。
- 抑制鼠标并露出腹部。用小指按压左后腿,收紧左腹股沟区域的皮肤。
- 用电动剃须刀从左下腹部除去老鼠的头发。使用浸泡在75%乙醇中的棉花清洁左腹部的后象限。
- 以非常浅的角度(0-15°)握住注射器,针头的斜面朝上,将其插入左大腿上部的部位,并通过皮下组织向前0.5-1cm进入腹股沟区域。
- 注射前拉回柱塞。如果有负压,请完全按下柱塞,并观察皮下出现小推注(形成液体袋)。
注意:如果血液被抽回针尖,请抽出并在另一个部位重试。 - 注射后取出针头并适当处理。松开鼠标并将其放回笼子中。
- 在B16F10-OVA植入后使用游标尺测量第6-8天的肿瘤大小。选择具有〜3mm直径(绿豆大小)肿瘤的小鼠,并将其平均随机分成两组。
注意:具有相似大小的肿瘤的小鼠被随机分配为供体和受体小鼠;从供体小鼠切除的匹配肿瘤组织将被移植到受体小鼠体内。此外,应包括非手术对照和假手术对照,以评估手术对过继细胞转移和小鼠一般健康的影响。因此,一组荷瘤小鼠作为非手术对照,接受CD45.1 + CD45.2 + 或CD45.1 + OT-I细胞,但没有手术。另一组小鼠作为假手术对照,接受CD45.1 + CD45.2 + 或CD45.1 + OT-I细胞以及随后的手术,类似于实验组,但没有同种异体移植。
4. 将先天性标记的OT-I T细胞过继转移到荷瘤小鼠体内
- 在转移前一天,通过腹膜内注射给每个荷瘤小鼠施用4mg溶于200μLPBS中的环磷酰胺。
注意:环磷酰胺治疗旨在诱导宿主淋巴细胞减少,为转移细胞产生"空间",促进其存活并归巢到淋巴器官以有效发挥作用。 - 使用具有明显同源标志物(6-8周龄,18-22g,与荷瘤小鼠同性)的幼稚OT-I转基因小鼠。使用CD45.1 + OT-I小鼠和CD45.1 + CD45.2 + OT-I小鼠分别将OVA257-264 抗原特异性T细胞转移到荷瘤供体和受体小鼠中。
注意:如果过继转移的OT-I细胞显示不同的同源或荧光标记物,则可以很容易地识别它们的起源。例如,将CD45.1 + OT-I T细胞注射到B16F10-OVA携带供体小鼠中,同时将CD45.1 + CD45.2 + OT-I T细胞注射到B16F10-OVA携带受体小鼠中。CD45.1和CD45.2都是泛淋巴细胞标志物CD45(Ly5)的同种型。其他常用的同源标志物包括CD90(Thy1)的不同亚型。该方案可用于携带不同同源标记物的小鼠。OT-I小鼠应与接受OT-I细胞移植的小鼠具有相同的性别,以避免排斥问题。 - 从OT-I小鼠的脾脏和淋巴结中分离淋巴细胞。
注意:此步骤中的以下程序必须在生物安全柜中执行,以保持严格的无菌状态。- 准备两个60毫米×10毫米培养皿。将3 mL R10培养基加入一个培养皿中,同时在另一个培养皿中加入3 mL RBL缓冲液。将70μm尼龙细胞过滤器置于含有RBL缓冲液的培养皿中。
- 在异氟醚腔室中对OT-I小鼠实施安乐死,然后进行宫颈脱位。
- 收获小鼠的脾脏,腹股沟(髂下)和腋窝淋巴结,并将其转移到60mm×10mm培养皿中,冰上装有3mL R10。
注意:根据要转移的荷瘤小鼠的数量,可以调整处死的OT-I小鼠的数量。来自脾脏和OT-I CD8 + T细胞的双侧腹股沟和腋窝淋巴结的OT-I CD8 + T细胞的典型产量约为每只小鼠约30-100×106 个细胞。 - 使用1 mL注射器的末端桶,通过过滤器在3 mL RBL缓冲液中浸渍脾脏。在室温下孵育3分钟,并通过加入3mL冷R10培养基终止反应。
- 捣碎淋巴结,直到只剩下结缔组织。用R10冲洗过滤器。将细胞悬浮液转移到新的15 mL锥形管中。在500× g,4°C下离心6分钟。
- 倾析上清液,并将细胞重悬于3mL MACS缓冲液中。将细胞悬浮液通过新的70μm细胞过滤器以除去任何絮状物。
- 在4°C下以500× g 离心细胞悬浮液5分钟。 倾析上清液。
- 根据制造商的协议,使用小鼠CD8 + T细胞分离试剂盒(参见 材料表)通过阴性选择纯化CD8 + T细胞。
注意:使用其他公司的套件时,请遵循制造商的说明。 - 将纯化的细胞悬浮液保存在冰上。取一小块细胞样本,与台盼蓝混合,使用血细胞计数器计数细胞。
- 通过流式细胞术确定OT-I(活/死CD8 + Va2 +)细胞的百分比。
注意:在转移之前,应同时进行同源标志物和转基因TCR染色,以验证细胞的正确表型。- 在1.5mL离心管中加入5×10 4-1×10 5个细胞放入1mL FACS缓冲液中,并在350×g,4°C下离心细胞悬浮液3分钟。
- 弃去上清液,并通过轻拂管底分散细胞。将管子放在冰上。
- 制备以下偶联抗体混合物(在100μL FACS缓冲液中稀释):抗CD8,1:200;抗TCR Vα2, 1:100;抗CD45.1, 1:200;抗CD45.2, 1:200;和活/死,1:200(参见 材料表)。
- 涡旋抗体混合物,并在15,000× g 下离心3分钟以沉淀抗体聚集体。将鸡尾酒储存在冰上,避免光线照射。
- 用100μL抗体混合物重悬细胞,并通过轻拂试管彻底混合。在黑暗中在冰上孵育30分钟。
注意:避免干扰试管底部的抗体聚集体。 - 用1mL FACS缓冲液洗涤沉淀两次。在350× g,4°C下离心3分钟。将细胞重悬于200μLFACS缓冲液中,并将细胞悬浮液转移到FACS管中。
注意:为了保持待转移的OT-I细胞的活力,请尽快测试样品。如果无法立即测试染色的OT-I细胞,请将细胞保存在黑暗的冰上或冷藏在4°C直至分析。或者,可以将样品重悬于1-4%多聚甲醛中以延长储存期(16小时)以防止变质。 - 在流式细胞仪上运行试样。通过将活/死CD8 + Vα2 +细胞的数量除以活/死细胞的数量来计算活/死CD8 + Va2 +细胞的百分比。
- 通过将活/死CD8 + Va2 +细胞的百分比乘以步骤4.3.9中获得的活细胞数来确定OT-I细胞(活/死CD8 + Va2 + )的绝对数量。
- 用PBS将OT-I细胞(活/死CD8 + Va2 +)的浓度调节至1.5×106 / mL。
- 将3×105 个不同的先天性标记的OT-I细胞(活/死CD8 + Va2 +)在200μLPBS中静脉注射到两组B16F10-OVA携带小鼠(从步骤3.8中分为供体小鼠和受体小鼠的荷瘤小鼠)中。
- 将200μLOT-I细胞(活/死CD8 + Va2 +)悬浮液取出到100 U胰岛素注射器(29G)中,并按照步骤3.2除去气泡。
- 将小鼠分别放在笼子中,在笼子上用红外灯在笼子上放置5-10分钟以扩张尾静脉。用适当大小的抑制装置固定鼠标。拉动尾巴将其拉直,并用75%乙醇喷洒以使静脉可见。
- 将注射器与静脉平行握住,并以0-15°的角度将其插入静脉。稍微拉回柱塞,如果血液进入桶,则以不超过1 mL / min的速率缓慢而稳定地注入悬浮液。
注意:注射部位的阻力或肿胀表明针头不在静脉内;注射部位应向近端移动。 - 注射完成后,取出注射器,轻轻按压插入区域3-5秒以止血。将小鼠放回笼子,仔细观察几分钟,以发现不良反应。如果它具有正常的活动性和鼻腔分泌物,请将其放回其他小鼠的陪伴下。
5. 从荷瘤供体小鼠中解剖肿瘤肿块
注意:在第5节和第6节的手术期间保持无菌条件。在每次使用前后通过高压灭菌对所有手术器械进行灭菌。用75%乙醇对生物安全柜中的操作区域进行消毒,然后进行紫外线照射。穿干净的礼服,帽子,口罩和无菌手套。
- 过继转移后8~10天,选择具有直径约5mm(大豆大小)的类似肿瘤质量的供体小鼠进行移植手术。
- 在生物安全柜中准备一个100毫米×20毫米的培养皿,并加入10毫升无菌冰冷的PBS。
- 在异氟醚腔室中对荷瘤供体小鼠实施安乐死,然后进行宫颈脱位。将小鼠浸入75%乙醇中3-5分钟,然后转移到生物安全柜中。
注意:此步骤中的以下程序必须在生物安全柜中执行,以保持严格的无菌状态。 - 将鼠标放在覆盖有干净吸水纸的解剖板上,以仰卧姿势放置。用解剖针限制小鼠四肢。
- 用剪刀沿着中线从尿道孔口上方切开皮肤到剑鞘。用镊子将皮肤向小鼠身体的左侧伸展,并用解剖针约束皮肤。
- 切除肿瘤,保持其胶囊尽可能完整。用手术剪刀小心轻轻地去除肿瘤附近的结缔组织。
注意:为了保持肿瘤的完整性,请勿剥离肿瘤囊或将肿瘤组织切成碎片。 - 将肿瘤组织置于含有10mL无菌冰冷PBS的100mm×20mm培养皿中,用于后续移植。
6. 将供体来源的肿瘤皮下移植到肿瘤匹配的受体小鼠身上
注意:同种异体移植物应该被植入小鼠的下胁腹,与先前存在的肿瘤位于同一侧,以使两个肿瘤引流到相同的淋巴结。在本文介绍的方案中,当B16F10-OVA肿瘤皮下植入小鼠的左腹股沟区域(第3节)时,在此步骤中将供体来源的肿瘤组织移植到受体的左侧。移植部位可以适应第一个植入的肿瘤部位。
- 通过腹膜内注射用250mg / kg的2,2,2-三溴乙醇麻醉肿瘤匹配的受体小鼠。捏住小鼠伸肌肢体的脚趾以评估麻醉水平并等待缺乏疼痛反射,这表明进行手术的适当麻醉深度。如果观察到发声或后肢退缩,进一步注射0.01-0.03 mL 2,2,2-三溴乙醇。
注意:肿瘤匹配的受体小鼠应与提供同种异体移植物的供体小鼠相同,以避免排斥问题。 - 在眼睛上使用兽药软膏,以防止干燥。用电动剃须刀剃掉鼠标的左侧。涂抹脱毛膏以去除剩余的头发。
注意:避免擦伤皮肤,这可能会增加污染和感染的风险。 - 将鼠标放在生物安全柜中。将其置于用干净的吸水纸覆盖的解剖板上的俯卧位置,小鼠的垂直轴平行于实验者的头部。
注意:此步骤中的以下程序必须在生物安全柜中执行,以保持严格的无菌状态。 - 用浸泡在聚维酮碘中的棉花擦拭剃须区域的皮肤。
注意:使用聚维酮碘代替75%乙醇进行灭菌,以防止体温损失。 - 用手术镊子抬起小鼠髋关节之间的中心点的皮肤。使用剪刀进行5毫米长的垂直切除。沿背中线将切口延伸至~10-15毫米。
- 通过将剪刀的闭合尖端插入切口,然后打开以将左侧腹膜与皮肤和软组织分开来进行尖锐的解剖。
注意:为避免对皮下组织和腹膜造成损害,请抬起切口中心的皮肤,然后将闭合的剪刀插入尽可能靠近皮肤的位置。 - 通过多次进行尖锐的解剖,在左侧做一个皮袋。将封装的,完整的供体来源的肿瘤肿块沉积到胶囊中。
注意:假手术对照组中的小鼠接受相同的手术,而无需供体来源的肿瘤移植。 - 通过中断缝合线关闭切口(参见材料列表)。每个切口放置2-3个缝合线。用浸泡在聚维酮碘中的棉花对切口周围的皮肤进行消毒。
注意:两针之间应有5毫米的连续缝合,与切口的距离应为3毫米。 - 将鼠标放在干净温暖的笼子中的横向位置。持续监测,直到它恢复足够的意识以维持胸骨卧位。
- 手术后每8小时以0.1mg / kg体重的剂量皮下注射丁丙诺啡,以减轻疼痛。监测老鼠的进食,饮水,移动和操作区域。只有在移植受者完全康复后,才将其送回其他动物的陪伴下。
注意:小鼠通常在3天内从手术创伤中恢复。如果小鼠没有恢复正常的喂养和活动能力,并表现出任何感染表现,请咨询兽医进行干预或将其安乐死。 - 在指定的时间点处死(如步骤4.3.2中的动物安乐死)小鼠,并回收感兴趣的细胞进行流式细胞术分析。
结果
该协议的原理图如图 1所示。肿瘤接种8 d后,将CD45.1+ 和CD45.1+CD45.2+ OT-I细胞注射到B16F10-OVA荷瘤C57BL/6小鼠体内。在移植后第8天从CD45.1 + OT-I细胞植入小鼠(供体)中手术解剖肿瘤,并将其移植到与植入肿瘤相同的一侧的背侧胁侧的肿瘤匹配的CD45.1 + CD45.2 + OT-I细胞植入小鼠(受体)中。通过流式细胞术( 图2所示的门控策略)分析,在TME中可以很容易地鉴定出CD44+ CD8+ 肿瘤抗原特异性T细胞群,包括CD45.1+ 供体来源和CD45.1+CD45.2+ 受体来源的TILs。随后,在指示的时间点分析同种异体移植物中这两个群体的比例,以研究抗原特异性CD8 + T细胞的动力学。在移植后第2天,移植肿瘤内有约83%的供体源性抗原特异性CD8 + T细胞,比受者来源的对应物更占主导地位。然而,在肿瘤发生晚期,受体来源的OT-I细胞的比例升高,超过了来自供体的肿瘤固有的OT-I细胞。(图 3)。
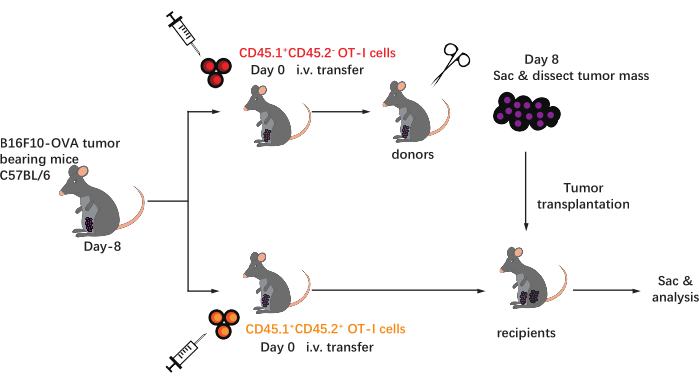
图1:实验设计示意图。 C57BL/ 6mice在腹股沟区域与B16F10-OVA肿瘤一起接受挑战。八天后,将不同的先天性标记(CD45.1 + 或CD45.1 + CD45.2 +)OT-I细胞转移到荷瘤小鼠体内。在转移后的第8天,CD45.1 + OT-I细胞植入小鼠上的肿瘤被手术解剖并皮下移植到肿瘤匹配的CD45.1 + CD45.2 + OT-I细胞植入受体中,与现有肿瘤位于同一侧的侧腹。然后,处死小鼠,并在指定的时间点分析同种异体移植物内的抗原特异性T细胞(OT-I细胞)。缩写:CD = 分化簇;静脉注射= 静脉注射;囊=牺牲。 请点击此处查看此图的大图。
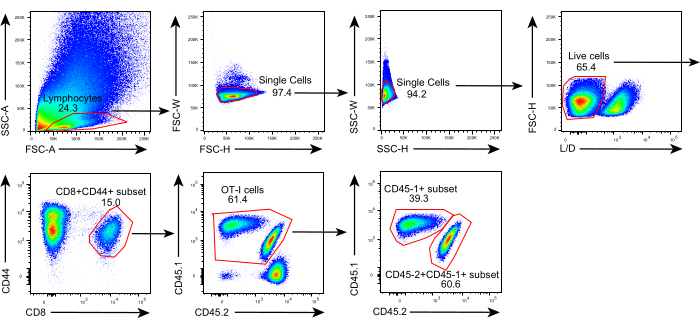
图2:流式细胞术分析的门控策略。 用于鉴定同种异体移植物中供体源性(CD45.1 +)和受体来源(CD45.1 + CD45.2 +)抗原特异性CD44 + CD8 + T细胞的门控策略。缩写:SSC-A = 侧散射面积;FSC-A = 前向散射面积;FSC-W = 正向散射宽度;FSC-H = 前向散射高度;SSC-W = 侧散射宽度;SSC-H = 侧散射高度;L/D = 活/死;CD = 分化簇。 请点击此处查看此图的大图。

图3:肿瘤同种异体移植物中供体和受体来源的抗原特异性CD8 + T细胞的比例。 代表性流式细胞术图显示用于在移植后第 2、8 和 15 天肿瘤同种异体移植物中用于鉴定供体来源和受体来源的 OT-I 细胞的先天标志物 CD45.1 和 CD45.2 的表达。这些数字表示CD44 + CD8 + T细胞群中两个子集的百分比。 请点击此处查看此图的大图。
讨论
T细胞介导的免疫在针对肿瘤的免疫反应中起着至关重要的作用,其中CTL在根除癌细胞中起主导作用。然而,TME内肿瘤抗原特异性CTL的起源尚未阐明30。这种肿瘤移植方案的使用提供了一个重要的线索,即尽管存在干细胞样TCF1 +祖细胞CD8 + T细胞,但肿瘤内抗原特异性CD8 + T细胞可能不会持续很长时间。值得注意的是,外周来源的肿瘤特异性CD8 + T细胞不断涌入肿瘤肿块。
据我们所知,这是一种相对方便和令人信服的方法,证实了TME内抗原特异性CD8 + T细胞的维持主要取决于外周来源的肿瘤特异性CD8 + T细胞的补充,而不是肿瘤常驻TIL的自我更新。虽然这里介绍的方案仅关注供体来源和受体来源的TIL的比例,但这两个群体的表型,功能和转录特性可以很容易地用流式细胞术检查。此外,结合ICB抗体以研究特定细胞亚群对ICB治疗的反应是可行的。
在该协议中,供体来源的肿瘤组织被移植到具有现有原始肿瘤的受体小鼠上。受体小鼠中的两个肿瘤将导致外围生成的T细胞分布成两个肿瘤肿块。此外,与没有移植的动物相比,肿瘤负担将增加近一倍。在试点实验中,我们试图在移植前切除受体小鼠的原始肿瘤;然而,通过手术彻底消除所有肿瘤细胞在技术上具有挑战性。残留的肿瘤细胞会迅速形成新的肿瘤组织。因此,在将T细胞免疫反应与未移植小鼠中的免疫反应进行比较时,该系统存在局限性。然而,该系统仍然可用于比较从供体荷瘤小鼠移植的同一TME内最近迁移的和现有的T细胞。此外,不可否认的是,肿瘤组织的移植可能导致炎症,这可能会影响肿瘤内的免疫细胞动力学。虽然手术对OT-I细胞浸润的影响可以通过非手术和假手术的对照来排除,但我们没有评估局部炎症反应对OT-I细胞动力学的影响。
应考虑一些因素,其中之一是环磷酰胺的使用。环磷酰胺31 是一种烷化剂,广泛用于治疗实体器官恶性肿瘤和淋巴组织增生性和自身免疫性疾病。B16F10-OVA接种后6至8天,在过继转移前施用环磷酰胺以诱导宿主小鼠的淋巴切除并增强转移的OT-I细胞29的活性。虽然黑色素瘤对这种试剂不敏感,但一些肿瘤细胞系,如EG732,一种小鼠胸腺淋巴瘤细胞系,对环磷酰胺有反应。用环磷酰胺治疗EG7小鼠可根除肿瘤,这表明必须仔细使用环磷酰胺或滴定敏感肿瘤模型。推荐的替代方法是在转移前一天进行单次亚致死剂量的辐射(4.5-5.5 Gy),最佳选择取决于肿瘤细胞系的特征。
其他步骤需要谨慎采取,包括仔细选择荷瘤供体小鼠和肿瘤移植期间精细的外科手术。植入的肿瘤将在移植后8-10天通过手术切除并移植到肿瘤匹配的受体小鼠中。在移植之前,选择直径约5mm的肿瘤肿块的可比大小作为同种异体移植物,以减少个体小鼠之间的差异并使获得的数据更加可靠。此外,在手术过程中,切口应靠近小鼠背部的中线,以使同种异体移植物与受体小鼠中已经存在的肿瘤保持距离。还建议进行轻柔的清扫,以防止腹股沟淋巴结和周围组织的损伤。
癌细胞的有效杀灭需要TME33内各种成分的协调。这里介绍的方案可以扩展到研究适应性和先天性免疫细胞,如自然杀伤细胞,肿瘤相关巨噬细胞和树突状细胞。此外,除了这里使用的B16F10-OVA之外,该方案还可以应用于其他皮下肿瘤模型。总而言之,上述肿瘤移植测定为研究抗肿瘤反应期间某些类型免疫细胞的相互作用转变提供了一种新方法,并且对肿瘤免疫学研究人员有用。
披露声明
作者没有利益冲突需要披露。
致谢
本研究由国家杰出青年自然科学基金(LY第31825011号)和国家自然科学基金(QH第31900643号,ZW 31900656号)资助。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore | SLGPR33RB | |
| 1 mL tuberculin syringe | KDL | BB000925 | |
| 1.5 mL centrifuge tube | KIRGEN | KG2211 | |
| 100 U insulin syringe | BD Biosciences | 320310 | |
| 15 mL conical tube | BEAVER | 43008 | |
| 2,2,2-Tribromoethanol (Avertin) | Sigma | T48402-25G | |
| 2-Methyl-2-butanol | Sigma | 240486-100ML | |
| 70 μm nylon cell strainer | BD Falcon | 352350 | |
| APC anti-mouse CD45.1 | BioLegend | 110714 | Clone:A20 |
| B16F10-OVA cell line | bluefbio | BFN607200447 | |
| BSA-V (bovine serum albumin) | Bioss | bs-0292P | |
| BV421 Mouse Anti-Mouse CD45.2 | BD Horizon | 562895 | Clone:104 |
| cell culture dish | BEAVER | 43701/43702/43703 | |
| centrifuge | Eppendorf | 5810R-A462/5424R | |
| cyclophosphamide | Sigma | C0768-25G | |
| Dulbecco's Modified Eagle Medium | Gibco | C11995500BT | |
| EasySep Mouse CD8+ T Cell Isolation Kit | Stemcell Technologies | 19853 | |
| EDTA | Sigma | EDS-500g | |
| FACS tubes | BD Falcon | 352052 | |
| fetal bovine serum | Gibco | 10270-106 | |
| flow cytometer | BD | FACSCanto II | |
| hemocytometer | PorLab Scientific | HM330 | |
| isoflurane | RWD life science | R510-22-16 | |
| KHCO3 | Sangon Biotech | A501195-0500 | |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit, for 633 or 635 nm excitation | Life Technologies | L10199 | |
| needle carrier | RWD Life Science | F31034-14 | |
| NH4Cl | Sangon Biotech | A501569-0500 | |
| paraformaldehyde | Beyotime | P0099-500ml | |
| PE anti-mouse TCR Vα2 | BioLegend | 127808 | Clone:B20.1 |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PerCP/Cy5.5 anti-mouse CD8a | BioLegend | 100734 | Clone:53-6.7 |
| RPMI-1640 | Sigma | R8758-500ML | |
| sodium azide | Sigma | S2002 | |
| surgical forceps | RWD Life Science | F12005-10 | |
| surgical scissors | RWD Life Science | S12003-09 | |
| suture thread | RWD Life Science | F34004-30 | |
| trypsin-EDTA | Sigma | T4049-100ml |
参考文献
- Blank, C. U., et al. Defining 'T cell exhaustion. Nature Reviews Immunology. 19 (11), 665-674 (2019).
- Leko, V., Rosenberg, S. A. Identifying and targeting human tumor antigens for T cell-based immunotherapy of solid tumors. Cancer Cell. 38 (4), 454-472 (2020).
- McLane, L. M., Abdel-Hakeem, M. S., Wherry, E. J. CD8 T cell exhaustion during chronic viral infection and cancer. Annual Review of Immunology. 37, 457-495 (2019).
- Davis, M. M., Brodin, P. Rebooting human immunology. Annual Review of Immunology. 36, 843-864 (2018).
- Sharma, P., Allison, J. P. The future of immune checkpoint therapy. Science. 348 (6230), 56-61 (2015).
- Littman, D. R. Releasing the brakes on cancer immunotherapy. Cell. 373 (16), 1490-1492 (2015).
- Verma, V., et al. PD-1 blockade in subprimed CD8 cells induces dysfunctional PD-1(+)CD38(hi) cells and anti-PD-1 resistance. Nature Immunology. 20, 1231-1243 (2019).
- Hashimoto, M., et al. CD8 T cell exhaustion in chronic infection and cancer: opportunities for interventions. Annual Review of Medicine. 69, 301-318 (2018).
- Dammeijer, F., et al. The PD-1/PD-L1-checkpoint restrains T cell immunity in tumor-draining lymph nodes. Cancer Cell. 38 (5), 685-700 (2020).
- Buchwald, Z. S., et al. Tumor-draining lymph node is important for a robust abscopal effect stimulated by radiotherapy. Journal for ImmunoTherapy of Cancer. 8 (2), 000867(2020).
- Philip, M., Schietinger, A. Heterogeneity and fate choice: T cell exhaustion in cancer and chronic infections. Current Opinion in Immunology. 58, 98-103 (2019).
- Miller, B. C., et al. Subsets of exhausted CD8(+) T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. 20, 326-336 (2019).
- Wu, T. D., et al. Peripheral T cell expansion predicts tumour infiltration and clinical response. Nature. 579, 274-278 (2020).
- Im, S. J., Konieczny, B. T., Hudson, W. H., Masopust, D., Ahmed, R. PD-1+ stemlike CD8 T cells are resident in lymphoid tissues during persistent LCMV infection. Proceedings of the National Academy of Sciences of the United State of America. 117 (8), 4292-4299 (2020).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Myers, L. M., et al. A functional subset of CD8(+) T cells during chronic exhaustion is defined by SIRPalpha expression. Nature Communications. 10 (1), 794(2019).
- Jansen, C. S., et al. An intra-tumoral niche maintains and differentiates stem-like CD8 T cells. Nature. 576, 465-470 (2019).
- Jadhav, R. R., et al. Epigenetic signature of PD-1+ TCF1+ CD8 T cells that act as resource cells during chronic viral infection and respond to PD-1 blockade. Proceedings of the National Academy of Sciences of the United State of America. 116 (28), 14113-14118 (2019).
- Li, H., et al. Dysfunctional CD8 T cells form a proliferative, dynamically regulated compartment within human melanoma. Cell. 176 (4), 775-789 (2018).
- Kurtulus, S., et al. Checkpoint blockade immunotherapy induces dynamic changes in PD-1(-)CD8(+) tumor-infiltrating T cells. Immunity. 50 (1), 181-194 (2019).
- Fransen, M. F., et al. Tumor-draining lymph nodes are pivotal in PD-1/PD-L1 checkpoint therapy. JCI Insight. 3 (23), 124507(2018).
- E, J. F., et al. CD8(+)CXCR5(+) T cells in tumor-draining lymph nodes are highly activated and predict better prognosis in colorectal cancer. Human Immunology. 79 (6), 446-452 (2018).
- Snell, L. M., et al. CD8(+) T cell priming in established chronic viral infection preferentially directs differentiation of memory-like cells for sustained immunity. Immunity. 49 (4), 678-694 (2018).
- Siddiqui, I., et al. Intratumoral Tcf1(+)PD-1(+)CD8(+) T cells with stem-like properties promote tumor control in response to vaccination and checkpoint blockade immunotherapy. Immunity. 50 (1), 195-211 (2019).
- Wang, Y., et al. The transcription factor TCF1 preserves the effector function of exhausted CD8 T cells during chronic viral infection. Frontiers in Immunology. 10, 169(2019).
- Krishna, S., et al. Stem-like CD8 T cells mediate response of adoptive cell immunotherapy against human cancer. Science. 370 (6522), 1328-1334 (2020).
- Yost, K. E., et al. Clonal replacement of tumor-specific T cells following PD-1 blockade. Nature Medicine. 25, 1251-1259 (2019).
- Zitvogel, L., Pitt, J. M., Daillere, R., Smyth, M. J., Kroemer, G. Mouse models in oncoimmunology. Nature Reviews Cancer. 16 (12), 759-773 (2016).
- Li, Y., et al. Bcl6 preserves the suppressive function of regulatory T cells during tumorigenesis. Frontiers in Immunology. 11, 806(2020).
- Yu, D., Ye, L. A portrait of CXCR5(+) follicular cytotoxic CD8(+) T cells. Trends in Immunology. 39 (12), 965-979 (2018).
- Bracci, L., et al. Cyclophosphamide enhances the antitumor efficacy of adoptively transferred immune cells through the induction of cytokine expression, B-cell and T-cell homeostatic proliferation, and specific tumor infiltration. Clinical Cancer Research. 13 (2), 644-653 (2007).
- Salem, M. L., El-Naggar, S. A., Mahmoud, H. A., Elgharabawy, R. M., Bader, A. M. Cyclophosphamide eradicates murine immunogenic tumor coding for a non-self-antigen and induces antitumor immunity. International Journal of Immunopathology and Pharmacology. 32, 1-5 (2018).
- Thorsson, V., et al. The Immune landscape of cancer. Immunity. 48 (4), 812-830 (2018).
Erratum
Formal Correction: Erratum: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice
Posted by JoVE Editors on 4/29/2022. Citeable Link.
An erratum was issued for: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice. The Protocol was updated.
Step 6.10 of the Protocol was updated from:
Administer penicillin every 8-12 h after the surgery for 3 days. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The administration of buprenorphine is suggested to prevent post-surgical pain [delete sentence]. The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
to:
Administer buprenorphine subcutaneously at a dose of 0.1 mg/kg body weight every 8 h three times after surgery to alleviate the pain. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。