Method Article
mRNA Birleştirme Değişikliklerini incelemek için E1A Minigene Aracını Kullanma
Bu Makalede
Özet
Bu protokol, kemoterapötik tedaviden sonra alternatif birleştirme regülasyonunda karakteristik olmayan işleve sahip bir proteinin rolünü değerlendirmek için hızlı ve kullanışlı bir araç sunar.
Özet
mRNA işleme, mRNA'yı çeviriye hazırlamak için 5'kapaklama, çoklu A ekleme ve birleştirme gibi birden fazla eşzamanlı adım içerir. Konsültasyonel birleştirmenin yanı sıra, alternatif mRNA birleştirme, bir genden çok fonksiyonlu proteinlerin ifadesini sağlar. Interactome çalışmaları genellikle yeni veya bilinmeyen proteinler için ilk analiz olduğundan, yem proteininin birleştirme faktörleriyle ilişkilendirmesi, mRNA birleştirme sürecine katılabileceğinin bir göstergesidir, ancak hangi bağlamda veya hangi genlerin düzenlendiğini belirlemek ampirik bir süreçtir. Bu işlevi değerlendirmek için iyi bir başlangıç noktası klasik minigene aracını kullanmaktır. Burada, farklı hücresel stres uyaranları sonrası alternatif birleştirme değişikliklerini değerlendirmek için adenoviral E1A minigene kullanımını sunuyoruz. Farklı stres tedavilerinden sonra NEK4 proteinini bıçaklayarak HEK293'te E1A minigene'nin birlenmesini değerlendirdik. Protokol, E1A minigene transfection, hücre tedavisi, RNA ekstraksiyonu ve cDNA sentezini, ardından PCR ve jel analizini ve E1A ekli varyantların nicelleştirilmesini içerir. Bu basit ve köklü yöntemin belirli tedavilerle birlikte kullanılması, hücresel süreçlere veya mRNA birleştirme ile hangi genlerin düzenlenebileceğine ışık tutmak için güvenilir bir başlangıç noktasıdır.
Giriş
Birleştirme, 5'mRNA kapaklama ve 3'mRNA poliadenilasyonuna aynı anda meydana gelen ökaryotik mRNA işlemede en önemli adımlar arasındadır, intron kaldırma ve ardından exon kavşağı. Birleştirme alanlarının (SS) spliceosome tarafından tanınması, küçük ribonükleoproteinler (snRNP U1, U2, U4 ve U6), küçük RNA'lar (snRNA'lar) ve birkaç düzenleyici protein1 içeren bir ribonükleoprotein kompleksi, birleştirme için gereklidir.
Ökaryotlarda intron kaldırmanın (konsitutive birleştirme) yanı sıra, intronlar tutulabilir ve eksonlar dışlanabilir, mRNA alternatif birleştirme (AS) adı verilen işlemi yapılandırabilir. Alternatif pre-mRNA birleştirme, ökaryotik genomların kodlama kapasitesini genişleterek nispeten az sayıda genden çok sayıda protein üretilmesini sağlar. Birden fazla ekson içeren insan mRNA'larının% 95-100'ünün alternatif birleştirme2,3'tengeçebileceği tahmin edilmektedir. Bu, nöronal gelişim, apoptoz aktivasyonu ve hücresel stres yanıtı4gibi biyolojik süreçler için temeldir Organizmaya aynı gen repertuarını kullanarak hücre işleyişini düzenlemek için alternatifler sağlar.
Alternatif birleştirme için gerekli makine, konsitütif birleştirme için kullanılanla aynıdır ve SS kullanımı alternatif birleştirme oluşumu için ana belirleyicidir. Constitutive birleştirme, genellikle spliceosome tanıma için konsensüs motiflerine daha benzer olan güçlü birleştirme alanlarının kullanımı ile ilgilidir5.
Alternatif eksonlar tipik olarak, cis düzenleyiciunsurları, 5'SS ve 3'SS'deki diziler bu eksonları kuşatırken, spliceosome için daha düşük bir bağlama kapasitesi gösterdiğinde, konstrüktif eksonlardan daha az verimli olarak tanınır. mRNA ayrıca eksonlarda (eksonik birleştirme arttırıcıları (ESE'ler) ve eksonik birleştirme susturucularında (ESSs)) ve intronlarda (intronic splicing enhancers (ISS) ve intronic splicing susturucularında (ISSs)) bulunan ve eksonik kullanımı artıran veya bastıran güçlendiriciler veya susturucular (ISSs) adlı bölgeleriiçerir. Bu diziler, düzenleyici öğeler veya birleştirme faktörleri (SF) tarafından tanınır. SF'ler esas olarak iki protein ailesi tarafından temsil edilir, ESE'lere bağlanan serine / arginin zengin birleştirme faktörleri (SRSF'ler) ve ESSs dizilerine bağlanan heterojen nükleer ribonükleoproteinler (hnRNPs) ailesi5.
Alternatif birleştirme, etkileşim ortaklarını değiştiren trans faktörlerin fosforilasyonu / defosforilasyonu ve birleştirme faktörlerinin hücresel lokalizasyonu ile modüle edilebilir6,7,8. Birleştirme faktörlerinin yeni düzenleyicilerinin belirlenmesi, birleştirmeyi ve dolayısıyla bazı kanser tedavilerini düzenlemek için yeni araçlar sağlayabilir.
Anufrieva ve ark.9, bir mRNA mikroarray gen ekspresyon profilinde, 101 hücre hattında ve farklı stres koşullarından sonra (platin bazlı ilaçlar, gama ışınlama, topoisomeraz inhibitörleri, tirozin kinaz inhibitörleri ve taksonlar) spliceosomal bileşenlerin seviyelerinde tutarlı değişiklikler gözlemledi. Birleştirme paterni ve kemoterapi etkinliği arasındaki ilişki, kemoterapiye dirençli olan akciğer kanseri hücrelerinde, kaspaz-9 varyantları oranındaki değişiklikleri gösteren10. Kemoterapötik panel ile tedavi edilen HEK293 hücreleri, pro-apoptotik varyantlarda bir artışla birleştirmede değişiklikler göstermektedir. Gabriel ve ark.11, farklı hücre hatlarında cisplatin tedavisinden sonra en az 700 birleştirme etkinliğinde değişiklikler gözlemledi ve birleştirme yollarının cisplatin etkilendiğine işaret etti. Birleştirme modülatörleri, birleştirmenin tümöral gelişim ve esas olarak kemoterapi yanıtı 12 için önemli olduğunu gösteren anti-tümöral aktivitegöstermiştir. Bu nedenle, kemoterapötikler gibi hücresel stresör ajanlarından sonra birleştirmeyi düzenleyen yeni proteinleri karakterize etmek, yeni tedavi stratejilerini keşfetmek için çok önemlidir.
Interactome çalışmalarından alternatif birleştirme düzenlemesinin ipuçları, özellikle yeni veya karakteristik olmayan proteinlerin işlevlerini karakterize etmek için önemlidir, proteinin AS'deki gerçek rolünü doğrulamak için daha genel ve basit bir yaklaşım talep edebilir. Minigenler, birleştirme regülasyonını etkileyen bir proteinin genel rolünün analizi için önemli araçlardır. Alternatif olarak birikmiş ve kuşatıcı genomik bölgeler içeren ilgi geninden segmentler içerirler13. Bir minigene aracı kullanmak, minigenenin uzunluğu gibi küçük olan ve bu nedenle amplifikasyon reaksiyonu için bir sınırlama olmayan çeşitli avantajlarla in vivo birleştirmenin analizini sağlar; aynı minigene farklı hücre hatlarında değerlendirilebilir; tüm hücresel bileşenler, esas olarak çeviri sonrası modifikasyonlarını düzenleyen (fosforilasyon ve hücre bölmelerindeki değişiklikler) mevcuttur ve13,14. Ayrıca, hücresel stres sonrası alternatif birleştirme düzenindeki değişiklikler gözlenebilir ve minigene sisteminin kullanımı, farklı uyaranlar tarafından modüle edilen yolu tanımlamaya izin verir.
13,14, ancak, ön test olarak, minigeneE1A 15,5'SS seçiminin vivo olarak incelenmesi için çok iyi kurulmuş bir alternatif birleştirme muhabir sistemidir. Sadece bir genden, E1A, beş mRNA'lar, üç farklı 5′ splice bölgesinin ve bir büyük veya bir küçük 3′ splice sitesinin seçimine dayalı alternatif birleştirme ile üretilir16,17,18. E1A varyantlarının ekspresyonu Adenoviral enfeksiyon dönemine göre değişir19,20.
Daha önce her iki Nek4 izoformlarının da SRSF1 ve hnRNPA1 gibi birleştirme faktörleriyle etkileşime girdiğini ve isoform 2 değişiklikleri E1A alternatif birleştirmeyi minigene ederken, isoform 1'in bu21. İzoform 1 en bol izoform olduğundan ve kemoterapi direncini ve DNA hasar yanıtını değiştirdiğinden, stres durumunda minigene E1A alternatif birleştirmeyi değiştirip değiştiremeyeceğini değerlendiriyoruz.
Minigene tahlil basit, düşük maliyetli ve hızlı bir yöntemdir, çünkü sadece RNA ekstraksiyonu, cDNA sentezi, amplifikasyon ve agarose jel analizlerine ihtiyaç duyar ve farklı tedavilerin hücresel alternatif birleştirme deseni üzerindeki etkisine kadar ilgi çekici bir protein tarafından alternatif birleştirme üzerinde olası bir etkiden bu yana değerlendirmek için yararlı bir araç olabilir.
Protokol
1. Kaplama hücreleri
NOT: Bu açıklanan protokolde, daha önce Nek4'ün kararlı indüklensiz ekspresyörü için oluşturulan HEK293 kararlı hücre hatları21kullanıldı, ancak aynı protokol HEK293 22 , HeLa23 , 24 ,25,26,U-2 OS27,COS728, SH-SY5Y29gibi diğer birçok hücre hattı için uygundur. Bazal koşullar altında minigene E1A izoformlarının ekspresyon modeli bu hücreler arasında değişir ve her durum için karakterize edilmelidir. Bu protokol kararlı hücre hatlarıyla sınırlı değildir. Aday proteinin değerlendirilmesinde en yaygın yaklaşım, sabit miktarda minigene ile miktarının artırılmasının geçici olarak birlikte transfeksiyonlanmasıdır. Aynı protokol nakavt hücreleri için de uygundur.
- Araç, virüssüz ve GFP kontrolleri göz önüne alındığında plaka hücreleri.
- Dulbecco'nun Modifiye Kartal Ortası'nda (DMEM) ilgi geninin kararlı ekspresyonuna sahip Kültür HEK293 hücreleri Fetal Sığır Serumunun (FBS) % 10'u ile desteklenmiştir, 4.5 g/L Glikoz, 4 mM L-Glutamin ve 100 μg/mL higromisin B ile, %5 CO2'de 37 °C'de doku kültürüyle işlenmiş plakalarda ve nemlendirilmiş bir atmosferde muhafaza edin.
- %0.25 tripsin-EDTA kullanarak hücreleri bölün. Plaka 3 x 10 5 hücreleri6 kuyulu plakalarda ve % 5 CO 2'de 37 °C'de24saat kuluçkaya yatırın.
NOT: Transfeksiyon için transeksiyon sonrası hücre ölümünü azaltmak için hücrelerin %70-80 bir arada olması gerekir.
2. Hücre nakli
NOT: Burada 1-2 μg pMTE1A minigene plazmid kullanılmıştır, ancak toksisiteyi önlemek için DNA miktarı ve ifade süresi minimumda tutulmalıdır. Örneğin, 1 μg pMTE1A DNA ile 30 saat transfeksiyondan sonra HeLa hücrelerinde yüksek toksisite gözlendi. Burada açıklanan transfeksiyon için lipid bazlı transfeksiyon reaktifi kullanılmıştır.
- Hek293 stabil hücrelerini kapadıktan sonra hücre konfluansı 24 saat kontrol edin ve sadece% 70-80 birleştiğinde transfect.
- Vakum pompası sistemi kullanmak yerine, hücre kültürü ortamını bir pipetle dikkatlice çıkarın. Daha sonra antibiyotiksiz 2 mL tam DMEM ortamını dikkatlice ekleyin ve plakayı tekrar inkübatöre koyun.
- Transfeksiyon tamponu (200 μL/kuyu) ile bir tüp hazırlayın, 2 μg pMTE1A DNA, girdap ekleyin ve ardından 2 μL transfeksiyon reaktifi ekleyin. Tekrar girdap ve oda sıcaklığında 10 dakika kuluçkaya yaslanın.
- Plakaları inkübatörden çıkarın ve transfeksiyon karışımını damla yönünde dikkatlice ekleyin.
- HEK293 kararlı hücrelere, transfeksiyondan 6 saat sonra Nek4 ekspresyon indüksiyonu için tetrasiklin (0,5 μg/mL) ekleyin. Orta değişim gerekli değildir.
NOT: Bu bölümde açıklanan hacimler/tutarlar bir kuyu içindir. Karışımı aynı tüpte deneyde kullanılan tüm kuyular için hazırlayın. - Egfp ile transfect yapmak için bir kuyu veya transfeksiyon verimliliğini tahmin etmek için plazmid ifade eden başka bir florofor hazırlayın. En az %40'lı transfeksiyon verimliliği ile daha iyi sonuçlar gözlenebilir, ancak daha önce daha düşük transfeksiyon verimliliği ile iyi performanslar gözlenmiştir.
- Ko-transfeksiyon (faiz proteini ve minigene) kullanırken, endojen mRNA'dan sonuç almaktan kaçınmak için transknakt olmayan hücrelerle bir kuyu tutun. E1A durumunda, HEK293 hücreleri zaten E1A genini ifade30.
3. İlaçların hazırlanması
NOT: Tedavi süresi ve konsantrasyonu, bazı genler için alternatif birleştirmedeki değişikliklere işaret eden literatür sonuçlarına göre seçilmiştır.
- Hücre canlılığında hiçbir etkisi olmayan alternatif birleştirme indüksiyonuna minimum konsantrasyonu belirlemek için teste başlamadan önce bir doz-yanıt eğrisi gerçekleştirin.
- Etanolde 5 mM konsantrasyonda bir Paclitaxel stok çözeltisi hazırlayın. Son konsantrasyon 1 μM'dir. -20 °C'de tutun. Araç kontrolü olarak %0.02 etanol kullanın.
- Yaklaşık 0,5 mg/mL'de (1,66 mM) %0,9 NaCl seyrelterek bir cisplatin çözeltisi hazırlayın. Işıktan, girdaptan koruyun ve 30 dakika boyunca 37 °C termal banyoda kuluçkaya yat. Son konsantrasyon 30 μM'dir. Taze hazırlayın veya bir aya kadar 2-10 ° C'de saklayın.
NOT: Tüm ilaçlar ışıktan korunmalıdır.
4. Hücre tedavisi ve toplanması
NOT: HEK293 stabil hücreler transfeksiyondan 48 saat sonra toplanmış ve bunun için transeksiyondan 24 saat sonra tedavi edilmiştir çünkü en yüksek Nek4 ekspresyon seviyesi 48 saat içinde elde edilir. Bununla birlikte, şu anda yüksek düzeyde 13S izoform ekspresyoform ifadesi (%90'a kadar) gözlenmiştir. 13S izoform oranını azaltmak için, transfeksiyondan maksimum 30 saat sonra hücreleri tedavi etmeye ve toplamaya çalışın.
- RNA/ DNase ücretsiz ipuçları ve tüpler kullanın. Üreticinin tavsiyesi üzerine fenol-kloroform reaktif ile toplam RNA ekstraksiyonu gerçekleştirin.
- Transfeksiyondan 24 saat sonra, floresan mikroskop kullanarak hücre morfolojisini ve transfeksiyon verimliliğini doğrulayın.
- Hücre kültürü ortamını, tercihen vakum pompası sistemi yerine pipet kullanarak çıkarın. Daha sonra daha önce açıklanan son konsantrasyonda kemoterapötiklerle hücre kültürü ortamı ekleyin.
- 37 °C'de kuluçkaya yaslanın, 18 -24 saat boyunca% 5 CO 2.
- Hücre kültürü ortamını bir kaba atarak ve doğrudan kuyuya 0,5 - 1 mL RNA ekstraksiyon reaktifi ekleyerek RNA toplayın. Kuyular çok bir aradaysa, RNA kalitesini artırmak için 1 mL RNA ekstraksiyon reaktifi kullanın.
- Pipetle homojenize edin ve 1,5 mL santrifüj tüpüne aktarın. Bu noktada, protokol örnekleri -80 °C'de depolayarak duraklatılabilir veya hemen RNA ekstraksiyonuna devam edebilir.
UYARI: Fenol bazlı RNA ekstraksiyon reaktifi toksiktir ve tüm prosedürler kimyasal bir duman kaputunda yapılmalı ve kalıntılar uygun şekilde atılmalıdır.
5. RNA ekstraksiyonu ve cDNA sentezi
- Duman kaputunda numuneleri çözün ve oda sıcaklığında 5 dakika kuluçkaya yatırın. 0.1 -0.2 mL kloroform ekleyin ve kuvvetlice çalkalanın.
- Oda sıcaklığında 3 dakika kuluçkaya yatır.
- 12.000 x g ve 4 °C'de 15 dakika santrifüj.
- Üst sulu fazı toplayın ve yeni bir 1,5 mL santrifüj tüpüne aktarın. Toplam hacmin yaklaşık% 60'ını toplayın; ancak, DNA'yı veya organik (alt) fazı toplamayın.
- 0.25 - 0.5 mL izopropanol ekleyin ve 4 kez ters çevrilerek ajite edin. Oda sıcaklığında 10 dakika kuluçkaya yatır.
- 10 dakika boyunca 12.000 x g'da, 4 °C'de santrifüj ve süpernatantı atın.
- RNA peletini etanol ile iki kez yıkayın (dietilptirokarbonat (DEPC) arıtılmış suda% 75). 5 dakika boyunca 7.500 x g'da santrifüj ve etanol atın.
- Tüpü bir havlu kağıdına ters çevirerek fazla etanol çıkarın ve ardından peleti 5 - 10 dakika boyunca kısmen kurutmak için tüpü bir duman kaputunun içinde açık bırakın.
- RNA peletini 15 μL DEPC arıtıcı suda yeniden sunun.
- RNA kalitesini doğrulamak için 230 nm, 260 nm ve 280 nm'de emicilik kullanarak toplam RNA'yı ölçün.
- Toplam RNA kalitesini doğrulamak için, 30 dk 31 için% 2.5 sodyum hipoklorit çözeltisinin% 1.2'si (v / v) ile önceden işlenmiş% 1 agarose jelçalıştırın.
- Toplam RNA'nın 1-2 μg'ını kullanarak cDNA sentezi gerçekleştirin.
- Pipet RNA, 1 μL oligo-dT (50 μM), 1 μL dNTP (10 mM) ve ses seviyesini çekirdeksiz su ile 12 μL'ye kadar oluşturur. Termositte 65 °C'de 5 dakika kuluçkaya yatırın.
- Reaksiyon karışımını soğutmak ve hazırlamak için termositlerden numuneleri çıkarın: 4 μL ters transkriptaz tamponu, 2 μL dithiothreitol (DTT) ve 1 μL ribononiklaaz inhibitörü. 2 dakika boyunca 37 °C'de kuluçkaya yaslanın.
- 1 μL termo-kararlı ters transkriptaz ekleyin. 37 °C'de 50 dakika kuluçkaya yatırın ve enzimi 70 °C'de 15 dakika inaktive edin.
NOT: cDNA birkaç hafta boyunca -20 °C'de saklanabilir. Putatif intron-retansiyon olayları ayrımcılığından kaynaklanan genomik kontaminasyon için ters olmayan bir transkriptaz (NRT) kontrolü gerçekleştirin.
6. pMTE1A minigene PCR
- Aşağıdaki koşullarla reaksiyon bileşimi (1,5 mM MgCl2, 0,3 mM dNTP karışımı, her astarın 0,5 μM'si, sıcak başlangıçlı Taq Polymerase'nin 2,5 U'su ve 150 ng cDNA) ile PCR gerçekleştirin:
2 dakika için 94 °C, 29 döngü: 1 dakika için 94 °C, 2 dakika için 50 °C, 2 dakika için 72 °C, 10 dakika için 72 °C. - PCR ürününün 20-25 μL'sini nükleik asit lekesi içeren% 3 agarose jeline yükleyin ve yaklaşık 1 saat boyunca 100 V'ta çalıştırın.
7. Bir görüntü işleme ve analiz yazılımı kullanılarak jelin analizi32
- Çalıştırdıktan sonra, herhangi bir bant doygunluğunu önleyen jeli (jel görüntüleme toplama sistemi kullanarak) fotoğraflayın ve bir görüntü işleme yazılımı kullanarak bantları ölçün.
- Niceleme için sırasıyla 13S, 12S ve 9S izoformlarına karşılık gelecek şekilde ~631 bp, ~493 bp ve ~156 bp bantlarını göz önünde bulundurun.
- Yazılımın Dosya menüsünden, görüntüleme alma sisteminden elde edilen görüntü dosyasını açın. Gri tonlamalı olarak dönüştürün, parlaklığı ve kontrastı ayarlayın ve gerekirse aykırı gürültüyü ortadan kaldırın.
- Dikdörtgen Seçimi aracıyla ilk şeridin etrafına bir dikdörtgen çizin ve Çözümle | Jeller | İlk Şerit komutunu seçin veya bunun için klavye kısayoluna basarak.
- İlk şeritteki dikdörtgenin ortasında tıklatıp tutmak ve bir sonraki şeride sürüklemek için fareyi kullanın. Analiz | Git Jeller | Sonraki Şerit'i seçin veya kullanılabilir kısayola basın. Bu adımı kalan tüm şeritlere tekrarlayın.
- Tüm şeritler vurgulandıktan ve numaralandıktan sonra Analiz | Jeller | Her şeridin bir profil arsa çizmek için Şeritler çizin.
- Düz çizgi seçim aracıyla, her bir tepenin tabanı boyunca her banda karşılık gelen bir çizgi çizerek arka plan gürültüsünü dışarıda bırakın. Tüm zirveler, her şeritten kapatıldıktan sonra, Asa aracını seçin ve her tepenin içini tıklayın. Vurgulanan her tepe için, görüntülenen Sonuçlar penceresinde ölçümler açılmalıdır.
- Her örnek için 3 bandın tümlerinden yoğunluğu toplayın ve her bir izoformun toplam yüzdesini hesaplayın.
- Her izoformun yüzdelerini veya tedavi edilmemiş örneklere göre yüzdedeki farkları çizin.
NOT: Üç E1A çeşidinin toplamının %100'e eşit olması gerektiğinden emin olun.
Sonuçlar
Kemoterapi sergisinden sonra hücrelerde birleştirme profilindeki değişiklikleri değerlendirmek için E1A minigene kullanılarak 5' splice sites tahlil yapıldı. Paclitaxel veya cisplatin tedavisinden sonra HEK293 stabil hücrelerinde AS regülasyonunda Nek4 - isoform 1'in rolü değerlendirildi.
Adenoviral E1A bölgesi, farklı splice donörlerinin kullanımı nedeniyle bir RNA öncüsünden üç ana mRNA'nın üretiminden sorumludur. Ortak 5' ve 3' termini paylaşırlar, ancak ekscislenmiş intronlarının boyutunda farklılık gösterirler. Adenoviral E1A mRNA'lar sedimasyon katsayılarına, 13S, 12S ve 9S'lerine göre adlandırılır. Adenovirüs enfeksiyonunun erken evresinde (yaklaşık 7 saat), enfekte hücreyi viral DNA replikasyonuna hazırlamak için önemli proteinler üretilir (13S - 723 aa ve 12S - 586 aa) ve bunların yanı sıra geç fazda (yaklaşık 18 saat) küçük bir protein (9S -249 aa)20üretilir. E1A'dan minigene içeren bir plazmid kullanılarak, üretilen her izoformdan mRNA oranını değerlendiren transfeksiyondan sonra hücrelerde alternatif birleştirme üzerindeki etkisi gözlenebilir: 13S: 631 bp, 12S: 493 bp ve 9S 156 bp (Şekil 1A ve B).
E1A izoformlarının bazal ekspresyolü hücre çizgisine ve E1A ekspresyonunun zamanına bağlıdır. HEK293-kararlı hücre hattının (HEK293-Flag) veya HEK293 rekombinaz içeren sitenin (HEK293-FRT - orijinal hücre hattı) daha yüksek bir ifade gösterdiği gözlenmiştir. 48 h E1A ifadesinden sonra benzer 13S ve 12S izoform seviyelerini gösteren HeLa hücrelerine (HeLa-PLKO) kıyasla 13S'in (Şekil 1C ve D).
HEK293 stabil hücrelerinde gözlenen yüksek 13S ekspresyoz seviyesi, daha kısa E1A ekspresyoz süresi altında (yaklaşık 30 saat) önemli ölçüde azalır. 30 saat ve 48 h'de 13S:12S:9S'nin oranı (%) sırasıyla 60:33:7 ve 80:15:5'tir (benzeri görülmemiş veriler). Bu nedenle, deneylere başlamadan önce bazal hücresel minigene E1A birleştirme profilini karakterize etmek önemlidir.
Cisplatine maruz kalan hücreler, 5's splicing seçiminde 12S ekspresyondan yana bir kayma gösterdi (tedavi edilmemiş hücrelere kıyasla yaklaşık% 15'lik bir artış). Bu etki HEK293'te, Nek4'ün 1. İfade yüzdesinde büyük değişiklikler gözlendiğinde, yüzdeleri olan bir çizim sonuçları açıkça temsil eder (Şekil 2).
Bir tedaviye yanıt veren iki koşulu (Bayrak ve Nek4 aşırı ifade) karşılaştırırken, genellikle verileri temsil etmenin en iyi yolu, bir grafikteki farklılıkları çizmektir, çünkü bazal ifade düzeyi farklı olabilir ve yüzdeler tedavinin gerçek etkisini yansıtmaz. Bu Şekil 3'te gözlemlenebilir. Paclitaxel tedavisinden sonra AS'deki değişiklikler çok ayrıktı, ancak değişikliklerin yönleri Flag ve Nek4 eksprese hücrelerinde tam tersiydi.
Tedaviden sonra yapılan küçük değişikliklere rağmen, sonuçlar tutarlıydı, bu da paclitaxel tedavisinin Bayrak ekspresyasyon hücrelerinde 12S ve 9S'de bir artışla 13S izoformunda bir azalmaya yol açtığını gösterirken, diğer yandan Nek4 eksprese hücrelerinde tam tersi bir etki gözlenir.

Şekil 1: Minigene E1A birleştirme deseni hücre çizgisine bağlıdır. A)Minigene E1A birleştirme sitelerinin şematik gösterimi. Oklar, minigene E1A izoformları amplifikasyonu için astar tavlama bölgesini gösterir. B)Minigene E1A'nın alternatif bir şekilde birekten üretilen izoformlar. C) HEK293 kararlı bir şekilde ifade bayrak boş vektör (HEK293 -Bayrak), PlKO vektör (HeLa - PLKO) ile trans enfekte hela veya, HEK293 rekombinaz içeren siteler (HEK293 kararlı ifade Bayrak veya Nek4.1 oluşturulan - HEK293-FRT) pMTE1A plamid ile trans enfekte edildi. Transfeksiyon toplam RNA izole edildikten ve Agarose jel(D)içinde E1A izoformları ayrıldıktan sonra 48h. BASAL koşullarda HEK293-Flag ve HeLa-PLKO hücrelerinde 13S, 12S ve 9S izoform yüzdesini karşılaştıran grafik. Üç bağımsız deneyden elde edilen veriler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Cisplatin tedavisinin minigene E1A birleştirme deseninde etkisi. HEK293 kararlı bir şekilde bayrak boş vektör (Bayrak) veya Nek4.1 Bayrak etiketi kaynaşmış ifade, pMTE1A plazmid ile trans enfekte edildi. Transfeksiyon tetrasiklinin protein ekspresyon indüksiyonu eklenmeden altı saat sonra. 24 saat ila 48 saat arasında, hücre kültürü ortamı 30 μM Cisplatin içeren ortam için değiştirildi. 24 saat inkübasyondan sonra toplam RNA çıkarıldı ve PCR ürünleri% 3 agarose jelde ayrıldı. A)Baskın minigene E1A izoformları tasvir edilir. B-D grafikleri, üç varyantın (13S, 12S ve 9S) toplamına göre her izoformun yüzdesini temsil eder. E'de, her izoforma ifade yüzdesi farkı araç (orta) kontrolüne göre sunulur. Grafikler üç bağımsız deneyin ortalaması ve SEM'i olarak sunulmaktadır. * s< 0.05, ** p<0.01 eşleşmemiş t testinde. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
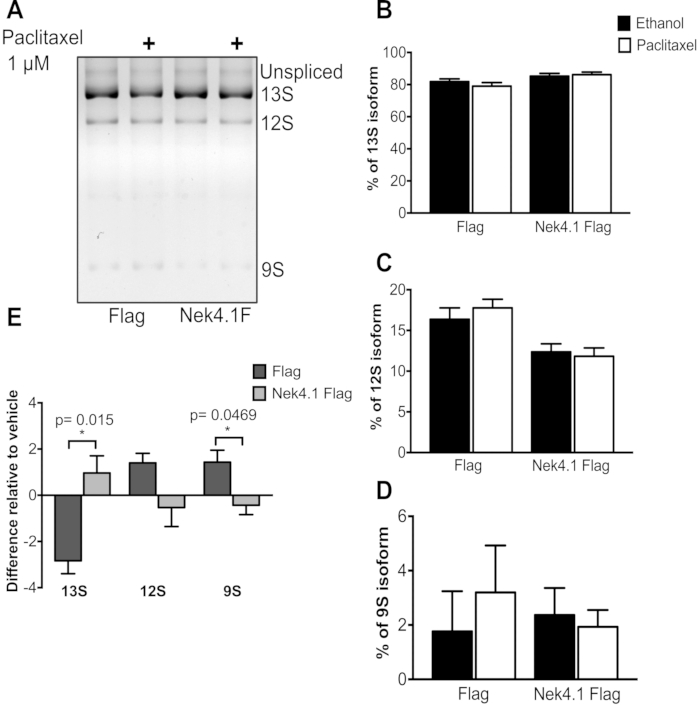
Şekil 3: Paclitaxel tedavisinin minigene E1A birleştirme deseninde etkisi. HEK293 kararlı bir şekilde bayrak boş vektör (Bayrak) veya Nek4.1 Bayrak kaynaşmış ifade, pMTE1A plazmid ile trans enfekte edildi. Transfeksiyon tetrasiklinin protein ekspresyon indüksiyonu eklenmeden altı saat sonra. 24 saat ila 48 saat arasında, hücre kültürü ortamı, araç kontrolü olarak kullanılan 1 μM Paclitaxel veya etanol (%0.02) içeren ortamla değiştirildi. 24 saat inkübasyondan sonra toplam RNA çıkarıldı ve PCR ürünleri% 3 agarose jelde ayrıldı. A)Baskın izoformlar tasvir edilir. B-D grafikleri, üç varyantın (13S, 12S ve 9S) toplamına göre her izoformun yüzdesini temsil eder. E'de, her izoforma ifade yüzdesi farkı araç (etanol) kontrolüne göre sunulur. Grafikler üç bağımsız deneyin ortalaması ve SEM'i olarak sunulmaktadır. * s< 0.05 eşleşmeyen t testinde. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Minigenes, küresel alternatif birleştirme in vivo etkilerini belirlemek için önemli araçlardır. Adenoviral minigene E1A,13,14hücredeki bunların miktarını artırarak proteinlerin rolünü değerlendirmek için on yıllardır başarıyla kullanılmaktadır. Burada, kemoterapötik maruziyet sonrası alternatif birleştirmeyi değerlendirmek için minigene E1A kullanımını öneriyoruz. Nek4 isoform 1'i ifade eden kararlı bir hücre hattı kullanıldı ve geçici transeksiyonun neden olduğu aşırı ekspresyon yapıtlarından kaçındı. Nek4'ün izoform 1'i, bazal koşullarda minigene E1A alternatif birleştirmede etki göstermedi21, ancak birçok birleştirme ile ilgili interactore sahiptir, bu nedenle, bu hücrelerde E1A alternatif birleştirmede kemoterapötik tedavinin spesifik etkisini değerlendirmemizi sağlar.
Düşük hassasiyetine rağmen, esas olarak radyoaktif yaklaşımlara kıyasla, burada açıklanan yöntem basittir ve özel reaktifler veya laboratuvar koşulları gerektirmez. Bununla birlikte, minigene E1A'nın 5'sS seçimlerinin küresel bir muhabiri olduğunu belirtmek önemlidir, ancak 3'SS seçimi bu protokolle değerlendirilebilir, ancak belirli minigene muhabiri14,33,34kullanılmalıdır. Ayrıca, sonuçlar hücre hattından etkilenebilir ve bazal alternatif birleştirme profili nedeniyle yanlış yorumlamayı önlemek için dikkatlice değerlendirilmelidir.
Genellikle, minigene E1A birleştirme deseninde büyük farklılıklar sadece birleştirme faktörlerinin ifadesi değiştirilirken gözlenir. Diğer değişiklikler, bu faktörlerin aktivitesini modüle eden çok sayıda protein nedeniyle daha az belirgindir. Bu nedenle dolaylı bir aday için çalışmalara başlandığında, bu aday proteinin artan miktarlarına dayalı klasik yaklaşım tercih edilmelidir. Bazı etkiler gözlendiğinde, düzenlemenin belirli bir hücresel uyarana özgü olup olmadığını araştırmak için tedaviler yapılabilir.
Ön olumlu bir sonuçtan sonra, deneyi optimize etmek için zaman ve ilaç konsantrasyonunun standardizasyonu yapılabilir.
Bu basit protokol bir ön testtir, ilgi proteininin alternatif birleştirmede bir etki gösterip göstermediğini cevaplayabilen bir başlangıç noktasıdır ve ayrıca alternatif birleştirme düzenlemesinde bir miktar etki zaten bilindiğinde, çalışmaları proteinin kemoterapi yanıtında alternatif birleştirmeyi düzenleyen bir rol oynadığı daha tutarlı yola yönlendirebilir.
Açıklamalar
Yazarlar rakip finansal çıkarları olmadığını beyan ederler.
Teşekkürler
Fundação de Amparo a Pesquisa do Estado de São Paulo'ya (FAPESP, Grant Temático 2017/03489-1'den JK'ya ve FLB 2018/05350-3)'e burs ve bu araştırmayı finanse etmek için Conselho Nacional de Desenvolvimento Cientifico e Tecnológico (CNPq) aracılığıyla. PMTE1A plazmid ve Zerler ve meslektaşlarına E1A klonlama çalışmalarından dolayı teşekkür ederiz. Ayrıca Prof. Dr. Patrícia Moriel, Prof. Dr. Wanda Pereira Almeida, Prof. Dr. Marcelo Lancellotti ve Prof. Dr. Karina Kogo Cogo Müller'e laboratuvar alan ve ekipmanlarını kullanmamızı sağlayan teşekkür ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100 pb DNA Ladder | Invitrogen | 15628-050 | |
| 6 wells plate | Sarstedt | 833920 | |
| Agarose | Sigma | A9539-250G | |
| Cisplatin | Sigma | P4394 | |
| DEPC water | ThermoFisher | AM9920 | |
| DMEM | ThermoFisher | 11965118 | |
| dNTP mix | ThermoFisher | 10297-018 | |
| Fetal Bovine Serum - FBS | ThermoFisher | 12657029 | |
| Fluorescent Microscope | Leica | DMIL LED FLUO | |
| Gel imaging acquisition system - ChemiDoc Gel Imagin System | Bio-Rad | ||
| GFP - pEGFPC3 | Clontech | ||
| HEK293 stable cells - HEK293 Flp-In | Generated from Flp-In™ T-REx™ 293 - Invitrogen and described in ref 21 | ||
| Hygromycin B | ThermoFisher | 10687010 | Used for Flp-In cells maintenemant |
| Image processing and analysis software - FIJI software | ref. 32 | ||
| Lipid- based transfection reagent - jetOPTIMUS Polyplus Reagent | Polyplus | 117-07 | |
| Oligo DT | ThermoFisher | 18418020 | |
| Paclitxel | Invitrogen | P3456 | |
| Plate Reader/ UV absorbance | Biotech | Epoch Biotek/ Take3 adapter | |
| pMTE1A plasmid | Provided by Dr. Adrian Krainer | ||
| pMTE1A F | Invitrogen | 5’ -ATTATCTGCCACGGAGGTGT-3 | |
| pMTE1A R | Invitrogen | 5’ -GGATAGCAGGCGCCATTTTA-3’ | |
| Refrigerated centrifuge | Eppendorf | F5810R | |
| Reverse Transcriptase - M-MLV | ThermoFisher | 28025013 | |
| Reverse transcriptase - Superscript IV | ThermoFisher | 18090050 | |
| Ribunuclease inhibitor RNAse OUT | ThermoFisher | 10777-019 | |
| RNA extraction phenol-chloroform based reagent - Trizol | ThermoFisher | 15596018 | |
| SybrSafe DNA gel stain | ThermoFisher | S33102 | |
| Taq Platinum | Thermo | 10966026 | |
| Tetracyclin | Sigma | T3383 | Used for Flag empty or Nek4- Flag expression induction |
| Thermocycler Bio-Rad | Bio-Rad | T100 | |
| Trypsin | Sigma | T4799 |
Referanslar
- Ule, J., Blencowe, B. J. Alternative Splicing Regulatory Networks: Functions, Mechanisms, and Evolution. Molecular Cell. 76 (2), 329-345 (2019).
- Pan, Q., Shai, O., Lee, L. J., Frey, B. J., Blencowe, B. J. Deep surveying of alternative splicing complexity in the human transcriptome by high-throughput sequencing. Nature Genetics. 40 (12), 1413-1415 (2008).
- Nilsen, T. W., Graveley, B. R. Expansion of the eukaryotic proteome by alternative splicing. Nature. 463 (7280), 457-463 (2010).
- Stamm, S. Signals and their transduction pathways regulating alternative splicing: a new dimension of the human genome. Human Molecular Genetics. 11 (20), 2409-2416 (2002).
- Kornblihtt, A. R., et al. Alternative splicing: a pivotal step between eukaryotic transcription and translation. Nature Reviews Molecular Cell Biology. 14 (3), 153-165 (2013).
- Zhong, X. -. Y., Ding, J. -. H., Adams, J. A., Ghosh, G., Fu, X. -. D. Regulation of SR protein phosphorylation and alternative splicing by modulating kinetic interactions of SRPK1 with molecular chaperones. Genes & Development. 23 (4), 482-495 (2009).
- Misteli, T., Cáceres, J. F., Clement, J. Q., Krainer, A. R., Wilkinson, M. F., Spector, D. L. Serine Phosphorylation of SR Proteins Is Required for Their Recruitment to Sites of Transcription In Vivo. Journal of Cell Biology. 143 (2), 297-307 (1998).
- Kanopka, A., et al. Regulation of adenovirus alternative RNA splicing by dephosphorylation of SR proteins. Nature. 393 (6681), 185-187 (1998).
- Anufrieva, K. S., et al. Therapy-induced stress response is associated with downregulation of pre-mRNA splicing in cancer cells. Genome Medicine. 10 (1), 49 (2018).
- Shultz, J. C., et al. SRSF1 Regulates the Alternative Splicing of Caspase 9 Via A Novel Intronic Splicing Enhancer Affecting the Chemotherapeutic Sensitivity of Non-Small Cell Lung Cancer Cells. Molecular Cancer Research. 9 (7), 889-900 (2011).
- Gabriel, M., et al. Role of the splicing factor SRSF4 in cisplatin-induced modifications of pre-mRNA splicing and apoptosis. BMC Cancer. 15, (2015).
- Lee, S. C. -. W., Abdel-Wahab, O. Therapeutic targeting of splicing in cancer. Nature Medicine. 22 (9), 976-986 (2016).
- Cooper, T. A. Use of minigene systems to dissect alternative splicing elements. Methods. 37 (4), 331-340 (2005).
- Stoss, O., Stoilov, P., Hartmann, A. M., Nayler, O., Stamm, S. The in vivo minigene approach to analyze tissue-specific splicing. Brain Research Protocols. 4 (3), 383-394 (1999).
- Zerler, B., et al. Adenovirus E1A coding sequences that enable ras and pmt oncogenes to transform cultured primary cells. Molecular and Cellular Biology. 6 (3), 887-899 (1986).
- Gattoni, R., Schmitt, P., Stevenin, J. In vitro splicing of adenovirus E1A transcripts: characterization of novel reactions and of multiple branch points abnormally far from the 3' splice site. Nucleic Acids Research. 16 (6), 2389-2409 (1988).
- Stephens, C., Harlow, E. Differential splicing yields novel adenovirus 5 E1A mRNAs that encode 30 kd and 35 kd proteins. The EMBO journal. 6 (7), 2027-2035 (1987).
- Ulfendahl, P. J., et al. A novel adenovirus-2 E1A mRNA encoding a protein with transcription activation properties. The EMBO journal. 6 (7), 2037-2044 (1987).
- Berk, A. J., Sharp, P. A. Structure of the adenovirus 2 early mRNAs. Cell. 14 (3), 695-711 (1978).
- Svensson, C., Pettersson, U., Akusjärvi, G. Splicing of adenovirus 2 early region 1A mRNAs is non-sequential. Journal of Molecular Biology. 165 (3), 475-495 (1983).
- Basei, F. L., Meirelles, G. V., Righetto, G. L., dos Santos Migueleti, D. L., Smetana, J. H. C., Kobarg, J. New interaction partners for Nek4.1 and Nek4.2 isoforms: from the DNA damage response to RNA splicing. Proteome Science. 13 (1), 11 (2015).
- Zhou, Z., et al. The Akt-SRPK-SR Axis Constitutes a Major Pathway in Transducing EGF Signaling to Regulate Alternative Splicing in the Nucleus. Molecular Cell. 47 (3), 422-433 (2012).
- Caceres, J., Stamm, S., Helfman, D., Krainer, A. Regulation of alternative splicing in vivo by overexpression of antagonistic splicing factors. Science. 265 (5179), 1706-1709 (1994).
- Zhong, X. -. Y., Ding, J. -. H., Adams, J. A., Ghosh, G., Fu, X. -. D. Regulation of SR protein phosphorylation and alternative splicing by modulating kinetic interactions of SRPK1 with molecular chaperones. Genes & Development. 23 (4), 482-495 (2009).
- Naro, C., et al. The centrosomal kinase NEK2 is a novel splicing factor kinase involved in cell survival. Nucleic Acids Research. 42 (5), 3218-3227 (2014).
- Lu, C. -. C., Chen, T. -. H., Wu, J. -. R., Chen, H. -. H., Yu, H. -. Y., Tarn, W. -. Y. Phylogenetic and Molecular Characterization of the Splicing Factor RBM4. PLoS ONE. 8 (3), 59092 (2013).
- Jarnæss, E., et al. Splicing Factor Arginine/Serine-rich 17A (SFRS17A) Is an A-kinase Anchoring Protein That Targets Protein Kinase A to Splicing Factor Compartments. Journal of Biological Chemistry. 284 (50), 35154-35164 (2009).
- Bressan, G. C., et al. Functional association of human Ki-1/57 with pre-mRNA splicing events. FEBS Journal. 276 (14), 3770-3783 (2009).
- Vivarelli, S., et al. Paraquat Modulates Alternative Pre-mRNA Splicing by Modifying the Intracellular Distribution of SRPK2. PLoS ONE. 8 (4), 61980 (2013).
- Russell, W. C., Graham, F. L., Smiley, J., Nairn, R. Characteristics of a Human Cell Line Transformed by DNA from Human Adenovirus Type 5. Journal of General Virology. 36 (1), 59-72 (1977).
- Aranda, P. S., LaJoie, D. M., Jorcyk, C. L. Bleach gel: A simple agarose gel for analyzing RNA quality. Electrophoresis. 33 (2), 366-369 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Bai, Y. Control of 3' splice site choice in vivo by ASF/SF2 and hnRNP A1. Nucleic Acids Research. 27 (4), 1126-1134 (1999).
- Cote, G. J., Nguyen, N., Lips, C. J. M., Berget, S. M., Gagel, R. F. Validation of an in vitro RNA processing system for CT/CGRP precursor mRNA. Nucleic Acids Research. 19 (13), 3601-3606 (1991).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır