Method Article
E1Aミニジーンツールを使用したmRNAスプライシング変更の研究
要約
このプロトコルは、化学療法治療後の代替スプライシング調節において特徴のない機能を有するタンパク質の役割を評価するための迅速かつ有用なツールを提示する。
要約
mRNA処理には、5'キャッピング、ポリA付加、スプライシングなどの翻訳用mRNAを準備するための複数の同時ステップが必要です。構成的なスプライシングに加えて、代替mRNAスプライシングは、1つの遺伝子から多機能タンパク質の発現を可能にする。相互作用研究は一般的に新しいまたは未知のタンパク質に対する最初の分析であるため、餌タンパク質とスプライシング因子との関連は、mRNAスプライシングプロセスに参加できることを示すが、どのような文脈で、またはどの遺伝子が調節されているかを決定することは経験的プロセスである。この関数を評価する良い出発点は、古典的なミニジーンツールを使用することです。ここでは、異なる細胞ストレス刺激後の代替スプライシング変化を評価するためのアデノウイルスE1Aミニジーンの使用法を提示する。異なるストレス処理の後に、HEK293におけるE1Aミニジーンのスプライシングを安定的に過剰発現させるNek4タンパク質のスプライシングを評価した。このプロトコルは、E1Aミニジーントランスフェクション、細胞処理、RNA抽出およびcDNA合成、続いてPCRおよびゲル分析およびE1Aスプライス変異体の定量化を含む。特定の治療法と組み合わせたこのシンプルで確立された方法の使用は、細胞プロセスやmRNAスプライシングによって調節できる遺伝子に光を当てる信頼できる出発点です。
概要
スプライシングは、5'mRNAキャッピングと3'mRNAポリアデニル化に同時に発生する真核生物mRNA処理における最も重要なステップの一つです。スプライセオソームによるスプライシング部位(SS)の認識には、小さなリボヌクレオタンパク質(snRNP U1、U2、U4およびU6)を含むリボヌクレオタンパク質複合体、小さなRNA(snRNA)およびいくつかの調節タンパク質1 がスプライシングに必要である。
イントロン除去(構成スプライシング)に加えて、真核生物では、イントロンを保持することができ、エキソンを除外することができ、mRNA代替スプライシング(AS)と呼ばれるプロセスを構成する。代替プレmRNAスプライシングは、真核生物ゲノムのコード容量を拡大し、比較的少数の遺伝子から多数のタンパク質を産生することを可能にする。複数のエキソンを含むヒトmRNAの95〜100%が代替スプライシング2,3を受けることができると推定される。これは、神経細胞の発達、アポトーシス活性化および細胞ストレス応答4のような生物学的プロセスの基本であり、同じレパートリー遺伝子を使用して細胞機能を調節する生物の代替手段を提供する。
代替スプライシングに必要な機械は、構成スプライシングに使用されるのと同じであり、SSの使用は、代替スプライシングの発生のための主要な決定要因です。構成スプライシングは、強いスプライシング部位の使用に関連しており、これは通常、スプライセソーム認識のためのコンセンサスモチーフに類似している5。
代替エキソンは、典型的には、その シス−調節要素の一度構成エキソンよりも効率が低く認識され、これらのエキソンに隣接する5'SSおよび3'SSの配列は、スプライセソームに対する劣った結合能力を示す。mRNAはまた、エキソン(エキソニックスプライシングエンハンサー(ESE)およびエキソニックスプライシングサイレンサー(ESS))およびイントロン(イントロニックスプライシングエンハンサー(ISE)およびイントロニックスプライシングサイレンサー(ISS))に位置するエンハンサーまたはサイレンサーと名付けられた領域を含み、それぞれ5。これらの配列は、トランス調節要素、またはスプライシング因子(SF)によって認識される。SFは、主に、ESEsに結合するセリン/アルギニンリッチスプライシング因子(SRSF)とESSs配列5に結合する異種核リボヌクレオタンパク質(hnRNP)ファミリーの2つのファミリーのタンパク質によって表される。
代替スプライシングは、スプライシング因子6、7、8の相互作用パートナーおよび細胞局在化を修飾するトランス因子のリン酸化/脱リン酸化によって変調することができる。スプライシング因子の新しい調節因子を同定することは、スプライシングを調節するための新しいツールを提供することができ、その結果、いくつかの癌治療。
Anufrievaら 9は、mRNAマイクロアレイ遺伝子発現プロファイルにおいて、101細胞株および異なるストレス状態(白金系薬物、ガンマ照射、トポイソメラーゼ阻害剤、チロシンキナーゼ阻害剤およびタキサン)におけるスプライセソーム成分のレベルにおける一貫した変化を観察した。スプライシングパターンと化学療法効果の関係は、化学療法耐性である肺癌細胞において既に実証されており、カスパーゼ-9変異体の変化率10を示す。化学療法パネルで治療されたHEK293細胞は、プロアポトーシス変異体の増加に伴うスプライシングの変化を示す。Gabriel et al.11 は、異なる細胞株におけるシスプラチン処理後のスプライシングの少なくとも700の事象の変化を観察し、スプライシング経路がシスプラチンに影響を受けていることを指摘した。スプライシングモジュレーターは既に抗腫瘍活性を実証しており、スプライシングが腫瘍の発達にとって重要であることを示し、主に化学療法応答12.したがって、化学療法薬のような細胞ストレッサー剤の後にスプライシングを調節する新しいタンパク質を特徴付けることは、治療の新しい戦略を発見するために非常に重要です。
相互作用研究からの代替スプライシング調節の手がかりは、特に新しいまたは特徴のないタンパク質の機能を特徴付けるために重要であり、ASにおけるタンパク質の実際の役割を検証するためのより一般的で簡単なアプローチを要求することができる。ミニ遺伝子は、スプライシング調節に影響を与えるタンパク質の一般的な役割の分析のための重要なツールです。それらは、代わりにスプライスおよび横たわるゲノム領域13を含む目的の遺伝子からのセグメントを含む。ミニジーンツールを使用すると、マイナーであり、したがって増幅反応に制限されないミニジーンの長さなどのいくつかの利点を持つin vivoのスプライシングの分析が可能になります。同じミニ遺伝子を異なる細胞株で評価することができます。すべての細胞成分は、主に翻訳後修飾(リン酸化および細胞区画の変化)の調節が存在し、13,14に対処することができる。さらに、代替スプライシングパターンの変化は、細胞ストレス後に観察され、かつ、ミニ遺伝子系を用いることで、異なる刺激によって変調される経路を同定することを可能にする。
スプライシングイベント13,14の異なる種類に特異的なミニジーンシステムが既にいくつか存在するが、予備的なアッセイとして、ミニジーンE1A15は、生体内での5'SS選択の研究のための非常に確立された代替スプライシングレポーターシステムである。1つの遺伝子のみから、E1A、5つのmRNAは、3つの異なる5′スプライス部位の選択に基づいて代替スプライシングによって生成され、1つの主要なまたは1つのマイナーな3′スプライス部位16、17、18の。E1A変異体の発現は、アデノウイルス感染の期間19、20に従って変化する。
我々は、両方のNek4アイソフォームがSRSF1およびhnRNPA1などのスプライシング因子と相互作用することを以前に示しており、アイソフォーム2はミニジーンE1A代替スプライシングを変化させるが、アイソフォーム1はその21では効果を有さない。アイソフォーム1は最も豊富なアイソフォームであり、化学療法抵抗とDNA損傷応答を変化させるため、ストレス状態でミニジーンE1A代替スプライシングを変えることができるかどうかを評価します。
Minigeneアッセイは、単純で低コストで迅速な方法であり、RNA抽出、cDNA合成、増幅およびアガロースゲル分析のみが必要であり、細胞代替スプライシングパターンに対する異なる治療法の影響まで、興味のあるタンパク質による代替スプライシングに対する効果が得られるため、評価に有用なツールとなり得る。
プロトコル
1. めっき細胞
注: このプロトコルでは、以前に Nek4 の安定な誘導発現のために生成された HEK293 安定セルラインが21を使用したが、HEK293 22、HeLa23、24、25、26、U-2OS27、COS728、SH-SY5Y29のような他の多くの細胞株に適した同じプロトコルである。基底条件下でのミニ遺伝子E1Aアイソフォームの発現パターンは、これらの細胞間で異なり、各条件に対して特徴付けるべきである。このプロトコルは安定した細胞株に限定されない。候補タンパク質の評価における最も一般的なアプローチは、一過性の共トランスフェクションによるミニジーンの固定量でのその量を増加させることである。同じプロトコルは、ノックアウトセルに適しています。
- 車両、未感染およびGFPコントロールを考慮したプレート細胞。
- 培養HEK293細胞は、牛胎児血清(FBS)の10%、4.5g/Lグルコース、4mM L-グルタミンを添加したダルベックコの改変イーグル培地(DMEM)に関心のある遺伝子の安定した発現を有し、100μg/mLのヒグロマイシンB、培養培養用プレート上での37°Cおよび2% のCO%で培養処理されたプレートに対して2%の高湿球菌体質を有する。
- 0.25% トリプシン-EDTAを使用してセルを分割します。プレート3 x 105細胞を6ウェルプレートに入れ、5%CO2で37°Cで24時間インキュベートします。
注:トランスフェクションの場合、細胞はトランスフェクション後の細胞死を減少させるために70〜80%コンフルエントでなければなりません。
2. 細胞トランスフェクション
注:pMTE1Aミニジーンプラスミドの1〜2μgを使用したが、DNA量と発現時間は、毒性を避けるために最小限に抑える必要があります。例えば、1μgのpMTE1A DNAを用いたトランスフェクションの30時間後にHeLa細胞で高い毒性が認められた。ここで説明するトランスフェクションには、脂質系トランスフェクション試薬が用いられました。
- 70-80%コンフルエントの場合にのみ、細胞合流を24時間めっきし、HEK293安定細胞をトランスフェクトした後に細胞合流をチェックする。
- 真空ポンプシステムを使用する代わりに、ピペットで細胞培養培地を慎重に取り出します。その後、抗生物質なしで2 mLの完全なDMEM培地を慎重に加え、プレートをインキュベーターに戻します。
- トランスフェクションバッファー(200 μL/well)を使用してチューブを調製し、2 μgの pMTE1A DNA、ボルテックスを加え、2 μLのトランスフェクション試薬を加えます。再び渦を起たし、室温で10分間インキュベートする。
- インキュベーターからプレートを取り出し、慎重にトランスフェクション混合物を滴下して追加します。
- HEK293安定細胞に、トランスフェクション後6時間のNek4発現誘導にテトラサイクリン(0.5μg/mL)を加える。中程度の変更は必要ありません。
注: このセクションで説明するボリューム/量は、1 つの井戸用です。実験で使用されるすべてのウェルの混合物を同じチューブで準備します。 - EGFPでトランスフェクトする1つの井戸、または別のフッ素酸を発現するプラスミドを調製し、トランスフェクション効率を推定します。より良い結果は、少なくとも40%のトランスフェクション効率で観察することができるが、より低いトランスフェクション効率と良好な性能は以前に観察された。
- 共トランスフェクション(関心タンパク質およびミニジーン)を使用する場合は、内因性mRNAから結果を得ることを避けるために、非トランスフェクション細胞とウェルを保ちます。E1Aの場合、HEK293細胞は既にE1A遺伝子30を発現している。
3. 薬の準備
注:治療の時間と濃度は、いくつかの遺伝子の代替スプライシングの変化を指摘する文献の結果に基づいて選択されました。
- 測定を開始する前に用量応答曲線を実行し、細胞生存率に影響を及ぼさない代替スプライシング誘導に対する最小濃度を決定する。
- エタノール中の5 mM濃度でパクリタキセルストック溶液を調製します。最終濃度は1μMで、-20°Cに保ちます。 車両制御として0.02%エタノールを使用してください。
- 0.5 mg/mL(1.66 mM)程度で0.9%NaClに希釈してシスプラチン溶液を調製します。熱浴で光、渦、インキュベートから保護し、30分間37°C。最終濃度は30μMで、新鮮な準備をするか、1ヶ月まで2〜10°Cで保管してください。
注:すべての薬物は、光から保護されなければなりません。
4. 細胞処理と収集
注:HEK293安定細胞は、トランスフェクション後48時間回収し、このために、48時間以内に最高のNek4発現レベルが達成されるため、トランスフェクション後24時間処理した。しかし、このとき、13Sアイソフォーム発現(90%まで)の高レベルが観察された。13Sアイソフォームの割合を減少させるために、トランスフェクション最大後30時間の細胞を治療し、収集してみてください。
- RNA/DNaseフリーのチップとチューブを使用してください。メーカーの推奨に従ってフェノールクロロホルム試薬を使用して、トータルRNA抽出を行います。
- トランスフェクション後24時間、蛍光顕微鏡を用いて細胞形態およびトランスフェクション効率を検証する。
- 細胞培養培地を除去し、真空ポンプシステムの代わりにピペットを優先的に使用する。次に、先に述べた最終濃度の化学療法薬を用いて細胞培養培地を添加する。
- 37°Cでインキュベートし、18〜24時間の5%CO2。
- 細胞培養培地を容器に捨て、0.5~1mLのRNA抽出試薬を直接ウェルに添加してRNAを回収します。ウェルが非常にコンフルエントである場合は、RNAの品質を向上させるために1 mLのRNA抽出試薬を使用してください。
- ピペットで均質化し、1.5 mL遠心分離管に移します。この時点で、プロトコルは、-80°Cでサンプルを保存することによって一時停止するか、またはすぐにRNA抽出に進むことができます。
警告:フェノールベースのRNA抽出試薬は有毒であり、すべての手順は化学ヒュームフードで行われ、残渣は適切に配置する必要があります。
5. RNA抽出とcDNA合成
- ヒュームフードではサンプルを解凍し、室温で5分間インキュベートします。0.1 -0.2 mLのクロロホルムを加え、激しく攪拌します。
- 室温で3分間インキュベートします。
- 遠心分離機 15分間 12,000 x g および 4 °C.
- 上部水相を収集し、新しい1.5 mL遠心分離管に移します。総量の約60%を収集します。ただし、DNAまたは有機(低)相を収集しないでください。
- 0.25 - 0.5 mLのイソプロパノールを加え、反転によって4回攪拌します。室温で10分間インキュベートします。
- 遠心分離機は10分間10分間、4°Cで遠心分離機を使用し、上清を捨てます。
- RNAペレットをエタノールで2回洗浄します(75%のジエチルピロカーボネート(DEPC)処理水)。7,500 x g で5分間遠心分離機を使用し、エタノールを捨てます。
- タオルペーパーでチューブを反転させて余分なエタノールを取り除き、チューブをヒュームフードの内側に開けてペレットを5〜10分間部分的に乾燥させます。
- RNAペレットを15μLのDEPC処理水で再懸濁します。
- 230 nm、260 nm、および 280 nm の吸光度を使用して、RNA の品質を確認するために、合計 RNA を定量化します。
- RNAの全品質を確認するために、1%アガロースゲルを1.2%(v/v)の2.5%次亜塩素酸ナトリウム溶液で30分間31分間前処理して実行します。
- 1~2 μgのRNAを使用してcDNA合成を行います。
- ピペットRNA、オリゴdT(50μM)1 μL、dNTP(10 mM)の1 μL、ヌクレアーゼフリー水で体積を12 μLにします。サーモサイクラーで65°Cで5分間インキュベートします。
- サーモサイクラーからサンプルを取り出して冷却し、反応混合物を調製します:4 μLの逆転写酵素バッファー、ジチオスライトール2 μL(DTT)、リボヌクレアーゼ阻害剤1μL。37°Cで2分間インキュベートします。
- 熱安定性の逆転写酵素を1 μL加えます。37°Cで50分間インキュベートし、70°Cで酵素を15分間不活性化します。
注:cDNAは-20°Cで数週間保存できます。推定イントロン保持イベントによるゲノム汚染に対する非逆転写酵素(NRT)制御を行う。
6. pMTE1A ミニジーン PCR
- 反応組成物(MgCl2の1.5 mM、0.3 mMのdNTPミックス、各プライマーの0.5 μM、ホットスタートTaqポリメラーゼの2.5 Uおよび150 ngのcDNA)を用いてPCRを行います。
94°C 2分、29サイクル:94°C1分、50°C2分、72°C2分、72°C10分。 - PCR産物の20~25μLを核酸染色を含む3%アガロースゲルに負荷し、約1時間100Vで実行します。
7. 画像処理および解析ソフトウェアを用いたゲルの解析32
- 実行後、任意のバンド飽和を避けるゲル(ゲルイメージング取得システムを使用して)を撮影し、画像処理ソフトウェアを使用してバンドを定量化します。
- 定量化については、~631bp、〜493bp、および〜156bpの各バンドをそれぞれ13S、12Sおよび9Sアイソフォームに対応することを検討する。
- ソフトウェアの [ファイル] メニューから、撮像収集システムから取得した画像ファイルを開きます。グレースケールに変換し、明るさとコントラストを調整し、必要に応じて外れ値のノイズを除去します。
- 長方形選択ツールで最初の車線の周囲に 長方形 を描き、解析|を使用して選択します 。ゲル|[最初のレーン] コマンドを選択するか、キーボードショートカットを押します。
- マウスを使用して、最初のレーンの長方形の中央をクリックして押さえた後、次のレーンにドラッグします。 分析|へ移動ゲル|[次のレーン] を選択するか、使用可能なショートカットを押します。残りのすべてのレーンにこの手順を繰り返します。
- すべてのレーンがハイライト表示され、番号が付いた後、[ 分析] |ゲル|各レーンの プロファイルプロットを描画するには、レーンをプロットします。
- 直線選択ツールを使用して、各バンドに対応する各ピークの底部に線を引き、バックグラウンドノイズを省きます。すべてのピークが閉じられた後、すべての車線から、ワンドツールを選択し、各ピークの内側をクリックします。ハイライト表示された各ピークに対して、表示される[結果] ウィンドウに測定値がポップアップ表示されます。
- 各サンプルの 3 バンドすべてから強度を合計し、合計に対する各アイソフォームの割合を計算します。
- 各アイソフォームのパーセンテージまたは未処理サンプルに対する割合の差をプロットします。
注: 3 つの E1A バリアントの合計が 100% に等しくなければなりません。
結果
E1Aミニジーンを用いた5'スプライス部位アッセイを行い、化学療法博覧会後の細胞におけるスプライシングプロファイルの変化を評価した。パクリタキセルまたはシスプラチン処理後のHEK293安定細胞におけるAS調節におけるNek4-アイソフォーム1の役割を評価した。
アデノウイルスE1A領域は、異なるスプライスドナーの使用のために、1つのRNA前駆体からの3つの主要なmRNAの産生を担う。彼らは共通の5'と3'の用語を共有しますが、切除イントロンの大きさは異なります。アデノウイルスE1A mRNAは、その沈積係数、13S、12Sおよび9Sに従って命名される。アデノウイルス感染の初期段階(約7時間)の間に、ウイルスDNA複製のために感染細胞を調製するために重要なタンパク質(13S-723 aaおよび12S-586 aa)および、それらの他の後期(約18h)で、小タンパク質(9S-249 aa)が20に産生される。E1A由来のミニジーンを含むプラスミドを用いて、トランスフェクション後の細胞における代替スプライシングへの影響は、産生される各アイソフォームからのmRNAの割合を評価する:13S:631bp、12S:493 bpおよび9S 156 bp(図1AおよびB)。
E1Aアイソフォーム変異体の基底式発現は、E1A発現の細胞株および時間に依存する。HEK293安定細胞株(HEK293-Flag)またはHEK293リコンビナーゼ含有部位(HEK293-FRT - 元細胞株)は、E1A発現の48時間後に同様のレベルの13Sおよび12Sアイソフォームを示すHeLa細胞(HeLa-PLKO)と比較して13Sのより高い発現を示すことを観察した(DCと1.
HEK293で観察される13S発現の高レベルは、E1A発現の短い時間(約30時間)の下でかなり減少している。30時間と48時間の13S:12S:9Sの割合(%)は、それぞれ60:33:7と80:15:5です(未提示データ)。このため、実験を開始する前に、基底細胞ミニジーンE1Aスプライシングプロファイルを特徴付ける事が重要です。
シスプラチンに曝露された細胞は、12S発現を支持する5'SSスプライシング選択におけるシフトを示した(未治療細胞と比較して約15%の増加)。この効果は、NEK4のアイソフォーム1と同様に、フラグ空のベクトルを安定的に発現させるHEK293で観察された。式のパーセンテージに大きな変化が見られると、パーセンテージを持つプロットが結果を明確に表します(図2)。
治療に応答する2つの条件(FlagとNek4過剰発現)を比較する場合、通常、データを表現する最良の方法は、基礎的な表現レベルが異なる可能性があり、パーセンテージが治療の実際の効果を反映しないため、グラフ上の差をプロットすることです。これは 図 3で確認できます。パクリタキセル処理後のASの変化は非常に離散的であったが、変化の方向はFlagおよびNek4発現細胞では反対であった。
治療後のわずかな変化にもかかわらず、結果は一貫して、パクリタキセル処理が13Sアイソフォームの減少をもたらし、Flag発現細胞における12Sおよび9Sの増加をもたらし、一方、一方、Nek4発現細胞では、逆効果が認められることを示す。

図1:ミニジーンE1Aスプライシングパターンは細胞株に依存する。)ミニジーン E1A スプライシングサイトの概略表現。矢印は、ミニ遺伝子E1Aアイソフォーム増幅のためのプライマーアニール領域を示す。B)ミニジーンE1Aの代替スプライシングから生成されるアイソフォーム。C)HEK293安定的に表現フラグ空のベクター(HEK293 -フラグ)、HELaはPLKOベクター(HeLa -PLKO)または、HEK293リコンビナーゼ含有部位(HEK293が安定に発現しているフラグまたはNek4.1から)pMTE1Asプラミドでトランスフェクトした。トランスフェクション合計RNAを分離し、E1Aアイソフォームをアガロースゲル(D)で分離した後48h。基底条件下でHEK293-Flag細胞とHeLa-PLKO細胞における13S、12Sおよび9Sアイソフォームの割合を比較したグラフ。3つの独立した実験からのデータ。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:ミニジーンE1Aスプライシングパターンにおけるシスプラチン処理の効果 HEK293はフラグ空ベクトル(Flag)またはNek4.1フラグタグを融合して安定に発現し、pMTE1Aプラスミドでトランスフェクトした。トランスフェクションテトラサイクリンをタンパク質発現誘導に添加してから6時間後。24時間〜48時間、30μMのシスプラチンを含む培地に対して細胞培養培地を交換した。24時間のインキュベーションの後、総RNAを抽出し、PCRの産物を3%アガロースゲルで分離した。 A)優勢なミニジーン E1A アイソフォームが描かれています。グラフ B-D は、3 つのバリアント (13S、12S、9S) の合計に対する各アイソフォームの割合を表します。 Eでは、各アイソフォームに対する表現の割合の差が車両(媒体)制御に対して提示される。グラフは、3つの独立した実験の平均とSEMとして提示されます。* p< 0.05, ** p<0.01 不対 t 検定で この図の大きなバージョンを表示するには、ここをクリックしてください。
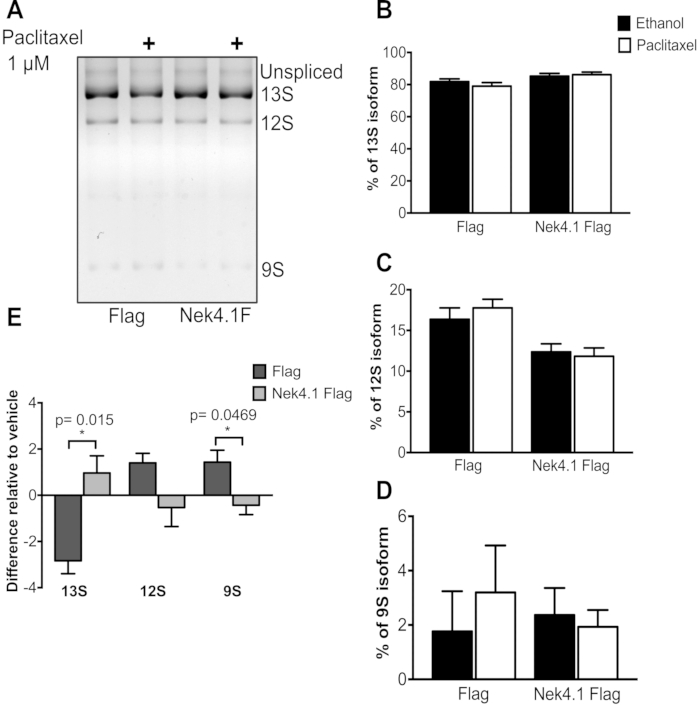
図3:ミニジーンE1Aスプライシングパターンにおけるパクリタキセル処理の効果 HEK293はフラグ空のベクター(Flag)またはNek4.1フラグが融合して安定に発現し、pMTE1Aプラスミドを導入した。トランスフェクションテトラサイクリンをタンパク質発現誘導に添加してから6時間後。24時間〜48時間、細胞培養培地を、1μMのパクリタキセルまたはエタノール(0.02%)を含む培地に置換し、車両制御として用いた。24時間のインキュベーションの後、総RNAを抽出し、PCRの産物を3%アガロースゲルで分離した。 A)優勢なアイソフォームが描かれています。グラフ B-D は、3 つのバリアント (13S、12S、9S) の合計に対する各アイソフォームの割合を表します。 Eでは、各アイソフォームに対する発現の割合の差が、車両(エタノール)制御に対して提示される。グラフは、3つの独立した実験の平均とSEMとして提示されます。* p< 0.05 ペアになっていない t 検定で。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ミニ遺伝子は、生体内のグローバル代替スプライシングの効果を決定するための重要なツールです。このアデノウイルスミニジーンE1Aは、細胞13,14におけるこれらの量を増加させることによってタンパク質の役割を評価するために何十年も正常に使用されてきた。ここでは、化学療法曝露後の代替スプライシングを評価するためのミニジーンE1Aの使用を提案する。Nek4アイソフォーム1を発現する安定した細胞株を用い、一時的なトランスフェクションによって生じる過剰発現のアーチファクトを回避した。Nek4のアイソフォーム1は、基底条件21におけるミニ遺伝子E1A代替スプライシングに効果を示さなかったが、多くのスプライシング関連インターアクターを有し、したがって、これらの細胞におけるE1A代替スプライシングにおける化学療法治療の特異的効果を評価することを可能にする。
感度が低いにもかかわらず、主に放射性アプローチと比較して、ここで説明する方法は簡単であり、特別な試薬や実験室の条件を必要としません。しかし、ミニジーンE1Aは5'SS選択のグローバルレポーターであることに注意することが重要ですが、3'SS選択は、このプロトコルで評価することができますが、特定のミニジーンレポーターは14、33、34を使用する必要があります。さらに、結果は細胞株の影響を受ける可能性があり、基底代替スプライシングプロファイルのために誤解を避けるために慎重に評価する必要があります。
通常、ミニ遺伝子E1Aスプライシングパターンの大きな違いは、スプライシング因子の発現を変化させる場合にのみ観察される。これらの因子の活性を調節するタンパク質の数が多いため、他の変化はあまり明白ではありません。このため、間接的な候補に対する研究を開始する際に、古典的なアプローチは、この候補タンパク質の増加量に基づいて好ましい。何らかの効果が観察されると、治療は、調節が特定の細胞刺激に特異的であるかどうかを探索するために行うことができる。
予備的な陽性結果の後、時間および薬物濃度の標準化を行い、実験を最適化することができる。
この単純なプロトコルは予備的なアッセイであり、対象となるタンパク質が代替スプライシングに効果を示すかどうかに答えることができる開始点であり、また、代替スプライシング調節のいくつかの効果が既に知られている場合、タンパク質が化学療法応答における代替スプライシングの役割を果たすより一貫した経路に研究を指示することができる。
開示事項
著者らは、競合する財政的利益はないと宣言している。
謝辞
我々は、フンダサン・デ・アンパロ・ア・ペスキサ・ド・エスタド・デ・サンパウロ(FAPESP、グラント・テマティコ2017/03489-1を通じて、JKとFLB 2018/05350-3へのフェローシップ)とコンセルホ・ナシオナル・デ・デセンボルメント・チエンティフィコ・エ・デセンボルメント・チエンティフィコ・エ・デセンボルメント・チエンティフィコ・エ・ココモ(この資金)に感謝します。私たちは、PMTE1AプラスミドとZerlerとE1Aクローニングでの彼らの仕事のためにpMTE1AプラスミドとZerlerと同僚を提供してくれたエイドリアン・クレイナー博士に感謝したいと思います。また、パトリシア・モリエル教授、ワンダ・ペレイラ・アルメイダ博士、マルセロ・ランチェロッティ教授、カリーナ・コゴ・コゴ・ミュラー教授の研究室スペースと機器の使用に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 100 pb DNA Ladder | Invitrogen | 15628-050 | |
| 6 wells plate | Sarstedt | 833920 | |
| Agarose | Sigma | A9539-250G | |
| Cisplatin | Sigma | P4394 | |
| DEPC water | ThermoFisher | AM9920 | |
| DMEM | ThermoFisher | 11965118 | |
| dNTP mix | ThermoFisher | 10297-018 | |
| Fetal Bovine Serum - FBS | ThermoFisher | 12657029 | |
| Fluorescent Microscope | Leica | DMIL LED FLUO | |
| Gel imaging acquisition system - ChemiDoc Gel Imagin System | Bio-Rad | ||
| GFP - pEGFPC3 | Clontech | ||
| HEK293 stable cells - HEK293 Flp-In | Generated from Flp-In™ T-REx™ 293 - Invitrogen and described in ref 21 | ||
| Hygromycin B | ThermoFisher | 10687010 | Used for Flp-In cells maintenemant |
| Image processing and analysis software - FIJI software | ref. 32 | ||
| Lipid- based transfection reagent - jetOPTIMUS Polyplus Reagent | Polyplus | 117-07 | |
| Oligo DT | ThermoFisher | 18418020 | |
| Paclitxel | Invitrogen | P3456 | |
| Plate Reader/ UV absorbance | Biotech | Epoch Biotek/ Take3 adapter | |
| pMTE1A plasmid | Provided by Dr. Adrian Krainer | ||
| pMTE1A F | Invitrogen | 5’ -ATTATCTGCCACGGAGGTGT-3 | |
| pMTE1A R | Invitrogen | 5’ -GGATAGCAGGCGCCATTTTA-3’ | |
| Refrigerated centrifuge | Eppendorf | F5810R | |
| Reverse Transcriptase - M-MLV | ThermoFisher | 28025013 | |
| Reverse transcriptase - Superscript IV | ThermoFisher | 18090050 | |
| Ribunuclease inhibitor RNAse OUT | ThermoFisher | 10777-019 | |
| RNA extraction phenol-chloroform based reagent - Trizol | ThermoFisher | 15596018 | |
| SybrSafe DNA gel stain | ThermoFisher | S33102 | |
| Taq Platinum | Thermo | 10966026 | |
| Tetracyclin | Sigma | T3383 | Used for Flag empty or Nek4- Flag expression induction |
| Thermocycler Bio-Rad | Bio-Rad | T100 | |
| Trypsin | Sigma | T4799 |
参考文献
- Ule, J., Blencowe, B. J. Alternative Splicing Regulatory Networks: Functions, Mechanisms, and Evolution. Molecular Cell. 76 (2), 329-345 (2019).
- Pan, Q., Shai, O., Lee, L. J., Frey, B. J., Blencowe, B. J. Deep surveying of alternative splicing complexity in the human transcriptome by high-throughput sequencing. Nature Genetics. 40 (12), 1413-1415 (2008).
- Nilsen, T. W., Graveley, B. R. Expansion of the eukaryotic proteome by alternative splicing. Nature. 463 (7280), 457-463 (2010).
- Stamm, S. Signals and their transduction pathways regulating alternative splicing: a new dimension of the human genome. Human Molecular Genetics. 11 (20), 2409-2416 (2002).
- Kornblihtt, A. R., et al. Alternative splicing: a pivotal step between eukaryotic transcription and translation. Nature Reviews Molecular Cell Biology. 14 (3), 153-165 (2013).
- Zhong, X. -. Y., Ding, J. -. H., Adams, J. A., Ghosh, G., Fu, X. -. D. Regulation of SR protein phosphorylation and alternative splicing by modulating kinetic interactions of SRPK1 with molecular chaperones. Genes & Development. 23 (4), 482-495 (2009).
- Misteli, T., Cáceres, J. F., Clement, J. Q., Krainer, A. R., Wilkinson, M. F., Spector, D. L. Serine Phosphorylation of SR Proteins Is Required for Their Recruitment to Sites of Transcription In Vivo. Journal of Cell Biology. 143 (2), 297-307 (1998).
- Kanopka, A., et al. Regulation of adenovirus alternative RNA splicing by dephosphorylation of SR proteins. Nature. 393 (6681), 185-187 (1998).
- Anufrieva, K. S., et al. Therapy-induced stress response is associated with downregulation of pre-mRNA splicing in cancer cells. Genome Medicine. 10 (1), 49 (2018).
- Shultz, J. C., et al. SRSF1 Regulates the Alternative Splicing of Caspase 9 Via A Novel Intronic Splicing Enhancer Affecting the Chemotherapeutic Sensitivity of Non-Small Cell Lung Cancer Cells. Molecular Cancer Research. 9 (7), 889-900 (2011).
- Gabriel, M., et al. Role of the splicing factor SRSF4 in cisplatin-induced modifications of pre-mRNA splicing and apoptosis. BMC Cancer. 15, (2015).
- Lee, S. C. -. W., Abdel-Wahab, O. Therapeutic targeting of splicing in cancer. Nature Medicine. 22 (9), 976-986 (2016).
- Cooper, T. A. Use of minigene systems to dissect alternative splicing elements. Methods. 37 (4), 331-340 (2005).
- Stoss, O., Stoilov, P., Hartmann, A. M., Nayler, O., Stamm, S. The in vivo minigene approach to analyze tissue-specific splicing. Brain Research Protocols. 4 (3), 383-394 (1999).
- Zerler, B., et al. Adenovirus E1A coding sequences that enable ras and pmt oncogenes to transform cultured primary cells. Molecular and Cellular Biology. 6 (3), 887-899 (1986).
- Gattoni, R., Schmitt, P., Stevenin, J. In vitro splicing of adenovirus E1A transcripts: characterization of novel reactions and of multiple branch points abnormally far from the 3' splice site. Nucleic Acids Research. 16 (6), 2389-2409 (1988).
- Stephens, C., Harlow, E. Differential splicing yields novel adenovirus 5 E1A mRNAs that encode 30 kd and 35 kd proteins. The EMBO journal. 6 (7), 2027-2035 (1987).
- Ulfendahl, P. J., et al. A novel adenovirus-2 E1A mRNA encoding a protein with transcription activation properties. The EMBO journal. 6 (7), 2037-2044 (1987).
- Berk, A. J., Sharp, P. A. Structure of the adenovirus 2 early mRNAs. Cell. 14 (3), 695-711 (1978).
- Svensson, C., Pettersson, U., Akusjärvi, G. Splicing of adenovirus 2 early region 1A mRNAs is non-sequential. Journal of Molecular Biology. 165 (3), 475-495 (1983).
- Basei, F. L., Meirelles, G. V., Righetto, G. L., dos Santos Migueleti, D. L., Smetana, J. H. C., Kobarg, J. New interaction partners for Nek4.1 and Nek4.2 isoforms: from the DNA damage response to RNA splicing. Proteome Science. 13 (1), 11 (2015).
- Zhou, Z., et al. The Akt-SRPK-SR Axis Constitutes a Major Pathway in Transducing EGF Signaling to Regulate Alternative Splicing in the Nucleus. Molecular Cell. 47 (3), 422-433 (2012).
- Caceres, J., Stamm, S., Helfman, D., Krainer, A. Regulation of alternative splicing in vivo by overexpression of antagonistic splicing factors. Science. 265 (5179), 1706-1709 (1994).
- Zhong, X. -. Y., Ding, J. -. H., Adams, J. A., Ghosh, G., Fu, X. -. D. Regulation of SR protein phosphorylation and alternative splicing by modulating kinetic interactions of SRPK1 with molecular chaperones. Genes & Development. 23 (4), 482-495 (2009).
- Naro, C., et al. The centrosomal kinase NEK2 is a novel splicing factor kinase involved in cell survival. Nucleic Acids Research. 42 (5), 3218-3227 (2014).
- Lu, C. -. C., Chen, T. -. H., Wu, J. -. R., Chen, H. -. H., Yu, H. -. Y., Tarn, W. -. Y. Phylogenetic and Molecular Characterization of the Splicing Factor RBM4. PLoS ONE. 8 (3), 59092 (2013).
- Jarnæss, E., et al. Splicing Factor Arginine/Serine-rich 17A (SFRS17A) Is an A-kinase Anchoring Protein That Targets Protein Kinase A to Splicing Factor Compartments. Journal of Biological Chemistry. 284 (50), 35154-35164 (2009).
- Bressan, G. C., et al. Functional association of human Ki-1/57 with pre-mRNA splicing events. FEBS Journal. 276 (14), 3770-3783 (2009).
- Vivarelli, S., et al. Paraquat Modulates Alternative Pre-mRNA Splicing by Modifying the Intracellular Distribution of SRPK2. PLoS ONE. 8 (4), 61980 (2013).
- Russell, W. C., Graham, F. L., Smiley, J., Nairn, R. Characteristics of a Human Cell Line Transformed by DNA from Human Adenovirus Type 5. Journal of General Virology. 36 (1), 59-72 (1977).
- Aranda, P. S., LaJoie, D. M., Jorcyk, C. L. Bleach gel: A simple agarose gel for analyzing RNA quality. Electrophoresis. 33 (2), 366-369 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Bai, Y. Control of 3' splice site choice in vivo by ASF/SF2 and hnRNP A1. Nucleic Acids Research. 27 (4), 1126-1134 (1999).
- Cote, G. J., Nguyen, N., Lips, C. J. M., Berget, S. M., Gagel, R. F. Validation of an in vitro RNA processing system for CT/CGRP precursor mRNA. Nucleic Acids Research. 19 (13), 3601-3606 (1991).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved