Method Article
Использование инструмента E1A Minigene для изучения изменений сплайсинга мРНК
В этой статье
Резюме
Этот протокол представляет собой быстрый и полезный инструмент для оценки роли белка с неохарактерной функцией в альтернативной регуляции сплайсинга после химиотерапевтического лечения.
Аннотация
Обработка мРНК включает в себя несколько одновременных этапов подготовки мРНК к трансляции, таких как 5'capping, поли-A сложение и сплайсинг. Помимо конститутивного сплайсинга, альтернативное сплайсинг мРНК позволяет экспрессифицирование многофункциональных белков из одного гена. Поскольку исследования интерактома, как правило, являются первым анализом новых или неизвестных белков, ассоциация белка приманки с факторами сплайсинга является признаком того, что он может участвовать в процессе сплайсинга мРНК, но определение того, в каком контексте или какие гены регулируются, является эмпирическим процессом. Хорошей отправной точкой для оценки этой функции является использование классического инструмента минигена. Здесь мы представляем использование минигена аденовирусного E1A для оценки альтернативных изменений сплайсинга после различных клеточных стрессовых стимулов. Мы оценили сращивание минигена E1A в HEK293, стабильно сверхэкспрессирующего белок Nek4 после различных стрессовых процедур. Протокол включает в себя трансфекцию минигена E1A, обработку клеток, экстракцию РНК и синтез кДНК, за которыми следует ПЦР и гель-анализ и количественная оценка сращиваемых вариантов E1A. Использование этого простого и хорошо заявидского метода в сочетании со специфическими методами лечения является надежной отправной точкой для того, чтобы пролить свет на клеточные процессы или на то, какие гены могут регулироваться сращиванием мРНК.
Введение
Сплайсинг является одним из наиболее важных этапов в обработке эукариотической мРНК, которая происходит одновременно с укупорки 5'мРНК и полиаденилированием 3'мРНК, включая удаление интрона с последующим переходом экзона. Для сплайсинга необходимо распознавание сайтов сплайсинга (SS) сплайсеосомой, рибонуклеопротеинового комплекса, содержащего мелкие рибонуклеопротеины (snRNP U1, U2, U4 и U6), малые РНК (snRNAs) и несколько регуляторных белков1.
Помимо удаления интронов (конститутивного сплайсинга), у эукариот интроны могут быть сохранены, а экзоны могут быть исключены, конфигурируя процесс, называемый альтернативным сплайсингом мРНК (AS). Альтернативное сплайсинг премрнК расширяет кодирующую способность эукариотических геномов, позволяя продуцировать большое и разнообразное количество белков из относительно небольшого числа генов. Подсчитано, что 95-100% человеческих мРНК, содержащих более одного экзона, могут подвергаться альтернативному сращиваниям2,3. Это имеет основополагающее значение для биологических процессов, таких как развитие нейронов, активация апоптоза и клеточная реакция на стресс4,предоставляя организму альтернативы для регулирования функционирования клеток с использованием одного и того же репертуара генов.
Механизм, необходимый для альтернативного сращивания, используется для конститутивного сращивания, а использование SS является основным определяющим фактором для альтернативного сращивания. Конститутивное сплайсинг связано с использованием сильных сайтов сплайсинга, которые обычно больше похожи на консенсусные мотивы для распознавания сплайсеосом5.
Альтернативные экзоны обычно распознаются менее эффективно, чем конститутивные экзоны, когда его цис-регуляторныеэлементы, последовательности в 5'SS и 3'SS, фланкирующие эти экзоны, показывают более низкую связывающую способность со сплайсеосомой. мРНК также содержит области, называемые энхансерами или глушителями, расположенными в экзонах (экзонные усилители сплайсинга (EES) и экзонные глушители сплайсинга (ESS)) и интронах (интронные усилители сплайсинга (ISEs) и интронные глушители сплайсинга (ISS)), которые усиливают или подавляют использование экзона, соответственно5. Эти последовательности распознаются трансрегулятивными элементами, или факторами сплайсинга (SF). SF представлены в основном двумя семействами белков: богатыми серином/аргинином факторами сплайсинга (SRSF), которые связываются с EES, и семейством гетерогенных ядерных рибонуклеопротеинов (hnRNP), которые связываются с последовательностями ЭСС5.
Альтернативное сплайсинг может модулироваться фосфорилированием/дефосфорилированием трансфакторов, модифицирующих взаимодействия партнеров и клеточной локализацией факторов сплайсинга6,7,8. Выявление новых регуляторов факторов сплайсинга может предоставить новые инструменты для регулирования сплайсинга и, следовательно, некоторых методов лечения рака.
Anufrieva et al.9,в профиле экспрессии гена микрочипа мРНК, наблюдали последовательные изменения уровней сплайсеосомальных компонентов в 101 клеточной линии и после различных стрессовых состояний (препараты на основе платины, гамма-облучение, ингибиторы топоизомеразы, ингибиторы тирозинкиназы и таксаны). Связь между паттерном сплайсинга и эффективностью химиотерапии уже была продемонстрирована в клетках рака легких, которые устойчивы к химиотерапии, показывая изменения в вариантах каспазы-910. Клетки HEK293, обработанные химиотерапевтической панелью, показывают изменения в сплайсинго с увеличением проапоптотических вариантов. Gabriel et al.11 наблюдали изменения по меньшей мере в 700 случаях сплайсинга после лечения цисплатином в различных клеточных линиях, указывая, что сплайсинговые пути подвержены влиянию цисплатина. Модуляторы сплайсинга уже продемонстрировали противоопухоляющую активность, показав, что сплайсинг важен для развития опухоли и, главным образом, ответа химиотерапии12. Следовательно, характеристика новых белков, которые регулируют сплайсинг после клеточных стрессоров, таких как химиотерапия, очень важна для открытия новых стратегий лечения.
Подсказки альтернативной регуляции сплайсинга из интерактомных исследований, особенно важные для характеристики функций новых или нехарактеризованных белков, могут потребовать более общего и простого подхода для проверки реальной роли белка в АС. Минигены являются важными инструментами для анализа общей роли белка, влияющего на регуляцию сплайсинга. Они содержат сегменты из интересующего гена, содержащие альтернативно сращенные и фланкированные геномныеобласти 13. Использование минигенного инструмента позволяет анализировать сращивание in vivo с рядом преимуществ, таких как длина минигена, которая незначительна и, следовательно, не является ограничением реакции усиления; один и тот же миниген может быть оценен в разных клеточных линиях; все клеточные компоненты, главным образом их регулирующая постпрокродная модификация (фосфорилирование и изменения в клеточных компартментах) присутствуют и могут быть рассмотрены13,14. Более того, изменения в альтернативной схеме сплайсинга могут наблюдаться после клеточного стресса и, используя минигенную систему, позволяют идентифицировать путь, модулируемый различными раздражителями.
Существует несколько уже описанных минигенных систем, которые специфичны для различных видов событий сплайсинга13,14,однако, в качестве предварительного анализа, миниген E1A15 является очень хорошо зарекомендовавшей себя альтернативной сплайсинговой репортерной системой для изучения отбора 5'SS in vivo. Только из одного гена, E1A, пять мРНК продуцируются альтернативным сплайсингом на основе отбора трех различных 5' сайтов сращивания и одного крупного или одного минорного 3'-сращиваниясайта 16,17,18. Экспрессия вариантов Е1А изменяется в зависимости от периода аденовирусной инфекции19,20.
Ранее мы показали, что обе изоформы Nek4 взаимодействуют с факторами сплайсинга, такими как SRSF1 и hnRNPA1, и хотя изоформа 2 изменяет миниген альтернативного сплайсинга E1A, изоформа 1 не влияет на этот21. Поскольку изоформа 1 является наиболее распространенной изоформой и изменяет устойчивость к химиотерапии и реакцию на повреждение ДНК, мы оцениваем, может ли она изменить альтернативное сращивание минигена E1A в стрессовом состоянии.
Анализ минигена является простым, недорогим и быстрым методом, поскольку он требует только экстракции РНК, синтеза кДНК, амплификации и анализа агарозного геля и может быть полезным инструментом для оценки, поскольку возможно влияние на альтернативное сплайсинг белка, представляющим интерес, до влияния различных методов лечения на клеточную альтернативную схему сплайсинга.
протокол
1. Покрывающие ячейки
ПРИМЕЧАНИЕ: В этом описанном протоколе были использованы стабильные клеточные линии HEK293, ранее сгенерированные для стабильной индуцируемой экспрессии Nek421,однако этот же протокол подходит для многих других клеточных линий, таких как HEK29322,HeLa23, 24,25,26,U-2 OS27,COS728,SH-SY5Y29. Картина экспрессии минигенных изоформ Е1А в базальных условиях варьируется между этими клетками и должна быть охарактеризована для каждого состояния. Этот протокол не ограничивается стабильными клеточными линиями. Наиболее распространенным подходом в оценке белка-кандидата является транзиторная ко-трансфекция увеличения его количества фиксированным количеством минигена. Этот же протокол подходит для нокаутных ячеек.
- Пластинчатые ячейки, учитывающие управление транспортным средством, нетрансфексированные и GFP.
- Культивирование клеток HEK293 со стабильной экспрессией гена, представляющим интерес, в модифицированной орлиной среде Dulbecco (DMEM), дополненной 10% фетальной бытовой сыворотки (FBS), 4,5 г / л глюкозы, 4 мМ L-глутамина и поддерживать 100 мкг / мл гигромицина B, на обработанных культурой тканей пластинах при 37 ° C в 5% CO2 и увлажненной атмосфере.
- Расщепляйте клетки с использованием 0,25% трипсина-ЭДТА. Пластина 3 х 105 клеток в 6-ю скважинных пластинах и инкубировать их в течение 24 ч при 37 °C в 5% CO2.
ПРИМЕЧАНИЕ: Для трансфекции клетки должны быть на 70-80% конфюэлектом, чтобы уменьшить гибель клеток после трансфекции.
2. Трансфекция клеток
ПРИМЕЧАНИЕ: Здесь использовалось 1-2 мкг минигенной плазмиды pMTE1A, однако количество ДНК, а также время экспрессии должны быть сведены к минимуму, чтобы избежать токсичности. Например, высокая токсичность наблюдалась в клетках HeLa после 30 ч трансфекции с 1 мкг днк pMTE1A. Для описанной здесь трансфекции использовался трансфекционный реагент на основе липидов.
- Проверяют слияние клеток через 24 ч после покрытия и трансфектирования heK293 стабильными ячейками только при 70-80% слиянии.
- Удалите питательную среду клеток аккуратно с помощью пипетки, вместо использования вакуумной насосной системы. Затем осторожно добавьте 2 мл полной среды DMEM без антибиотиков и положите пластину обратно в инкубатор.
- Подготовьте пробирку с трансфекционным буфером (200 мкл/скважина), добавьте 2 мкг ДНК pMTE1A, вихрь и затем добавьте 2 мкл трансфекционного реагента. Снова вихрь и инкубировать в течение 10 мин при комнатной температуре.
- Снимите пластины с инкубатора и осторожно добавьте трансфекционную смесь по каплям.
- К стабильным клеткам HEK293 добавляют тетрациклин (0,5 мкг/мл) для индукции экспрессии Nek4 через 6 ч после трансфекции. Изменение среды не требуется.
ПРИМЕЧАНИЕ: Объемы/суммы, описанные в этом разделе, предназначены для одной скважины. Приготовьте смесь для всех использованных в эксперименте скважин в одной трубе. - Подготовьте одну скважину к трансфекции с помощью EGFP или другого флуорофора, экспрессифициивающего плазмиду, чтобы оценить эффективность трансфекции. Лучшие результаты можно наблюдать при эффективности трансфекции не менее 40%, но ранее наблюдались хорошие показатели с более низкой эффективностью трансфекции.
- При использовании ко-трансфекции (интерес белка и минигена) сохраняют хорошо с неперетерфетными клетками, чтобы избежать получения результатов из эндогенной мРНК. В случае E1A клетки HEK293 уже экспрессировывают ген E1A30.
3. Приготовление препаратов
ПРИМЕЧАНИЕ: Время и концентрация лечения были выбраны на основе результатов литературы, которые указывают на изменения в альтернативном сплайсинге для некоторых генов.
- Выполните кривую доза-реакция перед началом анализа, чтобы определить минимальную концентрацию для альтернативной индукции сплайсинга без влияния на жизнеспособность клеток.
- Готовят паклитаксел в концентрации 5 мМ в этаноле. Конечная концентрация составляет 1 мкМ. Держать при -20 °C. Используйте 0,02% этанола в качестве контроля транспортного средства.
- Готовят раствор цисплатина, разбавляя в 0,9% NaCl около 0,5 мг/мл (1,66 мМ). Защищают от света, вихря и инкубируют в термальной ванне, 37 °C в течение 30 мин. Конечная концентрация составляет 30 мкМ. Готовят в свежем виде или хранят при 2-10 °C до одного месяца.
ПРИМЕЧАНИЕ: Все препараты должны быть защищены от света.
4. Обработка и сбор клеток
ПРИМЕЧАНИЕ: Стабильные клетки HEK293 собирали через 48 ч после трансфекции и для этого обрабатывали через 24 ч после трансфекции, поскольку самый высокий уровень экспрессии Nek4 достигается в течение 48 ч. Однако в это время наблюдались высокие уровни экспрессии изоформ 13S (до 90%). Чтобы уменьшить долю изоформы 13S, попробуйте обработать и собрать клетки через 30 ч после трансфекции максимум.
- Используйте без РНК/ДНКазы наконечники и трубки. Выполните полную экстракцию РНК фенол-хлороформным реагентом по рекомендации производителя.
- Через 24 ч после трансфекции проверьте морфологию клеток и эффективность трансфекции с помощью флуоресцентного микроскопа.
- Удалите клеточную культуральную среду, предпочтительно используя пипетку вместо вакуумной насосной системы. Затем добавляют клеточную культуральную среду с химиотерапевтическими препаратами в ранее описанной конечной концентрации.
- Инкубировать при 37 °C, 5% CO2 в течение 18 - 24 ч.
- Собирают РНК путем отбрасывания клеточной культурной среды в контейнер и добавления 0,5 - 1 мл реагента экстракции РНК непосредственно в колодец. Если скважины очень сливаются, используйте 1 мл реагента для экстракции РНК для улучшения качества РНК.
- Гомогенизируйте с помощью пипетки и переложите в центрифужную трубку 1,5 мл. На этом этапе протокол может быть приостановлен путем хранения образцов при -80 °C или немедленно приступить к извлечению РНК.
ПРЕДУПРЕЖДЕНИЕ: Реагент для экстракции РНК на основе фенола токсичен, и все процедуры должны выполняться в химическом вытяжном капюшоне, а остатки утилизироваться должным образом.
5. Экстракция РНК и синтез кДНК
- В вытяжке разморозить образцы и инкубировать в течение 5 мин при комнатной температуре. Добавить 0,1 -0,2 мл хлороформа и энергично перемешивать.
- Инкубировать в течение 3 мин при комнатной температуре.
- Центрифуга в течение 15 мин при 12 000 х г и 4 °C.
- Соберите верхнюю кувужную фазу и переложите на новую центрифужную трубку 1,5 мл. Соберите около 60% от общего объема; однако не собирайте ДНК или органическую (нижнюю) фазу.
- Добавляют 0,25 - 0,5 мл изопропанола и перемешивать путем инверсии 4 раза. Инкубировать в течение 10 мин при комнатной температуре.
- Центрифуга при 12 000 х г в течение 10 мин, при 4 °C и выбросьте супернатант.
- Дважды промыть гранулу РНК этанолом (75% в воде, обработанной диэтилпирокарбонатом (DEPC)). Центрифугу при 7 500 х г в течение 5 мин и выбросьте этанол.
- Удалите избыток этанола, переверните трубку на полотенцесушице, а затем оставьте трубку открытой внутри вытяжного капюшона, чтобы частично высушить гранулу в течение 5 - 10 минут.
- Повторное суспендирование гранулы РНК в 15 мкл воды, обработанной DEPC.
- Количественно оцените общую РНК, используя абсорбционные показатели при 230 нм, 260 нм и 280 нм для проверки качества РНК.
- Чтобы проверить общее качество РНК, запустите 1% агарозный гель, предварительно обработанный 1,2% (v/v) 2,5% раствора гипохлорита натрия в течение 30 мин31.
- Выполняют синтез кДНК с использованием 1-2 мкг общей РНК.
- Пипетная РНК, 1 мкл олиго-дТ (50 мкМ), 1 мкл дНТП (10 мМ) и составляют объем до 12 мкл с безнуклеазной водой. Инкубировать в термоциклере в течение 5 мин при 65 °C.
- Извлеките образцы из термоциклера для охлаждения и приготовьте реакционную смесь: 4 мкл буфера обратной транскриптазы, 2 мкл дитиотрейтола (ДТТ) и 1 мкл ингибитора рибонуклеазы. Инкубировать при 37 °C в течение 2 мин.
- Добавьте 1 мкл термостабильную обратную транскриптазу. Инкубировать при 37 °C в течение 50 мин и инактивировать фермент при 70 °C в течение 15 мин.
ПРИМЕЧАНИЕ: КДНК может храниться при -20 °C в течение нескольких недель. Выполните контроль необязательной транскриптазы (НЗТ) геномного загрязнения от предполагаемой дискриминации событий удержания интронов.
6. pMTE1A минигенная ПЦР
- Выполняют ПЦР с реакционной композицией (1,5 мМMgCl2,0,3 мМ смеси dNTP, 0,5 мкМ каждого праймера, 2,5 ЕД горячего запуска Taq Polymerase и 150 нг кДНК) при следующих условиях:
94 °C в течение 2 мин, 29 циклов: 94 °C в течение 1 мин, 50 °C в течение 2 мин, 72 °C в течение 2 мин, 72 °C в течение 10 мин. - Загрузить 20-25 мкл продукта ПЦР в 3% агарозный гель, содержащий окрашивание нуклеиновой кислоты, и запустить при 100 В в течение приблизительно 1 ч.
7. Анализ геля с помощью программного обеспечения для обработки и анализа изображений32
- После запуска сфотографируйте гель (с помощью системы сбора гелевых изображений), избегая насыщения полосы, и количественно оцените полосы с помощью программного обеспечения для обработки изображений.
- Для количественной оценки рассмотрим диапазоны при ~631 bp, ~493 bp и ~156 bp, чтобы соответствовать изоформам 13S, 12S и 9S соответственно.
- В меню Файл программного обеспечения откройте файл изображения, полученный из системы сбора изображений. Преобразуйте в оттенки серого, отрегулируйте яркость и контрастность и при необходимости удалите шумы, выделив.
- Нарисуйте прямоугольник вокруг первой полосы с помощью инструмента «Выделение прямоугольника» и выделите его с помощью | Гели | Выберите команду «Первая полоса» или нажав на нее сочетание клавиш.
- Используйте мышь, чтобы щелкнуть и удерживать в середине прямоугольника на первой полосе и перетащить его на следующую полосу. Перейти к анализу | Гели | Выберите Следующая полосаили нажмите доступный ярлык. Повторите этот шаг на всех оставшихся полосах.
- После того, как все полосы будут выделены и пронумерованы, перейдите в | Гели | Участок полос для рисования профильного участка каждой полосы.
- С помощью инструмента «Прямолинейный выбор» нарисуйте линию по основанию каждого пика, соответствующую каждой полосе, не пропуская фоновый шум. После того, как все пики, с каждой полосы, были закрыты, выберите инструмент «Палочка» и нажмите внутри каждого пика. Для каждого выделенного пика измерения должны появляться в появившемся окне Результаты.
- Суммируйте интенсивность из всех 3 полос для каждого образца и рассчитайте процент для каждой изоформы относительно общего числа.
- График процентов каждой изоформы или различий в процентах относительно необработанных образцов.
ПРИМЕЧАНИЕ: Убедитесь, что сумма трех вариантов E1A должна быть равна 100%.
Результаты
Был проведен 5-й анализ участков сращивания с использованием минигена E1A для оценки изменений профиля сплайсинга в клетках после экспозиции химиотерапии. Оценивалась роль Nek4 -изоформы 1 в регуляции АС в стабильных клетках HEK293 после лечения паклитакселом или цисплатином.
Аденовирусная область E1A отвечает за выработку трех основных мРНК из одного предшественника РНК из-за использования различных доноров сращивания. Они имеют общие 5' и 3' термины, но отличаются размером их исеченных интронов. Аденовирусные мРНК E1A названы в соответствии с их коэффициентами осаждения, 13S, 12S и 9S. Во время ранней фазы аденовирусной инфекции (около 7 ч) продуцируются белки, важные для подготовки инфицированной клетки к репликации вирусной ДНК (13S - 723 аа и 12S - 586 аа), а в поздней фазе (около 18 ч) помимо них, небольшой белок (9S -249 аа) продуцируется20. Используя плазмиду, содержащую миниген из E1A, эффект на альтернативное сплайсинг может наблюдаться в клетках после трансфекции, оценивая долю мРНК из каждой полученной изоформы: 13S: 631 bp, 12S: 493 bp и 9S 156 bp(фиг.1A и B).
Базальная экспрессия вариантов изоформ Е1А зависит от клеточной линии и времени экспрессии Е1А. Было замечено, что HEK293-стабильная клеточная линия (HEK293-Flag) или HEK293 рекомбиназа, содержащая сайт (HEK293-FRT - исходная клеточная линия), показывает более высокую экспрессию 13S по сравнению с клетками HeLa (HeLa-PLKO), которые показывают аналогичные уровни изоформ 13S и 12S после 48 ч экспрессии E1A (рис. 1C и D).
Высокий уровень экспрессии 13S, наблюдаемый в стабильных клетках HEK293, значительно снижается при более коротком времени экспрессии E1A (около 30 ч). Пропорция (%) 13S:12S:9S через 30 ч и 48 ч составляет 60:33:7 и 80:15:5 соответственно (непредставленные данные). По этой причине важно охарактеризовать профиль сплайсинга базально-клеточного минигена Е1А перед началом экспериментов.
Клетки, подвергшиеся воздействию цисплатина, показали сдвиг в выборе сплайсинга 5'SS в пользу экспрессии 12S (увеличение примерно на 15% по сравнению с необработанными клетками). Этот эффект наблюдался в HEK293 стабильно выражающей пустой вектор флага, а также изоформе 1 Nek4. Когда наблюдаются значительные изменения в проценте выражения, график с процентами четко представляет результаты(рисунок 2).
При сравнении двух состояний (сверхэкспрессии Flag и Nek4), реагирующих на лечение, обычно лучшим способом представления данных является построение различий на графике, потому что базальный уровень экспрессии может быть разным, и проценты не будут отражать реальный эффект лечения. Это можно наблюдать на рисунке 3. Изменения в АС после лечения паклитакселом были очень дискретными, но направления изменений были противоположны в клетках, экспрессирующих Флаг и Nek4.
Несмотря на небольшие изменения после лечения, результаты были последовательными, что указывает на то, что лечение паклитакселом приводит к снижению изоформы 13S с увеличением 12S и 9S в клетках, экспрессирующих Флаг, в то время как, с другой стороны, в клетках, экспрессирующих Nek4, наблюдается противоположный эффект.

Рисунок 1:Схема сращивания Minigene E1A зависит от клеточной линии. A) Схематическое изображение сайтов сращивания минигенов E1A. Стрелки указывают область отжига грунтовки для усиления изоформ минигена E1A. B)Изоформы, полученные в результате альтернативного сращивания минигена E1A. C)HEK293 стабильно экспрессирующий пустой вектор флага (HEK293 -Flag), heLa трансфектированный вектором PLKO (HeLa - PLKO) или HEK293 рекомбиназы-содержащие сайты (из чего были сгенерированы СТАБИЛЬНО экспрессируемые HEK293 Flag или Nek4.1 - HEK293-FRT) были трансфектированы плазмидой pMTE1A. Через 48 ч после трансфекции общую РНК выделили и разделили изоформы E1A в агарозном геле(D). График сравнения процентной доли изоформ 13S, 12S и 9S в клетках HEK293-Flag и HeLa-PLKO в базальных условиях. Данные трех независимых экспериментов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2:Эффект лечения цисплатином в минигенной схеме сплайсинга E1A. HEK293 стабильно экспрессируя пустой вектор флага (Flag) или nek4.1 Flag tag слитый, были трансфицированы плазмидой pMTE1A. Через шесть часов после трансфекции тетрациклин добавляли к индукции экспрессии белков. Через 24 ч до 48 ч клеточную культурную среду заменяли на среду, содержащую 30 мкМ цисплатина. После 24 ч инкубации экстрагировали общую РНК и отделяли продукты ПЦР на 3% агарозный гель. A) Изображены преобладающие минигенные изоформы E1A. Графики B-D представляют % каждой изоформы относительно суммы трех вариантов (13S, 12S и 9S). В Еразница в процентной доражаемой для каждой изоформы представлена относительно контроля транспортного средства (среды). Графики представлены как среднее и SEM трех независимых экспериментов. * p< 0,05, ** p<0,01 в непарном t-тесте. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
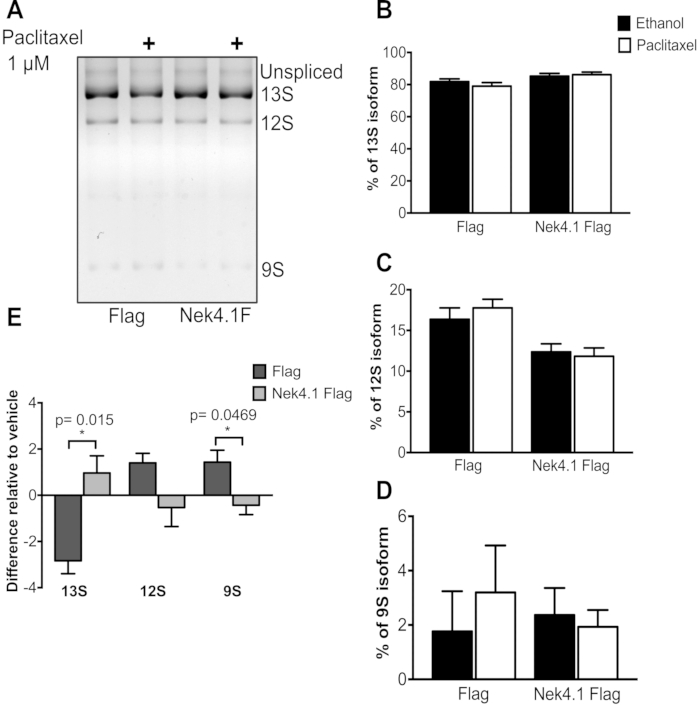
Рисунок 3:Эффект лечения Паклитакселом в минигенной схеме сплайсинга E1A. HEK293 стабильно экспрессируя пустой вектор флага (Flag) или Nek4.1 Flag слитый, были трансфектированы плазмидой pMTE1A. Через шесть часов после трансфекции тетрациклин добавляли к индукции экспрессии белков. Через 24 ч до 48 ч клеточную культурную среду заменяли средой, содержащей 1 мкМ паклитаксела или этанола (0,02%), используемого в качестве контроля транспортного средства. После 24 ч инкубации экстрагировали общую РНК и отделяли продукты ПЦР на 3% агарозный гель. A) Изображены преобладающие изоформы. Графики B-D представляют % каждой изоформы относительно суммы трех вариантов (13S, 12S и 9S). В Епредставлена разница в процентной доле экспрессии каждой изоформы относительно контроля транспортного средства (этанола). Графики представлены как среднее и SEM трех независимых экспериментов. * p< 0,05 в непарном t-тесте. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Минигены являются важными инструментами для определения эффектов в глобальном альтернативном сплайсинге in vivo. Аденовирусный миниген E1A успешно используется в течение десятилетий для оценки роли белков путем увеличения их количества в клетке13,14. Здесь мы предлагаем использование минигена E1A для оценки альтернативного сплайсинга после химиотерапевтического воздействия. Использовали стабильную клеточную линию, экспрессирующую изоформу Nek4 1, избегая артефактов сверхэкспрессии, вызванных переходной трансфекцией. Изоформа 1 Nek4 не показала эффекта в минигене E1A альтернативного сплайсинга в базальных условиях21,но имеет много связанных со сплайсингом интеракторов, что позволяет оценить специфический эффект химиотерапевтического лечения при альтернативном сплайсинге E1A в этих клетках.
Несмотря на свою низкую чувствительность, в основном по сравнению с радиоактивными подходами, описанный здесь метод прост и не требует специальных реагентов или лабораторных условий. Тем не менее, важно отметить, что миниген E1A является глобальным репортером выбора 5 SS, хотя выбор 3 SS может быть оценен с помощью этого протокола, конкретный репортер минигена должен использоваться14,33,34. Кроме того, результаты могут зависеть от клеточной линии и должны быть тщательно оценены, чтобы избежать неправильной интерпретации из-за базального альтернативного профиля сплайсинга.
Обычно большие различия в структуре сплайсинга минигена Е1А наблюдаются только при изменении экспрессии факторов сплайсинга. Другие изменения менее очевидны из-за большого количества белков, модулирующих активность этих факторов. По этой причине при начале исследований для косвенного кандидата следует отдавать предпочтение классическому подходу, основанному на увеличении количества этого белка-кандидата. Когда наблюдается некоторый эффект, лечение может быть выполнено, чтобы изучить, может ли регуляция быть специфичной для конкретного клеточного стимула.
После предварительного положительного результата может быть выполнена стандартизация времени и концентрации препарата для оптимизации эксперимента.
Этот простой протокол является предварительным анализом, отправной точкой, которая может ответить, показывает ли интересующий белок эффект в альтернативном сплайсинге, а также, когда некоторый эффект в альтернативной регуляции сплайсинга уже известен, может направить исследования к более последовательному пути, где белок играет роль, регулирующую альтернативное сплайсинг в ответе химиотерапии.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Мы благодарим Fundação de Amparo a Pesquisa do Estado de São Paulo (FAPESP, через грант Temático 2017/03489-1 для JK и стипендию FLB 2018/05350-3) и Conselho Nacional de Desenvolvimento Cientifico e Tecnológico (CNPq) за финансирование этого исследования. Мы хотели бы поблагодарить д-ра Адриана Крайнера за предоставление плазмиды pMTE1A и Церлера и его коллег за их работу по клонированию E1A. Мы также благодарим профессора д-ра Патрисию Мориэль, профессора д-ра Ванду Перейру Алмейду, профессора д-ра Марсело Ланчелотти и профессора д-ра Карину Кого Кого Мюллер за то, что они позволили нам использовать их лабораторные помещения и оборудование.
Материалы
| Name | Company | Catalog Number | Comments |
| 100 pb DNA Ladder | Invitrogen | 15628-050 | |
| 6 wells plate | Sarstedt | 833920 | |
| Agarose | Sigma | A9539-250G | |
| Cisplatin | Sigma | P4394 | |
| DEPC water | ThermoFisher | AM9920 | |
| DMEM | ThermoFisher | 11965118 | |
| dNTP mix | ThermoFisher | 10297-018 | |
| Fetal Bovine Serum - FBS | ThermoFisher | 12657029 | |
| Fluorescent Microscope | Leica | DMIL LED FLUO | |
| Gel imaging acquisition system - ChemiDoc Gel Imagin System | Bio-Rad | ||
| GFP - pEGFPC3 | Clontech | ||
| HEK293 stable cells - HEK293 Flp-In | Generated from Flp-In™ T-REx™ 293 - Invitrogen and described in ref 21 | ||
| Hygromycin B | ThermoFisher | 10687010 | Used for Flp-In cells maintenemant |
| Image processing and analysis software - FIJI software | ref. 32 | ||
| Lipid- based transfection reagent - jetOPTIMUS Polyplus Reagent | Polyplus | 117-07 | |
| Oligo DT | ThermoFisher | 18418020 | |
| Paclitxel | Invitrogen | P3456 | |
| Plate Reader/ UV absorbance | Biotech | Epoch Biotek/ Take3 adapter | |
| pMTE1A plasmid | Provided by Dr. Adrian Krainer | ||
| pMTE1A F | Invitrogen | 5’ -ATTATCTGCCACGGAGGTGT-3 | |
| pMTE1A R | Invitrogen | 5’ -GGATAGCAGGCGCCATTTTA-3’ | |
| Refrigerated centrifuge | Eppendorf | F5810R | |
| Reverse Transcriptase - M-MLV | ThermoFisher | 28025013 | |
| Reverse transcriptase - Superscript IV | ThermoFisher | 18090050 | |
| Ribunuclease inhibitor RNAse OUT | ThermoFisher | 10777-019 | |
| RNA extraction phenol-chloroform based reagent - Trizol | ThermoFisher | 15596018 | |
| SybrSafe DNA gel stain | ThermoFisher | S33102 | |
| Taq Platinum | Thermo | 10966026 | |
| Tetracyclin | Sigma | T3383 | Used for Flag empty or Nek4- Flag expression induction |
| Thermocycler Bio-Rad | Bio-Rad | T100 | |
| Trypsin | Sigma | T4799 |
Ссылки
- Ule, J., Blencowe, B. J. Alternative Splicing Regulatory Networks: Functions, Mechanisms, and Evolution. Molecular Cell. 76 (2), 329-345 (2019).
- Pan, Q., Shai, O., Lee, L. J., Frey, B. J., Blencowe, B. J. Deep surveying of alternative splicing complexity in the human transcriptome by high-throughput sequencing. Nature Genetics. 40 (12), 1413-1415 (2008).
- Nilsen, T. W., Graveley, B. R. Expansion of the eukaryotic proteome by alternative splicing. Nature. 463 (7280), 457-463 (2010).
- Stamm, S. Signals and their transduction pathways regulating alternative splicing: a new dimension of the human genome. Human Molecular Genetics. 11 (20), 2409-2416 (2002).
- Kornblihtt, A. R., et al. Alternative splicing: a pivotal step between eukaryotic transcription and translation. Nature Reviews Molecular Cell Biology. 14 (3), 153-165 (2013).
- Zhong, X. -. Y., Ding, J. -. H., Adams, J. A., Ghosh, G., Fu, X. -. D. Regulation of SR protein phosphorylation and alternative splicing by modulating kinetic interactions of SRPK1 with molecular chaperones. Genes & Development. 23 (4), 482-495 (2009).
- Misteli, T., Cáceres, J. F., Clement, J. Q., Krainer, A. R., Wilkinson, M. F., Spector, D. L. Serine Phosphorylation of SR Proteins Is Required for Their Recruitment to Sites of Transcription In Vivo. Journal of Cell Biology. 143 (2), 297-307 (1998).
- Kanopka, A., et al. Regulation of adenovirus alternative RNA splicing by dephosphorylation of SR proteins. Nature. 393 (6681), 185-187 (1998).
- Anufrieva, K. S., et al. Therapy-induced stress response is associated with downregulation of pre-mRNA splicing in cancer cells. Genome Medicine. 10 (1), 49 (2018).
- Shultz, J. C., et al. SRSF1 Regulates the Alternative Splicing of Caspase 9 Via A Novel Intronic Splicing Enhancer Affecting the Chemotherapeutic Sensitivity of Non-Small Cell Lung Cancer Cells. Molecular Cancer Research. 9 (7), 889-900 (2011).
- Gabriel, M., et al. Role of the splicing factor SRSF4 in cisplatin-induced modifications of pre-mRNA splicing and apoptosis. BMC Cancer. 15, (2015).
- Lee, S. C. -. W., Abdel-Wahab, O. Therapeutic targeting of splicing in cancer. Nature Medicine. 22 (9), 976-986 (2016).
- Cooper, T. A. Use of minigene systems to dissect alternative splicing elements. Methods. 37 (4), 331-340 (2005).
- Stoss, O., Stoilov, P., Hartmann, A. M., Nayler, O., Stamm, S. The in vivo minigene approach to analyze tissue-specific splicing. Brain Research Protocols. 4 (3), 383-394 (1999).
- Zerler, B., et al. Adenovirus E1A coding sequences that enable ras and pmt oncogenes to transform cultured primary cells. Molecular and Cellular Biology. 6 (3), 887-899 (1986).
- Gattoni, R., Schmitt, P., Stevenin, J. In vitro splicing of adenovirus E1A transcripts: characterization of novel reactions and of multiple branch points abnormally far from the 3' splice site. Nucleic Acids Research. 16 (6), 2389-2409 (1988).
- Stephens, C., Harlow, E. Differential splicing yields novel adenovirus 5 E1A mRNAs that encode 30 kd and 35 kd proteins. The EMBO journal. 6 (7), 2027-2035 (1987).
- Ulfendahl, P. J., et al. A novel adenovirus-2 E1A mRNA encoding a protein with transcription activation properties. The EMBO journal. 6 (7), 2037-2044 (1987).
- Berk, A. J., Sharp, P. A. Structure of the adenovirus 2 early mRNAs. Cell. 14 (3), 695-711 (1978).
- Svensson, C., Pettersson, U., Akusjärvi, G. Splicing of adenovirus 2 early region 1A mRNAs is non-sequential. Journal of Molecular Biology. 165 (3), 475-495 (1983).
- Basei, F. L., Meirelles, G. V., Righetto, G. L., dos Santos Migueleti, D. L., Smetana, J. H. C., Kobarg, J. New interaction partners for Nek4.1 and Nek4.2 isoforms: from the DNA damage response to RNA splicing. Proteome Science. 13 (1), 11 (2015).
- Zhou, Z., et al. The Akt-SRPK-SR Axis Constitutes a Major Pathway in Transducing EGF Signaling to Regulate Alternative Splicing in the Nucleus. Molecular Cell. 47 (3), 422-433 (2012).
- Caceres, J., Stamm, S., Helfman, D., Krainer, A. Regulation of alternative splicing in vivo by overexpression of antagonistic splicing factors. Science. 265 (5179), 1706-1709 (1994).
- Zhong, X. -. Y., Ding, J. -. H., Adams, J. A., Ghosh, G., Fu, X. -. D. Regulation of SR protein phosphorylation and alternative splicing by modulating kinetic interactions of SRPK1 with molecular chaperones. Genes & Development. 23 (4), 482-495 (2009).
- Naro, C., et al. The centrosomal kinase NEK2 is a novel splicing factor kinase involved in cell survival. Nucleic Acids Research. 42 (5), 3218-3227 (2014).
- Lu, C. -. C., Chen, T. -. H., Wu, J. -. R., Chen, H. -. H., Yu, H. -. Y., Tarn, W. -. Y. Phylogenetic and Molecular Characterization of the Splicing Factor RBM4. PLoS ONE. 8 (3), 59092 (2013).
- Jarnæss, E., et al. Splicing Factor Arginine/Serine-rich 17A (SFRS17A) Is an A-kinase Anchoring Protein That Targets Protein Kinase A to Splicing Factor Compartments. Journal of Biological Chemistry. 284 (50), 35154-35164 (2009).
- Bressan, G. C., et al. Functional association of human Ki-1/57 with pre-mRNA splicing events. FEBS Journal. 276 (14), 3770-3783 (2009).
- Vivarelli, S., et al. Paraquat Modulates Alternative Pre-mRNA Splicing by Modifying the Intracellular Distribution of SRPK2. PLoS ONE. 8 (4), 61980 (2013).
- Russell, W. C., Graham, F. L., Smiley, J., Nairn, R. Characteristics of a Human Cell Line Transformed by DNA from Human Adenovirus Type 5. Journal of General Virology. 36 (1), 59-72 (1977).
- Aranda, P. S., LaJoie, D. M., Jorcyk, C. L. Bleach gel: A simple agarose gel for analyzing RNA quality. Electrophoresis. 33 (2), 366-369 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Bai, Y. Control of 3' splice site choice in vivo by ASF/SF2 and hnRNP A1. Nucleic Acids Research. 27 (4), 1126-1134 (1999).
- Cote, G. J., Nguyen, N., Lips, C. J. M., Berget, S. M., Gagel, R. F. Validation of an in vitro RNA processing system for CT/CGRP precursor mRNA. Nucleic Acids Research. 19 (13), 3601-3606 (1991).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены