Method Article
Uso de la herramienta E1A Minigene para estudiar los cambios en el empalme de ARNm
En este artículo
Resumen
Este protocolo presenta una herramienta rápida y útil para evaluar el papel de una proteína con la función uncharacterized en la regulación que empalma alternativa después del tratamiento quimioterapéutico.
Resumen
El procesamiento del ARNm implica múltiples pasos simultáneos para preparar el ARNm para la traducción, como el 5'capping, la adición de poli-A y el empalme. Además del empalme constitutivo, el empalme alternativo del ARNm permite la expresión de proteínas multifuncionales a partir de un gen. Como los estudios de interactomas son generalmente el primer análisis de proteínas nuevas o desconocidas, la asociación de la proteína de cebo con factores de empalme es una indicación de que puede participar en el proceso de empalme de ARNm, pero determinar en qué contexto o qué genes están regulados es un proceso empírico. Un buen punto de partida para evaluar esta función es el uso de la herramienta clásica de minigene. Aquí presentamos el uso del minigene adenoviral E1A para evaluar los cambios que empalme alternativos después de diversos estímulos celulares de la tensión. Se evaluó el empalme del minigén E1A en HEK293 establemente sobreexpresando la proteína Nek4 después de diferentes tratamientos de estrés. El protocolo incluye transfección de minigenes E1A, tratamiento celular, extracción de ARN y síntesis de ADNc, seguido de pcr y análisis de gel y cuantificación de las variantes empalmeadas E1A. El uso de este método simple y bien establecido combinado con tratamientos específicos es un punto de partida confiable para arrojar luz sobre los procesos celulares o qué genes pueden ser regulados por el empalme de ARNm.
Introducción
El empalme es uno de los pasos más importantes en el proceso eucariota del mRNA que ocurre simultáneamente al 5' mRNA que tapa y al 3' poliadenylation del mRNA, comprendiendo del retiro del intrón seguido por la ensambladura del exón. El reconocimiento de los sitios que empalaban (SS) por el spliceosome, un complejo del ribonucleoprotein que contiene las pequeñas ribonucleoproteínas (snRNP U1, U2, U4 y U6), los pequeños RNAs (snRNAs) y varias proteínas reguladoras1 es necesario para empalmar.
Además de la extirpación de intrones (empalme constitutivo), en los eucariotas se pueden retener los intrones y se pueden excluir los exones, configurando el proceso llamado empalme alternativo de ARNm (EA). El empalme alternativo pre-ARNm amplía la capacidad de codificación de los genomas eucariotas permitiendo la producción de un número grande y diverso de proteínas a partir de un número relativamente pequeño de genes. Se estima que el 95-100% de los ARNm humanos que contienen más de un exón pueden someterse a empalme alternativo2,3. Esto es fundamental para procesos biológicos como el desarrollo neuronal, la activación de la apoptosis y la respuesta al estrés celular4,proporcionando al organismo alternativas para regular el funcionamiento celular utilizando el mismo repertorio de genes.
La maquinaria necesaria para el empalme alternativo es la misma utilizada para el empalme constitutivo y el uso de las SS es el principal determinante para la ocurrencia de empalme alternativo. El empalme constitutivo está relacionado con el uso de sitios de empalme fuerte, que suelen ser más similares a los motivos de consenso para el reconocimiento de spliceosomas5.
Los exones alternativos se reconocen típicamente menos eficientemente que los exones constitutivos una vez que sus elementos reguladores cis-,las secuencias en 5' SS y 3' SS flanqueando estos exones, demuestre una capacidad obligatoria inferior al emposoma. El ARNm también contiene regiones denominadas potenciadores o silenciadores ubicados en exones (potenciadores de empalme exónico (ESEs) y silenciadores de empalme exónicos (ESSs)) e intrones (potenciadores de empalme intrónico (ISEs) y silenciadores de empalme intrónico (ISSs)) que mejoran o reprimen el uso de exones, respectivamente5. Estas secuencias son reconocidas por elementos trans-reguladores, o factores de empalme (SF). Las SFs están representadas principalmente por dos familias de proteínas, los factores de empalme ricos en serina/arginina (SRSFs) que se unen a las EES y la familia de ribonucleoproteínas nucleares heterogéneas (hnRNPs) que se unen a las secuencias deLASE 5.
El empalme alternativo puede ser modulado por fosforilación/desfosforilación de factores trans que modifican las interacciones de los socios y localización celular de los factores de empalme6,7,8. La identificación de nuevos reguladores de los factores de empalme puede proporcionar nuevas herramientas para regular el empalme y, en consecuencia, algunos tratamientos contra el cáncer.
Anufrieva et al.9,en un perfil de expresión génica de microarrays de ARNm, observaron cambios consistentes en los niveles de componentes spliceosomales en 101 líneas celulares y después de diferentes condiciones de estrés (fármacos a base de platino, irradiación gamma, inhibidores de la topoisomerasa, inhibidores de la tirosina cinasa y taxanos). La relación entre el patrón de empalme y la eficacia de la quimioterapia ya se ha demostrado en células cancerosas de pulmón, que son resistentes a la quimioterapia, mostrando cambios en la tasa de variantes de la caspasa-910. Las células HEK293 tratadas con panel quimioterapéutico muestran cambios en el empalme con un aumento en las variantes pro-apoptóticas. Gabriel et al.11 observaron cambios en al menos 700 eventos de empalme después del tratamiento con cisplatino en diferentes líneas celulares, señalando que las vías de empalme están afectadas por el cisplatino. Los moduladores del empalme ya han demostrado actividad antitumoral, mostrando que el empalme es importante para el desarrollo tumoral y, principalmente, para la respuesta quimioterápica12. Por lo tanto, caracterizar nuevas proteínas que regulan el empalme después de agentes estresores celulares, como la quimioterapia, es muy importante para descubrir nuevas estrategias de tratamiento.
Las pistas de la regulación alternativa del empalme de estudios del interactome, particularmente importantes para caracterizar funciones de proteínas nuevas o no caracterizados, pueden exigir un acercamiento más general y simple para verificar el papel real de la proteína en COMO. Los minigenes son herramientas importantes para el análisis del papel general de una proteína que afecta a la regulación del empalme. Contienen segmentos de un gen de interés que contiene regiones genómicas alternativamente empalmadas y flanqueantes13. El uso de una herramienta minigénica permite el análisis del empalme in vivo con varias ventajas como la longitud del minigén que es menor y por lo tanto no es una limitación a la reacción de amplificación; el mismo minigén se puede evaluar en diferentes líneas celulares; todos los componentes celulares, principalmente su modificación postraduccional reguladora (fosforilación y cambios en los compartimentos celulares) están presentes y pueden ser abordados13,14. Por otra parte, se pueden observar cambios en el patrón de empalme alternativo después del estrés celular y, el uso de un sistema de minigenes, permiten identificar la vía modulada por diferentes estímulos.
Hay varios sistemas de minigenes ya descritos que son específicos para diferentes tipos de eventos de empalme13,14, sin embargo, como un ensayo preliminar, el minigén E1A15 es un sistema de reportero de empalme alternativo muy bien establecido para el estudio de la selección de 5 SS in vivo. A partir de un solo gen, E1A, cinco ARNm se producen por empalme alternativo basado en la selección de tres diferentes sitios de empalme de 5 ′ y de uno mayor o un menor 3 ′ sitio de empalme16,17,18. La expresión de las variantes de E1A cambia según el período de infección adenoviral19,20.
Hemos demostrado previamente que ambas isoformas Nek4 interactúan con factores de empalme como SRSF1 y hnRNPA1 y mientras que la isoforma 2 cambia el splicing alternativo del minigén E1A, la isoforma 1 no tiene ningún efecto en esa21. Porque el isoform 1 es el isoform más abundante y cambia resistencia de la quimioterapia y respuesta del daño de la DNA, evaluamos si podría cambiar el empalme alternativo del minigene E1A en una condición de la tensión.
El ensayo de minigene es un método sencillo, de bajo coste y rápido, ya que solo necesita extracción de ARN, síntesis de ADNc, amplificación y análisis de gel de agarosa, y puede ser una herramienta útil para evaluar desde un posible efecto sobre el empalme alternativo por una proteína de intereses hasta el efecto de diferentes tratamientos sobre el patrón de empalme alternativo celular.
Protocolo
1. Células de chapado
NOTA: En este protocolo descrito, hek293 líneas celulares estables, previamente generado para la expresión inducible estable de Nek4 se utilizaron21,sin embargo, el mismo protocolo es adecuado para muchas otras líneas celulares, tales como HEK29322,HeLa23,24,25,26,U-2 OS27,COS728,SH-SY5Y29. El patrón de expresión de las isoformas del minigén E1A en condiciones basales varía entre estas células y debe caracterizarse para cada condición. Este protocolo no se limita a líneas celulares estables. El enfoque más común en la evaluación de la proteína candidata es por co-transfección transitoria de aumentar su cantidad con la cantidad fija del minigén. El mismo protocolo es adecuado para las células knockout.
- Celdas de placa considerando controles de vehículos, no transfectados y GFP.
- Cultivo de células HEK293 con expresión estable del gen de interés en el Medio Águila Modificada de Dulbecco (DMEM) suplementadas con un 10% de Suero Fetal Bovino (FBS), 4,5 g/L de Glucosa, 4 mM de L-Glutamina y se mantienen con 100 μg/mL de higromicina B, sobre placas tratadas con cultivo de tejidos a 37 °C enCO2 al 5% y una atmósfera humidificada.
- Dividir las células usando 0,25% tripsina-EDTA. Placa 3 x 105 células en placas de 6 pozos e incubarlas durante 24 h a 37 °C en 5% deCO2.
NOTA: Para la transfección, las células deben ser 70-80% confluentes para disminuir la muerte celular después de la transfección.
2. Transfección celular
NOTA: Aquí se utilizaron 1-2 μg de plásmido del minigén pMTE1A, sin embargo, la cantidad de ADN, así como el tiempo de expresión, deben mantenerse al mínimo para evitar toxicidad. Por ejemplo, se observó alta toxicidad en células HeLa después de 30 h de transfección con 1 μg de ADN pMTE1A. Para la transfección aquí descrita, se utilizó un reactivo de transfección a base de lípidos
- Compruebe la confluencia celular 24 h después de chapado y transfectar hek293 células estables sólo cuando 70-80% confluyen.
- Retire el medio de cultivo celular cuidadosamente con una pipeta, en lugar de usar un sistema de bomba de vacío. Luego agregue cuidadosamente 2 mL de medio DMEM completo sin antibióticos y vuelva a colocar la placa en la incubadora.
- Prepare un tubo con el tampón de transfección (200 μL/pozo), agregue 2 μg de ADN pMTE1A, vórtice y luego agregue 2 μL de reactivo de transfección. Vórtice de nuevo e incubar durante 10 min a temperatura ambiente.
- Retire las placas de la incubadora y agregue cuidadosamente la mezcla de transfección gota a gota.
- A las células estables HEK293, añadir tetraciclina (0,5 μg/mL) para la inducción de la expresión de Nek4 6 h después de la transfección. El cambio de medio no es necesario.
NOTA: Los volúmenes/cantidades descritos en esta sección son para un pozo. Prepare la mezcla para todos los pozos utilizados en el experimento en el mismo tubo. - Prepare un pozo para transfectar con EGFP, u otro fluoróforo que exprese el plásmido para estimar la eficiencia de la transfección. Se pueden observar mejores resultados con una eficiencia de transfección de al menos el 40%, pero previamente se observaron buenos rendimientos con menor eficiencia de transfección.
- Cuando se utiliza la co-transfección (proteína de interés y minigene) mantener un pozo con células no transfectadas para evitar la obtención de resultados de ARNm endógeno. En el caso de E1A, las células HEK293 ya expresan el gen E1A30.
3. Preparación de los medicamentos
NOTA: El tiempo y la concentración del tratamiento se eligieron en función de los resultados de la literatura, que señalan cambios en el empalme alternativo para algunos genes.
- Realizar una curva dosis-respuesta antes de iniciar el ensayo para determinar la concentración mínima a la inducción de empalme alternativo sin ningún efecto en la viabilidad celular.
- Prepare una solución común de Paclitaxel a una concentración de 5 mM en etanol. La concentración final es de 1 μM. Mantener a -20 °C. Utilice etanol al 0,02% como control del vehículo.
- Preparar una solución de cisplatino diluyendo en NaCl al 0,9% a alrededor de 0,5 mg/mL (1,66 mM). Proteger de la luz, vórtice e incubar en un baño termal, 37 °C durante 30 min. La concentración final es de 30 μM. Preparar fresco o conservar a 2-10 °C hasta un mes.
NOTA: Todos los medicamentos deben estar protegidos de la luz.
4. Tratamiento y recolección celular
NOTA: Las células estables HEK293 se recogieron 48 h después de la transfección y para ello se trataron 24 h después de la transfección porque el nivel de expresión más alto de Nek4 se alcanza dentro de las 48 h. Sin embargo, los niveles de la expresión de la isoforma 13S (hasta el 90%) fueron observados en este tiempo. Para disminuir la proporción de isoforma 13S, trate de tratar y recoger las células 30 h después de la transfección máxima.
- Use puntas y tubos libres de ARN/DNasa. Realice la extracción total del ARN con el reactivo del fenol-cloroformo siguiendo la recomendación del fabricante.
- 24 h después de la transfección, verificar la morfología celular y la eficiencia de la transfección utilizando un microscopio fluorescente.
- Retire el medio de cultivo celular, preferentemente utilizando una pipeta en lugar de un sistema de bomba de vacío. A continuación, añadir el medio de cultivo celular con los quimioterapéuticos en la concentración final previamente descrita.
- Incubar a 37 °C, 5% co2 durante 18 - 24 h.
- Recoja el ARN desechando el medio de cultivo celular en un recipiente y agregando 0.5 - 1 mL de reactivo de extracción de ARN directamente al pozo. Si los pozos son muy confluentes, utilice 1 mL de reactivo de extracción de ARN para mejorar la calidad del ARN.
- Homogeneizar con la pipeta y transferir a un tubo centrífuga de 1,5 mL. En este punto, el protocolo se puede pausar almacenando muestras a -80 °C o proceder inmediatamente a la extracción de ARN.
ADVERTENCIA: El reactivo de extracción de ARN a base de fenol es tóxico y todos los procedimientos deben realizarse en una campana química de humos y los residuos deben eliminarse correctamente.
5. Extracción de ARN y síntesis de ADNc
- En una campana extractora descongelar las muestras e incubar durante 5 min a temperatura ambiente. Añadir 0,1 -0,2 mL de cloroformo y agitar vigorosamente.
- Incubar durante 3 min a temperatura ambiente.
- Centrífuga durante 15 min a 12.000 x g y 4 °C.
- Recoja la fase acuosa superior y transfiera a un nuevo tubo centrífuga de 1,5 mL. Recoger alrededor del 60% del volumen total; sin embargo, no recoja el ADN ni la fase orgánica (inferior).
- Añadir 0,25 - 0,5 mL de isopropanol y agitar por inversión 4 veces. Incubar durante 10 min a temperatura ambiente.
- Centrífuga a 12.000 x g durante 10 min, a 4 °C y deseche el sobrenadante.
- Lave el pellet de ARN dos veces con etanol (75% en agua tratada con dietilpirocarbonato (DEPC)). Centrífuga a 7.500 x g durante 5 min y deseche el etanol.
- Retire el exceso de etanol invirtiendo el tubo en un papel toalla y luego deje el tubo abierto dentro de una campana extractora de humos para secar parcialmente el pellet durante 5 - 10 min.
- Resuspend el pellet de ARN en 15 μL de agua tratada con DEPC.
- Cuantifique el ARN total usando la absorbancia en 230 nanómetro, 260 nanómetro, y 280 nanómetro para verificar calidad del ARN.
- Para verificar la calidad total del ARN, ejecute un gel de agarosa al 1% pre-tratado con 1,2% (v/v) de una solución de hipoclorito de sodio al 2,5% durante 30 min31.
- Realizar la síntesis de ADNc utilizando 1-2 μg de ARN total.
- Pipetear ARN, 1 μL de oligo-dT (50 μM), 1 μL de dNTP (10 mM) y componer el volumen a 12 μL con agua libre de nucleasa. Incubar en el termociclador durante 5 min a 65 °C.
- Retire las muestras del termociclador para enfriar y preparar la mezcla de reacción: 4 μL de tampón de la transcriptasa inversa, 2 μL de ditiothreitol (TDT) y 1 μL de inhibidor de la ribonucleasa. Incubar a 37 °C durante 2 min.
- Añadir 1 μL de transcriptasa inversa termoestable. Incubar a 37 °C durante 50 min e inactivar la enzima a 70 °C durante 15 min.
NOTA: El ADNc se puede almacenar a -20 °C durante varias semanas. Realizar un control de la transcriptasa no inversa (TRN) para la contaminación genómica de la discriminación putativa de eventos de retención de intrones.
6. PCR mínima del mínimo pMTE1A
- Realizar PCR con la composición de la reacción (1,5 mM de MgCl2,0,3 mM de mezcla dNTP, 0,5 μM de cada cebador, 2,5 U de una Taq Polimerasa de arranque en caliente y 150 ng de ADNc) con las siguientes condiciones:
94 °C durante 2 min, 29 ciclos de: 94 °C durante 1 min, 50 °C durante 2 min, 72 °C durante 2 min, 72 °C durante 10 min. - Cargue 20-25 μL del producto de PCR en un gel de agarosa al 3% que contenga manchas de ácido nucleico y funcione a 100 V durante aproximadamente 1 h.
7. Análisis del gel utilizando un software de procesamiento y análisis de imágenes32
- Después de la ejecución, fotografíe el gel (utilizando un sistema de adquisición de imágenes de gel) evitando cualquier saturación de banda y cuantifique las bandas utilizando un software de procesamiento de imágenes.
- Para la cuantificación considere las bandas a ~631 pb, ~493 pb y ~156 pb para corresponder a las isoformas 13S, 12S y 9S, respectivamente.
- En el menú Archivo del software, abra el archivo de imagen obtenido del sistema de adquisición de imágenes. Convierta a escala de grises, ajuste el brillo y el contraste y elimine el ruido de valores atípicos si es necesario.
- Dibuje un rectángulo alrededor del primer carril con la herramienta Selección de rectángulo y selecciónelo a través de la | Analizar Geles | Seleccione el comando Primer carril o pulse el método abreviado de teclado para él.
- Utilice el ratón para hacer clic y mantener en el centro del rectángulo en el primer carril y arrástrelo hacia el siguiente carril. Ir a Analizar | Geles | Seleccione Carril siguienteo pulse el acceso directo disponible. Repita este paso en todos los carriles restantes.
- Después de que todos los carriles estén resaltados y numerados, vaya a Analizar | Geles | Trazar carriles para dibujar una gráfica de perfil de cada carril.
- Con la herramienta Selección en línea recta, dibuje una línea a través de la base de cada pico correspondiente a cada banda, dejando fuera el ruido de fondo. Después de que todos los picos, de cada carril, se ha cerrado, seleccione la herramienta Varita y haga clic dentro de cada pico. Para cada pico resaltado, las mediciones deben aparecer en la ventana Resultados que aparece.
- Sume la intensidad de las 3 bandas para cada muestra y calcule el porcentaje para cada isoforma en relación con el total.
- Trace los porcentajes de cada isoforma o las diferencias en el porcentaje en relación con las muestras no tratadas.
NOTA: Asegúrese de que la suma de tres variantes E1A debe ser igual al 100%.
Resultados
Un 5' el análisis de los sitios del empalme usando el minigene de E1A fue realizado para evaluar cambios en perfil que empalmaba en células después de la exposición de la quimioterapia. Se evaluó el papel de Nek4-isoforma 1 en la regulación de AS en células estables HEK293 después del tratamiento con paclitaxel o cisplatino.
La región adenoviral de E1A es responsable de la producción de tres mRNAs principales a partir de un precursor del ARN debido al uso de diversos donantes del empalme. Comparten termini comunes de 5' y 3' pero difieren en el tamaño de sus intrones extirpados. Los ARNm adenovirales E1A se nombran según sus coeficientes de sedimentación, 13S, 12S y 9S. Durante la fase temprana de la infección por adenovirus (alrededor de 7 h), se producen proteínas importantes para preparar la célula infectada para la replicación del ADN viral (13S - 723 aa y 12S - 586 aa) y, en la fase tardía (alrededor de 18 h) además de esas, se produce una pequeña proteína (9S -249 aa)20. Utilizando un plásmido que contiene el minigén de E1A, se puede observar el efecto sobre el empalme alternativo en las células después de la transfección evaluando la proporción de ARNm de cada isoforma producida: 13S: 631 pb, 12S: 493 pb y 9S 156 pb(Figura 1A y B).
La expresión basal de las variantes de las isoformas E1A depende de la línea celular y del tiempo de expresión de E1A. Se observó que la línea celular HEK293-estable (HEK293-Flag) o el sitio que contiene recombinasa HEK293 (HEK293-FRT - la línea celular original) muestra una expresión más alta de 13S en comparación con las células HeLa (HeLa-PLKO) que muestra niveles similares de isoformas 13S y 12S después de 48 h de expresión E1A (Figura 1C y D).
El alto nivel de expresión 13S observado en células estables HEK293 se reduce considerablemente en tiempos más cortos de expresión E1A (alrededor de 30 h). La proporción (%) de 13S:12S:9S a las 30 h y 48 h es 60:33:7 y 80:15:5, respectivamente (datos no representados). Por esta razón, es importante caracterizar el perfil de empalme del minigén celular basal E1A antes de comenzar los experimentos.
Las células expuestas al cisplatin mostraron un cambio en 5' selección que empalmaba de los SS que favorecía la expresión 12S (un aumento del alrededor 15% comparado a las células no tratadas). Este efecto se observó en HEK293 expresando de forma estable el vector vacío de la bandera, así como la isoforma 1 de Nek4. Cuando se observan cambios importantes en el porcentaje de expresión, una gráfica con porcentajes representa claramente los resultados (Figura 2).
Al comparar dos condiciones (sobreexpresión de Flag y Nek4) que responden a un tratamiento, generalmente la mejor manera de representar los datos es trazar las diferencias en una gráfica, porque el nivel basal de expresión puede ser diferente, y los porcentajes no reflejarán el efecto real del tratamiento. Esto se puede observar en la Figura 3. Los cambios en COMO después del tratamiento del paclitaxel eran muy discretos, pero las direcciones de los cambios eran opuestas en la bandera y Nek4 que expresaban las células.
A pesar de los pequeños cambios después del tratamiento, los resultados fueron consistentes, lo que indica que el tratamiento con paclitaxel conduce a una disminución de la isoforma 13S, con un aumento de 12S y 9S en las células que expresan Flag, mientras que, por otro lado, en las células que expresan Nek4, se observa el efecto contrario.

Figura 1:El patrón de empalme del minigén E1A depende de la línea celular. A)Representación esquemática de los sitios de empalme del minigén E1A. Las flechas indican la región de recocido de cebadores para la amplificación de isoformas del minigén E1A. B)Isoformas generadas a partir del empalme alternativo del minigene E1A. C)HEK293 que expresa de forma estable el vector vacío de la bandera (HEK293 -Flag), HeLa transfectado con el vector PLKO (HeLa - PLKO) o, los sitios que contienen recombinasa HEK293 (a partir de lo que HEK293 que expresa establemente la bandera o Nek4.1 se generaron - HEK293-FRT) se transfectaron con el plásmido pMTE1A. 48h después de la transfección se aisló el ARN total y las isoformas E1A se separaron en gel de agarosa(D). Gráfico que compara el porcentaje de isoforma 13S, 12S y 9S en células HEK293-Flag y HeLa-PLKO en condiciones basales. Datos de tres experimentos independientes. Haga clic aquí para ver una versión más amplia de esta figura.

Figura 2:Efecto del tratamiento con cisplatino en el patrón de empalme del minigén E1A. HEK293 que expresaba establemente el vector vacío de la bandera (bandera) o la etiqueta de la bandera Nek4.1 fundida, fueron transfectados con el plásmido de pMTE1A. Seis horas después de la tetraciclina de la transfección fue agregada a la inducción de la expresión de las proteínas. 24 h a 48 h, el medio de cultivo celular fue reemplazado por un medio que contenía 30 μM de Cisplatino. Después de 24 h de incubación, el ARN total fue extraído y los productos de la polimerización en cadena fueron separados en el gel de la agarosa del 3%. A)Se representan las isoformas predominantes del minigén E1A. Los gráficos B-D representan el % de cada isoforma en relación con la suma de tres variantes (13S, 12S y 9S). En E,la diferencia en el porcentaje de expresión de cada isoforma se presenta en relación con el control del vehículo (medio). Los gráficos se presentan como la media y el SEM de tres experimentos independientes. * p< 0,05, ** p<0,01 en la prueba t no emparejada. Haga clic aquí para ver una versión más amplia de esta figura.
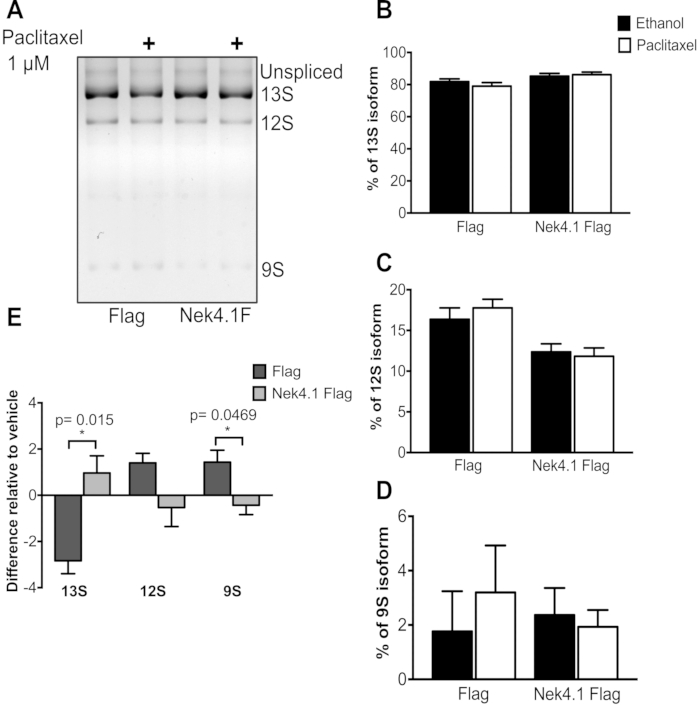
Figura 3:Efecto del tratamiento con paclitaxel en el patrón de empalme del minigén E1A. HEK293 que expresaba establemente el vector vacío de la bandera (bandera) o la bandera Nek4.1 fundida, fueron transfectados con el plásmido de pMTE1A. Seis horas después de la tetraciclina de la transfección fue agregada a la inducción de la expresión de las proteínas. De 24 h a 48 h, el medio de cultivo celular fue reemplazado por un medio que contenía 1 μM de Paclitaxel o etanol (0,02%) utilizado como control del vehículo. Después de 24 h de incubación, el ARN total fue extraído y los productos de la polimerización en cadena fueron separados en el gel de la agarosa del 3%. A)Se representan las isoformas predominantes. Los gráficos B-D representan el % de cada isoforma en relación con la suma de tres variantes (13S, 12S y 9S). En E,la diferencia en el porcentaje de expresión a cada isoforma se presenta en relación con el control del vehículo (etanol). Los gráficos se presentan como la media y el SEM de tres experimentos independientes. * p< 0,05 en la prueba t no emparejada. Haga clic aquí para ver una versión más amplia de esta figura.
Discusión
Los minigenes son herramientas importantes para determinar los efectos en el empalme alternativo global in vivo. El minigén adenoviral E1A se ha utilizado con éxito durante décadas para evaluar el papel de las proteínas aumentando la cantidad de estas en la célula13,14. Aquí, proponemos el uso del minigén E1A para evaluar el empalme alternativo después de la exposición quimioterapéutica. Una línea celular estable que expresaba el isoform 1 Nek4 fue utilizada, evitando los artefactos del énfasis excesivo causados por la transfección transitoria. La isoforma 1 de Nek4 no mostró efecto en el minigén E1A de empalme alternativo en condiciones basales21,pero tiene muchos interactores relacionados con el empalme, por lo tanto, lo que nos permite evaluar el efecto específico del tratamiento quimioterapéutico en el splicing alternativo E1A en estas células.
A pesar de su baja sensibilidad, principalmente en comparación con los enfoques radiactivos, el método descrito aquí es simple y no requiere reactivos especiales o condiciones de laboratorio. Sin embargo, es importante tener en cuenta que el minigén E1A es un reportero global de selecciones 5'SS, aunque la selección 3'SS se puede evaluar con este protocolo el minigene reportero específico debe ser utilizado14,33,34. Por otra parte, los resultados se pueden influenciar por la variedades de células y se deben evaluar cuidadosamente para evitar la interpretación debido a el perfil que empalma alternativo básico.
Por lo general, se observan grandes diferencias en el patrón de empalme del minigén E1A solo cuando se cambia la expresión de los factores de empalme. Otros cambios son menos obvios debido al gran número de proteínas que modulan la actividad de estos factores. Por esta razón, al iniciar los estudios para un candidato indirecto, se debe preferir el enfoque clásico, basado en cantidades crecientes de esta proteína candidata. Cuando se observa algún efecto, los tratamientos se pueden realizar para explorar si la regulación puede ser específica a un estímulo celular en particular.
Después de un resultado positivo preliminar, se puede realizar la estandarización del tiempo y la concentración del fármaco para optimizar el experimento.
Este protocolo simple es un ensayo preliminar, un punto de partida que puede responder si la proteína de interés muestra un efecto en el empalme alternativo y también, cuando ya se conoce algún efecto en la regulación del empalme alternativo, puede dirigir los estudios a la vía más consistente donde la proteína desempeña un papel regulador del empalme alternativo en la respuesta quimioterapéuica.
Divulgaciones
Los autores declaran que no tienen intereses financieros contrapuestos.
Agradecimientos
Agradecemos a la Fundação de Amparo a Pesquisa do Estado de São Paulo (FAPESP, a través de grant temático 2017/03489-1 a JK y beca a FLB 2018/05350-3) y al Conselho Nacional de Desenvolvimento Cientifico e Tecnológico (CNPq) por financiar esta investigación. Nos gustaría dar las gracias al Dr. Adrian Krainer por proporcionar el plásmido pMTE1A y a Zerler y sus colegas por su trabajo en la clonación E1A. También agradecemos a la Prof. Dra. Patrícia Moriel, a la Prof. Dra. Wanda Pereira Almeida, al Prof. Dr. Marcelo Lancellotti y a la Prof. Dra. Karina Kogo Cogo Müller por permitirnos utilizar su espacio y equipo de laboratorio.
Materiales
| Name | Company | Catalog Number | Comments |
| 100 pb DNA Ladder | Invitrogen | 15628-050 | |
| 6 wells plate | Sarstedt | 833920 | |
| Agarose | Sigma | A9539-250G | |
| Cisplatin | Sigma | P4394 | |
| DEPC water | ThermoFisher | AM9920 | |
| DMEM | ThermoFisher | 11965118 | |
| dNTP mix | ThermoFisher | 10297-018 | |
| Fetal Bovine Serum - FBS | ThermoFisher | 12657029 | |
| Fluorescent Microscope | Leica | DMIL LED FLUO | |
| Gel imaging acquisition system - ChemiDoc Gel Imagin System | Bio-Rad | ||
| GFP - pEGFPC3 | Clontech | ||
| HEK293 stable cells - HEK293 Flp-In | Generated from Flp-In™ T-REx™ 293 - Invitrogen and described in ref 21 | ||
| Hygromycin B | ThermoFisher | 10687010 | Used for Flp-In cells maintenemant |
| Image processing and analysis software - FIJI software | ref. 32 | ||
| Lipid- based transfection reagent - jetOPTIMUS Polyplus Reagent | Polyplus | 117-07 | |
| Oligo DT | ThermoFisher | 18418020 | |
| Paclitxel | Invitrogen | P3456 | |
| Plate Reader/ UV absorbance | Biotech | Epoch Biotek/ Take3 adapter | |
| pMTE1A plasmid | Provided by Dr. Adrian Krainer | ||
| pMTE1A F | Invitrogen | 5’ -ATTATCTGCCACGGAGGTGT-3 | |
| pMTE1A R | Invitrogen | 5’ -GGATAGCAGGCGCCATTTTA-3’ | |
| Refrigerated centrifuge | Eppendorf | F5810R | |
| Reverse Transcriptase - M-MLV | ThermoFisher | 28025013 | |
| Reverse transcriptase - Superscript IV | ThermoFisher | 18090050 | |
| Ribunuclease inhibitor RNAse OUT | ThermoFisher | 10777-019 | |
| RNA extraction phenol-chloroform based reagent - Trizol | ThermoFisher | 15596018 | |
| SybrSafe DNA gel stain | ThermoFisher | S33102 | |
| Taq Platinum | Thermo | 10966026 | |
| Tetracyclin | Sigma | T3383 | Used for Flag empty or Nek4- Flag expression induction |
| Thermocycler Bio-Rad | Bio-Rad | T100 | |
| Trypsin | Sigma | T4799 |
Referencias
- Ule, J., Blencowe, B. J. Alternative Splicing Regulatory Networks: Functions, Mechanisms, and Evolution. Molecular Cell. 76 (2), 329-345 (2019).
- Pan, Q., Shai, O., Lee, L. J., Frey, B. J., Blencowe, B. J. Deep surveying of alternative splicing complexity in the human transcriptome by high-throughput sequencing. Nature Genetics. 40 (12), 1413-1415 (2008).
- Nilsen, T. W., Graveley, B. R. Expansion of the eukaryotic proteome by alternative splicing. Nature. 463 (7280), 457-463 (2010).
- Stamm, S. Signals and their transduction pathways regulating alternative splicing: a new dimension of the human genome. Human Molecular Genetics. 11 (20), 2409-2416 (2002).
- Kornblihtt, A. R., et al. Alternative splicing: a pivotal step between eukaryotic transcription and translation. Nature Reviews Molecular Cell Biology. 14 (3), 153-165 (2013).
- Zhong, X. -. Y., Ding, J. -. H., Adams, J. A., Ghosh, G., Fu, X. -. D. Regulation of SR protein phosphorylation and alternative splicing by modulating kinetic interactions of SRPK1 with molecular chaperones. Genes & Development. 23 (4), 482-495 (2009).
- Misteli, T., Cáceres, J. F., Clement, J. Q., Krainer, A. R., Wilkinson, M. F., Spector, D. L. Serine Phosphorylation of SR Proteins Is Required for Their Recruitment to Sites of Transcription In Vivo. Journal of Cell Biology. 143 (2), 297-307 (1998).
- Kanopka, A., et al. Regulation of adenovirus alternative RNA splicing by dephosphorylation of SR proteins. Nature. 393 (6681), 185-187 (1998).
- Anufrieva, K. S., et al. Therapy-induced stress response is associated with downregulation of pre-mRNA splicing in cancer cells. Genome Medicine. 10 (1), 49 (2018).
- Shultz, J. C., et al. SRSF1 Regulates the Alternative Splicing of Caspase 9 Via A Novel Intronic Splicing Enhancer Affecting the Chemotherapeutic Sensitivity of Non-Small Cell Lung Cancer Cells. Molecular Cancer Research. 9 (7), 889-900 (2011).
- Gabriel, M., et al. Role of the splicing factor SRSF4 in cisplatin-induced modifications of pre-mRNA splicing and apoptosis. BMC Cancer. 15, (2015).
- Lee, S. C. -. W., Abdel-Wahab, O. Therapeutic targeting of splicing in cancer. Nature Medicine. 22 (9), 976-986 (2016).
- Cooper, T. A. Use of minigene systems to dissect alternative splicing elements. Methods. 37 (4), 331-340 (2005).
- Stoss, O., Stoilov, P., Hartmann, A. M., Nayler, O., Stamm, S. The in vivo minigene approach to analyze tissue-specific splicing. Brain Research Protocols. 4 (3), 383-394 (1999).
- Zerler, B., et al. Adenovirus E1A coding sequences that enable ras and pmt oncogenes to transform cultured primary cells. Molecular and Cellular Biology. 6 (3), 887-899 (1986).
- Gattoni, R., Schmitt, P., Stevenin, J. In vitro splicing of adenovirus E1A transcripts: characterization of novel reactions and of multiple branch points abnormally far from the 3' splice site. Nucleic Acids Research. 16 (6), 2389-2409 (1988).
- Stephens, C., Harlow, E. Differential splicing yields novel adenovirus 5 E1A mRNAs that encode 30 kd and 35 kd proteins. The EMBO journal. 6 (7), 2027-2035 (1987).
- Ulfendahl, P. J., et al. A novel adenovirus-2 E1A mRNA encoding a protein with transcription activation properties. The EMBO journal. 6 (7), 2037-2044 (1987).
- Berk, A. J., Sharp, P. A. Structure of the adenovirus 2 early mRNAs. Cell. 14 (3), 695-711 (1978).
- Svensson, C., Pettersson, U., Akusjärvi, G. Splicing of adenovirus 2 early region 1A mRNAs is non-sequential. Journal of Molecular Biology. 165 (3), 475-495 (1983).
- Basei, F. L., Meirelles, G. V., Righetto, G. L., dos Santos Migueleti, D. L., Smetana, J. H. C., Kobarg, J. New interaction partners for Nek4.1 and Nek4.2 isoforms: from the DNA damage response to RNA splicing. Proteome Science. 13 (1), 11 (2015).
- Zhou, Z., et al. The Akt-SRPK-SR Axis Constitutes a Major Pathway in Transducing EGF Signaling to Regulate Alternative Splicing in the Nucleus. Molecular Cell. 47 (3), 422-433 (2012).
- Caceres, J., Stamm, S., Helfman, D., Krainer, A. Regulation of alternative splicing in vivo by overexpression of antagonistic splicing factors. Science. 265 (5179), 1706-1709 (1994).
- Zhong, X. -. Y., Ding, J. -. H., Adams, J. A., Ghosh, G., Fu, X. -. D. Regulation of SR protein phosphorylation and alternative splicing by modulating kinetic interactions of SRPK1 with molecular chaperones. Genes & Development. 23 (4), 482-495 (2009).
- Naro, C., et al. The centrosomal kinase NEK2 is a novel splicing factor kinase involved in cell survival. Nucleic Acids Research. 42 (5), 3218-3227 (2014).
- Lu, C. -. C., Chen, T. -. H., Wu, J. -. R., Chen, H. -. H., Yu, H. -. Y., Tarn, W. -. Y. Phylogenetic and Molecular Characterization of the Splicing Factor RBM4. PLoS ONE. 8 (3), 59092 (2013).
- Jarnæss, E., et al. Splicing Factor Arginine/Serine-rich 17A (SFRS17A) Is an A-kinase Anchoring Protein That Targets Protein Kinase A to Splicing Factor Compartments. Journal of Biological Chemistry. 284 (50), 35154-35164 (2009).
- Bressan, G. C., et al. Functional association of human Ki-1/57 with pre-mRNA splicing events. FEBS Journal. 276 (14), 3770-3783 (2009).
- Vivarelli, S., et al. Paraquat Modulates Alternative Pre-mRNA Splicing by Modifying the Intracellular Distribution of SRPK2. PLoS ONE. 8 (4), 61980 (2013).
- Russell, W. C., Graham, F. L., Smiley, J., Nairn, R. Characteristics of a Human Cell Line Transformed by DNA from Human Adenovirus Type 5. Journal of General Virology. 36 (1), 59-72 (1977).
- Aranda, P. S., LaJoie, D. M., Jorcyk, C. L. Bleach gel: A simple agarose gel for analyzing RNA quality. Electrophoresis. 33 (2), 366-369 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Bai, Y. Control of 3' splice site choice in vivo by ASF/SF2 and hnRNP A1. Nucleic Acids Research. 27 (4), 1126-1134 (1999).
- Cote, G. J., Nguyen, N., Lips, C. J. M., Berget, S. M., Gagel, R. F. Validation of an in vitro RNA processing system for CT/CGRP precursor mRNA. Nucleic Acids Research. 19 (13), 3601-3606 (1991).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados