Method Article
שימוש בכלי המיני-דג'ן E1A לחקר שינויי ההסתבכות של mRNA
In This Article
Summary
פרוטוקול זה מציג כלי מהיר ושימושי להערכת תפקידו של חלבון עם פונקציה לא אופיינית בוויסות חיבור חלופי לאחר טיפול כימותרפי.
Abstract
עיבוד mRNA כרוך במספר שלבים בו-זמניים להכנת mRNA לתרגום, כגון 5'capping, תוספת פולי-A וחביך. מלבד חיבור מהווה, חיבור mRNA חלופי מאפשר ביטוי של חלבונים רב תכליתיים מגן אחד. כמו מחקרים interactome הם בדרך כלל הניתוח הראשון עבור חלבונים חדשים או לא ידועים, הקשר של חלבון הפיתיון עם גורמי חיבור הוא אינדיקציה כי זה יכול להשתתף בתהליך חיבור mRNA, אבל כדי לקבוע באיזה הקשר או מה הגנים מוסדר הוא תהליך אמפירי. נקודת התחלה טובה להערכת פונקציה זו היא באמצעות כלי מיני-דג'ן קלאסי. כאן אנו מציגים את השימוש במיני-ז'נים E1A אדנו-ויראלי להערכת שינויי ההצמדה החלופיים לאחר גירויי לחץ תאיים שונים. הערכנו את ההשתתפות של מיני-דגן E1A ב- HEK293 המבטא יתר על המידה חלבון Nek4 לאחר טיפולי הדגמה שונים. הפרוטוקול כולל E1A מיני-דבק, טיפול בתא, מיצוי RNA וסינתזת cDNA, ואחריו ניתוח PCR וג'ל וכימות של גרסאות משולבות E1A. השימוש בשיטה פשוטה ומבוססת זו בשילוב עם טיפולים ספציפיים הוא נקודת התחלה אמינה לשפוך אור על תהליכים תאיים או אילו גנים ניתן להסדיר על ידי חבית mRNA.
Introduction
חיבור הוא בין השלבים החשובים ביותר בעיבוד mRNA אאוקריוטי המתרחש בו זמנית ל- 5'mRNA המכסה ופוליאדנילציה של 3'mRNA, המורכבת מהסרת אינטרונים ואחריה צומת אקסון. ההכרה של אתרי splicing (SS) על ידי spliceosome, קומפלקס ריבונוקליאופרוטאין המכיל ריבונוקלאופרוטאינים קטנים (snRNP U1, U2, U4 ו- U6), RNAs קטנים (snRNAs) וכמה חלבוניםרגולטוריים 1 יש צורך splicing.
מלבד הסרה אינטרון (splicing מרכיב), ב eukaryotes, introns ניתן לשמור ו exons ניתן לשלול, קביעת התצורה של התהליך שנקרא splicing חלופי mRNA (AS). ההשתתפות החלופית לפני ה-mRNA מרחיבה את יכולת הקידוד של הגנום האוקריוטי המאפשר ייצור של מספר גדול ומגוון של חלבונים ממספר קטן יחסית של גנים. ההערכה היא כי 95-100% של mRNAs אנושי המכילים יותר מאקון אחד יכול לעבור splicingחלופי 2,3. זה בסיסי עבור תהליכים ביולוגיים כמו התפתחות עצבית, הפעלת אפופטוזיס ותגובת מתח תאי 4 , מתןחלופותהאורגניזם לווסת את תפקוד התא באמצעות אותו רפרטואר של גנים.
המכונות הדרושות לחבורת אלטרנטיבית זהה לשימוש בהשתלבתיות מכוננת והשימוש ב- SS הוא הקובע העיקרי להתרחשות פריצה חלופית. חלוקה מכוננת קשורה לשימוש באתרי חלוקה חזקים, הדומים בדרך כלל יותר למוזגי קונצנזוס להכרה5.
אקסונים אלטרנטיביים מוכרים בדרך כלל פחות ביעילות מאשר אקסונים מכוננים ברגע שהרכיבים הרגולטוריים של cis,הרצפים ב- 5 SS ו- 3'sS מאגפים את האקסונים האלה, מראים יכולת מחייבת נחותה לתרסיס. mRNA מכיל גם אזורים בשם משפרי או משתיקי קול הממוקמים אקסונים (משפרי ESEs) ו- splicing exonic (ESSs)) ואינטרונים (משפרי חוג אינטרוניים (ISEs) ומשתיקים אינטרוניים של שכפול (ISSs)) המשפרים או מדחיקים את השימוש ב- exon, בהתאמה5. רצפים אלה מזוהים על ידי אלמנטים טרנס-רגולטוריים, או גורמי שיתוף (SF). SFs מיוצגים בעיקר על ידי שתי משפחות של חלבונים, גורמי הצמדה עשירים serine / ארגינין (SRSFs) אשר נקשרים ESEs ואת המשפחה של ריבונוקלאופרוטאינים גרעיניים הטרוגניים (hnRNPs) אשר נקשרים רצפי ESSs5.
שכפול חלופי יכול להיות מווסת על ידי זרחן / dephosphorylation של טרנס - גורמים המשנים את השותפים אינטראקציות ולוקליזציה הסלולר של גורמי splicing6,7,8. זיהוי רגולטורים חדשים של גורמי שכפול יכול לספק כלים חדשים כדי לווסת את ההסתבכות, וכתוצאה מכך, כמה טיפולים בסרטן.
Anufrieva ואח'9, בפרופיל ביטוי גן microarray mRNA, נצפו שינויים עקביים ברמות של רכיבים spliceosomal ב 101 קווי תאים ולאחר תנאי לחץ שונים (תרופות מבוססות פלטינה, הקרנת גמא, מעכבי topoisomerase, מעכבי טירוסין קינאז ומסים). הקשר בין דפוס ההשתלשלות ויעילות הכימותרפיה כבר הוכח בתאי סרטן ריאות, שהם עמידים לכימותרפיה, ומציגים שינויים בגרסאות caspase-9 שיעור10. HEK293 תאים שטופלו עם לוח כימותרפיה להראות שינויים splicing עם עלייה בגרסאות פרו-אפופטוטי. גבריאל ואח' 11 נצפו שינויים לפחות 700 אירועים של splicing לאחר טיפול ציספלטין בשורות תאים שונים, וציין כי נתיבי שיוך מושפעים ציספלטין. מאפננים splicing כבר הוכיחו פעילות אנטי גידולית, מראה כי splicing חשוב להתפתחות הגידול, ובעיקר,תגובה כימותרפית 12. לפיכך, אפיון חלבונים חדשים המסדירים את ההשתתפות לאחר סוכני לחצים תאיים, כמו כימותרפיה, חשוב מאוד לגלות אסטרטגיות חדשות של טיפול.
הרמזים של ויסות שכפול אלטרנטיבי ממחקרים interactome, חשוב במיוחד לאפיין פונקציות של חלבונים חדשים או לא אופייניים, יכול לדרוש גישה כללית ופשוטה יותר כדי לאמת את התפקיד האמיתי של החלבון ב- AS. מיני-ג'נס הם כלים חשובים לניתוח התפקיד הכללי של חלבון המשפיע על ויסות ההשתתפות. הם מכילים קטעים מתוך גן של עניין המכיל לחילופין אזורים גנומיים מסונפים ולאגפים13. שימוש בכלי מיני-דג'ן מאפשר ניתוח של חוג ב- vivo עם מספר יתרונות כגון אורך המיניג'ן שהוא מינורי ולכן אינו מגבלה לתגובת ההגברה; ניתן להעריך את אותו מיני-דגן בשורות תאים שונים; כל הרכיבים התאיים, בעיקר שינוי לאחר התרגום שלהם (זרחן ושינויים בתאי התא) נמצאים וניתן לטפל בהם13,14. יתר על כן, שינויים דפוס splicing חלופי ניתן לראות לאחר מתח הסלולר, השימוש במערכת מיני-ז'ן, לאפשר לזהות את המסלול להיות מווסת על ידי גירויים שונים.
ישנן מספר מערכות מיני-דג'ן שכבר תוארו הספציפיות לסוגים שונים של אירועי חיתור13,14, עם זאת, כבדיקה ראשונית, המיני-ג'ין E1A15 היא מערכת כתבים חלופית מבוססת מאוד לחקר בחירת ה- SS של 5 ב- vivo. מתוך גן אחד בלבד, E1A, חמישה mRNAs מיוצרים על ידי חיבור חלופי המבוסס על בחירה של שלושה אתרי חיבור שונים 5 ′ ושל אחד גדול או אחד קטן 3 ′ splice אתר16,17,18. הביטוי של גרסאות E1A משתנה בהתאם לתקופה של זיהום אדנו-ויראלי19,20.
הראינו בעבר כי שני isoforms Nek4 אינטראקציה עם גורמי splicing כגון SRSF1 ו hnRNPA1 ובעוד isoform 2 משנה מיני-סוגן E1A חלופי, isoform 1 אין השפעה עלזה 21. מכיוון ש- isoform 1 הוא האיזופורם הנפוץ ביותר ומשנה עמידות לכימותרפיה ותגובת נזק לדנ"א, אנו מעריכים אם הוא יכול לשנות חוג חלופי של Minigene E1A במצב לחץ.
מיניג'ן אסאי היא שיטה פשוטה, בעלות נמוכה ומהירה, שכן היא זקוקה רק לחילוץ RNA, סינתזת cDNA, הגברה וניתוחי ג'ל אגרוז, ויכולה להיות כלי שימושי להערכה מאז השפעה אפשרית על חוג חלופי על ידי חלבון של תחומי עניין עד ההשפעה של טיפולים שונים על דפוס splicing חלופי הסלולר.
Protocol
1. תאי ציפוי
הערה: בפרוטוקול המתואר הזה, HEK293 קווי תאים יציבים, שנוצרו בעבר עבור ביטוי יציב ובלתי ניתן לתמיהה של Nek4 שימשו21, עם זאת, אותו פרוטוקול מתאים לקווי תאים רבים אחרים, כגון HEK29322, HeLa23,24,25,26, U-2 OS27, COS728, SH-SY5Y29. דפוס הביטוי של איזופורמים E1A מיניג'ן בתנאים בסיסיים משתנה בין תאים אלה ויש לאפיין אותו עבור כל תנאי. פרוטוקול זה אינו מוגבל לקווי תאים יציבים. הגישה הנפוצה ביותר בהערכת חלבון המועמד היא על ידי שיתוף פעולה חולף של הגדלת כמותו עם כמות קבועה של המיני-דגן. אותו פרוטוקול מתאים לתאי הסתרה.
- תאי לוח שוקלים רכב, לא נגוע ובקרות GFP.
- תאי HEK293 של תרבות עם ביטוי יציב של גן העניין במדיום הנשר המותנה (DMEM) של דולבק בתוספת 10% של סרום בקר עוברי (FBS), 4.5 גרם / L גלוקוז, 4 mM L-גלוטמין ולשמור עם 100 מיקרוגרם / מ"ל של hygromycin B, על לוחות שטופלו בתרבית רקמות ב 37 °C ב 5% CO2 ואטמוספירה לחה.
- לפצל תאים באמצעות 0.25% טריפסין-EDTA. צלחת 3 x 105 תאים ב 6-טוב צלחות ולדגירה אותם במשך 24 שעות ב 37 °C (5% CO2).
הערה: עבור transfection, תאים חייבים להיות 70-80% confluent כדי להפחית את המוות התא לאחר transfection.
2. תעתיק תאים
הערה: 1-2 מיקרוגרם של pMTE1A מיני-דגן plasmid שימש כאן, אולם כמות ה- DNA, כמו גם את זמן הביטוי, חייב להישמר מינימלי כדי למנוע רעילות. לדוגמה, רעילות גבוהה נצפתה בתאי HeLa לאחר 30 שעות של transfection עם 1 מיקרוגרם של DNA pMTE1A. עבור transfection המתואר כאן, ריאגנט transfection מבוסס שומנים שימש
- בדוק מפגש תאים 24 שעות לאחר ציפוי ולהדביק HEK293 תאים יציבים רק כאשר 70-80% confluent.
- הסר את תרבית התא בינוני בזהירות עם pipette, במקום להשתמש במערכת משאבת ואקום. לאחר מכן בזהירות להוסיף 2 מ"ל של מדיום DMEM מלא ללא אנטיביוטיקה ולהחזיר את הצלחת באינקובטור.
- הכן צינור עם חיץ transfection (200 μL / well), להוסיף 2 מיקרוגרם של pMTE1A DNA, מערבולת ולאחר מכן להוסיף 2 μL של ריאגנט transfection. מערבולת שוב ודגרה במשך 10 דקות בטמפרטורת החדר.
- מוציאים צלחות מהאינקובטור ומוסיפים בזהירות את תערובת הטרנספקטים.
- לתאים יציבים HEK293, הוסף טטרציקלין (0.5 מיקרוגרם/מ"ל) עבור אינדוקציה של ביטוי Nek4 6 שעות לאחר ההדבקה. אין צורך בשינוי בינוני.
הערה: אמצעי אחסון/סכומים המתוארים בסעיף זה מיועדים לבאר אחת. הכן את התערובת עבור כל הבארות המשמשות בניסוי באותו צינור. - הכן באר אחת כדי לעבור עם EGFP, או פלואורופור אחר מבטא plasmid כדי להעריך את יעילות transfection. תוצאות טובות יותר ניתן לראות עם יעילות transfection של לפחות 40%, אבל ביצועים טובים עם יעילות transfection נמוכה יותר נצפו בעבר.
- בעת שימוש בשיתוף פעולה (חלבון עניין ומיני-דג'ין) שמור על באר עם תאים שאינם נגועים כדי להימנע מהשגת תוצאות מ- mRNA אנדוגני. במקרה של E1A, תאי HEK293 כבר מבטאים את הגן E1A30.
3. הכנת הסמים
הערה: הזמן והריכוז של הטיפול נבחרו על סמך תוצאות הספרות, המצביעות על שינויים בהזרמה חלופית עבור גנים מסוימים.
- בצע עקומת תגובת מינון לפני תחילת ההסתה כדי לקבוע את הריכוז המינימלי אינדוקציה חיבור חלופי ללא השפעה על הכדאיות התא.
- הכן פתרון מלאי Paclitaxel בריכוז 5 mM באתנול. הריכוז הסופי הוא 1 מיקרומטר. לשמור על -20 °C (50 °F). השתמש 0.02% אתנול כמו בקרת רכב.
- הכן פתרון ציספלטין על ידי דילול ב 0.9% NaCl בסביבות 0.5 מ"ג / מ"ל (1.66 מ"מ). להגן מפני אור, מערבולת ודגרה באמבט תרמי, 37 °C (30 °F) למשך 30 דקות. הריכוז הסופי הוא 30 מיקרומטר. להכין טרי או לאחסן ב 2-10 °C (50 °F) עד חודש אחד.
הערה: כל הסמים חייבים להיות מוגנים מפני האור.
4. טיפול ואיסוף תאים
הערה: HEK293 תאים יציבים נאספו 48 שעות לאחר transfection ועל כך טופלו 24 שעות לאחר transfection כי רמת הביטוי Nek4 הגבוהה ביותר מושגת בתוך 48 שעות. עם זאת, רמות גבוהות של ביטוי איזופורם 13S (עד 90%) נצפו בשלב זה. כדי להקטין את היחס של isoform 13S, לנסות לטפל ולאסוף תאים 30 שעות לאחר transfection מקסימום.
- השתמש RNA / DNase טיפים חינם צינורות. בצע מיצוי RNA הכולל עם פנול-כלורופורם ריאגנט בעקבות המלצת היצרן.
- 24 שעות לאחר ההדבקה, לאמת מורפולוגיה של תאים ויעילות transfection באמצעות מיקרוסקופ פלואורסצנטי.
- הסר את המדיום תרבית התא, מועדף באמצעות pipette במקום מערכת משאבת ואקום. לאחר מכן להוסיף מדיום תרבית התא עם כימותרפיה בריכוז הסופי שתואר בעבר.
- דגירה ב 37 °C (5 °F), 5% CO2 עבור 18 - 24 שעות.
- לאסוף RNA על ידי השלכת המדיום תרבית התא במיכל והוספת 0.5 - 1 מ"ל של ריאגנט חילוץ RNA ישירות לבאר. אם בארות הן מאוד משכנעות, השתמש 1 מ"ל של ריאגנט מיצוי RNA כדי לשפר את איכות הרנ"א.
- הומוגני עם פיפטה ולהעביר צינור צנטריפוגה 1.5 מ"ל. בשלב זה, הפרוטוקול יכול להיות מושהה על ידי אחסון דגימות ב -80 °C (80 °F) או להמשיך מיד לחילוץ RNA.
אזהרה: ריאגנט החילוץ RNA מבוסס פנול רעיל וכל ההליכים צריכים להתבצע במכסה אדים כימי ושאריות מסולקות כראוי.
5. מיצוי RNA וסינתזת CDNA
- במכסה המנוע האדים מפשירים את הדגימות ודגר במשך 5 דקות בטמפרטורת החדר. הוסף 0.1 -0.2 מ"ל של כלורופורם ונסער במרץ.
- דגירה במשך 3 דקות בטמפרטורת החדר.
- צנטריפוגה למשך 15 דקות ב-12,000 x גרם ו-4 מעלות צלזיוס.
- לאסוף את השלב מימי העליון ולעבור צינור צנטריפוגה 1.5 מ"ל חדש. לאסוף כ-60% מהנפח הכולל; עם זאת, אין לאסוף את ה- DNA או את השלב האורגני (התחתון).
- הוסף 0.25 - 0.5 מ"ל של איזופרופנול ונסיסה על ידי היפוך 4 פעמים. דגירה במשך 10 דקות בטמפרטורת החדר.
- צנטריפוגה ב 12,000 x גרם במשך 10 דקות, ב 4 °C (55 °F) להשליך את supernatant.
- לשטוף את כדורי RNA פעמיים עם אתנול (75% במים דיאתילפירוקרבונט (DEPC). צנטריפוגה ב 7,500 x g במשך 5 דקות ולהשליך את האתנול.
- הסר אתנול עודף על ידי היפוך הצינור על נייר מגבת ולאחר מכן להשאיר את הצינור פתוח בתוך מכסה המנוע אדים לייבש חלקית את הכדור במשך 5 - 10 דקות.
- resuspend כדורי RNA ב 15 μL של מים שטופלו DEPC.
- כימת את סך הרנ"א באמצעות ספיגה ב- 230 ננומטר, 260 ננומטר ו- 280 ננומטר כדי לאמת את איכות ה- RNA.
- כדי לאמת את איכות הרנ"א הכוללת, הפעל ג'ל אגרוז 1% שטופלו מראש עם 1.2% (v/v) של פתרון היפוכלוריט נתרן 2.5% למשך 30 דקות31.
- בצע סינתזת cDNA באמצעות 1-2 מיקרוגרם של RNA הכולל.
- Pipette RNA, 1 μL של אוליגו-dT (50 מיקרומטר), 1 μL של dNTP (10 מ"מ) ולהוות את הנפח עד 12 μL עם מים ללא נוקלאז. דגירה בתרמוציקלר במשך 5 דקות ב 65 °C (65 °F).
- הסר דגימות מן thermocycler כדי להתקרר ולהכין את תערובת התגובה: 4 μL של חוצץ תמלול הפוך, 2 μL של dithiothreitol (DTT), ו 1 μL של מעכב ריבונוקלאז. דגירה ב 37 °C (50 °F) במשך 2 דקות.
- הוסף 1 μL של תמלול הפוך תרמו יציב. דגירה ב 37 °C במשך 50 דקות ולהנטרל את האנזים ב 70 °C (70 °F) במשך 15 דקות.
הערה: ניתן לאחסן את ה- cDNA ב- -20 °C (70 °F) למשך מספר שבועות. בצע בקרת תמלול לא הפוכה (NRT) לזיהום גנומי מאפליה של אירועי שימור אינטרון.
6. pMTE1A מיני פיג'ן PCR
- בצע PCR עם הרכב התגובה (1.5 mM של MgCl2, 0.3 מ"מ של תערובת dNTP, 0.5 מיקרומטר של כל פריימר, 2.5 U של הפעלה חמה טאק פולימראז ו 150 ננוגרם של cDNA) עם התנאים הבאים:
94 °C (74 °F) למשך 2 דקות, 29 מחזורים של: 94 °C (74 °F) למשך דקה אחת, 50 °C (50 °F) למשך 2 דקות, 72 °C (72 °F) למשך 10 דקות. - לטעון 20-25 μL של המוצר PCR בג'ל אגרוז 3% המכיל כתם חומצת גרעין ולהפעיל ב 100 V במשך כ 1 שעה.
7. ניתוח הג'ל באמצעות תוכנת עיבוד וניתוח תמונה32
- לאחר הריצה, צלם את הג'ל (באמצעות מערכת רכישת דימות ג'ל) תוך הימנעות מרוויה של רצועות וכימות הרצועות באמצעות תוכנת עיבוד תמונה.
- לכימות שקול את הרצועות ב ~ 631 bp, ~ 493 bp, ו ~ 156 bp כדי להתאים 13S, 12S ו 9S isoforms, בהתאמה.
- מתפריט קובץ של התוכנה, פתח את קובץ התמונה המתקבל ממערכת רכישת ההדמיה. המר לגווני אפור, התאם את הבהירות והחדות והסר רעש חריג במידת הצורך.
- ציירו מלבן סביב הנתיב הראשון בעזרת הכלי בחירת מלבן ובחרו אותו דרך | ג'לים | בחר את הפקודה נתיב ראשון, או על-ידי הקשה על קיצור המקשים עבורה.
- השתמש בעכבר כדי ללחוץ ולהחזיק באמצע המלבן בנתיב הראשון ולגרור אותו לנתיב הבא. עבור אל ניתוח | ג'לים | בחר בנתיב הבאאו הקש על קיצור הדרך הזמין. חזור על שלב זה לכל הנתיבים הנותרים.
- לאחר שכל הנתיבים מסומנים וממוספרים, עבור אל ניתוח | ג'לים | נתיבי עלילה כדי לצייר חלקת פרופיל של כל נתיב.
- בעזרת כלי בחירת הקו הישר, צייר קו לאורך הבסיס של כל פסגה המתאימה לכל רצועה, והשאר את רעשי הרקע. אחרי כל הפסגות, מכל נתיב, נסגרו, בחרו בכלי השרביט ולחצו בתוך כל פסגה. עבור כל שיא מסומן, מידות צריכות לצוץ בחלון התוצאות שמופיע.
- סכם את העוצמה מכל 3 הרצועות עבור כל דגימה וחשב את האחוז עבור כל איזופורם ביחס לסכום הכולל.
- התווה את האחוזים של כל איזופורם או את ההבדלים באחוזים ביחס לדגימות שלא טופלו.
הערה: ודא שהסכום של שלוש וריאנטים של E1A חייב להיות שווה ל- 100%.
תוצאות
5' splice אתרים בבדיקה באמצעות E1A minigene בוצע כדי להעריך שינויים בפרופיל splicing בתאים לאחר תערוכת כימותרפיה. התפקיד של Nek4 - isoform 1 בוויסות AS בתאים יציבים HEK293 לאחר טיפול paclitaxel או ציספלטין הוערך.
אזור Adenoviral E1A אחראי לייצור של שלושה mRNAs עיקריים ממבשר RNA אחד בגלל השימוש של תורמי splice שונים. הם חולקים טרמינלי משותף של 5' ו-3 אינץ', אך הם שונים בגודלם של האינטרונים הנתמכים שלהם. Adenoviral E1A mRNAs נקראים על פי מקדמי המשקעים שלהם, 13S, 12S ו 9S. במהלך השלב המוקדם של זיהום אדנווירוס (סביב 7 שעות), חלבונים חשובים להכנת התא הנגוע לשכפול DNA ויראלי מיוצרים (13S - 723 aa ו 12S - 586 aa) ו, בשלב מאוחר (סביב 18 שעות) מלבד אלה, חלבון קטן (9S -249 aa) מיוצר20. באמצעות plasmid המכיל את המיני-דגן מ- E1A, ניתן לראות את ההשפעה על חבורת חלופית בתאים לאחר טרנספקטיון הערכת חלקו של mRNA מכל איזופורם המיוצר: 13S: 631 bp, 12S: 493 bp ו 9S 156 bp (איור 1A ו- B).
ביטוי בזאלי של וריאנטים איזופורמים E1A תלוי קו התא ואת הזמן של ביטוי E1A. זה נצפתה כי קו תא יציב HEK293 (HEK293-Flag) או HEK293 רקומבינאז המכיל אתר (HEK293-FRT - קו התא המקורי) מציג ביטוי גבוה יותר של 13S בהשוואה לתאי HeLa (HeLa-PLKO) המציג רמות דומות של איזופורמים 13S ו- 12S לאחר 48 שעות של ביטוי E1A (איור 1C ו- D).
הרמה הגבוהה של ביטוי 13S שנצפו בתאים יציבים HEK293 יורדת במידה ניכרת תחת זמנים קצרים יותר של ביטוי E1A (סביב 30 שעות). השיעור (%) של 13S:12S:9S ב 30 שעות ו 48 שעות הוא 60:33:7 ו 80:15:5, בהתאמה (נתונים שאינם מיוצגים). מסיבה זו, חשוב לאפיין את פרופיל ההשתתפות של מיני-דגן הסלולר E1A לפני תחילת הניסויים.
תאים שנחשפו לציספלטין הראו שינוי בבחירת ההצמדה של 5 SS לטובת ביטוי 12S (עלייה של כ-15% בהשוואה לתאים לא מטופלים). אפקט זה נצפתה HEK293 ביציבות מבטא דגל ריק וקטור, כמו גם isoform 1 של Nek4. כאשר נצפים שינויים משמעותיים באחוז הביטוי, התוויית נתונים עם אחוזים מייצגת בבירור את התוצאות (איור 2).
כאשר משווים בין שני תנאים (ביטוי יתר של Flag ו- Nek4) המגיבים לטיפול, בדרך כלל הדרך הטובה ביותר לייצג את הנתונים היא התוויית ההבדלים בגרף, מכיוון שרמת הביטוי הבזלית יכולה להיות שונה, והאחוזים לא ישקפו את ההשפעה האמיתית של הטיפול. ניתן לצפות בכך באיור 3. שינויים ב- AS לאחר טיפול paclitaxel היו מאוד דיסקרטיים, אבל הכיוונים של השינויים היו הפוכים פלאג ו Nek4 מבטא תאים.
למרות שינויים קטנים לאחר הטיפול, התוצאות היו עקביות, מה שמצביע על כך שהטיפול בפצלקסל מוביל לירידה באיזופורם 13S, עם עלייה ב- 12S ו- 9S בתאי הבעת דגל, ואילו, מצד שני, ב- Nek4 מבטא תאים, ההשפעה ההפוכה נצפתה.

איור 1: תבנית ההשתתפות של Minigene E1A תלויה בקו התא. A) ייצוג סכמטי של אתרי שכפול מיני-דגם E1A. החצים מציינים את אזור חישול פריימר להגברת איזופורמים מיני-דג'ן E1A. B) Isoforms שנוצר מ- splicing חלופי של מיני-דגן E1A. ג) HEK293 מבטא ביציבות וקטור ריק דגל (HEK293 -דגל), HeLa transfected עם וקטור PLKO (HeLa - PLKO) או, HEK293 אתרי המכילים רקומבינאז (ממה HEK293 בייצוב מבטא דגל או Nek4.1 נוצרו - HEK293-FRT) היו transfected עם pMTE1A plasmid. 48 שעות לאחר ה- RNA הכולל של טרנספקטו היה מבודד ואיזופורמים E1A הופרדו בג'ל אגרוז (D). גרף המשווה את האחוז של איזופורם 13S, 12S ו- 9S בתאי HEK293-Flag ו- HeLa-PLKO בתנאים בסיסיים. נתונים משלושה ניסויים עצמאיים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: השפעת טיפול ציספלטין בדפוס ההצמדה של מיני-דגן E1A. HEK293 מבטא ביציבות וקטור ריק דגל (דגל) או Nek4.1 תג דגל התמזגו, היו transfected עם pMTE1A plasmid. שש שעות לאחר שטטרציקלין הטרנס-זיהום התווסף לחדירת ביטוי חלבונים. 24 שעות עד 48 שעות, המדיום תרבית התא הוחלף בינוני המכיל 30 מיקרומטר של ציספלטין. לאחר 24 שעות של דגירה, סך RNA הופק ואת המוצרים של PCR הופרדו ב 3% ג'ל אגרוז. A) מתוארים איזופורמים מיני-דג'ינים E1A. גרפים B-D מייצגים את האחוז של כל איזופורם ביחס לסכום של שלוש גרסאות (13S, 12S ו- 9S). ב- E, ההבדל באחוז הביטוי לכל איזופורם מוצג ביחס לבקרת רכב (בינונית). גרפים מוצגים כממוצע ו- SEM של שלושה ניסויים עצמאיים. * p< 0.05, ** p<0.01 במבחן t לא משוער. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
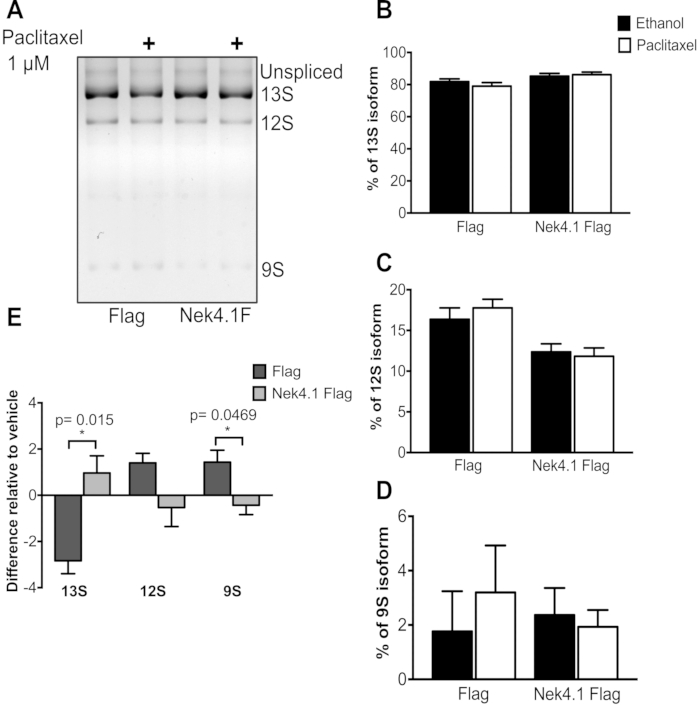
איור 3: השפעת טיפול פצליצ'ל בתבנית ההשתלבות של מיני-דגן E1A. HEK293 מבטא ביציבות וקטור ריק דגל (דגל) או Nek4.1 דגל התמזג, הועברו עם pMTE1A plasmid. שש שעות לאחר שטטרציקלין הטרנס-זיהום התווסף לחדירת ביטוי חלבונים. 24 שעות עד 48 שעות, המדיום תרבית התא הוחלף על ידי בינוני המכיל 1 μM של Paclitaxel או אתנול (0.02%) המשמש כמו בקרת רכב. לאחר 24 שעות של דגירה, סך RNA הופק ואת המוצרים של PCR הופרדו ב 3% ג'ל אגרוז. A) איזופורמים שלמים מתוארים. גרפים B-D מייצגים את האחוז של כל איזופורם ביחס לסכום של שלוש גרסאות (13S, 12S ו- 9S). ב- E, ההבדל באחוז הביטוי לכל איזופורם מוצג ביחס לבקרת הרכב (אתנול). גרפים מוצגים כממוצע ו- SEM של שלושה ניסויים עצמאיים. * p< 0.05 במבחן t לא משוחזר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
מיני-ג'נס הם כלים חשובים לקביעת ההשפעות של תרסיסים אלטרנטיביים גלובליים ב-vivo. ה adenoviral minigene E1A שימש בהצלחה במשך עשרות שנים כדי להעריך את התפקיד של חלבונים על ידי הגדלת כמות אלה בתא13,14. כאן, אנו מציעים את השימוש E1A minigene להערכת חוג חלופי לאחר חשיפה כימותרפית. קו תא יציב המבטא Isoform 1 Nek4 שימש, הימנעות הממצאים של ביטוי יתר שנגרם על ידי זיהום ארעי. isoform 1 של Nek4 לא הראה השפעה על מיני-gene E1A חלופי splicing בתנאים בסיסיים21, אבל יש אינטראקציות הקשורות splicing רבים, ולכן, המאפשר לנו להעריך את ההשפעה הספציפית של הטיפול הכימותרפי ב E1A חלופי splicing בתאים אלה.
למרות הרגישות הנמוכה שלה, בעיקר בהשוואה לגישות רדיואקטיביות, השיטה המתוארת כאן היא פשוטה ואינה דורשת ריאגנטים מיוחדים או תנאי מעבדה. עם זאת, חשוב לציין כי minigene E1A הוא כתב גלובלי של בחירות SS של 5, אם כי בחירת SS של 3 ניתן להעריך עם פרוטוקול זה כתב minigene ספציפי חייב לשמש14,33,34. יתר על כן, התוצאות יכולות להיות מושפעות מקו התא ויש להעריך אותן בקפידה כדי למנוע פרשנות שגויה בגלל פרופיל ההשתתפות החלופית של בזאלי.
בדרך כלל, הבדלים גדולים בתבנית splicing Minigene E1A נצפים רק בעת שינוי הביטוי של גורמי חלוקה. שינויים אחרים פחות ברורים בגלל המספר הגדול של חלבונים המווסתים את הפעילות של גורמים אלה. מסיבה זו, כאשר מתחילים מחקרים למועמד עקיף, הגישה הקלאסית, המבוססת על כמויות הולכות וגדלות של חלבון מועמד זה יש להעדיף. כאשר נצפתה השפעה מסוימת, ניתן לבצע את הטיפולים כדי לחקור אם הרגולציה יכולה להיות ספציפית לגירוי תאי מסוים.
לאחר תוצאה חיובית ראשונית, הסטנדרטיזציה של זמן וריכוז סמים יכולה להתבצע כדי לייעל את הניסוי.
פרוטוקול פשוט זה הוא בדיקה ראשונית, נקודת התחלה שיכולה לענות אם חלבון העניין מראה השפעה על חיבור חלופי וגם, כאשר השפעה מסוימת בוויסות חיבור חלופי כבר ידועה, יכול לכוון את המחקרים למסלול עקבי יותר שבו החלבון ממלא תפקיד ויסות חיבור חלופי בתגובת כימותרפיה.
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
אנו מודים Fundação de Amparo a Pesquisa do Estado de São Paulo (FAPESP, דרך גרנט Temático 2017/03489-1 ל- JK ואחווה ל FLB 2018/05350-3) ולקונסטליונל דה Desenvolvimento Cientifico e Tecnológico (CNPq) למימון מחקר זה. ברצוננו להודות לד"ר אדריאן קריינר על שסיפק את pMTE1A פלסמיד וזלר ועמיתיו על עבודתם בשיבוט E1A. אנו מודים גם לפרופ' ד"ר פטרישיה מוריאל, לפרופ' ד"ר וונדה פריירה אלמידה, לפרופ' מרסלו לנסלוטי ולפרופ' ד"ר קרינה קוגו קוגו מולר על כך שיאפשרו לנו להשתמש בשטח המעבדה ובציוד שלהם.
Materials
| Name | Company | Catalog Number | Comments |
| 100 pb DNA Ladder | Invitrogen | 15628-050 | |
| 6 wells plate | Sarstedt | 833920 | |
| Agarose | Sigma | A9539-250G | |
| Cisplatin | Sigma | P4394 | |
| DEPC water | ThermoFisher | AM9920 | |
| DMEM | ThermoFisher | 11965118 | |
| dNTP mix | ThermoFisher | 10297-018 | |
| Fetal Bovine Serum - FBS | ThermoFisher | 12657029 | |
| Fluorescent Microscope | Leica | DMIL LED FLUO | |
| Gel imaging acquisition system - ChemiDoc Gel Imagin System | Bio-Rad | ||
| GFP - pEGFPC3 | Clontech | ||
| HEK293 stable cells - HEK293 Flp-In | Generated from Flp-In™ T-REx™ 293 - Invitrogen and described in ref 21 | ||
| Hygromycin B | ThermoFisher | 10687010 | Used for Flp-In cells maintenemant |
| Image processing and analysis software - FIJI software | ref. 32 | ||
| Lipid- based transfection reagent - jetOPTIMUS Polyplus Reagent | Polyplus | 117-07 | |
| Oligo DT | ThermoFisher | 18418020 | |
| Paclitxel | Invitrogen | P3456 | |
| Plate Reader/ UV absorbance | Biotech | Epoch Biotek/ Take3 adapter | |
| pMTE1A plasmid | Provided by Dr. Adrian Krainer | ||
| pMTE1A F | Invitrogen | 5’ -ATTATCTGCCACGGAGGTGT-3 | |
| pMTE1A R | Invitrogen | 5’ -GGATAGCAGGCGCCATTTTA-3’ | |
| Refrigerated centrifuge | Eppendorf | F5810R | |
| Reverse Transcriptase - M-MLV | ThermoFisher | 28025013 | |
| Reverse transcriptase - Superscript IV | ThermoFisher | 18090050 | |
| Ribunuclease inhibitor RNAse OUT | ThermoFisher | 10777-019 | |
| RNA extraction phenol-chloroform based reagent - Trizol | ThermoFisher | 15596018 | |
| SybrSafe DNA gel stain | ThermoFisher | S33102 | |
| Taq Platinum | Thermo | 10966026 | |
| Tetracyclin | Sigma | T3383 | Used for Flag empty or Nek4- Flag expression induction |
| Thermocycler Bio-Rad | Bio-Rad | T100 | |
| Trypsin | Sigma | T4799 |
References
- Ule, J., Blencowe, B. J. Alternative Splicing Regulatory Networks: Functions, Mechanisms, and Evolution. Molecular Cell. 76 (2), 329-345 (2019).
- Pan, Q., Shai, O., Lee, L. J., Frey, B. J., Blencowe, B. J. Deep surveying of alternative splicing complexity in the human transcriptome by high-throughput sequencing. Nature Genetics. 40 (12), 1413-1415 (2008).
- Nilsen, T. W., Graveley, B. R. Expansion of the eukaryotic proteome by alternative splicing. Nature. 463 (7280), 457-463 (2010).
- Stamm, S. Signals and their transduction pathways regulating alternative splicing: a new dimension of the human genome. Human Molecular Genetics. 11 (20), 2409-2416 (2002).
- Kornblihtt, A. R., et al. Alternative splicing: a pivotal step between eukaryotic transcription and translation. Nature Reviews Molecular Cell Biology. 14 (3), 153-165 (2013).
- Zhong, X. -. Y., Ding, J. -. H., Adams, J. A., Ghosh, G., Fu, X. -. D. Regulation of SR protein phosphorylation and alternative splicing by modulating kinetic interactions of SRPK1 with molecular chaperones. Genes & Development. 23 (4), 482-495 (2009).
- Misteli, T., Cáceres, J. F., Clement, J. Q., Krainer, A. R., Wilkinson, M. F., Spector, D. L. Serine Phosphorylation of SR Proteins Is Required for Their Recruitment to Sites of Transcription In Vivo. Journal of Cell Biology. 143 (2), 297-307 (1998).
- Kanopka, A., et al. Regulation of adenovirus alternative RNA splicing by dephosphorylation of SR proteins. Nature. 393 (6681), 185-187 (1998).
- Anufrieva, K. S., et al. Therapy-induced stress response is associated with downregulation of pre-mRNA splicing in cancer cells. Genome Medicine. 10 (1), 49 (2018).
- Shultz, J. C., et al. SRSF1 Regulates the Alternative Splicing of Caspase 9 Via A Novel Intronic Splicing Enhancer Affecting the Chemotherapeutic Sensitivity of Non-Small Cell Lung Cancer Cells. Molecular Cancer Research. 9 (7), 889-900 (2011).
- Gabriel, M., et al. Role of the splicing factor SRSF4 in cisplatin-induced modifications of pre-mRNA splicing and apoptosis. BMC Cancer. 15, (2015).
- Lee, S. C. -. W., Abdel-Wahab, O. Therapeutic targeting of splicing in cancer. Nature Medicine. 22 (9), 976-986 (2016).
- Cooper, T. A. Use of minigene systems to dissect alternative splicing elements. Methods. 37 (4), 331-340 (2005).
- Stoss, O., Stoilov, P., Hartmann, A. M., Nayler, O., Stamm, S. The in vivo minigene approach to analyze tissue-specific splicing. Brain Research Protocols. 4 (3), 383-394 (1999).
- Zerler, B., et al. Adenovirus E1A coding sequences that enable ras and pmt oncogenes to transform cultured primary cells. Molecular and Cellular Biology. 6 (3), 887-899 (1986).
- Gattoni, R., Schmitt, P., Stevenin, J. In vitro splicing of adenovirus E1A transcripts: characterization of novel reactions and of multiple branch points abnormally far from the 3' splice site. Nucleic Acids Research. 16 (6), 2389-2409 (1988).
- Stephens, C., Harlow, E. Differential splicing yields novel adenovirus 5 E1A mRNAs that encode 30 kd and 35 kd proteins. The EMBO journal. 6 (7), 2027-2035 (1987).
- Ulfendahl, P. J., et al. A novel adenovirus-2 E1A mRNA encoding a protein with transcription activation properties. The EMBO journal. 6 (7), 2037-2044 (1987).
- Berk, A. J., Sharp, P. A. Structure of the adenovirus 2 early mRNAs. Cell. 14 (3), 695-711 (1978).
- Svensson, C., Pettersson, U., Akusjärvi, G. Splicing of adenovirus 2 early region 1A mRNAs is non-sequential. Journal of Molecular Biology. 165 (3), 475-495 (1983).
- Basei, F. L., Meirelles, G. V., Righetto, G. L., dos Santos Migueleti, D. L., Smetana, J. H. C., Kobarg, J. New interaction partners for Nek4.1 and Nek4.2 isoforms: from the DNA damage response to RNA splicing. Proteome Science. 13 (1), 11 (2015).
- Zhou, Z., et al. The Akt-SRPK-SR Axis Constitutes a Major Pathway in Transducing EGF Signaling to Regulate Alternative Splicing in the Nucleus. Molecular Cell. 47 (3), 422-433 (2012).
- Caceres, J., Stamm, S., Helfman, D., Krainer, A. Regulation of alternative splicing in vivo by overexpression of antagonistic splicing factors. Science. 265 (5179), 1706-1709 (1994).
- Zhong, X. -. Y., Ding, J. -. H., Adams, J. A., Ghosh, G., Fu, X. -. D. Regulation of SR protein phosphorylation and alternative splicing by modulating kinetic interactions of SRPK1 with molecular chaperones. Genes & Development. 23 (4), 482-495 (2009).
- Naro, C., et al. The centrosomal kinase NEK2 is a novel splicing factor kinase involved in cell survival. Nucleic Acids Research. 42 (5), 3218-3227 (2014).
- Lu, C. -. C., Chen, T. -. H., Wu, J. -. R., Chen, H. -. H., Yu, H. -. Y., Tarn, W. -. Y. Phylogenetic and Molecular Characterization of the Splicing Factor RBM4. PLoS ONE. 8 (3), 59092 (2013).
- Jarnæss, E., et al. Splicing Factor Arginine/Serine-rich 17A (SFRS17A) Is an A-kinase Anchoring Protein That Targets Protein Kinase A to Splicing Factor Compartments. Journal of Biological Chemistry. 284 (50), 35154-35164 (2009).
- Bressan, G. C., et al. Functional association of human Ki-1/57 with pre-mRNA splicing events. FEBS Journal. 276 (14), 3770-3783 (2009).
- Vivarelli, S., et al. Paraquat Modulates Alternative Pre-mRNA Splicing by Modifying the Intracellular Distribution of SRPK2. PLoS ONE. 8 (4), 61980 (2013).
- Russell, W. C., Graham, F. L., Smiley, J., Nairn, R. Characteristics of a Human Cell Line Transformed by DNA from Human Adenovirus Type 5. Journal of General Virology. 36 (1), 59-72 (1977).
- Aranda, P. S., LaJoie, D. M., Jorcyk, C. L. Bleach gel: A simple agarose gel for analyzing RNA quality. Electrophoresis. 33 (2), 366-369 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Bai, Y. Control of 3' splice site choice in vivo by ASF/SF2 and hnRNP A1. Nucleic Acids Research. 27 (4), 1126-1134 (1999).
- Cote, G. J., Nguyen, N., Lips, C. J. M., Berget, S. M., Gagel, R. F. Validation of an in vitro RNA processing system for CT/CGRP precursor mRNA. Nucleic Acids Research. 19 (13), 3601-3606 (1991).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.