Method Article
Tubulin'in Kontrollü Posttranslational Modifikasyonlar ve Sınırlı Kaynaklardan İzotiplerle Polimerizasyon-Depolimerizasyon Döngüleri ile Saflaştırılması
Bu Makalede
Özet
Bu protokol, polimerizasyon ve depolimerizasyon döngüleri kullanılarak kültürlü hücreler veya tek fare beyinleri gibi küçük/orta ölçekli kaynaklardan tübulin saflaştırmayı açıklar. Saflaştırılmış tubulin belirli izotiplerde zenginleştirilmiştir veya spesifik posttranslational modifikasyonlara sahiptir ve mikrotübül dinamiklerini ve etkileşimlerini incelemek için in vitro rekonsiyel testlerinde kullanılabilir.
Özet
Mikrotübül sitoskeleton çalışmalarının önemli bir yönü, in vitro rekonseptüs deneylerinde mikrotübül davranışının araştırılmasıdır. Dinamikler gibi mikrotübüllerin içsel özelliklerinin ve mikrotübül ilişkili proteinlerle (VIP' ler) etkileşimlerinin analizine izin verirler. "Tübulin kodu", mikrotübül özelliklerinin ve işlevlerinin düzenleyicileri olarak farklı tubulin izotiplerine ve çeşitli posttranslational değişikliklere (PTM' ler) işaret eden gelişmekte olan bir kavramdır. Tübulin kodunun moleküler mekanizmalarını keşfetmek için, belirli izotiplere ve PTM'lere sahip saflaştırılmış tubulin kullanarak in vitro rekonste deneyleri yapmak çok önemlidir.
Bugüne kadar, in vitro deneylerde yaygın olarak kullanılan, birçok PTM'yi barındıran ve tanımlanmış bir izotip bileşimine sahip olan beyin tübulini teknik olarak zordu. Bu nedenle, tübulini farklı kaynaklardan ve farklı izotip bileşimleri ve kontrollü PTM'lerden arındırmak için, polimerizasyon ve depolimerizasyon döngülerinin klasik yaklaşımını kullanarak bu protokolü geliştirdik. Benzeşim saflaştırmasına dayanan mevcut yöntemlerle karşılaştırıldığında, bu yaklaşım saf, polimerizasyona yetkin tübulin verir, çünkü polimerizasyona veya depolimerizasyona dirençli tübulin ardışık saflaştırma adımları sırasında atılır.
Tübulinin hücre çizgilerinden arındırılmasını, süspansiyonda veya bağlı kültürler olarak ve tek fare beyinlerinden tanımlarız. Yöntem ilk olarak hem süspansiyon hem de yapışık ayarlarda hücre kütlesinin neslini, lizis adımını, ardından polimerizasyon-depolimerizasyon döngüleri ile tübulin saflaştırmanın ardışık aşamalarını açıklar. Yöntemimiz, tübulin kodunun mikrotübüllerin içsel özellikleri ve ilişkili proteinlerle mikrotübül etkileşimleri üzerindeki etkisini ele alan deneylerde kullanılabilecek tübulin verir.
Giriş
Mikrotübüller birçok hücresel işlemde kritik roller oynar. Hücrelere şekillerini verirler, kromozom ayrımı için meiotik ve mitotik iğler oluştururlar ve hücre içi taşıma için izler görevi ederler. Bu farklı işlevleri yerine getirmek için mikrotübüller kendilerini farklı şekillerde düzenlerler. Alandaki merak uyandırıcı sorulardan biri, yapısal ve evrimsel olarak korunmuş mikrotübüllerin bu organizasyon ve işlev bolluğuna uyum sağlamasını sağlayan moleküler mekanizmaları anlamaktır. Potansiyel mekanizmalardan biri, 'tübulin kodu'1,2,3olarak bilinen kavram tarafından tanımlanan mikrotübüllerin çeşitlendirilmesidir. Tubulin kodu iki ana bileşen içerir: α ve β-tubulin gen ürünlerinin (tubulin izotipleri) mikrotübüllere ve tübulin posttranslational modifikasyonlara (PTM' ler) diferansiyel olarak dahil edildi.
1970'lerden bu yana, in vitro rekonstrüs deneyleri, gelişen ışık mikroskopi teknikleri ile birlikte, mikrotübüllerin özellikleri hakkında önemli keşiflerin önünü açmıştır: dinamik dengesizlik4 ve koşu bandı5ve diğer mekanizmaları ve işlevleri 6,7,8,9,10,11,12,13,14,15. Şimdiye kadar yapılan hemen hemen tüm in vitro deneyler, tekrarlanan polimerizasyon ve depolimerizasyon döngüleri kullanılarak beyin dokusundan saflaştırılmış tübulin bazlıdır16,17. Beyin dokusundan arınma, yüksek kaliteli tübulin elde etmenin avantajını büyük miktarlarda (genellikle gram miktarlar) sağlasa da, beyin dokusundan saflaştırılmış tübulin farklı tubulin izotiplerinin bir karışımı olduğu ve birçok tübulin PTM'si ile zenginleştirilmiş olması nedeniyle önemli bir dezavantaj heterojenliktir. Bu heterojenlik, mikrotübül özelliklerinin ve işlevlerinin kontrolünde belirli bir tübulin PTM'nin veya izotipin rolünü tanımlamayı imkansız kılar. Bu nedenle, tübulin kodunun moleküler mekanizmalarını ele almak için kontrollü tübulin PTM'leri ve homojen izotip bileşimi ile montaja yetkin tubulin üretmek esastır.
Son zamanlarda, maya Stu2p'in mikrotübül bağlayıcı TOG (tümör aşırı ekspresyonlu gen) etki alanını kullanarak tubulin'i benzeşim kromatografisi ile arındırmak için bir yaklaşım geliştirilmiştir18. Bu yöntemde, hücrelerin veya dokunun kabalyatlarındaki tübulin, matris immobilize TOG etki alanına bağlandığı bir sütundan geçirilir, bu da belirli bir, hatta çok küçük bir örneğin tüm tübulin havuzunun analizini sağlar. Rekombinant tübulin saflaştırmak için uzun zamandır beklenen bir yaklaşım da son yıllarda tanımlanmıştır. α ve β-tubulin genleri içeren iki cistronic vektörün böcek hücrelerinde ifade edildiği baculovirüs sistemine dayanmaktadır19. Bununla birlikte, bu yöntem çok hantal ve zaman alıcıdır ve bu nedenle çoğunlukla tubulin mutasyonları20 ve tubulin izotipleri21 , 22,23in vitro etkisini incelemek için kullanılır.
Mevcut protokolde, hücre çizgilerinden veya fare beyin dokusundan farklı modifikasyon seviyelerine sahip tübulin oluşturmak için köklü ve yaygın olarak kullanılan polimerizasyon-depolimerizasyon yaklaşımını kullanan bir yöntemi bir plan olarak tanımlıyoruz24. Bu prosedürde, tübulin çözünür (4 °C'de tübulin dimer) ve polimerize form (guanosin 5'-trifosfat [GTP] varlığında 30 °C'de mikrotübül) arasında döngüye girer. Her form ardışık santrifüjleme adımlarıyla ayrılır: tübulin dimerler soğuk (4 °C) bir dönüşten sonra süpernatanta kalırken, mikrotübüller 30 ° C'de peletlenecektir. Ayrıca, mikrotübül ilişkili proteinlerin mikrotübüllerden ve böylece son olarak saflaştırılmış tübulinden uzaklaştırılmasını sağlayan yüksek piperazin-N,N′-bis(2-etanesülfonic asit) (PIPES) konsantrasyonda bir polimerizasyon adımı gerçekleştirilir. Süspansiyon veya yapışık kültürler olarak yetiştirilen HeLa S3 hücrelerinden arındırılmış Tubulin, herhangi bir tübulin PTM'sinden neredeyse ücretsizdir ve son in vitro reconstitution deneylerindekullanılmıştır 25,26,27,28. Tubulin izotiplerinde ve PTM'lerde değişikliklerle çok sayıda fare modeli için kullanılabilecek tubulin'i tek fare beyinlerinden arındırma yöntemini daha da uyarladık.
Protokolde, ilk olarak kaynak materyalin (hücre kütlesi veya beyin dokusu), lizizinin(Şekil 1A)neslini ve ardından tübulini arındırmak için tübulin polimerizasyonu ve depolimerizasyonunun ardışık adımlarını açıklıyoruz (Şekil 1B). Saflaştırılmış tübulinin saflığını (Şekil 2A,B) ve miktarını (Şekil 3A,B) değerlendirmek için süreci daha ayrıntılı olarak açıklıyoruz. Yöntem, tübulin saflaştırmadan önce hücrelerde bir modifiye enzimi aşırı ifade ederek seçilen bir PTM ile zenginleştirilmiş tübulin üretmek için uyarlanabilir (Şekil 4B). Alternatif olarak, saflaştırma işlemi sırasında tübulin modifiye edici enzimler tubulin eklenebilir. Son olarak, spesifik izotiplerden veya PTM'lerden yoksun tübulini, ilgili tübulin değiştirici enzimlerde eksik olan farelerin beyinlerinden arındırabiliriz (Şekil 4B)29.
Burada tarif ettiğimiz yöntemin iki temel avantajı vardır: (i) nispeten kısa sürede yeterince büyük miktarlarda tübulin üretimine izin verir ve (ii) spesifik tubulin izotip bileşimi veya PTM'leri ile yüksek kaliteli, saf tubulin üretir. Bu makalenin ilişkili videosunda, bu prosedürde yer alan bazı kritik adımları vurguluyoruz.
Protokol
Hayvan bakımı ve bu çalışma için kullanımı Avrupa Topluluğu'nun önerileri doğrultusunda (2010/63/UE) gerçek gerçekleştirildi. Deneysel prosedürler, Uluslararası yönergelere uygun olarak Institut Curie CEEA-IC #118 etik komitesi (Ulusal Otorite tarafından verilen 04395.03 yetki) tarafından özel olarak onaylanmıştır.
1. Tübulin Saflaştırması için Reaktiflerin Hazırlanması
NOT: Tübulin saflaştırması için kullanılan tüm tamponlar potasyum tuzları içermeli ve sodyum tuzları içermemelidir30.
- Tam ortamın 1 L'sini hazırlayın: Dulbecco'nun modifiye Kartal ortamı (DMEM), %10 fetal sığır serumu (FBS, 100 mL), 200 mM L-glutamin (10 mL 2 M stok) ve 1x penisilin-streptomisin (100x stokun 10 mL'si). 4 °C'de saklayın.
- 140 g KOH'u suda eriterek 10 M potasyum hidroksit (KOH) hazırlayın, son hacmi 250 mL'ye ayarlayın ve oda sıcaklığında saklayın.
- 36,5 g EDTA'yı suda eriterek 0,5 M etilenediamin tetraasetik asit (EDTA), pH 8 hazırlayın, KOH kullanarak pH'ı 8,0'a ayarlayın (aksi takdirde EDTA çözülmez) ve son hacmi 250 mL'ye ayarlayın, filtre sterilize edin ve oda sıcaklığında saklayın.
- 500 mL PBS'ye 5 mL 0,5 M EDTA ekleyerek 5 mM fosfat tamponlu salin (PBS)-EDTA hazırlayın, filtreleyin ve oda sıcaklığında saklayın.
- 75,5 g BORUYU suda eriterek 0,5 M K-PIPES, pH 6,8 hazırlayın, KOH ile pH 6,8'e ayarlayın (aksi takdirde PIPES çözülmez) ve son hacmi 500 mL'ye ayarlayın, filtreleyin ve 4 °C'de saklayın.
- 15,1 g BORUYU suda eriterek 1 M K-PIPES, pH 6,8 hazırlayın, KOH ile pH 6,8'e ve son hacme 50 mL'ye ayarlayın, filtre sterilize edin ve 4 °C'de saklayın.
- 0.5 M potasyum-etilen glikol-bis(β-aminoetil eter)-N,N,N′, N′-tetraasetik asit (K-EGTA, pH 7.7) 47,5 g EGTA'yı suda eriterek KOH ile pH 7.7'ye ve son hacme 250 mL'ye ayarlayın, filtreleyin ve oda sıcaklığında saklayın.
- BRB80 (80 mM K-PIPES, pH 6.8; 1 mM K-EGTA; 1 mM magnezyum klorür [MgCl2]) çözeltisi, 0.5 M PIPES'in 3.2 mL'si, 40 μL'si 0.5 M K-EGTA ve 20 μL'si 1 M MgCl2 karıştırılarak son sesi 20 mL'ye ayarlayın. 4 °C'de saklayın.
- 25 mL'lik son bir hacim elde etmek ve -20 °C'de saklamak için izopropanolde 435 mg PMSF çözerek 0,1 M fenilmethanesülfonil florür (PMSF) hazırlayın.
- 2,5 mL'lik son bir hacim elde etmek için suda 10 mg aprotinin, 10 mg leupeptin ve 10 mg 4-(2-aminoetil)-benzenesülfonil florür çözerek proteaz inhibitörleri karışımını (200x) hazırlayın, 100 μL'lik aliquots yapın ve -20 °C'de saklayın.
- 45 mL suda 5 mL Triton X-100 karıştırarak% 10 Triton X-100 hazırlayın, filtreleyin ve oda sıcaklığında saklayın.
- Lizis tamponu hazırlayın (BRB80, 1 mM 2-mercaptoethanol, 1 mM PMSF, 1x proteaz inhibitörleri karışımı ve isteğe bağlı olarak HEK-293 hücreleri için, 0.2% Triton X-100) tubulin saflaştırma gününde 20 mL BRB80'i 1.5 μL 2-mercaptoethanol, 200 μL 0.1 M PMSF, 100 μL proteaz inhibitörleri karışımı ve isteğe bağlı olarak HEK-293 hücreleri ile karıştırarak , %10 Triton X-100'ün 400 μL'si.
NOT: 2-mercaptoethanol toksiktir ve duman kaputunda kullanılmalıdır. - 1 g GTP'yi 9,5 mL suda eriterek 0,2 M GTP hazırlayın, KOH kullanarak pH'ı 7,5'e ayarlayın, 20 μL'lik aliquotlar yapın ve -20 °C'de saklayın. Tekrarlanan donma-çözülme döngülerinden kaçının.
- 60,56 g Tris'i suda eriterek 1 M tris (hidroksimetil) aminomethane-hidroklorür (Tris-HCl) hazırlayın, HCl ile pH 6.8'e ayarlayın, 500 mL'lik son hacme kadar tamamlayın, filtre sterilize edin ve oda sıcaklığında saklayın.
- 5x Laemmli numune tamponu hazırlayın (450 mM dithiothreitol (DTT); %10 sodyum dodecylsulfate (SDS); 400 μM Tris-HCl, pH 6.8; %50 gliserol; ~%0.006 bromofenol mavisi) önceden ısıtılmış 1 M Tris-HCl, pH 6.8'in 16 mL'sine 4 g SDS ekleyerek çözeltiyi nazikçe karıştırın. Karışıma 2,6 g DTT ve %100 gliserol 20 mL ekleyin ve çözelti homojen hale gelene kadar karıştırın. Gerekli renk yoğunluğuna ulaşmak için istediğiniz miktarda bromofenol mavisi (2,5 mg) ekleyin. 5 mL aliquots yapın ve -20 °C'de saklayın. Damıtılmış suda 5x stoku seyrelterek Laemmli numune tamponunun 2x çalışma solüsyonunu hazırlayın.
2. Tübulin amplifikasyon ve hasat kaynakları
NOT: Bu protokolde üç tubulin kaynağı kullanılmıştır: (i) süspansiyon kültürü olarak yetiştirilen hücreler (HeLa S3 ve HEK-293); (ii) yandaş kültürler olarak yetiştirilen hücreler (HEK-293, HeLa ve U2 OS); ve (iii) fare beyin dokusu. Bu protokol tübulin arınma gününü '0. gün' olarak kabul eder ve buna göre 0. güne göre diğer adımlar tanımlanmıştır.
- Hücrelerin Amplifikasyonu
- Süspansiyon Kültürü Olarak Yetiştirilen Hücreler
NOT: Tübulini süspansiyon kültürlerinden başarıyla arındırmak için en az 2 L süspansiyon kültürü kullanın.- 2 L süspansiyon kültürü için, hazırlık gününden 10 gün önce 6 × 107 hücre elde etmek için tercih edilen hücre tipini canlandırın ve büyütün. -10. günde, plaka başına 107 hücrede altı adet 15 cm çapında tabak hücresi.
- -8 gün içinde, gerekli tam orta miktarını önceden 37 °C'ye ısıtın. Steril koşullarda her spinner şişesine 1 L önceden ısıtılmış ortam ekleyin. Spinnerları hücre kültürü inkübatörünün içinde 20-25 rpm'de ayarlanmış bir karıştırıcı tablasına yerleştirin, ortamın inkübatör atmosferine denge kurmasını sağlamak için yanal spinner kapaklarını hafifçe açın.
NOT: Herhangi bir kirlenmeyi önlemek için, ortamın dış yüzeyini ve spinner şişelerini% 70 etanol kullanarak iyice temizleyin. - -7. günde, %80-90 izdihama (yaklaşık 1,8 × 108 hücre) yetiştirilen hücreleri trypsinize edin ve toplayın. Bir seferde 3 tabaktan hücre toplayın, aşağı çevirin (200 × g,5 dk, oda sıcaklığı) ve tüm hücreleri 10 mL DMEM'de yeniden askıya alın.
NOT: Bu noktada hücrelerin iyice ayrışması, spinner şişelerinde hücre sağkalımını etkileyen ve düşük tübulin verimi ile sonuçlanan daha büyük agregaların oluşumunu önlemek için çok önemlidir. - 1 L DMEM içeren her spinner şişesine 5 mL hücre süspansiyonu ekleyin, iplikçileri hücre kültürü inkübatöründeki karıştırıcı tabloya geri verin ve hücrelerin bir hafta boyunca büyümesine izin verin.
- Bağlı Kültürler Olarak Yetiştirilen Hücreler
NOT: Tübulini yapışık hücrelerden başarıyla arındırmak için en az 10 tabak% 80-90 izdiham kullanın.- Tübulin hazırlama gününden üç gün önce 1 × 108 hücre elde etmek için istenen hücre tipini canlandırın ve güçlendirin.
- -3. günde, bu hücreleri tabak başına 1 × 107hücrede on 15 cm'lik yemeklere tabaklayın ve% 80-90 izdiham yaşamalarını sağlar.
- -1. günde, gerekirse, tübulin modifiye edici bir enzimi veya belirli bir tübulin izotipini ifade etmek için hücreleri bir plazmid ile transfect.
- Süspansiyon Kültürü Olarak Yetiştirilen Hücreler
- Hücrelerin/Beyin Dokusunun Toplanması
- Süspansiyon Kültürü Olarak Yetiştirilen Hücreler
- Hücre süspansiyonu iplikçilerden 1 L santrifüj şişelerine (Malzeme Masası)ve pelet hücrelerine 250 × g, 15 dk, oda sıcaklığında aktarın. Spinner şişelerinde hela S3 hücrelerinin başka bir kültürünü hemen başlatmak için, iplikçilerde 100 mL hücre süspansiyonu bırakın ve spinner şişesine 1 L komple, önceden ısıtılmış DMEM ekleyin.
NOT: Tübulin saflaştırmasına geçmeden önce bakteriyel kontaminasyon olup olmadığını dikkatlice kontrol edin. - Peletlenmiş hücreleri her santrifüj şişesinden 10 mL buz gibi PBS'de yeniden depolayın ve tüm hücreleri 50 mL vidalı kapak tüplerine aktarın. Yeniden süspansiyon sırasında hücreleri buzda tutun. Hücreleri 250 × g,15 dk, 4 °C'de pelet.
NOT: Spinner şişe temizleme ve depolama için önerileri izleyin (bkz. Malzeme tablosu). - Üstnatant atın ve hücre peletinin hacmini belirleyin. 2 L süspansiyon kültüründen (iki spinner şişe), 5-6 mL'lik bir hücre peleği bekleyin.
NOT: Aşağıda açıklanan protokolde hücre pelet hacminin 10 mL olduğu varsayıldır. Deneyi pelet hacimlerine göre ayarlayın. - 1 birim (10 mL) lizis tamponu ekleyin ve hücre peletini yeniden askıya alın.
NOT: Hücre pelet hacminin lizis tampon hacmine oranı başarılı tubulin saflaştırması için çok önemlidir. Daha fazla lizis tamponu eklemek tübulin konsantrasyonunu azaltır, bu da polimerizasyon için gereken kritik konsantrasyona ulaşamaz, böylece tübulin verimini büyük ölçüde azaltır.
NOT: Liziz tamponunda yeniden depolanan hücreler sıvı nitrojende çıtlatılabilir ve iki ay boyunca -80 °C'de saklanabilir.
- Hücre süspansiyonu iplikçilerden 1 L santrifüj şişelerine (Malzeme Masası)ve pelet hücrelerine 250 × g, 15 dk, oda sıcaklığında aktarın. Spinner şişelerinde hela S3 hücrelerinin başka bir kültürünü hemen başlatmak için, iplikçilerde 100 mL hücre süspansiyonu bırakın ve spinner şişesine 1 L komple, önceden ısıtılmış DMEM ekleyin.
- Bağlı Kültürler Olarak Yetiştirilen Hücreler
NOT: Başarılı tubulin saflaştırması için yapışan kültürlerden hücreler çok hızlı bir şekilde hasat edilmelidir (on 15 cm'lik yemeklerin toplanması için yaklaşık 15 dakika). Protokolün bu adımına üç kişi katıldı.- Bulaşıkları eğimli olarak 15 cm'lik tabaklardan ortamı çıkarın ve ardından hücreleri oda sıcaklığında 7 mL PBS-EDTA ile hafifçe yıkayın (kişi 1). Hücreleri orta veya tampon olmadan bırakmamak için aynı anda sadece üç 15 cm'lik yemekle çalışın.
- Hücrelere 5 mL PBS-EDTA ekleyin ve oda sıcaklığında 5 dakika kuluçkaya yatırın.
- Hücreleri kabın bir kenarına kürek çekerek (kişi 2) yavaşça ayırmak için bir hücre kaldırıcı kullanın ve tüm hücreleri 50 mL vidalı kapak tüpünde toplayın (kişi 3). Bulaşıklardan kalan hücreleri toplamak için her tabağı 2 mL pbs-EDTA ile durulayın. Bu adım sırasında, hücre süspansiyonu içeren 50 mL vidalı kapak tüpünü buz üzerinde tutun.
- Hücreleri 250 × g,10 dk, 4 °C'de pelet. Üstnatant atın ve hücre peletinin hacmini belirleyin. On 15 cm'lik yemeklerden ~1 mL'lik bir hacim bekleyin.
NOT: Aşağıda açıklanan protokolde hücre pelet hacminin 10 mL olduğu varsayıldır. Deneyleri pelet hacimlerine göre ayarlayın. - Hücreleri 1 birim (10 mL) lizis arabelleği içinde yeniden biriktirin.
NOT: Lizis tamponunda yeniden depolanan hücreler -80 °C'de iki aya kadar saklanabilir.
- Beyin Dokusu
NOT: Herhangi bir yaşta, cinsiyete veya genetik geçmişe sahip fareler kullanılabilir. Transgenik fare suşunun seçimi, ele alınacak bilimsel soruya bağlı olacaktır. Bu yazıda, ttll1-/- fareden arındırılmış, büyük bir beyin glutamylating enziminden yoksun tubulin tirozin ligaz benzeri 1 (TTLL1) protein31örneğini gösteriyoruz.- Fareyi servikal çıkık ile kurban edin, hızla kafasını koparın ve beyni yuvarlak bir alt tüpe toplayın. Beyinde fazla kan varsa, lizis tamponu ile hızlı bir şekilde yıkayın. Ölüm sonrası gecikme tübulin saflaştırma başarısını etkileyebileceğinden, fare kurban edilir edilir etmez beyni toplayın. Homojenizasyon için kullanılan probun genişliğine uyum sağlamak için yuvarlak tabanlı tüpler kullanın.
NOT: Toplanan fare beyinleri sıvı nitrojen içinde çıtlatılabilir ve 3 yıla kadar -80 °C'de saklanabilir. - Yetişkin bir fareden çıkarılan tek bir beyne 500 μL lizis tamponu ekleyin. Protokolün geri kalanı için, eklenen lizis arabelleği hacminin 10 mL olduğu varsayılır. Kullanılacak beyin sayısına göre deneyinize göre ayarlayın.
- Fareyi servikal çıkık ile kurban edin, hızla kafasını koparın ve beyni yuvarlak bir alt tüpe toplayın. Beyinde fazla kan varsa, lizis tamponu ile hızlı bir şekilde yıkayın. Ölüm sonrası gecikme tübulin saflaştırma başarısını etkileyebileceğinden, fare kurban edilir edilir etmez beyni toplayın. Homojenizasyon için kullanılan probun genişliğine uyum sağlamak için yuvarlak tabanlı tüpler kullanın.
- Süspansiyon Kültürü Olarak Yetiştirilen Hücreler
3. Hücrelerin veya Beyin Dokusunun Lizisi
- Süspansiyon Kültürü Olarak Yetiştirilen Hücreler
- HEK-293 için, farklı genişliklerdeki pipet uçlarını kullanarak tekrar tekrar yukarı ve aşağı pipetleme yaparak buz üzerindeki hücreleri uzatır. İlk olarak, 10 mL pipete bir p1000 ucu takın ve hücre süspansiyonunu her 5 dakikada bir, 10 dakika boyunca (üç pipetleme döngüsü) pipetlayın. İkinci olarak, bir p1000 ucuna bir p200 ucu ve 20 dakika boyunca her 5 dakikada bir daha pipet takın (beş pipetleme döngüsü).
- HeLa S3 için, hücreleri Fransız presi kullanarak ıslatın (ayarlar için Malzeme Tablosu'na bakın).
- Lizis karışımının (L)1/100'üncü hacmini (20 mL L için 200 μL) alın ve aynı hacimde 2x Laemmli tampon ekleyin, 5 dakika kaynatın ve daha fazla analiz için -20 °C'de saklayın.
- Bağlı Kültürler Olarak Yetiştirilen Hücreler
- Hücreleri sonicator probuna uyum sağlamak için yüksekliği azaltılmış 14 mL yuvarlak tabanlı bir tüpe aktarın (ayarlar için Malzeme Tablosu'na bakın). Hücreleri ~45 darbe için sonicate ve bir mikroskop altında lizis karışımı bir damla örnekleme ile hücre liziz onaylamak.
NOT: Bakliyat sayısı tübulin saflaştırmada kullanılan hücre tipine göre değişiklik gösterebilir. Hücrelerin çok fazla sonicating tubulin çökelmesine neden olabilir ve saflaştırma verimini olumsuz yönde etkileyecektir. - Bir p200 ucu kullanarak, hücreleri 20 dakika boyunca (beş pipetleme döngüsü) her 5 dakikada bir buz üzerinde yukarı ve aşağı borulayın.
- 1/100th hacimli lizis karışımı (L) (20 mL L için 200 μL) alın ve aynı hacimde 2x Laemmli tampon ekleyin, 5 dakika kaynatın ve daha fazla analiz için -20 ° C'de saklayın.
- Hücreleri sonicator probuna uyum sağlamak için yüksekliği azaltılmış 14 mL yuvarlak tabanlı bir tüpe aktarın (ayarlar için Malzeme Tablosu'na bakın). Hücreleri ~45 darbe için sonicate ve bir mikroskop altında lizis karışımı bir damla örnekleme ile hücre liziz onaylamak.
-
Beyin Dokusu
- Beyin dokusunu bir doku karıştırıcısı kullanarak lyse (ayarlar için Malzeme Tablosu'na bakın). Alternatif olarak, bir mikrotüp pestle veya eşdeğer bir ekipman kullanarak dokuyu izne haline ve pipet 18 G iğneli 1 mL şırınga ile buz üzerinde yukarı ve aşağı.
- 1/100th hacimli lizis karışımı (L) (20 mL L için 200 μL) alın ve aynı hacimde 2x Laemmli tampon ekleyin, 5 dakika kaynatın ve daha fazla analiz için -20 °C'de saklayın.
4. Tübulin Saflaştırılması
- Lisat Açıklaması
- Lizatı (liziz karışımının pelet ve çözünür kısmını ayırarak) 150.000 × g, 4 °C, 30 dk'da santrifüjleme ile temizleyin. Ultracentrifuge rotorlar ve tüpler hakkında ayrıntılı bilgi için Malzeme Tablosu'nu görün. Hücre özleri için, santrifüjlemeden sonra genellikle beyaz bir yüzen tabaka oluşur. Tübulin polimerizasyonuna müdahale ettiği için bu kayan tabakayı süpernatant ile birlikte aktarmayın. Yüzen tabakayı bozmadan süpernatantı hafifçe çıkarmak için uzun bir 20 G veya 21 G iğneye bağlı uygun hacimde bir şırınga kullanın. Süpernatant hala bulutluysa, 5.000 × g, 10 dakika boyunca 4 °C'de santrifüj.
- Süpernatantı (SN1) bir ultrasantrifüj tüpüne aktarın ve hacmini not edin. 10 mL hücre pelet için, SN1 için ~12 mL'lik bir hacim bekleyin.
- 1/100th hacimli SN1 (12 mL SN1 için 120 μL) alın ve aynı hacimde 2x Laemmli tampon ekleyin, 5 dakika kaynatın ve daha fazla analiz için -20 °C'de saklayın.
- Peletin (P1) BRB80'de(Malzeme Tablosu)SN1 ile aynı hacmi kullanarak yeniden biriktirin. P1'in 1/100.hacmini (20 mL P1 için 200 μL) alın ve aynı hacimde 2x Laemmli tampon ekleyin, 5 dakika kaynatın ve daha fazla analiz için -20 °C'de saklayın.
- Düşük Molarite Tamponunda İlk Polimerizasyon
- 1 hacim SN1 (12 mL), 1/200th hacimli 0,2 M GTP (60 μL; son konsantrasyon 1 mM) ve 0,5 hacim önceden ısıtılmış gliserol (6 mL) uygun hacimdeki bir vidalı kapak tüpünde birleştirerek polimerizasyon karışımını hazırlayın.
NOT: Gliserol, protokol boyunca polimerizasyon adımlarında bir kalabalık madde olarak kullanılır ve bu nedenle diğer bileşenlerin konsantrasyonlarının hesaplanmasında dikkate alınmaz. - Pipet karışımı yukarı ve aşağı, hafifçe hava kabarcıkları oluşumunu önlemek ve uygun ultracentrifuge tüplere aktarın.
NOT: Karışımı tüplere aktarırken, tüplerin ağırlığını ayarlayın (çiftler halinde). Bu, deneycinin polimerizasyon adımından sonra doğrudan mikrotübüllerin tortulasyonuna devam etmesini sağlar. Protokol boyunca tüm polimerizasyon adımları için bunu yapın. - Tüpleri parafilm ile örtün, 30 ° C'de ayarlanmış bir su banyosuna aktarın ve 20 dakika kuluçkaya yatırın.
- Tüpleri 150.000 × g, 30 °C'de 30 dakika santrifüj edin. Süpernatantı (SN2) çıkarın ve polimerize mikrotübüllerin (P2) peletini saklayın.
NOT: Mikrotübül pelet çıtlatılabilir ve 1 yıla kadar -80 °C'de saklanabilir. - 1/200. SN2 hacmini (18 mL SN2 için 90 μL) alın ve aynı hacimde 2x Laemmli tampon ekleyin, 5 dakika kaynatın ve daha fazla analiz için -20 °C'de saklayın.
- 1 hacim SN1 (12 mL), 1/200th hacimli 0,2 M GTP (60 μL; son konsantrasyon 1 mM) ve 0,5 hacim önceden ısıtılmış gliserol (6 mL) uygun hacimdeki bir vidalı kapak tüpünde birleştirerek polimerizasyon karışımını hazırlayın.
- İlk Depolymerization
- P2 peletine buz gibi BRB80 ekleyerek mikrotübülleri depolymerize edin ve 5 dakika boyunca buz üzerinde bırakın: hücrelerden tübulin için 1/60th (200 μL) ekleyin ve beyinlerden tübulin için SN1'in hacminin 1/20'si (600 μL) ekleyin.
NOT: Depolimerizasyon adımları sırasında pelete eklenen buz gibi BRB80 hacmi her zaman SN1'in hacmine göredir. - Çözelti tamamen homojen olana kadar hava kabarcıklarından kaçınarak mikrotübül peletini nazikçe yeniden kullanın. Birkaç pipetleme döngüsü için bir p1000 ucu ve ardından her 5 dakikada bir p200 ucu, 20 dakika (beş pipetleme döngüsü) kullanın. Bu, tübulin saflaştırmasının başarısı için çok önemli bir adımdır.
- Çözeltiyi uygun ultrasantrifüj tüplere aktarın ve 20 dakika boyunca 150.000 × g,4 °C'de aşağı doğru döndürün. SN3'i yeni bir 1,5 mL ultrasantrifüj tüpüne aktarın. Bu santrifüjleme adımından (P3) sonra oluşan pelet, çökemiş proteinler (mikrotübül ilişkili proteinler veya MAP'ler) ve depolimerize edilmemiş mikrotübüller içerir. Süpernatant (SN3) çözünür bileşenler içerir: depolymerize edilmiş tübül dimerleri ve DEPOLYMERIZED mikrotübüllerden ayrılan MAP'ler.
- 1–4 μL SN3 alın ve 9 cilt 2x Laemmli tampon ekleyin, 5 dakika kaynatın ve daha fazla analiz için -20 °C'de saklayın.
- PELET P3'ü BRB80'de (aynı SN3 hacminde) yeniden depolayın, 1-4 μL alın ve 9 cilt 2x Laemmli tampon ekleyin, 5 dakika kaynatın ve -20 °C'de saklayın.
- P2 peletine buz gibi BRB80 ekleyerek mikrotübülleri depolymerize edin ve 5 dakika boyunca buz üzerinde bırakın: hücrelerden tübulin için 1/60th (200 μL) ekleyin ve beyinlerden tübulin için SN1'in hacminin 1/20'si (600 μL) ekleyin.
- İkinci Polimerizasyon (Yüksek Molarite Tamponunda)
- 1 hacim SN3 (200 μL), 1 hacim önceden ısıtılmış 1 M PIPES (200 μL, son konsantrasyon 0,5 M), 1/100 0,2 M GTP hacmi (2 μL, son konsantrasyon 1 mM) ve uygun hacimdeki bir tüpte 1 hacim önceden ısıtılmış gliserol (200 μL).
- Hava kabarcıklarının oluşumunu önleyerek yukarı ve aşağı karışımı pipetlayın ve ultracentrifuge tüplerine aktarın.
- Tüpleri parafilm ile örtün, 30 ° C'de ayarlanmış bir su banyosuna aktarın ve 20 dakika kuluçkaya yatırın.
- Tüpleri 30 dakika boyunca 150.000 × g,30 °C'de santrifüj edin. Süpernatantı (SN4) çıkarın ve polimerize mikrotübüllerin peletini (P4) saklayın. Pelet P4 polimerize mikrotübülleri içerir ve süpernatanT SN4, elverişsiz tübül, MAP'ler ve diğer çözünür proteinleri içerir.
NOT: İkinci polimerizasyon adımından sonraki mikrotübül pelet çıtlatılabilir ve 1 yıla kadar -80 °C'de saklanabilir. - 1–4 μL alın ve 9 cilt 2x Laemmli tampon ekleyin, 5 dakika kaynatın ve daha fazla analiz için -20 °C'de saklayın.
- İkinci Depolymerization
- P4 peletine buz gibi BRB80 ekleyerek mikrotübülleri depolymerize edin ve 5 dakika boyunca buz üzerinde bırakın: hücrelerden tübulin için 1/100th (120 μL) ekleyin ve beyinlerden tübulin için SN1 hacminin 1/40'ını (300 μL) ekleyin.
- Pipet yukarı ve aşağı her 5 dakikada bir p200 ucu ile, 20 dakika boyunca (beş pipetleme döngüsü).
- Çözeltiyi 1,5 mL ultracentrifuge tüpe aktarın ve 20 dakika boyunca 150.000 × g,4 °C'de aşağı doğru döndürün. SN5'i yeni bir 1,5 mL ultracentrifuge tüpüne aktarın. Bu santrifüjleme adımından (P5) sonra oluşan pelet depolimerize olmayan mikrotübüller içerir. Süpernatant (SN5) çözünür tubulin içerir.
- 1–4 μL alın ve 9 cilt 2x Laemmli tampon ekleyin, 5 dakika kaynatın ve daha fazla analiz için -20 °C'de saklayın.
- PELET P5'i BRB80'de (aynı hacimde SN5) yeniden depolayın, 1-4 μL alın ve 9 cilt 2x Laemmli tampon ekleyin, 5 dakika kaynatın ve daha fazla analiz için -20 °C'de saklayın.
- Üçüncü Polimerizasyon (Düşük Molarite Tamponunda)
- Polimerizasyon karışımını hazırlayın: 1 hacim SN5 (120 μL),1/200 0,2 M GTP hacmi (0,6 μL, son konsantrasyon 1 mM) ve 0,5 hacim önceden ısıtılmış gliserol (60 μL) uygun hacimde bir tüpte.
- Pipet karışımı yukarı ve aşağı, hafifçe hava kabarcıkları oluşumunu önlemek ve uygun ultracentrifuge tüplere aktarın.
- Tüpleri parafilm ile örtün, 30 ° C'de ayarlanmış bir su banyosuna aktarın ve 20 dakika kuluçkaya yatırın.
- Tüpleri 30 dakika boyunca 150.000 × g,30 °C'de santrifüj edin. Pelet (P6) polimerize mikrotübüller içerir ve süpernatanT SN6 az miktarda polimerize edilmemiş tübulin içerir.
NOT: Mikrotübül peletleri çıtlatılabilir ve -80 °C'de 1 yıla kadar saklanabilir. - 1–4 μL alın ve 9 cilt 2x Laemmli tampon ekleyin, 5 dakika kaynatın ve daha fazla analiz için -20 °C'de saklayın.
- Üçüncü Depolymerization
- P6 peletine buz gibi BRB80 ekleyerek mikrotübülleri depolymerize edin ve 5 dakika boyunca buz üzerinde bırakın: hücrelerden tübulin için 1/100th (120 μL) ekleyin ve beyinlerden tübulin için SN1'in hacminin 1/40'ını (300 μL) ekleyin.
- Pipet yukarı ve aşağı her 5 dakikada bir p200 ucu ile, 20 dakika boyunca (beş pipetleme döngüsü).
- Çözeltiyi uygun ultrasantrifüj tüplere aktarın ve 20 dakika boyunca 150.000 × g, 4 °C'de aşağı doğru döndürün. SN7'yi yeni bir 1,5 mL ultracentrifuge tüpüne aktarın. Pelet (P7) az miktarda depolimerize edilmemiş mikrotübül içerir. Süpernatant (SN7) sadece depolimerize mikrotübüller (çözünür tubulin) içerir.
- 1–4 μL alın ve 9 cilt 2x Laemmli tampon ekleyin, 5 dakika kaynatın ve daha fazla analiz için -20 °C'de saklayın.
- P7 peletini BRB80'de (aynı hacimde SN7) yeniden depolayın, 1-4 μL alın ve 9 cilt 2x Laemmli tampon ekleyin, 5 dakika kaynatın ve daha fazla analiz için -20 °C'de saklayın.
- Tubulin miktarını ölçün (bkz. Temsili Sonuçlar)ve aliquot SN7'yi küçük hacimlerde ölçün, snap-freeze yapın ve -80 °C'de saklayın.
Sonuçlar
Bu yöntemin temel amacı, saflaştırılmış bileşenlerle tekrarlanan in vitro deneyler yapmak için yeterli miktarlarda yüksek kaliteli, montaja yetkin tubulin üretmektir. Bu tübulinden monte edilen mikrotübüller, dinamik veya kararlı mikrotübüller ile toplam iç yansıma floresan (TIRF) mikroskopi tekniğine dayalı rekonstrüt tahlillerinde, mikrotübül dinamiklerini test eden deneylerde, MAP'ler veya moleküler motorlarla etkileşimlerde ve motorlar tarafından kuvvet üretiminde kullanılabilir25. Ayrıca mikrotübül-MAP eş-peletleme tahlillerinde ve katı hal NMR spektroskopisinde de kullanılabilirler28.
Tubulin'in saflaştırma işlemi boyunca zenginleştirilmesi ve saflığı, klasik jellerde tek bir bant olarak birlikte göç eden α ve β-tübulinlerin ayrılmasına izin veren coomassie lekeli SDS-poliakrilamid jel elektroforez (PAGE) jeli, tercihen 'TUB' SDS-PAGEjellerikullanılarak izlenebilir. Farklı adımlarda toplanan lysates (son depolimerizasyon hariç, bkz. protokol) tübulin saflaştırma başarısını değerlendirmek için benzer miktarlarda jel üzerine yüklenir (Şekil 2A)24. Çok değerli olan son tubulin örneği, sadece tübulin konsantrasyonunun belirlenmesi için jel üzerine yüklenir. Tekrarlanan polimerizasyon ve depolimerizasyon döngüleri sürecinde bir miktar tübulin kaybetmek normaldir. Son saflaştırılmış tübulinin beklenenden daha düşük bir verimi, (i) mikrotübüllerin eksik depolimerizasyonu, P3, P5 ve P7 fraksiyonlarında önemli miktarda tübulin varlığı veya (ii) mikrotübüllere verimsiz bir tübulin polimerizasyonu ile görselleştirilir, bu durumda P2, P4 ve P6 fraksiyonlarında daha düşük miktarda tübulin ve SN2, SN4 ve SN6 kesirlerinde daha yüksek miktarda bulunur (Şekil 2B). Tubulin polimerizasyon adımları sırasında kaybolursa (daha düşük miktarlarda P2 ve P4) (i) polimerizasyon sırasında yeterli tübulin konsantrasyonunu sağlamak (ii) taze bir GTP aliquot kullanın ve/veya (iii) polimerizasyon reaksiyonunun sıcaklığını yeniden doğrulayın. Tübülin depolimerizasyon adımları sırasında kaybolursa (daha düşük miktarda SN3 ve SN5), karışımın buz üzerinde pipetlemesinin yanı sıra süreyi artırın.
Saflaştırılmış tübulinin nicelleştirilmesi için, örnekleri SDS-PAGE'de bilinen sığır serum albümin miktarları (BSA, 0,5 μg – 1 μg – 2 μg – 4 μg) (Şekil 3A)ile birlikte çalıştırın. Jeller Coomassie parlak mavi ile boyanır, taranır ve BSA ve tübulin bantlarının yoğunlukları https://openwetware.org/wiki/Protein_Quantification_Using_ImageJ açıklandığı gibi nicel yoğunluk (Şekil 3B) ile ölçülür. Aynı analizin ImageJ33'ünyükseltilmiş bir sürümü olan Fiji'de de yapılabileceğini lütfen unutmayın. Tübulin bantlarındaki protein miktarını hesaplamak için kullanılan doğrusal regresyon denklemini belirlemek için BSA bantlarından değerler kullanılmıştır. Tübulin konsantrasyonunun belirlenmesinde sadece BSA eğrisi aralığındaki tübulin bandı yoğunlukları kullanılır. Hesaplanan tübulin konsantrasyonuna dayanarak, istenen miktarda tübulin aliquotları hazırlanır, sıvı nitrojende çıtlatlanır ve -80 ° C'de saklanır. Genellikle dört spinner şişe HeLa S3 süspansiyon kültüründen (~15 g hücre), on adet 15 cm çapında yemeklerden (~1,2 g hücre) ~250 μg tübulin ve 1 g fare beyin dokusundan ~1 mg tübulin elde ediyoruz.
Belirli bir tübulin izotipinin veya modifikasyonunun zenginleştirilmesini doğrulamak için, saflaştırılmış tübulinin ~0.1 μg'si ilgili antikorlar kullanılarak immünblotted edilebilir34,35. Kontrol tübulin, ilgi tübüline bağlı olarak değişecektir. Modifiye edici enzim ile tüp bebek modifiye tubulin için, kontrol olarak tedavi edilmemiş tubulin kullanın. Selüloda modifiye edici bir enzimin aşırı ekspresyonu ile modifiye edilen tübulin için, enzimi kontrol olarak ifade etmeyen hücrelerden saflaştırılmış tübulin kullanın (Şekil 4A). Nakavt fare beyinlerinden arındırılmış tübulin için kontrol tubulin vahşi tip farelerden tubulin olacaktır (Şekil 4B). Tüm immünoblot analizlerinde, PTM'den bağımsız bir anti-α-tubulin antikor (12G10) kullanılarak eşit bir tübulin yükü doğrulanır.
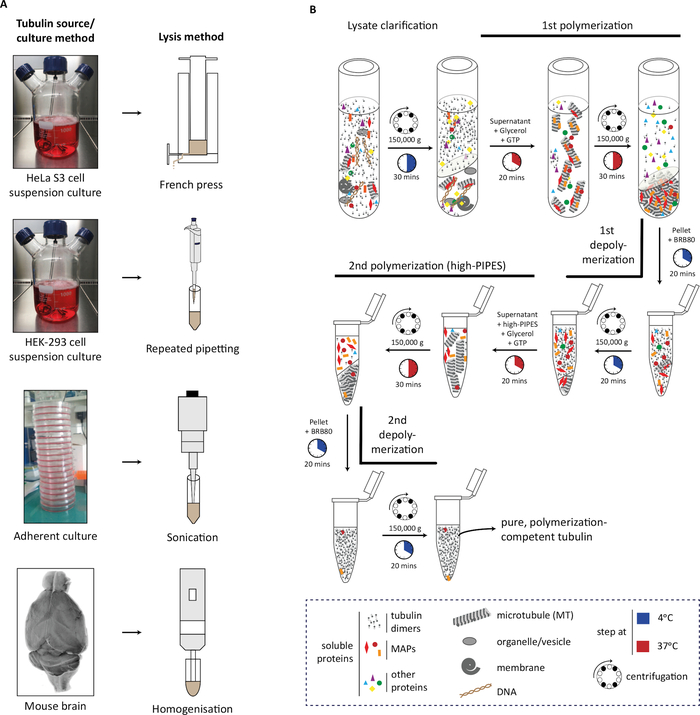
Şekil 1: Polimerizasyon-depolimerizasyon döngüleri kullanılarak farklı kaynaklardan tübülin saflaştırması. (A) Farklı tubulin kaynakları belirli stratejiler kullanılarak lysed edilir. Süspansiyonda kültürlenen HeLa S3 hücreleri Bir Fransız presi kullanılarak lislenir; HEK-293 hücreleri tekrarlayan pipetleme ile yutmuş. Yapışık hücreler, doku homojenizatör kullanılarak kısa sonikasyon darbeleri ve fare beyin dokusu kullanılarak yalanlandı. (B) Tübulin arıtma protokolünün ardışık adımlarının soğuk depolimerizasyon ve ısı-polimerizasyon döngüleri kullanılarak şematik gösterimi. Lizis ve lizat netleştirmesinden sonra mikrotübüller polimerize edilir ve peletlenir. Mikrotübüller daha sonra depolimerize edilir ve daha sonra mikrotübüllerle ilişkili protein (MAP) ko-çökeltisini önleyerek yüksek azı dişleri tamponunda polimerize edilmesine izin verilir. MAP içermeyen mikrotübüller daha sonra depolimerize edilir ve yüksek azı dişleri tamponunun eser miktarlarını kaldırmak için üçüncü bir polimerizasyon-depolimerizasyon döngüsüne tabi tutulabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Tübulin saflaştırmasının başarısının değerlendirilmesi. Tubulin saflaştırma protokolünün farklı adımlarında toplanan örnekler bir 'TUB' sodyum dodecylsulfate-poliakrilamid jel elektroforez (SDS-PAGE) jel üzerinde çalıştırıldı (ayrıntılar için protokole bakın) ve Coomassie parlak mavi ile boyandı. (A) Başarılı bir tübulin saflaştırmasında, α ve β-tübulinler süreç boyunca giderek zenginleştirilir. İkinci polimerizasyondan sonra, mikrotübül pelet (P4) diğer proteinlerden veya mikrotübül ilişkili proteinlerden (VIP' ler) kontaminasyon içermez. İşlem sırasında bir miktar tübulin kaybetmenin normal olduğunu unutmayın. (B) Başarısız bir tübulin saflaştırmasında, nihai tübulin verimi düşüktür ve tübulin depolimerizasyondan sonra pelette veya polimerizasyondan sonra süpernatanta kalır (kırmızı kutular). Burada gösterilen örnekte, tübulin her iki polimerizasyon adımında da verimli bir şekilde polimerize olmadı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Coomassie lekeli sodyum dodecylsulfate-poliakrilamid jel elektroforez (SDS-PAGE) jelleri ve densitometri kullanılarak saflaştırılmış tübulinin nicelemesi. (A) Bilinen miktarlarda sığır serum albümini (BSA; 0.5, 1, 2 ve 4 μg, gri gradyan çizgisi) ve farklı hacimlerde (sırasıyla 0.5 ve 1 μL, açık ve koyu renkler) püskür tübulin içeren coomassie lekeli SDS-PAGE jeli. Gösterilen örnekte jel üzerine tirozinli tubulin (HeLa S3 tubulin, açık ve koyu turuncu) ve detyrosinated tubulin (karboksipeptidaz A, açık ve koyu mavi ile tedavi edilen HeLa S3 tubulin) yüklenmiştir. (B) (A)'dan BSA bantları ImageJ kullanılarak ölçüldü (rastgele birimlerde, AU) ve yüklenen protein miktarına (griden siyah noktalara) çizildi. Bu noktalar, jel üzerine yüklenen tübulin örneklerindeki protein miktarlarını (açık ve koyu turuncu ve mavi noktalar) hesaplamak için kullanılan doğrusal regresyon çizgisini (gri gradyan çizgisi) ve denklemi hesaplamak için kullanılmıştır. Bu, tübulin örneklerinin konsantrasyonunun hesaplanmasını kolaylaştırdi. BSA standart eğrisinin ötesindeki noktaların konsantrasyonu (koyu turuncu ve mavi noktalar) belirlemek için kullanılmaması gerektiğini unutmayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
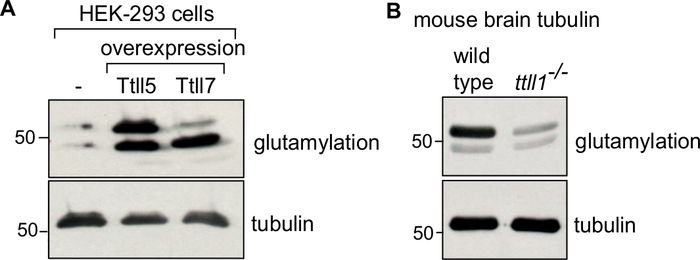
Şekil 4: Farklı PTM'ler ile saflaştırılmış tübulinin immünoblot analizi. (A) HEK-293 hücrelerinden arındırılmış tübulinler: vahşi tip veya TTLL5 veya TTLL7'yi aşırı ifade eden hücreler, GT335 antikor kullanılarak poliglutamilasyonun spesifik zenginleştirilmesi için analiz edildi. TTLL5 aşırı ifadesi α ve β-tubulin üzerinde poliglutamylation artırırken, TTLL7 aşırı ifade özellikle β-tubulin glutamilasyonunu zenginleştirir. (B) Tubulin vahşi tip beyin dokularından arındırıldı ve ttll1-/- fareler glutamilasyon paternleri için analiz edildi. Ttll1-/- farelerden tubulin poliglutamylation güçlü azalma, hangi ana beyin glutatylaz TTLL136. α ve β-tübulini ayırmak için 'KÜVET' jelleri kullanıldı. Bir anti-α-tubulin antikor olan 12G10 ile eşit miktarda tübulin yükü doğrulandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada açıklanan yöntem, hücre çizgilerinden ve tek fare beyinlerinden orta-büyük miktarlarda hızlı bir şekilde yüksek kaliteli, montaj yetkin tubulin üretmek için bir platform sağlar. Uzun yıllardır sahada kullanılan sığır beyinlerinden tübulin saflaştırmanın altın standart protokolüne dayanmaktadır16,17. Yaklaşımın özel bir avantajı, kurulduktan sonra çok az uygulamalı zaman gerektirirken büyük miktarlarda hücre üreten HeLa S3 hücrelerinin süspansiyon kültürlerinin kullanılmasıdır. Bu, protokolün herhangi bir hücre biyolojisi laboratuvarında gerçekleştirilmesi nispeten kolay hale getirirken, diğer tubulin saflaştırma yöntemleri18,19,32,37 belirli ekipman ve uzmanlık gerektirir ve bu nedenle çoğunlukla protein saflaştırmada güçlü bir geçmişe sahip laboratuvarlar tarafından kullanılır. Yapışık hücre hatlarından daha az miktarda tübulin üretirken, çeşitli hücre hatları kullanılabilir. Tubulin'i HeLa, U-2 OS ve HEK-293 hücrelerinden başarıyla arındırdık. Daha büyük ölçekli bir arınma gerekiyorsa, hasat edilen hücreler veya beyinler lizis tamponunda çıtlatılabilir ve -80 ° C'de saklanabilir ve daha büyük miktarlarda tübulin saflaştırmak için birden fazla hücre peleti veya beyni bir araya toplanabilir.
Hücre hatlarından arındırılmış tubulin, tübulin PTM'lerinden neredeyse arınmış. Bu Tyr-tubulin kolayca tek bir basit adımda detyrosinated (deTyr-) tubulindönüştürülebilir 25. Diğer PTM'lerle tübulin üretmek için, spesifik tübulin modifiye edici enzimler tübulin saflaştırmadan önce hücrelerde aşırı ifade edilebilir. Ayrıca, malzeme kaynağı olarak insan kökenli hücre hatlarının kullanılması, mikrotübüller ve insan VIP'leri arasındaki etkileşimleri incelerken potansiyel türler arası sorunların önlenmesine yardımcı olur. Ayrıca, tercüme edilmemiş (HEK293 gibi) veya dönüştürülmüş (HeLa gibi) hücrelerden elde edilen tübulin, mikrotübül yönlendirilmiş ilaçların (örneğin taksonlar) normal ve tümör hücreli mikrotübüller üzerindeki etkileri hakkında bilgi sağlayabilir.
Son olarak, protokolümüz tübulinin tek fare beyinlerinden arındırılmasını kolaylaştırır. Tübulin mutasyonlarının ve modifikasyonlarının fare modellerinin sayısı arttıkça, bu protokol mikrotübüllerin özelliklerinin ve etkileşimlerinin değiştirilmiş tubulin izotip bileşimi38 , 39,40veya tübulin PTM'leri31 , 41ile doğrudan analizedilmesineizin verir.
Yaklaşım polimerizasyon ve depolimerizasyon döngülerine dayanmaktadır. Bu nedenle, mikrotübüllerin montaj ve sökme özelliklerini etkileyen belirli PTM'lere sahip spesifik tubulin izotipleri veya tübulin, saflaştırma işlemi sırasında bu tür tübulin formlarının orantısız bir kaybına veya azalmasına neden olabilir. Bununla birlikte, asetilasyon, detyrosinasyon, glutamilasyon ve glikilasyon gibi büyük tübulin PTM'lerinin tübulin saflaştırma işlemi boyunca mikrotübüllerde tutulduğunu gösterdik24. Bununla birlikte, hücrelerde veya dokularda tübulin bileşiminin nicel analizleri için, TOG-kolon bazlı tübulin saflaştırma yaklaşımının tarafsız, polimerizasyondan bağımsız bir tübulin saflaştırmasına izin vereceği için daha uygun olduğu belirtilmelidir18. Sınırlamasına rağmen, protokolümüz titiz in vitro rekonseptür deneylerinde kullanılabilecek büyük miktarlarda yüksek kaliteli tübulin üretmede büyük bir avantaj sunmaktadır. Özellikle rutin deneylerde PTM bakımından zengin beyin tübülinin kullanımını kolaylaştırır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma ANR-10-IDEX-0001-02, LabEx Cell'n'Scale ANR-11-LBX-0038 ve Institut de convergence Q-life ANR-17-CONV-0005 tarafından desteklenmiştir. CJ, Institut Curie tarafından desteklenmektedir, Fransız Ulusal Araştırma Ajansı (ANR) ANR-12-BSV2-0007 ve ANR-17-CE13-0021 ödüllerini, Institut National du Cancer (INCA) hibe 2014-PL BIO-11-ICR-1 ve Fondation pour la Recherche Medicale (FRM) hibe DEQ20170336756. MMM, Fondation Vaincre Alzheimer hibeSI FR-16055p ve Fransa Alzheimer hibesi AAP SM 2019 n°2023 tarafından desteklenmektedir. JAS, Marie Skłodowska-Curie hibe anlaşması No 675737 ve FRM hibe FDT201904008210 kapsamında Avrupa Birliği'nin Horizon 2020 araştırma ve yenilik programı tarafından desteklenmiştir. SB, FRM hibesi FDT201805005465 tarafından desteklenmiştir.
Janke laboratuvarının tüm üyelerine, özellikle J. Souphron'a, G. Lakisic'e (Institut MICALIS, AgroParisTech) ve A. Gautreau'ya (Ecole Polytechnique) protokolün kurulması sırasında yardımları için teşekkür ederiz. Institut Curie hayvan tesisine fare yetiştiriciliği ve bakımı konusunda yardımları için teşekkür ederiz.
J. Frankel ve M. Nelson tarafından geliştirilen 12G10 antikor, NICHD himayesinde geliştirilen ve Iowa Üniversitesi tarafından sürdürülen Gelişimsel Çalışmalar Hybridoma Bankası'ndan elde edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 M MgCl2 | Sigma | #M1028 | |
| 1-L cell culture vessels | Techne F7610 | Used for spinner cultures. Never stir the empty spinner bottles. When spinner bottles are in the cell culture incubator, always keep the lateral valves of spinner bottles slightly open to facilitate the equilibration of media with incubator’s atmosphere. After use, fill the spinner bottles immediately with tap water to avoid drying of remaining cells on the bottle walls. Wash the bottles with deionised water, add app 200 ml of deionised water and autoclave. Under a sterile cell culture hood remove the water and allow the bottles to dry completely, still under the hood, for several hours. Never use detergents for cleaning the spinner bottles because any trace amounts of the detergent can be deleterious to the cells. | |
| 1.5- and 2-ml tubes | |||
| 14-ml round-bottom tubes | |||
| 15-cm-diameter sterile culture dishes | |||
| 15-ml screw-cap tubes | |||
| 2-mercaptoethanol | Sigma | #M3148 | 2-mercaptoethanol is toxic and should be used under the hood. |
| 4-(2-aminoethyl)-benzenesulfonyl fluoride | Sigma | #A8456 | |
| 40% Acrylamide | Bio-Rad | #161-0140 | |
| 5-, 10- 20-ml syringes | |||
| 5-ml, 10-ml, 25-ml sterile pipettes | |||
| 50-ml screw-cap tubes | |||
| Ammonium persulfate (APS) | Sigma | #A3678 | |
| Anti-alpha-tubulin antibody, 12G10 | Developed by J. Frankel and M. Nelson, obtained from the Developmental Studies Hybridoma Bank, developed under the auspices of the NICHD, and maintained by the University of Iowa | dilution: 1/500 | |
| Anti-glutamylated tubulin antibody, GT335 | AdipoGen | #AG-20B-0020 | dilution: 1/20,000 |
| Aprotinin | Sigma | #A1153 | |
| Balance (0.1 – 10 g) | |||
| Beckman 1-l polypropylene bottles | For collecting spinner cultures | ||
| Beckman Avanti J-26 XP centrifuge | For collecting spinner cultures | ||
| Biological stirrer | Techne MCS-104L | Installed in the cell culture incubator (for spinner cultures), 25 rpm for Hela S3 and HEK 293 cells | |
| Bis N,N’-Methylene-Bis-Acrylamide | Bio-Rad | #161-0201 | |
| Blender IKA Ultra-Turrax® | For lysing brain tissue, use 5-mm probe, with the machine set at power 6 or 7. Blend the brain tissue 2-3 times for 15 s on ice. | ||
| Bovine serum albumin (BSA) | Sigma | #A7906 | |
| Bromophenol blue | Sigma | #1.08122 | |
| Carboxypeptidase A (CPA) | Sigma | #C9268 | Concentration: 1.7 U/µl |
| Cell culture hood | |||
| Cell culture incubator set at 37°C, 5% CO2 | |||
| Dimethyl sulfoxide (DMSO) | Sigma | #D8418 | DMSO can enhance cell and skin permeability of other compounds. Avoid contact and use skin and eye protection. |
| DMEM medium | Life Technologies | #41965062 | |
| DTT, DL-Dithiothreitol | Sigma | #D9779 | |
| EDTA | Euromedex | #EU0007-C | |
| EGTA | Sigma | #E3889 | |
| Ethanol absolute | Fisher Chemical | #E/0650DF/15 | |
| Fetal bovine serum (FBS) | Sigma | #F7524 | |
| French pressure cell press | Thermo electron corporation | #FA-078A | with a #FA-032 cell; for lysing big amounts of cells. Set at medium ratio, and the gauge pressure of 1,000 psi (corresponds to 3,000 psi inside the disruption chamber). |
| Glycerol | VWR Chemicals | #24388.295 | |
| Glycine | Sigma | #G8898 | |
| GTP | Sigma | #G8877 | |
| Heating block | Stuart | #SBH130D | |
| Hela cells | ATCC® CCL-2™ | ||
| Hela S3 cells | ATCC | ATCC® CCL-2.2™ | |
| Hydrochloric acid (HCl ) | VWR | #20252.290 | |
| Inverted microscope | With fluorescence if cell transfection is to be verified | ||
| Isopropanol | VWR | #20842.298 | |
| jetPEI | Polyplus | #101 | |
| JLA-8.1000 rotor | For collecting spinner cultures | ||
| KOH | Sigma | #P1767 | KOH is corrosive and causes burns; use eye and skin protection. |
| L-Glutamine | Life Technologies | #25030123 | |
| Laboratory centrifuge for 50-ml tubes | Sigma | 4-16 K | |
| Leupeptin | Sigma | #L2884 | |
| Liquid nitrogen | |||
| Micro-pipettes p2.5, p10, p20, p100, p200 and p1000 and corresponding tips | |||
| Micropestles | Eppendorf | #0030 120.973 | |
| Mouse brain tissue | Animal care and use for this study were performed in accordance with the recommendations of the European Community (2010/63/UE). Experimental procedures were specifically approved by the ethics committee of the Institut Curie CEEA-IC #118 (authorization no. 04395.03 given by National Authority) in compliance with the international guidelines. | ||
| Needles 18G X 1 ½” (1.2 X 38 mm | Terumo | #18G | |
| Needles 20G X 1 ½” (0.9 X 38 mm | Terumo | #20G | |
| Needles 21G X 4 ¾” (0.8 X 120 mm | B.Braun | #466 5643 | |
| Parafilm | |||
| PBS | Life Technologies | #14190169 | |
| Penicillin-Streptomycin | Life Technologies | #15140130 | |
| pH-meter | |||
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma | #P7626 | PMSF powder is hazardous. Use skin and eye protection when preparing PMSF solutions. |
| PIPES | Sigma | #P6757 | |
| Pipette-boy | |||
| Rotors | Beckman 70.1 Ti; TLA-100.3; and TLA 55 | ||
| SDS-PAGE electrophoresis equipment | Bio-Rad | #1658001FC | |
| SDS, Sodium dodecyl sulphate | VWR | #442444H | For preparing Laemmeli buffer |
| SDS, Sodium dodecyl sulphate | Sigma | #L5750 | For preparing 'TUB' SDS-PAGE gels |
| Sonicator | Branson | #101-148-070 | Used for lysing cells grown as adherent cultures. Use 6.5 mm diameter probe, set the sonicator at “Output control” 1, “Duty cycle” 10% and time depending on the cell type used. |
| Tabletop centrifuge for 1.5 ml tubes | Eppendorf | 5417R | |
| TEMED, N, N, N′, N′-Tetramethylethylenediamine | Sigma | #9281 | |
| Trichostatin A (TSA) | Sigma | #T8552 | |
| Triton X-100 | Sigma | #T9284 | |
| Trizma base (Tris) | Sigma | #T1503 | |
| Trypsin | Life Technologies | #15090046 | |
| Ultracentrifuge rotors | TLA-55, TLA-100.3 and 70.1 Ti rotors | Set at 4°C or 30°C based on the need of the experiment | |
| Ultracentrifuge tubes | Beckman | #357448 | for using with TLA-55 rotor |
| Ultracentrifuge tubes | Beckman | #349622 | for using with TLA-100.3 rotor |
| Ultracentrifuge tubes | Beckman | #355631 | for using with 70.1 Ti rotor |
| Ultracentrifuges | Beckman | Optima L80-XP (or equivalent) and Optima MAX-XP (or equivalent) | Set at 4°C or 30°C based on the need of the experiment |
| Vortex mixer | |||
| Water bath equipped with floaters or tube holders | Set at 30°C |
Referanslar
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Janke, C. The tubulin code: Molecular components, readout mechanisms, and functions. Journal of Cell Biology. 206 (4), 461-472 (2014).
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews: Molecular Cell Biology. 21 (6), 307-326 (2020).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Margolis, R. L., Wilson, L. Opposite end assembly and disassembly of microtubules at steady state in vitro. Cell. 13 (1), 1-8 (1978).
- Borisy, G. G., Olmsted, J. B. Nucleated assembly of microtubules in porcine brain extracts. Science. 177 (55), 1196-1197 (1972).
- Kirschner, M. W., Williams, R. C. The mechanism of microtubule assembly in vitro. Journal of Supramolecular Structure. 2 (2-4), 412-428 (1974).
- Baas, P. W., Lin, S. Hooks and comets: The story of microtubule polarity orientation in the neuron. Developmental Neurobiology. 71 (6), 403-418 (2011).
- Stepanova, T., et al. Visualization of microtubule growth in cultured neurons via the use of EB3-GFP (end-binding protein 3-green fluorescent protein). Journal of Neuroscience. 23 (7), 2655-2664 (2003).
- Nedelec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Bieling, P., Telley, I. A., Surrey, T. A minimal midzone protein module controls formation and length of antiparallel microtubule overlaps. Cell. 142 (3), 420-432 (2010).
- Roostalu, J., et al. Directional switching of the kinesin Cin8 through motor coupling. Science. 332 (6025), 94-99 (2011).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nature Materials. 14 (11), 1156-1163 (2015).
- Hendricks, A. G., Goldman, Y. E., Holzbaur, E. L. F. Reconstituting the motility of isolated intracellular cargoes. Methods in Enzymology. 540, 249-262 (2014).
- Dogterom, M., Surrey, T. Microtubule organization in vitro. Current Opinion in Cell Biology. 25 (1), 23-29 (2013).
- Vallee, R. B. Reversible assembly purification of microtubules without assembly-promoting agents and further purification of tubulin, microtubule-associated proteins, and MAP fragments. Methods in Enzymology. 134, 89-104 (1986).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Widlund, P. O., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Molecular Biology of the Cell. 23 (22), 4393-4401 (2012).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Letters. 587 (21), 3450-3455 (2013).
- Uchimura, S., et al. A flipped ion pair at the dynein-microtubule interface is critical for dynein motility and ATPase activation. Journal of Cell Biology. 208 (2), 211-222 (2015).
- Pamula, M. C., Ti, S. C., Kapoor, T. M. The structured core of human beta tubulin confers isotype-specific polymerization properties. Journal of Cell Biology. 213 (4), 425-433 (2016).
- Vemu, A., et al. Structure and dynamics of single-isoform recombinant neuronal Human tubulin. Journal of Biological Chemistry. 291 (25), 12907-12915 (2016).
- Ti, S. C., Alushin, G. M., Kapoor, T. M. Human beta-tubulin isotypes can regulate microtubule protofilament number and stability. Developmental Cell. 47 (2), 175-190 (2018).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nature Protocols. 14, 1634-1660 (2019).
- Barisic, M., et al. Microtubule detyrosination guides chromosomes during mitosis. Science. 348 (6236), 799-803 (2015).
- Nirschl, J. J., Magiera, M. M., Lazarus, J. E., Janke, C., Holzbaur, E. L. F. alpha-Tubulin tyrosination and CLIP-170 phosphorylation regulate the initiation of dynein-driven transport in neurons. Cell Reports. 14 (11), 2637-2652 (2016).
- Guedes-Dias, P., et al. Kinesin-3 responds to local microtubule dynamics to target synaptic cargo delivery to the presynapse. Current Biology. 29 (2), 268-282 (2019).
- Luo, Y., et al. Direct observation of dynamic protein interactions involving human microtubules using solid-state NMR spectroscopy. Nature Communications. 11 (1), 18(2020).
- Even, A., et al. ATAT1-enriched vesicles promote microtubule acetylation via axonal transport. Science Advances. 5 (12), 2705(2019).
- Wolff, J., Sackett, D. L., Knipling, L. Cation selective promotion of tubulin polymerization by alkali metal chlorides. Protein Science. 5 (10), 2020-2028 (1996).
- Magiera, M. M., et al. Excessive tubulin polyglutamylation causes neurodegeneration and perturbs neuronal transport. EMBO Journal. 37 (23), 100440(2018).
- Lacroix, B., Janke, C. Generation of differentially polyglutamylated microtubules. Methods in Molecular Biology. 777, 57-69 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Magiera, M. M., Janke, C. Methods in Cell Biology Vol. 115 Microtubules, in vitro. Correia, J. J., Wilson, L. , Academic Press. 247-267 (2013).
- Hausrat, T. J., Radwitz, J., Lombino, F. L., Breiden, P., Kneussel, M. Alpha- and beta-tubulin isotypes are differentially expressed during brain development. Developmental Neurobiology. , (2020).
- Janke, C., et al. Tubulin polyglutamylase enzymes are members of the TTL domain protein family. Science. 308 (5729), 1758-1762 (2005).
- Newton, C. N., et al. Intrinsically slow dynamic instability of HeLa cell microtubules in vitro. Journal of Biological Chemistry. 277 (45), 42456-42462 (2002).
- Belvindrah, R., et al. Mutation of the alpha-tubulin Tuba1a leads to straighter microtubules and perturbs neuronal migration. Journal of Cell Biology. 216 (8), 2443-2461 (2017).
- Breuss, M., et al. Mutations in the murine homologue of TUBB5 cause microcephaly by perturbing cell cycle progression and inducing p53 associated apoptosis. Development. , (2016).
- Latremoliere, A., et al. Neuronal-specific TUBB3 is not required for normal neuronal function but is essential for timely axon regeneration. Cell Reports. 24 (7), 1865-1879 (2018).
- Morley, S. J., et al. Acetylated tubulin is essential for touch sensation in mice. Elife. 5, (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır