Method Article
중합-비합화 주기에 의해 제한된 소스에서 제어 된 번역 후 수정 및 동형으로 투불린의 정화
요약
이 프로토콜은 중합 및 중합 주기를 사용하여 배양 된 세포 또는 단일 마우스 뇌와 같은 중소 규모의 소스에서 튜룰린 정제를 설명합니다. 정제 된 튜룰린은 특정 동종형으로 풍부해지거나 특정 번역 후 변형을 가지며 체외 재관체 검사에서 미세 tubule 역학 및 상호 작용을 연구하는 데 사용할 수 있습니다.
초록
미세 투외 세포 골격의 연구의 한 가지 중요한 측면은 체외 재구성 실험에서 미세 tubule 행동의 조사입니다. 그(것)들은 역학과 같은 microtubules의 본질적인 속성의 분석및 microtubule 관련 단백질 (MAPs)와의 상호 작용을 허용합니다. "tubulin 코드"는 마이크로 튜블러 특성 및 기능의 조절자로서 다양한 튜룰린 동종 형 및 다양한 번역 후 변형 (PTM)을 가리키는 새로운 개념입니다. 튜룰린 코드의 분자 메커니즘을 탐구하려면 특정 동종 및 PTM을 사용하여 정제 된 튜룰린을 사용하여 체외 재구성 실험을 수행하는 것이 중요합니다.
현재까지, 이것은 널리 체외 실험에서 사용되는 뇌 튜룰린으로 기술적으로 도전했다, 많은 PTM을 항구하고 정의 된 동종 조성을 가지고. 따라서, 우리는 중합 및 비합화 주기의 고전적인 접근 방식을 사용하여, 다른 소스와 다른 등류 조성 및 제어 된 PTM로 튜룰린을 정화하기 위해이 프로토콜을 개발했다. 선호도 정화에 기초한 기존 방법에 비해, 이러한 접근법은 중합또는 중합화에 내성이 있는 튜룰린이 연속정화 단계에서 버려짐에 따라 순수하고 중합화능력이 있는 튜룰린을 산출한다.
우리는 현탁액또는 부착 배양으로 성장한 세포주에서 튜룰린의 정제를 설명하고 단일 마우스 뇌에서 설명합니다. 이 방법은 먼저 서스펜션 및 부착 설정 모두에서 세포 질량의 생성을 설명하고, 용해 단계, 중합-폴리머화 주기에 의한 튜룰린 정화의 연속적인 단계를 설명한다. 우리의 방법은 관련 단백질과의 마이크로 튜부 및 마이크로 튜블러 상호 작용의 본질적인 특성에 대한 튜룰린 코드의 영향을 다루는 실험에 사용할 수있는 tubulin을 산출합니다.
서문
마이크로튜브는 많은 세포 프로세스에서 중요한 역할을 합니다. 그(것)들은 세포에게 그들의 모양을 주고, 염색체 분리를 위한 메이오제 및 미토Tic 스핀들을 만들고, 세포내 수송을 위한 트랙역할을 합니다. 이러한 다양한 기능을 수행하기 위해 마이크로 튜버는 다른 방식으로 자신을 구성합니다. 이 분야의 흥미로운 질문 중 하나는 구조적으로 진화적으로 보존된 마이크로투블러가 조직과 기능의 이 과다에 적응할 수 있도록 하는 분자 메커니즘을 이해하는 것입니다. 한 가지 잠재적 메커니즘은'튜룰린코드'1,2,3로알려진 개념에 의해 정의되는 마이크로투부의 다양화이다. tubulin 코드는 두 가지 주요 구성 요소를 포함: α-및 β-tubulin 유전자 제품의 차동 통합 (tubulin 등색형) 마이크로 튜부 및 튜룰린 번역 후 수정 (PTM).
1970년대 부터 진화하는 빛 현미경 기술과 결합된 체외 재헌법 실험은 미세투부의 특성에 대한 중요한 발견의 길을 열어주었습니다: 동적 불안정4 및 러닝머신5,그리고 그들의 다른메커니즘및 기능6,7,7,9,11,12,13, 14,14,15. 지금까지 수행된 거의 모든 체외 실험은 중합및 중합제의 반복주기를 사용하여 뇌 조직에서 정제된튜룰린(tubulin)에기초해 왔다16,17. 뇌 조직에서 정제하는 것은 대량(보통 그램 양)으로 고품질 튜룰린을 얻는 이점을 부여하지만, 뇌 조직에서 정제된 튜룰린이 다른 튜룰린 동종형의 혼합물이며 많은 튜룰린 PTM이 풍부하기 때문에 한 가지 중요한 단점은 이질성입니다. 이러한 이질성은 마이크로튜블러 특성 및 기능의 제어에서 특정 튜룰린 PTM 또는 동소형의 역할을 묘사하는 것을 불가능하게 합니다. 따라서, 조절된 튜룰린 PTM 및 균질동형 조성물을 가진 조립 유능한 튜룰린을 생산하는 것은 튜룰린 코드의 분자 메커니즘을 해결하는 데 필수적이다.
최근에는 효모 Stu2p의 마이크로투블러 결합 TOG(종양 과잉 발현 유전자) 도메인을 이용한 친화성 크로마토그래피에 의한 튜블러린을 정화하는 접근법이개발되었다. 이 방법에서, 세포 또는 조직의 조잡한 용해의 튜룰린은 주어진, 심지어 아주 작은, 샘플의 전체 tubulin 풀의 분석을 허용하는 매트릭스 고정 TOG 도메인에 결합하는 컬럼을 통해 전달된다. 재조합 튜룰린을 정화하기 위한 대망의 접근법도 최근 몇 년 동안 설명되어 있습니다. 그것은 α 및 β-tubulin 유전자를 포함하는 bi-cistronic 벡터가 곤충세포(19)에서발현되는 바쿨로바이러스 시스템을 기반으로 한다. 그러나, 이 방법은 매우 번거롭고 시간이 많이 소요되며, 따라서 주로 체외에서 튜룰린 돌연변이20 및 튜룰린 동소형21,22,23의 충격을 연구하기 위해 사용됩니다.
현재 프로토콜에서, 우리는 잘 확립되고 널리 사용되는 중합체-중합화 접근법을 세포주 또는 마우스 뇌조직(24)으로부터다른 수준의 변형으로 튜룰린을 생성하는 청사진으로 사용하는 방법을 설명한다. 이 절차에서, 튜룰린은 수용성(4°C의 튜룰린 이머)과 중합형(구아노신 5'-triphosphate[GTP]의 존재시 30°C의 마이크로튜블러)를 순환한다. 각 형태는 원심분리의 연속단계를 통해 분리된다: 튜룰린 조광기는 감기(4°C) 스핀 후 상부체에 남아 있는 반면, 마이크로튜부는 30°C에서 펠릿화된다. 더욱이, 하나의 중합 단계는 높은 piperazine-N,N-fis(2-에탄설포닉산) (PIPES) 농도에서 수행되며, 이는 마이크로투부에서 마이크로튜버 관련 단백질을 제거할 수 있게 해주며, 따라서, 최종 적으로 정제된 튜룰린으로부터 수행된다. 정지 또는 부착 배양으로 성장 한 HeLa S3 세포로부터 정제 된 Tubulin은 임의의 튜룰린 PTM이 거의 없으며 최근 시험관 내 재분학 실험25,26,27,28에서사용되어 왔다. 우리는 더 하나의 마우스 뇌에서 튜룰린을 정화하는 방법을 적응했다, 이는 튜룰린 등색형 및 PTM의 변화와 마우스 모델의 큰 숫자에 사용할 수 있습니다.
프로토콜에서, 우리는 먼저 원료의 생성을 설명 (세포 질량 또는 뇌 조직), 그것의 lysis(도 1A),튜룰린 중합 및 비합화의 연속 단계 다음 튜룰린정화(도 1B). 우리는 정제된 튜룰린의순도(도 2A, B)및 수량(도3A, B)을평가하는 과정을 더 설명한다. 상기 방법은 튜룰린정제(도 4B)에앞서 세포내 변형 효소를 과발현함으로써 선택된 PTM으로 농축된 튜룰린을 생성하도록 조정할 수 있다. 대안적으로, 튜룰린 변형 효소는 정화 과정에서 튜룰린에 첨가될 수 있다. 마지막으로, 해당 튜룰린 변형효소(도 4B)29에서부족한 쥐의 뇌로부터 특정 동소형 또는 PTM이 부족한 튜룰린을 정화할 수 있다.
여기서 설명하는 방법에는 두 가지 주요 장점이 있습니다: (i) 비교적 짧은 시간에 충분히 많은 양의 튜룰린을 생산할 수 있으며, (ii) 특정 튜룰린 동형 조성물 또는 PTM을 사용하여 고품질의 순수 튜룰린을 생성합니다. 이 원고의 관련 비디오에서는 이 절차와 관련된 몇 가지 중요한 단계를 강조합니다.
프로토콜
이 연구를 위한 동물 관리 및 사용은 유럽 공동체 (2010/63/UE)의 권고에 따라 수행되었습니다. 실험 절차는 국제 지침에 따라 Institut Curie CEEA-IC #118 (승인 번호 04395.03)의 윤리위원회에 의해 특별히 승인되었습니다.
1. 투불린 정화시약 준비
참고: 튜룰린 정제에 사용되는 모든 완충제에는 칼륨 염과 나트륨 염30이포함되어야 한다.
- 전체 매체 의 1 L준비: 덜벡코의 수정 된 독수리 매체 (DMEM), 10 % 태아 소 혈청 (FBS, 100 mL), 200 mM L-글루타민 (2 M 재고의 10 mL), 1 x 페니실린 - 연쇄 상류술 (100 x 재고100xL). 4 °C에 보관하십시오.
- 물에 140g의 KOH를 용해시켜 10M 칼륨 수산화(KOH)를 준비하고 최종 부피를 250mL로 조정하고 실온에서 보관하십시오.
- 0.5M 에틸렌디아민 테트라아세틱산(EDTA), pH 8을 준비하여 36.5g의 EDTA를 물에 용해시키고, KOH(그렇지 않으면 EDTA가 용해되지 않음)를 사용하여 pH를 8.0으로 조정하고 최종 부피를 250mL로 조절하고, 필터 살균, 실온에 저장한다.
- PBS의 500mL에 0.5M EDTA의 5mL를 추가하고, 필터 살균하고, 실온에서 보관하여 5mM 인산염 완충식염수(PBS)-EDTA를 준비한다.
- 0.5M K-PIPES, pH 6.8을 준비하여 75.5g의 파이프를 물에 용해시킴으로써 KOH(그렇지 않으면 파이프가 용해되지 않음)와 최종 부피를 500mL로 조정하고, 필터 멸균하고, 4°C에 보관한다.
- 1M K-PIPES, pH 6.8을 준비하여 15.1 g의 파이프를 물에 용해시키고, KOH와 최종 부피를 50mL로 pH 6.8로 조정하고, 필터 멸균하고, 4°C에서 보관한다.
- 0.5M 칼륨 에틸렌 글리콜 비스(β-아미노에틸에테르)-N,N,N,N&N-테트라아세틱산(K-EGTA,pH 7.7)을 물에 47.5g의 EGTA를 용해하여 KOH와 최종 부피200m에서 pH 7.7에 적응하고, 최종 부피량은 25L에 저장합니다.
- BRB80(80mM K-PIPES, pH 6.8; 1mM K-EGTA; 1mM K-EGTA; 1mM MM K-EGTA; 1mM MM K-EGTA; 1mM 마그네슘 염화마그네슘 [MgCl2])용액을 0.5M PIPES의 3.2mL, 0.5M K-EGTA의 40μL, 1M MgCl 20의 20 μL을 준비하여 최종 M MgCl20의 20 μL을 조정한다. 4 °C에 보관하십시오.
- 0.1m 페닐메탄술포닐 불소(PMSF)를 이소프로판올에 435 mg의 PMSF를 용해하여 최종 부피를 25mL로 확보하고 -20°C에 보관하십시오.
- 프로테아제 억제제 믹스(200x)를 10 mg의 아프로틴, 루페프틴 10mg, 물 속에서 4-(2-아미노에틸)-벤젠술포닐 불소 10mg을 용해하여 최종 부피를 2.5mL, 100 μL의 알리쿼트, 100μL, C-20의 알리쿼트 만들기, -200 μL의 알리쿼트 만들기, -200 μL의 알리쿼트 만들기.
- 트리톤 X-100 5mL을 45mL의 물에 섞어 10% 트리톤 X-100을 준비하고, 필터 살균을 하고, 실온에서 보관한다.
- 준비 용해 버퍼 (BRB80 1 mM 2-mercaptoethanol, 1 mM PMSF, 1 x protease 억제제 믹스및, HEK-293 셀의 경우, 0.2% 트리톤 X-100)을 2-메르카포에탄올의 1.5 μL, 200 μL의 200 μL, 프로테아제 억제제 및 HE-293의 100 μL을 혼합하여 BRB8020의 20mL를 혼합하여 튜룰린 정화 당일0.2% 트리톤 X-100) , 400 μL 10% 트리톤 X-100.
참고 : 2-mercaptoethanol독성이며 연기 후드에 사용해야합니다. - 9.5mL의 물에 GTP 1 g을 용해시켜 0.2M GTP를 준비하고, KOH를 사용하여 pH를 7.5로 조정하고, 20 μL의 알리쿼트를 만들고, -20°C에 보관하십시오. 반복되는 동결 해동 주기를 피하십시오.
- 물 속에서 60.56 g의 트리를 용해시켜 1 M 트리스(하이드록시메틸) 아미노메탄-염산염(Tris-HCl)을 준비하고, HCl을 사용하여 pH 6.8에 적응하고, 500mL의 최종 부피로 완성하고, 필터 살균을 하고, 실온에서 보관하십시오.
- 5배 Laemmli 샘플 버퍼(450mM 디티오트리톨(DTT); 10% 나트륨 도데킬술페이트(SDS); 400 μM Tris-HCl, pH 6.8; 50% 글리세롤; ~0.006% 브로모페놀 블루) 예열된 1M Tris-HCl, pH 6.8의 16mL에 SDS 4 g을 첨가하고 용액을 부드럽게 혼합한다. DTT 2.6 g와 100% 글리세롤 20mL를 넣고 용액이 균일해질 때까지 저어줍니다. 필요한 색상 강도에 도달하기 위해 원하는 양의 브로모페놀 블루(2.5 mg)를 추가합니다. 5mL 알리쿼트및 저장 -20°C에 보관하십시오. 증류수에 5배 의 재고를 희석하여 Laemmli 샘플 버퍼의 2배 작동 솔루션을 준비합니다.
2. 튜룰린의 증폭 및 수확 원천
참고 : 이 프로토콜에서, 튜룰린의 세 가지 소스가 사용되었다: (i) 세포 (HeLa S3 및 HEK-293) 현탁액 배양으로 성장; (ii) 신봉배양(HEK-293, HeLa 및 U2 OS)으로 성장한 세포; 및 (iii) 마우스 뇌 조직. 이 프로토콜은 튜룰린 정화의 날을 '0일'로 간주하고 그에 따라 다른 단계는 0일째에 비해 설명되었다.
- 세포의 증폭
- 현탁액 배양으로 재배된 세포
참고: 서스펜션 문화로부터 튜룰린을 성공적으로 정화하려면 최소 2L의 서스펜션 문화를 사용하십시오.- 서스펜션 배양 2L의 경우, 제조일 10일 전에 6× 107세포를 얻기 위해 선호하는 세포 유형을 부활시키고 성장한다. 당일 -10일, 플레이트당107개의 세포에서 직경 6개에 접시셀을 접시에 담는다.
- 당일 -8에서는 필요한 양의 완전 중간~37°C를 예열한다. 멸균 조건에서 각 스피너 병에 예열 된 매체 1 L을 추가하십시오. 세포 배양 인큐베이터 내부의 20-25 rpm에 설정된 교반기 테이블에 스피너를 놓고 측면 스피너 캡을 약간 열어 배지가 인큐베이터의 대기에 평형화될 수 있도록 합니다.
참고: 오염을 방지하기 위해 70%의 에탄올을 사용하여 미디어 와 스피너 병의 외부 표면을 철저히 청소하십시오. - 당일 -7일에는 80~90%의 결합(약 1.8× 108세포)로 자란 세포를 트립시니화하고 수집한다. 한 번에 3가지 접시에서 세포를 수집하고, 스핀다운(× g,5분, 실온) DMEM의 10mL에서 모든 세포를 다시 중단합니다.
참고: 이 시점에서 세포의 철저한 해리는 세포 생존에 영향을 미치고 낮은 tubulin 수율귀착되는 스피너 병에 있는 더 큰 응집체의 형성을 피하기 위하여 아주 중요합니다. - DMEM의 1L을 포함하는 각 스피너 병에 셀 서스펜션의 5mL를 추가하고, 세포 배양 인큐베이터의 교반기 테이블에 스피너를 반환하고, 세포가 1 주일 동안 성장할 수 있도록합니다.
- 신봉배양으로 자란 세포
참고: 부착 된 세포에서 튜룰린을 성공적으로 정화하려면 최소 10 개의 접시를 80-90 % 결합하십시오.- 원하는 세포 유형을 부활시키고 증폭하여 튜룰린 제제의 날 3일 전에 1 × 108세포를 얻습니다.
- 당일 -3일에는 10 개의 15cm 요리에 이 세포를 접시 당 1 × 107세포로 접시에 접시에 담아 80-90 % 합류할 수 있습니다.
- 당일 -1, 필요한 경우, 플라스미드를 가진 트랜스펙트 세포는 튜룰린 변형 효소 또는 특정 튜룰린 동소형을 표현한다.
- 현탁액 배양으로 재배된 세포
- 세포/뇌 조직 수확
- 현탁액 배양으로 재배된 세포
- 스피너에서 셀 서스펜션을 1L 원심분리기병(재료 표)으로옮기고 펠릿 셀을 25 ×0 g,15분, 실온으로 옮긴다. 스피너 병에 HeLa S3 세포의 또 다른 배양을 즉시 시작하기 위해 스피너에 셀 서스펜션 100mL를 두고 스피너 병에 완전하고 예열된 DMEM 1 L을 추가하십시오.
참고: 튜룰린 정화를 진행하기 전에 세균 오염을 주의 깊게 확인하십시오. - 각 원심분리기 병에서 10mL의 얼음-차가운 PBS를 재중단하고 모든 세포를 50mL 나사 캡 튜브로 이송합니다. 재서스펜션 중에 세포를 얼음 위에 보관하십시오. 250 × g,15 분, 4 °C에서 세포를 펠릿.
참고: 스피너 병 청소 및 보관에 대한 권장 사항을 따르십시오(재료 표참조). - 상체를 버리고 셀 펠릿의 부피를 결정합니다. 서스펜션 배양(스피너 병 2개)의 2L부터 5-6mL의 셀 펠릿을 기대한다.
참고: 아래에 설명된 프로토콜에서, 세포 펠릿 부피는 10mL로 가정됩니다. 펠릿 볼륨에 따라 실험을 조정합니다. - 용해 버퍼의 1 부피 (10 mL)를 추가하고 셀 펠릿을 다시 일시 중단합니다.
참고: 세포 펠릿 부피에서 용액 버퍼 부피의 비율은 성공적인 튜룰린 정화에 매우 중요합니다. 더 많은 용해 완충액을 추가하면 튜룰린 농도가 감소하여 중합화에 필요한 임계 농도에 도달하지 못하여 튜룰린 수율을 크게 줄입니다.
참고: 리시스 버퍼에서 재장매된 세포는 액체 질소에서 스냅 동결및 -80°C에서 2개월 동안 저장될 수 있다.
- 스피너에서 셀 서스펜션을 1L 원심분리기병(재료 표)으로옮기고 펠릿 셀을 25 ×0 g,15분, 실온으로 옮긴다. 스피너 병에 HeLa S3 세포의 또 다른 배양을 즉시 시작하기 위해 스피너에 셀 서스펜션 100mL를 두고 스피너 병에 완전하고 예열된 DMEM 1 L을 추가하십시오.
- 신봉배양으로 자란 세포
참고: 부착 배양의 세포는 성공적인 튜룰린 정화를 위해 매우 빠르게 수확해야합니다 (10 15cm 요리를 수확하는 데 약 15 분). 이 프로토콜단계에는 3명이 참여했습니다.- 접시를 절개하여 15cm 접시에서 배지를 제거한 다음 실온(사람 1)에서 PBS-EDTA 7mL로 셀을 부드럽게 씻습니다. 중간 또는 버퍼없이 세포를 떠나지 않도록 한 번에 세 개의 15cm 접시와 함께 작동합니다.
- 세포에 PBS-EDTA 5mL을 추가하고 실온에서 5 분 동안 배양하십시오.
- 셀 리프터를 사용하여 접시의 한 가장자리(사람 2)로 밀쳐서 세포를 부드럽게 분리하고 50mL 나사 캡 튜브(사람 3)에서 모든 세포를 수집합니다. PBS-EDTA의 추가 2mL로 각 접시를 헹구어 나머지 세포를 접시에서 채집합니다. 이 단계에서는 얼음 에 세포 현탁액을 포함하는 50 mL 나사 캡 튜브를 유지하십시오.
- 250 × g,10 분, 4 °C에서 세포를 펠릿. 상체를 버리고 셀 펠릿의 부피를 결정합니다. 10 15cm 요리에서 ~ 1 mL의 볼륨을 기대합니다.
참고: 아래에 설명된 프로토콜에서, 세포 펠릿 부피는 10mL로 가정됩니다. 펠릿 볼륨에 따라 실험을 조정합니다. - 용해 버퍼의 1 부피 (10 mL)로 셀을 다시 일시 중지합니다.
참고: 리시스 버퍼에서 다시 매달린 셀은 최대 2개월 동안 -80°C로 저장할 수 있습니다.
- 뇌 조직
참고: 모든 연령, 성별 또는 유전적 배경을 가지고 있는 마우스를 사용할 수 있습니다. 형질 전환 마우스 변형의 선택은 해결 될 과학적 질문에 따라 달라집니다. 본 원고에서는, 우리는 ttll1-/-마우스로부터 정제된 튜룰린의 예를 보여 주며, 주요 뇌 글루타밀라팅 효소가 결여되어 있으며, 튜부린 티로신 리개제 1(TTLL1)단백질(31)을나타낸다.- 자궁 경부 탈구로 마우스를 희생하고, 신속하게 참수하고, 둥근 바닥 튜브로 뇌를 수집합니다. 뇌에 과도한 혈액이 있는 경우, 재빨리 리시스 버퍼로 씻으라. 마우스가 사후 지연으로 희생되자마자 뇌를 수집하면 튜룰린 정화의 성공에 영향을 줄 수 있습니다. 동질화에 사용되는 프로브의 폭을 수용하기 위해 둥근 바닥 튜브를 사용합니다.
참고: 수집된 마우스 뇌는 액체 질소에서 스냅 냉동및 -80°C에서 최대 3년 동안 보관할 수 있다. - 성인 마우스에서 추출한 단일 뇌에 500 μL의 리시스 버퍼를 추가합니다. 나머지 프로토콜의 경우 추가된 용해 버퍼의 부피는 10mL로 가정됩니다. 사용할 뇌의 수에 따라 실험에 맞게 조정합니다.
- 자궁 경부 탈구로 마우스를 희생하고, 신속하게 참수하고, 둥근 바닥 튜브로 뇌를 수집합니다. 뇌에 과도한 혈액이 있는 경우, 재빨리 리시스 버퍼로 씻으라. 마우스가 사후 지연으로 희생되자마자 뇌를 수집하면 튜룰린 정화의 성공에 영향을 줄 수 있습니다. 동질화에 사용되는 프로브의 폭을 수용하기 위해 둥근 바닥 튜브를 사용합니다.
- 현탁액 배양으로 재배된 세포
3. 세포 또는 뇌 조직의 연수
- 현탁액 배양으로 재배된 세포
- HEK-293의 경우, 다른 너비의 파이펫 팁을 사용하여 반복적으로 위아래로 피펫을 하여 얼음 에 세포를 lyse. 먼저 p1000 팁을 10mL 파이펫에 부착하고, 5분마다 셀 서스펜션을 위아래로 피펫하여 10분(파이펫팅 3사이클)한다. 둘째, p200 팁을 p1000 팁에 부착하고 5분마다 파이펫을 추가로 부착하여 20분(파이펫팅 5주기).
- HeLa S3의 경우 프랑스 프레스를 사용하여 셀을 lyse합니다(설정용 재료 표 참조).
- 용해 믹스(L)의 1/100th 부피를 20mL에 넣고, 2x Laemmli 버퍼의 동일한 부피를 추가하고, 5분 동안 끓이고, 추가 분석을 위해 -20°C에 보관한다.
- 신봉배양으로 자란 세포
- 초음파 처리기 프로브를 수용하기 위해 높이가 감소된 14mL 원형 하단 튜브로 셀을 전송합니다(설정용 재료 표 참조). ~45 펄스에 대한 세포를 초음파처리하고 현미경하에서 용액 혼합의 한 방울을 샘플링하여 세포 용해를 확인합니다.
참고: 펄스의 수는 튜룰린 정화에 사용되는 세포 유형에 따라 다를 수 있습니다. 세포를 너무 많이 초음파 처리하면 튜룰린이 침전될 수 있으며 정화 수율에 부정적인 영향을 미칠 수 있습니다. - p200 팁을 사용하여 20분(파이펫팅 5사이클)에 5분마다 얼음 위를 오가며 세포를 피펫합니다.
- 1/100th 부피의 용해 믹스(L)(L)(200 μL)를 2x Laemmli 버퍼의 동일한 부피를 추가하고 5분 동안 끓이고 추가 분석을 위해 -20°C에 보관하십시오.
- 초음파 처리기 프로브를 수용하기 위해 높이가 감소된 14mL 원형 하단 튜브로 셀을 전송합니다(설정용 재료 표 참조). ~45 펄스에 대한 세포를 초음파처리하고 현미경하에서 용액 혼합의 한 방울을 샘플링하여 세포 용해를 확인합니다.
-
뇌 조직
- 조직 블렌더를 사용하여 뇌 조직을 lyse (설정재료의 표 참조). 또는, 마이크로튜브 유봉 또는 동등한 장비및 파이펫을 사용하여 조직을 18 G 바늘로 1mL 주사기로 얼음 위에 위아래로 분해하십시오.
- 1/100th 부피의 용액(L)(L)(200 μL)을 20mL로 넣고, 2x Laemmli 버퍼의 동일한 부피를 추가하고, 5분 동안 끓이고, 추가 분석을 위해 -20°C에 저장한다.
4. 투불린 정화
- 리자테 해명
- 150,000 × g,4°C, 30분에서 원심분리로 용해(리시스 믹스의 펠릿 및 수용성 분획 분리)를 지웁니다. 초원심분리기 로터 및 튜브에 대한 자세한 내용은 재료 표를 참조하십시오. 세포 추출물의 경우 원심 분리 후 백색 부동 층이 형성되는 경우가 많습니다. 이 부동 층은 우부막 중합화를 방해하기 때문에 상부층과 함께 전송하지 마십시오. 긴 20G 또는 21 G 바늘에 부착된 적절한 부피의 주사기를 사용하여 부동 층을 방해하지 않고 상퍼를 부드럽게 제거하십시오. 상체가 여전히 흐린 경우, 원심분리기는 5,000 × g,4°C에서 10분 동안 이다.
- 상체(SN1)를 초원심분리기 튜브로 옮기고 그 부피를 주목한다. 10 mL 셀 펠릿의 경우 SN1용 ~12mL의 부피를 기대하십시오.
- SN1의 1/100th 부피(SN1의 12mL에 대해 120 μL)를 취하고, 2x Laemmli 버퍼의 동일한 부피를 추가하고, 5분 동안 끓이고, 추가 분석을 위해 -20°C에 저장하십시오.
- SN1과 동일한 부피를 사용하여 BRB80(재료표)에서펠릿(P1)을 재연한다. P1의 1/100th 부피 (P1의 20mL에 대한 200 μL)를 취하고, 2x Laemmli 버퍼의 동일한 부피를 추가하고 5 분 동안 끓이고 추가 분석을 위해 -20 °C에 저장하십시오.
- 저음 버퍼의 첫 번째 중합
- SN1(12mL), 1/200th 부피 0.2M GTP(60μL; 최종 농도 1mMM), 및 0.5부피의 사전 가열 글리세롤(6mL)을 적절한 부피의 스크렉캡 튜브에 결합하여 중합 혼합을 준비한다.
참고: 글리세롤은 프로토콜 전체의 중합 단계에서 밀집제로 사용되므로 다른 성분의 농도 계산에서 고려되지 않습니다. - 파이펫 위아래로 혼합, 부드럽게 기포의 형성을 피하고 적절한 초원심 분리 튜브로 전송.
참고: 믹스를 튜브로 옮기는 동안 튜브의 무게를 조정합니다(쌍으로). 이를 통해 실험자는 중합 단계 후 미세투부의 퇴적물을 직접 진행할 수 있습니다. 프로토콜 전체의 모든 중합 단계에 대해 이렇게 하십시오. - 파라필름으로 튜브를 덮고 30°C로 설정된 수조로 옮기고 20분 동안 배양합니다.
- 150,000 × g, 30°C에서 30분 동안 튜브를 원심분리합니다. 상체(SN2)를 제거하고 중합된 마이크로투블러(P2)의 펠릿을 보관한다.
참고: 마이크로튜블러 펠릿은 스냅 냉동 및 최대 1년 동안 -80°C로 보관할 수 있습니다. - SN2(18mL SN2의 경우 90 μL)의 1/200th 부피를 취하고 2x Laemmli 버퍼의 동일한 부피를 추가하고 5분 동안 끓이고 -20°C에 저장하여 추가 분석을 위해 추가 분석을 위해 -20°C에 저장하십시오.
- SN1(12mL), 1/200th 부피 0.2M GTP(60μL; 최종 농도 1mMM), 및 0.5부피의 사전 가열 글리세롤(6mL)을 적절한 부피의 스크렉캡 튜브에 결합하여 중합 혼합을 준비한다.
- 첫 번째 비합리화
- 펠릿 P2에 얼음 차가운 BRB80을 추가하여 마이크로투블러를 비합하고 5 분 동안 얼음에 둡니다 : 세포에서 튜룰린을 추가하고 1/60th (200 μL)를 추가하고 뇌의 튜룰린의 경우 SN1의 부피의 1/20 th (600 μL)를 추가하십시오.
참고: 저합화 단계 동안 펠릿에 첨가된 얼음-차가운 BRB80의 부피는 항상 SN1의 부피에 상대적입니다. - 마이크로튜블러 펠릿을 부드럽게 재놓아, 용액이 완전히 균일할 때까지 기포를 피하십시오. p1000 팁을 사용하여 파이프 팅의 몇 사이클에 대 한 다음 p200 팁 매 5 분 마다, 20 분 (파이펫의 5 사이클). 이것은 튜룰린 정화의 성공을위한 중요한 단계입니다.
- 용액을 적절한 초원심분리기로 옮기고, 150,000× g,4°C에서 20분 동안 회전한다. SN3을 새로운 1.5mL 초원심분리기 튜브로 전송합니다. 이 원심분리 단계(P3) 후에 형성된 펠릿은 침전단백질(microtubule-관련 단백질 또는 MAP) 및 비중합체 마이크로투알을 함유하고 있습니다. 상체부(SN3)에는 고분자 된 마이크로투블러에서 분리 된 비합합된 튜룰린 디머 및 MAPs가 용해성 성분을 함유하고 있습니다.
- SN3의 1-4 μL을 취하고, 2x Laemmli 버퍼의 9부피를 추가하고, 5분 동안 끓이고, 추가 분석을 위해 -20°C에 저장하십시오.
- BRB80에서 펠릿 P3를 재중단(동일한 양의 SN3)에서, 1-4 μL을 취하고, 2x Laemmli 버퍼9부부, 5분 동안 끓이고 -20°C에 저장한다.
- 펠릿 P2에 얼음 차가운 BRB80을 추가하여 마이크로투블러를 비합하고 5 분 동안 얼음에 둡니다 : 세포에서 튜룰린을 추가하고 1/60th (200 μL)를 추가하고 뇌의 튜룰린의 경우 SN1의 부피의 1/20 th (600 μL)를 추가하십시오.
- 두 번째 중합 (고음 완충제)
- SN3(200 μL) 1부피, 예열된 1M PIPES 1부피(200 μL, 최종 농도 0.5M), 0.2M GTP(2μL, 최종 농도 1mMM)1부, 예열된 글리세롤 1부(200 μL)를 결합하여 중합 믹스를 준비한다.
- 기포의 형성을 피하고, 위아래로 혼합을 피파하고, 초원심분리기 튜브로 옮기다.
- 파라필름으로 튜브를 덮고 30°C로 설정된 수조로 옮기고 20분 동안 배양합니다.
- 150,000 × g,30°C에서 30분 동안 튜브를 원심분리합니다. 상체(SN4)를 제거하고 중합된 마이크로투블러(P4)의 펠릿을 보관한다. 펠릿 P4는 중합된 마이크로튜브를 포함하고, 상류성 SN4는 중합되지 않은 튜룰린, MAP 및 기타 수용성 단백질을 함유하고 있다.
참고: 제2 중합 단계 후 의 미세투알릿은 스냅-냉동 및 최대 1년 동안 -80°C로 저장될 수 있다. - 1-4 μL을 가지고 2x Laemmli 버퍼9 부피를 추가하고 5 분 동안 끓이고 추가 분석을 위해 -20 °C에 저장하십시오.
- 두 번째 폴리머화
- 펠릿 P4에 얼음 차가운 BRB80을 추가하여 마이크로투블러를 비합하고 5 분 동안 얼음에 둡니다 : 세포에서 튜룰린을 넣고 1/100th (120 μL)를 추가하고 뇌의 튜룰린의 경우 SN1의 부피의 1/40 th (300 μL)를 추가하십시오.
- 파이펫은 5분마다 p200 팁으로 위아래로 20분(파이펫팅 5주기).
- 용액을 1.5mL 초원심분리기로 옮기고, 150,000× g,4°C에서 20분 동안 회전한다. SN5를 새로운 1.5mL 초원심분리기 튜브로 전송합니다. 이 원심분리 단계(P5) 후에 형성된 펠릿은 비중합체 마이크로투알을 함유하고 있다. 상수 (SN5)에는 수용성 튜룰린이 포함되어 있습니다.
- 1-4 μL을 가지고 2x Laemmli 버퍼9 부피를 추가하고 5 분 동안 끓이고 추가 분석을 위해 -20 °C에 저장하십시오.
- BRB80(동일한 부피의 SN5)에서 펠릿 P5를 재중단하고, 1-4 μL을 취하고, 2x Laemmli 버퍼9부피를 추가하고, 5분 동안 끓이고, 추가 분석을 위해 -20°C에 저장한다.
- 제3 중합 (저음 버퍼)
- 중합 혼합 준비: SN5(120 μL), 1/200th 부피 0.2M GTP(0.6 μL, 최종 농도는 1mM), 및 적절한 부피의 튜브에서 0.5부피의 사전 가열 글리세롤(60 μL)이 있다.
- 파이펫 위아래로 혼합, 부드럽게 기포의 형성을 피하고, 적절한 초원심 분리 튜브로 전송.
- 파라필름으로 튜브를 덮고 30°C로 설정된 수조로 옮기고 20분 동안 배양합니다.
- 150,000 × g,30°C에서 30분 동안 튜브를 원심분리합니다. 펠릿(P6)은 중합된 마이크로튜브를 함유하고 있으며 상수 SN6에는 소량의 비중합체 튜룰린이 포함되어 있다.
참고: 마이크로튜블 펠릿은 스냅 냉동 및 최대 1년 동안 -80°C로 보관할 수 있습니다. - 1-4 μL을 가지고 2x Laemmli 버퍼9 부피를 추가하고 5 분 동안 끓이고 추가 분석을 위해 -20 °C에 저장하십시오.
- 제3의 중합 해제
- 펠릿 P6에 얼음 차가운 BRB80을 추가하여 마이크로투피를 분해하고 5 분 동안 얼음에 둡니다 : 세포에서 튜룰린을 넣고 1/100th (120 μL)를 추가하고 뇌의 튜룰린의 경우 SN1의 부피의 1/40 th (300 μL)를 추가하십시오.
- 파이펫은 5분마다 p200 팁으로 위아래로 20분(파이펫팅 5주기).
- 용액을 적절한 초원심분리기로 옮기고, 150,000× g,4°C에서 20분 동안 회전한다. 새로운 1.5 mL 초원심분리기 튜브로 SN7을 전송합니다. 펠릿(P7)에는 소량의 비중합체 마이크로튜비를 함유하고 있습니다. 상체(SN7)에는 단독으로 비합합된 마이크로투알(수용성 튜룰린)이 함유되어 있습니다.
- 1-4 μL을 가지고 2x Laemmli 버퍼9 부피를 추가하고 5 분 동안 끓이고 추가 분석을 위해 -20 °C에 저장하십시오.
- BRB80(동일한 부피S)에서 펠릿 P7을 재중단하고, 1-4 μL을 취하고, 2x Laemmli 버퍼9부부, 5분 동안 끓이고, 추가 분석을 위해 -20°C에 저장한다.
- 튜룰린의 양을 정량화(대표 결과참조) 및 알리쿼트 SN7은 소량으로 정량화하고, 스냅 동결및 저장-80°C에 저장한다.
결과
이 방법의 주요 목표는 정제 된 구성 요소와 함께 반복 된 체외 실험을 수행하기에 충분한 수량으로 고품질의 조립 능력이있는 튜룰린을 생산하는 것입니다. 이 튜룰린에서 조립된 마이크로튜블러는 동적 또는 안정적인 마이크로튜부를 이용한 총 내부 반사 형광(TIRF) 현미경 기술, 미세투부역학, MAP 또는 분자 모터와의 상호 작용 및모터(25)에의한 힘 발생을 테스트하는 실험에서 재구성 된 해석에 사용될 수 있다. 그들은 또한 마이크로 튜블러-MAP 공동 펠릿 분석 및 고체 상태 NMR 분광법28에서사용할 수 있습니다.
정화 공정 전반에 걸쳐 튜룰린의 농축및 순도는 쿠마시 염색 된 SDS-폴리 아크라이알라미드 젤 전기 포근 (PAGE) 젤을 사용하여 모니터링 할 수 있으며, 바람직하게는 'TUB' SDS-PAGE 젤을 사용하여 단일 반밴드로 공동 이동하는 α 및 β 튜룰린의분리를허용합니다. 다양한 단계에서 수집된 용해(최후의 비합화를 제외하고, 프로토콜 참조)는 튜룰린 정제의 성공을 평가하기 위한 비교 가능한 양으로 젤에 적재된다(도2A)24. 매우 귀중한 최종 튜룰린 샘플은 튜부린 농도의 측정을 위해 젤에만 로드됩니다. 중합 및 비합화의 반복 사이클의 과정에서 일부 튜룰린을 잃는 것은 정상입니다. 최종 정제 된 튜룰린의 예상보다 낮은 수율은 (i) 마이크로 투블러의 불완전한 비합화로 인해 될 수 있으며, 분수 P3, P5 및 P7, 또는 (ii) 마이크로튜부로비효율적인 튜룰린 중합화가 존재하는 중요한 양의 튜룰린의 존재에 의해 시각화되며, 이 경우 더 적은 양의 튜룰린이 분획 P2, P4 및 P6 이상분획 SN2, SN4 및 SN6(그림2B)에서존재한다. 중합 단계(P2 및 P4의 더 적은 양)(i)가 중합(ii) GTP의 신선한 알리쿼트를 사용하는 동안 충분한 튜룰린 농도를 보장하고,또는(iii) 중합 반응의 온도를 재확인한다. 투룰린이 비합합 단계(SN3 및 SN5의 더 적은 양)에서 분실되면, 얼음에 혼합의 시간뿐만 아니라 파이펫팅을 증가시면.
정제된 튜룰린의 정량화를 위해, SDS-PAGE에서 소 세럼 알부민(BSA, 0.5 μg – 1 μg – 2 μg – 4 μg)(그림 3A)의알려진 수량과 함께 샘플을 실행한다. 젤은 쿠마시 블라스트 블루, 스캔, BSA 및 튜룰린 밴드의 강도로 염색되어 https://openwetware.org/wiki/Protein_Quantification_Using_ImageJ 설명된 정량적밀도(도 3B)에의해 측정됩니다. 동일한 분석은 피지에서 수행 할 수 있습니다, ImageJ33의업그레이드 된 버전. BSA 대역의 값은 튜룰린 대역에서 단백질의 양을 계산하는 데 사용되었던 선형 회귀 방정식을 결정하는 데 사용되었습니다. BSA 곡선 범위 내에서 튜룰린 밴드 강도만 사용하여 튜룰린 농도를 결정합니다. 계산된 튜룰린 농도에 기초하여, 원하는 부비의 알리쿼트(aliquots)가 액체 질소로 제조되고, 스냅 냉동되어 -80°C에 저장된다. 우리는 일반적으로 HeLa S3 서스펜션 배양물 4 개 스피너 병 (세포의 ~ 15 g), 10 15cm 직경의 요리 (세포 1.2 g)에서 - 250 μg의 튜룰린과 마우스 뇌 조직 1 g에서 - 1 mg의 튜룰린을 얻습니다.
특정 튜불린 이소타입 또는 수정의 농축을 확인하기 위해, 정제된 튜불린의 ~0.1 μg는 각각의 항체를 사용하여 면역블레드될 수 있다34,35. 컨트롤 튜룰린은 관심의 튜룰린에 따라 달라집니다. 변형 효소로 체외에서 변형된 튜룰린의 경우 비처리 된 튜룰린을 제어로 사용하십시오. 변종의 과발현에 의해 셀룰로에서 변형된 튜불린의 경우, 효소를 대조군으로 표현하지 않는 세포로부터 정제된 튜불린을 사용한다(도4A). 녹아웃 마우스 뇌로부터 정제된 튜룰린에 대한 제어 튜룰린은 야생형마우스(도 4B)로부터튜룰린이 될 것이다. 모든 면역블롯 분석에서, PTM 독립적인 α-투룰린 항체(12G10)를 사용하여 동일한 부하의 튜불린이 검증된다.
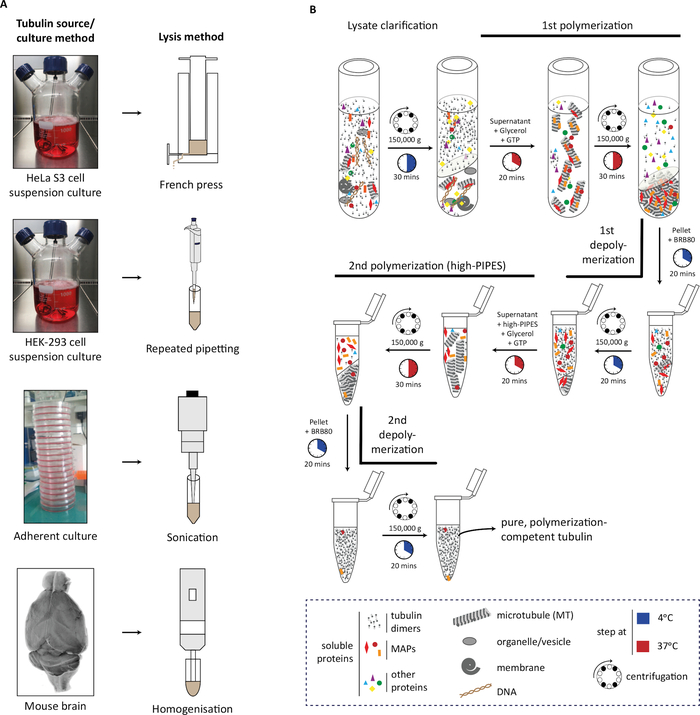
도 1: 중합-중합 주기를 사용하여 다른 소스로부터 의 투룰린 정제. (A)튜룰린의 다른 소스는 특정 전략을 사용하여 lysed. 현탁액에서 배양된 HeLa S3 세포는 프랑스 언론을 사용하여 용액을 제거합니다. HEK-293 세포는 반복적인 파이펫팅에 의해 용해된다. 부착 세포는 조직 균질화를 사용하여 초음파 처리 및 마우스 뇌 조직의 짧은 펄스를 사용하여 용해되었다. (B)냉중합 및 온수 중합의 주기를 이용한 튜룰린 정화 프로토콜의 연속단계의 회로도 표현. 용액과 용액 설명 후, 마이크로 투튜브는 중합및 펠릿화된다. 마이크로튜블은 그 때 중합화되고 그 후에 고어도 완충제에서 중합하게 허용되고, 마이크로튜버와 함께 마이크로투알 관련 단백질(MAP) 공동 침전을 방지합니다. MAP-free 마이크로튜블은 그 후 중합화-중합제의 제3주기를 더 거쳐 고약함 버퍼의 미량을 제거할 수 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 튜룰린 정화의 성공 평가. 튜룰린 정화 프로토콜의 다른 단계에서 수집된 샘플은 'TUB' 나트륨 도데딜설라테-폴리아크라이알라미드 젤 전기포아증(SDS-PAGE) 젤(자세한 내용의 프로토콜 참조)에서 실행되었으며 쿠마시 브릴리언트 블루로 염색하였다. (A)성공적인 튜룰린 정화에서 α 및 β 튜룰린은 과정 전반에 걸쳐 점진적으로 풍부합니다. 제2 중합 후, 마이크로튜브 펠릿(P4)은 다른 단백질 또는 마이크로튜트 관련 단백질(MAP)으로부터 거의 오염이 없다. 절차 중에 튜룰린을 잃는 것은 정상입니다. (B)실패한 튜룰린 정제에서 최종 튜룰린 수율은 낮으며, 투룰린은 중합 후 또는 중합 후 상부체(red box)에 남아 있다. 여기에 나타난 예에서, 튜룰린은 두 중합 단계에서 효율적으로 중합하지 않았다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 쿠마시 염색 나트륨 도데실설페이트-폴리아크라이알라미드 젤 전기포레시스(SDS-PAGE) 젤 및 밀도를 사용하여 정제된 튜룰린의 정량화. (A)쿠마시 스테인드 SDS-PAGE 젤은 소 세럼 알부민(BSA; 0.5, 1, 2 및 4 μg, 회색 그라데이션 라인) 및 정제된 튜룰린의 다른 부피(각각 0.5 및 1 μL, 빛 및 어두운 색상)의 알려진 수량을 가진 겔. 표시된 예에서, 티로시네이트 튜룰린(HeLa S3 tubulin, 밝고 다크 오렌지) 및 탈티로시네이트 튜룰린(Carboxypeptidase A로 처리된 HeLa S3 tubulin, 가볍고 진한 파란색)이 젤에 적재되었다. (B)B) BSA 대역으로부터 (A)는 ImageJ(임의 단위, AU)를 사용하여 정량화하고 적재된 단백질의 양(회색에서 검은 색 점에)에 대하여 플롯하였다. 이러한 점은 겔에 로드된 튜룰린 샘플(빛과 진한 주황색 및 파란색 점)에서 단백질의 양을 계산하는 데 사용된 선형 회귀 선(회색 그라데이션 라인) 및 방정식을 계산하는 데 사용되었습니다. 이것은 튜룰린 샘플의 농도의 계산을 용이하게. BSA 표준 곡선을 초과하는 점을 사용하여 농도(짙은 주황색 및 파란색 점)를 결정해서는 안 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
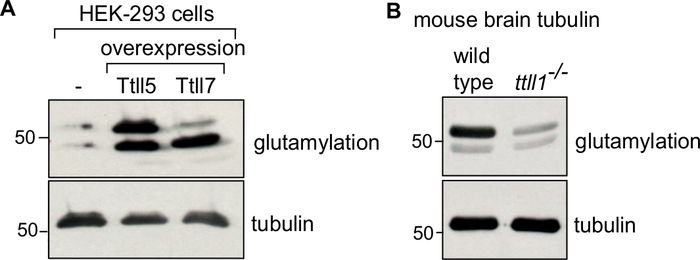
그림 4: 다른 PTM을 가진 정제 된 튜불린의 면역 블롯 분석. (A)HEK-293 세포로부터 정제된 투굴린: GT335 항체를 이용한 폴리글루타밀화의 특이적 농축을 위해 TTLL5 또는 TTLL7을 과발현하는 세포가 분석되었다. TTLL5 과발현은 α 및 β 튜룰린에서 폴리글루타밀레이션을 증가시지만 TTLL7 과발현은 특히 β-튜룰린 글루타밀레이션을 풍부하게 합니다. (B)투툴린은 야생형 및 ttll1-/-마우스의 뇌 조직으로부터 정제된 글루타밀화 의 패턴을 분석하였다. 주요 뇌 글루타밀라제 TTLL136이부족한 ttll1-/-마우스로부터 튜룰린의 폴리글루타밀화의 강력한 감소를 주목한다. 'TUB' 젤은 α 및 β 튜룰린을 분리하는 데 사용되었습니다. 12G10, 항-α-튜룰린 항체에 의해 동일한 양의 튜룰린 하중이 확인되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 설명된 방법은 세포주 및 단일 마우스 뇌에서 중량으로 고품질의 조립 능력이 있는 튜룰린을 신속하게 생성하는 플랫폼을 제공한다. 그것은 오랜 년 동안 분야에서 사용되는 소 뇌에서 튜룰린 정제의 금 표준 프로토콜을 기반으로16,17. 접근법의 한 가지 특별한 장점은 HeLa S3 세포의 현탁액 배양을 사용하는 것입니다. 이는 프로토콜이 임의의 세포생물학 실험실에서 비교적 쉽게 수행될 수 있게 하는 반면, 다른 튜룰린 정제방법(18,19,32,37)은 특정 장비와 전문 지식이 필요하며, 따라서 단백질 정제에 대한 강한 배경을 가진 실험실에서 주로 사용된다. 부착 된 세포주에서 소량의 튜룰린을 생산할 때 다양한 세포주를 사용할 수 있습니다. 우리는 성공적으로 HeLa에서 튜룰린을 정제, U-2 OS, 그리고 HEK-293 세포. 대규모 정화가 필요한 경우, 수확된 세포 또는 뇌는 -80°C에 저장되어 용해 완충제에서 스냅 냉동및 저장될 수 있으며, 다중 세포 펠릿 또는 뇌를 함께 풀링하여 더 많은 양의 튜룰린을 정화할 수 있다.
세포주에서 정제된 투불린은 튜룰린 PTM이 거의 없습니다. 이 티르 튜부린은 쉽게 하나의 간단한 단계25에서detyrosined (deTyr-) 튜룰린으로 변환 할 수 있습니다. 다른 PTM을 사용하여 튜룰린을 생산하기 위해, 특정 튜룰린 변형 효소는 튜룰린 정화 전에 세포에서 과발현될 수 있다. 더욱이, 물질의 근원으로 인간 기원의 세포주를 사용하는 것은 microtubules와 인간 적인 MAPs 사이 상호 작용을 공부할 때 잠재적인 교차 종 문제를 피하는 것을 돕습니다. 또한, 변형되지 않은(HEK293) 또는 변형(HeLa 등) 세포로부터의 튜룰린은 정상 대 종양 세포 소과비에 대한 미세투필 지향 약물(예를 들어, taxanes)의 효과에 대한 정보를 제공할 수 있다.
마지막으로, 우리의 프로토콜은 단일 마우스 뇌에서 튜룰린의 정화를 용이하게. 튜룰린 돌연변이 및 수정의 마우스 모델수가 증가함에 따라, 이 프로토콜은 변경된 튜툴린 동종조성물(38,39,40 또는 튜룰린 PTM31, 41)과마이크로튜블러의 성질 및 상호작용의 직접적인 분석을 허용한다.
접근은 중합화 및 비합화의 주기를 기반으로 합니다. 따라서, 특정 튜룰린 동소형 또는 마이크로투블러의 조립 및 분해 특성에 영향을 미치는 특정 PTM을 가진 튜룰린은 정화 과정에서 그러한 튜룰린 형태의 불균형한 손실 또는 감소를 초래할 수 있다. 그럼에도 불구하고, 우리는 아세틸화, 황량화, 글루타밀화 및 글리시네이션과 같은 주요 튜룰린 PTM이 튜룰린 정화공정(24)을통해 마이크로튜부에 유지되는 것을 보여주었습니다. 그러나, 세포 또는 조직에서 튜룰린 조성물의 정량적 분석을 위해, TOG 컬럼 계 튜룰린 정제 접근법은 편견, 중합-독립적인 튜룰린정제(18)를허용하기 때문에 더 적절하다는 점에 유의해야 한다. 그 한계에도 불구하고, 우리의 프로토콜은 체외 재헌법 실험에서 세심하게 사용할 수있는 고품질 튜룰린의 큰 양을 생성에 큰 이점을 제공합니다. 특히, 일상적인 실험에서 PTM이 풍부한 뇌 튜룰린의 사용을 용이하게한다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 ANR-10-IDEX-0001-02, LabEx Cell'n'Scale ANR-11-LBX-0038 및 Institut de 컨버전스 Q-life ANR-17-CONV-0005에 의해 지원되었습니다. CJ는 인스티투트 큐리의 지원을 받고 있습니다. 프랑스 국립연구청(ANR)은 ANR-12-BSV2-0007 및 ANR-17-CE13-0021, 인스티투트 국립 뒤암(INCA) 교부금 2014-PL BIO-11-ICR-1, 그리고 퐁당 부어 라 레쉐메디컬(FRM) 교부금 DEQ2010.30.16. MMM은 퐁도크 알츠하이머 보조금 FR-16055p에 의해 지원되며, 프랑스 알츠하이머 는 AAP SM을 부여 2019 n ° 2023. JAS는 마리 Skłodowska-Curie 보조금 협정 No 675737에 따라 유럽 연합의 호라이즌 2020 연구 및 혁신 프로그램에 의해 지원되었으며, FRM 보조금 FDT201904008210. SB는 FRM 보조금 FDT201805005465에 의해 지원되었다.
우리는 Janke 연구소의 모든 구성원, 특히 J. 수프론뿐만 아니라 G. 라키치 (Institut MICALIS, AgroParisTech) 및 A. Gautreau (에콜 폴리 테크닉대학)의 프로토콜 설립 기간 동안 도움을 주셔서 감사합니다. 우리는 마우스 사육과 관리에 도움을 준 Institut Curie의 동물 시설에 감사드립니다.
J. 프랑켈과 M. 넬슨에 의해 개발 된 항체 12G10은 NICHD의 후원하에 개발된 개발 연구 하이브리드 종 은행에서 얻어졌고 아이오와 대학에 의해 유지되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 M MgCl2 | Sigma | #M1028 | |
| 1-L cell culture vessels | Techne F7610 | Used for spinner cultures. Never stir the empty spinner bottles. When spinner bottles are in the cell culture incubator, always keep the lateral valves of spinner bottles slightly open to facilitate the equilibration of media with incubator’s atmosphere. After use, fill the spinner bottles immediately with tap water to avoid drying of remaining cells on the bottle walls. Wash the bottles with deionised water, add app 200 ml of deionised water and autoclave. Under a sterile cell culture hood remove the water and allow the bottles to dry completely, still under the hood, for several hours. Never use detergents for cleaning the spinner bottles because any trace amounts of the detergent can be deleterious to the cells. | |
| 1.5- and 2-ml tubes | |||
| 14-ml round-bottom tubes | |||
| 15-cm-diameter sterile culture dishes | |||
| 15-ml screw-cap tubes | |||
| 2-mercaptoethanol | Sigma | #M3148 | 2-mercaptoethanol is toxic and should be used under the hood. |
| 4-(2-aminoethyl)-benzenesulfonyl fluoride | Sigma | #A8456 | |
| 40% Acrylamide | Bio-Rad | #161-0140 | |
| 5-, 10- 20-ml syringes | |||
| 5-ml, 10-ml, 25-ml sterile pipettes | |||
| 50-ml screw-cap tubes | |||
| Ammonium persulfate (APS) | Sigma | #A3678 | |
| Anti-alpha-tubulin antibody, 12G10 | Developed by J. Frankel and M. Nelson, obtained from the Developmental Studies Hybridoma Bank, developed under the auspices of the NICHD, and maintained by the University of Iowa | dilution: 1/500 | |
| Anti-glutamylated tubulin antibody, GT335 | AdipoGen | #AG-20B-0020 | dilution: 1/20,000 |
| Aprotinin | Sigma | #A1153 | |
| Balance (0.1 – 10 g) | |||
| Beckman 1-l polypropylene bottles | For collecting spinner cultures | ||
| Beckman Avanti J-26 XP centrifuge | For collecting spinner cultures | ||
| Biological stirrer | Techne MCS-104L | Installed in the cell culture incubator (for spinner cultures), 25 rpm for Hela S3 and HEK 293 cells | |
| Bis N,N’-Methylene-Bis-Acrylamide | Bio-Rad | #161-0201 | |
| Blender IKA Ultra-Turrax® | For lysing brain tissue, use 5-mm probe, with the machine set at power 6 or 7. Blend the brain tissue 2-3 times for 15 s on ice. | ||
| Bovine serum albumin (BSA) | Sigma | #A7906 | |
| Bromophenol blue | Sigma | #1.08122 | |
| Carboxypeptidase A (CPA) | Sigma | #C9268 | Concentration: 1.7 U/µl |
| Cell culture hood | |||
| Cell culture incubator set at 37°C, 5% CO2 | |||
| Dimethyl sulfoxide (DMSO) | Sigma | #D8418 | DMSO can enhance cell and skin permeability of other compounds. Avoid contact and use skin and eye protection. |
| DMEM medium | Life Technologies | #41965062 | |
| DTT, DL-Dithiothreitol | Sigma | #D9779 | |
| EDTA | Euromedex | #EU0007-C | |
| EGTA | Sigma | #E3889 | |
| Ethanol absolute | Fisher Chemical | #E/0650DF/15 | |
| Fetal bovine serum (FBS) | Sigma | #F7524 | |
| French pressure cell press | Thermo electron corporation | #FA-078A | with a #FA-032 cell; for lysing big amounts of cells. Set at medium ratio, and the gauge pressure of 1,000 psi (corresponds to 3,000 psi inside the disruption chamber). |
| Glycerol | VWR Chemicals | #24388.295 | |
| Glycine | Sigma | #G8898 | |
| GTP | Sigma | #G8877 | |
| Heating block | Stuart | #SBH130D | |
| Hela cells | ATCC® CCL-2™ | ||
| Hela S3 cells | ATCC | ATCC® CCL-2.2™ | |
| Hydrochloric acid (HCl ) | VWR | #20252.290 | |
| Inverted microscope | With fluorescence if cell transfection is to be verified | ||
| Isopropanol | VWR | #20842.298 | |
| jetPEI | Polyplus | #101 | |
| JLA-8.1000 rotor | For collecting spinner cultures | ||
| KOH | Sigma | #P1767 | KOH is corrosive and causes burns; use eye and skin protection. |
| L-Glutamine | Life Technologies | #25030123 | |
| Laboratory centrifuge for 50-ml tubes | Sigma | 4-16 K | |
| Leupeptin | Sigma | #L2884 | |
| Liquid nitrogen | |||
| Micro-pipettes p2.5, p10, p20, p100, p200 and p1000 and corresponding tips | |||
| Micropestles | Eppendorf | #0030 120.973 | |
| Mouse brain tissue | Animal care and use for this study were performed in accordance with the recommendations of the European Community (2010/63/UE). Experimental procedures were specifically approved by the ethics committee of the Institut Curie CEEA-IC #118 (authorization no. 04395.03 given by National Authority) in compliance with the international guidelines. | ||
| Needles 18G X 1 ½” (1.2 X 38 mm | Terumo | #18G | |
| Needles 20G X 1 ½” (0.9 X 38 mm | Terumo | #20G | |
| Needles 21G X 4 ¾” (0.8 X 120 mm | B.Braun | #466 5643 | |
| Parafilm | |||
| PBS | Life Technologies | #14190169 | |
| Penicillin-Streptomycin | Life Technologies | #15140130 | |
| pH-meter | |||
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma | #P7626 | PMSF powder is hazardous. Use skin and eye protection when preparing PMSF solutions. |
| PIPES | Sigma | #P6757 | |
| Pipette-boy | |||
| Rotors | Beckman 70.1 Ti; TLA-100.3; and TLA 55 | ||
| SDS-PAGE electrophoresis equipment | Bio-Rad | #1658001FC | |
| SDS, Sodium dodecyl sulphate | VWR | #442444H | For preparing Laemmeli buffer |
| SDS, Sodium dodecyl sulphate | Sigma | #L5750 | For preparing 'TUB' SDS-PAGE gels |
| Sonicator | Branson | #101-148-070 | Used for lysing cells grown as adherent cultures. Use 6.5 mm diameter probe, set the sonicator at “Output control” 1, “Duty cycle” 10% and time depending on the cell type used. |
| Tabletop centrifuge for 1.5 ml tubes | Eppendorf | 5417R | |
| TEMED, N, N, N′, N′-Tetramethylethylenediamine | Sigma | #9281 | |
| Trichostatin A (TSA) | Sigma | #T8552 | |
| Triton X-100 | Sigma | #T9284 | |
| Trizma base (Tris) | Sigma | #T1503 | |
| Trypsin | Life Technologies | #15090046 | |
| Ultracentrifuge rotors | TLA-55, TLA-100.3 and 70.1 Ti rotors | Set at 4°C or 30°C based on the need of the experiment | |
| Ultracentrifuge tubes | Beckman | #357448 | for using with TLA-55 rotor |
| Ultracentrifuge tubes | Beckman | #349622 | for using with TLA-100.3 rotor |
| Ultracentrifuge tubes | Beckman | #355631 | for using with 70.1 Ti rotor |
| Ultracentrifuges | Beckman | Optima L80-XP (or equivalent) and Optima MAX-XP (or equivalent) | Set at 4°C or 30°C based on the need of the experiment |
| Vortex mixer | |||
| Water bath equipped with floaters or tube holders | Set at 30°C |
참고문헌
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Janke, C. The tubulin code: Molecular components, readout mechanisms, and functions. Journal of Cell Biology. 206 (4), 461-472 (2014).
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews: Molecular Cell Biology. 21 (6), 307-326 (2020).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Margolis, R. L., Wilson, L. Opposite end assembly and disassembly of microtubules at steady state in vitro. Cell. 13 (1), 1-8 (1978).
- Borisy, G. G., Olmsted, J. B. Nucleated assembly of microtubules in porcine brain extracts. Science. 177 (55), 1196-1197 (1972).
- Kirschner, M. W., Williams, R. C. The mechanism of microtubule assembly in vitro. Journal of Supramolecular Structure. 2 (2-4), 412-428 (1974).
- Baas, P. W., Lin, S. Hooks and comets: The story of microtubule polarity orientation in the neuron. Developmental Neurobiology. 71 (6), 403-418 (2011).
- Stepanova, T., et al. Visualization of microtubule growth in cultured neurons via the use of EB3-GFP (end-binding protein 3-green fluorescent protein). Journal of Neuroscience. 23 (7), 2655-2664 (2003).
- Nedelec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Bieling, P., Telley, I. A., Surrey, T. A minimal midzone protein module controls formation and length of antiparallel microtubule overlaps. Cell. 142 (3), 420-432 (2010).
- Roostalu, J., et al. Directional switching of the kinesin Cin8 through motor coupling. Science. 332 (6025), 94-99 (2011).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nature Materials. 14 (11), 1156-1163 (2015).
- Hendricks, A. G., Goldman, Y. E., Holzbaur, E. L. F. Reconstituting the motility of isolated intracellular cargoes. Methods in Enzymology. 540, 249-262 (2014).
- Dogterom, M., Surrey, T. Microtubule organization in vitro. Current Opinion in Cell Biology. 25 (1), 23-29 (2013).
- Vallee, R. B. Reversible assembly purification of microtubules without assembly-promoting agents and further purification of tubulin, microtubule-associated proteins, and MAP fragments. Methods in Enzymology. 134, 89-104 (1986).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Widlund, P. O., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Molecular Biology of the Cell. 23 (22), 4393-4401 (2012).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Letters. 587 (21), 3450-3455 (2013).
- Uchimura, S., et al. A flipped ion pair at the dynein-microtubule interface is critical for dynein motility and ATPase activation. Journal of Cell Biology. 208 (2), 211-222 (2015).
- Pamula, M. C., Ti, S. C., Kapoor, T. M. The structured core of human beta tubulin confers isotype-specific polymerization properties. Journal of Cell Biology. 213 (4), 425-433 (2016).
- Vemu, A., et al. Structure and dynamics of single-isoform recombinant neuronal Human tubulin. Journal of Biological Chemistry. 291 (25), 12907-12915 (2016).
- Ti, S. C., Alushin, G. M., Kapoor, T. M. Human beta-tubulin isotypes can regulate microtubule protofilament number and stability. Developmental Cell. 47 (2), 175-190 (2018).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nature Protocols. 14, 1634-1660 (2019).
- Barisic, M., et al. Microtubule detyrosination guides chromosomes during mitosis. Science. 348 (6236), 799-803 (2015).
- Nirschl, J. J., Magiera, M. M., Lazarus, J. E., Janke, C., Holzbaur, E. L. F. alpha-Tubulin tyrosination and CLIP-170 phosphorylation regulate the initiation of dynein-driven transport in neurons. Cell Reports. 14 (11), 2637-2652 (2016).
- Guedes-Dias, P., et al. Kinesin-3 responds to local microtubule dynamics to target synaptic cargo delivery to the presynapse. Current Biology. 29 (2), 268-282 (2019).
- Luo, Y., et al. Direct observation of dynamic protein interactions involving human microtubules using solid-state NMR spectroscopy. Nature Communications. 11 (1), 18(2020).
- Even, A., et al. ATAT1-enriched vesicles promote microtubule acetylation via axonal transport. Science Advances. 5 (12), 2705(2019).
- Wolff, J., Sackett, D. L., Knipling, L. Cation selective promotion of tubulin polymerization by alkali metal chlorides. Protein Science. 5 (10), 2020-2028 (1996).
- Magiera, M. M., et al. Excessive tubulin polyglutamylation causes neurodegeneration and perturbs neuronal transport. EMBO Journal. 37 (23), 100440(2018).
- Lacroix, B., Janke, C. Generation of differentially polyglutamylated microtubules. Methods in Molecular Biology. 777, 57-69 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Magiera, M. M., Janke, C. Methods in Cell Biology Vol. 115 Microtubules, in vitro. Correia, J. J., Wilson, L. , Academic Press. 247-267 (2013).
- Hausrat, T. J., Radwitz, J., Lombino, F. L., Breiden, P., Kneussel, M. Alpha- and beta-tubulin isotypes are differentially expressed during brain development. Developmental Neurobiology. , (2020).
- Janke, C., et al. Tubulin polyglutamylase enzymes are members of the TTL domain protein family. Science. 308 (5729), 1758-1762 (2005).
- Newton, C. N., et al. Intrinsically slow dynamic instability of HeLa cell microtubules in vitro. Journal of Biological Chemistry. 277 (45), 42456-42462 (2002).
- Belvindrah, R., et al. Mutation of the alpha-tubulin Tuba1a leads to straighter microtubules and perturbs neuronal migration. Journal of Cell Biology. 216 (8), 2443-2461 (2017).
- Breuss, M., et al. Mutations in the murine homologue of TUBB5 cause microcephaly by perturbing cell cycle progression and inducing p53 associated apoptosis. Development. , (2016).
- Latremoliere, A., et al. Neuronal-specific TUBB3 is not required for normal neuronal function but is essential for timely axon regeneration. Cell Reports. 24 (7), 1865-1879 (2018).
- Morley, S. J., et al. Acetylated tubulin is essential for touch sensation in mice. Elife. 5, (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유