Method Article
Purificación de tubulina con modificaciones posttranslacionales controladas e isotipos de fuentes limitadas por ciclos de polimerización-despolimerización
En este artículo
Resumen
Este protocolo describe la purificación de la tubulina a partir de fuentes pequeñas/medianas como células cultivadas o cerebros de ratón único, utilizando ciclos de polimerización y despolimerización. La tubulina purificada se enriquece en isotipos específicos o tiene modificaciones posttranslacionales específicas y se puede utilizar en ensayos de reconstitución in vitro para estudiar dinámicas e interacciones de microtúbulos.
Resumen
Un aspecto importante de los estudios del citoesqueleto de microtúbulos es la investigación del comportamiento de los microtúbulos en experimentos de reconstitución in vitro. Permiten el análisis de las propiedades intrínsecas de los microtúbulos, como la dinámica, y sus interacciones con proteínas asociadas a microtúbulos (MAPs). El "código de tubulina" es un concepto emergente que apunta a diferentes isotipos de tubulina y varias modificaciones posttranslacionales (PTM) como reguladores de propiedades y funciones de microtúbulos. Para explorar los mecanismos moleculares del código de tubulina, es crucial realizar experimentos de reconstitución in vitro utilizando tubulina purificada con isotipos y PTM específicos.
Hasta la fecha, esto era técnicamente desafiante como la tubulina cerebral, que es ampliamente utilizada en experimentos in vitro, alberga muchos PTM y tiene una composición isotipo definida. Por lo tanto, desarrollamos este protocolo para purificar la tubulina de diferentes fuentes y con diferentes composiciones isotipos y PTMs controlados, utilizando el enfoque clásico de los ciclos de polimerización y despolimerización. En comparación con los métodos existentes basados en la purificación de la afinidad, este enfoque produce tubulina pura y competente para la polimerización, ya que la tubulina resistente a la polimerización o despolimerización se descarta durante los sucesivos pasos de purificación.
Describimos la purificación de la tubulina de las líneas celulares, cultivada ya sea en suspensión o como cultivos adherentes, y de cerebros de ratón únicos. El método describe primero la generación de masa celular tanto en la suspensión como en los ajustes adherentes, el paso de lisis, seguido de las sucesivas etapas de purificación de la tubulina mediante ciclos de polimerización-despolimerización. Nuestro método produce tubulina que se puede utilizar en experimentos que abordan el impacto del código de tubulina en las propiedades intrínsecas de microtúbulos e interacciones de microtúbulos con proteínas asociadas.
Introducción
Los microtúbulos desempeñan un papel crítico en muchos procesos celulares. Dan a las células su forma, construyen husillos meioticos y mitoticos para la segregación cromosómica, y sirven como pistas para el transporte intracelular. Para realizar estas diversas funciones, los microtúbulos se organizan de diferentes maneras. Una de las preguntas intrigantes en el campo es entender los mecanismos moleculares que permiten que los microtúbulos conservados estructural y evolutivamente se adapten a esta plétora de organizaciones y funciones. Un mecanismo potencial es la diversificación de los microtúbulos, que se define por el concepto conocido como el 'código de tubulina'1,2,3. El código de tubulina incluye dos componentes principales: la incorporación diferencial de productos genéticos de α y β-tubulina (isotipos de tubulina) en los microtúbulos y modificaciones posttransacionales de tubulina (PTM).
Desde la década de 1970, los experimentos de reconstitución in vitro, combinados con técnicas de microscopía ligera en evolución, han allanado el camino para importantes descubrimientos sobre las propiedades de los microtúbulos: inestabilidad dinámica4 y cinta de correr5,y sus otros mecanismos y funciones6,7,8,9,10,11,12,13,14,15. Casi todos los experimentos in vitro realizados hasta ahora se han basado en la tubulina purificada del tejido cerebral utilizando ciclos repetidos de polimerización y despolimerización16,17. Aunque la purificación del tejido cerebral confiere la ventaja de obtener tubulina de alta calidad en grandes cantidades (generalmente cantidades de gramo), un inconveniente importante es la heterogeneidad ya que la tubulina purificada del tejido cerebral es una mezcla de diferentes isotipos de tubulina y se enriquece con muchos PTMs de tubulina. Esta heterogeneidad hace imposible delinear el papel de un PTM de tubulina en particular o isotipo en el control de propiedades y funciones de microtúbulos. Por lo tanto, producir tubulina competente para el montaje con PTMs de tubulina controlados y composición homogénea del isotipo es esencial para abordar los mecanismos moleculares del código de tubulina.
Recientemente, se ha desarrollado un enfoque para purificar la tubulina mediante cromatografía de afinidad utilizando el dominio tog (gensobreexpresado tumoral) de levadura Stu2p. En este método, la tubulina en liatos crudos de células o tejidos se pasa a través de una columna donde se une al dominio TOG inmovilizado por matriz, lo que permite el análisis de toda la piscina de tubulina de una muestra dada, incluso muy pequeña. Un enfoque largamente esperado para purificar la tubulina recombinante también ha sido descrito en los últimos años. Se basa en el sistema baculovirus, en el que se expresa un vector bi-cistrónico que contiene genes α y β-tubulina en las células de insectos19. Sin embargo, este método es muy engorroso y lento y por lo tanto se utiliza principalmente para estudiar el impacto de las mutaciones de tubulina20 y isotipos de tubulina21,22,23 in vitro.
En el protocolo actual, describimos un método que utiliza el enfoque de polimerización-despolimerización bien establecido y ampliamente utilizado como un plan para generar tubulina con diferentes niveles de modificación ya sea a partir de líneas celulares o del tejido cerebral del ratón24. En este procedimiento, la tubulina se ciclo entre el soluble (trobulina dimer a 4 °C) y forma polimerizada (microtúbulos a 30 °C en presencia de guanosina 5'-tripfosfato [GTP]). Cada forma se separa a través de sucesivos pasos de centrifugación: los atenuadores de tubulina permanecerán en el sobrenadante después de un giro frío (4 °C), mientras que los microtúbulos se peletizarán a 30 °C. Además, se lleva a cabo un paso de polimerización a alta concentración de piperazina-N,N′-bis(ácido etanoesulfónico) (PIPES), que permite la eliminación de proteínas asociadas a microtúbulos de los microtúbulos y, por lo tanto, de la tubulina finalmente purificada. La tubulina purificada a partir de células HeLa S3 cultivadas como cultivos de suspensión o adherentes está virtualmente libre de cualquier PTM de tubulina y se ha utilizado en experimentos recientes de reconstitución in vitro25,26,27,28. Hemos adaptado aún más el método para purificar la tubulina de cerebros de ratón único, que se pueden utilizar para un gran número de modelos de ratón con cambios en isotipos de tubulina y PTM.
En el protocolo, primero describimos la generación del material de origen (masa celular o tejido cerebral), su lisis(Figura 1A),seguido de los sucesivos pasos de polimerización y despolimerización de la tubulina para purificar la tubulina (Figura 1B). Además, describimos el proceso para evaluar la pureza(Figura 2A,B)y la cantidad (Figura 3A,B) de la tubulina purificada. El método se puede adaptar para producir tubulina enriquecida con un PTM seleccionado mediante la sobreexpresión de una enzima modificadora en las células antes de la purificación de la tubulina (Figura 4B). Alternativamente, las enzimas modificadores de la tubulina se pueden agregar a la tubulina durante el proceso de purificación. Por último, podemos purificar la tubulina carente de isotipos específicos o PTMs de los cerebros de ratones deficientes en las correspondientes enzimas modificadores de la tubulina (Figura 4B)29.
El método que describimos aquí tiene dos ventajas principales: (i) permite la producción de cantidades suficientemente grandes de tubulina en un tiempo relativamente corto, y (ii) genera tubulina pura de alta calidad, con composición isotipo de tubulina específica o PTM. En el video asociado de este manuscrito, destacamos algunos de los pasos críticos involucrados en este procedimiento.
Protocolo
El cuidado y uso de animales para este estudio se realizó de acuerdo con las recomendaciones de la Comunidad Europea (2010/63/UE). Los procedimientos experimentales fueron aprobados específicamente por el comité de ética del Institut Curie CEEA-IC #118 (autorización Nº 04395.03 dada por la Autoridad Nacional) en cumplimiento de las directrices internacionales.
1. Preparación de reactivos para purificación de tubulina
NOTA: Todos los tampones utilizados para la purificación de la tubulina deben contener sales de potasio y NO sales de sodio30.
- Preparar 1 L de medio completo: el medio eagle modificado (DMEM) de Dulbecco, con un 10% de suero bovino fetal (FBS, 100 ml), 200 mM L-glutamina (10 ml de 2 M de stock) y 1x penicilina-estreptomicina (10 ml de stock de 100x). Conservar a 4 °C.
- Prepare 10 M de hidróxido de potasio (KOH) disolviendo 140 g de KOH en agua, ajuste el volumen final a 250 ml y almacene a temperatura ambiente.
- Preparar ácido tetraacético de etilenodiamina de 0,5 M (EDTA), pH 8, disolviendo 36,5 g de EDTA en agua, ajustar el pH a 8,0 usando KOH (de lo contrario EDTA no se disolverá) y el volumen final a 250 ml, esterilizar el filtro y almacenar a temperatura ambiente.
- Prepare solución salina (PBS)-EDTA tamponada de fosfato de 5 mM añadiendo 5 ml de 0,5 M EDTA a 500 ml de PBS, esterilizar el filtro y almacenar a temperatura ambiente.
- Prepare 0,5 M K-PIPES, pH 6,8, disolviendo 75,5 g de TUBERÍAS en agua, ajúsese a pH 6,8 con KOH (de lo contrario PIPES no se disolverá) y el volumen final a 500 mL, esterilizará el filtro y almacenará a 4 °C.
- Prepare 1 M K-PIPES, pH 6.8, disolviendo 15.1 g de PIPAS en agua, ajuste a pH 6.8 con KOH y el volumen final a 50 mL, filtre-esteriliza y almacene a 4 °C.
- Preparar 0,5 M de potasio-etilenglicol-bis (β-éter de aminoetil)-N,N,N′,N′-ácido tetraacético (K-EGTA, pH 7.7) disolviendo 47.5 g de EGTA en agua, ajuste a pH 7.7 con KOH y el volumen final a 250 mL, filtre-esteriliza y almacene a temperatura ambiente.
- Preparar BRB80 (80 mM K-PIPES, pH 6,8; 1 mM K-EGTA; 1 mM de cloruro de magnesio [MgCl2])mediante la mezcla de 3,2 ml de tuberías de 0,5 M, 40 μL de 0,5 M K-EGTA y 20 μL de 1 M MgCl2 y ajuste el volumen final a 20 ml. Conservar a 4 °C.
- Preparar 0,1 M fenilmethanesulfonil fluoruro (PMSF) disolviendo 435 mg de PMSF en isopropanol para obtener un volumen final de 25 ml y almacenar a -20 °C.
- Preparar inhibidores de la proteasa mezclar (200x) mediante la disolución de 10 mg de aprotinin, 10 mg de leupeptina, y 10 mg de 4-(2-aminoetil)-bencenosulfonil fluoruro en agua para obtener un volumen final de 2,5 ml, hacer alícuotas de 100 μL, y almacenar a -20 °C.
- Preparar 10% Tritón X-100 mezclando 5 ml de Tritón X-100 en 45 ml de agua, esterilizar filtro y almacenar a temperatura ambiente.
- Preparar tampón de lisis (BRB80 complementado con 1 mM 2-mercaptoetanol, 1 mM PMSF, 1x inhibidores de la proteasa se mezclan y, opcionalmente para células HEK-293, 0,2% Tritón X-100) el día de la purificación de la tubulina mezclando 20 ml de BRB80 con 1,5 μL de 2-mercaptoetanol, 200 μL de 0,1 M PMSF, 100 μL de la mezcla de inhibidores de la proteasa y, opcionalmente, para las células HEK-293 , 400 μL del 10% Tritón X-100.
NOTA: 2-mercaptoetanol es tóxico y debe utilizarse en la campana de humo. - Prepare 0,2 M GTP disolviendo 1 g de GTP en 9,5 ml de agua, ajuste el pH a 7,5 usando KOH, haga alícuotas de 20 μL y almacene a -20 °C. Evite ciclos repetidos de congelación y descongelación.
- Preparar 1 M tris (hidroximetil) aminometano-clorhidrato (Tris-HCl) disolviendo 60,56 g de Tris en agua, ajustarse a pH 6,8 con HCl, completar a un volumen final de 500 mL, esterilizar el filtro y almacenar a temperatura ambiente.
- Preparar 5x tampón de muestra Laemmli (450 mM dithiothreitol (TDT); 10% dodecylsulfato sódico (SDS); 400 μM Tris-HCl, pH 6.8; 50% glicerol; ~0.006% azul bromophenol) añadiendo 4 g de SDS a 16 ml de Tris-HCl de 1 M precalentado, pH 6.8, y mezclar la solución suavemente. Añadir 2,6 g de TDT y 20 ml de 100% glicerol a la mezcla y revuelva hasta que la solución se vuelva homogénea. Añadir la cantidad deseada de bromophenol azul (2,5 mg) para alcanzar la intensidad de color requerida. Haga 5 mL de coácuotas y guárdelos a -20 °C. Prepare la solución de trabajo 2x del amortiguador de la muestra Laemmli diluyendo el caldo 5x en agua destilada.
2. Amplificación y cosecha de fuentes de tubulina
NOTA: En este protocolo, se utilizaron tres fuentes de tubulina: (i) células (HeLa S3 y HEK-293) cultivadas como cultivos de suspensión; (ii) células cultivadas como cultivos adherentes (HEK-293, HeLa y U2 OS); y (iii) tejido cerebral del ratón. Este protocolo considera el día de la purificación de la tubulina como "día 0" y, en consecuencia, se han descrito otros pasos con respecto al día 0.
- Amplificación de células
- Células cultivadas como cultivos de suspensión
NOTA: Para purificar con éxito la tubulina de los cultivos de suspensión, utilice al menos 2 L de cultivo de suspensión.- Para 2 L de cultivo de suspensión, revivir y crecer el tipo de célula preferida para obtener 6 × 107 células 10 días antes del día de preparación. El día -10, las células de los platos en seis platos de 15 cm de diámetro a 107 células por plato.
- El día -8, precaliente la cantidad requerida de medio completo a 37 °C. Agregue 1 L de medio precalentado a cada botella de spinner en condiciones estériles. Coloque los hilanderos en una mesa de agitador situada a 20-25 rpm dentro de la incubadora de cultivo celular, abra ligeramente las tapas laterales del spinner para permitir que el medio se reequilibren a la atmósfera de la incubadora.
NOTA: Para evitar cualquier contaminación, limpie a fondo la superficie exterior de los medios de comunicación y las botellas de spinner usando 70% de etanol. - En el día -7, trippinizar y recoger las células cultivadas hasta el 80-90% de confluencia (aproximadamente 1,8 × 108 células). Recoge células de 3 platos a la vez, baja (200 × g,5 min, temperatura ambiente) y vuelve a suspender todas las celdas en 10 ml de DMEM.
NOTA: La disociación exhaustiva de las células en este punto es muy importante para evitar la formación de agregados más grandes en las botellas de spinner, lo que afecta la supervivencia celular y resulta en un bajo rendimiento de tubulina. - Agregue 5 ml de la suspensión celular a cada frasco de spinner que contenga 1 L de DMEM, devuelva los spinners a la mesa del agitador en la incubadora de cultivo celular y permita que las células crezcan durante una semana.
- Células cultivadas como culturas adherentes
NOTA: Para purificar con éxito la tubulina de las células adherentes, utilice un mínimo de 10 platos de 80-90% de confluencia.- Revive y amplifica el tipo de célula deseado para obtener 1 × 108 células tres días antes del día de la preparación de la tubulina.
- El día -3, platea estas células en diez platos de 15 cm a 1 × 107células por plato y les permite crecer 80-90% de confluencia.
- El día -1, si es necesario, transfecta las células con un plásmido para expresar una enzima modificador de la tubulina o un isotipo de tubulina en particular.
- Células cultivadas como cultivos de suspensión
- Cosecha de las células/tejido cerebral
- Células cultivadas como cultivos de suspensión
- Transfiera la suspensión celular de los hilanderos a botellas de centrífuga de 1 L(tabla de materiales)y las células de pellets a 250 × g,15 min, temperatura ambiente. Para iniciar inmediatamente otra cultura de células HeLa S3 en las botellas spinner, deje 100 ml de suspensión celular en los spinners, y agregue 1 L de DMEM completo y precalentado a la botella spinner.
NOTA: Compruebe cuidadosamente la contaminación bacteriana antes de proceder a la purificación de la tubulina. - Resuspend células peletadas de cada botella de centrífuga en 10 ml de PBS helado, y transferir todas las células a tubos de tapa de tornillo de 50 ml. Durante la re-suspensión, mantenga las células en hielo. Peletizar las celdas a 250 × g,15 min, 4 °C.
NOTA: Siga las recomendaciones para la limpieza y almacenamiento de botellas spinner (consulte Tabla de materiales). - Deseche el sobrenadante y determine el volumen del pellet de celda. A partir de 2 L de cultivo de suspensión (dos botellas spinner), espere un pellet celular de 5-6 mL.
NOTA: En el protocolo descrito a continuación, se supone que el volumen del pellet celular es de 10 ml. Ajuste el experimento según los volúmenes de pellets. - Agregue 1 volumen (10 ml) de búfer de lisis y vuelva a suspender el pellet de celda.
NOTA: La relación entre el volumen de pellets celulares y el volumen del búfer de lisis es muy importante para la purificación exitosa de la tubulina. Añadir más buffer de lisis disminuye la concentración de tubulina, que luego no alcanza la concentración crítica necesaria para la polimerización, reduciendo así en gran medida el rendimiento de la tubulina.
NOTA: Las células resuspended en tampón de lisis se pueden congelar en nitrógeno líquido y almacenarse a -80 °C durante dos meses.
- Transfiera la suspensión celular de los hilanderos a botellas de centrífuga de 1 L(tabla de materiales)y las células de pellets a 250 × g,15 min, temperatura ambiente. Para iniciar inmediatamente otra cultura de células HeLa S3 en las botellas spinner, deje 100 ml de suspensión celular en los spinners, y agregue 1 L de DMEM completo y precalentado a la botella spinner.
- Células cultivadas como culturas adherentes
NOTA: Las células de cultivos adherentes deben cosecharse muy rápidamente para una purificación exitosa de la tubulina (aproximadamente 15 minutos para cosechar diez platos de 15 cm). Tres personas participaron en este paso del protocolo.- Retire el medio de los platos de 15 cm inclining los platos, y luego lave suavemente las celdas con 7 mL de PBS-EDTA a temperatura ambiente (persona 1). Trabajar sólo con tres platos de 15 cm a la vez para evitar salir de las celdas sin medio o amortiguador.
- Añadir 5 ml de PBS-EDTA a las células e incubarlas durante 5 minutos a temperatura ambiente.
- Utilice un elevador de celdas para separar suavemente las células empujándolas a un borde del plato (persona 2) y recoger todas las células en un tubo de tapa de tornillo de 50 ml (persona 3). Enjuague cada plato con 2 ml adicionales de PBS-EDTA para recoger las células restantes de los platos. Durante este paso, mantenga el tubo de tapa de tornillo de 50 ml que contiene la suspensión celular en hielo.
- Peletizar las celdas a 250 × g, 10 min, 4 °C. Deseche el sobrenadante y determine el volumen del pellet de celda. Espere un volumen de ~ 1 mL de diez platos de 15 cm.
NOTA: En el protocolo descrito a continuación, se supone que el volumen del pellet celular es de 10 ml. Ajuste los experimentos según los volúmenes de pellets. - Resuspend las células en 1 volumen (10 ml) de búfer de lisis.
NOTA: Las células resuspended en el búfer de lisis se pueden almacenar a -80 °C durante un máximo de dos meses.
- Tejido cerebral
NOTA: Se pueden utilizar ratones de cualquier edad, sexo o antecedentes genéticos. La elección de la cepa transgénica del ratón dependerá de la cuestión científica a abordar. En este manuscrito, mostramos el ejemplo de tubulina purificada del ratón ttll1-/-, carente de una enzima glutamilante cerebral importante, la proteína 1 (TTLL1) similar a la tirabulina ligasa de tirosina31.- Sacrifique el ratón por dislocación cervical, decapite rápidamente y recoja el cerebro en un tubo de fondo redondo. Si hay exceso de sangre en el cerebro, lávese rápidamente con tampón de lisis. Recoger el cerebro tan pronto como el ratón es sacrificado como un retraso post mortem puede afectar el éxito de la purificación de la tubulina. Utilice tubos de fondo redondo para acomodar el ancho de la sonda utilizada para la homogeneización.
NOTA: Los cerebros recogidos del ratón se pueden congelar en nitrógeno líquido y almacenarse a -80 °C durante un tiempo de hasta 3 años. - Añadir 500 μL de tampón de lisis a un solo cerebro extraído de un ratón adulto. Para el resto del protocolo, se supone que el volumen del búfer de lisis agregado es de 10 ml. Ajuste para su experimento de acuerdo con el número de cerebros que se utilizarán.
- Sacrifique el ratón por dislocación cervical, decapite rápidamente y recoja el cerebro en un tubo de fondo redondo. Si hay exceso de sangre en el cerebro, lávese rápidamente con tampón de lisis. Recoger el cerebro tan pronto como el ratón es sacrificado como un retraso post mortem puede afectar el éxito de la purificación de la tubulina. Utilice tubos de fondo redondo para acomodar el ancho de la sonda utilizada para la homogeneización.
- Células cultivadas como cultivos de suspensión
3. Lisis de células o tejido cerebral
- Células cultivadas como cultivos de suspensión
- Para HEK-293, lijar las células sobre hielo pipeteando repetitivamente hacia arriba y hacia abajo usando puntas de pipeta de diferentes anchos. En primer lugar, coloque una punta p1000 a una pipeta de 10 ml y pipetee la suspensión celular hacia arriba y hacia abajo cada 5 minutos, durante 10 minutos (tres ciclos de pipeteo). En segundo lugar, coloque una punta p200 a una punta p1000 y pipeta adicional cada 5 minutos, durante 20 minutos (cinco ciclos de pipeteo).
- Para HeLa S3,lice las celdas con una prensa francesa (consulte Tabla de materiales para ajustes).
- Tome elvolumen 1/100 de la mezcla de lisis (L) (200 μL para 20 ml de L) y agregue el mismo volumen del búfer 2x Laemmli, hierva durante 5 minutos y almacene a -20 °C para su posterior análisis.
- Células cultivadas como culturas adherentes
- Transfiera las células a un tubo de fondo redondo de 14 ml cuya altura se ha reducido para acomodar la sonda sonicator (consulte Tabla de materiales para ajustes). Sonicar las células para ~ 45 pulsos, y confirmar lisis celular mediante el muestreo de una gota de la mezcla de lisis bajo un microscopio.
NOTA: El número de pulsos podría variar según el tipo de célula utilizado para la purificación de la tubulina. Sonicar las células demasiado podría hacer que la tubulina se precipite y afectará negativamente el rendimiento de purificación. - Pipetear las células hacia arriba y hacia abajo sobre el hielo cada 5 minutos durante 20 min (cinco ciclos de pipeteo), usando una punta p200.
- Tome 1/100º volumen de mezcla de lisis (L) (200 μL para 20 ml de L) y agregue el mismo volumen de 2x buffer de Laemmli, hierva durante 5 minutos y almacene a -20 °C para su posterior análisis.
- Transfiera las células a un tubo de fondo redondo de 14 ml cuya altura se ha reducido para acomodar la sonda sonicator (consulte Tabla de materiales para ajustes). Sonicar las células para ~ 45 pulsos, y confirmar lisis celular mediante el muestreo de una gota de la mezcla de lisis bajo un microscopio.
-
Tejido cerebral
- Lilice el tejido cerebral usando una licuadora de tejido (consulte Tabla de materiales para los ajustes). Alternativamente, lise el tejido usando un pestle de microtubos o un equipo equivalente y pipeta arriba y abajo en el hielo con una jeringa de 1 ml con una aguja de 18 G.
- Tome 1/100º volumen de mezcla de lisis (L) (200 μL para 20 ml de L) y agregue el mismo volumen del búfer de 2x Laemmli, hierva durante 5 minutos y almacene a -20 °C para su posterior análisis.
4. Purificación de Tubulin
- Aclaración de Lysate
- Despeje el lisato (separación de pellets y fracción soluble de la mezcla de lisis) por centrifugación a 150.000 × g,4 °C, 30 min. Consulte Tabla de materiales para obtener más información sobre los rotores y tubos ultracentrífugas. Para extractos de células, una capa flotante blanca a menudo se forma después de la centrifugación. No transfiera esta capa flotante junto con el sobrenadante, ya que interfiere con la polimerización de la tubulina. Utilice una jeringa de volumen adecuado unida a una aguja larga de 20 G o 21 G para eliminar suavemente el sobrenadante sin perturbar la capa flotante. Si el sobrenadante todavía está nublado, centrífuga a 5.000 × g,4 °C durante 10 min.
- Transfiera el sobrenadante (SN1) a un tubo ultracentrífuga y observe su volumen. Para un pellet de celda de 10 mL, espere un volumen de ~ 12 mL para SN1.
- Tome elvolumen 1/100 del SN1 (120 μL para 12 ml de SN1) y agregue el mismo volumen del búfer 2x Laemmli, hierva durante 5 minutos y almacene a -20 °C para su posterior análisis.
- Resuspend el pellet (P1) en BRB80 (Tabla de Materiales) utilizando el mismo volumen que SN1. Tome 1/100th volumen de P1 (200 μL para 20 mL de P1), y agregue el mismo volumen de 2x buffer Laemmli, hierva durante 5 min y almacene a -20 °C para su posterior análisis.
- Primera polimerización en buffer de baja molaridad
- Prepare la mezcla de polimerización combinando 1 volumen de SN1 (12 ml),volumen 1/200 de 0,2 M GTP (60 μL; concentración final 1 mM) y 0,5 volúmenes de glicerol precalentado (6 ml) en un tubo de tapa de tornillo del volumen adecuado.
NOTA: El glicerol se utiliza como agente de hacinamiento en los pasos de polimerización a lo largo del protocolo y por lo tanto no se considera en los cálculos de las concentraciones de otros componentes. - Pipetear la mezcla hacia arriba y hacia abajo, evitando suavemente la formación de burbujas de aire y transferirla a los tubos ultracentrífugas apropiados.
NOTA: Al transferir la mezcla a los tubos, ajuste el peso de los tubos (en pares). Esto permite al experimentador proceder directamente a la sedimentación de microtúbulos después del paso de polimerización. Haga esto para todos los pasos de polimerización a lo largo del protocolo. - Cubra los tubos con parafilm, transfiéralo a un baño de agua a 30 °C e incubar durante 20 min.
- Centrífuga los tubos a 150.000 × g, 30 °C durante 30 min. Retire el sobrenadante (SN2) y mantenga el pellet de microtúbulos polimerizados (P2).
NOTA: El pellet microtúbulo se puede congelar y almacenar a -80 °C durante un año. - Tome 1/200th volumen de SN2 (90 μL para 18 mL SN2) y agregue el mismo volumen de 2x buffer Laemmli, hierva durante 5 min y almacene a -20 °C para su posterior análisis.
- Prepare la mezcla de polimerización combinando 1 volumen de SN1 (12 ml),volumen 1/200 de 0,2 M GTP (60 μL; concentración final 1 mM) y 0,5 volúmenes de glicerol precalentado (6 ml) en un tubo de tapa de tornillo del volumen adecuado.
- Primera despolimerización
- Despolimerizar microtúbulos añadiendo BRB80 helado al pellet P2, y dejar en hielo durante 5 minutos: para la tubulina de las células, añadir 1/60th (200 μL), y para la tubulina del cerebro, añadir 1/20th (600 μL) del volumen del SN1.
NOTA: El volumen de BRB80 helado añadido al pellet durante los pasos de despolimerización siempre es relativo al volumen de SN1. - Resuspend el pellet de microtúbulo suavemente, evitando burbujas de aire, hasta que la solución es completamente homogénea. Utilice una punta p1000 para un par de ciclos de pipeteo seguido de una punta p200 cada 5 minutos, durante 20 min (cinco ciclos de pipeteo). Este es un paso crucial para el éxito de la purificación de la tubulina.
- Transfiera la solución a tubos ultracentrífugas adecuados y baje a 150.000 × g,4 °C durante 20 minutos. Transfiera el SN3 a un nuevo tubo ultracentrífuga de 1,5 ml. El pellet formado después de este paso de centrifugación (P3) contiene proteínas precipitadas (proteínas asociadas a microtúbulos o MAPs) y microtúbulos no despolimerizados. El sobrenadante (SN3) contiene componentes solubles: atenuadores de tubulina despolimerizados y MAPs, que se han separado de los microtúbulos despolimerizados.
- Tome 1-4 μL de SN3, y agregue 9 volúmenes de 2x buffer Laemmli, hierva durante 5 min y guárdelo a -20 °C para análisis posteriores.
- Resuspend el pellet P3 en BRB80 (en el mismo volumen de SN3), tomar 1-4 μL, y añadir 9 volúmenes de 2x laemmli buffer, hervir durante 5 min, y almacenar a -20 °C.
- Despolimerizar microtúbulos añadiendo BRB80 helado al pellet P2, y dejar en hielo durante 5 minutos: para la tubulina de las células, añadir 1/60th (200 μL), y para la tubulina del cerebro, añadir 1/20th (600 μL) del volumen del SN1.
- Segunda polimerización (en búfer de alta molaridad)
- Preparar la mezcla de polimerización combinando 1 volumen de SN3 (200 μL), 1 volumen de tubos de 1 M precalentados (200 μL, concentración final 0,5 M), 1/100de º volumen de 0,2 M GTP (2 μL, concentración final 1 mM) y 1 volumen de glicerol precalentado (200 μL) en un tubo del volumen adecuado.
- Pipetear la mezcla hacia arriba y hacia abajo, evitando la formación de burbujas de aire, y transferirla a tubos ultracentrífugas.
- Cubra los tubos con parafilm, transfiérelos a un baño de agua a 30 °C e incubarlos durante 20 minutos.
- Centrífuga los tubos a 150.000 × g,30 °C durante 30 min. Retire el sobrenadante (SN4) y mantenga el pellet de microtúbulos polimerizados (P4). El pellet P4 contiene los microtúbulos polimerizados, y el sobrenadante SN4 contiene tubulina virgen, MAPs y otras proteínas solubles.
NOTA: El pellet de microtúbulo después del segundo paso de polimerización se puede congelar y almacenar a -80 °C durante un año. - Tome 1-4 μL y agregue 9 volúmenes de búfer Laemmli 2x, hierva durante 5 minutos y almacene a -20 °C para análisis posteriores.
- Segunda despolimerización
- Despolimerizar microtúbulos añadiendo BRB80 helado al pellet P4, y dejar en hielo durante 5 minutos: para la tubulina de las células, añadir 1/100th (120 μL), y para la tubulina del cerebro, añadir 1/40th (300 μL) del volumen del SN1.
- Pipeta arriba y abajo con una punta p200 cada 5 minutos, durante 20 min (cinco ciclos de pipeteo).
- Transfiera la solución a un tubo ultracentrífuga de 1,5 ml y baje a 150.000 × g,4 °C durante 20 minutos. Transfiera el SN5 a un nuevo tubo ultracentrífuga de 1,5 ml. El pellet formado después de este paso de centrifugación (P5) contiene microtúbulos no despolimerizados. El sobrenadante (SN5) contiene la túbulina soluble.
- Tome 1-4 μL y agregue 9 volúmenes de búfer Laemmli 2x, hierva durante 5 minutos y almacene a -20 °C para análisis posteriores.
- Resuspend el pellet P5 en BRB80 (mismo volumen de SN5), tomar 1-4 μL, y añadir 9 volúmenes de 2x laemmli buffer, hervir durante 5 min, y almacenar a -20 °C para análisis posteriores.
- Tercera polimerización (en buffer de baja molaridad)
- Preparar la mezcla de polimerización: 1 volumen de SN5 (120 μL),1/200 de volumen de 0,2 M GTP (0,6 μL, la concentración final es de 1 mM) y 0,5 de glicerol precalentado (60 μL) en un tubo del volumen adecuado.
- Pipetear la mezcla hacia arriba y hacia abajo, evitando suavemente la formación de burbujas de aire, y transferirla a los tubos ultracentrífugas apropiados.
- Cubra los tubos con parafilm, transfiérelos a un baño de agua a 30 °C e incubarlos durante 20 minutos.
- Centrífuga los tubos a 150.000 × g,30 °C durante 30 min. El pellet (P6) contiene microtúbulos polimerizados y el sobrenadante SN6 contiene pequeñas cantidades de tubulina no polimerizada.
NOTA: Los pellets de microtúbulos se pueden congelar y almacenar a -80 °C durante un año. - Tome 1-4 μL y agregue 9 volúmenes de búfer Laemmli 2x, hierva durante 5 minutos y almacene a -20 °C para análisis posteriores.
- Tercera despolimerización
- Despolimerizar microtúbulos añadiendo BRB80 helado al pellet P6, y dejar en hielo durante 5 minutos: para la tubulina de las células, añadir 1/100th (120 μL), y para la tubulina del cerebro, añadir 1/40th (300 μL) del volumen del SN1.
- Pipeta arriba y abajo con una punta p200 cada 5 minutos, durante 20 min (cinco ciclos de pipeteo).
- Transfiera la solución a los tubos ultracentrífugas adecuados y baje a 150.000 × g,4 °C durante 20 minutos. Transfiera SN7 a un nuevo tubo ultracentrífuga de 1,5 ml. El pellet (P7) contiene pequeñas cantidades de microtúbulos no despolimerizados. El sobrenadante (SN7) contiene microtúbulos exclusivamente despolimerizados (tubulina soluble).
- Tome 1-4 μL y agregue 9 volúmenes de búfer Laemmli 2x, hierva durante 5 minutos y almacene a -20 °C para análisis posteriores.
- Resuspend el pellet P7 en BRB80 (mismo volumen de SN7), tomar 1-4 μL, y añadir 9 volúmenes de 2x laemmli buffer, hervir durante 5 min, y almacenar a -20 °C para análisis posteriores.
- Cuantifique la cantidad de tubulina (véanse los resultados representativos)y aliquot SN7 en volúmenes pequeños, se congelan y almacenan a -80 °C.
Resultados
El objetivo principal de este método es producir tubulina de alta calidad y competente para el montaje en cantidades suficientes para realizar experimentos in vitro repetidos con los componentes purificados. Los microtúbulos ensamblados a partir de esta tubulina se pueden utilizar en ensayos de reconstitución basados en la técnica de microscopía de fluorescencia de reflexión interna total (TIRF) con microtúbulos dinámicos o estables, en experimentos que prueban dinámicas de microtúbulos, interacciones con MAPs o motores moleculares, y generación de fuerza por los motores25. También se pueden utilizar en ensayos de co-pelleting microtúbulos-MAP y espectroscopia NMR de estado sólido28.
El enriquecimiento y la pureza de la tubulina durante todo el proceso de purificación se pueden controlar mediante el uso de un gel de electroforesis SDS-poliacrilamida (PAGE) manchado por Coomassie, preferiblemente los geles SDS-PAGE 'TUB', que permiten la separación de α- y β-tubulinas, que co-migran como una sola banda en geles clásicos32. Los lysates recogidos en diferentes pasos (excepto la última despolimerización, véase el protocolo) se cargan en el gel en cantidades comparables para evaluar el éxito de la purificación de la tubulina (Figura 2A)24. La muestra final de tubulina, que es muy preciosa, sólo se carga en el gel para la determinación de la concentración de tubulina. Es normal perder algo de tubulina en el proceso de ciclos repetidos de polimerización y despolimerización. Un rendimiento inferior a lo esperado de la tubulina purificada final puede deberse a (i) despolimerización incompleta de microtúbulos, visualizada por la presencia de una cantidad importante de tubulina en las fracciones P3, P5 y P7, o (ii) una polimerización ineficiente de la tubulina en microtúbulos, en cuyo caso una menor cantidad de tubulina está presente en las fracciones P2, P4 y P6 y superiores en las fracciones SN2, SN4 y SN6(Figura 2B). Si la tubulina se pierde durante los pasos de polimerización (cantidades más bajas de P2 y P4) (i) asegurar suficiente concentración de tubulina durante la polimerización (ii) utilizar una nueva alícuota de GTP, y /o (iii) confirmar la temperatura de la reacción de polimerización. Si la tubulina se pierde durante los pasos de despolimerización (cantidades más bajas de SN3 y SN5), aumente el tiempo, así como el pipeteo de la mezcla en el hielo.
Para la cuantificación de la tubulina purificada, ejecute las muestras junto con las cantidades conocidas de albúmina sérica bovina (BSA, 0,5 μg – 1 μg – 2 μg – 4 μg) (Figura 3A) en SDS-PAGE. Los geles están manchados con Coomassie azul brillante, escaneado, y las intensidades de BSA y bandas de tubulina se miden por densitometría cuantitativa(Figura 3B)como se describe en https://openwetware.org/wiki/Protein_Quantification_Using_ImageJ. Tenga en cuenta que el mismo análisis se puede hacer en Fiji, una versión actualizada de ImageJ33. Los valores de las bandas BSA se utilizaron para determinar la ecuación de regresión lineal, que se utilizó para calcular la cantidad de proteína en las bandas de tubulina. Sólo intensidades de banda de tubulina dentro del rango de la curva BSA se utilizan para determinar la concentración de tubulina. Sobre la base de la concentración calculada de tubulina, se preparan alícuotas de los volúmenes deseados de tubulina, se congelan en nitrógeno líquido y se almacenan a -80 °C. Por lo general obtenemos aproximadamente ~ 2 mg de tubulina de cuatro botellas spinner de cultivos de suspensión HeLa S3 (~ 15 g de células), ~ 250 μg de tubulina de diez platos de 15 cm de diámetro (~ 1.2 g de células), y ~ 1 mg de tubulina de 1 g de tejido cerebral del ratón.
Para confirmar el enriquecimiento de un isotipo o modificación de tubulina en particular, ~0,1 μg de la tubulina purificada se puede inmunoblotted utilizando los anticuerpos respectivos34,35. La tubulina de control variará dependiendo de la tubulina de interés. Para la tubulina modificada in vitro con una enzima modificador, utilice la tubulina no tratada como control. Para la tubulina modificada en celulo por la sobreexpresión de una enzima modificador, utilice tubulina purificada a partir de células que no expresan la enzima como control (Figura 4A). Controlar la tubulina para la tubulina purificada de cerebros knockout-ratón será tubulina de ratones de tipo salvaje(Figura 4B). En todos los análisis de inmunoblot, se verifica una carga igual de tubulina mediante el uso de un anticuerpo anti-α-tubulina independiente del PTM (12G10).
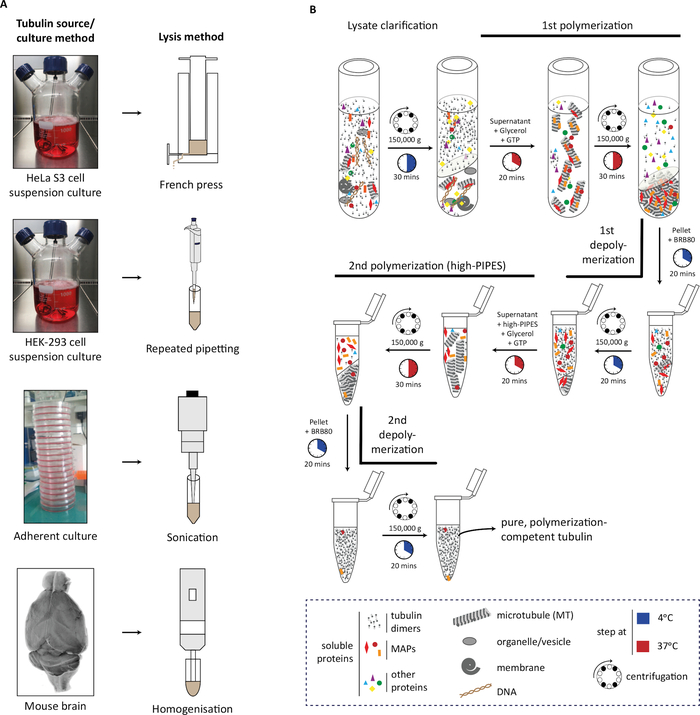
Figura 1: Purificación de tubulina de diferentes fuentes utilizando ciclos de polimerización-despolimerización. (A) Diferentes fuentes de tubulina se mida utilizando estrategias específicas. Las células HeLa S3 cultivadas en suspensión se midan con una prensa francesa; Las células HEK-293 se mienten mediante pipeteo repetitivo. Las células adherentes fueron lysed usando pulsos cortos de sonicación y tejido cerebral del ratón usando un homogeneizador de tejido. (B) Representación esquemática de los pasos sucesivos del protocolo de purificación de tubulina utilizando ciclos de despolimerización en frío y polimerización cálida. Después de la lisis y la aclaración del lisato, los microtúbulos son polimerizados y peletizados. A continuación, se despolimerizan los microtúbulos y posteriormente se les permite polimerizar en un amortiguador de alta molaridad, evitando la co sedimentación de proteínas asociadas a microtúbulos (MAP) con los microtúbulos. A continuación, los microtúbulos libres de MAPAS se despolimerizan y pueden someterse a un tercer ciclo de polimerización-despolimerización para eliminar las cantidades traza del búfer de alta molaridad. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Evaluación del éxito de la purificación de la tubulina. Las muestras recogidas en diferentes pasos del protocolo de purificación de la tubulina se ejecutaron en un gel de dodecylsulfato sódico-poliacrilamida 'TUB' electroforesis (SDS-PAGE) en gel (ver protocolo para más detalles) y teñido con Coomassie azul brillante. (A) En una purificación exitosa de la tubulina, α y β-tubulinas se enriquecen progresivamente a lo largo del proceso. Después de la segunda polimerización, el pellet de microtúbulo (P4) está virtualmente libre de contaminación de otras proteínas o proteínas asociadas a microtúbulos (MAPs). Tenga en cuenta que es normal perder algo de tubulina durante el procedimiento. (B) En una purificación infructuosa de la tubulina, el rendimiento final de la tubulina es bajo, y la tubulina permanece ya sea en el pellet después de la despolimerización o en el sobrenadante después de la polimerización (cajas rojas). En el ejemplo que se muestra aquí, la tubulina no polimerizó eficientemente en ambos pasos de polimerización. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Cuantificación de la tubulina purificada utilizando geles de dodecilsulfato-poliacrilamida de sodio manchado de Coomassie electroforesis (SDS-PAGE) y densitometría. (A) Gel SDS-PAGE manchado de Coomassie con cantidades conocidas de albúmina sérica bovina (BSA; 0,5, 1, 2 y 4 μg, línea de degradado gris) y diferentes volúmenes (0,5 y 1 μL, colores claros y oscuros, respectivamente) de tubulina purificada. En el ejemplo que se muestra, la tubulina tirosinada (tubulina HeLa S3, naranja claro y oscuro) y la tubulina destilinada (tubulina HeLa S3 tratada con carboxopeptidasa A, azul claro y oscuro) se cargaron en el gel. (B) Las bandas BSA de (A) fueron cuantificadas usando ImageJ (en unidades arbitrarias, AU) y trazadas contra la cantidad de proteína cargada (gris a puntos negros). Esos puntos se utilizaron para calcular la línea de regresión lineal (la línea de degradado gris) y la ecuación, que se utilizaron para calcular las cantidades de proteína en las muestras de tubulina (puntos naranja y azul claro y oscuro) cargadas en el gel. Esto facilitó el cálculo de la concentración de las muestras de tubulina. Tenga en cuenta que los puntos que se encuentran más allá de la curva estándar BSA no deben utilizarse para determinar la concentración (puntos naranja oscuro y azul). Haga clic aquí para ver una versión más grande de esta figura.
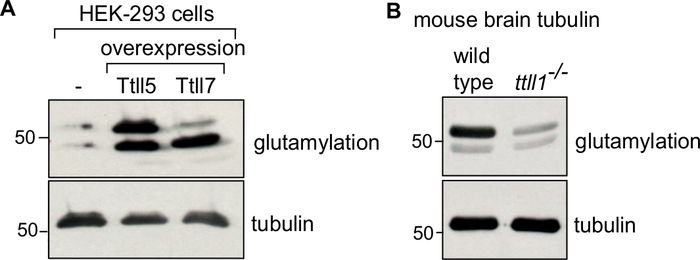
Figura 4: Análisis inmunoblote de tubulina purificada con diferentes PTM. (A) Las tubulinas purificadas a partir de células HEK-293: tipo salvaje, o células que sobreexprimen TTLL5 o TTLL7 fueron analizadas para el enriquecimiento específico de poliglutamilación utilizando el anticuerpo GT335. Mientras que la sobreexpresión TTLL5 aumenta la poliglutamilación en α y β-tubulina, la sobreexpresión TTLL7 enriquece específicamente la glutamilación β-tubulina. B) Se analizó la tubulina purificada a partir de tejidos cerebrales de tipo salvaje y ratones ttll1-/- para patrones de glutamilación. Tenga en cuenta la fuerte reducción de la poliglutaminación de la tubulina de ratones ttll1-/-, que carecen de la glutamilasa cerebral principal TTLL136. Los geles 'TUB' se utilizaron para separar α y β-tubulina. Una cantidad igual de carga de tubulina fue confirmada por 12G10, un anticuerpo anti-α-tubulina. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El método descrito aquí proporciona una plataforma para generar rápidamente tubulina de alta calidad y competente para el montaje en cantidades medianas y grandes a partir de líneas celulares y cerebros de ratón único. Se basa en el protocolo estándar de oro de purificación de tubulina de cerebros bovinos utilizados en el campo durante muchos años16,17. Una ventaja particular del enfoque es el uso de cultivos de suspensión de células HeLa S3, que, una vez establecidas, produce grandes cantidades de células mientras que requiere poco tiempo práctico. Esto hace que el protocolo sea relativamente fácil de realizar en cualquier laboratorio de biología celular, mientras que otros métodos de purificación de tubulina18,19,32,37 requieren equipos específicos y experiencia y por lo tanto son utilizados principalmente por laboratorios con un fuerte fondo en la purificación de proteínas. Al producir cantidades más pequeñas de tubulina a partir de líneas celulares adherentes, se puede utilizar una variedad de líneas celulares. Hemos purificado con éxito la tubulina de las células HeLa, U-2 OS y HEK-293. Si se necesita una purificación a mayor escala, las células o cerebros cosechados pueden ser congelados en tampón de lisis y almacenados a -80 °C, y múltiples pellets celulares o cerebros se pueden unir para purificar cantidades más grandes de tubulina.
La tubulina purificada a partir de líneas celulares está virtualmente libre de PTMs de tubulina. Esta tyr-tubulina se puede convertir fácilmente en tubulina destilinada (deTyr-) en un solo paso directo25. Para producir tubulina con otros PTMs, enzimas específicas que modifican la tubulina pueden ser sobreexpresadas en las células antes de la purificación de la tubulina. Además, el uso de líneas celulares de origen humano como fuente de material ayuda a evitar posibles problemas entre especies al estudiar las interacciones entre microtúbulos y MAPs humanos. Además, la tubulina de células no transformadas (como HEK293) o transformadas (como HeLa) puede proporcionar información sobre los efectos de los fármacos dirigidos por microtúbulos (por ejemplo, taxanos) en microtúbulos de células tumorales normales.
Por último, nuestro protocolo facilita la purificación de la tubulina de cerebros de ratón únicos. A medida que se genera un número creciente de modelos de ratón de mutaciones y modificaciones de tubulina, este protocolo permite el análisis directo de las propiedades e interacciones de microtúbulos con composición isotipo de tubulina alterada38,39,40 o PTMs de tubulina31,41.
El enfoque se basa en ciclos de polimerización y despolimerización. Por lo tanto, los isotipos específicos de tubulina o tubulina con PPT particulares que afectan a las propiedades de montaje y desmontaje de microtúbulos podrían resultar en una pérdida o reducción desproporcionada de tales formas de tubulina durante el proceso de purificación. Sin embargo, hemos demostrado que los PTMs de tubulina más importantes, como la acetilación, la destilación, la glutamilación y la glicilación, se conservan en los microtúbulos durante todo el proceso de purificación de la tubulina24. Sin embargo, cabe señalar que para los análisis cuantitativos de la composición de la tubulina en células o tejidos, el enfoque de purificación de tubulina a base de columna TOG es más apropiado, ya que permitiría una purificación de tubulina imparcial e independiente de la polimerización18. A pesar de su limitación, nuestro protocolo ofrece una gran ventaja en la generación de grandes cantidades de tubulina de alta calidad que se puede utilizar en experimentos meticulosos de reconstitución in vitro. En particular, facilita el uso de tubulina cerebral rica en PTM en experimentos de rutina.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el ANR-10-IDEX-0001-02, el LabEx Cell'n'Scale ANR-11-LBX-0038 y el Institut de convergencia Q-life ANR-17-CONV-0005. CJ cuenta con el apoyo del Institut Curie, la Agencia Nacional de Investigación francesa (ANR) otorga ANR-12-BSV2-0007 y ANR-17-CE13-0021, la subvención del Institut National du Cancer (INCA) 2014-PL BIO-11-ICR-1, y la beca de la Fundación pour la Recherche Medicale (FRM) DEQ20170336756. MMM es apoyado por la fundación Vaincre Alzheimer grant FR-16055p, y por la francia Alzheimer grant AAP SM 2019 n°2023. JAS recibió el apoyo del programa de investigación e innovación Horizonte 2020 de la Unión Europea en el marco del acuerdo de subvención Marie Skłodowska-Curie nº 675737, y la subvención FRM FDT201904008210. SB fue apoyado por la subvención FRM FDT201805005465.
Agradecemos a todos los miembros del laboratorio Janke, en particular a J. Souphron, así como a G. Lakisic (Institut MICALIS, AgroParisTech) y A. Gautreau (Ecole Polytechnique) por su ayuda durante el establecimiento del protocolo. Nos gustaría agradecer a las instalaciones animales del Institut Curie por su ayuda con la cría y el cuidado de ratones.
El anticuerpo 12G10, desarrollado por J. Frankel y M. Nelson, fue obtenido del Banco de Hybridoma de Estudios de Desarrollo desarrollado bajo los auspicios del NICHD y mantenido por la Universidad de Iowa.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 M MgCl2 | Sigma | #M1028 | |
| 1-L cell culture vessels | Techne F7610 | Used for spinner cultures. Never stir the empty spinner bottles. When spinner bottles are in the cell culture incubator, always keep the lateral valves of spinner bottles slightly open to facilitate the equilibration of media with incubator’s atmosphere. After use, fill the spinner bottles immediately with tap water to avoid drying of remaining cells on the bottle walls. Wash the bottles with deionised water, add app 200 ml of deionised water and autoclave. Under a sterile cell culture hood remove the water and allow the bottles to dry completely, still under the hood, for several hours. Never use detergents for cleaning the spinner bottles because any trace amounts of the detergent can be deleterious to the cells. | |
| 1.5- and 2-ml tubes | |||
| 14-ml round-bottom tubes | |||
| 15-cm-diameter sterile culture dishes | |||
| 15-ml screw-cap tubes | |||
| 2-mercaptoethanol | Sigma | #M3148 | 2-mercaptoethanol is toxic and should be used under the hood. |
| 4-(2-aminoethyl)-benzenesulfonyl fluoride | Sigma | #A8456 | |
| 40% Acrylamide | Bio-Rad | #161-0140 | |
| 5-, 10- 20-ml syringes | |||
| 5-ml, 10-ml, 25-ml sterile pipettes | |||
| 50-ml screw-cap tubes | |||
| Ammonium persulfate (APS) | Sigma | #A3678 | |
| Anti-alpha-tubulin antibody, 12G10 | Developed by J. Frankel and M. Nelson, obtained from the Developmental Studies Hybridoma Bank, developed under the auspices of the NICHD, and maintained by the University of Iowa | dilution: 1/500 | |
| Anti-glutamylated tubulin antibody, GT335 | AdipoGen | #AG-20B-0020 | dilution: 1/20,000 |
| Aprotinin | Sigma | #A1153 | |
| Balance (0.1 – 10 g) | |||
| Beckman 1-l polypropylene bottles | For collecting spinner cultures | ||
| Beckman Avanti J-26 XP centrifuge | For collecting spinner cultures | ||
| Biological stirrer | Techne MCS-104L | Installed in the cell culture incubator (for spinner cultures), 25 rpm for Hela S3 and HEK 293 cells | |
| Bis N,N’-Methylene-Bis-Acrylamide | Bio-Rad | #161-0201 | |
| Blender IKA Ultra-Turrax® | For lysing brain tissue, use 5-mm probe, with the machine set at power 6 or 7. Blend the brain tissue 2-3 times for 15 s on ice. | ||
| Bovine serum albumin (BSA) | Sigma | #A7906 | |
| Bromophenol blue | Sigma | #1.08122 | |
| Carboxypeptidase A (CPA) | Sigma | #C9268 | Concentration: 1.7 U/µl |
| Cell culture hood | |||
| Cell culture incubator set at 37°C, 5% CO2 | |||
| Dimethyl sulfoxide (DMSO) | Sigma | #D8418 | DMSO can enhance cell and skin permeability of other compounds. Avoid contact and use skin and eye protection. |
| DMEM medium | Life Technologies | #41965062 | |
| DTT, DL-Dithiothreitol | Sigma | #D9779 | |
| EDTA | Euromedex | #EU0007-C | |
| EGTA | Sigma | #E3889 | |
| Ethanol absolute | Fisher Chemical | #E/0650DF/15 | |
| Fetal bovine serum (FBS) | Sigma | #F7524 | |
| French pressure cell press | Thermo electron corporation | #FA-078A | with a #FA-032 cell; for lysing big amounts of cells. Set at medium ratio, and the gauge pressure of 1,000 psi (corresponds to 3,000 psi inside the disruption chamber). |
| Glycerol | VWR Chemicals | #24388.295 | |
| Glycine | Sigma | #G8898 | |
| GTP | Sigma | #G8877 | |
| Heating block | Stuart | #SBH130D | |
| Hela cells | ATCC® CCL-2™ | ||
| Hela S3 cells | ATCC | ATCC® CCL-2.2™ | |
| Hydrochloric acid (HCl ) | VWR | #20252.290 | |
| Inverted microscope | With fluorescence if cell transfection is to be verified | ||
| Isopropanol | VWR | #20842.298 | |
| jetPEI | Polyplus | #101 | |
| JLA-8.1000 rotor | For collecting spinner cultures | ||
| KOH | Sigma | #P1767 | KOH is corrosive and causes burns; use eye and skin protection. |
| L-Glutamine | Life Technologies | #25030123 | |
| Laboratory centrifuge for 50-ml tubes | Sigma | 4-16 K | |
| Leupeptin | Sigma | #L2884 | |
| Liquid nitrogen | |||
| Micro-pipettes p2.5, p10, p20, p100, p200 and p1000 and corresponding tips | |||
| Micropestles | Eppendorf | #0030 120.973 | |
| Mouse brain tissue | Animal care and use for this study were performed in accordance with the recommendations of the European Community (2010/63/UE). Experimental procedures were specifically approved by the ethics committee of the Institut Curie CEEA-IC #118 (authorization no. 04395.03 given by National Authority) in compliance with the international guidelines. | ||
| Needles 18G X 1 ½” (1.2 X 38 mm | Terumo | #18G | |
| Needles 20G X 1 ½” (0.9 X 38 mm | Terumo | #20G | |
| Needles 21G X 4 ¾” (0.8 X 120 mm | B.Braun | #466 5643 | |
| Parafilm | |||
| PBS | Life Technologies | #14190169 | |
| Penicillin-Streptomycin | Life Technologies | #15140130 | |
| pH-meter | |||
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma | #P7626 | PMSF powder is hazardous. Use skin and eye protection when preparing PMSF solutions. |
| PIPES | Sigma | #P6757 | |
| Pipette-boy | |||
| Rotors | Beckman 70.1 Ti; TLA-100.3; and TLA 55 | ||
| SDS-PAGE electrophoresis equipment | Bio-Rad | #1658001FC | |
| SDS, Sodium dodecyl sulphate | VWR | #442444H | For preparing Laemmeli buffer |
| SDS, Sodium dodecyl sulphate | Sigma | #L5750 | For preparing 'TUB' SDS-PAGE gels |
| Sonicator | Branson | #101-148-070 | Used for lysing cells grown as adherent cultures. Use 6.5 mm diameter probe, set the sonicator at “Output control” 1, “Duty cycle” 10% and time depending on the cell type used. |
| Tabletop centrifuge for 1.5 ml tubes | Eppendorf | 5417R | |
| TEMED, N, N, N′, N′-Tetramethylethylenediamine | Sigma | #9281 | |
| Trichostatin A (TSA) | Sigma | #T8552 | |
| Triton X-100 | Sigma | #T9284 | |
| Trizma base (Tris) | Sigma | #T1503 | |
| Trypsin | Life Technologies | #15090046 | |
| Ultracentrifuge rotors | TLA-55, TLA-100.3 and 70.1 Ti rotors | Set at 4°C or 30°C based on the need of the experiment | |
| Ultracentrifuge tubes | Beckman | #357448 | for using with TLA-55 rotor |
| Ultracentrifuge tubes | Beckman | #349622 | for using with TLA-100.3 rotor |
| Ultracentrifuge tubes | Beckman | #355631 | for using with 70.1 Ti rotor |
| Ultracentrifuges | Beckman | Optima L80-XP (or equivalent) and Optima MAX-XP (or equivalent) | Set at 4°C or 30°C based on the need of the experiment |
| Vortex mixer | |||
| Water bath equipped with floaters or tube holders | Set at 30°C |
Referencias
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Janke, C. The tubulin code: Molecular components, readout mechanisms, and functions. Journal of Cell Biology. 206 (4), 461-472 (2014).
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews: Molecular Cell Biology. 21 (6), 307-326 (2020).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Margolis, R. L., Wilson, L. Opposite end assembly and disassembly of microtubules at steady state in vitro. Cell. 13 (1), 1-8 (1978).
- Borisy, G. G., Olmsted, J. B. Nucleated assembly of microtubules in porcine brain extracts. Science. 177 (55), 1196-1197 (1972).
- Kirschner, M. W., Williams, R. C. The mechanism of microtubule assembly in vitro. Journal of Supramolecular Structure. 2 (2-4), 412-428 (1974).
- Baas, P. W., Lin, S. Hooks and comets: The story of microtubule polarity orientation in the neuron. Developmental Neurobiology. 71 (6), 403-418 (2011).
- Stepanova, T., et al. Visualization of microtubule growth in cultured neurons via the use of EB3-GFP (end-binding protein 3-green fluorescent protein). Journal of Neuroscience. 23 (7), 2655-2664 (2003).
- Nedelec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Bieling, P., Telley, I. A., Surrey, T. A minimal midzone protein module controls formation and length of antiparallel microtubule overlaps. Cell. 142 (3), 420-432 (2010).
- Roostalu, J., et al. Directional switching of the kinesin Cin8 through motor coupling. Science. 332 (6025), 94-99 (2011).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nature Materials. 14 (11), 1156-1163 (2015).
- Hendricks, A. G., Goldman, Y. E., Holzbaur, E. L. F. Reconstituting the motility of isolated intracellular cargoes. Methods in Enzymology. 540, 249-262 (2014).
- Dogterom, M., Surrey, T. Microtubule organization in vitro. Current Opinion in Cell Biology. 25 (1), 23-29 (2013).
- Vallee, R. B. Reversible assembly purification of microtubules without assembly-promoting agents and further purification of tubulin, microtubule-associated proteins, and MAP fragments. Methods in Enzymology. 134, 89-104 (1986).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Widlund, P. O., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Molecular Biology of the Cell. 23 (22), 4393-4401 (2012).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Letters. 587 (21), 3450-3455 (2013).
- Uchimura, S., et al. A flipped ion pair at the dynein-microtubule interface is critical for dynein motility and ATPase activation. Journal of Cell Biology. 208 (2), 211-222 (2015).
- Pamula, M. C., Ti, S. C., Kapoor, T. M. The structured core of human beta tubulin confers isotype-specific polymerization properties. Journal of Cell Biology. 213 (4), 425-433 (2016).
- Vemu, A., et al. Structure and dynamics of single-isoform recombinant neuronal Human tubulin. Journal of Biological Chemistry. 291 (25), 12907-12915 (2016).
- Ti, S. C., Alushin, G. M., Kapoor, T. M. Human beta-tubulin isotypes can regulate microtubule protofilament number and stability. Developmental Cell. 47 (2), 175-190 (2018).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nature Protocols. 14, 1634-1660 (2019).
- Barisic, M., et al. Microtubule detyrosination guides chromosomes during mitosis. Science. 348 (6236), 799-803 (2015).
- Nirschl, J. J., Magiera, M. M., Lazarus, J. E., Janke, C., Holzbaur, E. L. F. alpha-Tubulin tyrosination and CLIP-170 phosphorylation regulate the initiation of dynein-driven transport in neurons. Cell Reports. 14 (11), 2637-2652 (2016).
- Guedes-Dias, P., et al. Kinesin-3 responds to local microtubule dynamics to target synaptic cargo delivery to the presynapse. Current Biology. 29 (2), 268-282 (2019).
- Luo, Y., et al. Direct observation of dynamic protein interactions involving human microtubules using solid-state NMR spectroscopy. Nature Communications. 11 (1), 18(2020).
- Even, A., et al. ATAT1-enriched vesicles promote microtubule acetylation via axonal transport. Science Advances. 5 (12), 2705(2019).
- Wolff, J., Sackett, D. L., Knipling, L. Cation selective promotion of tubulin polymerization by alkali metal chlorides. Protein Science. 5 (10), 2020-2028 (1996).
- Magiera, M. M., et al. Excessive tubulin polyglutamylation causes neurodegeneration and perturbs neuronal transport. EMBO Journal. 37 (23), 100440(2018).
- Lacroix, B., Janke, C. Generation of differentially polyglutamylated microtubules. Methods in Molecular Biology. 777, 57-69 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Magiera, M. M., Janke, C. Methods in Cell Biology Vol. 115 Microtubules, in vitro. Correia, J. J., Wilson, L. , Academic Press. 247-267 (2013).
- Hausrat, T. J., Radwitz, J., Lombino, F. L., Breiden, P., Kneussel, M. Alpha- and beta-tubulin isotypes are differentially expressed during brain development. Developmental Neurobiology. , (2020).
- Janke, C., et al. Tubulin polyglutamylase enzymes are members of the TTL domain protein family. Science. 308 (5729), 1758-1762 (2005).
- Newton, C. N., et al. Intrinsically slow dynamic instability of HeLa cell microtubules in vitro. Journal of Biological Chemistry. 277 (45), 42456-42462 (2002).
- Belvindrah, R., et al. Mutation of the alpha-tubulin Tuba1a leads to straighter microtubules and perturbs neuronal migration. Journal of Cell Biology. 216 (8), 2443-2461 (2017).
- Breuss, M., et al. Mutations in the murine homologue of TUBB5 cause microcephaly by perturbing cell cycle progression and inducing p53 associated apoptosis. Development. , (2016).
- Latremoliere, A., et al. Neuronal-specific TUBB3 is not required for normal neuronal function but is essential for timely axon regeneration. Cell Reports. 24 (7), 1865-1879 (2018).
- Morley, S. J., et al. Acetylated tubulin is essential for touch sensation in mice. Elife. 5, (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados