Method Article
טיהור טובולין עם שינויים מבוקרים לאחר טרנסלציה ואיזוטיפים ממקורות מוגבלים על ידי מחזורי פידול-דפולימריזציה
In This Article
Summary
פרוטוקול זה מתאר טיהור טובולין ממקורות קטנים/בינוניים כגון תאים תרבותיים או מוחות של עכבר יחיד, באמצעות מחזורי פולמור והדפולימוריזציה. טובולין מטוהר מועשר איזוטיפים ספציפיים או יש שינויים פוסט-טרנסלציה ספציפיים והוא יכול לשמש במבחנה reconsays ללמוד דינמיקה microtubule ואינטראקציות.
Abstract
היבט חשוב אחד של מחקרים של ציטוסקלטון microtubule הוא חקירת התנהגות microtubule בניסויים השבת במבחנה. הם מאפשרים ניתוח של המאפיינים המהותיים של microtubules, כגון דינמיקה, ואת האינטראקציות שלהם עם חלבונים הקשורים microtubule (MAPs). "קוד tubulin" הוא מושג המתעוררים המצביע על isotypes טובולין שונים ושינויים פוסט-טרנזיוניים שונים (PTMs) כמו הרגולטורים של תכונות ופונקציות microtubule. כדי לחקור את המנגנונים המולקולריים של קוד tubulin, זה חיוני לבצע ניסויים reconstitution במבחנה באמצעות tubulin מטוהרים עם isotypes ספציפיים PTMs.
עד כה, זה היה מאתגר מבחינה טכנית כמו tubulin המוח, אשר נעשה שימוש נרחב בניסויים במבחנה, מחסה PTMs רבים ויש לו הרכב איזוטיפ מוגדר. לפיכך, פיתחנו פרוטוקול זה כדי לטהר טובולין ממקורות שונים עם קומפוזיציות איזוטיפ שונות PTMs מבוקר, באמצעות הגישה הקלאסית של מחזורי פולמור והתפרקות. בהשוואה לשיטות קיימות המבוססות על טיהור זיקה, גישה זו מניבה טובולין טהור, בעל יכולת פולמוריזציה, שכן טובולין עמיד בפני פולמור או דפולימריזציה מושלך במהלך שלבי הטיהור העוקבים.
אנו מתארים את הטיהור של טובולין מקווי תאים, גדל או בהשעיה או כמו תרבויות חסידיות, וממוחות עכבר יחיד. השיטה מתארת תחילה את הדור של מסת התא הן בהגדרות ההשעיה והן בהגדרות החסידות, שלב התזה, ואחריו השלבים העוקבים של טיהור טובולין על ידי מחזורי פולמוריזציה-דפולימריזציה. השיטה שלנו מניבה טובולין שניתן להשתמש בו בניסויים העוסקים בהשפעה של קוד טובולין על המאפיינים המהותיים של מיקרוטובולים ואינטראקציות מיקרוטובולה עם חלבונים נלווים.
Introduction
מיקרוטובולות ממלאות תפקידים קריטיים בתהליכים תאיים רבים. הם נותנים לתאים את צורתם, בונים צירים מיוטיים ומיטוטיים להפרדת כרומוזום, ומשמשים מסלולים להובלה תאית. כדי לבצע פונקציות מגוונות אלה, microtubules לארגן את עצמם בדרכים שונות. אחת השאלות המסקרנות בתחום היא להבין את המנגנונים המולקולריים המאפשרים למיקרוטובולים השמורים מבחינה מבנית ואבולוציונית להסתגל לשפע זה של ארגונים ותפקודים. מנגנון פוטנציאלי אחד הוא גיוון של microtubules, אשר מוגדר על ידי המושג המכונה "קוד tubulin"1,2,3. קוד טובולין כולל שני מרכיבים עיקריים: שילוב דיפרנציאלי של מוצרי גנים α ו- β-טובולין (isotypes טובולין) לתוך microtubules ו tubulin שינויים פוסט טראנסלציה (PTMs).
מאז שנות השבעים, ניסויי שחזור במבחנה, בשילוב עם טכניקות מיקרוסקופיות אור מתפתחות, סללו את הדרך לתגליות חשובות על תכונות של מיקרוטובולים: חוסר יציבותדינמית 4 והליכון5, ומנגנונים אחרים שלהם פונקציות6,7,8,9,10,11,12,13,14,15. כמעט כל הניסויים במבחנה שבוצעו עד כה התבססו על טובולין מטוהר מרקמת המוח באמצעות מחזורים חוזרים ונשנים של פולמור והתפרקות16,17. למרות טיהור מרקמת המוח מעניק את היתרון של קבלת טובולין באיכות גבוהה בכמויות גדולות (בדרך כלל כמויות גרם), חיסרון חשוב אחד הוא הטרוגניות כמו tubulin מטוהרים מרקמת המוח היא תערובת של isotypes טובולין שונים מועשר PTMs טובולין רבים. הטרוגניות זו אינה מאפשרת לציין את תפקידו של טובולין PTM מסוים או איזוטיפ בשליטה על תכונות ופונקציות microtubule. לכן, ייצור tubulin הרכבה מוסמך עם PTMs טובולין מבוקר הרכב isotype הומוגני הוא חיוני כדי לטפל במנגנונים המולקולריים של קוד tubulin.
לאחרונה, גישה לטהר טובולין על ידי כרומטוגרפיה זיקה באמצעות TOG מחייב microtubule (הגן overexpressed הגידול) של שמרים Stu2p פותחה18. בשיטה זו, טובולין ב lysates גס של תאים או רקמה מועבר דרך עמודה שבה הוא נקשר לתחום TOG משותק מטריצה, המאפשר ניתוח של כל מאגר טובולין של נתון, אפילו קטן מאוד, מדגם. גישה המיוחלת לטהר טובולין רקומביננטי תוארה גם בשנים האחרונות. הוא מבוסס על מערכת baculovirus, שבה וקטור דו-סיסטרוני המכיל גנים α ו- β-טובולין מתבטא בתאי חרקים19. עם זאת, שיטה זו היא מסורבלת מאוד זמן רב ולכן משמש בעיקר לחקר ההשפעה של מוטציות tubulin20 ו tubulin isotypes21,22,23 במבחנה.
בפרוטוקול הנוכחי, אנו מתארים שיטה המשתמשת בגישה מבוססת היטב בשימוש נרחב פולימריזציה-depolymerization כשרטוט כדי ליצור tubulin עם רמות שונות של שינוי או מקווי התא או מרקמת המוח העכבר24. בהליך זה, טובולין הוא רכב על אופניים בין מסיס (טובולין דימר ב 4 מעלות צלזיוס) וצורה פולימרית (microtubule ב 30 מעלות צלזיוס בנוכחות guanosine 5'-triphosphate [GTP]). כל צורה מופרדת באמצעות צעדים רצופים של צנטריפוגה: dimers tubulin יישארו supernatant לאחר ספין קר (4 מעלות צלזיוס), ואילו microtubules יהיה גלולות ב 30 מעלות צלזיוס. יתר על כן, צעד אחד של פולמריזציה מתבצע ב piperazine גבוהה-N, N′-bis(2-אתנסולפונית חומצה) (PIPES) ריכוז, המאפשר הסרת חלבונים הקשורים microtubule מן microtubules ובכך, מן טובולין מטוהרים סוף סוף. Tubulin מטוהרים מתאי HeLa S3 גדל כמו השעיה או תרבויות חסידים הוא כמעט ללא כל tubulin PTM והוא שימש לאחרונה בניסויים reconstitution במבחנה25,26,27,28. התאמנו עוד יותר את השיטה לטיהור טובולין ממוחות עכבר יחיד, אשר ניתן להשתמש בהם עבור מספר רב של דגמי עכבר עם שינויים איזוטיפים טובולין ו PTMs.
בפרוטוקול, אנו מתארים תחילה את הדור של חומר המקור (מסת תא או רקמת מוח), את התמוגה שלו (איור 1A), ואחריו את השלבים העוקבים של פולמריזציה של טובולין והתפרקות כדי לטהר את הצינורית(איור 1B). בנוסף, אנו מתארים את התהליך להערכת הטוהר (איור 2א',ב)ואת הכמות (איור 3א',ב)של הצינור המטוהר. ניתן להתאים את השיטה לייצור טובולין מועשר ב-PTM נבחר על ידי דיכוי יתר של אנזים משתנה בתאים לפני טיהור הצינורית(איור 4B). לחלופין, ניתן להוסיף אנזימים לשינוי טובולין ל Tubulin במהלך תהליך הטיהור. לבסוף, אנו יכולים לטהר טובולין חסר isotypes ספציפיים או PTMs ממוחם של עכברים לקוי באנזימים המתאימים לשינוי טובולין (איור 4B)29.
לשיטה שאנו מתארים כאן יש שני יתרונות עיקריים: (i) היא מאפשרת ייצור של כמויות גדולות מספיק של טובולין בזמן קצר יחסית, ו-(ii) היא מייצרת טובולין טהור באיכות גבוהה, עם הרכב איזוטיפ צינורי ספציפי או PTMs. בסרטון המשויך לכתב יד זה, אנו מדגישים כמה מהשלבים הקריטיים הכרוכים בהליך זה.
Protocol
הטיפול בבעלי החיים והשימוש במחקר זה בוצעו בהתאם להמלצות הקהילה האירופית (2010/63/UE). הליכים ניסיוניים אושרו באופן ספציפי על ידי ועדת האתיקה של המכון קירי CEEA-IC #118 (אישור מס ' 04395.03 שניתן על ידי הרשות הלאומית) בהתאם להנחיות הבינלאומיות.
1. הכנת ריאגנטים לטיהור טובולין
הערה: כל המאגרים המשמשים לטיהור טובולין צריכים להכיל מלחי אשלגן ולא מלחי נתרן30.
- הכן 1 L של מדיום שלם: בינוני הנשר שונה של Dulbecco (DMEM), עם 10% סרום שור עוברי (FBS, 100 מ"ל), 200 מ"מ L-גלוטמין (10 מ"ל של 2 M מלאי), ו 1x פניצילין-סטרפטומיצין (10 מ"ל של 100x מלאי). יש לאחסן ב-4 מעלות צלזיוס.
- הכן 10 M אשלגן הידרוקסיד (KOH) על ידי המסת 140 גרם של KOH במים, להתאים את הנפח הסופי ל 250 מ"ל, ולאחסן בטמפרטורת החדר.
- הכן 0.5 M חומצה טטראצטית ethylenediamine (EDTA), pH 8, על ידי המסת 36.5 גרם של EDTA במים, להתאים את ה- pH ל 8.0 באמצעות KOH (אחרת EDTA לא להתמוסס) ואת הנפח הסופי ל 250 מ"ל, מסנן-לעקר, ולאחסן בטמפרטורת החדר.
- הכן מלוחים עם אגירת פוספט (PBS)-EDTA בהכנת 5 מ"ל של 0.5 M EDTA ל- 500 מ"ל של PBS, עיקור מסנן ואחסון בטמפרטורת החדר.
- הכן 0.5 M K-PIPES, pH 6.8, על ידי המסת 75.5 גרם של צינורות במים, להתאים pH 6.8 עם KOH (אחרת צינורות לא להתמוסס) ואת הנפח הסופי ל 500 מ"ל, מסנן-לעקר, ולאחסן ב 4 מעלות צלזיוס.
- הכן 1 M K-PIPES, pH 6.8, על ידי המסת 15.1 גרם של צינורות במים, להתאים pH 6.8 עם KOH ואת הנפח הסופי ל 50 מ"ל, לחטא מסנן, ולאחסן ב 4 °C (60 °F).
- הכן 0.5 מ אשלגן-אתילן גליקול-ביס (אתר β אמינאתיל)-N, N, N′,N′- חומצהטטראאצטית (K-EGTA, pH 7.7) על ידי המסת 47.5 גרם של EGTA במים, להתאים pH 7.7 עם KOH ואת הנפח הסופי ל 250 מ"ל, לחטא מסנן, ולאחסן בטמפרטורת החדר.
- הכן BRB80 (80 mM K-PIPES, pH 6.8; 1 mM K-EGTA; 1 מ"מ מגנזיום כלורי [MgCl2])פתרון על ידי ערבוב 3.2 מ"ל של 0.5 M PIPES, 40 μL של 0.5 M K-EGTA, ו 20 μL של 1 M MgCl2 ולהתאים את עוצמת הקול הסופית ל 20 מ"ל. יש לאחסן ב-4 מעלות צלזיוס.
- הכן 0.1 M פנילמטאנסולפוניל פלואוריד (PMSF) על ידי המסת 435 מ"ג של PMSF איזופרופנול כדי להשיג נפח סופי של 25 מ"ל ולאחסן ב -20 מעלות צלזיוס.
- הכן מעכבי פרוטאז לערבב (200x) על ידי המסת 10 מ"ג של אפרוטינין, 10 מ"ג של leupeptin, ו 10 מ"ג של 4-(2-aminoethyl)-בנזנסולפוניל פלואוריד במים כדי להשיג נפח סופי של 2.5 מ"ל, להפוך aliquots של 100 μL, ולאחסן ב -20 °C (60 °F).
- הכן 10% טריטון X-100 על ידי ערבוב 5 מ"ל של טריטון X-100 ב 45 מ"ל של מים, לחטא מסנן, ולאחסן בטמפרטורת החדר.
- הכן מאגר תמוגה (BRB80 בתוספת 1 mM 2-mercaptoethanol, 1 mM PMSF, 1x מעכבי פרוטאז לערבב, אופציונלי עבור HEK-293 תאים, 0.2% טריטון X-100) ביום של טיהור tubulin על ידי ערבוב 20 מ"ל של BRB80 עם 1.5 μL של 2-mercaptoethanol, 200 μL של 0.1 M PMSF, 100 μL של מעכבי פרוטאז לערבב, אופציונלי עבור HEK-293 תאים , 400 μL של 10% טריטון X-100.
הערה: 2-mercaptoethanol רעיל ויש להשתמש בו במכסה המנוע. - הכן 0.2 M GTP על ידי המסת 1 גרם של GTP ב 9.5 מ"ל של מים, להתאים את ה- pH ל 7.5 באמצעות KOH, להפוך aliquots של 20 μL, ולאחסן ב -20 מעלות צלזיוס. הימנע מחזורי ההקפאה-הפשרה חוזרים ונשנים.
- הכן 1 M tris (hydroxymethyl) aminomethane-hydrochloride (Tris-HCl) על ידי המסת 60.56 גרם של טריס במים, להתאים pH 6.8 עם HCl, להשלים את הנפח הסופי של 500 מ"ל, לחטא מסנן, ולאחסן בטמפרטורת החדר.
- הכן מאגר מדגם 5x Laemmli (450 מ"מ דיתיוטריטול (DTT); 10% נתרן דודכילסולפט (SDS); 400 מיקרומטר טריס-HCl, pH 6.8; 50% גליצרול; ~ 0.006% כחול ברומופנול) על ידי הוספת 4 גרם של SDS ל 16 מ"ל של שחומם מראש 1 M Tris-HCl, pH 6.8, ומערבבים את הפתרון בעדינות. מוסיפים 2.6 גרם של DTT ו 20 מ"ל של 100% גליצרול לתערובת ומערבבים עד שהפתרון הופך הומוגני. מוסיפים את הכמות הרצויה של כחול ברומופנול (2.5 מ"ג) כדי להגיע לעוצמת הצבע הנדרשת. הפוך 5 מ"ל aliquots ולאחסן ב -20 מעלות צלזיוס. הכן את הפתרון 2x עבודה של מאגר מדגם Laemmli על ידי דילול מלאי 5x במים מזוקקים.
2. מקורות הגברה וקצירה של טובולין
הערה: בפרוטוקול זה, שלושה מקורות של טובולין שימשו: (i) תאים (HeLa S3 ו HEK-293) גדל כמו תרבויות השעיה; (ii) תאים הגדלים כתרבויות חסידיות (HEK-293, HeLa, ו- U2 OS); ו-(iii) רקמת מוח של עכבר. פרוטוקול זה מתייחס ליום טיהור הצינור כ'יום 0' ובהתאם לכך תוארו צעדים אחרים ביחס ליום 0.
- הגברה של תאים
- תאים הגדלים כתרבויות השעיה
הערה: כדי לטהר בהצלחה טובולין מתרבויות השעיה, להשתמש לפחות 2 L של תרבות ההשעיה.- עבור 2 L של תרבות ההשעיה, להחיות ולגדול את סוג התא המועדף כדי לקבל 6 × 107 תאים 10 ימים לפני יום ההכנה. ביום -10, תאי צלחת על שש מנות בקוטר 15 ס"מ ב 107 תאים לכל צלחת.
- ביום -8, מחממים מראש את הכמות הנדרשת של מדיום מלא עד 37 מעלות צלזיוס. יש להוסיף 1 ליטר מדיום מחומם מראש לכל בקבוק ספינר בתנאים סטריליים. מניחים את הספינרים על שולחן מערבב שנקבע במהירות של 20-25 סל"ד בתוך חממת תרבות התאים, פותחים מעט את כובעי הספינרים לרוחב כדי לאפשר למדיום להשתוות לאווירת החממה.
הערה: כדי למנוע זיהום, לנקות ביסודיות את המשטח החיצוני של התקשורת ובקבוקי ספינר באמצעות 70% אתנול. - ביום -7, לנסות ולאסוף את התאים גדל 80-90% מפגש (כ 1.8 × 108 תאים). לאסוף תאים מ 3 מנות בכל פעם, לסובב למטה (200 × גרם,5 דקות, טמפרטורת החדר), ולהשעות מחדש את כל התאים ב 10 מ"ל של DMEM.
הערה: ניתוק יסודי של התאים בשלב זה חשוב מאוד כדי למנוע היווצרות של אגרגטים גדולים יותר בבקבוקי ספינר, אשר משפיע על הישרדות התא ותוצאות בתפוקת טובולין נמוכה. - הוסף 5 מ"ל של השעיית התא לכל בקבוק ספינר המכיל 1 L של DMEM, להחזיר את spinners לשולחן stirrer באינקובטור תרבות התא, ולאפשר לתאים לגדול במשך שבוע אחד.
- תאים הגדלים כתרבויות חסידיות
הערה: כדי לטהר בהצלחה טובולין מתאים חסידים, השתמש במינימום של 10 מנות של 80-90% מפגש.- להחיות ולהגביר את סוג התא הרצוי כדי לקבל 1 × 108 תאים שלושה ימים לפני יום הכנת tubulin.
- ביום -3, צלחת תאים אלה על עשר מנות 15 ס"מ ב 1 × 107תאים למנה ולאפשר להם לגדול 80-90% מפגש.
- ביום -1, במידת הצורך, תאי transfect עם פלסמיד להביע אנזים שינוי tubulin או isotype טובולין מסוים.
- תאים הגדלים כתרבויות השעיה
- קצירת התאים/רקמת המוח
- תאים הגדלים כתרבויות השעיה
- מעבירים את השעיית התא מ- spinners לבקבוקי צנטריפוגה L 1(שולחן החומרים)ותאי גלולה ב 250 × גרם,15 דקות, טמפרטורת החדר. להתחלת תרבות נוספת של תאי HeLa S3 בבקבוקי הספינר, השאירו 100 מ"ל של השעיית תאים בטווחים, והוסיפו 1 ליטר של DMEM שלם ומחומם מראש לבקבוק הספינר.
הערה: בדוק היטב זיהום חיידקי לפני שתמשיך לטיהור צינורית. - Resuspend תאים כדוריים מכל בקבוק צנטריפוגה ב 10 מ"ל של PBS קר כקרח, ולהעביר את כל התאים לתוך 50 מ"ל בורג כובע צינורות. במהלך השעיה מחדש, לשמור את התאים על קרח. גלולה התאים ב 250 × גרם,15 דקות, 4 מעלות צלזיוס.
הערה: פעל בהתאם להמלצות לניקוי ואחסון של בקבוקי ספינר (ראה טבלת חומרים). - השלך את supernatant ולקבוע את נפח גלולת התא. מ 2 L של תרבות ההשעיה (שני בקבוקי ספינר), מצפה גלולה תא של 5-6 מ"ל.
הערה: בפרוטוקול המתואר להלן, נפח גלולת התא הוא הניח להיות 10 מ"ל. להתאים את הניסוי על פי נפחי גלולה. - הוסף 1 נפח (10 מ"ל) של מאגר תמוגה להשעות מחדש את גלולת התא.
הערה: היחס בין נפח גלולת התא לנפח מאגר תמוגה חשוב מאוד עבור טיהור tubulin מוצלח. הוספת מאגר תמוגה יותר מקטין את ריכוז טובולין, אשר לאחר מכן לא מצליח להגיע לריכוז הקריטי הדרוש לפולימור, ובכך להפחית מאוד את התשואה tubulin.
הערה: תאים לשימוש חוזר במאגר תמוגה ניתן להקפיא הצמדה בחנקן נוזלי ומאוחסנים ב -80 מעלות צלזיוס למשך חודשיים.
- מעבירים את השעיית התא מ- spinners לבקבוקי צנטריפוגה L 1(שולחן החומרים)ותאי גלולה ב 250 × גרם,15 דקות, טמפרטורת החדר. להתחלת תרבות נוספת של תאי HeLa S3 בבקבוקי הספינר, השאירו 100 מ"ל של השעיית תאים בטווחים, והוסיפו 1 ליטר של DMEM שלם ומחומם מראש לבקבוק הספינר.
- תאים הגדלים כתרבויות חסידיות
הערה: יש לקצור במהירות רבה תאים מתרבויות חסידיות לטיהור טובולין מוצלח (כ-15 דקות לקצירת 10 מנות 15 ס"מ). שלושה אנשים השתתפו בשלב זה של הפרוטוקול.- הסר את המדיום מכלים 15 ס"מ על ידי נטייה הכלים, ולאחר מכן בעדינות לשטוף את התאים עם 7 מ"ל של PBS-EDTA בטמפרטורת החדר (אדם 1). לעבוד רק עם שלוש מנות 15 ס"מ בכל פעם, כדי למנוע השארת התאים ללא בינוני או חיץ.
- מוסיפים 5 מ"ל של PBS-EDTA לתאים ומדגרים אותם במשך 5 דקות בטמפרטורת החדר.
- השתמש מרים תאים בעדינות לנתק את התאים על ידי חפירת אותם לקצה אחד של המנה (אדם 2), ולאסוף את כל התאים בצינור בורג כובע 50 מ"ל (אדם 3). יש לשטוף כל צלחת ב-2 מ"ל נוספים של PBS-EDTA כדי לאסוף את כל התאים שנותרו מהכלים. במהלך שלב זה, לשמור על צינור בורג כובע 50 מ"ל המכיל את המתלה התא על הקרח.
- גלולה התאים ב 250 × גרם,10 דקות, 4 מעלות צלזיוס. השלך את supernatant ולקבוע את נפח גלולת התא. צפו לנפח של ~ 1 מ"ל מעשר מנות 15 ס"מ.
הערה: בפרוטוקול המתואר להלן, נפח גלולת התא הוא הניח להיות 10 מ"ל. להתאים את הניסויים על פי נפחי גלולה. - התחדשו עם התאים באמצעי אחסון אחד (10 מ"ל) של מאגר תמוגה.
הערה: ניתן לאחסן תאים בעלי שימוש חוזר במאגר תמוגה ב- -80 °C (60 °F) למשך עד חודשיים.
- רקמת המוח
הערה: ניתן להשתמש בעכברים בכל גיל, מין או רקע גנטי. הבחירה בזן העכבר המהונדס תהיה תלויה בשאלה המדעית שיש לטפל בה. בכתב יד זה, אנו מראים את הדוגמה של טובולין מטוהר מן ttll1-/- עכבר, חסר אנזים glutamylating המוח העיקרי, טובולין טירוסין ליגאז כמו 1 (TTLL1) חלבון31.- להקריב את העכבר על ידי נקע בצוואר הרחם, במהירות לערוף, ולאסוף את המוח לתוך צינור עגול למטה. אם יש עודף דם על המוח, לשטוף במהירות עם חיץ תמוגה. לאסוף את המוח ברגע העכבר מוקרב כמו עיכוב שלאחר המוות יכול להשפיע על ההצלחה של טיהור tubulin. השתמש בצינורות עגולים למטה כדי להתאים את רוחב החללית המשמשת הומוגניזציה.
הערה: מוחות עכבר שנאספו יכולים להיות קפואים בחנקן נוזלי ומאוחסנים ב-80 °C (70 °F) למשך עד 3 שנים. - הוסף 500 μL של מאגר תמוגה למוח יחיד המופק מעכבר בוגר. עבור שאר הפרוטוקול, ההנחה היא שאמצעי האחסון של מאגר התמוגה שנוסף הוא 10 מ"ל. התאם לניסוי שלך לפי מספר המוחות שישמשו.
- להקריב את העכבר על ידי נקע בצוואר הרחם, במהירות לערוף, ולאסוף את המוח לתוך צינור עגול למטה. אם יש עודף דם על המוח, לשטוף במהירות עם חיץ תמוגה. לאסוף את המוח ברגע העכבר מוקרב כמו עיכוב שלאחר המוות יכול להשפיע על ההצלחה של טיהור tubulin. השתמש בצינורות עגולים למטה כדי להתאים את רוחב החללית המשמשת הומוגניזציה.
- תאים הגדלים כתרבויות השעיה
3. תמוגה של תאים או רקמת המוח
- תאים הגדלים כתרבויות השעיה
- עבור HEK-293, lyse התאים על הקרח על ידי צנרת חוזרת ונשנית למעלה ולמטה באמצעות טיפים פיפטה ברוחב שונה. ראשית, לצרף עצה p1000 פיפטה 10 מ"ל, פיפטה המתלה התא למעלה ולמטה כל 5 דקות, במשך 10 דקות (שלושה מחזורים של pipetting). שנית, לצרף קצה p200 לקצה p1000 ופיפט נוסף כל 5 דקות, במשך 20 דקות (חמישה מחזורים של pipetting).
- עבור HeLa S3, lyse התאים באמצעות עיתונות צרפתית (ראה טבלה של חומרים עבור הגדרות).
- קח 1/100נפח של תערובת תמוגה (L) (200 μL עבור 20 מ"ל של L), ולהוסיף את אותו נפח של 2x Laemmli חוצץ, להרתיח במשך 5 דקות, ולאחסן ב -20 מעלות צלזיוס לניתוח נוסף.
- תאים הגדלים כתרבויות חסידיות
- להעביר את התאים לתוך צינור עגול למטה 14 מ"ל שגובהו הופחת כדי להתאים את החללית sonicator (ראה טבלה של חומרים עבור הגדרות). Sonicate התאים עבור ~ 45 פולסים, ולאשר תמוגה התא על ידי דגימת טיפה של תערובת תמוגה תחת מיקרוסקופ.
הערה: מספר הפולסים יכול להשתנות בהתאם לסוג התא המשמש לטיהור צינורית. Sonicating תאים יותר מדי יכול לגרום טובולין לזרז, ישפיע לרעה על תשואת הטיהור. - פיפטה התאים למעלה ולמטה על קרח כל 5 דקות במשך 20 דקות (חמישה מחזורים של pipetting), באמצעות קצה p200.
- קח 1/100נפח של תערובת תמוגה (L) (200 μL עבור 20 מ"ל של L) ולהוסיף את אותו נפח של 2x Laemmli חוצץ, להרתיח במשך 5 דקות ולאחסן ב -20 מעלות צלזיוס לניתוח נוסף.
- להעביר את התאים לתוך צינור עגול למטה 14 מ"ל שגובהו הופחת כדי להתאים את החללית sonicator (ראה טבלה של חומרים עבור הגדרות). Sonicate התאים עבור ~ 45 פולסים, ולאשר תמוגה התא על ידי דגימת טיפה של תערובת תמוגה תחת מיקרוסקופ.
-
רקמת המוח
- Lyse רקמת המוח באמצעות בלנדר רקמה (ראה טבלה של חומרים עבור הגדרות). לחלופין, lyse את הרקמה באמצעות עלה microtube או ציוד שווה ערך פיפטה למעלה ולמטה על קרח עם מזרק 1 מ"ל עם מחט 18 G.
- קח 1/100 נפח של תערובת תמוגה (L) (200 μL עבור 20 מ"ל של L), ולהוסיף את אותו נפח של 2x Laemmli חוצץ, להרתיח במשך 5 דקות, ולאחסן ב -20 מעלות צלזיוס לניתוח נוסף.
4. טיהור טובולין
- בירור Lysate
- לנקות את lysate (הפרדת גלולה וחלק מסיס של תערובת תמוגה) על ידי צנטריפוגה ב 150,000 × גרם, 4 °C (60 °F), 30 דקות. ראה טבלה של חומרים לקבלת פרטים על רוטורים ultracentrifuge וצינורות. עבור תמציות תאים, שכבה צפה לבנה נוצרת לעתים קרובות לאחר צנטריפוגה. אין להעביר שכבה צפה זו יחד עם supernatant, כפי שהוא מפריע פולמורציה tubulin. השתמש מזרק של נפח מתאים מחובר ארוך 20 G או 21 G מחט כדי להסיר בעדינות את supernatant מבלי להפריע את השכבה הצפה. אם supernatant הוא עדיין מעונן, צנטריפוגה ב 5,000 × גרם,4 °C (60 °F) במשך 10 דקות.
- העבר את supernatant (SN1) לצינור ultracentrifuge ולשים לב לנפח שלה. עבור גלולה תא 10 מ"ל, לצפות נפח של ~ 12 מ"ל עבור SN1.
- קח 1/100נפח של SN1 (120 μL עבור 12 מ"ל של SN1), ולהוסיף את אותו נפח של 2x Laemmli חוצץ, להרתיח במשך 5 דקות, ולאחסן ב -20 מעלות צלזיוס לניתוח נוסף.
- Resuspend גלולה (P1) ב BRB80 (שולחן החומרים) באמצעות אותו נפח כמו SN1. קח 1/100נפח של P1 (200 μL עבור 20 מ"ל של P1), ולהוסיף את אותו נפח של 2x Laemmli חוצץ, להרתיח במשך 5 דקות, ולאחסן ב -20 מעלות צלזיוס לניתוח נוסף.
- פירוז ראשון במאגר הטוחנות הנמוכה
- הכינו את תערובת הפולמליזציה על ידי שילוב נפח אחד של SN1 (12 מ"ל), נפח 1/200 של 0.2 M GTP (60 μL; ריכוז סופי 1 מ"מ), ונפח 0.5 של גליצרול מחומם מראש (6 מ"ל) בצינור בורג-קאפ של הנפח המתאים.
הערה: גליצרול משמש כסוכן צפיפות בשלבי פולמור לאורך הפרוטוקול ולכן אינו נחשב בחישובים של ריכוזי רכיבים אחרים. - פיפטה לערבב למעלה ולמטה, בעדינות הימנעות היווצרות של בועות אוויר ולהעביר אותו לצינורות ultracentrifuge המתאים.
הערה: בעת העברת התערובת לצינורות, להתאים את המשקל של הצינורות (בזוגות). זה מאפשר לניסוי להמשיך ישירות משקעים של microtubules לאחר שלב פולמורציה. בצע פעולה זו עבור כל שלבי הפולמליזציה לאורך הפרוטוקול. - מכסים את הצינורות בפרפילם, מעבירים לאמבט מים ב-30 מעלות צלזיוס, ומדגרים במשך 20 דקות.
- צנטריפוגה הצינורות ב 150,000 × גרם, 30 מעלות צלזיוס במשך 30 דקות. הסר את supernatant (SN2), ולשמור את גלולה של microtubules פולימרי (P2).
הערה: גלולת Microtubule ניתן להקפיא ולאחסן ב -80 °C (70 °F) עד 1 שנה. - קח 1/200נפח של SN2 (90 μL עבור 18 מ"ל SN2) ולהוסיף את אותו נפח של 2x Laemmli חוצץ, להרתיח במשך 5 דקות, ולאחסן ב -20 מעלות צלזיוס לניתוח נוסף.
- הכינו את תערובת הפולמליזציה על ידי שילוב נפח אחד של SN1 (12 מ"ל), נפח 1/200 של 0.2 M GTP (60 μL; ריכוז סופי 1 מ"מ), ונפח 0.5 של גליצרול מחומם מראש (6 מ"ל) בצינור בורג-קאפ של הנפח המתאים.
- הדמיה ראשונה
- Depolymerize microtubules על ידי הוספת BRB80 קר כקרח לכדור P2, ולהשאיר על הקרח במשך 5 דקות: עבור tubulin מתאים, להוסיף 1/60th (200 μL), ועל tubulin מן המוח, להוסיף 1/20th (600 μL) של נפח SN1.
הערה: נפח BRB80 קר כקרח שנוסף לכדור במהלך שלבי ההשמצה הוא תמיד יחסית לנפח של SN1. - Resuspend גלולת microtubule בעדינות, הימנעות בועות אוויר, עד הפתרון הוא הומוגני לחלוטין. השתמש עצה p1000 עבור כמה מחזורים של pipetting ואחריו עצה p200 כל 5 דקות, במשך 20 דקות (חמישה מחזורים של pipetting). זהו צעד מכריע להצלחת טיהור הצינור.
- להעביר את הפתרון לצינורות ultracentrifuge המתאימים, ולסובב למטה ב 150,000 × גרם, 4 מעלות צלזיוס במשך 20 דקות. העבר את ה-SN3 לצינור אולטרה-צנטריפוגה חדש של 1.5 מ"ל. גלולה שנוצרה לאחר שלב צנטריפוגה זה (P3) מכיל חלבונים מזורזים (חלבונים הקשורים microtubule או MAPs) ו microtubules שאינם depolymerized. הסופרנט (SN3) מכיל רכיבים מסיסים: דימרים של טובולין דהוי ו- MAPs, שהתנתקו מהמיקרוטובולות המופקרות.
- קח 1-4 μL של SN3, ולהוסיף 9 כרכים של חיץ Laemmli 2x, להרתיח במשך 5 דקות, ולאחסן ב -20 מעלות צלזיוס לניתוחים נוספים.
- Resuspend את גלולה P3 ב BRB80 (באותו נפח של SN3), לקחת 1-4 μL, ולהוסיף 9 כרכים של חיץ Laemmli 2x, להרתיח במשך 5 דקות, ולאחסן ב -20 מעלות צלזיוס.
- Depolymerize microtubules על ידי הוספת BRB80 קר כקרח לכדור P2, ולהשאיר על הקרח במשך 5 דקות: עבור tubulin מתאים, להוסיף 1/60th (200 μL), ועל tubulin מן המוח, להוסיף 1/20th (600 μL) של נפח SN1.
- פירוז שני (במאגר הטוחנות הגבוהה)
- הכן את תערובת פולמור על ידי שילוב 1 נפח של SN3 (200 μL), 1 נפח של 1 M צינורות מחוממים מראש (200 μL, ריכוז סופי 0.5 M), 1/100 נפח של 0.2 M GTP (2 μL, ריכוז סופי 1 מ"מ), ו 1 נפח של גליצרול מחומם מראש (200 μL) בצינור של נפח המתאים.
- פיפטה לערבב למעלה ולמטה, הימנעות היווצרות של בועות אוויר, ולהעביר אותו צינורות ultracentrifuge.
- מכסים את הצינורות בפרפילם, מעבירים אותם לאמבט מים ב-30 מעלות צלזיוס, ומדגרים במשך 20 דקות.
- צנטריפוגה הצינורות ב 150,000 × גרם,30 מעלות צלזיוס במשך 30 דקות. הסר את supernatant (SN4), ולשמור את גלולה של microtubules פולימרי (P4). גלולה P4 מכיל את microtubules פולימר, ואת SN4 supernatant מכיל טובולין unpolymerized, MAPs, וחלבונים מסיסים אחרים.
הערה: גלולת microtubule לאחר שלב פילמור השני ניתן להקפיא בצמד ומאוחסן ב -80 מעלות צלזיוס עד 1 שנה. - קח 1-4 μL ולהוסיף 9 כרכים של חיץ Laemmli 2x, להרתיח במשך 5 דקות, ולאחסן ב -20 מעלות צלזיוס לניתוחים נוספים.
- הדמיה שנייה
- Depolymerize microtubules על ידי הוספת BRB80 קר כקרח לכדור P4, ולהשאיר על הקרח במשך 5 דקות: עבור tubulin מתאים, להוסיף 1/100th (120 μL), ועל טובולין מן המוח, להוסיף 1/40th (300 μL) של נפח SN1.
- פיפטה למעלה ולמטה עם קצה p 200 כל 5 דקות, במשך 20 דקות (חמישה מחזורים של pipetting).
- להעביר את הפתרון צינור אולטרה צנטריפוגה 1.5 מ"ל, ולסובב למטה ב 150,000 × גרם, 4 °C (69 °F) במשך 20 דקות. העבר את ה-SN5 לצינור אולטרה-צנטריפוגה חדש של 1.5 מ"ל. גלולה שנוצרה לאחר שלב צנטריפוגה זה (P5) מכיל microtubules לא depolymerized. הסופרנט (SN5) מכיל את הצינורית המסיסה.
- קח 1-4 μL ולהוסיף 9 כרכים של חיץ Laemmli 2x, להרתיח במשך 5 דקות, ולאחסן ב -20 מעלות צלזיוס לניתוחים נוספים.
- Resuspend את גלולה P5 ב BRB80 (אותו נפח של SN5), לקחת 1-4 μL, ולהוסיף 9 כרכים של חיץ Laemmli 2x, להרתיח במשך 5 דקות, ולאחסן ב -20 מעלות צלזיוס לניתוחים נוספים.
- פירוז שלישי (במאגר הטוחנות הנמוכה)
- הכן את תערובת הפולמליזציה: 1 נפח של SN5 (120 μL), 1/200 נפח של 0.2 M GTP (0.6 μL, הריכוז הסופי הוא 1 מ"מ), ו 0.5 נפח של גליצרול מחומם מראש (60 μL) בצינור של נפח המתאים.
- פיפטה לערבב למעלה ולמטה, בעדינות הימנעות היווצרות של בועות אוויר, ולהעביר אותו לצינורות ultracentrifuge המתאים.
- מכסים את הצינורות בפרפילם, מעבירים אותם לאמבט מים ב-30 מעלות צלזיוס, ומדגרים במשך 20 דקות.
- צנטריפוגה הצינורות ב 150,000 × גרם,30 מעלות צלזיוס במשך 30 דקות. גלולה (P6) מכיל microtubules פולימרי SN6 supernatant מכיל כמויות קטנות של טובולין לא פולימרי.
הערה: כדורי Microtubule ניתן להקפיא ולאחסן ב -80 מעלות צלזיוס עד 1 שנה. - קח 1-4 μL ולהוסיף 9 כרכים של חיץ Laemmli 2x, להרתיח במשך 5 דקות, ולאחסן ב -20 מעלות צלזיוס לניתוחים נוספים.
- הדמיה שלישית
- Depolymerize microtubules על ידי הוספת BRB80 קר כקרח לכדור P6, ולהשאיר על הקרח במשך 5 דקות: עבור tubulin מתאים, להוסיף 1/100th (120 μL), ועל tubulin מן המוח, להוסיף 1/40th (300 μL) של נפח SN1.
- פיפטה למעלה ולמטה עם קצה p 200 כל 5 דקות, במשך 20 דקות (חמישה מחזורים של pipetting).
- להעביר את הפתרון לצינורות ultracentrifuge המתאימים, ולסובב למטה ב 150,000 × גרם, 4 °C (69 °F) במשך 20 דקות. העבר את SN7 לצינור אולטרה-צנטריפוגה חדש של 1.5 מ"ל. גלולה (P7) מכיל כמויות קטנות של microtubules לא depolymerized. הסופרנט (SN7) מכיל מיקרוטובוליות דהוי בלבד (טובולין מסיס).
- קח 1-4 μL ולהוסיף 9 כרכים של חיץ Laemmli 2x, להרתיח במשך 5 דקות, ולאחסן ב -20 מעלות צלזיוס לניתוחים נוספים.
- Resuspend את גלולה P7 ב BRB80 (אותו נפח של SN7), לקחת 1-4 μL, ולהוסיף 9 כרכים של חיץ Laemmli 2x, להרתיח במשך 5 דקות, ולאחסן ב -20 מעלות צלזיוס לניתוחים נוספים.
- לכמת את כמות tubulin (ראה תוצאות נציג)ו aliquot SN7 לתוך כמויות קטנות, הצמד להקפיא, ולאחסן ב -80 °C (69 °F).
תוצאות
המטרה העיקרית של שיטה זו היא לייצר טובולין איכותי, מוכשר הרכבה בכמויות מספיקות כדי לבצע ניסויים חוזרים ונשנים במבחנה עם הרכיבים המטוהרים. מיקרוטבולים שנאספו מתוך צינורית זו יכולים לשמש במבחני שחזור המבוססים על טכניקת המיקרוסקופיה הכוללת של פלואורסצנטיות השתקפות פנימית (TIRF) עם מיקרוטובולים דינמיים או יציבים, בניסויים הבודקים דינמיקה של מיקרוטובולה, אינטראקציות עם MAPs או מנועים מולקולריים, ויצירת כוח על ידי המנועים25. ניתן להשתמש בהם גם במבחני כדורים משותפים של microtubule-MAP ובספקטרוסקופיית NMR במצב מוצק28.
את ההעשרה והטוהר של טובולין לאורך כל תהליך הטיהור ניתן לפקח באמצעות ג'ל אלקטרופורזה SDS-polyacrylamide מוכתם Coomassie (PAGE), רצוי 'TUB' SDS-PAGE ג'לים, המאפשרים הפרדה של α- ו β-tubulins, אשר נודדים במשותף כמו להקה אחת בג'לים קלאסיים32. Lysates שנאספו בשלבים שונים (למעט הדהויפולמריזציה האחרונה, ראה פרוטוקול) נטענים על הג'ל בכמויות דומות להערכת ההצלחה של טיהור טובולין (איור 2A)24. דגימת הצינור הסופית, שהיא יקרה מאוד, נטענת רק על הג'ל לקביעת ריכוז הצינור. זה נורמלי לאבד קצת טובולין בתהליך של מחזורים חוזרים ונשנים של פולמור ו depolymerization. תשואה נמוכה מהצפוי של הצינור המטוהר הסופי יכולה לנבוע מהדחה חלקית של מיקרוטובולות, הדמיה על ידי נוכחות של כמות חשובה של טובולין בשברים P3, P5, ו P7, או (ii) פולמריזציה טובולין יעיל לתוך microtubules, ובמקרה זה כמות נמוכה יותר של טובולין קיים שברים P2, P4, ו P6 ומעלה שברים SN2, SN4, ו SN6 (איור 2B). אם הצינורית אובדת במהלך שלבי פולמור (כמויות נמוכות יותר של P2 ו- P4) (i) להבטיח ריכוז טובולין מספיק במהלך פולמור (ii) להשתמש aliquot טרי של GTP, ו / או (iii) לאשר מחדש את הטמפרטורה של תגובת פולמור. אם tubulin הולך לאיבוד במהלך צעדי depolymerization (כמויות נמוכות יותר של SN3 ו SN5), להגדיל את הזמן, כמו גם pipetting של התערובת על הקרח.
לכימות של טובולין מטוהר, הפעל את הדגימות יחד עם הכמויות הידועות של אלבומין סרום שור (BSA, 0.5 מיקרוגרם – 1 מיקרוגרם – 2 מיקרוגרם – 4 מיקרוגרם) (איור 3A) ב- SDS-PAGE. הג'לים מוכתמים בכחול בוהק של קומאסי, סרוקים, ועוצמותיהן של להקות BSA ו tubulin נמדדות לפי צפיפות כמותית (איור 3B)כמתואר https://openwetware.org/wiki/Protein_Quantification_Using_ImageJ. שים לב כי ניתוח זהה יכול להיעשות פיג'י, גרסה משודרגת של ImageJ33. ערכים מפס BSA שימשו לקביעת משוואת הרגרסיה הליניארית, ששימשה לחישוב כמות החלבון ברצועות הצינוריות. רק עוצמות רצועת tubulin בטווח של עקומת BSA משמשים כדי לקבוע ריכוז טובולין. בהתבסס על ריכוז טובולין מחושב, aliquots של כמויות הרצויות של טובולין מוכנים, הצמד קפוא חנקן נוזלי, ומאוחסן ב -80 מעלות צלזיוס. אנחנו בדרך כלל להשיג על ~ 2 מ"ג של טובולין מארבעה בקבוקי ספינר של תרביות השעיה HeLa S3 (~ 15 גרם של תאים), ~ 250 מיקרוגרם של tubulin מעשר מנות בקוטר 15 ס"מ (~ 1.2 גרם של תאים), ו ~ 1 מ"ג של טובולין מ 1 גרם של רקמת המוח.
כדי לאשר את ההעשרה של isotype צינורי מסוים או שינוי, ~ 0.1 מיקרוגרם של tubulin מטוהרים ניתן immunoblotted באמצעות נוגדנים בהתאמה34,35. צינורית הבקרה תשתנה בהתאם לטובולין המעניין. עבור טובולין שונה במבחנה עם אנזים שינוי, להשתמש tubulin שאינם מטופלים כשליטה. ל Tubulin שונה בצלולו על ידי overexpression של אנזים שינוי, להשתמש tubulin מטוהרים מתאים שאינם מבטאים את האנזים כשליטה (איור 4A). צינורית בקרה עבור tubulin מטוהרים ממוחות עכבר נוקאאוט יהיה tubulin מעכברים מסוג בר (איור 4B). בכל הניתוחים האימונובלטים, עומס שווה של טובולין מאומת באמצעות נוגדן אנטי-α-טובולין (12G10) שאינו תלוי ב-PTM.
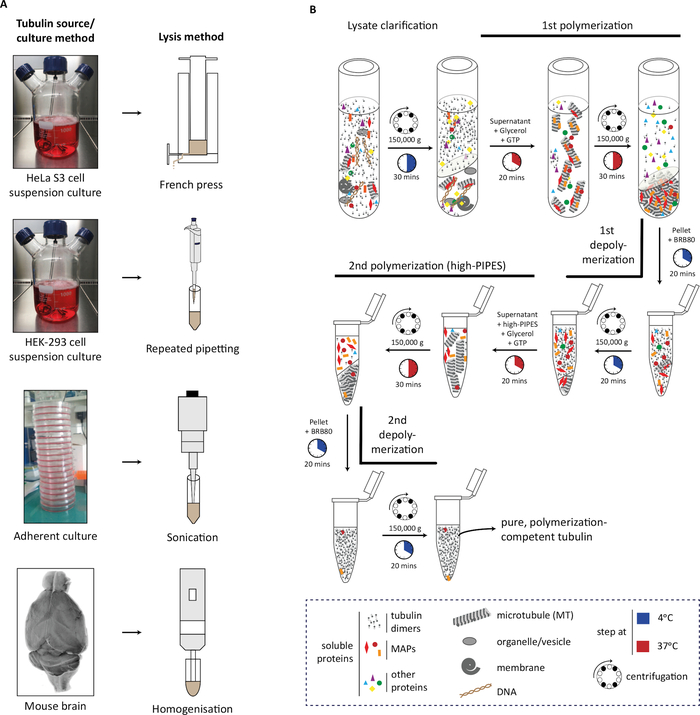
איור 1: טיהור טובולין ממקורות שונים באמצעות מחזורי פילמליזציה-דפולימריזציה. (A)מקורות שונים של טובולין הם lysed באמצעות אסטרטגיות ספציפיות. תאי HeLa S3 בתרבית בהשעיה הם lysed באמצעות עיתונות צרפתית; תאי HEK-293 הם lysed על ידי צינורות חוזרים ונשנים. תאים חסידיים היו lysed באמצעות פולסים קצרים של sonication ורקמת המוח העכבר באמצעות הומוגניזר רקמה. (B)ייצוג סכמטי של השלבים העוקבים של פרוטוקול טיהור הצינור באמצעות מחזורים של דפולמריזציה קרה ופילמור חם. לאחר תמוגה ובירור lysate, microtubules הם polymerized ו pelleted. לאחר מכן, המיקרוטובולות עוברות דה-פולימרציה ולאחר מכן מותרות ל polymerize במאגר טוחנות גבוהה, ומונעות משקעים משותפים של חלבון הקשור למיקרו-טובול (MAP) עם המיקרו-טובולות. מיקרוטובולות ללא MAP לאחר מכן depolymerized והוא יכול להיות נתון עוד יותר למחזור שלישי של דיפולימריזציה פולימריזציה כדי להסיר כמויות זעירות של מאגר טוחנות גבוהה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: הערכת ההצלחה של טיהור הצינור. דגימות שנאספו בשלבים שונים של פרוטוקול טיהור tubulin נוהלו על 'TUB' נתרן dodecylsulfate-polyacrylamide ג'ל אלקטרופורזה (SDS-PAGE) ג'ל (ראה פרוטוקול לפרטים) ומוכתם בכחול מבריק קומאסי. (A)בטיהור טובולין מוצלח, α ו-β-טובולינים מועשרים בהדרגה לאורך כל התהליך. לאחר פילמור השני, גלולת microtubule (P4) הוא כמעט ללא זיהום מחלבונים אחרים או חלבונים הקשורים microtubule (MAPs). שים לב כי זה נורמלי לאבד קצת tubulin במהלך ההליך. (B)בטיהור טובולין לא מוצלח, תשואת הצינור הסופית נמוכה, ו tubulin נשאר גם גלולה לאחר דפולימריזציה או ב supernatant לאחר פילמור (תיבות אדומות). בדוגמה המוצגת כאן, טובולין לא פולמריזציה יעילה בשני שלבי פולמור. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: כימות של טובולין מטוהר באמצעות נתרן דוכילסולפט-פוליאקרילמיד ג'ל אלקטרופורזה (SDS-PAGE) מוכתם קומאסי. (A)ג'ל SDS-PAGE מוכתם קומאסי עם כמויות ידועות של אלבומין סרום שור (BSA; 0.5, 1, 2 ו 4 מיקרוגרם, קו הדרגתי אפור) ונפחים שונים (0.5 ו 1 μL, צבעים בהירים וכהים, בהתאמה) של טובולין מטוהרים. בדוגמה המוצגת, טובולין טירוזיני (HeLa S3 טובולין, כתום בהיר וכהה) ו tubulinated detyrosinated (HeLa S3 tubulin מטופלים carboxypeptidase A, אור וכחול כהה) היו טעונים על הג'ל. (B)להקות BSA מ-(A) כמתו באמצעות ImageJ (ביחידות שרירותיות, AU) והותוו כנגד כמות החלבון שנטען (נקודות אפורות לשחור). נקודות אלה שימשו לחישוב קו הרגרסיה הליניארי (קו השיפוע האפור) והמשוואה, ששימשו לחישוב כמויות החלבון בדגימות הצינוריות (נקודות כתומות וכחולות בהירות וכהות) שנטענו על הג'ל. זה הקל על חישוב הריכוז של דגימות טובולין. שים לב כי אין להשתמש בנקודות שמעבר לעקומה הסטנדרטית של BSA כדי לקבוע ריכוז (נקודות כתומות כהות וכחולות). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
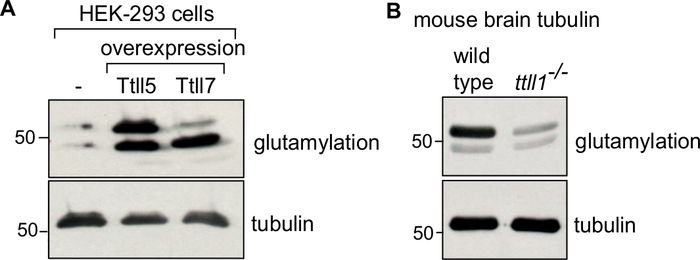
איור 4: ניתוח אימונובלוט של טובולין מטוהר עם PTMs שונים. (A) Tubulins מטוהרים מתאי HEK-293: סוג פראי, או תאים overexpressing TTLL5 או TTLL7 נותחו להעשרה ספציפית של polyglutamylation באמצעות נוגדן GT335. בעוד TTLL5 overexpression מגביר polyglutamylation על α- ו β-טובולין, TTLL7 overexpression במיוחד מעשיר β-טובולין גלוטמילציה. (B) טובולין מטוהר מרקמות המוח מסוג בר ו ttll1-/- עכברים נותחו עבור דפוסים של גלוטמילציה. שים לב להפחתה חזקה של פוליגלוטמילציה של טובולין מ ttll1-/- עכברים, אשר חסרים את המוח העיקרי גלוטמילאז TTLL136. ג'לים 'TUB' שימשו להפרדת α- ו β-טובולין. כמות שווה של עומס טובולין אושרה על ידי 12G10, נוגדן אנטי α טובולין. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
השיטה המתוארת כאן מספקת פלטפורמה ליצירת טובולין איכותי ומוכשר להרכבה בכמויות בינוניות-גדולות מקווי תאים וממוחות של עכבר יחיד. הוא מבוסס על פרוטוקול תקן זהב של טיהור tubulin ממוחות שור המשמשים בתחום במשך שנים רבות16,17. אחד היתרונות הספציפיים של הגישה הוא השימוש בתרביות השעיה של תאי HeLa S3, אשר, לאחר שנקבע, מניב כמויות גדולות של תאים תוך דרישת זמן מעשי קטן. זה עושה את הפרוטוקול קל יחסית לבצע בכל מעבדה לביולוגיה של התא, ואילו שיטות טיהור טובולין אחרות18,19,32,37 דורשים ציוד ספציפי ומומחיות ולכן משמשים בעיקר על ידי מעבדות עם רקע חזק טיהור חלבון. בעת הפקת כמויות קטנות יותר של טובולין מקווי תאים חסידים, ניתן להשתמש במגוון קווי תאים. טיהרנו בהצלחה טובולין מתאי HeLa, U-2 ו- HEK-293. אם יש צורך בטיהור בקנה מידה גדול יותר, תאים שנקטפו או מוחות יכולים להיות קפואים במאגר תמוגה ומאוחסנים ב -80 מעלות צלזיוס, וכדורי תאים מרובים או מוחות יכולים להיות מאוגדים יחד כדי לטהר כמויות גדולות יותר של טובולין.
טובולין מטוהר מקווי תאים הוא כמעט ללא PTMs טובולין. טיר-טובולין זה יכול בקלות להיות מומר צינורית detyrosinated (deTyr-) בצעד אחד פשוט25. כדי לייצר טובולין עם PTMs אחרים, אנזימים ספציפיים לשינוי טובולין ניתן להגזים בתאים לפני טיהור טובולין. יתר על כן, שימוש בקווי תאים ממוצא אנושי כמקור החומר מסייע במניעת בעיות פוטנציאליות בין מינים בעת לימוד אינטראקציות בין מיקרוטובולים ל- MAPs אנושיים. יתר על כן, tubulin מן untransformed (כגון HEK293) או טרנספורמציה (כגון HeLa) תאים יכולים לספק מידע על ההשפעות של תרופות מכוונות microtubule (למשל, taxanes) על נורמלי לעומת microtubules תא הגידול.
לבסוף, הפרוטוקול שלנו מקל על טיהור טובולין ממוחות של עכבר יחיד. כמו מספר גדל והולך של מודלים העכבר של מוטציות tubulin ושינויים נוצרים, פרוטוקול זה מאפשר ניתוח ישיר של המאפיינים והאינטראקציות של microtubules עם הרכב isotype tubulin השתנה38,39,40 או tubulin PTMs31,41.
הגישה מבוססת על מחזורים של פילמליזציה ודפולימריזציה. לכן, איזוטיפים צינוריים ספציפיים או טובולין עם PTMs מסוימים המשפיעים על ההרכבה ופירוק המאפיינים של microtubules יכול לגרום לאובדן לא פרופורציונלי או הפחתה של צורות טובולין כאלה במהלך תהליך הטיהור. עם זאת, הראינו כי PTMs צינורית גדולה, כגון אצטילציה, detyrosination, גלוטמילציה, ו glycylation, נשמרים על microtubules לאורך כלתהליך טיהורtubulin 24 . עם זאת, יש לציין כי עבור ניתוחים כמותיים של הרכב טובולין בתאים או ברקמות, הגישה מבוססת טור TOG טיהור tubulin מתאים יותר כפי שהוא יאפשר משוחד, פולמריזציה עצמאיתטובולין טיהור 18. למרות המגבלה שלו, הפרוטוקול שלנו מציע יתרון גדול ביצירת כמויות גדולות של טובולין באיכות גבוהה שניתן להשתמש בהם בניסויים קפדניים בשיחזור במבחנה. בפרט, זה מקל על השימוש טובולין במוח עשיר PTM בניסויים שגרתיים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי ANR-10-IDEX-0001-02, תא LabEx'n'Scale ANR-11-LBX-0038 ומכון דה התכנסות Q-life ANR-17-CONV-0005. סי.ג'יי נתמך על ידי המכון קירי, סוכנות המחקר הלאומית הצרפתית (ANR) מעניקה ANR-12-BSV2-0007 ו ANR-17-CE13-0021, המכון הלאומי לסרטן (INCA) מענק 2014-PL BIO-11-ICR-1, ואת פונדציה לשפוך la Recherche רפואי (FRM) מענק DEQ2017033676. MMM נתמך על ידי מענק אלצהיימר לשווא פונדציה FR-16055p, ועל ידי צרפת אלצהיימר מענק AAP SM 2019 n ° 2023. JAS נתמכה על ידי תוכנית המחקר והחדשנות Horizon 2020 של האיחוד האירופי במסגרת הסכם המענק מארי סקלודובסקי-קירי מס' 675737, ומענק FRM FDT201904008210. SB נתמך על ידי מענק FRM FDT201805005465.
אנו מודים לכל חברי מעבדת ינקה, ובמיוחד לג'יי מרקהרון, כמו גם לג'י לאקיסיק (מכון MICALIS, AgroParisTech) וא. גאוטרו (אקול פוליטכניק) על העזרה במהלך הקמת הפרוטוקול. ברצוננו להודות למתקן החיות של המכון קירי על העזרה בגידול וטיפול בעכבר.
הנוגדן 12G10, שפותח על ידי ג'יי פרנקל ו מ ' נלסון, התקבל מבנק Hybridoma מחקרים התפתחותיים שפותח בחסות NICHD ומתוחזק על ידי אוניברסיטת איווה.
Materials
| Name | Company | Catalog Number | Comments |
| 1 M MgCl2 | Sigma | #M1028 | |
| 1-L cell culture vessels | Techne F7610 | Used for spinner cultures. Never stir the empty spinner bottles. When spinner bottles are in the cell culture incubator, always keep the lateral valves of spinner bottles slightly open to facilitate the equilibration of media with incubator’s atmosphere. After use, fill the spinner bottles immediately with tap water to avoid drying of remaining cells on the bottle walls. Wash the bottles with deionised water, add app 200 ml of deionised water and autoclave. Under a sterile cell culture hood remove the water and allow the bottles to dry completely, still under the hood, for several hours. Never use detergents for cleaning the spinner bottles because any trace amounts of the detergent can be deleterious to the cells. | |
| 1.5- and 2-ml tubes | |||
| 14-ml round-bottom tubes | |||
| 15-cm-diameter sterile culture dishes | |||
| 15-ml screw-cap tubes | |||
| 2-mercaptoethanol | Sigma | #M3148 | 2-mercaptoethanol is toxic and should be used under the hood. |
| 4-(2-aminoethyl)-benzenesulfonyl fluoride | Sigma | #A8456 | |
| 40% Acrylamide | Bio-Rad | #161-0140 | |
| 5-, 10- 20-ml syringes | |||
| 5-ml, 10-ml, 25-ml sterile pipettes | |||
| 50-ml screw-cap tubes | |||
| Ammonium persulfate (APS) | Sigma | #A3678 | |
| Anti-alpha-tubulin antibody, 12G10 | Developed by J. Frankel and M. Nelson, obtained from the Developmental Studies Hybridoma Bank, developed under the auspices of the NICHD, and maintained by the University of Iowa | dilution: 1/500 | |
| Anti-glutamylated tubulin antibody, GT335 | AdipoGen | #AG-20B-0020 | dilution: 1/20,000 |
| Aprotinin | Sigma | #A1153 | |
| Balance (0.1 – 10 g) | |||
| Beckman 1-l polypropylene bottles | For collecting spinner cultures | ||
| Beckman Avanti J-26 XP centrifuge | For collecting spinner cultures | ||
| Biological stirrer | Techne MCS-104L | Installed in the cell culture incubator (for spinner cultures), 25 rpm for Hela S3 and HEK 293 cells | |
| Bis N,N’-Methylene-Bis-Acrylamide | Bio-Rad | #161-0201 | |
| Blender IKA Ultra-Turrax® | For lysing brain tissue, use 5-mm probe, with the machine set at power 6 or 7. Blend the brain tissue 2-3 times for 15 s on ice. | ||
| Bovine serum albumin (BSA) | Sigma | #A7906 | |
| Bromophenol blue | Sigma | #1.08122 | |
| Carboxypeptidase A (CPA) | Sigma | #C9268 | Concentration: 1.7 U/µl |
| Cell culture hood | |||
| Cell culture incubator set at 37°C, 5% CO2 | |||
| Dimethyl sulfoxide (DMSO) | Sigma | #D8418 | DMSO can enhance cell and skin permeability of other compounds. Avoid contact and use skin and eye protection. |
| DMEM medium | Life Technologies | #41965062 | |
| DTT, DL-Dithiothreitol | Sigma | #D9779 | |
| EDTA | Euromedex | #EU0007-C | |
| EGTA | Sigma | #E3889 | |
| Ethanol absolute | Fisher Chemical | #E/0650DF/15 | |
| Fetal bovine serum (FBS) | Sigma | #F7524 | |
| French pressure cell press | Thermo electron corporation | #FA-078A | with a #FA-032 cell; for lysing big amounts of cells. Set at medium ratio, and the gauge pressure of 1,000 psi (corresponds to 3,000 psi inside the disruption chamber). |
| Glycerol | VWR Chemicals | #24388.295 | |
| Glycine | Sigma | #G8898 | |
| GTP | Sigma | #G8877 | |
| Heating block | Stuart | #SBH130D | |
| Hela cells | ATCC® CCL-2™ | ||
| Hela S3 cells | ATCC | ATCC® CCL-2.2™ | |
| Hydrochloric acid (HCl ) | VWR | #20252.290 | |
| Inverted microscope | With fluorescence if cell transfection is to be verified | ||
| Isopropanol | VWR | #20842.298 | |
| jetPEI | Polyplus | #101 | |
| JLA-8.1000 rotor | For collecting spinner cultures | ||
| KOH | Sigma | #P1767 | KOH is corrosive and causes burns; use eye and skin protection. |
| L-Glutamine | Life Technologies | #25030123 | |
| Laboratory centrifuge for 50-ml tubes | Sigma | 4-16 K | |
| Leupeptin | Sigma | #L2884 | |
| Liquid nitrogen | |||
| Micro-pipettes p2.5, p10, p20, p100, p200 and p1000 and corresponding tips | |||
| Micropestles | Eppendorf | #0030 120.973 | |
| Mouse brain tissue | Animal care and use for this study were performed in accordance with the recommendations of the European Community (2010/63/UE). Experimental procedures were specifically approved by the ethics committee of the Institut Curie CEEA-IC #118 (authorization no. 04395.03 given by National Authority) in compliance with the international guidelines. | ||
| Needles 18G X 1 ½” (1.2 X 38 mm | Terumo | #18G | |
| Needles 20G X 1 ½” (0.9 X 38 mm | Terumo | #20G | |
| Needles 21G X 4 ¾” (0.8 X 120 mm | B.Braun | #466 5643 | |
| Parafilm | |||
| PBS | Life Technologies | #14190169 | |
| Penicillin-Streptomycin | Life Technologies | #15140130 | |
| pH-meter | |||
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma | #P7626 | PMSF powder is hazardous. Use skin and eye protection when preparing PMSF solutions. |
| PIPES | Sigma | #P6757 | |
| Pipette-boy | |||
| Rotors | Beckman 70.1 Ti; TLA-100.3; and TLA 55 | ||
| SDS-PAGE electrophoresis equipment | Bio-Rad | #1658001FC | |
| SDS, Sodium dodecyl sulphate | VWR | #442444H | For preparing Laemmeli buffer |
| SDS, Sodium dodecyl sulphate | Sigma | #L5750 | For preparing 'TUB' SDS-PAGE gels |
| Sonicator | Branson | #101-148-070 | Used for lysing cells grown as adherent cultures. Use 6.5 mm diameter probe, set the sonicator at “Output control” 1, “Duty cycle” 10% and time depending on the cell type used. |
| Tabletop centrifuge for 1.5 ml tubes | Eppendorf | 5417R | |
| TEMED, N, N, N′, N′-Tetramethylethylenediamine | Sigma | #9281 | |
| Trichostatin A (TSA) | Sigma | #T8552 | |
| Triton X-100 | Sigma | #T9284 | |
| Trizma base (Tris) | Sigma | #T1503 | |
| Trypsin | Life Technologies | #15090046 | |
| Ultracentrifuge rotors | TLA-55, TLA-100.3 and 70.1 Ti rotors | Set at 4°C or 30°C based on the need of the experiment | |
| Ultracentrifuge tubes | Beckman | #357448 | for using with TLA-55 rotor |
| Ultracentrifuge tubes | Beckman | #349622 | for using with TLA-100.3 rotor |
| Ultracentrifuge tubes | Beckman | #355631 | for using with 70.1 Ti rotor |
| Ultracentrifuges | Beckman | Optima L80-XP (or equivalent) and Optima MAX-XP (or equivalent) | Set at 4°C or 30°C based on the need of the experiment |
| Vortex mixer | |||
| Water bath equipped with floaters or tube holders | Set at 30°C |
References
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Janke, C. The tubulin code: Molecular components, readout mechanisms, and functions. Journal of Cell Biology. 206 (4), 461-472 (2014).
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews: Molecular Cell Biology. 21 (6), 307-326 (2020).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Margolis, R. L., Wilson, L. Opposite end assembly and disassembly of microtubules at steady state in vitro. Cell. 13 (1), 1-8 (1978).
- Borisy, G. G., Olmsted, J. B. Nucleated assembly of microtubules in porcine brain extracts. Science. 177 (55), 1196-1197 (1972).
- Kirschner, M. W., Williams, R. C. The mechanism of microtubule assembly in vitro. Journal of Supramolecular Structure. 2 (2-4), 412-428 (1974).
- Baas, P. W., Lin, S. Hooks and comets: The story of microtubule polarity orientation in the neuron. Developmental Neurobiology. 71 (6), 403-418 (2011).
- Stepanova, T., et al. Visualization of microtubule growth in cultured neurons via the use of EB3-GFP (end-binding protein 3-green fluorescent protein). Journal of Neuroscience. 23 (7), 2655-2664 (2003).
- Nedelec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Bieling, P., Telley, I. A., Surrey, T. A minimal midzone protein module controls formation and length of antiparallel microtubule overlaps. Cell. 142 (3), 420-432 (2010).
- Roostalu, J., et al. Directional switching of the kinesin Cin8 through motor coupling. Science. 332 (6025), 94-99 (2011).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nature Materials. 14 (11), 1156-1163 (2015).
- Hendricks, A. G., Goldman, Y. E., Holzbaur, E. L. F. Reconstituting the motility of isolated intracellular cargoes. Methods in Enzymology. 540, 249-262 (2014).
- Dogterom, M., Surrey, T. Microtubule organization in vitro. Current Opinion in Cell Biology. 25 (1), 23-29 (2013).
- Vallee, R. B. Reversible assembly purification of microtubules without assembly-promoting agents and further purification of tubulin, microtubule-associated proteins, and MAP fragments. Methods in Enzymology. 134, 89-104 (1986).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Widlund, P. O., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Molecular Biology of the Cell. 23 (22), 4393-4401 (2012).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Letters. 587 (21), 3450-3455 (2013).
- Uchimura, S., et al. A flipped ion pair at the dynein-microtubule interface is critical for dynein motility and ATPase activation. Journal of Cell Biology. 208 (2), 211-222 (2015).
- Pamula, M. C., Ti, S. C., Kapoor, T. M. The structured core of human beta tubulin confers isotype-specific polymerization properties. Journal of Cell Biology. 213 (4), 425-433 (2016).
- Vemu, A., et al. Structure and dynamics of single-isoform recombinant neuronal Human tubulin. Journal of Biological Chemistry. 291 (25), 12907-12915 (2016).
- Ti, S. C., Alushin, G. M., Kapoor, T. M. Human beta-tubulin isotypes can regulate microtubule protofilament number and stability. Developmental Cell. 47 (2), 175-190 (2018).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nature Protocols. 14, 1634-1660 (2019).
- Barisic, M., et al. Microtubule detyrosination guides chromosomes during mitosis. Science. 348 (6236), 799-803 (2015).
- Nirschl, J. J., Magiera, M. M., Lazarus, J. E., Janke, C., Holzbaur, E. L. F. alpha-Tubulin tyrosination and CLIP-170 phosphorylation regulate the initiation of dynein-driven transport in neurons. Cell Reports. 14 (11), 2637-2652 (2016).
- Guedes-Dias, P., et al. Kinesin-3 responds to local microtubule dynamics to target synaptic cargo delivery to the presynapse. Current Biology. 29 (2), 268-282 (2019).
- Luo, Y., et al. Direct observation of dynamic protein interactions involving human microtubules using solid-state NMR spectroscopy. Nature Communications. 11 (1), 18(2020).
- Even, A., et al. ATAT1-enriched vesicles promote microtubule acetylation via axonal transport. Science Advances. 5 (12), 2705(2019).
- Wolff, J., Sackett, D. L., Knipling, L. Cation selective promotion of tubulin polymerization by alkali metal chlorides. Protein Science. 5 (10), 2020-2028 (1996).
- Magiera, M. M., et al. Excessive tubulin polyglutamylation causes neurodegeneration and perturbs neuronal transport. EMBO Journal. 37 (23), 100440(2018).
- Lacroix, B., Janke, C. Generation of differentially polyglutamylated microtubules. Methods in Molecular Biology. 777, 57-69 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Magiera, M. M., Janke, C. Methods in Cell Biology Vol. 115 Microtubules, in vitro. Correia, J. J., Wilson, L. , Academic Press. 247-267 (2013).
- Hausrat, T. J., Radwitz, J., Lombino, F. L., Breiden, P., Kneussel, M. Alpha- and beta-tubulin isotypes are differentially expressed during brain development. Developmental Neurobiology. , (2020).
- Janke, C., et al. Tubulin polyglutamylase enzymes are members of the TTL domain protein family. Science. 308 (5729), 1758-1762 (2005).
- Newton, C. N., et al. Intrinsically slow dynamic instability of HeLa cell microtubules in vitro. Journal of Biological Chemistry. 277 (45), 42456-42462 (2002).
- Belvindrah, R., et al. Mutation of the alpha-tubulin Tuba1a leads to straighter microtubules and perturbs neuronal migration. Journal of Cell Biology. 216 (8), 2443-2461 (2017).
- Breuss, M., et al. Mutations in the murine homologue of TUBB5 cause microcephaly by perturbing cell cycle progression and inducing p53 associated apoptosis. Development. , (2016).
- Latremoliere, A., et al. Neuronal-specific TUBB3 is not required for normal neuronal function but is essential for timely axon regeneration. Cell Reports. 24 (7), 1865-1879 (2018).
- Morley, S. J., et al. Acetylated tubulin is essential for touch sensation in mice. Elife. 5, (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved