Method Article
تنقية توبولين مع التعديلات ما بعد النقل الخاضعة للرقابة وIsotypes من مصادر محدودة من قبل دورات البلمرة- Depolymerization
In This Article
Summary
يصف هذا البروتوكول تنقية التوبولين من مصادر صغيرة / متوسطة الحجم مثل الخلايا المستزرعة أو أدمغة الماوس الواحدة ، وذلك باستخدام دورات البلمرة وإزالة البوليمر. يتم إثراء التوبولين المنقى في أنواع متساوية محددة أو لديه تعديلات محددة بعد النقل ويمكن استخدامه في فحوصات إعادة تشكيل المختبر لدراسة ديناميكيات microtubule والتفاعلات.
Abstract
أحد الجوانب الهامة لدراسات الهيكل الخلوي microtubule هو التحقيق في سلوك microtubule في تجارب إعادة تشكيل المختبر. أنها تسمح بتحليل الخصائص الجوهرية لل microtubules، مثل الديناميات، وتفاعلاتها مع البروتينات المرتبطة microtubule (MAPs). "رمز توبولين" هو مفهوم الناشئة التي تشير إلى isotypes توبولين مختلفة ومختلف التعديلات ما بعد النقل (PTMs) والمنظمين للخصائص microtubule والوظائف. لاستكشاف الآليات الجزيئية للشفرة التوبولين, من المهم إجراء تجارب إعادة تشكيل في المختبر باستخدام tubulin تنقية مع isotypes محددة وPTMs.
حتى الآن، كان هذا تحديا من الناحية الفنية كما توبولين الدماغ، والذي يستخدم على نطاق واسع في التجارب المختبرية، ويؤوي العديد من PTMs ولها تكوين isotype محددة. ومن ثم، وضعنا هذا البروتوكول لتنقية التوبولين من مصادر مختلفة ومع التراكيب isotype مختلفة وPTMs التي تسيطر عليها، وذلك باستخدام النهج الكلاسيكي من البلمرة ودورات إزالة البوليمر. بالمقارنة مع الأساليب القائمة القائمة على تنقية تقارب، وهذا النهج ينتج نقية، البلمرة المختصة التوبولين، كما يتم التخلص من أنبوبولين مقاومة للبوليمرة أو إزالة البوليمر خلال خطوات تنقية المتعاقبة.
نحن نصف تنقية التوبولين من خطوط الخلية ، التي تزرع إما في التعليق أو كثقافات معتنقة ، ومن أدمغة فأرة واحدة. تصف الطريقة أولا توليد كتلة الخلية في كل من إعدادات التعليق والتمسك ، وهي خطوة التحلل ، تليها المراحل المتعاقبة لتنقية التوبولين عن طريق دورات البلمرة والتخلص من البوليمر. تنتج طريقتنا التوبولين الذي يمكن استخدامه في التجارب التي تعالج تأثير رمز التوبولين على الخصائص الجوهرية للميكروبات وتفاعلات microtubule مع البروتينات المرتبطة بها.
Introduction
تلعب الخلايا الدقيقة أدوارا حاسمة في العديد من العمليات الخلوية. أنها تعطي الخلايا شكلها، وبناء المغزل ميوتيك وميتوتيك للفصل الكروموسوم، وبمثابة مسارات للنقل داخل الخلايا. لأداء هذه الوظائف المتنوعة، تنظم البيبات الدقيقة نفسها بطرق مختلفة. أحد الأسئلة المثيرة للاهتمام في هذا المجال هو فهم الآليات الجزيئية التي تسمح للخلايا الدقيقة المحفوظة هيكليا وتطوريا بالتكيف مع هذا العدد الكبير من المنظمات والوظائف. آلية واحدة محتملة هي تنويع microtubules ، والتي يتم تعريفها من خلال المفهوم المعروف باسم "رمز توبولين"1،2،3. يتضمن رمز توبولين عنصرين رئيسيين: الدمج التفاضلي للمنتجات الجينية α β-توبولين (أنواع توبولين) في الأنابيب الدقيقة وتعديلات ما بعد النقل الأنبوبي (PTMs).
منذ السبعينيات، مهدت تجارب إعادة تشكيل المختبر، إلى جانب تقنيات المجهر الخفيف المتطورة، الطريق لاكتشافات مهمة حول خصائص الميكروبات: عدم الاستقرار الديناميكي4 والمطحنة5،وآلياتها ووظائفها الأخرى6و7و8و9و10و11و12و13و14و15. تقريبا جميع التجارب في المختبر التي أجريت حتى الآن وقد استندت على tubulin تنقيتها من أنسجة المخ باستخدام دورات متكررة من البلمرة وإزالة البوليمر16،17. على الرغم من أن تنقية من أنسجة الدماغ يمنح ميزة الحصول على توبولين عالية الجودة بكميات كبيرة (عادة كميات غرام), عيب واحد مهم هو التغايرية كما tubulin تنقيتها من أنسجة الدماغ هو مزيج من isotypes توبولين مختلفة ويتم إثراء مع العديد من PTMs توبولين. هذا التغايرية يجعل من المستحيل تحديد دور PTM توبولين معينة أو isotype في السيطرة على خصائص microtubule والوظائف. وبالتالي، إنتاج التوبيولين التجميع المختصة مع PTMs توبولين الخاضعة للرقابة وتكوين isotype متجانسة أمر ضروري لمعالجة الآليات الجزيئية للرمز توبولين.
في الآونة الأخيرة ، تم تطوير نهج لتنقية التوبولين عن طريق الكروماتوغرافيا تقارب باستخدام TOG microtubule ملزمة (الجينات المفرطة في التعبير عن الورم) مجال الخميرة Stu2p18. في هذه الطريقة ، يتم تمرير التوبولين في اللخص الخام من الخلايا أو الأنسجة من خلال عمود حيث يرتبط بمجال TOG المشلولين بالمصفوفة ، والذي يسمح بتحليل بركة التوبولين بأكملها لعينة معينة ، حتى صغيرة جدا. كما تم وصف نهج طال انتظاره لتنقية التوبولين المؤتلف في السنوات الأخيرة. وهو يقوم على نظام فيروس الباكولو ، حيث يتم التعبير عن ناقل ثنائي ال سيسترونيك يحتوي على جينات α β توبولين في خلايا الحشرات19. ومع ذلك، فإن هذه الطريقة مرهقة جدا وتستغرق وقتا طويلا، وبالتالي تستخدم في الغالب لدراسة تأثير الطفرات التوبولين20 وأنابيب isotypes21،22،23 في المختبر.
في البروتوكول الحالي، ونحن نصف الطريقة التي تستخدم راسخة وتستخدم على نطاق واسع نهج البلمرة-depolymerization كمخطط لتوليد توبولين مع مستويات مختلفة من التعديل إما من خطوط الخلية أو من أنسجة الدماغ الماوس24. في هذا الإجراء، يتم تدوير التوبولين بين القابل للذوبان (أنبوبي ديمر في 4 درجة مئوية) وشكل بلمرة (microtubule في 30 درجة مئوية في وجود جوانوسين 5'-ثلاثي الفوسفات [GTP]). يتم فصل كل نموذج من خلال خطوات متتالية من الطرد المركزي: ستبقى أجهزة الدرنات في النتواة الفائقة بعد دوران بارد (4 درجة مئوية) ، في حين سيتم إعادة الكريات الدقيقة عند 30 درجة مئوية. وعلاوة على ذلك، يتم تنفيذ خطوة واحدة البلمرة في ارتفاع piperazine- N،N′-bis(2-ethanesulfonic حمض) (PIPES) التركيز، والذي يسمح لإزالة البروتينات المرتبطة microtubule من microtubules وبالتالي، من tubulin تنقية أخيرا. Tubulin تنقيتها من خلايا هيلا S3 نمت كما تعليق أو الثقافات المنضمة خالية تقريبا من أي PTM tubulin وقد استخدمت في التجارب الأخيرة في المختبر إعادة تشكيل25,26,27,28. لقد قمنا كذلك بتكييف الطريقة لتنقية التوبولين من أدمغة فأرة واحدة ، والتي يمكن استخدامها لعدد كبير من نماذج الماوس مع تغييرات في أنواع التوبولين وPTMs.
في البروتوكول، ونحن أول وصف جيل من المواد المصدر (كتلة الخلية أو أنسجة الدماغ)، تحلل لها (الشكل 1A)،تليها الخطوات المتتالية من البلمرة توبولين وإزالة البوليمر لتنقية التوبولين (الشكل 1B). ونحن كذلك وصف عملية لتقييمنقاء (الشكل 2A، B)وكمية (الشكل 3A، B) من tubulin المنقى. ويمكن تكييف هذه الطريقة لإنتاج التوبولين المخصب مع PTM مختارة عن طريق الإفراط في التعبير عن انزيم تعديل في الخلايا قبل تنقية التوبولين (الشكل 4B). بدلا من ذلك، يمكن إضافة الإنزيمات المعدلة للتوبولين إلى التوبولين أثناء عملية التطهير. وأخيرا، يمكننا تنقية tubulin تفتقر إلى isotypes محددة أو PTMs من أدمغة الفئران ناقصة في الإنزيمات تعديل tubulin المقابلة (الشكل 4B)29.
الطريقة التي نصفها هنا لها ميزتان رئيسيتان: (1) أنها تسمح بإنتاج كميات كبيرة بما فيه الكفاية من التوبولين في وقت قصير نسبيا ، و (2) تولد توبولين نقي عالي الجودة ، مع تكوين أي نوع توبولين محدد أو PTMs. في الفيديو المصاحب لهذه المخطوطة، نسلط الضوء على بعض الخطوات الحاسمة التي ينطوي عليها هذا الإجراء.
Protocol
وقد أجريت رعاية الحيوانات واستخدامها لهذه الدراسة وفقا لتوصيات الجماعة الأوروبية (2010/63/UE). وقد وافقت لجنة الأخلاقيات التابعة لمعهد كوري CEEA-IC #118 (التفويض رقم 04395.03 الصادر عن السلطة الوطنية) على الإجراءات التجريبية امتثالا للمبادئ التوجيهية الدولية.
1. إعداد الكواشف لتنقية توبولين
ملاحظة: يجب أن تحتوي جميع المخازن المؤقتة المستخدمة لتنقية التوبولين على أملاح البوتاسيوم وليس أملاح الصوديوم30.
- إعداد 1 لتر من المتوسط الكامل: متوسط النسر المعدل في دولبيكو (DMEM)، مع مصل بقري جنيني 10٪ (FBS، 100 مل)، 200 مل L-glutamine (10 مل من مخزون 2 M)، و1x البنسلين-ستريبتوميسين (10 مل من مخزون 100x). يخزن عند درجة حرارة 4 درجات مئوية.
- إعداد هيدروكسيد البوتاسيوم 10 M (KOH) عن طريق حل 140 غرام من KOH في الماء، وضبط الحجم النهائي إلى 250 مل، وتخزينها في درجة حرارة الغرفة.
- إعداد 0.5 M إيثيلينديامين حمض رباعي الأسيتيك (EDTA), درجة الحموضة 8, عن طريق حل 36.5 غرام من EDTA في الماء, ضبط درجة الحموضة إلى 8.0 باستخدام KOH (وإلا EDTA لن تذوب) والحجم النهائي إلى 250 مل, تصفية تعقيم, وتخزينها في درجة حرارة الغرفة.
- إعداد 5 MM الفوسفات العازلة المالحة (PBS)-EDTA بإضافة 5 مل من 0.5 M EDTA إلى 500 مل من برنامج تلفزيوني، تصفية تعقيم، وتخزينها في درجة حرارة الغرفة.
- إعداد 0.5 M K-PIPES، درجة الحموضة 6.8، عن طريق حل 75.5 غرام من الأنابيب في الماء، والتكيف مع درجة الحموضة 6.8 مع KOH (وإلا PIPES لن تذوب) والحجم النهائي إلى 500 مل، تصفية تعقيم، وتخزينها في 4 درجة مئوية.
- إعداد 1 M K-PIPES، درجة الحموضة 6.8، عن طريق حل 15.1 غرام من الأنابيب في الماء، والتكيف مع درجة الحموضة 6.8 مع KOH وحجم النهائي إلى 50 مل، تصفية التعقيم، وتخزينها في 4 درجة مئوية.
- إعداد 0.5 M البوتاسيوم-الإيثيلين غليكول-بيس (β-أمينوثيل الأثير)-N,N,N′,N′-حمض رباعي الأسيتيك (K-EGTA, درجة الحموضة 7.7) عن طريق حل 47.5 غرام من EGTA في الماء, ضبط درجة الحموضة 7.7 مع كوه والحجم النهائي إلى 250 مل, تصفية تعقيم, وتخزينها في درجة حرارة الغرفة.
- إعداد BRB80 (80 MM K-PIPES، درجة الحموضة 6.8؛ 1 MM K-EGTA؛ 1 mM كلوريد المغنيسيوم [MgCl2]) الحل عن طريق خلط 3.2 مل من 0.5 M PIPES، 40 ميكرولتر من 0.5 M K-EGTA، و 20 ميكرولتر من 1 M MgCl2 وضبط الحجم النهائي إلى 20 مل. يخزن عند درجة حرارة 4 درجات مئوية.
- إعداد 0.1 M فينيل ميثانسولفونيل فلوريد (PMSF) عن طريق حل 435 ملغ من PMSF في ايزوبروبانول للحصول على حجم نهائي من 25 مل وتخزينها في -20 درجة مئوية.
- إعداد مثبطات بروتياز مزيج (200x) عن طريق حل 10 ملغ من aprotinin، 10 ملغ من leupeptin، و 10 ملغ من 4-(2-aminoethyl)-البنزينسولفونيل الفلوريد في الماء للحصول على حجم نهائي من 2.5 مل، وجعل الاقتباسات من 100 ميكرولتر، وتخزينها في -20 درجة مئوية.
- إعداد 10٪ تريتون X-100 عن طريق خلط 5 مل من تريتون X-100 في 45 مل من الماء، تصفية التعقيم، وتخزينها في درجة حرارة الغرفة.
- إعداد تحلل العازلة (BRB80 تستكمل مع 1 MM 2-mercaptoethanol, 1 MM PMSF, 1x مثبطات البروتيز مزيج و, اختياريا لخلايا HEK-293, 0.2٪ تريتون X-100) في يوم تنقية التوبولين عن طريق خلط 20 مل من BRB80 مع 1.5 ميكرولتر من 2-ميركابتوثانول، 200 ميكرولتر من 0.1 M PMSF، 100 ميكرولتر من مثبطات البروتيز مزيج و، اختياريا لخلايا HEK-293 ، 400 ميكرولتر من 10٪ تريتون X-100.
ملاحظة: 2-ميركابتوثانول سامة وينبغي استخدامها في غطاء الدخان. - إعداد 0.2 M GTP عن طريق حل 1 غرام من GTP في 9.5 مل من الماء، وضبط درجة الحموضة إلى 7.5 باستخدام كوه، وجعل aliquots من 20 ميكرولتر، وتخزينها في -20 درجة مئوية. تجنب تكرار دورات التجميد والذوبان.
- إعداد 1 M تريس (هيدروكسي ميثيل) أمينوميثان هيدروكلوريد (تريس-HCl) عن طريق حل 60.56 غرام من تريس في الماء، والتكيف مع درجة الحموضة 6.8 مع HCl، كاملة إلى حجم نهائي من 500 مل، تصفية التعقيم، وتخزينها في درجة حرارة الغرفة.
- إعداد 5x Laemmli عينة العازلة (450 mM dithiothreitol (DTT)؛ 10٪ دودسيلسلفات الصوديوم (SDS)؛ 400 ميكرومتر تريس-HCl، درجة الحموضة 6.8; 50٪ الجلسرين; ~ 0.006٪ بروموفينول الأزرق) عن طريق إضافة 4 غرام من SDS إلى 16 مل من مسخن 1 M تريس-HCl, درجة الحموضة 6.8, وخلط الحل بلطف. إضافة 2.6 غرام من DTT و 20 مل من 100٪ الجلسرين إلى المزيج ويحرك حتى يصبح الحل متجانسة. أضف الكمية المطلوبة من بروموفينول الأزرق (2.5 ملغ) للوصول إلى كثافة اللون المطلوبة. جعل 5 مل aliquots وتخزينها في -20 درجة مئوية. إعداد حل العمل 2X من Laemmli عينة العازلة عن طريق تمييع المخزون 5x في الماء المقطر.
2. تضخيم وحصاد مصادر التوبولين
ملاحظة: في هذا البروتوكول، استخدمت ثلاثة مصادر للتبولين: '1' الخلايا (HeLa S3 و HEK-293) التي نمت كثقافات تعليق؛ '2' الخلايا (HeLa S3 و HEK-293) التي نمت كثقافات تعليق؛ '2' الخلايا (HeLa S3 و HEK-293) التي نمت كثقافات تعليق؛ '2' الخلايا (HeLa S3 و HEK-293) التي نمت كث '2' الخلايا التي تنمو كثقافات معتنقة (HEK-293 و HeLa وU2 OS)؛ و (3) أنسجة دماغ الفأر. يعتبر هذا البروتوكول يوم تنقية التوبولين "اليوم 0" وبناء على ذلك ، تم وصف خطوات أخرى بالنسبة لليوم 0.
- تضخيم الخلايا
- الخلايا المزروعة كثقافات تعليق
ملاحظة: لتنقية التوبولين بنجاح من ثقافات التعليق، استخدم على الأقل 2 لتر من ثقافة التعليق.- ل 2 L من ثقافة تعليق, إحياء وتنمو نوع الخلية المفضلة للحصول على 6 × 107 خلايا قبل 10 أيام من يوم التحضير. في اليوم -10، لوحة الخلايا على ستة أطباق قطرها 15 سم في 107 خلايا لكل لوحة.
- في اليوم -8، سخني الكمية المطلوبة من الوسط الكامل إلى 37 درجة مئوية. إضافة 1 لتر من المتوسطة ساخنة مسبقا إلى كل زجاجة الدوار في ظل ظروف معقمة. ضع المغازل على طاولة التحريك المحددة في 20-25 دورة في الدقيقة داخل حاضنة ثقافة الخلية ، وافتح قليلا قبعات الدوار الجانبية للسماح للوسط بالتوازن مع جو الحاضنة.
ملاحظة: لتجنب أي تلوث، تنظيف السطح الخارجي تماما من وسائل الإعلام وزجاجات الدوار باستخدام الإيثانول 70٪. - في اليوم -7، جرب وجمع الخلايا نمت إلى التقاء 80-90٪ (حوالي 1.8 × 108 خلايا). جمع الخلايا من 3 أطباق في وقت واحد، تدور أسفل (200 × غرام،5 دقائق، ودرجة حرارة الغرفة)، وإعادة تعليق جميع الخلايا في 10 مل من DMEM.
ملاحظة: الفصام الشامل للخلايا في هذه المرحلة مهم جدا لتجنب تشكيل مجاميع أكبر في زجاجات الدوار، مما يؤثر على بقاء الخلية ويؤدي إلى انخفاض العائد التوبولين. - إضافة 5 مل من تعليق الخلية إلى كل زجاجة الدوار التي تحتوي على 1 لتر من DMEM، والعودة المغازل إلى طاولة stirrer في حاضنة ثقافة الخلية، والسماح للخلايا تنمو لمدة أسبوع واحد.
- الخلايا المزروعة كثقافات معتنقة
ملاحظة: لتنقية التوبولين بنجاح من الخلايا الملتصقة، استخدم ما لا يقل عن 10 أطباق من التقاء 80-90٪.- إحياء وتضخيم نوع الخلية المطلوبة للحصول على 1 × 108 خلايا قبل ثلاثة أيام من يوم إعداد توبولين.
- في اليوم -3، لوحة هذه الخلايا على عشرة أطباق 15 سم في 1 × 107خلايا لكل طبق والسماح لهم بالنمو التقاء 80-90٪.
- في اليوم -1، إذا لزم الأمر، خلايا العدوى مع البلازميد للتعبير عن إنزيم تعديل توبولين أو ايزوبيل توبولين معينة.
- الخلايا المزروعة كثقافات تعليق
- حصاد الخلايا / أنسجة الدماغ
- الخلايا المزروعة كثقافات تعليق
- نقل تعليق الخلية من المغازل إلى زجاجات الطرد المركزي 1 لتر (جدول المواد) وخلايا بيليه في 250 × غرام، 15 دقيقة ، ودرجة حرارة الغرفة. للبدء فورا ثقافة أخرى من خلايا هيلا S3 في زجاجات الدوار، وترك 100 مل من تعليق الخلية في المغازل، وإضافة 1 لتر من كامل، DMEM ساخنة مسبقا إلى زجاجة الدوار.
ملاحظة: تحقق بعناية من التلوث البكتيري قبل المتابعة لتنقية التوبولين. - Resuspend الكريات الخلايا من كل زجاجة الطرد المركزي في 10 مل من الجليد الباردة برنامج تلفزيوني، ونقل جميع الخلايا إلى أنابيب المسمار كاب 50 مل. أثناء إعادة تعليق، والحفاظ على الخلايا على الجليد. بيليه الخلايا في 250 × غرام، 15 دقيقة ، 4 درجة مئوية.
ملاحظة: اتبع توصيات لتنظيف زجاجة الدوار والتخزين (انظر جدول المواد). - تجاهل supernatant وتحديد حجم بيليه الخلية. من 2 لتر من ثقافة التعليق (زجاجتين الدوار)، نتوقع بيليه خلية من 5-6 مل.
ملاحظة: في البروتوكول الموضح أدناه، يفترض أن يكون حجم بيليه الخلية 10 مل. ضبط التجربة وفقا لأحجام بيليه. - إضافة 1 حجم (10 مل) من العازلة تحلل وإعادة تعليق بيليه الخلية.
ملاحظة: نسبة حجم بيليه الخلية إلى حجم العازلة تحلل مهم جدا لتنقية التوبولين ناجحة. إضافة المزيد من العازلة تحلل يقلل من تركيز التوبولين، الذي فشل بعد ذلك للوصول إلى التركيز الحرج اللازم للبوليمرة، وبالتالي الحد بشكل كبير من العائد توبولين.
ملاحظة: يمكن تجميد الخلايا التي أعيد إنفاقها في حاجز التحلل في النيتروجين السائل وتخزينها عند -80 درجة مئوية لمدة شهرين.
- نقل تعليق الخلية من المغازل إلى زجاجات الطرد المركزي 1 لتر (جدول المواد) وخلايا بيليه في 250 × غرام، 15 دقيقة ، ودرجة حرارة الغرفة. للبدء فورا ثقافة أخرى من خلايا هيلا S3 في زجاجات الدوار، وترك 100 مل من تعليق الخلية في المغازل، وإضافة 1 لتر من كامل، DMEM ساخنة مسبقا إلى زجاجة الدوار.
- الخلايا المزروعة كثقافات معتنقة
ملاحظة: يجب حصاد الخلايا من الثقافات الملتصقة بسرعة كبيرة لتنقية التوبولين الناجحة (حوالي 15 دقيقة لحصاد عشرة أطباق 15 سم). وشارك ثلاثة أشخاص في هذه الخطوة من البروتوكول.- إزالة المتوسطة من أطباق 15 سم عن طريق ميل الأطباق، ومن ثم غسل الخلايا بلطف مع 7 مل من PBS-EDTA في درجة حرارة الغرفة (الشخص 1). العمل فقط مع ثلاثة أطباق 15 سم في وقت واحد لتجنب ترك الخلايا دون المتوسطة أو العازلة.
- إضافة 5 مل من PBS-EDTA إلى الخلايا واحتضانها لمدة 5 دقائق في درجة حرارة الغرفة.
- استخدام رافع الخلية لفصل بلطف الخلايا عن طريق جرف لهم إلى حافة واحدة من الطبق (الشخص 2)، وجمع جميع الخلايا في أنبوب المسمار كاب 50 مل (الشخص 3). شطف كل لوحة مع 2 مل إضافية من PBS-EDTA لجمع أي خلايا المتبقية من الأطباق. خلال هذه الخطوة، والحفاظ على أنبوب المسمار كاب 50 مل التي تحتوي على تعليق الخلية على الجليد.
- بيليه الخلايا في 250 × غرام، 10 دقيقة ، 4 درجة مئوية. تجاهل supernatant وتحديد حجم بيليه الخلية. نتوقع حجم ~ 1 مل من عشرة أطباق 15 سم.
ملاحظة: في البروتوكول الموضح أدناه، يفترض أن يكون حجم بيليه الخلية 10 مل. ضبط التجارب وفقا لأحجام بيليه. - Resuspend الخلايا في 1 حجم (10 مل) من تحلل العازلة.
ملاحظة: يمكن تخزين الخلايا التي أعيد إنفاقها في المخزن المؤقت للتحلل عند -80 درجة مئوية لمدة تصل إلى شهرين.
- أنسجة المخ
ملاحظة: يمكن استخدام الفئران من أي عمر أو جنس أو خلفية وراثية. وسيتوقف اختيار سلالة الفأر المعدلة وراثيا على المسألة العلمية التي يتعين معالجتها. في هذه المخطوطة، نعرض مثال توبولين تنقيتها من ttll1-/- الماوس، تفتقر إلى إنزيم الجلوتاميلات الدماغ الرئيسية، وتوبولين التيروزين ليغانيس مثل 1 (TTLL1) البروتين31.- التضحية الماوس عن طريق خلع عنق الرحم، وقطع رأس بسرعة، وجمع الدماغ في أنبوب الجولة القاع. إذا كان هناك فائض في الدم على الدماغ، ويغسل بسرعة مع العازلة تحلل. جمع الدماغ بمجرد التضحية الماوس كما تأخير ما بعد الوفاة يمكن أن تؤثر على نجاح تنقية التوبولين. استخدم أنابيب مستديرة القاع لاستيعاب عرض المسبار المستخدم للتجانس.
ملاحظة: يمكن تجميع أدمغة الفئران المفاجئة المجمدة في النيتروجين السائل وتخزينها في -80 درجة مئوية لمدة تصل إلى 3 سنوات. - أضف 500 ميكرولتر من حاجز التحلل إلى دماغ واحد مستخرج من فأر بالغ. بالنسبة لبقية البروتوكول، يفترض أن يكون حجم المخزن المؤقت تحلل المضافة 10 مل. ضبط لتجربتك وفقا لعدد من العقول لاستخدامها.
- التضحية الماوس عن طريق خلع عنق الرحم، وقطع رأس بسرعة، وجمع الدماغ في أنبوب الجولة القاع. إذا كان هناك فائض في الدم على الدماغ، ويغسل بسرعة مع العازلة تحلل. جمع الدماغ بمجرد التضحية الماوس كما تأخير ما بعد الوفاة يمكن أن تؤثر على نجاح تنقية التوبولين. استخدم أنابيب مستديرة القاع لاستيعاب عرض المسبار المستخدم للتجانس.
- الخلايا المزروعة كثقافات تعليق
3. تحلل الخلايا أو أنسجة الدماغ
- الخلايا المزروعة كثقافات تعليق
- ل HEK-293، lyse الخلايا على الجليد عن طريق الأنابيب بشكل متكرر صعودا وهبوطا باستخدام نصائح ماصة من عروض مختلفة. أولا، نعلق تلميح p1000 إلى ماصة 10 مل، وماصة تعليق الخلية صعودا وهبوطا كل 5 دقائق، لمدة 10 دقيقة (ثلاث دورات من pipetting). ثانيا، إرفاق تلميح P200 إلى طرف p1000 والمزيد من ماصة كل 5 دقائق، لمدة 20 دقيقة (خمس دورات من pipetting).
- للحصول على HeLa S3، ازل الخلايا باستخدام الصحافة الفرنسية (راجع جدول المواد للإعدادات).
- خذ 1/100وحدة تخزين من مزيج التحلل (L) (200 ميكرولتر ل 20 مل من L)، وأضف نفس الحجم من المخزن المؤقت 2x Laemmli، يغلي لمدة 5 دقائق، ويخزن عند -20 درجة مئوية لمزيد من التحليل.
- الخلايا المزروعة كثقافات معتنقة
- نقل الخلايا إلى أنبوب 14 مل ذهابا وإيابا الذي تم تخفيض ارتفاع لاستيعاب التحقيق sonicator (انظر جدول المواد للإعدادات). Sonicate الخلايا ل~ 45 نبضات، وتأكيد تحلل الخلية عن طريق أخذ عينات قطرة من مزيج تحلل تحت المجهر.
ملاحظة: يمكن أن يختلف عدد البقول وفقا لنوع الخلية المستخدمة لتنقية التوبولين. سونيكاتينغ الخلايا أكثر من اللازم يمكن أن يسبب توبولين لتسريع وسوف تؤثر سلبا على غلة تنقية. - ماصة الخلايا صعودا وهبوطا على الجليد كل 5 دقائق لمدة 20 دقيقة (خمس دورات من pipetting)، وذلك باستخدام تلميح p200.
- خذ 1/100th حجم مزيج التحلل (L) (200 ميكرولتر ل20 مل من L) وإضافة نفس الحجم من العازلة Laemmli 2x، يغلي لمدة 5 دقائق وتخزينها في -20 درجة مئوية لمزيد من التحليل.
- نقل الخلايا إلى أنبوب 14 مل ذهابا وإيابا الذي تم تخفيض ارتفاع لاستيعاب التحقيق sonicator (انظر جدول المواد للإعدادات). Sonicate الخلايا ل~ 45 نبضات، وتأكيد تحلل الخلية عن طريق أخذ عينات قطرة من مزيج تحلل تحت المجهر.
-
أنسجة المخ
- Lyse أنسجة الدماغ باستخدام خلاط الأنسجة (انظر جدول المواد للإعدادات). بدلا من ذلك، lyse الأنسجة باستخدام الحشرات microtube أو ما يعادلها من المعدات وماصة صعودا وهبوطا على الجليد مع حقنة 1 مل مع إبرة 18G.
- خذ 1/100th حجم مزيج التحلل (L) (200 ميكرولتر ل20 مل من L)، وإضافة نفس الحجم من العازلة Laemmli 2x، يغلي لمدة 5 دقائق، وتخزينها في -20 درجة مئوية لمزيد من التحليل.
4. تنقية توبولين
- توضيح Lysate
- مسح التحلل (فصل بيليه وجزء قابل للذوبان من مزيج تحلل) عن طريق الطرد المركزي في 150،000 × غرام، 4 درجة مئوية ، 30 دقيقة. انظر جدول المواد للحصول على تفاصيل حول الدوارات والأنابيب فائقة المركزية. بالنسبة لمستخلصات الخلايا، غالبا ما تتشكل طبقة عائمة بيضاء بعد الطرد المركزي. لا نقل هذه الطبقة العائمة جنبا إلى جنب مع supernatant، كما أنه يتداخل مع بلمرة التوبولين. استخدام حقنة من حجم المناسبة تعلق على إبرة طويلة 20 G أو 21 G لإزالة بلطف supernatant دون إزعاج الطبقة العائمة. إذا كان الفائق لا يزال غائما ، فإن جهاز الطرد المركزي عند 5000 × غرام، 4 درجات مئوية لمدة 10 دقائق.
- نقل supernatant (SN1) إلى أنبوب الطرد المركزي للغاية ونلاحظ حجمه. لبيليه الخلية 10 مل، نتوقع حجم ~ 12 مل لSN1.
- خذ 1/100وحدة تخزين SN1 (120 ميكرولتر ل 12 مل من SN1)، وأضف نفس الحجم من العازلة Laemmli 2x، يغلي لمدة 5 دقائق، وتخزينها في -20 درجة مئوية لمزيد من التحليل.
- Resuspend بيليه (P1) في BRB80(جدول المواد)باستخدام نفس حجم SN1. خذ 1/100th حجم P1 (200 ميكرولتر ل20 مل من P1)، وإضافة نفس الحجم من العازلة Laemmli 2x، يغلي لمدة 5 دقائق، وتخزينها في -20 درجة مئوية لمزيد من التحليل.
- البلمرة الأولى في العازلة منخفضة المولاريتي
- إعداد مزيج البلمرة عن طريق الجمع بين 1 حجم SN1 (12 مل), 1/200حجم th من 0.2 M GTP (60 ميكرولتر; التركيز النهائي 1 mM), و 0.5 حجم الجلسرين قبل تسخينها (6 مل) في أنبوب المسمار كاب من حجم المناسبة.
ملاحظة: يستخدم الجلسرين كعامل الازدحام في خطوات البلمرة في جميع أنحاء البروتوكول، وبالتالي لا يعتبر في حسابات تركيزات المكونات الأخرى. - ماصة المزيج صعودا وهبوطا، وتجنب بلطف تشكيل فقاعات الهواء ونقله إلى أنابيب الطرد الفائق المناسبة.
ملاحظة: أثناء نقل المزيج إلى الأنابيب، قم بضبط وزن الأنابيب (بالأزواج). وهذا يسمح للمجرب للمضي قدما مباشرة إلى ترسيب microtubules بعد خطوة البلمرة. القيام بذلك لجميع خطوات البلمرة في جميع أنحاء البروتوكول. - تغطية الأنابيب مع parafilm، ونقل إلى حمام مائي تعيين في 30 درجة مئوية، واحتضان لمدة 20 دقيقة.
- طرد الأنابيب في 150،000 × غرام، 30 درجة مئوية لمدة 30 دقيقة. إزالة supernatant (SN2) ، والحفاظ على بيليه من microtubules البوليمرات (P2).
ملاحظة: يمكن أن تكون مصغرة بيليه المفاجئة المجمدة وتخزينها في -80 درجة مئوية لمدة تصل إلى 1 سنة. - خذ 1/200th حجم SN2 (90 ميكرولتر ل18 مل SN2) وإضافة نفس الحجم من العازلة Laemmli 2x، يغلي لمدة 5 دقائق، وتخزينها في -20 درجة مئوية لمزيد من التحليل.
- إعداد مزيج البلمرة عن طريق الجمع بين 1 حجم SN1 (12 مل), 1/200حجم th من 0.2 M GTP (60 ميكرولتر; التركيز النهائي 1 mM), و 0.5 حجم الجلسرين قبل تسخينها (6 مل) في أنبوب المسمار كاب من حجم المناسبة.
- أول إزالة للبوميرة
- Depolymerize microtubules بإضافة BRB80 الجليد الباردة إلى بيليه P2، وترك على الجليد لمدة 5 دقائق: لtupoulin من الخلايا، إضافة 1/60th (200 ميكرولتر)، وللتوبولين من العقول، إضافة 1/20th (600 ميكروغرام) من حجم SN1.
ملاحظة: حجم BRB80 الجليد الباردة تضاف إلى بيليه خلال خطوات إزالة البلمرة هو دائما بالنسبة لحجم SN1. - Resuspend بيليه microtubule بلطف، وتجنب فقاعات الهواء، حتى الحل هو متجانسة تماما. استخدام تلميح p1000 لبضع دورات من pipetting تليها تلميح P200 كل 5 دقائق، لمدة 20 دقيقة (خمس دورات من pipetting). هذه خطوة حاسمة لنجاح تنقية التوبولين.
- نقل الحل إلى أنابيب الطرد المركزي المناسبة، وتدور إلى أسفل في 150،000 × غرام،4 درجة مئوية لمدة 20 دقيقة. نقل SN3 إلى أنبوب جديد 1.5 مل من أجهزة الطرد المركزي الفائق. بيليه تشكلت بعد هذه الخطوة الطرد المركزي (P3) يحتوي على البروتينات المعجلة (البروتينات المرتبطة microtubule أو MAPs) والميكروبات غير المعالجة. وsupernatant (SN3) يحتوي على مكونات قابلة للذوبان: ديبوليمرد الدرنات وMAPs, التي انفصلت عن microtubules depolymerized.
- خذ 1-4 ميكرولتر من SN3، وأضف 9 مجلدات من 2x Laemmli العازلة، يغلي لمدة 5 دقائق، وتخزينها في -20 درجة مئوية لمزيد من التحليلات.
- Resuspend بيليه P3 في BRB80 (في نفس حجم SN3)، واتخاذ 1-4 ميكرولتر، وإضافة 9 وحدات تخزين من العازلة Laemmli 2x، يغلي لمدة 5 دقائق، وتخزينها في -20 درجة مئوية.
- Depolymerize microtubules بإضافة BRB80 الجليد الباردة إلى بيليه P2، وترك على الجليد لمدة 5 دقائق: لtupoulin من الخلايا، إضافة 1/60th (200 ميكرولتر)، وللتوبولين من العقول، إضافة 1/20th (600 ميكروغرام) من حجم SN1.
- البلمرة الثانية (في العازلة عالية المولاريتي)
- إعداد مزيج البلمرة عن طريق الجمع بين 1 حجم SN3 (200 ميكرولتر)، 1 حجم أنابيب 1 M ساخنة مسبقا (200 ميكرولتر، التركيز النهائي 0.5 M), 1/100th حجم 0.2 M GTP (2 ميكرولتر, التركيز النهائي 1 mM), و 1 حجم من الجلسرين قبل تسخينها (200 ميكرولتر) في أنبوب من الحجم المناسب.
- ماصة المزيج صعودا وهبوطا، وتجنب تشكيل فقاعات الهواء، ونقله إلى أنابيب الطرد المركزي للغاية.
- تغطية الأنابيب مع parafilm، ونقلها إلى حمام مائي تعيين في 30 درجة مئوية، واحتضان لمدة 20 دقيقة.
- أجهزة الطرد المركزي أنابيب في 150،000 × غرام، 30 درجة مئوية لمدة 30 دقيقة. إزالة supernatant (SN4) ، والحفاظ على بيليه من microtubules البوليمر (P4). بيليه P4 يحتوي على microtubules البوليمرات، وSN4 فائقة يحتوي على توبولين البكر، MAPs، وغيرها من البروتينات القابلة للذوبان.
ملاحظة: يمكن أن تكون بيليه microtubule بعد الخطوة الثانية البلمرة المفاجئة المجمدة وتخزينها في -80 درجة مئوية لمدة تصل إلى 1 سنة. - خذ 1-4 ميكرولتر وأضف 9 مجلدات من 2x Laemmli العازلة، يغلي لمدة 5 دقائق، وتخزينها في -20 درجة مئوية لمزيد من التحليلات.
- إزالة الطابع الثاني
- depolymerize microtubules عن طريق إضافة BRB80 الجليد الباردة إلى بيليه P4، وترك على الجليد لمدة 5 دقائق: لtupoulin من الخلايا، إضافة 1/100th (120 ميكرولتر)، وللتوبولين من العقول، إضافة 1/40th (300 ميكروغرام) من حجم SN1.
- ماصة صعودا وهبوطا مع تلميح p200 كل 5 دقائق، لمدة 20 دقيقة (خمس دورات من pipetting).
- نقل الحل إلى أنبوب 1.5 مل فائقة المركزية، وتدور أسفل في 150،000 × غرام،4 درجة مئوية لمدة 20 دقيقة. نقل SN5 إلى أنبوب جديد 1.5 مل من أجهزة الطرد المركزي الفائق. بيليه تشكلت بعد هذه الخطوة الطرد المركزي (P5) يحتوي على microtubules غير مزيل للبوهر. وsupernatant (SN5) يحتوي على أنبوبي قابل للذوبان.
- خذ 1-4 ميكرولتر وأضف 9 مجلدات من 2x Laemmli العازلة، يغلي لمدة 5 دقائق، وتخزينها في -20 درجة مئوية لمزيد من التحليلات.
- Resuspend بيليه P5 في BRB80 (نفس حجم SN5)، واتخاذ 1-4 ميكرولتر، وإضافة 9 مجلدات من العازلة Laemmli 2x، يغلي لمدة 5 دقائق، وتخزينها في -20 درجة مئوية لمزيد من التحليلات.
- البلمرة الثالثة (في المخزن المؤقت منخفض المولاري)
- إعداد مزيج البلمرة: 1 حجم SN5 (120 ميكرولتر)، 1/200حجم 0.2 M GTP (0.6 ميكرولتر، التركيز النهائي هو 1 mM)، و 0.5 حجم الجلسرين قبل تسخينها (60 ميكرولتر) في أنبوب من الحجم المناسب.
- ماصة المزيج صعودا وهبوطا، وتجنب بلطف تشكيل فقاعات الهواء، ونقله إلى أنابيب الطرد الفائق المناسبة.
- تغطية الأنابيب مع parafilm، ونقلها إلى حمام مائي تعيين في 30 درجة مئوية، واحتضان لمدة 20 دقيقة.
- أجهزة الطرد المركزي أنابيب في 150،000 × غرام، 30 درجة مئوية لمدة 30 دقيقة. بيليه (P6) يحتوي على microtubules البوليمرات وSN6 فائقة يحتوي على كميات صغيرة من التوبولين غير البوليمرية.
ملاحظة: يمكن أن تكون الكريات Microtubule المفاجئة المجمدة وتخزينها في -80 درجة مئوية لمدة تصل إلى 1 سنة. - خذ 1-4 ميكرولتر وأضف 9 مجلدات من 2x Laemmli العازلة، يغلي لمدة 5 دقائق، وتخزينها في -20 درجة مئوية لمزيد من التحليلات.
- إزالة الطابع الثالث
- depolymerize microtubules عن طريق إضافة BRB80 الجليد الباردة إلى بيليه P6، وترك على الجليد لمدة 5 دقائق: لtupoulin من الخلايا، إضافة 1/100th (120 ميكرولتر)، وبالنسبة للتوبولين من العقول، إضافة 1/40th (300 μL) من حجم SN1.
- ماصة صعودا وهبوطا مع تلميح p200 كل 5 دقائق، لمدة 20 دقيقة (خمس دورات من pipetting).
- نقل الحل إلى أنابيب الطرد المركزي فائقة المناسبة، وتدور أسفل في 150،000 × غرام،4 درجة مئوية لمدة 20 دقيقة. نقل SN7 إلى أنبوب جديد 1.5 مل من أجهزة الطرد المركزي الفائق. بيليه (P7) يحتوي على كميات صغيرة من microtubules غير depolymerized. وsupernatant (SN7) يحتوي على microtubules depolymerized حصرا (أنبوبي قابل للذوبان).
- خذ 1-4 ميكرولتر وأضف 9 مجلدات من 2x Laemmli العازلة، يغلي لمدة 5 دقائق، وتخزينها في -20 درجة مئوية لمزيد من التحليلات.
- Resuspend بيليه P7 في BRB80 (نفس حجم SN7)، واتخاذ 1-4 ميكرولتر، وإضافة 9 مجلدات من العازلة Laemmli 2x، يغلي لمدة 5 دقائق، وتخزينها في -20 درجة مئوية لمزيد من التحليلات.
- تحديد كمية التوبولين (انظر النتائج التمثيلية)وaliquot SN7 في أحجام صغيرة، المفاجئة تجميد، وتخزينها في -80 درجة مئوية.
النتائج
الهدف الرئيسي من هذه الطريقة هو إنتاج عالية الجودة، والتوبيولين الجمعية المختصة بكميات كافية لإجراء التجارب المتكررة في المختبر مع المكونات المنقى. ويمكن استخدام Microtubules تجميعها من هذا tubulin في إعادة تشكيل المقايسات على أساس الانعكاس الداخلي الكلي fluorescence (TIRF) تقنية المجهر مع microtubules إما ديناميكية أو مستقرة، في تجارب اختبار ديناميات microtubule، والتفاعلات مع MAPs أو المحركات الجزيئية، وتوليد القوة من قبل المحركات25. ويمكن أيضا أن تستخدم في microtubule-MAP شارك بيليه المقايسات والصلبة الدولة NMR الطيف28.
ويمكن رصد إثراء ونقاء التوبولين طوال عملية تنقية باستخدام هلام هلام SDS-polyacrylamide (PAGE) الملطخ بكوماسي ، ويفضل أن يكون جل SDS-PAGE "TUB" ، الذي يسمح بفصل α β - tubulins ، والتي تشارك في الهجرة كفرقة واحدة في المواد الهلامية الكلاسيكية32. يتم تحميل Lysates التي تم جمعها في خطوات مختلفة (باستثناء إزالة الشعر الأخير ، انظر البروتوكول) على الجل بكميات مماثلة لتقييم نجاح تنقية التوبولين (الشكل 2A)24. يتم تحميل عينة التوبولين النهائية ، وهي ثمينة جدا ، فقط على الجل لتحديد تركيز التوبولين. فمن الطبيعي أن تفقد بعض التوبولين في عملية دورات متكررة من البلمرة وإزالة البوليمر. يمكن أن يكون العائد أقل من المتوقع من التوبولين النقي النهائي بسبب إما (1) إزالة البقع غير الكاملة من الأنابيب الدقيقة ، تصور من خلال وجود كمية هامة من التوبولين في كسور P3, P5, و P7, أو (2) بلمرة توبولين غير فعالة في microtubules, وفي هذه الحالة كمية أقل من التوبولين موجود في كسور P2, P4, و P6 وأعلى في كسور SN2, SN4, و SN6 (الشكل 2B). إذا فقدت التوبولين أثناء خطوات البلمرة (كميات أقل من P2 و P4) (1) ضمان تركيز التوبولين كافية أثناء البلمرة (2) استخدام aliquot جديدة من GTP، و / أو (3) إعادة تأكيد درجة حرارة تفاعل البلمرة. إذا تم فقدان التوبولين أثناء خطوات إزالة البلمرة (كميات أقل من SN3 و SN5) ، قم بزيادة الوقت وكذلك ماصة المزيج على الجليد.
من أجل تحديد كمية التوبولين المنقى، قم بتشغيل العينات جنبا إلى جنب مع الكميات المعروفة من ألبوم مصل البقر (BSA، 0.5 ميكروغرام - 1 ميكروغرام - 2 ميكروغرام - 4 ميكروغرام) (الشكل 3A) على SDS-PAGE. وتلطخ المواد الهلامية مع Coomassie الأزرق الرائعة، الممسوحة ضوئيا، ويتم قياس كثافة BSA والعصابات tubulin من قبل قياس الكثافة الكمية(الشكل 3B)كما هو موضح في https://openwetware.org/wiki/Protein_Quantification_Using_ImageJ. يرجى ملاحظة أن نفس التحليل يمكن القيام به في فيجي، نسخة مطورة من ImageJ33. استخدمت القيم من نطاقات BSA لتحديد معادلة الانحدار الخطي ، والتي تم استخدامها لحساب كمية البروتين في نطاقات التوبولين. وتستخدم فقط كثافة الفرقة توبولين ضمن نطاق منحنى BSA لتحديد تركيز التوبولين. استنادا إلى تركيز التوبولين المحسوب ، يتم إعداد الاقتباسات من الكميات المطلوبة من التوبولين ، والمفاجئة المجمدة في النيتروجين السائل ، وتخزينها عند -80 درجة مئوية. نحصل عادة على حوالي ~ 2 ملغ من التوبولين من أربع زجاجات الدوار من الثقافات تعليق هيلا S3 (~ 15 غرام من الخلايا)، ~ 250 ميكروغرام من التوبولين من عشرة أطباق قطرها 15 سم (~ 1.2 غرام من الخلايا)، و ~ 1 ملغ من توبولين من 1 غرام من أنسجة الدماغ الماوس.
لتأكيد إثراء نوع معين من التوبولين أو التعديل ، يمكن أن يكون ~ 0.1 ميكروغرام من التوبولين المنقى مناعيا باستخدام أجسام مضادة ذات الصلة34،35. فإن أنبوبولين السيطرة تختلف تبعا لتوبولين من الفائدة. بالنسبة إلى التوبولين المعدل في المختبر باستخدام إنزيم معدل، استخدم التوبولين غير المعالج كتحكم. لتوبولين تعديل في cellulo عن طريق الإفراط في التعبير عن انزيم تعديل, استخدام tubulin تنقيتها من الخلايا التي لا تعبر عن الانزيم والسيطرة (الشكل 4A). السيطرة tubulin لتوبولين تنقيتها من العقول خروج المغلوب الماوس سيكون توبولين من الفئران نوع البرية (الشكل 4B). في جميع التحليلات المناعية، يتم التحقق من حمولة متساوية من التوبولين باستخدام الأجسام المضادة α-توبولين المستقلة PTM (12G10).
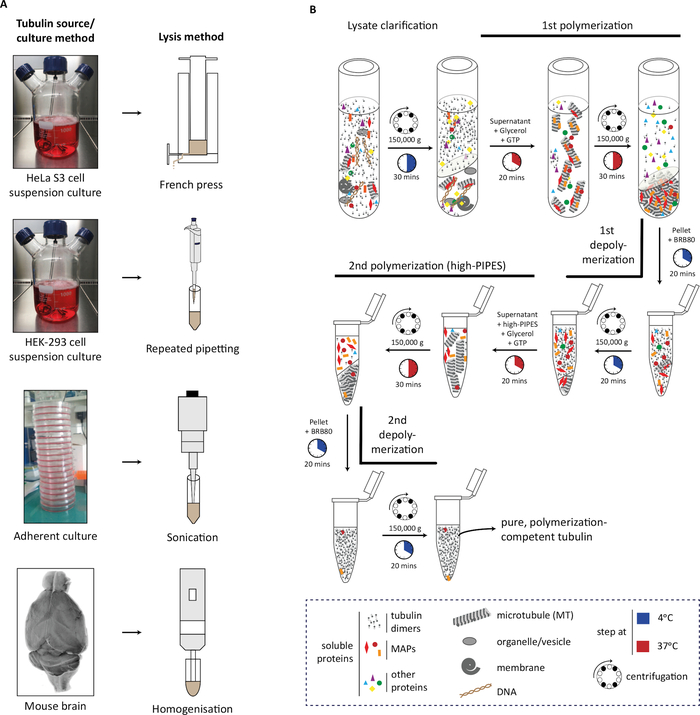
الشكل 1: تنقية التوبولين من مصادر مختلفة باستخدام دورات البلمرة والتخلص من البوليمرات. (أ)يتم lysed مصادر مختلفة من التوبولين باستخدام استراتيجيات محددة. يتم lysed خلايا HeLa S3 المستزرعة في التعليق باستخدام الصحافة الفرنسية. يتم lysed خلايا HEK-293 بواسطة pipetting المتكررة. تم مسح الخلايا الملتصقة باستخدام نبضات قصيرة من سونيكيشن وأنسجة دماغ الماوس باستخدام متجانس الأنسجة. (ب)التمثيل التخطيطي للخطوات المتتالية لبروتوكول تنقية التوبولين باستخدام دورات من إزالة البوليمر البارد والبوليمرة الدافئة. بعد توضيح التحلل والتحلل ، يتم بلمرة microtubules والكريات. ثم يتم إزالة البوليمرات الدقيقة والسماح لها بعد ذلك بالبوليمرات في حاجز عالي الضرس ، مما يمنع الترسيب المشترك للبروتين المرتبط بالميكروتبول (MAP) مع البروتينات الدقيقة. ثم يتم إزالة البوليمرات الدقيقة الخالية من MAP ويمكن إخضاعها لدورة ثالثة من البلمرة لإزالة البوليمر لإزالة كميات ضئيلة من العازلة عالية الضرس. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تقييم نجاح تنقية التوبولين. تم تشغيل العينات التي تم جمعها على خطوات مختلفة من بروتوكول تنقية التوبولين على هلام "TUB" دودسيلسولفات الصوديوم -polyacrylamide هلام electrophoresis (SDS-PAGE) (انظر البروتوكول للحصول على التفاصيل) وملطخة باللون الأزرق اللامع Coomassie. (أ)في تنقية التوبولين الناجحة، يتم إثراء α β-tubulins تدريجيا طوال العملية. بعد البلمرة الثانية ، فإن بيليه microtubule (P4) خالية تقريبا من التلوث من البروتينات الأخرى أو البروتينات المرتبطة بالميكروتبول (MAPs). لاحظ أنه من الطبيعي أن تفقد بعض التوبولين أثناء العملية. (ب)في تنقية التوبولين غير ناجحة، والغلة tubulin النهائي منخفضة، ويبقى التوبولين إما في بيليه بعد depolymerization أو في supernatant بعد البلمرة (صناديق حمراء). في المثال المبين هنا، لم توبولين البلمرة بكفاءة في كل من خطوات البلمرة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تحديد كمي من التوبولين المنقى باستخدام المواد الهلامية دودسيلسلفات الصوديوم الملون بالكوماسي بولياكريلاميد هلام الكهربائي (SDS-PAGE) وقياس الكثافة. (أ)هلام SDS-PAGE الملطخ بكوماسي مع كميات معروفة من ألبوم مصل البقر (BSA؛ 0.5 و 1 و 2 و 4 ميكروغرام، خط تدرج رمادي) وأحجام مختلفة (0.5 و 1 ميكرولتر، ألوان فاتحة ومظلمة، على التوالي) من التوبولين النقي. في المثال المبين، تم تحميل أنبوبولين التيروزينات (HeLa S3 tubulin، البرتقالي الفاتح والداكن) والتوبيولين المفكك (HeLa S3 tubulin المعالج بالكاربوكسيببتيداز A، الأزرق الفاتح والمظلم) على الجل. (ب)تم قياس نطاقات BSA من (A) باستخدام ImageJ (في وحدات عشوائية ، الاتحاد الافريقي) ورسمت ضد كمية البروتين المحملة (الرمادي إلى الأسود). وقد استخدمت هذه النقاط لحساب خط الانحدار الخطي (خط التدرج الرمادي) والمعادلة، والتي استخدمت لحساب كميات البروتين في عينات توبولين (الضوء والبرتقال الداكن والنقاط الزرقاء) المحملة على الجل. هذا سهل حساب تركيز عينات التوبولين. لاحظ أنه لا ينبغي استخدام النقاط التي تقع خارج منحنى BSA القياسي لتحديد التركيز (النقاط البرتقالية والزرقاء الداكنة). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
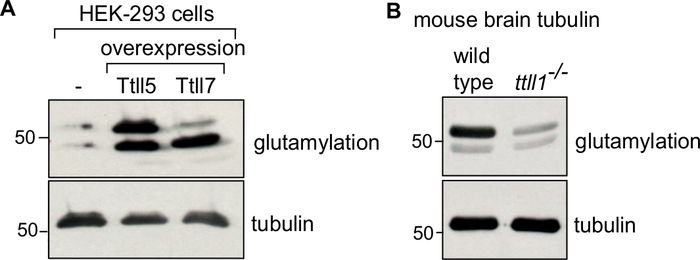
الشكل 4: تحليل مناعة التوبولين المنقى مع PTMs مختلفة. (أ)تم تحليل التوبولينات النقية من خلايا HEK-293: نوع البرية، أو الخلايا التي تفرط في التعبير TTLL5 أو TTLL7 لإثراء محدد من تعدد الغلوتين باستخدام الأجسام المضادة GT335. في حين أن التعبير المفرط TTLL5 يزيد من تعدد الغلوتاميل على α- β-توبولين, TTLL7 الإفراط في التعبير يثري على وجه التحديد β-توبولين الجلوتاميل. (ب)توبولين تنقيتها من أنسجة المخ من نوع البرية وttll1-/- الفئران تم تحليلها لأنماط الجلوتاميل. لاحظ الانخفاض القوي في تعدد الغلوتين من التوبولين من ttll1-/- الفئران، والتي تفتقر إلى الجلوتاميلاز الدماغ الرئيسية TTLL136. تم استخدام المواد الهلامية "TUB" لفصل α β-tubulin. تم تأكيد كمية متساوية من حمولة التوبولين من قبل 12G10 ، وهو مضاد α التوبولين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
الطريقة الموصوفة هنا يوفر منصة لتوليد بسرعة عالية الجودة، والتوبيولين التجميع المختصة بكميات متوسطة كبيرة من خطوط الخلية وأدمغة الماوس واحد. وهو يقوم على بروتوكول الذهب القياسية لتنقية التوبولين من العقول البقرية المستخدمة في هذا المجال لسنوات عديدة16،17. وتتمثل إحدى المزايا الخاصة لهذا النهج في استخدام ثقافات التعليق لخلايا HeLa S3، التي تنتج، بمجرد إنشائها، كميات كبيرة من الخلايا بينما تتطلب القليل من التدريب العملي في الوقت المحدد. وهذا يجعل البروتوكول من السهل نسبيا لأداء في أي مختبر بيولوجيا الخلية، في حين أن أساليب تنقية التوبولين الأخرى18،19،32،37 تتطلب معدات وخبرات محددة ، وبالتالي تستخدم في الغالب من قبل المختبرات ذات الخلفية القوية في تنقية البروتين. عند إنتاج كميات أصغر من التوبولين من خطوط الخلايا الملتصقة ، يمكن استخدام مجموعة متنوعة من خطوط الخلايا. لقد نجحنا في تنقية التوبولين من خلايا HeLa وU-2 OS و HEK-293. إذا كانت هناك حاجة إلى تنقية على نطاق أوسع ، يمكن تجميد الخلايا أو الأدمغة المحصودة في حاجز التحلل وتخزينها عند -80 درجة مئوية ، ويمكن تجميع الكريات أو الأدمغة المتعددة للخلايا معا لتنقية كميات أكبر من التوبولين.
Tubulin تنقيتها من خطوط الخلية خالية تقريبا من PTMs التوبولين. هذا Tyr-tubulin يمكن بسهولة تحويلها إلى أنبوبين detyrosinated (deTyr-) في خطوة واحدة مباشرة25. لإنتاج التوبولين مع PTMs الأخرى، يمكن التعبير عن إنزيمات محددة لتعديل التوبولين في الخلايا قبل تنقية التوبولين. وعلاوة على ذلك، فإن استخدام خطوط الخلايا ذات الأصل البشري كمصدر للمواد يساعد على تجنب القضايا المحتملة بين الأنواع عند دراسة التفاعلات بين الخلايا الدقيقة و MAPs البشرية. علاوة على ذلك ، يمكن أن يوفر التوبولين من الخلايا غير المحولة (مثل HEK293) أو الخلايا المتحولة (مثل HeLa) معلومات حول آثار الأدوية الموجهة بالميكروتوبيولي (مثل الضرائب) على الخلايا الدقيقة العادية مقابل الخلايا السرطانية.
وأخيرا، بروتوكولنا يسهل تنقية التوبولين من أدمغة فأرة واحدة. كما يتم إنشاء عدد متزايد من نماذج الماوس من الطفرات التوبولين والتعديلات، وهذا البروتوكول يسمح التحليل المباشر لخصائص وتفاعلات microtubules مع تكوين ايزوتيب توبولين تغيير38،39،40 أو توبولين PTMs31،41.
ويستند هذا النهج على دورات من البلمرة وإزالة البلمرة. وبالتالي، يمكن أن يؤدي isotypes توبولين محددة أو tubulin مع PTMs معينة التي تؤثر على التجميع وخصائص التفكيك من microtubules في فقدان غير متناسب أو الحد من أشكال التوبولين هذه أثناء عملية تنقية. ومع ذلك، فقد أظهرنا أن الأنابيب الرئيسية PTMs، مثل أستيل، detyrosination، الجلوتاميل، والجيليسيلييشن، يتم الاحتفاظ بها على microtubules في جميع أنحاء عملية تنقية أنبوبولين24. ومع ذلك ، تجدر الإشارة إلى أنه بالنسبة للتحليلات الكمية لتكوين التوبولين في الخلايا أو الأنسجة ، فإن نهج تنقية التوبولين القائم على عمود TOG هو أكثر ملاءمة لأنه سيسمح بتنقية توبولين مستقلة عن البلمرة وغير متحيزة18. على الرغم من قيوده، يوفر بروتوكولنا ميزة كبيرة في توليد كميات كبيرة من التوبولين عالي الجودة الذي يمكن استخدامه في تجارب إعادة تشكيل المختبر الدقيقة. على وجه الخصوص، فإنه يسهل استخدام أنبوبولين الدماغ PTM الغنية في التجارب الروتينية.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم دعم هذا العمل من قبل ANR-10-IDEX-0001-02، وLabEx Cell'n'Scale ANR-11-LBX-0038 ومعهد التقارب Q-life ANR-17-CONV-0005. ويدعم CJ من قبل معهد كوري، تمنح الوكالة الوطنية الفرنسية للبحوث ANR-12-BSV2-0007 و ANR-17-CE13-0021، ومنحة المعهد الوطني للسرطان (INCA) 2014-PL BIO-11-ICR-1، ومنحة مؤسسة من أجل لا ريشرش الطبية (FRM) DEQ20170336756. يتم دعم MMM من قبل منحة الزهايمر Fondation Vaincre FR-16055p ، ومنحة الزهايمر الفرنسية AAP SM 2019 n°2023. وقد تم دعم JAS من قبل الاتحاد الأوروبي أفق 2020 برنامج البحث والابتكار في إطار اتفاق منحة ماري Skłodowska-كوري رقم 675737، ومنحة FRM FDT201904008210. تم دعم SB من قبل منحة FRM FDT201805005465.
نشكر جميع أعضاء مختبر جانكي، ولا سيما ج. شورون، وكذلك ج. لاكيسيتش (معهد MICALIS، AgroParisTech) وأ. غوتريو (المدرسة البوليتكونيكية) على المساعدة أثناء وضع البروتوكول. نود أن نشكر منشأة الحيوانات في معهد كوري للمساعدة في تربية الفئران والرعاية.
تم الحصول على الأجسام المضادة 12G10، التي وضعها ج. فرانكل و M. نيلسون، من بنك الدراسات التنموية الهجينة وضعت تحت رعاية NICHD وصيانتها من قبل جامعة أيوا.
Materials
| Name | Company | Catalog Number | Comments |
| 1 M MgCl2 | Sigma | #M1028 | |
| 1-L cell culture vessels | Techne F7610 | Used for spinner cultures. Never stir the empty spinner bottles. When spinner bottles are in the cell culture incubator, always keep the lateral valves of spinner bottles slightly open to facilitate the equilibration of media with incubator’s atmosphere. After use, fill the spinner bottles immediately with tap water to avoid drying of remaining cells on the bottle walls. Wash the bottles with deionised water, add app 200 ml of deionised water and autoclave. Under a sterile cell culture hood remove the water and allow the bottles to dry completely, still under the hood, for several hours. Never use detergents for cleaning the spinner bottles because any trace amounts of the detergent can be deleterious to the cells. | |
| 1.5- and 2-ml tubes | |||
| 14-ml round-bottom tubes | |||
| 15-cm-diameter sterile culture dishes | |||
| 15-ml screw-cap tubes | |||
| 2-mercaptoethanol | Sigma | #M3148 | 2-mercaptoethanol is toxic and should be used under the hood. |
| 4-(2-aminoethyl)-benzenesulfonyl fluoride | Sigma | #A8456 | |
| 40% Acrylamide | Bio-Rad | #161-0140 | |
| 5-, 10- 20-ml syringes | |||
| 5-ml, 10-ml, 25-ml sterile pipettes | |||
| 50-ml screw-cap tubes | |||
| Ammonium persulfate (APS) | Sigma | #A3678 | |
| Anti-alpha-tubulin antibody, 12G10 | Developed by J. Frankel and M. Nelson, obtained from the Developmental Studies Hybridoma Bank, developed under the auspices of the NICHD, and maintained by the University of Iowa | dilution: 1/500 | |
| Anti-glutamylated tubulin antibody, GT335 | AdipoGen | #AG-20B-0020 | dilution: 1/20,000 |
| Aprotinin | Sigma | #A1153 | |
| Balance (0.1 – 10 g) | |||
| Beckman 1-l polypropylene bottles | For collecting spinner cultures | ||
| Beckman Avanti J-26 XP centrifuge | For collecting spinner cultures | ||
| Biological stirrer | Techne MCS-104L | Installed in the cell culture incubator (for spinner cultures), 25 rpm for Hela S3 and HEK 293 cells | |
| Bis N,N’-Methylene-Bis-Acrylamide | Bio-Rad | #161-0201 | |
| Blender IKA Ultra-Turrax® | For lysing brain tissue, use 5-mm probe, with the machine set at power 6 or 7. Blend the brain tissue 2-3 times for 15 s on ice. | ||
| Bovine serum albumin (BSA) | Sigma | #A7906 | |
| Bromophenol blue | Sigma | #1.08122 | |
| Carboxypeptidase A (CPA) | Sigma | #C9268 | Concentration: 1.7 U/µl |
| Cell culture hood | |||
| Cell culture incubator set at 37°C, 5% CO2 | |||
| Dimethyl sulfoxide (DMSO) | Sigma | #D8418 | DMSO can enhance cell and skin permeability of other compounds. Avoid contact and use skin and eye protection. |
| DMEM medium | Life Technologies | #41965062 | |
| DTT, DL-Dithiothreitol | Sigma | #D9779 | |
| EDTA | Euromedex | #EU0007-C | |
| EGTA | Sigma | #E3889 | |
| Ethanol absolute | Fisher Chemical | #E/0650DF/15 | |
| Fetal bovine serum (FBS) | Sigma | #F7524 | |
| French pressure cell press | Thermo electron corporation | #FA-078A | with a #FA-032 cell; for lysing big amounts of cells. Set at medium ratio, and the gauge pressure of 1,000 psi (corresponds to 3,000 psi inside the disruption chamber). |
| Glycerol | VWR Chemicals | #24388.295 | |
| Glycine | Sigma | #G8898 | |
| GTP | Sigma | #G8877 | |
| Heating block | Stuart | #SBH130D | |
| Hela cells | ATCC® CCL-2™ | ||
| Hela S3 cells | ATCC | ATCC® CCL-2.2™ | |
| Hydrochloric acid (HCl ) | VWR | #20252.290 | |
| Inverted microscope | With fluorescence if cell transfection is to be verified | ||
| Isopropanol | VWR | #20842.298 | |
| jetPEI | Polyplus | #101 | |
| JLA-8.1000 rotor | For collecting spinner cultures | ||
| KOH | Sigma | #P1767 | KOH is corrosive and causes burns; use eye and skin protection. |
| L-Glutamine | Life Technologies | #25030123 | |
| Laboratory centrifuge for 50-ml tubes | Sigma | 4-16 K | |
| Leupeptin | Sigma | #L2884 | |
| Liquid nitrogen | |||
| Micro-pipettes p2.5, p10, p20, p100, p200 and p1000 and corresponding tips | |||
| Micropestles | Eppendorf | #0030 120.973 | |
| Mouse brain tissue | Animal care and use for this study were performed in accordance with the recommendations of the European Community (2010/63/UE). Experimental procedures were specifically approved by the ethics committee of the Institut Curie CEEA-IC #118 (authorization no. 04395.03 given by National Authority) in compliance with the international guidelines. | ||
| Needles 18G X 1 ½” (1.2 X 38 mm | Terumo | #18G | |
| Needles 20G X 1 ½” (0.9 X 38 mm | Terumo | #20G | |
| Needles 21G X 4 ¾” (0.8 X 120 mm | B.Braun | #466 5643 | |
| Parafilm | |||
| PBS | Life Technologies | #14190169 | |
| Penicillin-Streptomycin | Life Technologies | #15140130 | |
| pH-meter | |||
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma | #P7626 | PMSF powder is hazardous. Use skin and eye protection when preparing PMSF solutions. |
| PIPES | Sigma | #P6757 | |
| Pipette-boy | |||
| Rotors | Beckman 70.1 Ti; TLA-100.3; and TLA 55 | ||
| SDS-PAGE electrophoresis equipment | Bio-Rad | #1658001FC | |
| SDS, Sodium dodecyl sulphate | VWR | #442444H | For preparing Laemmeli buffer |
| SDS, Sodium dodecyl sulphate | Sigma | #L5750 | For preparing 'TUB' SDS-PAGE gels |
| Sonicator | Branson | #101-148-070 | Used for lysing cells grown as adherent cultures. Use 6.5 mm diameter probe, set the sonicator at “Output control” 1, “Duty cycle” 10% and time depending on the cell type used. |
| Tabletop centrifuge for 1.5 ml tubes | Eppendorf | 5417R | |
| TEMED, N, N, N′, N′-Tetramethylethylenediamine | Sigma | #9281 | |
| Trichostatin A (TSA) | Sigma | #T8552 | |
| Triton X-100 | Sigma | #T9284 | |
| Trizma base (Tris) | Sigma | #T1503 | |
| Trypsin | Life Technologies | #15090046 | |
| Ultracentrifuge rotors | TLA-55, TLA-100.3 and 70.1 Ti rotors | Set at 4°C or 30°C based on the need of the experiment | |
| Ultracentrifuge tubes | Beckman | #357448 | for using with TLA-55 rotor |
| Ultracentrifuge tubes | Beckman | #349622 | for using with TLA-100.3 rotor |
| Ultracentrifuge tubes | Beckman | #355631 | for using with 70.1 Ti rotor |
| Ultracentrifuges | Beckman | Optima L80-XP (or equivalent) and Optima MAX-XP (or equivalent) | Set at 4°C or 30°C based on the need of the experiment |
| Vortex mixer | |||
| Water bath equipped with floaters or tube holders | Set at 30°C |
References
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Janke, C. The tubulin code: Molecular components, readout mechanisms, and functions. Journal of Cell Biology. 206 (4), 461-472 (2014).
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews: Molecular Cell Biology. 21 (6), 307-326 (2020).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Margolis, R. L., Wilson, L. Opposite end assembly and disassembly of microtubules at steady state in vitro. Cell. 13 (1), 1-8 (1978).
- Borisy, G. G., Olmsted, J. B. Nucleated assembly of microtubules in porcine brain extracts. Science. 177 (55), 1196-1197 (1972).
- Kirschner, M. W., Williams, R. C. The mechanism of microtubule assembly in vitro. Journal of Supramolecular Structure. 2 (2-4), 412-428 (1974).
- Baas, P. W., Lin, S. Hooks and comets: The story of microtubule polarity orientation in the neuron. Developmental Neurobiology. 71 (6), 403-418 (2011).
- Stepanova, T., et al. Visualization of microtubule growth in cultured neurons via the use of EB3-GFP (end-binding protein 3-green fluorescent protein). Journal of Neuroscience. 23 (7), 2655-2664 (2003).
- Nedelec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Bieling, P., Telley, I. A., Surrey, T. A minimal midzone protein module controls formation and length of antiparallel microtubule overlaps. Cell. 142 (3), 420-432 (2010).
- Roostalu, J., et al. Directional switching of the kinesin Cin8 through motor coupling. Science. 332 (6025), 94-99 (2011).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nature Materials. 14 (11), 1156-1163 (2015).
- Hendricks, A. G., Goldman, Y. E., Holzbaur, E. L. F. Reconstituting the motility of isolated intracellular cargoes. Methods in Enzymology. 540, 249-262 (2014).
- Dogterom, M., Surrey, T. Microtubule organization in vitro. Current Opinion in Cell Biology. 25 (1), 23-29 (2013).
- Vallee, R. B. Reversible assembly purification of microtubules without assembly-promoting agents and further purification of tubulin, microtubule-associated proteins, and MAP fragments. Methods in Enzymology. 134, 89-104 (1986).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Widlund, P. O., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Molecular Biology of the Cell. 23 (22), 4393-4401 (2012).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Letters. 587 (21), 3450-3455 (2013).
- Uchimura, S., et al. A flipped ion pair at the dynein-microtubule interface is critical for dynein motility and ATPase activation. Journal of Cell Biology. 208 (2), 211-222 (2015).
- Pamula, M. C., Ti, S. C., Kapoor, T. M. The structured core of human beta tubulin confers isotype-specific polymerization properties. Journal of Cell Biology. 213 (4), 425-433 (2016).
- Vemu, A., et al. Structure and dynamics of single-isoform recombinant neuronal Human tubulin. Journal of Biological Chemistry. 291 (25), 12907-12915 (2016).
- Ti, S. C., Alushin, G. M., Kapoor, T. M. Human beta-tubulin isotypes can regulate microtubule protofilament number and stability. Developmental Cell. 47 (2), 175-190 (2018).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nature Protocols. 14, 1634-1660 (2019).
- Barisic, M., et al. Microtubule detyrosination guides chromosomes during mitosis. Science. 348 (6236), 799-803 (2015).
- Nirschl, J. J., Magiera, M. M., Lazarus, J. E., Janke, C., Holzbaur, E. L. F. alpha-Tubulin tyrosination and CLIP-170 phosphorylation regulate the initiation of dynein-driven transport in neurons. Cell Reports. 14 (11), 2637-2652 (2016).
- Guedes-Dias, P., et al. Kinesin-3 responds to local microtubule dynamics to target synaptic cargo delivery to the presynapse. Current Biology. 29 (2), 268-282 (2019).
- Luo, Y., et al. Direct observation of dynamic protein interactions involving human microtubules using solid-state NMR spectroscopy. Nature Communications. 11 (1), 18(2020).
- Even, A., et al. ATAT1-enriched vesicles promote microtubule acetylation via axonal transport. Science Advances. 5 (12), 2705(2019).
- Wolff, J., Sackett, D. L., Knipling, L. Cation selective promotion of tubulin polymerization by alkali metal chlorides. Protein Science. 5 (10), 2020-2028 (1996).
- Magiera, M. M., et al. Excessive tubulin polyglutamylation causes neurodegeneration and perturbs neuronal transport. EMBO Journal. 37 (23), 100440(2018).
- Lacroix, B., Janke, C. Generation of differentially polyglutamylated microtubules. Methods in Molecular Biology. 777, 57-69 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Magiera, M. M., Janke, C. Methods in Cell Biology Vol. 115 Microtubules, in vitro. Correia, J. J., Wilson, L. , Academic Press. 247-267 (2013).
- Hausrat, T. J., Radwitz, J., Lombino, F. L., Breiden, P., Kneussel, M. Alpha- and beta-tubulin isotypes are differentially expressed during brain development. Developmental Neurobiology. , (2020).
- Janke, C., et al. Tubulin polyglutamylase enzymes are members of the TTL domain protein family. Science. 308 (5729), 1758-1762 (2005).
- Newton, C. N., et al. Intrinsically slow dynamic instability of HeLa cell microtubules in vitro. Journal of Biological Chemistry. 277 (45), 42456-42462 (2002).
- Belvindrah, R., et al. Mutation of the alpha-tubulin Tuba1a leads to straighter microtubules and perturbs neuronal migration. Journal of Cell Biology. 216 (8), 2443-2461 (2017).
- Breuss, M., et al. Mutations in the murine homologue of TUBB5 cause microcephaly by perturbing cell cycle progression and inducing p53 associated apoptosis. Development. , (2016).
- Latremoliere, A., et al. Neuronal-specific TUBB3 is not required for normal neuronal function but is essential for timely axon regeneration. Cell Reports. 24 (7), 1865-1879 (2018).
- Morley, S. J., et al. Acetylated tubulin is essential for touch sensation in mice. Elife. 5, (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved