Method Article
通过聚合-去聚合周期,通过有限来源的受控后翻译修改和异种型对图布林进行净化
摘要
本协议使用聚合和去聚合周期描述从中小型来源(如培养细胞或单个小鼠大脑)提纯的图布林。纯化的图布林富含特定的同位素或具有特定的翻译后修饰,可用于体外重组测定,以研究微管动力学和相互作用。
摘要
微管细胞学研究的一个重要方面是在体外重组实验中对微管行为的研究。它们允许分析微管的内在特性,如动力学,以及它们与微管相关蛋白质(MAPs)的相互作用。"图布林代码"是一个新兴的概念,指向不同的图布林同位素同位素和各种翻译后修改 (PTM) 作为微管属性和功能的调节器。要探索图布林密码的分子机制,必须使用具有特定同位素和PTM的纯化图布林进行体外重组实验。
迄今为止,这在技术上是具有挑战性的,因为脑图布林,这是广泛应用于体外实验,窝藏许多PTM,并有一个定义的异构型组成。因此,我们开发了这种协议,利用聚合和去聚合周期的经典方法,从不同来源、不同同型成分和受控PTM中纯化图布林。与现有基于亲和力纯化的方法相比,该方法产生纯聚合能力强的图布林,因为在连续的净化步骤中,对聚合或去聚合具有抗性的图布林被丢弃。
我们描述从细胞系中提炼的图布林,无论是在悬浮中生长还是作为粘附培养物生长,以及从单一小鼠大脑中生长。该方法首先描述了在悬架和附定设置(裂解步骤)中细胞质量的生成,然后是通过聚合-去聚合周期进行图布林纯化的连续阶段。我们的方法产生图布林,可用于解决图布林代码对微管的内在特性和微管与相关蛋白质相互作用的影响的实验。
引言
微管在许多细胞过程中起着关键作用。它们为细胞提供形状,为染色体分离构建髓和线粒体主轴,并作为细胞内运输的轨道。为了执行这些不同的功能,微管以不同的方式组织自己。该领域的一个耐人寻味的问题是了解分子机制,使结构和进化保存的微管能够适应这种过多的组织和功能。一个潜在的机制是微管的多样化,这是由被称为"图布林代码"1,2,3的概念定义。图布林密码包括两个主要组成部分:将α和β图布林基因产物(图布林异构型)的微分结合到微管中,以及图布林翻译后修饰(PTM)。
自20世纪70年代以来,体外重组实验结合不断发展的光显微镜技术,为有关微管特性的重要发现铺平了道路:动态不稳定4和跑步5,以及它们的其他机制和功能6、7、8、9、10、11、12、13、14、15。到目前为止,几乎所有的体外实验都是基于使用重复的聚合和去聚合周期从脑组织中纯化的图布林16,17。虽然从脑组织中提纯赋予了大量(通常克量)获得高质量图布林的优势,但一个重要的缺点是异质性,因为从脑组织中纯化的图布林是不同图布林异种型的混合物,并富含许多图布林PTM。这种异质性使得无法描述特定的图布林PTM或同位素在微管特性和功能控制中的作用。因此,生产具有受控图布林PTM和同质异型成分的组装能力图布林对于解决图布林代码的分子机制至关重要。
最近,一种利用酵母Stu2p的微管结合托格(肿瘤过度表达基因)域的亲和色谱净化图布林的方法已经开发出来。在这种方法中,细胞或组织粗裂解的图布林通过一个柱子,它与矩阵固定的托格域结合,从而能够分析给定甚至非常小的样品的整个图布林池。近年来,人们还描述了一种期待已久的净化重组管蛋白的方法。它基于巴库洛病毒系统,其中含有α和β-图布林基因的双柠檬载体在昆虫细胞19中表达。然而,这种方法是非常繁琐和耗时的,因此主要用于研究图布林突变的影响20和图布林等型21,22,23体外。
在目前的协议中,我们描述了一种方法,它使用成熟和广泛使用的聚合去聚化方法作为蓝图,从细胞系或小鼠脑组织24产生不同程度的修饰图布林。在此过程中,图布林在可溶性(4 °C的图布林二毛钱)和聚合形式(在瓜诺辛 5'-三磷酸 [GTP] 存在的情况下在 30 °C 处的微管)之间循环。每种形式都通过连续的离心步骤分离:在冷(4 °C)旋转后,图布林调光器将留在超自然体中,而微管将在30°C下喷出。 此外,在高管氨酸-N,N+-bis(2-乙醇离子酸)(PIPES)浓度下进行一个聚合步骤,允许从微管中去除微管相关蛋白质,从而从最终纯化的图布林中去除。从 HeLa S3 细胞中纯化为悬浮或粘附培养物的 Tubulin 几乎没有任何图布林 PTM,并已用于最近的体外重组实验25,26,27,28.我们进一步调整了从单只小鼠大脑中净化图布林的方法,可用于大量小鼠模型,这些模型具有图布林异种类型和PTM的变化。
在协议中,我们首先描述了源材料(细胞质量或脑组织)的生成,其裂解(图1A),然后是图布林聚合和去聚合的连续步骤,以净化图布林(图1B)。我们进一步描述了评估纯化吐布林的纯度(图2A,B)和数量(图3A,B)的过程。该方法可以通过在图布林纯化(图4B)之前在细胞中过度表达修改酶来生产富含选PTM的图布林。或者,在净化过程中,可以将调子蛋白修改酶添加到图布林中。最后,我们可以从缺乏相应图布林修饰酶(图4B)29的小鼠大脑中提炼出缺乏特定同型或PTM的图蛋白。
我们在这里描述的方法有两个主要优点:(一) 它允许在相对较短的时间内生产足够大量的图布林, (ii) 它产生高品质, 纯图布林, 与特定的图布林异型组成或PTM.在本手稿的相关视频中,我们重点介绍了此程序中涉及的一些关键步骤。
研究方案
根据欧洲共同体的建议(2010/63/UE),对这项研究进行动物护理和使用。实验程序是居里CEEA-IC#118(国家管理局授权号04395.03)根据国际准则特别批准的。
1. 为图布林净化准备试剂
注:所有用于图布林净化的缓冲剂应含有钾盐,而不是钠盐30。
- 准备 1 L 的完整介质:杜尔贝科的改良鹰介质 (DMEM), 10% 胎儿牛血清 (FBS, 100 mL), 200 mM L-谷氨酰胺 (10 毫升 2 M 股票) 和 1x 青霉素链霉素 (10 毫升 100x 股票).存储在4°C。
- 通过在水中溶解 140 克 KOH,将最终体积调整为 250 mL,并在室温下储存,从而准备 10 M 氢氧化钾 (KOH)。
- 准备 0.5 M 乙烯胺四乙酸 (EDTA), pH 8, 通过溶解 36.5 克 EDTA 在水中, 调整 pH 到 8.0 使用 KOH (否则 EDTA 不会溶解) 和最终体积到 250 mL, 过滤消毒, 并在室温下存储.
- 通过将 5 mL 的 0.5 M EDTA 添加到 500 mL 的 PBS、过滤消毒并在室温下存储,准备 5 m 磷酸盐缓冲盐水 (PBS)-EDTA。
- 准备 0.5 M K-PIPES, pH 6.8, 通过溶解 75.5 g 管道在水中, 调整到 pH 6.8 与 KOH (否则 PIPES 不会溶解) 和最终体积到 500 mL, 过滤消毒, 并存储在 4 °C.
- 准备 1 M K-PIPES, pH 6.8, 通过溶解 15.1 g 管道在水中, 调整到 pH 6.8 与 KOH 和最终体积到 50 mL, 过滤消毒, 并存储在 4 °C.
- 准备0.5 M钾-乙二醇-比斯(β-甲基乙醚) -N,N,N+,N+-四乙酸(K-EGTA, pH 7.7)通过溶解47.5克EGTA在水中,调整到pH 7.7与KOH和最终体积到250 mL,过滤消毒,并在室温下存储。
- 准备BRB80(80米K-管道, pH 6.8; 1 mM K-EGTA; 1 mM 氯化镁 [MgCl2])溶液,混合 3.2 mL 的 0.5 M PIPES、40 μL 的 0.5 M K-EGTA 和 20 μL 的 1 MgCl2, 并将最终体积调整为 20 mL。存储在4°C。
- 通过溶解 435 毫克的 PMSF 在异丙酚中,准备 0.1 M 苯甲基硫化物 (PMSF),以获得 25 mL 的最终体积,并储存在 -20 °C。
- 通过溶解10毫克阿普罗汀来准备蛋白酶抑制剂混合物(200x), 10毫克的麻风素和10毫克的4-(2-aminoethyl)-苯硫化物氟化物在水中获得2.5毫升的最终体积,使100μL的阿利库特,并存储在-20°C。
- 通过将 5 mL 的 Triton X-100 混合在 45 mL 水中,过滤消毒并在室温下存储,准备 10% Triton X-100。
- 准备Lysis缓冲器(BRB80补充1mM 2-甲基乙醇,1米PMSF,1x蛋白酶抑制剂混合,并可选地为 HEK-293 细胞, 0.2% Triton X-100) 在涂布林净化当天,将 20 mL 的 BRB80 与 1.5μL 的 2-麦加托乙醇、200 μL 的 0.1 M PMSF、100 μL 的蛋白酶抑制剂混合,并可选地混合 HEK-293 细胞,400μL的10%特里顿X-100。
注:2-甲基乙醇是有毒的,应用于烟熏。 - 通过在 9.5 mL 水中溶解 1 克 GTP 来准备 0.2 M GTP,使用 KOH 将 pH 调整到 7.5,制作 20μL 的单数,并存储在 -20 °C。 避免重复的冻结-解冻周期。
- 通过在水中溶解 60.56 克 Tris,用 HCl 调整到 pH 6.8,完成到 500 mL 的最终体积,过滤消毒并在室温下存储,从而准备 1 M 三元(羟基甲基)氨基甲烷-盐酸酯(Tris-HCl)。
- 准备 5x 莱姆利样品缓冲器 (450 m M 二硫醇 (DTT); 10% 钠二硫酸盐 (SDS); 400 μM 特里斯 -HCl, pH 6.8; 50% 甘油; ~0.006% 溴酚蓝色), 通过添加 4 克 SDS 到 16 mL 预热 1 M 特里斯 - HCl, pH 6.8, 并轻轻地混合溶液.将 2.6 克 DTT 和 20 mL 的 100% 甘油加入混合物中搅拌,直到溶液变得均匀。添加所需的溴酚蓝色(2.5毫克)量,以达到所需的颜色强度。制作 5 mL 的别名,并存储在 -20 °C。 通过稀释蒸馏水中的 5 倍库存,准备 Laemli 样品缓冲液的 2 倍工作解决方案。
2. 吐布林的扩增和收获来源
注:在此协议中,使用了三种来源的图布林:(一) 细胞(HeLa S3 和 HEK-293) 生长为悬浮培养物:(二) 作为附体培养物生长的细胞(HEK-293、HeLa和U2操作系统);和(三)小鼠脑组织。该协议将图布林净化日视为"第 0 天",因此,与其他步骤相对于第 0 天进行了描述。
- 细胞扩增
- 作为悬浮培养物生长的细胞
注意:要成功地从悬浮培养物中净化图布林,请使用至少 2 升悬浮培养物。- 对于2升的悬浮培养,恢复和生长首选细胞类型获得6×107 细胞10天前的准备。在-10日,板细胞在6个直径15厘米的菜肴上,每盘107 个细胞。
- 在第 -8 天,预热所需的完整中等量至 37 °C。 在无菌条件下,为每个微调器瓶添加 1 升预热介质。将微调器放在细胞培养孵化器内 20-25 rpm 的搅拌台上,稍微打开侧向微调器盖,使介质平衡到孵化器的大气中。
注意:为避免任何污染,请使用 70% 乙醇彻底清洁介质和微调器瓶的外表面。 - 在-7日,尝试对生长到80-90%汇合的细胞(约1.8×108 个细胞)进行分化和收集。一次从 3 个菜肴中收集细胞,向下旋转(200 × 克,5 分钟,室温),并在 DMEM 的 10 mL 中重新悬浮所有细胞。
注:此时细胞的彻底分离对于避免在微调器瓶中形成较大的聚合物非常重要,这会影响细胞的生存,并导致低图布林产量。 - 将 5 毫升的细胞悬架添加到每个含有 1 升 DMEM 的微调器瓶中,将微调器返回到细胞培养孵化器中的搅拌器表,并允许细胞生长一周。
- 作为粘附培养物生长的细胞
注意:要成功地从粘附细胞中净化图布林,请使用至少 10 道 80-90% 的汇合菜。- 恢复和放大所需的细胞类型,在涂布林准备前三天获得1×10 8 个细胞。
- 在-3天,将这些细胞放在10个15厘米的盘子上,每盘1×10 7个细胞,使它们生长80-90%的汇合。
- 在-1日,如果需要,用质粒感染细胞,以表达图布林修饰酶或特定的图布林同位素。
- 作为悬浮培养物生长的细胞
- 采集细胞/脑组织
- 作为悬浮培养物生长的细胞
- 在250×克(15分钟)的室温下,将微调器的细胞悬架转移到1L离心机瓶(材料表)和颗粒细胞中。要立即在微调器瓶中启动 HeLa S3 细胞的另一种培养,请在微调器中保留 100 mL 的细胞悬浮,并在微调器瓶中加入 1 升完整的预热 DMEM。
注意:在进行图布林净化之前,请仔细检查细菌污染。 - 将每个离心机瓶中的聚合细胞在 10 mL 的冰冷 PBS 中恢复,并将所有电池转移到 50 mL 螺钉管中。在重新悬浮期间,将细胞保持在冰上。将细胞颗粒在250× 克,15分钟,4°C。
注意:遵循微调器瓶清洁和存储的建议(参见 材料表)。 - 丢弃超自然体并确定细胞颗粒的体积。从2升悬浮培养(两个微调器瓶),预计细胞颗粒为5-6毫升。
注意:在下面描述的协议中,细胞颗粒体积假设为 10 mL。根据颗粒体积调整实验。 - 添加1个体积(10 mL)的裂解缓冲,并重新悬浮细胞颗粒。
注:细胞颗粒体积与裂解缓冲体积的比例对于成功提布林纯化非常重要。添加更多的裂解缓冲器可降低图布林浓度,从而无法达到聚合所需的临界浓度,从而大大降低图布林产量。
注意:在裂解缓冲中恢复的细胞可以在液氮中快速冷冻,并储存在-80°C两个月。
- 在250×克(15分钟)的室温下,将微调器的细胞悬架转移到1L离心机瓶(材料表)和颗粒细胞中。要立即在微调器瓶中启动 HeLa S3 细胞的另一种培养,请在微调器中保留 100 mL 的细胞悬浮,并在微调器瓶中加入 1 升完整的预热 DMEM。
- 作为粘附培养物生长的细胞
注:必须非常迅速地收获来自粘附培养物的细胞,以成功净化图布林(收获10个15厘米的菜肴大约15分钟)。三个人参加了协议的这一步骤。- 通过将盘子倾斜从 15 厘米的盘子中取出介质,然后在室温下用 7 mL 的 PBS-EDTA 轻轻清洗细胞(人 1)。一次只使用三个 15 厘米的菜肴,以避免离开细胞没有中等或缓冲。
- 将 5 mL 的 PBS-EDTA 添加到细胞中,并在室温下孵育 5 分钟。
- 使用细胞升降机将细胞铲到盘子的一边(人 2)轻轻分离细胞,并将所有细胞收集到 50 mL 螺丝盖管(人 3)中。用额外的 2 mL PBS-EDTA 冲洗每个盘子,从菜肴中收集剩余的细胞。在此步骤中,保持包含冰上细胞悬架的 50 mL 螺钉管。
- 将细胞颗粒在250× 克,10分钟,4°C。 丢弃超自然体并确定细胞颗粒的体积。预计从10个15厘米的菜肴体积~1 mL。
注意:在下面描述的协议中,细胞颗粒体积假设为 10 mL。根据颗粒体积调整实验。 - 将细胞在 1 卷 (10 mL) 裂解缓冲区中重新吸附。
注:在裂解缓冲器中恢复的细胞可储存在-80°C,最长达两个月。
- 脑组织
注:任何年龄、性别或遗传背景的老鼠都可以使用。转基因小鼠菌株的选择将取决于要解决的科学问题。在这份手稿中,我们展示了从ttll1-/-小鼠中纯化的图布林的例子,缺乏一种主要的大脑谷氨酸酶,图布林酪氨酸韧带状1(TTLL1)蛋白31。- 通过颈椎脱位牺牲小鼠,迅速斩首,并将大脑收集到圆底管中。如果大脑中有多余的血液,用裂解缓冲器快速洗涤。老鼠一牺牲大脑,就会收集大脑,因为验尸延迟会影响图布林净化的成功。使用圆底管来适应用于同质化的探头的宽度。
注:收集的鼠脑可在液氮中快速冷冻,储存在-80°C下长达3年。 - 将 500 μL 的裂解缓冲器添加到从成年小鼠中提取的单个大脑中。对于协议的其余部分,添加的裂解缓冲器的体积假设为 10 mL。根据要使用的大脑数量调整您的实验。
- 通过颈椎脱位牺牲小鼠,迅速斩首,并将大脑收集到圆底管中。如果大脑中有多余的血液,用裂解缓冲器快速洗涤。老鼠一牺牲大脑,就会收集大脑,因为验尸延迟会影响图布林净化的成功。使用圆底管来适应用于同质化的探头的宽度。
- 作为悬浮培养物生长的细胞
3. 细胞或脑组织裂解
- 作为悬浮培养物生长的细胞
- 对于 HEK-293,使用不同宽度的移液器尖反复上下管道,将细胞解冻在冰上。首先,将 p1000 提示连接到 10 mL 移液器上,每 5 分钟将电池上下悬架一次,10 分钟(三个管道循环)。其次,将 p200 提示连接到 p1000 尖端,每 5 分钟附加一次移液器,每次 20 分钟(五圈管道)。
- 对于 HeLa S3,使用法国按压解细胞(参见 设置材料表 )。
- 以裂解混合 (L) (200 μL 代表 20 毫升 L) 的 1/100卷 为例,并添加相同体积的 2 倍 Laemmli 缓冲器,煮沸 5 分钟,并存储在 -20 °C 以供进一步分析。
- 作为粘附培养物生长的细胞
- 将细胞转移到 14 mL 的圆底管中,该管的高度已降低,以适应声波探测器(参见 设置材料表 )。将细胞发出~45个脉冲,并通过在显微镜下取样一滴裂解混合物来确认细胞裂解。
注:脉冲的数量可能因用于图布林纯化的细胞类型而异。声波细胞过多可能导致图布林沉淀,并会对净化产量产生负面影响。 - 使用 p200 尖,每 5 分钟在冰上上下输送一次电池,每次 20 分钟(5 圈管道化)。
- 以第 1/100卷 的裂解混合 (L) (200 μL 代表 20 毫升 L) 为例,并添加相同体积的 2 倍 Laemmli 缓冲器,煮沸 5 分钟,储存在 -20 °C 以供进一步分析。
- 将细胞转移到 14 mL 的圆底管中,该管的高度已降低,以适应声波探测器(参见 设置材料表 )。将细胞发出~45个脉冲,并通过在显微镜下取样一滴裂解混合物来确认细胞裂解。
-
脑组织
- 使用组织搅拌机对脑组织进行酶(有关设置,请参阅 材料表 )。或者,使用微管或等效设备在冰上上下搅拌组织,用 1mL 注射器和 18 G 针在冰上上下搅拌。
- 以第 1/100卷 的裂解混合 (L) (200 μL 代表 20 毫升 L),并添加相同体积的 2 倍 Laemmli 缓冲器,煮沸 5 分钟,并存储在 -20 °C 以供进一步分析。
4. 图布林净化
- 莱萨特澄清
- 通过离心机在 150,000 × 克、4 °C、30 分钟内清除裂解物(分离颗粒和裂解混合物的可溶性部分)。有关超中心燃料转子和管子的详细信息,请参阅 材料表 。对于细胞提取物,通常在离心后形成白色浮动层。不要将此浮动层与超自然物一起转移,因为它会干扰图布林聚合。使用附着在长 20 G 或 21 G 针上的适当体积注射器,在不干扰浮动层的情况下轻轻去除超自然物。如果超自然人仍然多云,离心机在5000× 克,4°C 10分钟。
- 将超自然(SN1)转移到超中心管中,并记下其体积。对于 10 mL 细胞颗粒,SN1 的预期体积为 ~12 mL。
- 以第 1/100卷 SN1(120 μL 表示 12 mL 的 SN1)为例,并添加相同体积的 2 倍 Laemli 缓冲器,煮沸 5 分钟,并存储在 -20 °C 以供进一步分析。
- 使用与 SN1 相同的音量在 BRB80 (材料表) 中重新使用颗粒 (P1)。以第 1/100卷 P1(200 μL 表示 20 mL 的 P1)为例,并添加相同体积的 2 倍 Laemmli 缓冲器,煮沸 5 分钟,并存储在 -20 °C 以供进一步分析。
- 低摩尔缓冲区的第一次聚合
- 将 1 卷 SN1 (12 mL)、1/200th 体积 0.2 M GTP (60 μL;最终浓度 1 mM) 和 0.5 体积预热甘油 (6 mL) 组合在适当体积的螺丝盖管中,准备聚合组合。
注:在整个协议的聚合步骤中,甘油用作挤塞剂,因此在计算其他组件的浓度时不考虑。 - 将混合物上下混合,轻轻避免气泡的形成,并将其转移到适当的超中心管中。
注意:在将混合物转移到管子时,调整管子的重量(成对)。这使得实验者能够在聚合步骤后直接进行微管沉降。在整个协议中,所有聚合步骤都这样做。 - 用胶片覆盖管子,转移到30°C的水浴池,孵育20分钟。
- 离心管在150,000×克,30°C 30分钟。去除超自然(SN2),并保留聚合微管(P2)的颗粒。
注:微管颗粒可快速冷冻,储存在-80°C,最长达1年。 - 以第 1/200卷 SN2 (90 μL 代表 18 mL SN2) 为例,并添加相同体积的 2 倍 Laemmli 缓冲器,煮沸 5 分钟,并存储在 -20 °C 以供进一步分析。
- 将 1 卷 SN1 (12 mL)、1/200th 体积 0.2 M GTP (60 μL;最终浓度 1 mM) 和 0.5 体积预热甘油 (6 mL) 组合在适当体积的螺丝盖管中,准备聚合组合。
- 第一次去聚合
- 通过在颗粒 P2 中加入冰冷的 BRB80 来去聚微管,并在冰上离开 5 分钟:对于细胞中的图布林,添加 1/60th (200 μL),以及来自大脑的图布林,加入 SN1 体积的 1/20(600 μL)。
注:在去聚过程中添加到颗粒中的冰冷BRB80体积始终与SN1的体积相对。 - 轻轻补充微管颗粒,避免气泡,直到溶液完全均匀。使用 p1000 提示进行几个周期的管道输送,然后每 5 分钟使用一次 p200 小费,20 分钟(5 个管道循环)。这是图布林净化成功的关键一步。
- 将溶液转移到适当的超中心管中,在 150,000 × g,4°C 下旋转 20 分钟。将SN3转移到一个新的1.5 mL超中心管。这种离心步骤 (P3) 后形成的颗粒包含沉淀蛋白(微管相关蛋白质或 MAP)和非脱聚微管。超细剂 (SN3) 包含可溶性组件:脱聚的图布林调光器和 MAP,这些晶体与脱聚微管分离。
- 服用 1–4 μL 的 SN3,并添加 9 卷 2x Laemmli 缓冲器,煮沸 5 分钟,并储存在 -20 °C 以供进一步分析。
- 在BRB80中补充颗粒P3(相同体积的SN3),取1+4μL,并添加9卷2x莱姆利缓冲器,煮5分钟,储存在-20°C。
- 通过在颗粒 P2 中加入冰冷的 BRB80 来去聚微管,并在冰上离开 5 分钟:对于细胞中的图布林,添加 1/60th (200 μL),以及来自大脑的图布林,加入 SN1 体积的 1/20(600 μL)。
- 第二次聚合(高分子缓冲区)
- 通过组合 1 卷 SN3 (200 μL)、1 卷预热 1 M PIPES (200 μL) 来准备聚合混合, 最终浓度 0.5 M),1/100体 积 0.2 M GTP (2 μL,最终浓度 1 mM), 和 1 体积预热甘油 (200 μL) 在适当体积的管中。
- 将气泡上下混合,避免形成气泡,并将其传输到超中心管。
- 用胶片盖住管子,将它们转移到30°C的水浴池中,孵育20分钟。
- 离心管在150,000× 克,30°C 30分钟。去除超自然物 (SN4),并保留聚合微管 (P4) 的颗粒。颗粒P4含有聚合微管,超自然SN4含有未聚合的管蛋白、MAP和其他可溶性蛋白质。
注:第二个聚合步骤后的微管颗粒可被快速冷冻并储存在-80°C下长达1年。 - 服用 1–4 μL,加入 9 卷 2x Laemmli 缓冲器,煮沸 5 分钟,并储存在 -20 °C 以供进一步分析。
- 第二次去聚合
- 通过在颗粒 P4 中加入冰冷 BRB80 来去聚微管,并在冰上保留 5 分钟:对于细胞中的图布林,添加 1/100th (120 μL),以及来自大脑的图布林,加入 SN1 体积的 1/40(300 μL)。
- 每 5 分钟用 p200 提示上下吹笛,20 分钟(五圈管道)。
- 将溶液转移到 1.5 mL 的超中轴管中,在 150,000 × g、4°C 下旋转 20 分钟。将SN5转移到一个新的1.5 mL超中心管。这种离心步骤 (P5) 后形成的颗粒包含非脱聚微管。超自然 (SN5) 含有可溶性图布林。
- 服用 1–4 μL,加入 9 卷 2x Laemmli 缓冲器,煮沸 5 分钟,并储存在 -20 °C 以供进一步分析。
- 在BRB80中重新加入颗粒P5(相同体积的SN5),取1+4μL,并添加9卷2x Laemmli缓冲器,煮5分钟,储存在-20°C以供进一步分析。
- 第三聚合(低摩尔缓冲区)
- 准备聚合混合:1 卷 SN5 (120 μL), 1/200体 积 0.2 M GTP (0.6 μL, 最终浓度为 1 mM), 和 0.5 体积预热甘油 (60 μL) 在适当体积的管中。
- 将气泡上下混合,轻轻避免形成气泡,并将其转移到适当的超中心管中。
- 用胶片盖住管子,将它们转移到30°C的水浴池中,孵育20分钟。
- 离心管在150,000× 克,30°C 30分钟。颗粒 (P6) 包含聚合微管,超自然 SN6 含有少量非聚合管蛋白。
注:微管颗粒可快速冷冻,储存在-80°C,最长达1年。 - 服用 1–4 μL,加入 9 卷 2x Laemmli 缓冲器,煮沸 5 分钟,并储存在 -20 °C 以供进一步分析。
- 第三次去聚合
- 通过在颗粒 P6 中加入冰冷 BRB80 来去聚微管,并在冰上保留 5 分钟:对于细胞中的图布林,添加 1/100th (120 μL),以及来自大脑的图布林,加入 SN1 体积的 1/40(300 μL)。
- 每 5 分钟用 p200 提示上下吹笛,20 分钟(五圈管道)。
- 将溶液转移到适当的超中心管中,在 150,000 × 克、4 °C 下旋转 20 分钟。将SN7转移到一个新的1.5 mL超中心管。颗粒 (P7) 包含少量非脱聚微管。超自然(SN7)含有完全去聚化的微管(可溶性图布林)。
- 服用 1–4 μL,加入 9 卷 2x Laemmli 缓冲器,煮沸 5 分钟,并储存在 -20 °C 以供进一步分析。
- 在BRB80中重新加入颗粒P7(相同体积的SN7),取1~4μL,并加入9卷2x莱姆利缓冲器,煮5分钟,储存在-20°C以供进一步分析。
- 将图布林(参见 代表性结果)和aliquot SN7的数量量化为小批量、快速冻结,并存储在-80°C。
结果
该方法的主要目标是生产出质量高、装配能力强的图布林,其数量足以对纯化成分进行反复的体外实验。从这种管蛋白组装的微管可用于重组测定,基于全内部反射荧光(TIRF)显微镜技术与动态或稳定的微管,在实验测试微管动力学,与MAP或分子电机的相互作用,并强制发电的电机25。它们还可用于微管-MAP共聚检测和固态NMR光谱28。
在整个净化过程中,可以通过使用库马西染色 SDS-聚丙烯酰胺凝胶 (PAGE) 凝胶(最好是"TUB"SDS-PAGE 凝胶)来监测图布林的丰富性和纯度,这种凝胶允许分离α和β-图布林,后者在经典凝胶32中作为单一波段共同迁移。以不同步骤收集的 Lysates(除了最后一次去聚,参见协议)以可比的量加载到凝胶上,用于评估图布林纯化(图 2A)24的成功。最终的图布林样品非常珍贵,只加载在凝胶上,以确定图布林浓度。在聚合和去聚合的重复循环中失去一些图布林是正常的。最终纯化的吐布林产量低于预期可能是由于 (i) 微管的不完全去聚化, 可视化为分数 P3、P5 和 P7 中存在大量图布林,或 (ii) 将低效的图布林聚合成微管,在这种情况下,在分数 P2、P4 和 P6 中存在少量的图布林,在分数 SN2、SN4 和 SN6(图 2B)中存在较低量的图布林。如果图布林在聚合步骤中丢失(P2 和 P4 的较低量)(i) 确保聚合期间有足够的图布林浓度(ii) 使用 GTP 的新鲜别名,并且/或 (iii) 重新确认聚合反应的温度。如果在去聚过程中丢失了图布林(SN3 和 SN5 的较低量),则增加时间以及在冰上输送混合物。
有关纯化图布林的定量,在 SDS-PAGE 上与已知数量的牛血清白蛋白 (BSA, 0.5 μg = 1μg = 2μg = 4 μg) (图 3A)一起运行样本。凝胶沾染了库马西明亮的蓝色,扫描,和BSA和图布林带的强度测量定量密度计(图3B),如 https://openwetware.org/wiki/Protein_Quantification_Using_ImageJ 描述。请注意,同样的分析可以在斐济做,图像J33的升级版本。BSA波段的值用于确定线性回归方程,该方程用于计算图布林带中的蛋白质量。仅使用 BSA 曲线范围内的图布林带强性来确定图布林浓度。根据计算的图布林浓度,准备了所需量的图布林,在液氮中快速冷冻,并储存在-80°C。 我们通常从四瓶 HeLa S3 悬浮培养物(约 15 克细胞)、从 10 个直径 15 厘米的菜肴中获取约 2 毫克的涂布林(约 1.2 克细胞),以及从 1 克小鼠脑组织中获得约 1 毫克的图布林。
为了确认特定图布林同位素同位素的丰富性或修饰,使用各自的抗体34,35可以免疫0.1μg的纯化图布林。控制图布林将因感兴趣的图布林而异。对于用改性酶在体外修改的图布林,使用未经处理的图布林作为控制。对于通过过度表达的改性酶在纤维素中修改的图布林,使用从不表达酶作为控制的细胞中纯化的图布林(图4A)。控制从敲除老鼠大脑中纯化的图布林的图布林将是来自野生小鼠的图布林 (图4B) 。在所有免疫量分析中,使用PTM独立抗α-图布林抗体(12G10)验证同等负荷的图布林。
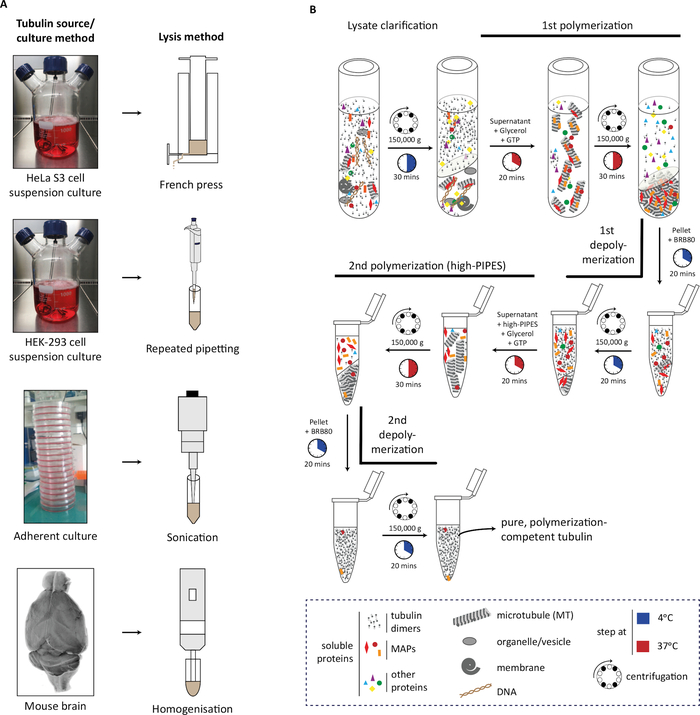
图1:使用聚合去聚化循环从不同来源提炼图布林。(A) 使用特定策略对不同来源的图布林进行裂解。悬浮培养的 HeLa S3 细胞使用法国印刷机进行解体:HEK-293细胞通过重复的管道化进行解体。粘附细胞使用声波和小鼠脑组织的短脉冲使用组织同质化解。(B) 使用冷聚合和热聚合的循环,对图布林净化协议的连续步骤进行示意图表示。在裂解和裂解澄清后,微管被聚合和聚合。然后,微管去聚合,然后允许在高摩尔缓冲区聚合,防止微管相关蛋白质 (MAP) 与微管共同沉积。然后,无 MAP 的微管被去聚合,并可以进一步进行第三个循环的聚合去聚化,以去除高摩尔缓冲器的微量。 请单击此处查看此图的更大版本。

图2:评估图布林净化的成功率。在图布林净化协议的不同步骤收集的样品在"TUB"钠多硫酸盐-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶(详情见协议)上运行,并沾染了库马西明亮的蓝色。(A) 在成功的图布林净化中,在整个过程中,α和β管素逐渐丰富。第二次聚合后,微管颗粒 (P4) 几乎不受其他蛋白质或微管相关蛋白质 (MAP) 的污染。请注意,在手术过程中丢失一些图布林是正常的。(B) 在不成功的图布林纯化中,最终的图布林产量较低,而图布林在脱聚后或聚合后仍留在颗粒中(红盒子)中。在此处显示的示例中,图布林在两个聚合步骤中均未有效聚合。 请单击此处查看此图的更大版本。

图3:使用库马西染色钠多硫酸盐-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶和密度计量对纯化图布林进行量化。(A) 库马西染色 SDS-PAGE 凝胶,已知数量为牛血清白蛋白 (BSA; 0.5, 1, 2 和 4 μg, 灰色梯度线) 和不同卷 (0.5 和 1 μL, 光和深色, 分别) 纯化图布林.在示例中,酪蛋白图布林(HeLa S3 图布林,浅橙色和深橙色)和脱脂图布林(HeLa S3 图布林处理与卡宾肽 A, 浅蓝色和深蓝色) 被加载在凝胶上。(B) 使用 ImageJ(任意单位,AU)对来自 (A) 的 BSA 波段进行量化,并根据加载的蛋白质量(灰色到黑色点)进行绘图。这些点用于计算线性回归线(灰色梯度线)和方程,用于计算在凝胶上加载的图布林样品(浅色和深橙色和蓝色点)中的蛋白质量。这有助于计算图布林样品的浓度。请注意,位于 BSA 标准曲线之外的点不应用于确定浓度(深橙色和蓝色点)。 请单击此处查看此图的更大版本。
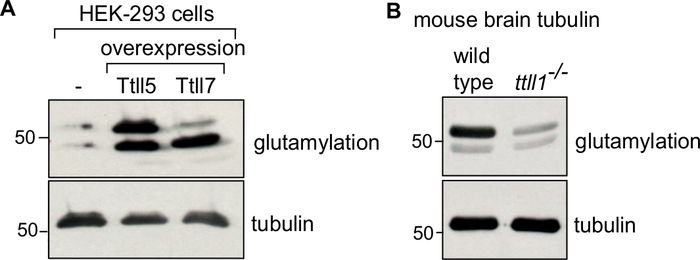
图4:用不同的PTM对纯化图布林进行免疫斑点分析。(A) 从 HEK-293 细胞中纯化的图布林: 野生类型, 或过度表达 TTLL5 或 TTLL7 的细胞被分析为使用 GT335 抗体进行聚胶酰化的具体浓缩。虽然TTLL5过度表达会增加α和β-图布林的聚胶氨酸化,但TTLL7过度表达会特别丰富β-图布林谷氨酸化。(B) 从野生类型的脑组织中纯化的图布林和ttll1-/-小鼠被分析为谷氨酰化模式。注意从ttll1-/-小鼠的多胶氨酸化的强减小鼠,缺乏主要的大脑谷氨酸酶TTLL136。"TUB"凝胶用于分离α和β图布林。12G10确认了同等量的图布林负载,这是一种抗α图布林抗体。请单击此处查看此图的更大版本。
讨论
这里描述的方法提供了一个平台,从细胞线和单个鼠标大脑中快速产生高质量、具有组装能力的中量图布林。它是基于黄金标准协议的图布林纯化牛脑用于该领域多年16,17。该方法的一个特别优点是使用 HeLa S3 细胞的悬浮培养物,一旦建立,就会产生大量的细胞,同时几乎不需要动手时间。这使得该协议在任何细胞生物学实验室中都相对容易执行,而其他图布林纯化方法18、19、32、37则需要特定的设备和专业知识,因此大多被具有强大蛋白质纯化背景的实验室使用。当从粘附细胞系中产生少量的图布林时,可以使用各种细胞系。我们已经成功地从 HeLa、U-2 操作系统和 HEK-293 细胞中纯化了图布林。如果需要更大规模的净化,收获的细胞或大脑可以在裂解缓冲区中快速冻结,并储存在 -80 °C,多个细胞颗粒或大脑可以聚集在一起,以净化更多的图布林。
从细胞系中净化的图布林几乎不含图布林PTM。这种提尔-图布林可以很容易地转换为去甲酸化 (deTyr-) 图布林在一个单一的直接步骤25.要与其他PTM一起生产图布林,在图布林纯化之前,特定的图布林改性酶可以在细胞中过度表达。此外,在研究微管和人类MAP之间的相互作用时,利用人类起源的细胞系作为物质来源有助于避免潜在的跨物种问题。此外,来自未转化(如 HEK293)或转化(如 HeLa)细胞的图布林可以提供有关微管定向药物(如分类药物)对正常与肿瘤细胞微管的影响的信息。
最后,我们的协议促进从单一小鼠大脑中净化图布林。随着越来越多的小鼠模型的图布林突变和修改正在产生,这个协议允许直接分析的特性和相互作用的微管与改变的图布林同位素的组成38,39,40或图布林PTM31,41。
该方法基于聚合和去聚合的周期。因此,特定的图布林同型或图布林与特定的PTM,影响微管的组装和拆卸特性,可能会导致这种图布林形式的不成比例的损失或减少在净化过程中。然而,我们已经表明,主要的图布林PTM,如乙酰化,去甲酸化,谷氨酸化和甘油化,保留在整个图布林净化过程中的微管24。然而,应该指出的是,对于细胞或组织中图布林成分的定量分析,基于托格柱的图布林纯化方法更合适,因为它将允许一个公正的,聚合独立的图布林纯化18。尽管其局限性,我们的协议提供了一个很大的优势,在产生大量的高品质的图布林,可用于细致的体外重组实验。特别是,它有助于在常规实验中使用富含PTM的大脑图布林。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了ANR-10-IDEX-0001-02、LabEx单元'n'Scale ANR-11-LBX-0038和收敛Q-life ANR-17-CONV-0005研究所的支持。CJ由居里研究所支持,法国国家研究机构(ANR)授予ANR-12-BSV2-0007和ANR-17-CE13-0021, 国家癌症学院(INCA)赠款2014-PL BIO-11-ICR-1,以及雷彻切医学基金会(FRM)赠款DEQ20170336756。MMM由Vaincre老年痴呆症基金会赠款FR-16055p支持,并得到法国阿尔茨海默氏症赠款AAP SM 2019 n+2023的支持。JAS 得到了欧盟"地平线 2020"研究和创新计划的支持,该计划由玛丽·斯考多夫斯卡-库里赠款协议第 675737 号和 FRM 赠款 FDT201904008210 提供。SB 得到了 FRM 赠款 FDT201805005465 的支持。
我们感谢Janke实验室的所有成员,特别是J.苏普龙,以及G.拉基西奇(米卡利斯研究所、农业巴黎技术研究所)和A.高特劳(理工学院)在制定议定书期间的帮助。我们要感谢居里动物设施在老鼠繁殖和护理方面所提供帮助。
抗体12G10由J.弗兰克尔和M.纳尔逊开发,来自由NICCHD赞助、爱荷华大学维护的发展研究杂交瘤银行。
材料
| Name | Company | Catalog Number | Comments |
| 1 M MgCl2 | Sigma | #M1028 | |
| 1-L cell culture vessels | Techne F7610 | Used for spinner cultures. Never stir the empty spinner bottles. When spinner bottles are in the cell culture incubator, always keep the lateral valves of spinner bottles slightly open to facilitate the equilibration of media with incubator’s atmosphere. After use, fill the spinner bottles immediately with tap water to avoid drying of remaining cells on the bottle walls. Wash the bottles with deionised water, add app 200 ml of deionised water and autoclave. Under a sterile cell culture hood remove the water and allow the bottles to dry completely, still under the hood, for several hours. Never use detergents for cleaning the spinner bottles because any trace amounts of the detergent can be deleterious to the cells. | |
| 1.5- and 2-ml tubes | |||
| 14-ml round-bottom tubes | |||
| 15-cm-diameter sterile culture dishes | |||
| 15-ml screw-cap tubes | |||
| 2-mercaptoethanol | Sigma | #M3148 | 2-mercaptoethanol is toxic and should be used under the hood. |
| 4-(2-aminoethyl)-benzenesulfonyl fluoride | Sigma | #A8456 | |
| 40% Acrylamide | Bio-Rad | #161-0140 | |
| 5-, 10- 20-ml syringes | |||
| 5-ml, 10-ml, 25-ml sterile pipettes | |||
| 50-ml screw-cap tubes | |||
| Ammonium persulfate (APS) | Sigma | #A3678 | |
| Anti-alpha-tubulin antibody, 12G10 | Developed by J. Frankel and M. Nelson, obtained from the Developmental Studies Hybridoma Bank, developed under the auspices of the NICHD, and maintained by the University of Iowa | dilution: 1/500 | |
| Anti-glutamylated tubulin antibody, GT335 | AdipoGen | #AG-20B-0020 | dilution: 1/20,000 |
| Aprotinin | Sigma | #A1153 | |
| Balance (0.1 – 10 g) | |||
| Beckman 1-l polypropylene bottles | For collecting spinner cultures | ||
| Beckman Avanti J-26 XP centrifuge | For collecting spinner cultures | ||
| Biological stirrer | Techne MCS-104L | Installed in the cell culture incubator (for spinner cultures), 25 rpm for Hela S3 and HEK 293 cells | |
| Bis N,N’-Methylene-Bis-Acrylamide | Bio-Rad | #161-0201 | |
| Blender IKA Ultra-Turrax® | For lysing brain tissue, use 5-mm probe, with the machine set at power 6 or 7. Blend the brain tissue 2-3 times for 15 s on ice. | ||
| Bovine serum albumin (BSA) | Sigma | #A7906 | |
| Bromophenol blue | Sigma | #1.08122 | |
| Carboxypeptidase A (CPA) | Sigma | #C9268 | Concentration: 1.7 U/µl |
| Cell culture hood | |||
| Cell culture incubator set at 37°C, 5% CO2 | |||
| Dimethyl sulfoxide (DMSO) | Sigma | #D8418 | DMSO can enhance cell and skin permeability of other compounds. Avoid contact and use skin and eye protection. |
| DMEM medium | Life Technologies | #41965062 | |
| DTT, DL-Dithiothreitol | Sigma | #D9779 | |
| EDTA | Euromedex | #EU0007-C | |
| EGTA | Sigma | #E3889 | |
| Ethanol absolute | Fisher Chemical | #E/0650DF/15 | |
| Fetal bovine serum (FBS) | Sigma | #F7524 | |
| French pressure cell press | Thermo electron corporation | #FA-078A | with a #FA-032 cell; for lysing big amounts of cells. Set at medium ratio, and the gauge pressure of 1,000 psi (corresponds to 3,000 psi inside the disruption chamber). |
| Glycerol | VWR Chemicals | #24388.295 | |
| Glycine | Sigma | #G8898 | |
| GTP | Sigma | #G8877 | |
| Heating block | Stuart | #SBH130D | |
| Hela cells | ATCC® CCL-2™ | ||
| Hela S3 cells | ATCC | ATCC® CCL-2.2™ | |
| Hydrochloric acid (HCl ) | VWR | #20252.290 | |
| Inverted microscope | With fluorescence if cell transfection is to be verified | ||
| Isopropanol | VWR | #20842.298 | |
| jetPEI | Polyplus | #101 | |
| JLA-8.1000 rotor | For collecting spinner cultures | ||
| KOH | Sigma | #P1767 | KOH is corrosive and causes burns; use eye and skin protection. |
| L-Glutamine | Life Technologies | #25030123 | |
| Laboratory centrifuge for 50-ml tubes | Sigma | 4-16 K | |
| Leupeptin | Sigma | #L2884 | |
| Liquid nitrogen | |||
| Micro-pipettes p2.5, p10, p20, p100, p200 and p1000 and corresponding tips | |||
| Micropestles | Eppendorf | #0030 120.973 | |
| Mouse brain tissue | Animal care and use for this study were performed in accordance with the recommendations of the European Community (2010/63/UE). Experimental procedures were specifically approved by the ethics committee of the Institut Curie CEEA-IC #118 (authorization no. 04395.03 given by National Authority) in compliance with the international guidelines. | ||
| Needles 18G X 1 ½” (1.2 X 38 mm | Terumo | #18G | |
| Needles 20G X 1 ½” (0.9 X 38 mm | Terumo | #20G | |
| Needles 21G X 4 ¾” (0.8 X 120 mm | B.Braun | #466 5643 | |
| Parafilm | |||
| PBS | Life Technologies | #14190169 | |
| Penicillin-Streptomycin | Life Technologies | #15140130 | |
| pH-meter | |||
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma | #P7626 | PMSF powder is hazardous. Use skin and eye protection when preparing PMSF solutions. |
| PIPES | Sigma | #P6757 | |
| Pipette-boy | |||
| Rotors | Beckman 70.1 Ti; TLA-100.3; and TLA 55 | ||
| SDS-PAGE electrophoresis equipment | Bio-Rad | #1658001FC | |
| SDS, Sodium dodecyl sulphate | VWR | #442444H | For preparing Laemmeli buffer |
| SDS, Sodium dodecyl sulphate | Sigma | #L5750 | For preparing 'TUB' SDS-PAGE gels |
| Sonicator | Branson | #101-148-070 | Used for lysing cells grown as adherent cultures. Use 6.5 mm diameter probe, set the sonicator at “Output control” 1, “Duty cycle” 10% and time depending on the cell type used. |
| Tabletop centrifuge for 1.5 ml tubes | Eppendorf | 5417R | |
| TEMED, N, N, N′, N′-Tetramethylethylenediamine | Sigma | #9281 | |
| Trichostatin A (TSA) | Sigma | #T8552 | |
| Triton X-100 | Sigma | #T9284 | |
| Trizma base (Tris) | Sigma | #T1503 | |
| Trypsin | Life Technologies | #15090046 | |
| Ultracentrifuge rotors | TLA-55, TLA-100.3 and 70.1 Ti rotors | Set at 4°C or 30°C based on the need of the experiment | |
| Ultracentrifuge tubes | Beckman | #357448 | for using with TLA-55 rotor |
| Ultracentrifuge tubes | Beckman | #349622 | for using with TLA-100.3 rotor |
| Ultracentrifuge tubes | Beckman | #355631 | for using with 70.1 Ti rotor |
| Ultracentrifuges | Beckman | Optima L80-XP (or equivalent) and Optima MAX-XP (or equivalent) | Set at 4°C or 30°C based on the need of the experiment |
| Vortex mixer | |||
| Water bath equipped with floaters or tube holders | Set at 30°C |
参考文献
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Janke, C. The tubulin code: Molecular components, readout mechanisms, and functions. Journal of Cell Biology. 206 (4), 461-472 (2014).
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews: Molecular Cell Biology. 21 (6), 307-326 (2020).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Margolis, R. L., Wilson, L. Opposite end assembly and disassembly of microtubules at steady state in vitro. Cell. 13 (1), 1-8 (1978).
- Borisy, G. G., Olmsted, J. B. Nucleated assembly of microtubules in porcine brain extracts. Science. 177 (55), 1196-1197 (1972).
- Kirschner, M. W., Williams, R. C. The mechanism of microtubule assembly in vitro. Journal of Supramolecular Structure. 2 (2-4), 412-428 (1974).
- Baas, P. W., Lin, S. Hooks and comets: The story of microtubule polarity orientation in the neuron. Developmental Neurobiology. 71 (6), 403-418 (2011).
- Stepanova, T., et al. Visualization of microtubule growth in cultured neurons via the use of EB3-GFP (end-binding protein 3-green fluorescent protein). Journal of Neuroscience. 23 (7), 2655-2664 (2003).
- Nedelec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Bieling, P., Telley, I. A., Surrey, T. A minimal midzone protein module controls formation and length of antiparallel microtubule overlaps. Cell. 142 (3), 420-432 (2010).
- Roostalu, J., et al. Directional switching of the kinesin Cin8 through motor coupling. Science. 332 (6025), 94-99 (2011).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nature Materials. 14 (11), 1156-1163 (2015).
- Hendricks, A. G., Goldman, Y. E., Holzbaur, E. L. F. Reconstituting the motility of isolated intracellular cargoes. Methods in Enzymology. 540, 249-262 (2014).
- Dogterom, M., Surrey, T. Microtubule organization in vitro. Current Opinion in Cell Biology. 25 (1), 23-29 (2013).
- Vallee, R. B. Reversible assembly purification of microtubules without assembly-promoting agents and further purification of tubulin, microtubule-associated proteins, and MAP fragments. Methods in Enzymology. 134, 89-104 (1986).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Widlund, P. O., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Molecular Biology of the Cell. 23 (22), 4393-4401 (2012).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Letters. 587 (21), 3450-3455 (2013).
- Uchimura, S., et al. A flipped ion pair at the dynein-microtubule interface is critical for dynein motility and ATPase activation. Journal of Cell Biology. 208 (2), 211-222 (2015).
- Pamula, M. C., Ti, S. C., Kapoor, T. M. The structured core of human beta tubulin confers isotype-specific polymerization properties. Journal of Cell Biology. 213 (4), 425-433 (2016).
- Vemu, A., et al. Structure and dynamics of single-isoform recombinant neuronal Human tubulin. Journal of Biological Chemistry. 291 (25), 12907-12915 (2016).
- Ti, S. C., Alushin, G. M., Kapoor, T. M. Human beta-tubulin isotypes can regulate microtubule protofilament number and stability. Developmental Cell. 47 (2), 175-190 (2018).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nature Protocols. 14, 1634-1660 (2019).
- Barisic, M., et al. Microtubule detyrosination guides chromosomes during mitosis. Science. 348 (6236), 799-803 (2015).
- Nirschl, J. J., Magiera, M. M., Lazarus, J. E., Janke, C., Holzbaur, E. L. F. alpha-Tubulin tyrosination and CLIP-170 phosphorylation regulate the initiation of dynein-driven transport in neurons. Cell Reports. 14 (11), 2637-2652 (2016).
- Guedes-Dias, P., et al. Kinesin-3 responds to local microtubule dynamics to target synaptic cargo delivery to the presynapse. Current Biology. 29 (2), 268-282 (2019).
- Luo, Y., et al. Direct observation of dynamic protein interactions involving human microtubules using solid-state NMR spectroscopy. Nature Communications. 11 (1), 18(2020).
- Even, A., et al. ATAT1-enriched vesicles promote microtubule acetylation via axonal transport. Science Advances. 5 (12), 2705(2019).
- Wolff, J., Sackett, D. L., Knipling, L. Cation selective promotion of tubulin polymerization by alkali metal chlorides. Protein Science. 5 (10), 2020-2028 (1996).
- Magiera, M. M., et al. Excessive tubulin polyglutamylation causes neurodegeneration and perturbs neuronal transport. EMBO Journal. 37 (23), 100440(2018).
- Lacroix, B., Janke, C. Generation of differentially polyglutamylated microtubules. Methods in Molecular Biology. 777, 57-69 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Magiera, M. M., Janke, C. Methods in Cell Biology Vol. 115 Microtubules, in vitro. Correia, J. J., Wilson, L. , Academic Press. 247-267 (2013).
- Hausrat, T. J., Radwitz, J., Lombino, F. L., Breiden, P., Kneussel, M. Alpha- and beta-tubulin isotypes are differentially expressed during brain development. Developmental Neurobiology. , (2020).
- Janke, C., et al. Tubulin polyglutamylase enzymes are members of the TTL domain protein family. Science. 308 (5729), 1758-1762 (2005).
- Newton, C. N., et al. Intrinsically slow dynamic instability of HeLa cell microtubules in vitro. Journal of Biological Chemistry. 277 (45), 42456-42462 (2002).
- Belvindrah, R., et al. Mutation of the alpha-tubulin Tuba1a leads to straighter microtubules and perturbs neuronal migration. Journal of Cell Biology. 216 (8), 2443-2461 (2017).
- Breuss, M., et al. Mutations in the murine homologue of TUBB5 cause microcephaly by perturbing cell cycle progression and inducing p53 associated apoptosis. Development. , (2016).
- Latremoliere, A., et al. Neuronal-specific TUBB3 is not required for normal neuronal function but is essential for timely axon regeneration. Cell Reports. 24 (7), 1865-1879 (2018).
- Morley, S. J., et al. Acetylated tubulin is essential for touch sensation in mice. Elife. 5, (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。