Method Article
Очистка Тубулина с контролируемыми посттрансляционными модификациями и изотипами из ограниченных источников по циклам полимеризации-деполимеризации
В этой статье
Резюме
Этот протокол описывает очистку тубулина из малых/средних источников, таких как культурные клетки или мозг одной мыши, используя циклы полимеризации и деполимеризации. Очищенный тубулин обогащается в конкретных изотипах или имеет специфические посттрансляционные модификации и может быть использован в анализах восстановления in vitro для изучения динамики и взаимодействий микротрубочек.
Аннотация
Одним из важных аспектов исследований цитоскелета микротрубочек является исследование поведения микротрубочек в экспериментах по восстановлению в пробирке. Они позволяют анализ внутренних свойств микротрубочек, таких как динамика, и их взаимодействия с микротрубочками связанных белков (MAPs). "Трубулин код" является новой концепцией, которая указывает на различные изотипы тубулина и различные посттрансляционные модификации (ПТМ) в качестве регуляторов свойств и функций микротрубочек. Для изучения молекулярных механизмов кода тубулина крайне важно проводить эксперименты по восстановлению в пробирке с использованием очищенного тубулина с конкретными изотипами и ПТМ.
На сегодняшний день, это было технически сложной задачей, как мозг тубулин, который широко используется в экспериментах in vitro, гавани многих PTMs и имеет определенный состав изотипа. Поэтому мы разработали этот протокол для очистки тубулина из разных источников и с различными изотипными композициями и контролируемыми ПТМ, используя классический подход циклов полимеризации и деполимеризации. По сравнению с существующими методами, основанными на сродстве очистки, этот подход дает чистый, полимеризации компетентных тубулин, как тубулин устойчивы к полимеризации или деполимеризации отбрасывается в ходе последовательных шагов очистки.
Мы описываем очищение тубулина от клеточных линий, выращенных либо в суспензии, либо как культуры адептов, так и из мозгов одной мыши. Метод сначала описывает генерацию массы клеток как в условиях подвески, так и в настройках адепта, этап лиза, за которым следуют последовательные этапы очистки тубулина циклами полимеризации-деполимеризации. Наш метод дает тубулин, который может быть использован в экспериментах, касаясь влияния кода тубулина на внутренние свойства микротрубочек и микротрубочек взаимодействия с сопутствующими белками.
Введение
Микротрубоконы играют важную роль во многих клеточных процессах. Они придают клеткам свою форму, строят мейотические и митотические шпиндели для хромосомной сегрегации и служат следами внутриклеточного транспорта. Для выполнения этих разнообразных функций микротрубоконы организуются по-разному. Один из интригующих вопросов в этой области заключается в том, чтобы понять молекулярные механизмы, которые позволяют структурно и эволюционно сохраненных микротрубочек адаптироваться к этому множеству организаций и функций. Одним из потенциальных механизмов является диверсификация микротрубочек, которая определяется понятием, известным как «трубулин код»1,2,3. Код тубулина включает в себя два основных компонента: дифференциальное включение α- и β-тубулиных генных продуктов (трубулиновых изотипов) в микротрубобулы и трубулиновые посттрансляционные модификации (ПТМ).
С 1970-х годов эксперименты по восстановлению в пробирке, в сочетании с развивающимися методами световой микроскопии, проложили путь для важных открытий о свойствах микротрубочек:динамическая нестабильность 4 и беговая дорожка 5, иих другие механизмы и функции 6,7,8,9,10,11,12,13,14,15. Почти все эксперименты in vitro, выполненные до сих пор, были основаны на тубулине, очищенном от ткани мозга с использованием повторных циклов полимеризациии деполимеризации 16,17. Хотя очищение от ткани мозга дает преимущество получения высококачественного тубулина в больших количествах (обычно граммовых количествах), одним из важных недостатков является неоднородность, так как тубулин, очищенный из тканей мозга, представляет собой смесь различных тобулиных изотипов и обогащен многими тубулиными ПТМ. Такая неоднородность не позволяет разграничить роль конкретного тубулина PTM или изотипа в управлении свойствами и функциями микротрубочек. Таким образом, для решения молекулярных механизмов трубулинового кода необходимо производить сборочно-компетентный тубулин ПТМ и однородный изотипный состав.
Недавно был разработан подход к очищению тубулина с помощью хроматографии с использованием микротрубочек-связывающих TOG (опухолево-переэкспрессивного гена)дрожжейStu2p. В этом методе тубулин в сырых лизах клеток или тканей проходит через столбец, где он связывается с матрично-иммобилизованным доменом TOG, что позволяет анализ всего пула тубулина данного, даже очень маленького, образца. В последние годы также был описан долгожданный подход к очистке рекомбинантного тубулина. Он основан на бакуловирусной системе, в которой в клетках насекомых19α-β двухтубулиновых генов. Тем не менее, этот метод является очень громоздким и трудоемким и поэтому в основном используется для изучениявоздействия мутаций тубулина 20 и трубулинизотипов 21,22,23 in vitro.
В текущем протоколе мы описываем метод, который использует хорошо затвердевшей и широко используемый подход полимеризации-деполимеризации как план для генерации тубулина с различными уровнями модификации либо из клеточных линий, либо изткани мозга мыши 24. В этой процедуре тубулин циклически циклически проносят между растворимым (тубулиновый димер при 4 градусов по Цельсию) и полимеризованной формой (микротрубочка при 30 градусов по Цельсию при наличии гуанозина 5'-трифосфата (ГТП). Каждая форма отделяется последовательными шагами центрифугации: тубулинский димеры останутся в супернатанте после холодного (4 градусов по Цельсию) спина, в то время как микротрубоколы будут гранулироваться при 30 градусах Цельсия. Кроме того, один шаг полимеризации осуществляется при высокой концентрациипиперазина-N,N-бис(2-этанесульфоновая кислота) (PIPES), что позволяет удалить микротрубочные белки из микротрубочек и, таким образом, из окончательно очищенного тубулина. Тубулин очищены от HeLa S3 клетки, выращенные в качестве подвески или адепт культур практически не имеет каких-либо тубулин PTM и был использован в последние экспериментыэкстракорпорального восстановления 25,26,27,28. Мы также адаптировали метод очистки тубулина от мозгов одной мыши, который может быть использован для большого количества моделей мышей с изменениями в изотипах тубулина и ПТМ.
В протоколе мы сначала описываем генерацию исходных материалов (клеточной массы или мозговой ткани), его лиза(рисунок 1A),а затем последовательные шаги полимеризации тубулина и деполимеризации для очистки тубулина(рисунок 1B). Далее мы описываем процесс оценки чистоты(рисунок 2A,B)и количества(рисунок 3A,B) очищенного тубулина. Метод может быть адаптирован для производства тубулина, обогащенного выбранным PTM путем переэкспрессирования изменяемого фермента в клетках до очистки тубулина(рисунок 4B). Кроме того, в процессе очистки в тубулин можно добавить ферменты, изменяющие тубулин. Наконец, мы можем очистить тубулин без конкретных изотипов или ПТМ из мозга мышей, не хватает соответствующих тубулин-изменяющих ферментов (рисунок 4B)29.
Метод, который мы описываем здесь, имеет два основных преимущества: i) он позволяет за относительно короткое время произвести достаточно большое количество тубулина, и ii) он генерирует высококачественный, чистый тубулин, либо с специфическим составом изотипа тубулина, либо с ПТМ. В связанном видео этой рукописи мы подчеркиваем некоторые из важнейших шагов, связанных с этой процедурой.
протокол
Уход за животными и их использование для этого исследования были проведены в соответствии с рекомендациями Европейского сообщества (2010/63/UE). Экспериментальные процедуры были специально утверждены комитетом по этике Института Кюри CEEA-IC #118 (разрешение No 04395.03, данное Национальным органом) в соответствии с международными руководящими принципами.
1. Подготовка реагентов для очистки Тубулина
ПРИМЕЧАНИЕ: Все буферы, используемые для очистки тубулина должны содержать соли калия и не соли натрия30.
- Подготовка 1 л полной среды: модифицированный Eagle среднего Dulbecco (DMEM), с 10% плода бычьей сыворотки (FBS, 100 мл), 200 мМ L-глутамин (10 мл 2 М запасов), и 1x пенициллин-стрептомицин (10 мл 100x запасов). Хранить при 4 градусов по Цельсию.
- Приготовьте 10 М гидроксида калия (KOH) путем растворения 140 г KOH в воде, отрегулируйте конечный объем до 250 мл и храните при комнатной температуре.
- Приготовьте тетраакетную кислоту 0,5 М этилендиамина (ЭДТА), рН 8, растворив 36,5 г ЭДТА в воде, отрегулируйте рН до 8,0 с помощью KOH (иначе ЭДТА не растворится), а конечный объем до 250 мл, фильтр-стерилизовать и хранить при комнатной температуре.
- Приготовьте 5 мМ фосфат-буферный солевой раствор (PBS)-EDTA, добавив 5 мл 0,5 М EDTA до 500 мл PBS, фильтр-стерилизовать, и хранить при комнатной температуре.
- Приготовьте 0,5 М K-PIPES, рН 6.8, растворив 75,5 г PIPES в воде, отрегулируйте до рН 6.8 с KOH (иначе PIPES не растворится) и окончательный объем до 500 мл, фильтр-стерилизовать, и хранить при 4 градусах Цельсия.
- Приготовьте 1 М K-PIPES, рН 6.8, растворив 15,1 г PIPES в воде, отрегулируйте до рН 6,8 с KOH и конечный объем до 50 мл, фильтр-стерилизовать, и хранить при 4 градусах Цельсия.
- Подготовка 0,5 М калия-этиленгликоль-бис (β-аминоэтиловый эфир)-N,N, N, N, N-тетраацетическая кислота (K-EGTA, рН 7,7) путем растворения 47,5 г EGTA в воде, настроить до рН 7,7 с KOH и конечный объем до 250 мл, фильтр-стерилизовать, и хранить в комнате температуры.
- Подготовка BRB80 (80 мММ K-PIPES, рН 6,8; 1 мМ К-ЕГТА; 1 мм магниевогохлорида «MgCl 2»)раствор путем смешивания 3,2 мл 0,5 М PIPES, 40 МКЛ 0,5 М К-ЕГТА и 20 л 1 М МгКл2 и отрегулируйте конечный объем до 20 мл. Хранить при 4 градусов по Цельсию.
- Подготовка 0,1 М фенилметанесульфонил фторид (PMSF) путем растворения 435 мг ПМСФ в изопропаноле, чтобы получить окончательный объем 25 мл и хранить при -20 градусов по Цельсию.
- Подготовка ингибиторы протеазы смесь (200x) путем растворения 10 мг апротинина, 10 мг лейпептина, и 10 мг 4-(2-аминоэтил)-бензенсульфонил фторид в воде, чтобы получить окончательный объем 2,5 мл, сделать aliquots 100 йл, и хранить при -20 градусов по Цельсию.
- Приготовьте 10% Triton X-100, смешивая 5 мл Triton X-100 в 45 мл воды, фильтр-стерилизовать и хранить при комнатной температуре.
- Подготовка буфера лиза (BRB80, дополненный 1 мМ 2-меркаптоэтанол, 1 мМ ПМСФ, 1x ингибиторы протеазы и, по желанию для клеток HEK-293, 0,2% Triton X-100) в день очистки тубулина путем смешивания 20 мл BRB80 с 1,5 МЛ 2-меркаптоэтанола, 200 МЛ 0,1 М PMSF, 100 йл ингибиторов протеазы смеси и, по желанию для HEK-293 клеток , 400 МКЛ 10% Тритон X-100.
ПРИМЕЧАНИЕ: 2-меркаптоэтанол является токсичным и должны быть использованы в дым капот. - Приготовьте 0,2 М ГТП, растворив 1 г ГТП в 9,5 мл воды, отрегулируйте рН до 7,5 с помощью KOH, сделайте алициты по 20 МЛ и храните при -20 градусах Цельсия. Избегайте повторных циклов замораживания-оттепели.
- Подготовка 1 M tris (гидроксиметил) аминометан-гидрохлорид (Tris-HCl) путем растворения 60,56 г Триса в воде, настроить до рН 6,8 с HCl, в комплекте с окончательным объемом 500 мл, фильтр-стерилизовать, и хранить при комнатной температуре.
- Подготовка 5x Лаеммли образец буфера (450 мМм дитиотрейтол (DTT); 10% додекилульфат натрия (SDS); 400 МКМ Трис-HCl, рН 6,8; 50% глицерол; 0,006% бромофено-голубой) путем добавления 4 г SDS до 16 мл предварительно разогретого 1 M Tris-HCl, pH 6.8, и смешать раствор мягко. Добавить 2,6 г DTT и 20 мл 100% глицерола в смесь и перемешать, пока раствор не станет однородным. Добавьте нужное количество бромофено-голубого (2,5 мг), чтобы достичь требуемой интенсивности цвета. Сделать 5 мл aliquots и хранить при -20 градусов по Цельсию. Подготовь 2x рабочий раствор буфера образца Laemmli путем разбавления 5x бульона в дистиллированной воде.
2. Источники усиления и сбора тубулина
ПРИМЕЧАНИЕ: В этом протоколе были использованы три источника тубулина: i) клетки (HeLa S3 и HEK-293), выращенные как культуры подвески; ii) клетки, выращенные как культуры адептов (HEK-293, HeLa и U2 OS); и iii) ткани мозга мыши. Этот протокол рассматривает день очистки тубулина как "день 0" и, соответственно, другие шаги были описаны по отношению к 0-му дню.
- Усиление ячеек
- Клетки, выращенные как культуры подвески
ПРИМЕЧАНИЕ: Для успешного очищения тубулина от культур подвески используйте не менее 2 л культуры подвески.- Для 2 l культуры подвески, оживить и вырастить предпочтительный тип клетки, чтобы получить 6 × 107 клеток за 10 дней до дня подготовки. Днем -10, пластины клетки на шесть 15 см в диаметре блюда на 107 клеток на тарелку.
- Днем -8, разогреть необходимое количество полного среднего до 37 градусов по Цельсию. Добавьте 1 л предварительно разогретой среды к каждой бутылке спиннера в стерильных условиях. Поместите спиннеры на перемешивают стол, установленный на 20-25 об / мин внутри инкубатора культуры клеток, слегка откройте боковой спиннер шапки, чтобы среда равномерный в атмосферу инкубатора.
ПРИМЕЧАНИЕ: Чтобы избежать загрязнения, тщательно очистить внешнюю поверхность средств массовой информации и спиннер бутылки с использованием 70% этанола. - На день -7, трипсилизовать и собирать клетки выросли до 80-90% слияния (примерно 1,8 × 108 клеток). Соберите клетки из 3 блюд одновременно, вращайся вниз (200 × г,5 мин, комнатная температура) и повторно приостанавливай все клетки в 10 мл DMEM.
ПРИМЕЧАНИЕ: Тщательная диссоциация клеток на данный момент очень важно, чтобы избежать образования больших агрегатов в спиннер бутылки, которая влияет на выживание клеток и приводит к низкой урожайности тубулина. - Добавьте 5 мл клеточной подвески к каждой бутылке спиннера, содержащей 1 л DMEM, верните спиннеры к столу мешалки в инкубаторе культуры клеток и позвольте клеткам расти в течение одной недели.
- Клетки, выращенные как адепт культуры
ПРИМЕЧАНИЕ: Чтобы успешно очистить тубулин от адептов клеток, используйте как минимум 10 блюд 80-90% слияния.- Оживить и усилить желаемый тип клетки, чтобы получить 1 × 108 клеток за три дня до дня приготовления тубулина.
- На день -3, пластины этих клеток на десять 15 см посуды на 1 × 107 клетокна блюдо и позволяют им расти 80-90% слияния.
- На день -1, при необходимости, трансфектные клетки с плазмидой, чтобы выразить трубулин-изменяющий фермент или определенный изотип тубулина.
- Клетки, выращенные как культуры подвески
- Сбор клеток/мозговой ткани
- Клетки, выращенные как культуры подвески
- Передача клеточной суспензии из спиннеров в 1 л центрифуг бутылки(таблица материалов)и гранулы клетки на 250 × г, 15 мин, комнатная температура. Для немедленного начала другой культуры HeLa S3 клеток в спиннер бутылки, оставить 100 мл клеточной подвески в спиннеры, и добавить 1 л полной, предварительно нагретой DMEM в бутылку спиннера.
ПРИМЕЧАНИЕ: Тщательно проверьте на бактериальное загрязнение, прежде чем приступить к очистке тубулина. - Resuspend гранулированные клетки из каждой бутылки центрифуги в 10 мл ледяной PBS, и передать все клетки в 50 мл винт-шапка труб. Во время повторной суспензии держите клетки на льду. Пеллет клетки при 250 × г,15 мин, 4 градусов по Цельсию.
ПРИМЕЧАНИЕ: Следуйте рекомендациям по очистке и хранению бутылок спиннера (см. таблицу материалов). - Откажитесь от супернатанта и определите объем клеточной гранулы. От 2 л культуры подвески (две бутылки спиннера), ожидать ячейки гранулы 5-6 мл.
ПРИМЕЧАНИЕ: В протоколе, описанной ниже, объем гранул клетки, как предполагается, составляет 10 мл. Отрегулируйте эксперимент в соответствии с объемами гранул. - Добавьте 1 том (10 мл) буфера лиза и повторно приостановит ячейку гранулы.
ПРИМЕЧАНИЕ: Соотношение объема клеточных гранул к объему буфера лиза очень важно для успешной очистки тубулина. Добавление дополнительного буфера лиза снижает концентрацию тубулина, которая затем не достигает критической концентрации, необходимой для полимеризации, тем самым значительно снижая урожайность тубулина.
ПРИМЕЧАНИЕ: Клетки, повторно засыкаемые в буфере лиза, могут быть заморожены в жидком азоте и храниться при -80 градусов по Цельсию в течение двух месяцев.
- Передача клеточной суспензии из спиннеров в 1 л центрифуг бутылки(таблица материалов)и гранулы клетки на 250 × г, 15 мин, комнатная температура. Для немедленного начала другой культуры HeLa S3 клеток в спиннер бутылки, оставить 100 мл клеточной подвески в спиннеры, и добавить 1 л полной, предварительно нагретой DMEM в бутылку спиннера.
- Клетки, выращенные как адепт культуры
ПРИМЕЧАНИЕ: Клетки из культур приверженцев должны быть собраны очень быстро для успешной очистки тубулина (примерно 15 минут для сбора десяти 15 см посуды). В этом этапе протокола приняли участие три человека.- Удалите среду из 15 см посуды путем наклона посуды, а затем аккуратно промыть клетки с 7 мл PBS-EDTA при комнатной температуре (человек 1). Работайте только с тремя 15 см посуды в то время, чтобы избежать выхода из клеток без среднего или буфера.
- Добавьте 5 мл PBS-EDTA в клетки и инкубировать их в течение 5 минут при комнатной температуре.
- Используйте сотовый подъемник, чтобы аккуратно отсоединить клетки, лопатой их к одному краю блюда (человек 2), и собрать все клетки в 50 мл винт-шапка трубки (человек 3). Промыть каждую тарелку дополнительными 2 мл PBS-EDTA, чтобы собрать оставшиеся клетки из посуды. Во время этого шага держите 50 мл винт-шапка трубки, содержащей подвеску клетки на льду.
- Пеллет клетки при 250 × г,10 мин, 4 градусов по Цельсию. Откажитесь от супернатанта и определите объем клеточной гранулы. Ожидайте объем 1 мл от десяти 15 см посуды.
ПРИМЕЧАНИЕ: В протоколе, описанной ниже, объем гранул клетки, как предполагается, составляет 10 мл. Отрегулируйте эксперименты в зависимости от объемов гранул. - Повторное увеличение ячеек в 1 томе (10 мл) буфера лиза.
ПРИМЕЧАНИЕ: Ячейки, повторно засыкаемые в буфере лиза, могут храниться при -80 градусов по Цельсию в течение двух месяцев.
- Ткань мозга
ПРИМЕЧАНИЕ: Мыши любого возраста, пола или генетического происхождения могут быть использованы. Выбор трансгенного штамма мыши будет зависеть от научного вопроса, который необходимо решить. В этой рукописи мы покажем пример тубулина, очищенного от ttll1-/- мыши, не хватает основного фермента глутамилации мозга, тубулина тирозина лигазы, как 1 (TTLL1)белка 31.- Пожертвуй мышью при вывихе шейки матки, быстро обезглавите и соберите мозг в круглую нижнюю трубку. Если есть избыток крови на мозг, быстро мыть с лиза буфера. Соберите мозг, как только мышь принесена в жертву, как посмертная задержка может повлиять на успех очистки тубулина. Используйте трубы с круглым дном для размещения ширины зонда, используемого для гомогенизации.
ПРИМЕЧАНИЕ: Собранные мозги мыши могут быть snap-frozen в жидком азоте и хранить на -80 C на up to 3 лет. - Добавьте 500 МКЛ буфера лиза в один мозг, извлеченный из взрослой мыши. Для остальной части протокола объем добавленного буфера лиза предполагается 10 мл. Отрегулируйте для вашего эксперимента в зависимости от количества мозгов, которые будут использоваться.
- Пожертвуй мышью при вывихе шейки матки, быстро обезглавите и соберите мозг в круглую нижнюю трубку. Если есть избыток крови на мозг, быстро мыть с лиза буфера. Соберите мозг, как только мышь принесена в жертву, как посмертная задержка может повлиять на успех очистки тубулина. Используйте трубы с круглым дном для размещения ширины зонда, используемого для гомогенизации.
- Клетки, выращенные как культуры подвески
3. Лиз клеток или тканей мозга
- Клетки, выращенные как культуры подвески
- Для HEK-293, лизировать клетки на льду, повторно трубопроводов вверх и вниз с помощью пипетки советы различной ширины. Во-первых, прикрепите наконечник p1000 к 10 мл пипетки, и пипетка подвески ячейки вверх и вниз каждые 5 минут, в течение 10 минут (три цикла пипетки). Во-вторых, приложите наконечник p200 к кончику p1000 и далее пипетку каждые 5 минут, в течение 20 минут (пять циклов пипетки).
- Для HeLa S3, подышечные клетки с помощью французской прессы (см. Таблицу материалов для настроек).
- Возьмите 1/100й том смеси лиза (L) (200 л для 20 мл L), и добавить тот же объем 2x laemmli буфера, кипятить в течение 5 минут, и хранить при -20 градусов по Цельсию для дальнейшего анализа.
- Клетки, выращенные как адепт культуры
- Перенесите клетки в 14 мл круглой нижней трубки, высота которой была уменьшена для размещения зонда sonicator (см. Таблицу материалов для настроек). Sonicate клетки для 45 импульсов, и подтвердить лиз клеток путем отбора проб капли лиза смесь под микроскопом.
ПРИМЕЧАНИЕ: Количество импульсов может варьироваться в зависимости от типа клеток, используемых для очистки тубулина. Sonicating клетки слишком много может привести к тубулин осадков и негативно повлияет на урожайность очистки. - Pipette клетки вверх и вниз по льду каждые 5 минут в течение 20 минут (пять циклов пипетки), используя p200 отзыв.
- Возьмите 1/100-й том смеси лиза (L) (200 л для 20 мл L) и добавьте тот же объем 2x буфера Laemmli, кипятите в течение 5 минут и храните при -20 градусов по Цельсию для дальнейшего анализа.
- Перенесите клетки в 14 мл круглой нижней трубки, высота которой была уменьшена для размещения зонда sonicator (см. Таблицу материалов для настроек). Sonicate клетки для 45 импульсов, и подтвердить лиз клеток путем отбора проб капли лиза смесь под микроскопом.
-
Ткань мозга
- Излишейте ткани мозга с помощью тканевого блендера (см. Таблицу материалов для настроек). Кроме того, подлизать ткани с помощью микротрубки пестик или эквивалентное оборудование и пипетки вверх и вниз по льду с 1 мл шприц с иглой 18 G.
- Возьмите 1/100й том смеси лиза (L) (200 л для 20 мл L), и добавить тот же объем 2x laemmli буфера, кипятить в течение 5 минут, и хранить при -20 градусов по Цельсию для дальнейшего анализа.
4. Очистка Тубулина
- Лисейт разъяснения
- Очистите лизат (разделяя гранулы и растворимую долю смеси лиза) центрифугой при 150 000 × г,4 градусов по Цельсию, 30 мин. Подробнее о роторах и трубках ultracentrifuge можно узнать за таблицей материалов. Для клеточных экстрактов после центрифугации часто образуется белый плавающий слой. Не переносите этот плавающий слой вместе со супернатантом, так как он мешает полимеризации тубулина. Используйте шприц соответствующего объема, прикрепленный к длинной игле 20 G или 21 G, чтобы аккуратно удалить супернатант, не нарушая плавающий слой. Если супернатант по-прежнему облачно, центрифуга на 5000 × г,4 градусов по Цельсию в течение 10 мин.
- Перенесите супернатант (SN1) в ультрацентрифугную трубку и обратите внимание на ее объем. Для гранулы 10 мл клеток, ожидать объем 12 мл для SN1.
- Возьмите 1/100-й том SN1 (120 л для 12 мл SN1), и добавить тот же объем 2x laemmli буфера, кипятить в течение 5 минут, и хранить при -20 градусов по Цельсию для дальнейшего анализа.
- Повторное использование гранул (P1) в BRB80(Таблица материалов)с использованием того же объема, что и SN1. Возьмите 1/100-й том P1 (200 л для 20 мл P1), и добавить тот же объем 2x буфера Laemmli, кипятить в течение 5 мин, и хранить при -20 градусов по Цельсию для дальнейшего анализа.
- Первая полимеризация в буфере с низким содержанием моли
- Подготовьте смесь полимеризации, объединив 1 том SN1 (12 мл), 1/200-й объем 0,2 М GTP (60 МКЛ; окончательная концентрация 1 мМ) и 0,5 тома предварительно нагретого глицерола (6 мл) в винтовой крышке трубки соответствующего объема.
ПРИМЕЧАНИЕ: Глицерол используется в качестве скученного агента в шагах полимеризации на протяжении всего протокола и, таким образом, не рассматривается при расчетах концентраций других компонентов. - Pipette смешивать вверх и вниз, осторожно избегая образования пузырьков воздуха и передать его в соответствующие ультрацентрифуг трубки.
ПРИМЕЧАНИЕ: При переносе смеси в трубки, настроить вес труб (в парах). Это позволяет экспериментатору непосредственно переходить к осадочных микротрубочкам после шага полимеризации. Сделай это для всех шагов полимеризации на протяжении всего протокола. - Обложка трубки с парафильмом, передача на водяную баню при 30 градусов по Цельсию, и инкубировать в течение 20 минут.
- Центрифуга труб при 150 000 ×, 30 градусов по Цельсию в течение 30 мин. Удалите супернатант (SN2) и держите гранулы полимеризованных микротрубочек (P2).
ПРИМЕЧАНИЕ: Гранулы microtubule могут быть застыли и хранятся при -80 градусов по Цельсию на срок до 1 года. - Возьмите 1/200-й том SN2 (90 л для 18 мл SN2) и добавьте тот же объем 2x буфера Laemmli, кипятите в течение 5 минут, и храните при -20 C для дальнейшего анализа.
- Подготовьте смесь полимеризации, объединив 1 том SN1 (12 мл), 1/200-й объем 0,2 М GTP (60 МКЛ; окончательная концентрация 1 мМ) и 0,5 тома предварительно нагретого глицерола (6 мл) в винтовой крышке трубки соответствующего объема.
- Первая деполимеризация
- Деполимеризируйте микротрубочные трубы, добавляя ледяной BRB80 в гранулы P2, и оставьте на льду на 5 мин: для тубулина из клеток добавьте 1/60 тыс. (200 МКЛ), а для тубулина из мозга добавьте 1/20тыс. (600 МЛ) объема SN1.
ПРИМЕЧАНИЕ: Объем ледяного BRB80, добавленного в гранулы во время шагов по деполимеризации, всегда относительно объема SN1. - Аккуратно перерасходуйте гранулы микротрубочек, избегая пузырьков воздуха, пока раствор не станет полностью однородным. Используйте наконечник p1000 в течение нескольких циклов пипетки следуют p200 отзыв каждые 5 минут, в течение 20 минут (пять циклов пипетки). Это важный шаг для успеха очистки тубулина.
- Перенесите раствор в соответствующие ультрацентрифуговые трубки и вращайся вниз при 150 000 × г,4 градусов по Цельсию в течение 20 мин. Перенесите SN3 на новую ультрацентрифугную трубку 1,5 мл. Гранулы, образоваваемые после этого шага центрифугации (P3), содержат осажденные белки (микробубуль-ассоциированные белки или MAPs) и недеполимерированные микротрубоколы. Супернатант (SN3) содержит растворимые компоненты: деполимеризованные тубулиные димеры и МАПы, которые отделились от деполимеризованных микротрубочек.
- Возьмите 1-4 л SN3 и добавьте 9 томов 2x буфера Laemmli, варите 5 минут и храните при -20 градусах цельсия для дальнейшего анализа.
- Resuspend гранулы P3 в BRB80 (в том же объеме SN3), принять 1-4 л, и добавить 9 томов 2x Laemmli буфера, кипятить в течение 5 минут, и хранить при -20 градусов по Цельсию.
- Деполимеризируйте микротрубочные трубы, добавляя ледяной BRB80 в гранулы P2, и оставьте на льду на 5 мин: для тубулина из клеток добавьте 1/60 тыс. (200 МКЛ), а для тубулина из мозга добавьте 1/20тыс. (600 МЛ) объема SN1.
- Вторая полимеризация (в буфере высокой молити)
- Подготовьте смесь полимеризации, объединив 1 том SN3 (200 МКЛ), 1 том предварительно нагретых 1 M PIPES (200 МКЛ, окончательная концентрация 0,5 М), 1/100-й объем 0,2 М ГТП (2 МКЛ, окончательная концентрация 1 мМ) и 1 том предварительно нагретого глицерола (200 МКЛ) в трубке соответствующего объема.
- Pipette смешивать вверх и вниз, избегая образования пузырьков воздуха, и передать его в ультрацентрифуг труб.
- Обложка трубки с parafilm, передать их на водяную баню, установленную при 30 градусов по Цельсию, и инкубировать в течение 20 минут.
- Центрифуга труб при 150 000 г ×,30 градусов по Цельсию в течение 30 мин. Удалите супернатант (SN4) и храните гранулы полимеризованных микротрубочек (P4). Гранулы P4 содержат полимеризованные микротрубоконы, а супернатант SN4 содержит неполимеризованный тубулин, МАПы и другие растворимые белки.
ПРИМЕЧАНИЕ: Гранулы микротрубочек после второго шага полимеризации могут быть заморожены и храниться при -80 градусов по Цельсию на срок до 1 года. - Возьмите 1-4 Л и добавьте 9 томов 2x буфера Laemmli, кипятите в течение 5 минут и храните при -20 градусах по Цельсию для дальнейшего анализа.
- Вторая деполимеризация
- Деполимеризировать микротрубочные трубы, добавляя ледяной BRB80 в гранулу P4, и оставить на льду на 5 мин: для тубулина из клеток, добавить 1/100тыс. (120 МКЛ), а для тубулина из мозга, добавить 1/40тыс. (300 йл) объема SN1.
- Pipette вверх и вниз с p200 отзыв каждые 5 минут, в течение 20 минут (пять циклов трубопроводов).
- Перенесите раствор в 1,5 мл ультрацентрифуг трубки, и спина вниз на 150000 × г, 4 КК в течение 20 мин. Перенесите SN5 на новую ультрацентрифугную трубку 1,5 мл. Гранулы, образоваваемые после этого шага центрифугации (P5), содержат недесполимерированные микротрубоконы. Супернатант (SN5) содержит растворимый тубулин.
- Возьмите 1-4 Л и добавьте 9 томов 2x буфера Laemmli, кипятите в течение 5 минут и храните при -20 градусах по Цельсию для дальнейшего анализа.
- Resuspend гранулы P5 в BRB80 (тот же объем SN5), принять 1-4 л, и добавить 9 томов 2x Laemmli буфера, кипятить в течение 5 минут, и хранить при -20 градусов по Цельсию для дальнейшего анализа.
- Третья полимеризация (в буфере с низким уровнем молити)
- Подготовьте смесь полимеризации: 1 том SN5 (120 МКЛ), 1/200-й том 0,2 М ГТП (0,6 МКЛ, окончательная концентрация 1 мМ) и 0,5 тома предварительно нагретого глицерола (60 КЛ) в трубке соответствующего объема.
- Pipette смешивать вверх и вниз, мягко избегая образования пузырьков воздуха, и передать его в соответствующие ультрацентрифуг трубки.
- Обложка трубки с parafilm, передать их на водяную баню, установленную при 30 градусов по Цельсию, и инкубировать в течение 20 минут.
- Центрифуга труб при 150 000 г ×,30 градусов по Цельсию в течение 30 мин. Гранулы (P6) содержат полимеризованные микротрубоконы, а супернатант SN6 содержит небольшое количество небер полимеризованного тубулина.
ПРИМЕЧАНИЕ: Гранулы microtubule могут быть snap-frozen и храниться при -80 градусов по Цельсию на срок до 1 года. - Возьмите 1-4 Л и добавьте 9 томов 2x буфера Laemmli, кипятите в течение 5 минут и храните при -20 градусах по Цельсию для дальнейшего анализа.
- Третья деполимеризация
- Деполимеризируйте микротрубочные трубы, добавляя ледяной BRB80 в гранулу P6, и оставьте на льду на 5 минут: для тубулина из клеток добавьте 1/100тыс. (120 МКЛ), а для тубулина из мозга добавьте 1/40тыс. (300 йл) объема SN1.
- Pipette вверх и вниз с p200 отзыв каждые 5 минут, в течение 20 минут (пять циклов трубопроводов).
- Перенесите раствор в соответствующие ультрацентрифуговые трубки и вращайся вниз при 150 000 × г,4 градусов по Цельсию в течение 20 мин. Перенесите SN7 на новую ультрацентрифугную трубку 1,5 мл. Гранулы (P7) содержат небольшое количество неразгладимых микротрубочек. Супернатант (SN7) содержит исключительно деполимеризованные микротрубоконы (растворимый тубулин).
- Возьмите 1-4 Л и добавьте 9 томов 2x буфера Laemmli, кипятите в течение 5 минут и храните при -20 градусах по Цельсию для дальнейшего анализа.
- Resuspend гранулы P7 в BRB80 (тот же объем SN7), принять 1-4 л, и добавить 9 томов 2x Laemmli буфера, кипятить в течение 5 минут, и хранить при -20 градусов по Цельсию для дальнейшего анализа.
- Количественная оценка количества тубулина (см. результаты представителя)и aliquot SN7 в небольших объемах, snap-freeze, и хранить при -80 градусов по Цельсию.
Результаты
Основной целью этого метода является производство высококачественных, сборочных трубулинов в количествах, достаточных для проведения повторных экспериментов в пробирке с очищенными компонентами. Микротрубоконы, собранные из этого тубулина, могут быть использованы в анализах восстановления на основе общей внутренней рефлексии флуоресценции (TIRF) микроскопии с динамической или стабильной микротрубочек, в экспериментах тестирования микротрубочек динамики, взаимодействия с MAPs или молекулярных двигателей, исилы генерации двигателей 25. Они также могут быть использованы в микротрубочках-MAP совместно гранулирования анализы и твердотельной спектроскопии ЯМР28.
Обогащение и чистота тубулина на протяжении всего процесса очистки можно контролировать с помощью coomassie окрашенных SDS-полиакриламид гель электрофорез (PAGE) гель, предпочтительно 'TUB' SDS-PAGE гели, которые позволяют для разделения α- и β-тубулины, которые совместно мигрируют в качествеодной полосы в классических гелях 32. Лизаты, собранные на разных этапах (кроме последней деполимеризации, см. протокол) загружаются на гель в сопоставимых количествах для оценки успеха очистки тубулина(рисунок 2A)24. Окончательный образец тубулина, который очень ценен, загружается только на гель для определения концентрации тубулина. Нормально терять тубулин в процессе повторных циклов полимеризации и деполимеризации. Более низкая, чем ожидалось, доходность конечного очищенного тубулина может быть обусловлена либо (i) неполной деполимеризацией микротрубочек, визуализировано наличием значительного количества тубулина в фракциях P3, P5 и P7, или (ii) неэффективной полимеризации тубулина в микротрубоконы, и в этом случае меньшее количество тубулина присутствует в фракциях P2, P4, и P6 и выше в фракциях SN2, SN4 и SN6 (Рисунок 2B). Если тубулин теряется во время полимеризации (меньшее количество P2 и P4) i) обеспечивает достаточную концентрацию тубулина во время полимеризации (ii) используйте свежий алицит GTP, и/или (iii) подтверждает температуру реакции полимеризации. Если тубулин теряется во время шагов деполимеризации (меньшее количество SN3 и SN5), увеличьте время, а также трубоупотерю смеси на льду.
Для количественной оценки очищенного тубулина, запустите образцы вместе с известными количествами альбумин сыворотки крупного рогатого скота (BSA, 0,5 мкг - 1 мкг - 2 мкг - 4 мкг) (Рисунок 3A) на SDS-PAGE. Гели окрашены в блестящий синий, отсканированный, и интенсивности полос BSA и тубулин измеряются количественной денситометрии(рисунок 3B), как описано в https://openwetware.org/wiki/Protein_Quantification_Using_ImageJ. Пожалуйста, обратите внимание, что тот же анализ может быть сделано на Фиджи, обновленная версия ImageJ33. Значения из полос BSA были использованы для определения линейного уравнения регрессии, которое использовалось для расчета количества белка в тубулиновых полосах. Для определения концентрации тубулина используются только интенсивности тубулиновой полосы в пределах кривой BSA. На основе расчетной концентрации тубулина готовятся алициты желаемых объемов тубулина, застывают в жидком азоте и хранят при -80 градусах Цельсия. Обычно мы получаем около 2 мг тубулина из четырех бутылок спиннеров культур подвески HeLa S3 (15 г клеток), 250 мкг тубулина из десяти блюд диаметром 15 см (1,2 г клеток) и 1 мг тубулина из 1 г ткани мозга мыши.
Для подтверждения обогащения конкретного изотипа тубулина или модификации, 0,1 мкг очищенного тубулина может быть иммуноблоттирован с использованиемсоответствующих антител 34,35. Контрольный тубулин будет варьироваться в зависимости от тубулина интереса. Для тубулина, модифицированного в пробирке с изменяющий фермент, используйте необработаемый тубулин в качестве контроля. Для тубулина, модифицированного в целлюлозе путем переэкспрессии изменяемого фермента, используйте тубулин, очищенный от клеток, которые не выражают фермент вкачестве контроля (рисунок 4A). Контроль тубулина для тубулина, очищенного от мозгов нокаут-мышей, будет тубулином от диких мышей типа(рисунок 4B). Во всех иммуноблотических анализах равная нагрузка тубулина проверяется с помощью PTM-независимого анти-α-тубулина антитела (12G10).
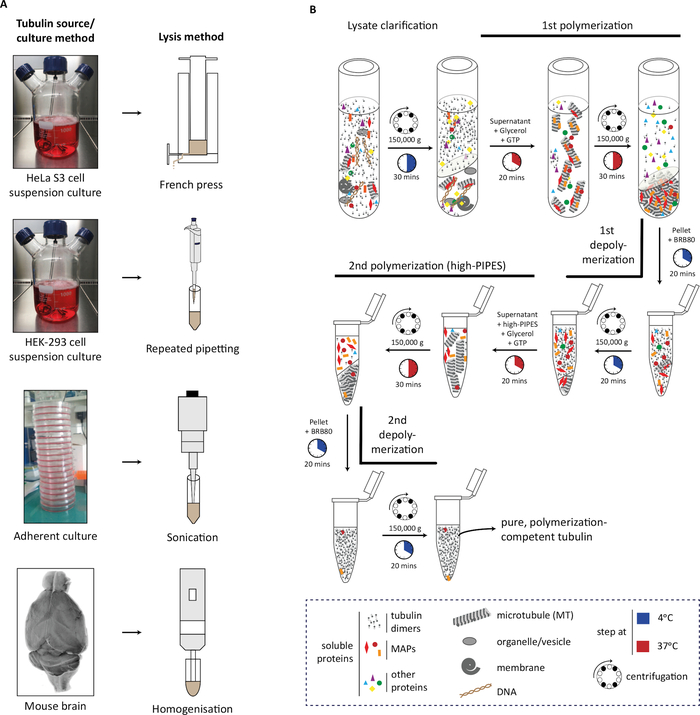
Рисунок 1: Очистка Тубулина из различных источников с использованием циклов полимеризации-деполимеризации. (A)Различные источники тубулина лизулин с использованием конкретных стратегий. Клетки HeLa S3, обувядемые подвеской, подслались с помощью французской прессы; Клетки HEK-293 окаймливания повторяющимися трубами. Приверженцы клетки были лизированы с помощью коротких импульсов sonication и мыши ткани мозга с помощью гомогенизатора тканей. (B)Схематическое представление последовательных этапов протокола очистки тубулина с использованием циклов холодо-деполимеризации и теплополимизации. После лиза и лизатного прояснения микротрубоконы полимеризуются и гранулируются. Микротрубочные батареи затем деполимеризируются и впоследствии допускаются к полимеризации в буфере высокой молярности, предотвращая совместное осаждение микробубульного белка (MAP) с микротрубочками. Микротрубоконы, свободные от MAP, затем деполимеризируются и могут быть дополнительно подвергнуты третьему циклу полимеризации-деполимеризации для удаления следов большого буфера молярности. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Оценка успеха очистки тубулина. Образцы, собранные на разных этапах протокола очистки тубулина, были запущены на геле «TUB» додекилсульфат-полиакриламид гель (SDS-PAGE) гель (см. протокол для деталей) и окрашены блестящим синим цветом Кумасси. (A)В успешной очистке тубулина, α- и β-тубулины постепенно обогащаются на протяжении всего процесса. После второй полимеризации гранулы микротрубочек (P4) практически не могут быть загрязнены другими белками или микробубульными белками (MAPs). Обратите внимание, что это нормально потерять некоторые тубулин во время процедуры. (B)При неудачной очистке тубулина окончательный выход тубулина низок, а тубулин остается либо в грануле после деполимеризации, либо в супернатанте после полимеризации (красные ящики). В приведенном здесь примере тубулин не полимеризируется эффективно в обоих этапах полимеризации. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Количественная оценка очищенного тубулина с использованием геля и денситометрии, окрашенного натрием додекилсульфата-полиакриламинида геля (SDS-PAGE). (A) Coomassie-окрашенные SDS-PAGE гель с известным количеством бычьей сыворотки альбумин (BSA; 0,5, 1, 2 и 4 мкг, серый градиент линии) и различных томов (0,5 и 1 Л, светлые и темные цвета, соответственно) очищенных тубулина. В показанном примере на гель были загружены тирозинированный тубулин (HeLa S3 тубулин, светло-оранжевый) и дезирозированный тубулин (HeLa S3 tubulin, обработанный карбоксипептидазом А, светлым и темно-синим). (B) BSA полосы из (A) были количественно с помощью ImageJ (в произвольных единиц, АС) и построены против количества белка загружены (серый до черных точек). Эти точки использовались для расчета линейной линии регрессии (серая градиентная линия) и уравнения, которые использовались для расчета количества белка в образцах тубулина (светлых и темно-оранжевых и синих точек), загруженных на гель. Это облегчило расчет концентрации образцов тубулина. Обратите внимание, что точки, которые лежат за пределами стандартной кривой BSA, не должны использоваться для определения концентрации (темно-оранжевые и синие точки). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
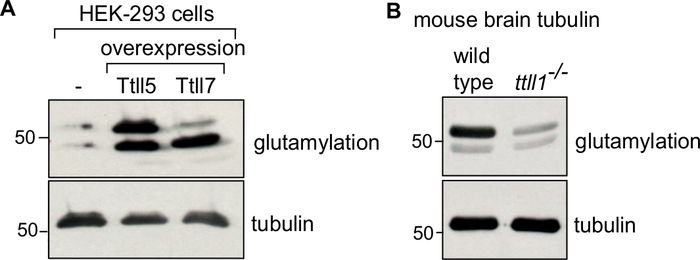
Рисунок 4: Иммуноблотный анализ очищенного тубулина с различными ПТМ. (A)Тубулины, очищенные от клеток HEK-293: дикого типа, или клетки, переэкспрессивные TTLL5 или TTLL7, были проанализированы для специфического обогащения полиглутамиляции с помощью антител GT335. В то время как переэкспрессия TTLL5 увеличивает α- и β-тубулина, переэкспрессия TTLL7 специально обогащает β-тубулиновую глутамиляцию. (B)Тубулин очищается от тканей мозга дикого типа и ttll1-/- мышей были проанализированы для моделей глутамилирования. Обратите внимание на сильное снижение полиглутамилляции тубулина от ttll1-/- мышей, которым не хватает основной глутамилазы мозга TTLL136. Гели «TUB» использовались для α- и β-тубулина. Равное количество трубулиновой нагрузки было подтверждено 12G10, анти-α-тубулин антитела. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Описанный здесь метод обеспечивает платформу для быстрого генерации высококачественных, сборочных трубулинов в средних больших количествах из клеточных линий и мозгов одной мыши. Он основан на золотом стандартном протоколе очистки тубулина от бычьего мозга, используемого в полев течение многих лет 16,17. Одним из особых преимуществ этого подхода является использование культур подвески клеток HeLa S3, которые, как только установлено, дает большое количество клеток, требуя при этом мало практического времени. Это делает протокол относительно легким для выполнения в любой лаборатории клеточной биологии, в то время какдругие методы очистки тубулина 18,19,32,37 требуют специального оборудования и опыта и, таким образом, в основном используются лабораториями с сильным фоном в очищении белка. При производстве меньшего количества тубулина из линий клеток- адептов можно использовать различные клеточные линии. Мы успешно очищали тубулин от клеток HeLa, U-2 OS и HEK-293. Если требуется более масштабная очистка, собранные клетки или мозги могут быть застыли в буфере лиза и храниться при -80 градусов по Цельсию, а несколько клеточных гранул или мозгов могут быть объединенными вместе, чтобы очистить большее количество тубулина.
Тубулин, очищенный от клеточных линий, практически не имеет тубулиных ПТМ. Этот Тир-тубулин можно легко преобразовать в стирозинированный (deTyr-) тубулин в один простой шаг25. Для производства тубулина с другими ПТМ специфические трубулин-изменяющие ферменты могут быть переэкспрессированы в клетках до очистки тубулина. Кроме того, использование клеточных линий человеческого происхождения в качестве источника материала помогает избежать потенциальных проблем между видами при изучении взаимодействий между микротрубочками и человеческими MAPs. Кроме того, тубулин из нетрансформированных (таких как HEK293) или преобразованных (например, HeLa) клеток может предоставить информацию о воздействии микротрубочек направлены препараты (например, таксаны) на нормальные против опухолевых клеток микротрубочек.
Наконец, наш протокол облегчает очистку тубулина от мозга одной мыши. По мере того как увеличивая число моделей мыши мутаций и изменений tubulin генерируются, этот протокол позволяет сразу анализ свойств и взаимодействий микротрубочек с измененным составом изотипа тубулина38,39,40 или тубулинPTMs 31,41.
Подход основан на циклах полимеризации и деполимеризации. Таким образом, специфические трубулиновые изотипы или тубулин с особыми ПТМ, влияющими на сборку и разборку микротрубочек, могут привести к непропорциональной потере или уменьшению таких тубулиных форм в процессе очистки. Тем не менее, мы показали, что основные ПТМ тубулина, такие как ацетилирование, детирозинирование, глутамилирование и гликилирование, сохраняются на микротрубочках на протяжении всего процесса очисткитубулина 24. Однако следует отметить, что для количественного анализа состава тубулина в клетках или тканях подход к очистке тубулина на основе TOG-колонки более уместен, так как позволит обеспечить объективную, полимеризацию-независимую очисткутубулина 18. Несмотря на свои ограничения, наш протокол предлагает большое преимущество в создании большого количества высококачественного тубулина, который может быть использован в тщательных экспериментах по восстановлению в пробирке. В частности, он облегчает использование PTM-богатых трубулин мозга в обычных экспериментах.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Эта работа была поддержана ANR-10-IDEX-0001-02, LabEx Cell'n'Scale ANR-11-LBX-0038 и Институт конвергенции NO-жизни ANR-17-CONV-0005. CJ поддерживается Институтом Кюри, Французское национальное исследовательское агентство (ANR) присуждает ANR-12-BSV2-0007 и ANR-17-CE13-0021, Грант Института национального рака (INCA) 2014-PL BIO-11-ICR-1, и Фонд за Recherche Medicale (FRM) грант DE'20170336756. МММ поддерживается Фондом Vaincre Альцгеймера грант FR-16055p, и Франция Альцгеймера грант AAP SM 2019 n'2023. JAS была поддержана научно-исследовательской и инновационной программой Европейского союза Horizon 2020 в рамках грантового соглашения Мари Склодовской-Кюри No 675737 и грантом FRM FDT201904008210. SB был поддержан грантом FRM FDT201805005465.
Мы благодарим всех сотрудников лаборатории Janke, в частности Дж.Супхрона, а также Г. Лакисича (Институт MICALIS, AgroParisTech) и А. Гаутреу (Политехническая школа) за помощь при создании протокола. Мы хотели бы поблагодарить животноводию Института Кюри за помощь в разведении и уходе за мышами.
Антитело 12G10, разработанное J. Frankel и M. Нельсон, было получено из развития исследований Hybridoma банка, разработанного под эгидой NICHD и поддерживается Университетом штата Айова.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 M MgCl2 | Sigma | #M1028 | |
| 1-L cell culture vessels | Techne F7610 | Used for spinner cultures. Never stir the empty spinner bottles. When spinner bottles are in the cell culture incubator, always keep the lateral valves of spinner bottles slightly open to facilitate the equilibration of media with incubator’s atmosphere. After use, fill the spinner bottles immediately with tap water to avoid drying of remaining cells on the bottle walls. Wash the bottles with deionised water, add app 200 ml of deionised water and autoclave. Under a sterile cell culture hood remove the water and allow the bottles to dry completely, still under the hood, for several hours. Never use detergents for cleaning the spinner bottles because any trace amounts of the detergent can be deleterious to the cells. | |
| 1.5- and 2-ml tubes | |||
| 14-ml round-bottom tubes | |||
| 15-cm-diameter sterile culture dishes | |||
| 15-ml screw-cap tubes | |||
| 2-mercaptoethanol | Sigma | #M3148 | 2-mercaptoethanol is toxic and should be used under the hood. |
| 4-(2-aminoethyl)-benzenesulfonyl fluoride | Sigma | #A8456 | |
| 40% Acrylamide | Bio-Rad | #161-0140 | |
| 5-, 10- 20-ml syringes | |||
| 5-ml, 10-ml, 25-ml sterile pipettes | |||
| 50-ml screw-cap tubes | |||
| Ammonium persulfate (APS) | Sigma | #A3678 | |
| Anti-alpha-tubulin antibody, 12G10 | Developed by J. Frankel and M. Nelson, obtained from the Developmental Studies Hybridoma Bank, developed under the auspices of the NICHD, and maintained by the University of Iowa | dilution: 1/500 | |
| Anti-glutamylated tubulin antibody, GT335 | AdipoGen | #AG-20B-0020 | dilution: 1/20,000 |
| Aprotinin | Sigma | #A1153 | |
| Balance (0.1 – 10 g) | |||
| Beckman 1-l polypropylene bottles | For collecting spinner cultures | ||
| Beckman Avanti J-26 XP centrifuge | For collecting spinner cultures | ||
| Biological stirrer | Techne MCS-104L | Installed in the cell culture incubator (for spinner cultures), 25 rpm for Hela S3 and HEK 293 cells | |
| Bis N,N’-Methylene-Bis-Acrylamide | Bio-Rad | #161-0201 | |
| Blender IKA Ultra-Turrax® | For lysing brain tissue, use 5-mm probe, with the machine set at power 6 or 7. Blend the brain tissue 2-3 times for 15 s on ice. | ||
| Bovine serum albumin (BSA) | Sigma | #A7906 | |
| Bromophenol blue | Sigma | #1.08122 | |
| Carboxypeptidase A (CPA) | Sigma | #C9268 | Concentration: 1.7 U/µl |
| Cell culture hood | |||
| Cell culture incubator set at 37°C, 5% CO2 | |||
| Dimethyl sulfoxide (DMSO) | Sigma | #D8418 | DMSO can enhance cell and skin permeability of other compounds. Avoid contact and use skin and eye protection. |
| DMEM medium | Life Technologies | #41965062 | |
| DTT, DL-Dithiothreitol | Sigma | #D9779 | |
| EDTA | Euromedex | #EU0007-C | |
| EGTA | Sigma | #E3889 | |
| Ethanol absolute | Fisher Chemical | #E/0650DF/15 | |
| Fetal bovine serum (FBS) | Sigma | #F7524 | |
| French pressure cell press | Thermo electron corporation | #FA-078A | with a #FA-032 cell; for lysing big amounts of cells. Set at medium ratio, and the gauge pressure of 1,000 psi (corresponds to 3,000 psi inside the disruption chamber). |
| Glycerol | VWR Chemicals | #24388.295 | |
| Glycine | Sigma | #G8898 | |
| GTP | Sigma | #G8877 | |
| Heating block | Stuart | #SBH130D | |
| Hela cells | ATCC® CCL-2™ | ||
| Hela S3 cells | ATCC | ATCC® CCL-2.2™ | |
| Hydrochloric acid (HCl ) | VWR | #20252.290 | |
| Inverted microscope | With fluorescence if cell transfection is to be verified | ||
| Isopropanol | VWR | #20842.298 | |
| jetPEI | Polyplus | #101 | |
| JLA-8.1000 rotor | For collecting spinner cultures | ||
| KOH | Sigma | #P1767 | KOH is corrosive and causes burns; use eye and skin protection. |
| L-Glutamine | Life Technologies | #25030123 | |
| Laboratory centrifuge for 50-ml tubes | Sigma | 4-16 K | |
| Leupeptin | Sigma | #L2884 | |
| Liquid nitrogen | |||
| Micro-pipettes p2.5, p10, p20, p100, p200 and p1000 and corresponding tips | |||
| Micropestles | Eppendorf | #0030 120.973 | |
| Mouse brain tissue | Animal care and use for this study were performed in accordance with the recommendations of the European Community (2010/63/UE). Experimental procedures were specifically approved by the ethics committee of the Institut Curie CEEA-IC #118 (authorization no. 04395.03 given by National Authority) in compliance with the international guidelines. | ||
| Needles 18G X 1 ½” (1.2 X 38 mm | Terumo | #18G | |
| Needles 20G X 1 ½” (0.9 X 38 mm | Terumo | #20G | |
| Needles 21G X 4 ¾” (0.8 X 120 mm | B.Braun | #466 5643 | |
| Parafilm | |||
| PBS | Life Technologies | #14190169 | |
| Penicillin-Streptomycin | Life Technologies | #15140130 | |
| pH-meter | |||
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma | #P7626 | PMSF powder is hazardous. Use skin and eye protection when preparing PMSF solutions. |
| PIPES | Sigma | #P6757 | |
| Pipette-boy | |||
| Rotors | Beckman 70.1 Ti; TLA-100.3; and TLA 55 | ||
| SDS-PAGE electrophoresis equipment | Bio-Rad | #1658001FC | |
| SDS, Sodium dodecyl sulphate | VWR | #442444H | For preparing Laemmeli buffer |
| SDS, Sodium dodecyl sulphate | Sigma | #L5750 | For preparing 'TUB' SDS-PAGE gels |
| Sonicator | Branson | #101-148-070 | Used for lysing cells grown as adherent cultures. Use 6.5 mm diameter probe, set the sonicator at “Output control” 1, “Duty cycle” 10% and time depending on the cell type used. |
| Tabletop centrifuge for 1.5 ml tubes | Eppendorf | 5417R | |
| TEMED, N, N, N′, N′-Tetramethylethylenediamine | Sigma | #9281 | |
| Trichostatin A (TSA) | Sigma | #T8552 | |
| Triton X-100 | Sigma | #T9284 | |
| Trizma base (Tris) | Sigma | #T1503 | |
| Trypsin | Life Technologies | #15090046 | |
| Ultracentrifuge rotors | TLA-55, TLA-100.3 and 70.1 Ti rotors | Set at 4°C or 30°C based on the need of the experiment | |
| Ultracentrifuge tubes | Beckman | #357448 | for using with TLA-55 rotor |
| Ultracentrifuge tubes | Beckman | #349622 | for using with TLA-100.3 rotor |
| Ultracentrifuge tubes | Beckman | #355631 | for using with 70.1 Ti rotor |
| Ultracentrifuges | Beckman | Optima L80-XP (or equivalent) and Optima MAX-XP (or equivalent) | Set at 4°C or 30°C based on the need of the experiment |
| Vortex mixer | |||
| Water bath equipped with floaters or tube holders | Set at 30°C |
Ссылки
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Janke, C. The tubulin code: Molecular components, readout mechanisms, and functions. Journal of Cell Biology. 206 (4), 461-472 (2014).
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews: Molecular Cell Biology. 21 (6), 307-326 (2020).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Margolis, R. L., Wilson, L. Opposite end assembly and disassembly of microtubules at steady state in vitro. Cell. 13 (1), 1-8 (1978).
- Borisy, G. G., Olmsted, J. B. Nucleated assembly of microtubules in porcine brain extracts. Science. 177 (55), 1196-1197 (1972).
- Kirschner, M. W., Williams, R. C. The mechanism of microtubule assembly in vitro. Journal of Supramolecular Structure. 2 (2-4), 412-428 (1974).
- Baas, P. W., Lin, S. Hooks and comets: The story of microtubule polarity orientation in the neuron. Developmental Neurobiology. 71 (6), 403-418 (2011).
- Stepanova, T., et al. Visualization of microtubule growth in cultured neurons via the use of EB3-GFP (end-binding protein 3-green fluorescent protein). Journal of Neuroscience. 23 (7), 2655-2664 (2003).
- Nedelec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Bieling, P., Telley, I. A., Surrey, T. A minimal midzone protein module controls formation and length of antiparallel microtubule overlaps. Cell. 142 (3), 420-432 (2010).
- Roostalu, J., et al. Directional switching of the kinesin Cin8 through motor coupling. Science. 332 (6025), 94-99 (2011).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nature Materials. 14 (11), 1156-1163 (2015).
- Hendricks, A. G., Goldman, Y. E., Holzbaur, E. L. F. Reconstituting the motility of isolated intracellular cargoes. Methods in Enzymology. 540, 249-262 (2014).
- Dogterom, M., Surrey, T. Microtubule organization in vitro. Current Opinion in Cell Biology. 25 (1), 23-29 (2013).
- Vallee, R. B. Reversible assembly purification of microtubules without assembly-promoting agents and further purification of tubulin, microtubule-associated proteins, and MAP fragments. Methods in Enzymology. 134, 89-104 (1986).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Widlund, P. O., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Molecular Biology of the Cell. 23 (22), 4393-4401 (2012).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Letters. 587 (21), 3450-3455 (2013).
- Uchimura, S., et al. A flipped ion pair at the dynein-microtubule interface is critical for dynein motility and ATPase activation. Journal of Cell Biology. 208 (2), 211-222 (2015).
- Pamula, M. C., Ti, S. C., Kapoor, T. M. The structured core of human beta tubulin confers isotype-specific polymerization properties. Journal of Cell Biology. 213 (4), 425-433 (2016).
- Vemu, A., et al. Structure and dynamics of single-isoform recombinant neuronal Human tubulin. Journal of Biological Chemistry. 291 (25), 12907-12915 (2016).
- Ti, S. C., Alushin, G. M., Kapoor, T. M. Human beta-tubulin isotypes can regulate microtubule protofilament number and stability. Developmental Cell. 47 (2), 175-190 (2018).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nature Protocols. 14, 1634-1660 (2019).
- Barisic, M., et al. Microtubule detyrosination guides chromosomes during mitosis. Science. 348 (6236), 799-803 (2015).
- Nirschl, J. J., Magiera, M. M., Lazarus, J. E., Janke, C., Holzbaur, E. L. F. alpha-Tubulin tyrosination and CLIP-170 phosphorylation regulate the initiation of dynein-driven transport in neurons. Cell Reports. 14 (11), 2637-2652 (2016).
- Guedes-Dias, P., et al. Kinesin-3 responds to local microtubule dynamics to target synaptic cargo delivery to the presynapse. Current Biology. 29 (2), 268-282 (2019).
- Luo, Y., et al. Direct observation of dynamic protein interactions involving human microtubules using solid-state NMR spectroscopy. Nature Communications. 11 (1), 18(2020).
- Even, A., et al. ATAT1-enriched vesicles promote microtubule acetylation via axonal transport. Science Advances. 5 (12), 2705(2019).
- Wolff, J., Sackett, D. L., Knipling, L. Cation selective promotion of tubulin polymerization by alkali metal chlorides. Protein Science. 5 (10), 2020-2028 (1996).
- Magiera, M. M., et al. Excessive tubulin polyglutamylation causes neurodegeneration and perturbs neuronal transport. EMBO Journal. 37 (23), 100440(2018).
- Lacroix, B., Janke, C. Generation of differentially polyglutamylated microtubules. Methods in Molecular Biology. 777, 57-69 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Magiera, M. M., Janke, C. Methods in Cell Biology Vol. 115 Microtubules, in vitro. Correia, J. J., Wilson, L. , Academic Press. 247-267 (2013).
- Hausrat, T. J., Radwitz, J., Lombino, F. L., Breiden, P., Kneussel, M. Alpha- and beta-tubulin isotypes are differentially expressed during brain development. Developmental Neurobiology. , (2020).
- Janke, C., et al. Tubulin polyglutamylase enzymes are members of the TTL domain protein family. Science. 308 (5729), 1758-1762 (2005).
- Newton, C. N., et al. Intrinsically slow dynamic instability of HeLa cell microtubules in vitro. Journal of Biological Chemistry. 277 (45), 42456-42462 (2002).
- Belvindrah, R., et al. Mutation of the alpha-tubulin Tuba1a leads to straighter microtubules and perturbs neuronal migration. Journal of Cell Biology. 216 (8), 2443-2461 (2017).
- Breuss, M., et al. Mutations in the murine homologue of TUBB5 cause microcephaly by perturbing cell cycle progression and inducing p53 associated apoptosis. Development. , (2016).
- Latremoliere, A., et al. Neuronal-specific TUBB3 is not required for normal neuronal function but is essential for timely axon regeneration. Cell Reports. 24 (7), 1865-1879 (2018).
- Morley, S. J., et al. Acetylated tubulin is essential for touch sensation in mice. Elife. 5, (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены