Method Article
Reinigung von Tubulin mit kontrollierten posttranslationalen Modifikationen und Isotypen aus begrenzten Quellen durch Polymerisations-Depolymerisationszyklen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Tubulinreinigung aus kleinen/mittleren Quellen wie kultivierten Zellen oder Gehirnen mit einer Maus unter Verwendung von Polymerisations- und Depolymerisationszyklen. Das gereinigte Tubulin ist in bestimmten Isotypen angereichert oder hat spezifische posttranslationale Modifikationen und kann in In-vitro-Rekonstitutions-Assays zur Untersuchung der Mikrotubuli-Dynamik und -Wechselwirkungen verwendet werden.
Zusammenfassung
Ein wichtiger Aspekt der Untersuchungen des Mikrotubuli-Zytoskeletts ist die Untersuchung des Mikrotubuli-Verhaltens in In-vitro-Rekonstitutionsexperimenten. Sie ermöglichen die Analyse der intrinsischen Eigenschaften von Mikrotubuli, wie dynamik, und ihrer Wechselwirkungen mit mikrotubuli-assoziierten Proteinen (MAPs). Der "Tubulin-Code" ist ein neu entstehendes Konzept, das auf verschiedene Tubulin-Isotypen und verschiedene posttranslationale Modifikationen (PTMs) als Regulatoren von Mikrotubuli-Eigenschaften und -Funktionen verweist. Um die molekularen Mechanismen des Tubulin-Codes zu erforschen, ist es entscheidend, In-vitro-Rekonstitutionsexperimente mit gereinigtem Tubulin mit spezifischen Isotypen und PTMs durchzuführen.
Bis heute war dies technisch eine Herausforderung als Gehirn Tubulin, das weit verbreitet in In-vitro-Experimente verwendet wird, beherbergt viele PTMs und hat eine definierte Isotypzusammensetzung. Daher haben wir dieses Protokoll entwickelt, um Tubulin aus verschiedenen Quellen und mit unterschiedlichen Isotypzusammensetzungen und kontrollierten PTMs zu reinigen, wobei der klassische Ansatz von Polymerisations- und Depolymerisationszyklen verwendet wird. Im Vergleich zu bestehenden Methoden, die auf der Affinitätsreinigung basieren, ergibt dieser Ansatz reines, polymerisationskompetentes Tubulin, da Tubulin, das gegen Polymerisation oder Depolymerisation resistent ist, während der aufeinanderfolgenden Reinigungsschritte verworfen wird.
Wir beschreiben die Reinigung von Tubulin aus Zelllinien, die entweder in Suspension oder als anhantibe Kulturen angebaut werden, und von einzelnen Mausgehirnen. Das Verfahren beschreibt zunächst die Erzeugung von Zellmasse sowohl in Suspensions- als auch in Hafteinstellungen, dem Lyseschritt, gefolgt von den aufeinanderfolgenden Stadien der Tubulinreinigung durch Polymerisations-Depolymerisationszyklen. Unsere Methode liefert Tubulin, das in Experimenten verwendet werden kann, die sich mit dem Einfluss des Tubulin-Codes auf die intrinsischen Eigenschaften von Mikrotubuli und Mikrotubuli-Wechselwirkungen mit assoziierten Proteinen befassen.
Einleitung
Mikrotubuli spielen in vielen zellulären Prozessen eine entscheidende Rolle. Sie geben Zellen ihre Form, bauen meiotische und mitotische Spindeln für die Chromosomensegregation und dienen als Spuren für den intrazellulären Transport. Um diese vielfältigen Funktionen auszuführen, organisieren sich Mikrotubuli auf unterschiedliche Weise. Eine der faszinierendsten Fragen auf diesem Gebiet ist es, die molekularen Mechanismen zu verstehen, die es den strukturell und evolutionär konservierten Mikrotubuli ermöglichen, sich an diese Fülle von Organisationen und Funktionen anzupassen. Ein potenzieller Mechanismus ist die Diversifizierung der Mikrotubuli, die durch das Konzept definiert wird, das als "Tubulin-Code"1,2,3" bekannt ist. Der Tubulin-Code umfasst zwei Hauptkomponenten: die Differentialintegration von α- und β-Tubulin-Genprodukten (Tubulin-Isotypen) in die Mikrotubuli und Tubulin-Posttranslationalmodifikationen (PTMs).
Seit den 1970er Jahren haben In-vitro-Rekonstitutionsexperimente, kombiniert mit sich entwickelnden Lichtmikroskopie-Techniken, den Weg für wichtige Entdeckungen über die Eigenschaften von Mikrotubuli geebnet: dynamische Instabilität4 und Laufband5,und ihre anderen Mechanismen und Funktionen6,7,8,9,10,11,12,13,14,15. Fast alle bisher durchgeführten In-vitro-Experimente basierten auf Tubulin, das aus Hirngewebe mit wiederholten Zyklen der Polymerisation und Depolymerisation16,17gereinigt wurde. Obwohl die Reinigung aus dem Hirngewebe den Vorteil der Gewinnung von hochwertigem Tubulin in großen Mengen (in der Regel Grammmengen) verleiht, ist ein wichtiger Nachteil die Heterogenität, da Tubulin, das aus Hirngewebe gereinigt wird, eine Mischung aus verschiedenen Tubulin-Isotypen ist und mit vielen Tubulin-PTMs angereichert ist. Diese Heterogenität macht es unmöglich, die Rolle eines bestimmten Tubulin-PTM oder Isotyps bei der Kontrolle von Mikrotubuli-Eigenschaften und -Funktionen abzustecken. Daher ist die Herstellung von Montage-kompetentem Tubulin mit kontrollierten Tubulin-PTMs und homogener Isotypzusammensetzung unerlässlich, um die molekularen Mechanismen des Tubulincodes anzugehen.
Kürzlich wurde ein Ansatz zur Reinigung von Tubulin durch Affinitätschromatographie mit der mikrotubulienbindenden TOG-Domäne (Tumor-überexprimiertes Gen) der Hefe Stu2pentwickelt. Bei dieser Methode wird Tubulin in rohen Lysaten von Zellen oder Geweben durch eine Säule geleitet, wo es an die matriximmobilisierte TOG-Domäne bindet, die die Analyse des gesamten Tubulinpools einer bestimmten, sogar sehr kleinen Probe ermöglicht. Ein lang erwarteter Ansatz zur Reinigung des rekombinanten Tubulins wurde in den letzten Jahren ebenfalls beschrieben. Es basiert auf dem Baculovirus-System, in dem ein bi-cistronischer Vektor, der α- und β-Tubulin-Gene enthält, in Insektenzellen19exprimiert wird. Diese Methode ist jedoch sehr umständlich und zeitaufwändig und wird daher hauptsächlich zur Untersuchung der Auswirkungen der Tubulinmutationen20 und der Tubulin-Isotypen21,22,23 in vitro verwendet.
Im aktuellen Protokoll beschreiben wir eine Methode, die den etablierten und weit verbreiteten Polymerisations-Depolymerisationsansatz als Blaupause verwendet, um Tubulin mit unterschiedlichen Modifikationsstufen entweder aus Zelllinien oder aus Maushirngewebe zu erzeugen24. Bei diesem Verfahren wird Tubulin zwischen dem löslichen (Tubulin-Dimer bei 4 °C) und der polymerisierten Form (Mikrotubuli bei 30 °C in Gegenwart von Guanosin 5'-Triphosphat [GTP]) geradelt. Jede Form wird durch aufeinander folgende Zentrifugationsschritte getrennt: Tubulin-Dimere bleiben nach einer Erkältung (4 °C) im Überstand, während Mikrotubuli bei 30 °C pelletiert werden. Darüber hinaus wird ein Polymerisationsschritt bei hoherPiperazin-N-Bis(2-Ethansulfonsäure) (PIPES) Konzentration durchgeführt, die die Entfernung von mikrotubuli-assoziierten Proteinen aus den Mikrotubuli und damit aus dem schließlich gereinigten Tubuli ermöglicht. Tubulin gereinigt aus HeLa S3 Zellen als Suspension oder anhantibe Kulturen gewachsen ist praktisch frei von jedem Tubulin PTM und wurde in den jüngsten In-vitro-Rekonstitutionsexperimente25,26,27,28verwendet. Wir haben die Methode zur Reinigung von Tubulin von einzelnen Mausgehirnen weiter angepasst, die für eine große Anzahl von Mausmodellen mit Änderungen in Tubulin-Isotypen und PTMs verwendet werden können.
Im Protokoll beschreiben wir zunächst die Erzeugung des Ausgangsmaterials (Zellmasse oder Hirngewebe), seine Lyse (Abbildung 1A), gefolgt von den aufeinanderfolgenden Schritten der Tubulinpolymerisation und Depolymerisation zur Reinigung des Tubulins (Abbildung 1B). Wir beschreiben ferner das Verfahren zur Beurteilung der Reinheit (Abbildung 2A,B) und der Menge (Abbildung 3A,B) des gereinigten Tubulins. Das Verfahren kann angepasst werden, um Tubulin zu produzieren, das mit einem ausgewählten PTM angereichert ist, indem ein modifizierendes Enzym in Zellen vor der Tubulinreinigung überexzessiert wird (Abbildung 4B). Alternativ können Tubulin-modifizierende Enzyme während des Reinigungsprozesses dem Tubulizuz hinzugefügt werden. Schließlich können wir Tubulin ohne spezifische Isotypen oder PTMs aus dem Gehirn von Mäusen reinigen, die einen Mangel an den entsprechenden Tubulin-modifizierenden Enzymen aufweisen (Abbildung 4B)29.
Die Methode, die wir hier beschreiben, hat zwei Hauptvorteile: (i) es ermöglicht die Produktion ausreichend großer Mengen Tubulin in relativ kurzer Zeit, und (ii) es erzeugt hochwertiges, reines Tubulin, entweder mit spezifischer Tubulin-Isotypzusammensetzung oder PTMs. Im zugehörigen Video dieses Manuskripts heben wir einige der kritischen Schritte dieses Verfahrens hervor.
Protokoll
Die Tierpflege und -verwendung für diese Studie wurde in Übereinstimmung mit den Empfehlungen der Europäischen Gemeinschaft (2010/63/UE) durchgeführt. Experimentelle Verfahren wurden von der Ethikkommission des Institut Curie CEEA-IC #118 (Genehmigungnr. 04395.03 von der nationalen Behörde) in Übereinstimmung mit den internationalen Richtlinien ausdrücklich genehmigt.
1. Herstellung von Reagenzien zur Tubulinreinigung
HINWEIS: Alle Puffer, die für die Tubulinreinigung verwendet werden, sollten Kaliumsalze und NICHT Natriumsalzeenthalten 30.
- Bereiten Sie 1 L des kompletten Mediums vor: Dulbeccos modifiziertes Eagle Medium (DMEM), mit 10% fetalem Rinderserum (FBS, 100 ml), 200 mM L-Glutamin (10 ml von 2 M Vorrat) und 1x Penicillin-Streptomycin (10 ml 100x Vorrat). Bei 4 °C lagern.
- 10 M Kaliumhydroxid (KOH) vorbereiten, 140 g KOH in Wasser auflösen, das Endvolumen auf 250 ml einstellen und bei Raumtemperatur lagern.
- 0,5 M Ethylendiamintetraessigsäure (EDTA), pH 8, durch Auflösen von 36,5 g EDTA in Wasser vorbereiten, den pH-Wert mit KOH auf 8,0 einstellen (sonst löst sich EDTA nicht auf) und das Endvolumen auf 250 ml, filtersterilisieren und bei Raumtemperatur aufbewahren.
- Bereiten Sie 5 mM Phosphat-gepufferte Saline (PBS)-EDTA vor, indem Sie 5 ml 0,5 M EDTA zu 500 ml PBS hinzufügen, filtersterilisieren und bei Raumtemperatur lagern.
- 0,5 M K-PIPES, pH 6,8 vorbereiten, 75,5 g PIPES in Wasser auflösen, mit KOH auf pH 6,8 (sonst löst sich PIPES nicht auf) und das Endvolumen auf 500 ml einstellen, filtersterilisieren und bei 4 °C lagern.
- 1 M K-PIPES, pH 6,8 vorbereiten, 15,1 g PIPES in Wasser auflösen, mit KOH auf pH 6,8 und das Endvolumen auf 50 ml einstellen, filtersterilisieren und bei 4 °C lagern.
- 0,5 M Kalium-Ethylenglykol-Bis(β-Aminoethylether)-N,N,N,-Tetraessigsäure(K-EGTA, pH 7,7) vorbereiten, indem 47,5 g EGTA in Wasser aufgelöst werden, auf pH 7,7 mit KOH und das Endvolumen auf 250 ml einstellen, filtersterilisieren und bei Raumtemperatur lagern.
- BRB80 (80 mM K-PIPES, pH 6,8; 1 mM K-EGTA; 1 mM Magnesiumchlorid [MgCl2]) Lösung durch Mischen von 3,2 ml 0,5 m PIPES, 40 l mit 0,5 m K-EGTA und 20 l von 1 M MgCl2 und Einstellen des Endvolumens auf 20 ml vorbereiten. Bei 4 °C lagern.
- 0,1 M Phenylmethansulfonylfluorid (PMSF) vorbereiten, indem 435 mg PMSF in Isopropanol aufgelöst werden, um ein Endvolumen von 25 ml zu erhalten und bei -20 °C lagern.
- Präechen Sie Protease-Inhibitoren (200x) durch Auflösen von 10 mg Aprotinin, 10 mg Leupeptin und 10 mg 4-(2-Aminoethyl)-Benzolesulfonylfluorid in Wasser, um ein Endvolumen von 2,5 ml zu erhalten, Aliquots von 100 l zu bilden und bei -20 °C zu lagern.
- Bereiten Sie 10% Triton X-100 vor, indem Sie 5 ml Triton X-100 in 45 ml Wasser mischen, filtersterilisieren und bei Raumtemperatur lagern.
- Lysispuffer (BRB80 ergänzt durch 1 mM 2-Mercaptoethanol, 1 mM PMSF, 1x Proteasehemmer mischen und, gegebenenfalls für HEK-293-Zellen, 0,2% Triton X-100) am Tag der Tubulinreinigung durch Mischen von 20 ml BRB80 mit 1,5 l 2-Mercaptoethanol, 200 l 0,1 M PMSF, 100 l der Proteaseinhibitoren mischung und, optional für HEK-293-Zellen, und optional für HEK-293-Zellen , 400 l von 10% Triton X-100.
HINWEIS: 2-Mercaptoethanol ist giftig und sollte in der Dunstabzugshaube verwendet werden. - 0,2 m GTP vorbereiten, indem Sie 1 g GTP in 9,5 ml Wasser auflösen, den pH-Wert mit KOH auf 7,5 einstellen, Aliquots von 20 l bilden und bei -20 °C lagern. Vermeiden Sie wiederholte Frost-Tau-Zyklen.
- 1 M Tris(Hydroxymethyl)-Aminomethan-Hydrochlorid (Tris-HCl) vorbereiten, indem 60,56 g Tris in Wasser aufgelöst werden, mit HCl auf pH 6,8 einstellen, auf ein Endvolumen von 500 ml abschließen, filtersterilisieren und bei Raumtemperatur lagern.
- 5x Laemmli Probenpuffer (450 mM Dithiothreitol (DTT); 10% Natriumdodecylsulfat (SDS); 400 m Tris-HCl, pH 6,8; 50% Glycerin; 0,006% Bromphenolblau) durch Zugabe von 4 g SDS zu 16 ml vorgeheiztem 1 M Tris-HCl, pH 6,8, und die Lösung sanft mischen. 2,6 g DTT und 20 ml 100% Glycerin in die Mischung geben und rühren, bis die Lösung homogen wird. Fügen Sie die gewünschte Menge Bromphenolblau (2,5 mg) hinzu, um die erforderliche Farbintensität zu erreichen. 5 ml Aliquots herstellen und bei -20 °C lagern. Bereiten Sie die 2x Arbeitslösung des Laemmli-Probenpuffers vor, indem Sie den 5-fachen Vorrat in destilliertem Wasser verdünnen.
2. Amplifikations- und Erntequellen von Tubulin
HINWEIS: In diesem Protokoll wurden drei Tubulinquellen verwendet: (i) Zellen (HeLa S3 und HEK-293), die als Suspensionskulturen angebaut werden; ii) Zellen, die als Anhantibe Kulturen angebaut werden (HEK-293, HeLa und U2 OS); und (iii) Maus-Hirngewebe. Dieses Protokoll betrachtet den Tag der Tubulinreinigung als "Tag 0" und dementsprechend wurden andere Schritte relativ zu Tag 0 beschrieben.
- Amplifikation von Zellen
- Zellen, die als Suspensionskulturen angebaut werden
HINWEIS: Um Tubulin erfolgreich von Suspensionskulturen zu reinigen, verwenden Sie mindestens 2 L Suspensionskultur.- Für 2 L Suspensionskultur, beleben und wachsen Sie den bevorzugten Zelltyp, um 6 × 107 Zellen 10 Tage vor dem Tag der Vorbereitung zu erhalten. Am Tag -10, Tellerzellen auf sechs 15 cm Durchmesser Gerichte mit 107 Zellen pro Platte.
- Am Tag -8 die benötigte Menge an komplettem Medium auf 37 °C vorheizen. Fügen Sie 1 L vorgeheiztes Medium zu jeder Spinnerflasche unter sterilen Bedingungen hinzu. Legen Sie die Spinner auf einen Rührtisch von 20 bis 25 Umdrehungen pro Minute im Zellkultur-Inkubator, öffnen Sie die seitlichen Spinnerkappen leicht, damit das Medium der Atmosphäre des Inkubators gleichkommen kann.
HINWEIS: Um Verunreinigungen zu vermeiden, reinigen Sie die Außenfläche der Medien und Spinnerflaschen gründlich mit 70 % Ethanol. - Am Tag -7 versuchen sie, die auf 80–90 % zusammengewachsenen Zellen (ca. 1,8 × 108 Zellen) zu sammeln. Sammeln Sie Zellen aus 3 Gerichten gleichzeitig, drehen Sie sich nach unten (200 × g, 5 min, Raumtemperatur), und hängen Sie alle Zellen in 10 ml DMEM wieder auf.
HINWEIS: Eine gründliche Dissoziation der Zellen an dieser Stelle ist sehr wichtig, um die Bildung größerer Aggregate in den Spinnerflaschen zu vermeiden, was das Zellüberleben beeinflusst und zu einer niedrigen Tubulinausbeute führt. - Fügen Sie 5 ml der Zellsuspension zu jeder Spinnerflasche mit 1 L DMEM hinzu, geben Sie die Spinner an den Rührtisch im Zellkultur-Inkubator zurück und lassen Sie Zellen eine Woche lang wachsen.
- Zellen, die als anhandende Kulturen angebaut werden
HINWEIS: Um Tubulin erfolgreich von anhaftenden Zellen zu reinigen, verwenden Sie mindestens 10 Gerichte mit 80–90% Zusammenfluss.- Beleben und verstärken Sie den gewünschten Zelltyp, um 1 × 108 Zellen drei Tage vor dem Tag der Tubulinpräparation zu erhalten.
- Am Tag -3 diese Zellen auf zehn 15 cm Teller zu 1 × 107Zellen pro Schale und lassen Sie sie 80-90% Zusammenfluss wachsen.
- Am Tag -1, falls erforderlich, transfekieren Zellen mit einem Plasmid, um ein Tubulin-modifizierendes Enzym oder einen bestimmten Tubulin-Isotyp auszudrücken.
- Zellen, die als Suspensionskulturen angebaut werden
- Ernte der Zellen/Gehirngewebe
- Zellen, die als Suspensionskulturen angebaut werden
- Übertragen Sie die Zellsuspension von Spinnern in 1 L Zentrifugenflaschen (Materialtabelle)und Pelletzellen bei 250 × g,15 min, Raumtemperatur. Um sofort eine andere Kultur der HeLa S3-Zellen in den Spinnerflaschen zu starten, lassen Sie 100 ml Zellsuspension in den Spinnern und fügen Sie 1 L komplettes, vorgewärmtes DMEM in die Spinnerflasche.
HINWEIS: Prüfen Sie sorgfältig auf bakterielle Kontamination, bevor Sie die Tubulinreinigung in Dierin untersuchen. - Pelletzellen aus jeder Zentrifugenflasche in 10 ml eiskaltem PBS aussetzen und alle Zellen in 50 ml Schraubkappenrohre übertragen. Während der Wiedersuspension die Zellen auf Eis halten. Pellet die Zellen bei 250 × g, 15 min, 4 °C.
HINWEIS: Befolgen Sie die Empfehlungen für die Reinigung und Lagerung von Spinnerflaschen (siehe Materialtabelle). - Entsorgen Sie den Überstand und bestimmen Sie das Volumen des Zellpellets. Von 2 L Suspensionskultur (zwei Spinnerflaschen) erwarten Sie ein Zellpellet von 5–6 ml.
HINWEIS: In dem unten beschriebenen Protokoll wird das Zellpelletvolumen auf 10 ml angenommen. Passen Sie das Experiment an die Pelletvolumina an. - Fügen Sie 1 Volumen (10 ml) Lysepuffer hinzu und setzen Sie das Zellpellet wieder auf.
HINWEIS: Das Verhältnis von Zellpelletvolumen zu Lysepuffervolumen ist sehr wichtig für eine erfolgreiche Tubulinreinigung. Durch die Zugabe von mehr Lysepuffer verringert sich die Tubulinkonzentration, die dann nicht die kritische Konzentration erreicht, die für die Polymerisation erforderlich ist, wodurch die Tubulinausbeute erheblich reduziert wird.
HINWEIS: Zellen, die im Lysepuffer resuspendiert werden, können in flüssigem Stickstoff eingefroren und zwei Monate lang bei -80 °C gelagert werden.
- Übertragen Sie die Zellsuspension von Spinnern in 1 L Zentrifugenflaschen (Materialtabelle)und Pelletzellen bei 250 × g,15 min, Raumtemperatur. Um sofort eine andere Kultur der HeLa S3-Zellen in den Spinnerflaschen zu starten, lassen Sie 100 ml Zellsuspension in den Spinnern und fügen Sie 1 L komplettes, vorgewärmtes DMEM in die Spinnerflasche.
- Zellen, die als anhandende Kulturen angebaut werden
HINWEIS: Zellen aus anhaftenden Kulturen müssen sehr schnell geerntet werden, um eine erfolgreiche Tubulinreinigung zu erhalten (ca. 15 Minuten für die Ernte von zehn 15 cm Schalen). Drei Personen nahmen an diesem Schritt des Protokolls teil.- Entfernen Sie das Medium von 15 cm Geschirr, indem Sie die Gerichte geneigt, und waschen Sie dann sanft die Zellen mit 7 ml PBS-EDTA bei Raumtemperatur (Person 1). Arbeiten Sie nur mit drei 15 cm Geschirr zu einer Zeit, um zu vermeiden, dass die Zellen ohne Medium oder Puffer verlassen.
- Fügen Sie den Zellen 5 ml PBS-EDTA hinzu und inkubieren Sie sie 5 min bei Raumtemperatur.
- Verwenden Sie einen Zellheber, um die Zellen sanft zu lösen, indem Sie sie an eine Kante der Schale schieben (Person 2), und sammeln Sie alle Zellen in einem 50 ml Schraubkappenrohr (Person 3). Spülen Sie jede Platte mit zusätzlichen 2 ml PBS-EDTA, um alle verbleibenden Zellen aus den Gerichten zu sammeln. Bewahren Sie in diesem Schritt das 50 ml Schraubkappenrohr mit der Zellsuspension auf Eis auf.
- Pellet die Zellen bei 250 × g, 10 min, 4 °C. Entsorgen Sie den Überstand und bestimmen Sie das Volumen des Zellpellets. Erwarten Sie ein Volumen von 1 ml von zehn 15 cm Geschirr.
HINWEIS: In dem unten beschriebenen Protokoll wird das Zellpelletvolumen auf 10 ml angenommen. Passen Sie die Experimente an die Pelletvolumina an. - Setzen Sie die Zellen in 1 Volumen (10 ml) Lysepuffer aus.
HINWEIS: Zellen, die im Lysepuffer resuspendiert werden, können bis zu zwei Monate bei -80 °C gelagert werden.
- Hirngewebe
HINWEIS: Mäuse jeden Alters, Geschlechts oder genetischen Hintergrunds können verwendet werden. Die Wahl des transgenen Mausstamms hängt von der zu behandelnden wissenschaftlichen Frage ab. In diesem Manuskript zeigen wir das Beispiel von Tubulin, das von der ttll1-/- Maus gereinigt wird, ohne ein großes Gehirnglutamylierungsenzym, das Tubulintyrosinligase-ähnliche 1 (TTLL1) Protein31.- Opfern Sie die Maus durch Zervixdislokation, enthaupten Sie schnell und sammeln Sie das Gehirn in einem runden Bodenrohr. Wenn es überschüssiges Blut im Gehirn gibt, waschen Sie schnell mit Lysepuffer. Sammeln Sie das Gehirn, sobald die Maus geopfert wird, da eine post-mortem Verzögerung den Erfolg der Tubulinreinigung beeinflussen kann. Verwenden Sie Rundbodenrohre, um die Breite der Sonde aufzunehmen, die für die Homogenisierung verwendet wird.
HINWEIS: Gesammelte Mausgehirne können in flüssigem Stickstoff eingefroren und bis zu 3 Jahre bei -80 °C gelagert werden. - Fügen Sie einem einzelnen Gehirn, das aus einer erwachsenen Maus extrahiert wurde, einen Lysepuffer von 500 l hinzu. Für den Rest des Protokolls wird das Volumen des hinzugefügten Lysepuffers auf 10 ml angenommen. Passen Sie ihr Experiment an die Anzahl der zu verwendenden Gehirne an.
- Opfern Sie die Maus durch Zervixdislokation, enthaupten Sie schnell und sammeln Sie das Gehirn in einem runden Bodenrohr. Wenn es überschüssiges Blut im Gehirn gibt, waschen Sie schnell mit Lysepuffer. Sammeln Sie das Gehirn, sobald die Maus geopfert wird, da eine post-mortem Verzögerung den Erfolg der Tubulinreinigung beeinflussen kann. Verwenden Sie Rundbodenrohre, um die Breite der Sonde aufzunehmen, die für die Homogenisierung verwendet wird.
- Zellen, die als Suspensionskulturen angebaut werden
3. Lyse von Zellen oder Hirngewebe
- Zellen, die als Suspensionskulturen angebaut werden
- Für HEK-293 lysieren Sie die Zellen auf dem Eis, indem Sie sich wiederholt mit Pipettenspitzen unterschiedlicher Breite nach oben und unten pfeifen. Befestigen Sie zunächst eine p1000-Spitze an einer 10 ml Pipette und pipette die Zellsuspension alle 5 min nach oben und unten, für 10 min (drei Zyklen der Pipetten). Zweitens, befestigen Sie eine p200 Spitze an einer p1000 Spitze und weitere Pipette alle 5 min, für 20 min (fünf Zyklen der Pipetten).
- Für HeLa S3 lysieren Sie die Zellen mit einer französischen Presse (siehe Tabelle der Materialien für Einstellungen).
- Nehmen Sie das 1/100. Volumen des Lyse-Mix (L) (200 l für 20 ml L), und fügen Sie das gleiche Volumen von 2x Laemmli Puffer, kochen für 5 min, und lagern bei -20 °C für die weitere Analyse.
- Zellen, die als anhandende Kulturen angebaut werden
- Übertragen Sie die Zellen in ein 14 ml Rundbodenrohr, dessen Höhe für die Beschallungssonde reduziert wurde (siehe Tabelle der Materialien für Einstellungen). Beschallen Sie die Zellen für 45 Pulse und bestätigen Sie die Zelllyse, indem Sie einen Tropfen des Lysemixes unter dem Mikroskop abtasten.
HINWEIS: Die Anzahl der Impulse kann je nach Zelltyp für die Tubulinreinigung variieren. Die Zusersonicing-Zellen zu viel könnten tubulitieren und wird die Reinigungsleistung negativ beeinflussen. - Pipette die Zellen auf und ab auf Eis alle 5 min für 20 min (fünf Zyklen der Pipetten), mit einer p200 Spitze.
- Nehmen Sie das 1/100. Volumen der Lysemischung (L) (200 l für 20 ml L) und fügen Sie das gleiche Volumen von 2x Laemmli Puffer hinzu, kochen Sie für 5 min und lagern Sie bei -20 °C für weitere Analysen.
- Übertragen Sie die Zellen in ein 14 ml Rundbodenrohr, dessen Höhe für die Beschallungssonde reduziert wurde (siehe Tabelle der Materialien für Einstellungen). Beschallen Sie die Zellen für 45 Pulse und bestätigen Sie die Zelllyse, indem Sie einen Tropfen des Lysemixes unter dem Mikroskop abtasten.
-
Hirngewebe
- Lyse das Gehirngewebe mit einem Gewebemixer (siehe Tabelle der Materialien für Einstellungen). Alternativ lysieren Sie das Gewebe mit einem Mikrorohr-Stößel oder einer gleichwertigen Ausrüstung und Pipette auf Eis mit einer 1 ml Spritze mit einer 18 G Nadel.
- Nehmen Sie das 1/100. Volumen der Lysemischung (L) (200 l für 20 ml L), und fügen Sie das gleiche Volumen von 2x Laemmli Puffer hinzu, kochen Sie für 5 min, und lagern Sie bei -20 °C für weitere Analysen.
4. Reinigung von Tubulin
- Lysate-Klarstellung
- Lysat (Trennpellet und löslicher Anteil der Lysemischung) durch Zentrifugation bei 150.000 × g,4 °C, 30 min. Siehe Tabelle der Materialien für Details über Ultrazentrifugenrotoren und Rohre. Bei Zellextrakten wird oft nach der Zentrifugation eine weiße schwimmende Schicht gebildet. Übertragen Sie diese schwimmende Schicht nicht zusammen mit dem Überstand, da sie die Tubulinpolymerisation stört. Verwenden Sie eine Spritze mit entsprechendem Volumen, die an einer langen 20 G oder 21 G Nadel befestigt ist, um den Überstand vorsichtig zu entfernen, ohne die schwimmende Schicht zu stören. Wenn der Überstand noch bewölkt ist, Zentrifuge bei 5.000 × g, 4 °C für 10 min.
- Übertragen Sie den Überstand (SN1) auf ein Ultrazentrifugenrohr und notieren Sie dessen Volumen. Für ein 10 ml Zellpellet erwarten Sie ein Volumen von 12 ml für SN1.
- Nehmen Sie das 1/100. Volumen von SN1 (120 l für 12 ml SN1), und fügen Sie das gleiche Volumen von 2x Laemmli Puffer hinzu, kochen Sie für 5 min, und lagern Sie bei -20 °C für weitere Analysen.
- Setzen Sie das Pellet (P1) in BRB80 (Materialtabelle) mit dem gleichen Volumen wie SN1 wieder aus. Nehmen Sie das 1/100. P1-Volumen (200 l für 20 ml P1), und fügen Sie das gleiche Volumen von 2x Laemmli-Puffer hinzu, kochen Sie 5 min und lagern Sie bei -20 °C für weitere Analysen.
- Erste Polymerisation im Low-Molarity Buffer
- Bereiten Sie den Polymerisationsmix vor, indem Sie 1 Volumen SN1 (12 ml), 1/200volumen von 0,2 m GTP (60 l; Endkonzentration 1 mM) und 0,5 Volumen vorgewärmtes Glycerin (6 ml) in einem Schraubverschlussrohr mit dem entsprechenden Volumen kombinieren.
HINWEIS: Glycerin wird als Crowding-Agent in den Polymerisationsschritten im gesamten Protokoll verwendet und wird daher bei der Berechnung der Konzentrationen anderer Komponenten nicht berücksichtigt. - Pipette die Verwechslung nach oben und unten, sanft die Bildung von Luftblasen zu vermeiden und übertragen Sie es auf die entsprechenden Ultrazentrifugenrohre.
HINWEIS: Stellen Sie beim Übertragen der Mischung auf die Rohre das Gewicht der Rohre (paarweise) ein. Dies ermöglicht es dem Experimentator, nach dem Polymerisationsschritt direkt mit der Sedimentation von Mikrotubuli fortzufahren. Tun Sie dies für alle Polymerisationsschritte im gesamten Protokoll. - Die Rohre mit Parafilm bedecken, auf ein Wasserbad auf 30 °C übertragen und 20 min inkubieren.
- Zentrifugieren Sie die Rohre bei 150.000 × g, 30 °C für 30 min. Entfernen Sie den Überstand (SN2), und halten Sie das Pellet der polymerisierten Mikrotubuli (P2).
HINWEIS: Microtubule Pellet kann bis zu 1 Jahr lang bei -80 °C eingefroren und gelagert werden. - Nehmen Sie das 1/200-te Volumen von SN2 (90 l für 18 ml SN2) und fügen Sie das gleiche Volumen von 2x Laemmli Puffer hinzu, kochen Sie für 5 min, und lagern Sie bei -20 °C für weitere Analysen.
- Bereiten Sie den Polymerisationsmix vor, indem Sie 1 Volumen SN1 (12 ml), 1/200volumen von 0,2 m GTP (60 l; Endkonzentration 1 mM) und 0,5 Volumen vorgewärmtes Glycerin (6 ml) in einem Schraubverschlussrohr mit dem entsprechenden Volumen kombinieren.
- Erste Depolymerisation
- Depolymerisieren Sie Mikrotubuli durch Zugabe von eiskaltem BRB80 zum Pellet P2, und lassen Sie sie 5 min auf dem Eis: für Tubulin aus Zellen 1/60th (200 l) hinzufügen, und für Tubulin aus Gehirnen 1/20th (600 l) des Volumens des SN1 hinzufügen.
HINWEIS: Das Volumen des eiskalten BRB80, das dem Pellet während der Depolymerisationsschritte zugesetzt wird, ist immer relativ zum Volumen von SN1. - Setzen Sie das Mikrotubulipellet vorsichtig aus, um Luftblasen zu vermeiden, bis die Lösung vollständig homogen ist. Verwenden Sie eine p1000 Spitze für ein paar Zyklen der Pipetten, gefolgt von einer p200 Spitze alle 5 min, für 20 min (fünf Zyklen der Pipetten). Dies ist ein entscheidender Schritt für den Erfolg der Tubulinreinigung.
- Übertragen Sie die Lösung auf geeignete Ultrazentrifugenrohre und drehen Sie sie bei 150.000 × g, 4 °C für 20 min. Übertragen Sie den SN3 auf ein neues 1,5 ml Ultrazentrifugenrohr. Das nach diesem Zentrifugationsschritt (P3) gebildete Pellet enthält ausgefällte Proteine (mikrotubulie-assoziierte Proteine oder MAPs) und nicht-depolymerisierte Mikrotubuli. Der Überstand (SN3) enthält lösliche Komponenten: depolymerisierte Tubulin-Dimere und MAPs, die sich von den depolymerisierten Mikrotubuli gelöst haben.
- Nehmen Sie 1–4 L SN3, und fügen Sie 9 Bände 2x Laemmli Puffer, kochen für 5 min, und lagern Sie bei -20 °C für weitere Analysen.
- Setzen Sie das Pellet P3 in BRB80 (im gleichen Volumen von SN3) wieder auf, nehmen Sie 1–4 l, und fügen Sie 9 Bände mit 2x Laemmli-Puffer hinzu, kochen Sie für 5 min und lagern Sie bei -20 °C.
- Depolymerisieren Sie Mikrotubuli durch Zugabe von eiskaltem BRB80 zum Pellet P2, und lassen Sie sie 5 min auf dem Eis: für Tubulin aus Zellen 1/60th (200 l) hinzufügen, und für Tubulin aus Gehirnen 1/20th (600 l) des Volumens des SN1 hinzufügen.
- Zweite Polymerisation (in Hoch-Molarity-Puffer)
- Bereiten Sie den Polymerisationsmix vor, indem Sie 1 Volumen SN3 (200 l), 1 Volumen vorgewärmt1 M PIPES (200 l, Endkonzentration 0,5 m), 1/100th Volumen von 0,2 m GTP (2 l, Endkonzentration 1 mM) und 1 Volumen vorgewärmten Glycerin (200 l) in einem Rohr mit dem entsprechenden Volumen kombinieren.
- Pipette die Verwechslung nach oben und unten, Vermeidung der Bildung von Luftblasen, und übertragen Sie es auf Ultrazentrifugenrohre.
- Die Rohre mit Parafilm bedecken, in ein Wasserbad auf 30 °C geben und 20 min inkubieren.
- Zentrifugieren Sie die Rohre bei 150.000 × g, 30 °C für 30 min. Entfernen Sie den Überstand (SN4), und halten Sie das Pellet der polymerisierten Mikrotubuli (P4). Das Pellet P4 enthält die polymerisierten Mikrotubuli, und der Überstand SN4 enthält unpolymerisiertes Tubulin, MAPs und andere lösliche Proteine.
HINWEIS: Das Mikrotubulipellet nach dem zweiten Polymerisationsschritt kann bis zu einem Jahr bei -80 °C eingefroren und gelagert werden. - Nehmen Sie 1–4 l und fügen Sie 9 Bände 2x Laemmli Puffer, kochen für 5 min, und lagern Sie bei -20 °C für weitere Analysen.
- Zweite Depolymerisation
- Depolymerisieren Sie Mikrotubuli durch Zugabe von eiskaltem BRB80 zum Pellet P4, und lassen Sie sie 5 min auf dem Eis: für Tubulin aus Zellen 1/100th (120 l) hinzufügen, und für Tubulin aus Gehirnen 1/40th (300 l) des Volumens des SN1 hinzufügen.
- Pipette nach oben und unten mit einer p200 Spitze alle 5 min, für 20 min (fünf Zyklen der Pipetten).
- Übertragen Sie die Lösung auf ein 1,5 ml Ultrazentrifugenrohr und drehen Sie sie bei 150.000 × g, 4 °C für 20 min. Übertragen Sie den SN5 auf ein neues 1,5 ml Ultrazentrifugenrohr. Das nach diesem Zentrifugationsschritt (P5) gebildete Pellet enthält nicht-depolymerisierte Mikrotubuli. Der Überstand (SN5) enthält das lösliche Tubulin.
- Nehmen Sie 1–4 l und fügen Sie 9 Bände 2x Laemmli Puffer, kochen für 5 min, und lagern Sie bei -20 °C für weitere Analysen.
- Das Pellet P5 in BRB80 (gleiches Volumen von SN5) wieder aufhängen, 1–4 l nehmen und 9 Volumina mit 2x Laemmli-Puffer hinzufügen, 5 min kochen und bei -20 °C für weitere Analysen lagern.
- Dritte Polymerisation (in Low-Molarity Buffer)
- Bereiten Sie den Polymerisationsmix vor: 1 Volumen SN5 (120 l), 1/200t Volumen von 0,2 m GTP (0,6 l, Endkonzentration 1 mM) und 0,5 Volumen vorgewärmtes Glycerin (60 l) in einem Rohr mit dem entsprechenden Volumen.
- Pipette die Verwechslung nach oben und unten, sanft vermeidung bildung von Luftblasen, und übertragen Sie es auf die entsprechenden Ultrazentrifugenrohre.
- Die Rohre mit Parafilm bedecken, in ein Wasserbad auf 30 °C geben und 20 min inkubieren.
- Zentrifugieren Sie die Rohre bei 150.000 × g, 30 °C für 30 min. Das Pellet (P6) enthält polymerisierte Mikrotubuli und der Überstand SN6 kleine Mengen nicht polymerisierten Tubulins.
HINWEIS: Mikrotubuli-Pellets können bis zu einem Jahr bei -80 °C eingefroren und gelagert werden. - Nehmen Sie 1–4 l und fügen Sie 9 Bände 2x Laemmli Puffer, kochen für 5 min, und lagern Sie bei -20 °C für weitere Analysen.
- Dritte Depolymerisation
- Depolymerisieren Sie Mikrotubuli durch Zugabe von eiskaltem BRB80 zum Pellet P6, und lassen Sie sie 5 min auf dem Eis: für Tubulin aus Zellen 1/100th (120 l) hinzufügen, und für Tubulin aus Gehirnen 1/40th (300 l) des Volumens des SN1 hinzufügen.
- Pipette nach oben und unten mit einer p200 Spitze alle 5 min, für 20 min (fünf Zyklen der Pipetten).
- Übertragen Sie die Lösung auf die entsprechenden Ultrazentrifugenrohre und drehen Sie sie bei 150.000 × g, 4 °C für 20 min. Übertragen Sie SN7 auf ein neues 1,5 ml Ultrazentrifugenrohr. Das Pellet (P7) enthält geringe Mengen nicht-depolymerisierter Mikrotubuli. Der Überstand (SN7) enthält ausschließlich depolymerisierte Mikrotubuli (lösliches Tubulin).
- Nehmen Sie 1–4 l und fügen Sie 9 Bände 2x Laemmli Puffer, kochen für 5 min, und lagern Sie bei -20 °C für weitere Analysen.
- Das Pellet P7 in BRB80 (gleiches Volumen von SN7) wieder aufhängen, 1–4 l nehmen und 9 Volumina mit 2x Laemmli-Puffer hinzufügen, 5 min kochen und bei -20 °C für weitere Analysen lagern.
- Quantifizieren Sie die Menge an Tubulin (siehe Repräsentative Ergebnisse) und aliquot SN7 in kleine Mengen, Snap-Freeze, und lagern Sie bei -80 °C.
Ergebnisse
Das Hauptziel dieser Methode ist die Herstellung von hochwertigem, montagekompetentem Tubulin in Mengen, die für wiederholte In-vitro-Experimente mit den gereinigten Komponenten ausreichen. Aus diesem Tubulin zusammengesetzte Mikrotubuli können in Rekonstitutionstests verwendet werden, die auf der gesamten internen Reflexionsfluoreszenz-Mikroskopie (TIRF) mit dynamischen oder stabilen Mikrotubuli basieren, in Experimenten, die Mikrotubulidynamik, Wechselwirkungen mit MAPs oder molekularen Motoren und die Krafterzeugung durch die Motoren25testen. Sie können auch in microtubule-MAP Co-Pelleting Assays und Festkörper-NMR-Spektroskopie28verwendet werden.
Die Anreicherung und Reinheit von Tubulin während des gesamten Reinigungsprozesses kann mit einem Coomassie-gebeizten SDS-Polyacrylamid-Gel-Elektrophorese (PAGE)-Gel, vorzugsweise den "TUB" SDS-PAGE Gelen, überwacht werden, die die Trennung von α- und β-Tubulinen ermöglichen, die als einzelnes Band in klassischen Gelen mitmigrieren32. Lysate, die in verschiedenen Schritten gesammelt werden (mit Ausnahme der allerletzten Depolymerisation, siehe Protokoll), werden in vergleichbaren Mengen auf das Gel geladen, um den Erfolg der Tubulinreinigung zu bewerten (Abbildung 2A)24. Die letzte Tubulinprobe, die sehr kostbar ist, wird nur zur Bestimmung der Tubulinkonzentration auf das Gel geladen. Es ist normal, etwas Tubulin im Prozess der wiederholten Zyklen der Polymerisation und Depolymerisation zu verlieren. Eine niedrigere ausbeutete des endgültigen gereinigten Tubulins kann entweder (i) auf eine unvollständige Depolymerisation von Mikrotubuli zurückzuführen sein, visualisiert durch das Vorhandensein einer großen Menge Tubulin in den Fraktionen P3, P5 und P7, oder (ii) eine ineffiziente Tubulinpolymerisation in Mikrotubuli, in diesem Fall ist eine geringere Menge tubulin in den Fraktionen P2, P4 und P6 und höher in den Fraktionen SN2, SN4 und SN6 vorhanden (Abbildung 2B). Wenn das Tubulin während der Polymerisationsschritte verloren geht (niedrigere Mengen an P2 und P4) (i) eine ausreichende Tubulinkonzentration während der Polymerisation (ii) verwenden Sie ein frisches Aliquot von GTP, und/oder (iii) die Temperatur der Polymerisationsreaktion bestätigen. Wenn das Tubulin während der Depolymerisationsschritte verloren geht (niedrigere Mengen an SN3 und SN5), erhöhen Sie die Zeit sowie die Pipettierung der Mischung auf Eis.
Für die Quantifizierung von gereinigtem Tubulin führen Sie die Proben zusammen mit den bekannten Mengen an Rinderserumalbumin (BSA, 0,5 g – 1 g – 2 g – 4 g)(Abbildung 3A) auf SDS-PAGE aus. Gele sind mit Coomassie brillant blau gefärbt, gescannt, und die Intensitäten von BSA und Tubulin-Bänder werden durch quantitative Densitometrie gemessen (Abbildung 3B) wie in https://openwetware.org/wiki/Protein_Quantification_Using_ImageJ beschrieben. Bitte beachten Sie, dass die gleiche Analyse in Fidschi durchgeführt werden kann, eine aktualisierte Version von ImageJ33. Werte aus den BSA-Bändern wurden verwendet, um die lineare Regressionsgleichung zu bestimmen, die verwendet wurde, um die Proteinmenge in den Tubulinbändern zu berechnen. Zur Bestimmung der Tubulinkonzentration werden nur Tubulinbandintensitäten im Bereich der BSA-Kurve verwendet. Basierend auf der berechneten Tubulinkonzentration werden Aliquots der gewünschten Tubulinmengen hergestellt, in flüssigem Stickstoff eingefroren und bei -80 °C gelagert. Wir erhalten in der Regel etwa 2 mg Tubulin aus vier Spinnerflaschen mit HeLa S3 Suspensionskulturen (15 g Zellen), 250 g Tubulin aus zehn Gerichten mit einem Durchmesser von 15 cm (1,2 g Zellen) und 1 mg Tubulin aus 1 g Maushirngewebe.
Zur Bestätigung der Anreicherung eines bestimmten Tubulin-Isotyps oder einer Modifikation kann mit den entsprechenden Antikörpern34,35die Anreicherung eines bestimmten Tubulin-Isotyps oder eine Modifikation bestätigt werden. Die Kontrolle Tubulin variiert je nach Tubulin von Interesse. Für Tubulin modifiziert in vitro mit einem modifizierenden Enzym, verwenden Sie unbehandeltes Tubulin als Kontrolle. Für Tubulin, das in Cellulo durch die Überexpression eines modifizierenden Enzyms modifiziert wird, verwenden Sie Tubulin, das von Zellen gereinigt wird, die das Enzym nicht als Kontrolle ausdrücken (Abbildung 4A). Kontrolle Tubulin für Tubulin gereinigt von Knockout-Maus Gehirne werden Tubulin von wilden Typ Mäuse sein (Abbildung 4B). In allen Immunoblot-Analysen wird eine gleiche Tubulinbelastung mit einem PTM-unabhängigen Anti-α-Tubulin-Antikörper (12G10) überprüft.
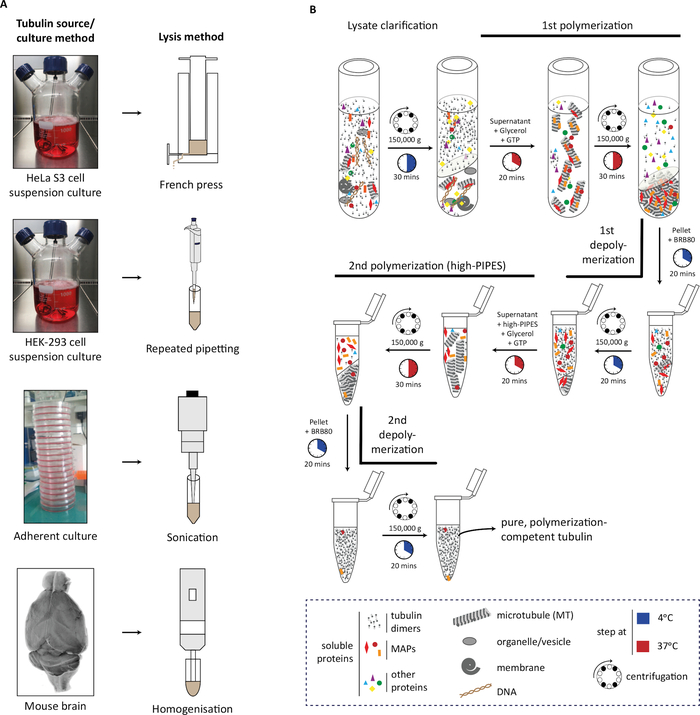
Abbildung 1: Tubulinreinigung aus verschiedenen Quellen mit Polymerisations-Depolymerisationszyklen. (A) Verschiedene Tubulinquellen werden mit spezifischen Strategien lysiert. HeLa S3 Zellen in Suspension kultiviert werden mit einer französischen Presse lysiert; HEK-293-Zellen werden durch repetitive Pipetten lysiert. Anhaftete Zellen wurden mit kurzen Pulsen der Beschallung und Maus-Hirngewebe mit einem Gewebe homogenisator lysiert. (B) Schematische Darstellung der aufeinanderfolgenden Schritte des Tubulinreinigungsprotokolls unter Verwendung von Zyklen der Kaltdepolymerisation und Warmpolymerisation. Nach Lyse- und Lysatklärung werden Mikrotubuli polymerisiert und pelletiert. Mikrotubuli werden dann depolymerisiert und anschließend in einem Hochmolaritätspuffer polymerisiert, wodurch eine Kosedimentation des mikrotubuli-assoziierten Proteins (MAP) mit den Mikrotubuli verhindert wird. MAP-freie Mikrotubuli werden dann depolymerisiert und können einem dritten Zyklus der Polymerisations-Depolymerisation unterzogen werden, um Spuren mengen des Hochmolaritätspuffers zu entfernen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Bewertung des Erfolgs der Tubulinreinigung. Proben, die in verschiedenen Schritten des Tubulin-Reinigungsprotokolls gesammelt wurden, wurden auf einem "TUB"-Natriumdodecylsulfat-Polyacrylamid-Gel-Elektrophorese (SDS-PAGE)-Gel (siehe Protokoll für Details) ausgeführt und mit Coomassie-Brillantblau gebeizt. (A) Bei einer erfolgreichen Tubulinreinigung werden α- und β-Tubuline während des gesamten Prozesses schrittweise angereichert. Nach der zweiten Polymerisation ist das Mikrotubulipellet (P4) praktisch frei von Verunreinigungen durch andere Proteine oder mikrotubulieassoziierte Proteine (MAPs). Beachten Sie, dass es normal ist, etwas Tubulin während des Eingriffs zu verlieren. (B) Bei einer erfolglosen Tubulinreinigung ist die endgültige Tubulinausbeute gering, und Tubulin verbleibt entweder im Pellet nach der Depolymerisation oder im Überstand nach Polymerisation (rote Felder). Im hier gezeigten Beispiel polymerisiert Tubulin in beiden Polymerisationsschritten nicht effizient. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Quantifizierung des gereinigten Tubulins mit Coomassie-gebeiztem Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese (SDS-PAGE) Gele und Densitometrie. (A) Coomassie-gefärbtes SDS-PAGE-Gel mit bekannten Mengen Rinderserumalbumin (BSA; 0,5, 1, 2 und 4 g, graue Gradientenlinie) und verschiedenen Volumina (0,5 bzw. 1 l, helle bzw. dunkle Farben) von gereinigtem Tubulin. Im gezeigten Beispiel wurden tyrosiniertes Tubulin (HeLa S3 Tubulin, helles und dunkles Orange) und detyrosiniertes Tubulin (HeLa S3 Tubulin behandelt mit Carboxypeptidase A, hell und dunkelblau) auf das Gel geladen. (B) BSA-Bänder von (A) wurden mit ImageJ (in beliebigen Einheiten, AU) quantifiziert und gegen die Menge des geladenen Proteins (graue bis schwarze Punkte) geplottet. Diese Punkte wurden verwendet, um die lineare Regressionslinie (die graue Gradientenlinie) und die Gleichung zu berechnen, die verwendet wurden, um die Proteinmengen in den Tubulinproben (helle und dunkle orange und blaue Punkte) zu berechnen, die auf das Gel geladen wurden. Dies erleichterte die Berechnung der Konzentration der Tubulinproben. Beachten Sie, dass die Punkte, die über die BSA-Standardkurve hinausgehen, nicht zur Bestimmung der Konzentration verwendet werden sollten (dunkelorange und blaue Punkte). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
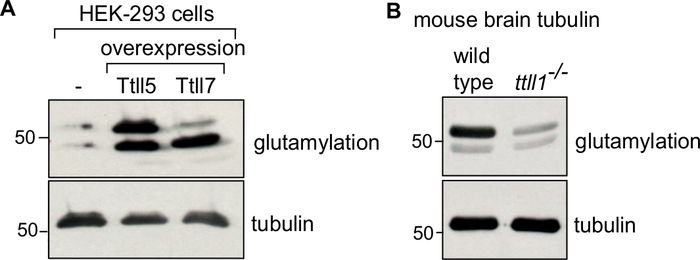
Abbildung 4: Immunoblot-Analyse von gereinigtem Tubulin mit verschiedenen PTMs. (A) Tubuline, die aus HEK-293-Zellen gereinigt wurden: Wildtyp oder Zellen, die TTLL5 oder TTLL7 überexzättigten, wurden mit dem GT335-Antikörper auf die spezifische Anreicherung der Polyglutamylierung untersucht. Während die TTLL5-Überexpression die Polyglutamylierung auf α- und β-Tubulin erhöht, bereichert die TTLL7-Überexpression speziell β-Tubulin-Glutamylierung. (B) Tubulin gereinigt aus Gehirngeweben wilden Typs und ttll1-/- Mäuse wurden auf Muster der Glutamylierung analysiert. Beachten Sie die starke Reduktion der Polyglutamylierung von Tubulin von ttll1-/- Mäusen, denen die Haupthirnglutamylase TTLL136fehlt. "TUB"-Gelwurden verwendet, um α- und β-Tubulin zu trennen. Eine gleiche Menge an Tubulinbelastung wurde durch 12G10, einen Anti-α-Tubulin-Antikörper, bestätigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die hier beschriebene Methode bietet eine Plattform, um schnell hochwertiges, montagekompetentes Tubulin in mittelgroßen Mengen aus Zelllinien und einzelnen Mausgehirnen zu erzeugen. Es basiert auf dem Gold-Standard-Protokoll der Tubulinreinigung von Rinderhirnen, die seit vielen Jahren im Feld verwendet werden16,17. Ein besonderer Vorteil des Ansatzes ist die Verwendung von Suspensionskulturen von HeLa S3-Zellen, die, sobald sie etabliert sind, große Mengen an Zellen ergeben, während sie wenig Praktische Zeit benötigen. Dies macht das Protokoll relativ einfach in jedem Zellbiologielabor durchzuführen, während andere Tubulinreinigungsmethoden18,19,32,37 spezifische Ausrüstung und Know-how erfordern und daher meist von Laboratorien mit einem starken Hintergrund in der Proteinreinigung verwendet werden. Bei der Herstellung kleinerer Mengen tubulin aus anhaftenden Zelllinien kann eine Vielzahl von Zelllinien verwendet werden. Wir haben Tubulin erfolgreich aus HeLa-, U-2 OS- und HEK-293-Zellen gereinigt. Wenn eine größere Reinigung erforderlich ist, können geerntete Zellen oder Gehirne im Lysepuffer eingefroren und bei -80 °C gespeichert werden, und mehrere Zellpellets oder Gehirne können zusammengepoolt werden, um größere Mengen Tubulin zu reinigen.
Tubulin, gereinigt aus Zelllinien, ist praktisch frei von Tubulin-PTMs. Dieses Tyr-Tubulin kann leicht in einem einzigen einfachen Schritt25in detyrosiniertes (deTyr-) Tubulin umgewandelt werden. Um Tubulin mit anderen PTMs zu produzieren, können spezifische Tubulin-modifizierende Enzyme in Zellen vor der Tubulinreinigung überexprimiert werden. Darüber hinaus hilft die Verwendung von Zelllinien menschlichen Ursprungs als Materialquelle, mögliche artenübergreifende Probleme bei der Untersuchung von Wechselwirkungen zwischen Mikrotubuli und menschlichen MAPs zu vermeiden. Darüber hinaus kann Tubulin aus untransformierten (wie HEK293) oder transformierten (wie HeLa) Zellen Informationen über die Auswirkungen von mikrotubuliegerichteten Medikamenten (z. B. Taxane) auf normal- vs. Tumorzellmikrotubuli liefern.
Schließlich erleichtert unser Protokoll die Reinigung von Tubulin von einzelnen Mausgehirnen. Da immer mehr Mausmodelle von Tubulinmutationen und Modifikationen erzeugt werden, ermöglicht dieses Protokoll eine direkte Analyse der Eigenschaften und Wechselwirkungen von Mikrotubuli mit veränderter Tubulin-Isotypzusammensetzung38,39,40 oder Tubulin-PTMs31,41.
Der Ansatz basiert auf Zyklen der Polymerisation und Depolymerisation. So können spezifische Tubulin-Isotypen oder Tubulin mit bestimmten PTMs, die die Montage- und Demontageeigenschaften von Mikrotubuli beeinflussen, zu einem unverhältnismäßigen Verlust oder einer Verringerung solcher Tubulinformen während des Reinigungsprozesses führen. Nichtsdestotrotz haben wir gezeigt, dass wichtige Tubulin-PTMs, wie Acetylierung, Detyrosinierung, Glutamylierung und Glykolation, während des gesamten Tubulinreinigungsprozesses auf den Mikrotubuli zurückgehalten werden24. Es sollte jedoch beachtet werden, dass für quantitative Analysen der Tubulinzusammensetzung in Zellen oder Geweben der TOG-Spalten-basierte Tubulinreinigungsansatz besser geeignet ist, da er eine unvoreingenommene, polymerisationsunabhängige Tubulinreinigung ermöglichen würde18. Trotz seiner Einschränkung bietet unser Protokoll einen großen Vorteil bei der Erzeugung großer Mengen an hochwertigem Tubulin, das in sorgfältigen In-vitro-Rekonstitutionsexperimenten verwendet werden kann. Insbesondere erleichtert es die Verwendung von PTM-reichem Hirntubulin in Routineexperimenten.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde unterstützt durch den ANR-10-IDEX-0001-02, den LabEx Cell'n'Scale ANR-11-LBX-0038 und das Institut de convergence Q-life ANR-17-CONV-0005. Cj wird vom Institut Curie, der französischen National Research Agency (ANR) vergeben ANR-12-BSV2-0007 und ANR-17-CE13-0021, dem Institut National du Cancer (INCA) Grant 2014-PL BIO-11-ICR-1 und der Fondation pour la Recherche Medicale (FRM) Grant DEQ2017036756. MMM wird durch das Fondation Vaincre Alzheimer Stipendium FR-16055p und durch das France Alzheimer Grant AAP SM 2019 n°2023 unterstützt. JAS wurde durch das Forschungs- und Innovationsprogramm Horizont 2020 der Europäischen Union im Rahmen der Marie-Skodowska-Curie-Zuschussvereinbarung Nr. 675737 und des FRM-Zuschusses FDT201904008210 unterstützt. SB wurde durch den FRM-Zuschuss FDT201805005465 unterstützt.
Wir danken allen Mitgliedern des Janke-Labors, insbesondere J. Souphron, sowie G. Lakisic (Institut MICALIS, AgroParisTech) und A. Gautreau (Ecole Polytechnique) für die Hilfe bei der Erstellung des Protokolls. Wir danken der Tieranlage des Institut Curie für die Hilfe bei der Mauszucht und -pflege.
Der von J. Frankel und M. Nelson entwickelte Antikörper 12G10 wurde von der Developmental Studies Hybridoma Bank gewonnen, die unter der Schirmherrschaft der NICHD entwickelt und von der University of Iowa gepflegt wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 M MgCl2 | Sigma | #M1028 | |
| 1-L cell culture vessels | Techne F7610 | Used for spinner cultures. Never stir the empty spinner bottles. When spinner bottles are in the cell culture incubator, always keep the lateral valves of spinner bottles slightly open to facilitate the equilibration of media with incubator’s atmosphere. After use, fill the spinner bottles immediately with tap water to avoid drying of remaining cells on the bottle walls. Wash the bottles with deionised water, add app 200 ml of deionised water and autoclave. Under a sterile cell culture hood remove the water and allow the bottles to dry completely, still under the hood, for several hours. Never use detergents for cleaning the spinner bottles because any trace amounts of the detergent can be deleterious to the cells. | |
| 1.5- and 2-ml tubes | |||
| 14-ml round-bottom tubes | |||
| 15-cm-diameter sterile culture dishes | |||
| 15-ml screw-cap tubes | |||
| 2-mercaptoethanol | Sigma | #M3148 | 2-mercaptoethanol is toxic and should be used under the hood. |
| 4-(2-aminoethyl)-benzenesulfonyl fluoride | Sigma | #A8456 | |
| 40% Acrylamide | Bio-Rad | #161-0140 | |
| 5-, 10- 20-ml syringes | |||
| 5-ml, 10-ml, 25-ml sterile pipettes | |||
| 50-ml screw-cap tubes | |||
| Ammonium persulfate (APS) | Sigma | #A3678 | |
| Anti-alpha-tubulin antibody, 12G10 | Developed by J. Frankel and M. Nelson, obtained from the Developmental Studies Hybridoma Bank, developed under the auspices of the NICHD, and maintained by the University of Iowa | dilution: 1/500 | |
| Anti-glutamylated tubulin antibody, GT335 | AdipoGen | #AG-20B-0020 | dilution: 1/20,000 |
| Aprotinin | Sigma | #A1153 | |
| Balance (0.1 – 10 g) | |||
| Beckman 1-l polypropylene bottles | For collecting spinner cultures | ||
| Beckman Avanti J-26 XP centrifuge | For collecting spinner cultures | ||
| Biological stirrer | Techne MCS-104L | Installed in the cell culture incubator (for spinner cultures), 25 rpm for Hela S3 and HEK 293 cells | |
| Bis N,N’-Methylene-Bis-Acrylamide | Bio-Rad | #161-0201 | |
| Blender IKA Ultra-Turrax® | For lysing brain tissue, use 5-mm probe, with the machine set at power 6 or 7. Blend the brain tissue 2-3 times for 15 s on ice. | ||
| Bovine serum albumin (BSA) | Sigma | #A7906 | |
| Bromophenol blue | Sigma | #1.08122 | |
| Carboxypeptidase A (CPA) | Sigma | #C9268 | Concentration: 1.7 U/µl |
| Cell culture hood | |||
| Cell culture incubator set at 37°C, 5% CO2 | |||
| Dimethyl sulfoxide (DMSO) | Sigma | #D8418 | DMSO can enhance cell and skin permeability of other compounds. Avoid contact and use skin and eye protection. |
| DMEM medium | Life Technologies | #41965062 | |
| DTT, DL-Dithiothreitol | Sigma | #D9779 | |
| EDTA | Euromedex | #EU0007-C | |
| EGTA | Sigma | #E3889 | |
| Ethanol absolute | Fisher Chemical | #E/0650DF/15 | |
| Fetal bovine serum (FBS) | Sigma | #F7524 | |
| French pressure cell press | Thermo electron corporation | #FA-078A | with a #FA-032 cell; for lysing big amounts of cells. Set at medium ratio, and the gauge pressure of 1,000 psi (corresponds to 3,000 psi inside the disruption chamber). |
| Glycerol | VWR Chemicals | #24388.295 | |
| Glycine | Sigma | #G8898 | |
| GTP | Sigma | #G8877 | |
| Heating block | Stuart | #SBH130D | |
| Hela cells | ATCC® CCL-2™ | ||
| Hela S3 cells | ATCC | ATCC® CCL-2.2™ | |
| Hydrochloric acid (HCl ) | VWR | #20252.290 | |
| Inverted microscope | With fluorescence if cell transfection is to be verified | ||
| Isopropanol | VWR | #20842.298 | |
| jetPEI | Polyplus | #101 | |
| JLA-8.1000 rotor | For collecting spinner cultures | ||
| KOH | Sigma | #P1767 | KOH is corrosive and causes burns; use eye and skin protection. |
| L-Glutamine | Life Technologies | #25030123 | |
| Laboratory centrifuge for 50-ml tubes | Sigma | 4-16 K | |
| Leupeptin | Sigma | #L2884 | |
| Liquid nitrogen | |||
| Micro-pipettes p2.5, p10, p20, p100, p200 and p1000 and corresponding tips | |||
| Micropestles | Eppendorf | #0030 120.973 | |
| Mouse brain tissue | Animal care and use for this study were performed in accordance with the recommendations of the European Community (2010/63/UE). Experimental procedures were specifically approved by the ethics committee of the Institut Curie CEEA-IC #118 (authorization no. 04395.03 given by National Authority) in compliance with the international guidelines. | ||
| Needles 18G X 1 ½” (1.2 X 38 mm | Terumo | #18G | |
| Needles 20G X 1 ½” (0.9 X 38 mm | Terumo | #20G | |
| Needles 21G X 4 ¾” (0.8 X 120 mm | B.Braun | #466 5643 | |
| Parafilm | |||
| PBS | Life Technologies | #14190169 | |
| Penicillin-Streptomycin | Life Technologies | #15140130 | |
| pH-meter | |||
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma | #P7626 | PMSF powder is hazardous. Use skin and eye protection when preparing PMSF solutions. |
| PIPES | Sigma | #P6757 | |
| Pipette-boy | |||
| Rotors | Beckman 70.1 Ti; TLA-100.3; and TLA 55 | ||
| SDS-PAGE electrophoresis equipment | Bio-Rad | #1658001FC | |
| SDS, Sodium dodecyl sulphate | VWR | #442444H | For preparing Laemmeli buffer |
| SDS, Sodium dodecyl sulphate | Sigma | #L5750 | For preparing 'TUB' SDS-PAGE gels |
| Sonicator | Branson | #101-148-070 | Used for lysing cells grown as adherent cultures. Use 6.5 mm diameter probe, set the sonicator at “Output control” 1, “Duty cycle” 10% and time depending on the cell type used. |
| Tabletop centrifuge for 1.5 ml tubes | Eppendorf | 5417R | |
| TEMED, N, N, N′, N′-Tetramethylethylenediamine | Sigma | #9281 | |
| Trichostatin A (TSA) | Sigma | #T8552 | |
| Triton X-100 | Sigma | #T9284 | |
| Trizma base (Tris) | Sigma | #T1503 | |
| Trypsin | Life Technologies | #15090046 | |
| Ultracentrifuge rotors | TLA-55, TLA-100.3 and 70.1 Ti rotors | Set at 4°C or 30°C based on the need of the experiment | |
| Ultracentrifuge tubes | Beckman | #357448 | for using with TLA-55 rotor |
| Ultracentrifuge tubes | Beckman | #349622 | for using with TLA-100.3 rotor |
| Ultracentrifuge tubes | Beckman | #355631 | for using with 70.1 Ti rotor |
| Ultracentrifuges | Beckman | Optima L80-XP (or equivalent) and Optima MAX-XP (or equivalent) | Set at 4°C or 30°C based on the need of the experiment |
| Vortex mixer | |||
| Water bath equipped with floaters or tube holders | Set at 30°C |
Referenzen
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Janke, C. The tubulin code: Molecular components, readout mechanisms, and functions. Journal of Cell Biology. 206 (4), 461-472 (2014).
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews: Molecular Cell Biology. 21 (6), 307-326 (2020).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Margolis, R. L., Wilson, L. Opposite end assembly and disassembly of microtubules at steady state in vitro. Cell. 13 (1), 1-8 (1978).
- Borisy, G. G., Olmsted, J. B. Nucleated assembly of microtubules in porcine brain extracts. Science. 177 (55), 1196-1197 (1972).
- Kirschner, M. W., Williams, R. C. The mechanism of microtubule assembly in vitro. Journal of Supramolecular Structure. 2 (2-4), 412-428 (1974).
- Baas, P. W., Lin, S. Hooks and comets: The story of microtubule polarity orientation in the neuron. Developmental Neurobiology. 71 (6), 403-418 (2011).
- Stepanova, T., et al. Visualization of microtubule growth in cultured neurons via the use of EB3-GFP (end-binding protein 3-green fluorescent protein). Journal of Neuroscience. 23 (7), 2655-2664 (2003).
- Nedelec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Bieling, P., Telley, I. A., Surrey, T. A minimal midzone protein module controls formation and length of antiparallel microtubule overlaps. Cell. 142 (3), 420-432 (2010).
- Roostalu, J., et al. Directional switching of the kinesin Cin8 through motor coupling. Science. 332 (6025), 94-99 (2011).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nature Materials. 14 (11), 1156-1163 (2015).
- Hendricks, A. G., Goldman, Y. E., Holzbaur, E. L. F. Reconstituting the motility of isolated intracellular cargoes. Methods in Enzymology. 540, 249-262 (2014).
- Dogterom, M., Surrey, T. Microtubule organization in vitro. Current Opinion in Cell Biology. 25 (1), 23-29 (2013).
- Vallee, R. B. Reversible assembly purification of microtubules without assembly-promoting agents and further purification of tubulin, microtubule-associated proteins, and MAP fragments. Methods in Enzymology. 134, 89-104 (1986).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Widlund, P. O., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Molecular Biology of the Cell. 23 (22), 4393-4401 (2012).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Letters. 587 (21), 3450-3455 (2013).
- Uchimura, S., et al. A flipped ion pair at the dynein-microtubule interface is critical for dynein motility and ATPase activation. Journal of Cell Biology. 208 (2), 211-222 (2015).
- Pamula, M. C., Ti, S. C., Kapoor, T. M. The structured core of human beta tubulin confers isotype-specific polymerization properties. Journal of Cell Biology. 213 (4), 425-433 (2016).
- Vemu, A., et al. Structure and dynamics of single-isoform recombinant neuronal Human tubulin. Journal of Biological Chemistry. 291 (25), 12907-12915 (2016).
- Ti, S. C., Alushin, G. M., Kapoor, T. M. Human beta-tubulin isotypes can regulate microtubule protofilament number and stability. Developmental Cell. 47 (2), 175-190 (2018).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nature Protocols. 14, 1634-1660 (2019).
- Barisic, M., et al. Microtubule detyrosination guides chromosomes during mitosis. Science. 348 (6236), 799-803 (2015).
- Nirschl, J. J., Magiera, M. M., Lazarus, J. E., Janke, C., Holzbaur, E. L. F. alpha-Tubulin tyrosination and CLIP-170 phosphorylation regulate the initiation of dynein-driven transport in neurons. Cell Reports. 14 (11), 2637-2652 (2016).
- Guedes-Dias, P., et al. Kinesin-3 responds to local microtubule dynamics to target synaptic cargo delivery to the presynapse. Current Biology. 29 (2), 268-282 (2019).
- Luo, Y., et al. Direct observation of dynamic protein interactions involving human microtubules using solid-state NMR spectroscopy. Nature Communications. 11 (1), 18(2020).
- Even, A., et al. ATAT1-enriched vesicles promote microtubule acetylation via axonal transport. Science Advances. 5 (12), 2705(2019).
- Wolff, J., Sackett, D. L., Knipling, L. Cation selective promotion of tubulin polymerization by alkali metal chlorides. Protein Science. 5 (10), 2020-2028 (1996).
- Magiera, M. M., et al. Excessive tubulin polyglutamylation causes neurodegeneration and perturbs neuronal transport. EMBO Journal. 37 (23), 100440(2018).
- Lacroix, B., Janke, C. Generation of differentially polyglutamylated microtubules. Methods in Molecular Biology. 777, 57-69 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Magiera, M. M., Janke, C. Methods in Cell Biology Vol. 115 Microtubules, in vitro. Correia, J. J., Wilson, L. , Academic Press. 247-267 (2013).
- Hausrat, T. J., Radwitz, J., Lombino, F. L., Breiden, P., Kneussel, M. Alpha- and beta-tubulin isotypes are differentially expressed during brain development. Developmental Neurobiology. , (2020).
- Janke, C., et al. Tubulin polyglutamylase enzymes are members of the TTL domain protein family. Science. 308 (5729), 1758-1762 (2005).
- Newton, C. N., et al. Intrinsically slow dynamic instability of HeLa cell microtubules in vitro. Journal of Biological Chemistry. 277 (45), 42456-42462 (2002).
- Belvindrah, R., et al. Mutation of the alpha-tubulin Tuba1a leads to straighter microtubules and perturbs neuronal migration. Journal of Cell Biology. 216 (8), 2443-2461 (2017).
- Breuss, M., et al. Mutations in the murine homologue of TUBB5 cause microcephaly by perturbing cell cycle progression and inducing p53 associated apoptosis. Development. , (2016).
- Latremoliere, A., et al. Neuronal-specific TUBB3 is not required for normal neuronal function but is essential for timely axon regeneration. Cell Reports. 24 (7), 1865-1879 (2018).
- Morley, S. J., et al. Acetylated tubulin is essential for touch sensation in mice. Elife. 5, (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten