Method Article
Endoskopik Endonazal Kafatası Taban Cerrahisinde Difüzyon MRI Tractografisinin Rolü
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Difüzyon MRI tractografisini hasta çalışmalarında kafatası tabanı tümörü için endoskopik endonazal cerrahiye entegre etmek için bir protokol sunuyoruz. Ameliyat öncesi ve sonrası evrelerde bu nörogörüntüleme çalışmalarını benimseme yöntemleri açıklanmıştır.
Özet
Endoskopik endonazal cerrahi karmaşık kafatası tabanı tümörlerinin yönetiminde önemli bir rol kazanmıştır. Burun boşlukları tarafından temsil edilen doğal anatomik ekstra-kranial bir yol aracılığıyla büyük bir iyi huylu ve kötü huylu lezyon grubunun rezeksiyonu sağlar, beyin geri çekilmesi ve nörovasküler manipülasyondan kaçınır. Bu, hastaların hızlı klinik iyileşmesi ve geleneksel kafatası tabanı cerrahisinin ana uyarısını temsil eden kalıcı nörolojik sekel riskinin düşük olması ile yansır. Bu ameliyat, çoğunlukla ameliyat öncesi nörogörüntleme üzerine kurulu, özellikleri ve çevredeki sinirsel yapılarla ilişkisi göz önünde bulundurularak her özel vakaya göre uyarlanmalıdır. Tractografi gibi gelişmiş MRI teknikleri, teknik sorunlar nedeniyle kafatası taban cerrahisinde nadiren benimsenmiştir: nöronavigasyon sistemine dahil edilmek üzere güvenilir rekonstrüksiyonlar oluşturmak için uzun ve karmaşık süreçler.
Bu makale, kurumda uygulanan protokolü sunmayı amaçlamaktadır ve her hasta için en uygun tedaviyi seçmek, cerrahi sonuçları iyileştirmek ve bu alanda kişiselleştirilmiş tıbbın ilerlemesini takip etmek amacıyla nöro cerrahlar ve nörogörüntür ekibi (nörologlar, nöroradyologlar, nöropsikologlar, fizikçiler ve biyomühendisler) arasındaki sinerjik işbirliğini ve ekip çalışmasını vurgulamaktadır.
Giriş
Kafatası tabanı orta çizgisine ve paramedian bölgelere ön yoldan yaklaşma, burun fossaesini doğal boşluklar olarak benimseme olasılığı, bir yüzyıldan daha eskiye dayanan uzun bir geçmişe sahiptir1. Bununla birlikte, son 20 yılda görselleştirme ve operatif teknolojiler, bu bölgelerin cerraha panoramik ve ayrıntılı 2D/3D görünümünü veren endoskopun(1) tanıtılması nedeniyle meningiomalar, konkordatolar, kondrosarkomlar ve kraniyofarinjiomlar 1 gibi en karmaşık tümörlerin tedavisini dahil etme olasılıklarını genişletecek kadar gelişmiştir. (2) intraoperatif nöronavigasyon sistemlerinin geliştirilmesi ve (3) özel cerrahi aletlerin uygulanması. Kassam ve arkadaşları tarafından titizlikle gösterildiği ve birden fazla inceleme ve meta-analizle doğrulanan gibi, bu cerrahi yaklaşımın avantajları esas olarak zorlu kafatası tabanı tümörlerini resect etme, herhangi bir doğrudan beyin geri çekilmesinden veya sinir manipülasyonundan kaçınma şansı ile temsil edilir, böylece cerrahi komplikasyon riskini azaltır ve uzun süreli nörolojik ve görsel sekel2,3,4, 5,6,7,8,9,10,11,12.
Birden fazla kafatası tabanı ve hipofiz-dienfalik tümörler için, ideal cerrahi hedef son yıllarda hastanın yaşam kalitesini korumak için nörolojik fonksiyonların korunması ile mümkün olan en kapsamlı tümör çıkarılmasından en güvenli şekilde çıkarılmasına kadar değişmiştir3. Bu sınırlama, radyasyon tedavisi (uygun olduğunda proton veya karbon iyonları gibi büyük parçacıkların benimsenmesi) ve seçilen neoplazmlar için kraniyofarenjiomlar için BRAF/ MEK yolunun inhibitörleri olarak kemoterapi gibi yenilikçi ve etkili adjuvan tedavilerle telafi edilebilir13,14,15.
Bununla birlikte, bu hedefleri takip etmek için, cerrahi stratejiyi her vakanın özel özelliğine göre uyarlamak için dikkatli bir ameliyat öncesi değerlendirme çok önemlidir2. Çoğu merkezde, MRI ameliyat öncesi protokolü genellikle sadece lezyonun morfolojik karakterizasyonunu sağlayan standart yapısal dizilerle gerçekleştirilir. Bununla birlikte, bu tekniklerle tümörün bitişik yapılarla anatomik ilişkisini güvenilir bir şekilde değerlendirmek her zaman mümkün değildir3. Ayrıca, her hasta sadece difüzyon MRI tractografisi ve fonksiyonel MRI (fMRI) ile tespit edilebilen farklı patoloji kaynaklı fonksiyonel yeniden düzenleme profilleri sunabilir ve bu profiller hem ameliyat planlamasında hem de intraoperatif adımlar16,17'derehberlik sağlamak için kullanılabilir.
Şu anda, fMRI, cerrahi planlama18,19 ve hastaların sonuçlarını iyileştirmek için rehberlik olarak beyin fonksiyonel aktivitesini ve bağlantısını haritalamak için en yaygın kullanılan nörogörüntleme modalitesidir20. Görev tabanlı fMRI, işlevsel olarak belirli görev performansına (örneğin, parmakla dokunma, fonmik akıcılık) dahil olan, ancak kafatası tabanı tümörlerinin incelenmesi için geçerli olmayan "belagatli" beyin bölgelerini tanımlamak için tercih edilmesi gereken modalitedir.
Difüzyon MRI çektirme in vivo ve beyaz madde beyin bağlantılarının yanı sıra kraniyal sinirlerin noninvaziv rekonstrüksiyonuna izin verir, beyin hodolojik yapısını araştırır21. Her beyin voksel içinde değerlendirilen su molekülü difüzyasyon profillerini birbirine bağlayarak aksonal yolları yeniden oluşturmak için farklı tractografi algoritmaları geliştirilmiştir. Deterministik tractografi baskın difüzyellik yönünü takip ederken, olasılıksal tractografi olası yolların bağlantı dağılımını değerlendirir. Ek olarak, her voksel içindeki difüzyonu değerlendirmek için farklı modeller uygulanabilir ve iki ana kategori tanımlamak mümkündür: tek bir lif oryantasyonunun değerlendirildiği difüzyon tensör modeli gibi tek fiber modeller ve birkaç geçiş lifi yöneliminin yeniden inşa edildiği küresel dekonvolüsiyon gibi çoklu fiber modeller22,23. Difüzyon MRI tractografisi hakkındaki metodolojik tartışmalara rağmen, nöroşirürjik iş akışındaki faydası şu anda belirlenmiştir. Beyaz madde yolu çıkığı ve tümöre olan uzaklığı değerlendirmek, spesifik beyaz madde bağlantılarını korumak mümkündür. Ayrıca, difüzyon tensör görüntüleme (DTI) haritaları, özellikle fraksiyonel anizotropi (FA) ve ortalama difüzyozite (MD), olası tümör infiltrasyonu ile ilgili mikroyapısal beyaz madde değişikliklerini değerlendirmek ve boyuna sistem izleme için uygulanabilir. Tüm bu özellikler difüzyon MRI tractografiyi hem ameliyat öncesi planlama hem de nöronavigasyon sistemleri aracılığıyla ameliyat içi karar verme için güçlü bir araç haline getirir24.
Bununla birlikte, kafatası taban cerrahisine tractografi tekniklerinin uygulanması, nöronavigasyon sistemlerinde difüzyon MRI dizi alımını, analiz protokolünü ve tractografi sonuçlarını optimize etmek için özel teknik bilgiye ve zaman alıcı çalışmaya duyulan ihtiyaçla sınırlıdır25. Son olarak, daha fazla sınırlama, bu analizleri intraparenkimalden ekstra-parenkimal beyaz madde yapılarına, kraniyal sinirler olarak genişleten teknik zorluklardan kaynaklanmaktadır. Nitekim, sadece son çalışmalar ileri MRI ve kafatası taban cerrahisi26 , 27,28entegre etmeye çalışan ön sonuçlar sundu.
Bu makale, difüzyon MRI tractografisi kullanılarak hipofiz-dienfalik ve kafatası tabanı tümörlerinin multidisipliner yönetimi için bir protokol sunun. Bu protokolün kurumda uygulanması, nöro cerrahlar, nöro-endokrinologlar ve nörogörüntürleme ekibi (klinik ve biyoinformatik uzmanlığı dahil) arasındaki işbirliğinden ve bu hastalara etkili bir entegre çoklu eksenel yaklaşım sunmaktan ortaya çıktı.
Merkezde, kafatası tabanı tümörleri olan hastaların yönetimi, mümkün olan en bilgilendirici tanımın sağlanması ve cerrahi planın uyarllaştırılması ve kişiselleştirilmek için multidisipliner protokoller entegre ettik. Bu protokolün, kafatası tabanı tümörü olan herhangi bir hastanın tedavi stratejisine rehberlik etmesi ve bu lezyonların neden olduğu beyin modifikasyonları hakkındaki bilgileri geliştirmesi için hem klinik hem de araştırma ortamında benimsenebileceğini gösteriyoruz.
Protokol
Protokol, Yerel Araştırma Komitesi'nin etik standartlarını ve 1964 Helsinki bildirgesini ve daha sonraki değişikliklerini veya karşılaştırılabilir etik standartlarını takip ediyor.
1. Hastaların seçimi
- Aşağıdaki dahil etme kriterlerini benimseyin: 18 yaşından büyük, tamamen işbirliği yapan, kafatası tabanının bir tümörünü veya hipofiz-dienfalik bölgesini sunan hastalar.
- MRI'a kontrendikasyonu olan (yani kalp pili veya ferromanyetik materyal) veya acil klinik durumlarla (yani intrakraniyal hipertansiyon, acil ameliyat gerektiren akut görme kaybı) veya hamile kadınları veya akıl hastalığı olan hastaları veya bu protokole katılmayı açıkça reddeden hastaları hariç tutun.
2. MR sınavına hazırlık
- MRI sınavından önce, sınava önemli kontrendikasyonu ve kontrast maddesi enjeksiyonunu hariç tutmak için güvenlik formunu yönetin: vücutta ferromanyetik malzeme yok, MRI cihazlarının değerlendirilmesi, güvenli veya şartlı, kalp pili yok, göz kontakt lensleri yok.
- MRI alımı için kullanılan tarayıcı yüksek bir alansa (örneğin, 3 T, Bkz. Malzeme Tablosu),örneğin nörostimülasyon cihazlarıyla ilgili olası ek kontrendikasyonları göz önünde bulundurun.
- Hastanın klostrofobisi olup olmadığını kontrol edin.
- Hastanın görüntüleme sınavının risklerini ve faydalarını kabul etmek için MRI onay formunu okuyup imzaladığından emin olun.
- Bir nöropsikologun tümör konumuna göre genel bir değerlendirme ve hedeflenen bir nörokrenişsel değerlendirme yapması.
- El baskınlığını değerlendirmek için Edinburgh envanterini yönetin29.
3. Hastanın tarayıcıda konumlandırılması
- MRI gürültüsünü azaltmak için hastaya kulak tıkacı verin.
- Kafa hareketleri görüntüleme kalitesini etkileyebilir; bu nedenle, kafa hareketlerini azaltmak için köpük pedler kullanın, başı MRI bobini içinde hareketsiz hale getirmek.
- Muayeneyi kesmesi gerektiğinde hastaya acil durum alarmı düğmesi verin.
- Tarayıcının dışındaki MRI alım odasından hastayı izlemek, konuşmak ve dinlemek için tarayıcının içindeki kamerayı ve mikrofonu açın.
4. Beyin MRI protokolü ayarı ve alım parametreleri
- Standartlaştırılmış çokmodal MRI protokolü yüksek alan tarayıcısı (1,5 T veya 3T) alın. Aşağıdaki sıra parametreleri, baş boyunlu yüksek yoğunluklu dizi bobini (64 kanal) kullanarak 3 T MRI'a başvurur.
- Yüksek çözünürlüklü ve hacimsel anatomik diziler edin: T1 ağırlıklı pre-ve post-gadolinyum kontrast ajan yönetimi ve FLAIR T2 ağırlıklı.
- T1 ve T2 ağırlıklı görüntüler için, sıra başına yaklaşık 5 dakikalık 1x1x1 mm3 tarama süresi izotropik çözünürlük sağlayan sürekli sagittal dilimler elde edin.
- Yüksek çözünürlüklü T2 ağırlıklı bir dizi alın ve kraniyal sinir görselleştirmesi için tümör bölgesini lokalize edin: voksel boyutu 0.5x0.5x0.5 mm3 olan hacimsel CISS (Sabit Durumda Yapıcı Girişim) (yaklaşık 9 dakikalık tarama süresi).
- Tek çekim eko-düzlemci görüntüler (EPI), 2x2x2 mm 3 voksel boyutu, b değeri 2000 s/mm2olan 64 manyetik gradyan yönü, 98 ms yankı süresi ve 4300 ms gevşeme süresi kullanarak difüzyon ağırlıklı diziler edin.
- Difüzyon ağırlıklı alımın başında, faz kodlama yönü ön-arka olarak ayarlanmış null b-değerine sahip beş birim elde edin (difüzyon ağırlıklı görüntüler için toplam tarama süresi 5 dakika).
- Ayrıca, EPI alımı (42 saniyelik tarama süresi) nedeniyle görüntüleme bozulmalarını düzeltmek için null b-değeri olan ancak ters faz kodlama yönü olan posterior-ön olmak üzere üç birim uzadı. Sürekli eksenel dilimler elde edilir.
- Tümör bölgesinde lokalize multi-veya tek voksel MRI-spektroskopi gibi spesifik tümör özelliklerini araştırmak için ek diziler uzayın.
NOT: MRI sınavına hasta hazırlığı hariç toplam tarama süresi yaklaşık 30 dakikadır.
5. Beyin MR görüntüleri ön işleme
- MRI verilerini, MRI alma konsolları OLAN DICOM (.dcm) tarafından benimsenen görüntüleme biçiminden, gelişmiş görüntüleme analizlerinde kullanılan NIFTI formatına (.nii) dönüştürün.
- dcm2niix işlevini çalıştırın (https://github.com/rordenlab/dcm2niix). Giriş dosyaları dicom görüntüleri ve ilgili .nii dosyaları çıktı olarak ayarlayın: T1.nii, Flair.nii, T1_contrast.nii, DTI_b2000.nii ve DTI_b0_flip.nii.
- Gelişmiş görüntüleme analizleri için gereken FSL (https://fsl.fmrib.ox.ac.uk/fsl/fslwiki) ve MRtrix3 (https://www.mrtrix.org) yazılımını yükleyin.
- Doğrusal bir görüntü kaydı gerçekleştiren FSL-flirt işlevini çalıştırarak Flair.nii ve T1_contrast.nii'yi T1.nii görüntüsüne kaydedin.
- EPI görüntüleme bozulma yapıtlarını dikkate alan FSL-epi_reg işlevini çalıştırarak DTI_b2000.nii görüntüsünü T1.nii'ye kaydedin.
- DTI_b2000.nii görüntüsünü sunan faz kodlama yönü yapıtlarını düzeltmek için FSL-topup işlevini çalıştırın. DTI_b0_flip.nii ters faz kodlama alımını "in_main" giriş dosyası olarak ayarlayın.
- Ana bileşen gürültü modellemesi ile denoising görüntüleme için MRtrix3-dwidenoise işlevini çalıştırın.
- Girdap akımını düzeltmek ve sinyal bırakma yapıtını düzeltmek için FSL-eddy işlevini çalıştırın ve MRI bobini kaynaklı sinyal inhomogeneities için MRtrix3-dwibias doğru işlevi.
- T1.nii görüntüsünü sunan kafa derisi sinyalini kaldırmak ve "_brain" sonekini kullanarak çıktı dosyasını yeniden adlandırmak için FSL-bet işlevini çalıştırın: T1_brain.nii.
6. Tümör segmentasyonu
- Itk-snap yazılımını yükleyin (http://www.itksnap.org) 30.
- Itk-snap yazılımı yüklendikten sonra, File - Open Main Image tuşuna basın ve T1.nii görüntüsünü seçin, ardından File - Add Another Imager tuşuna basın ve Yarı saydam kaplama seçeneğini ayarlayarak Flair.nii ve T1_contrast.nii görüntülerini yükleyin.
- T1.nii, Flair.nii ve T1_contrast.nii görüntülerindeki tümörü inceleyin. Lezyonu çizerken izlenecek anatomik düzlemi seçin, örneğin eksenel.
- Başlamak için işaretçiyi tek bir eksenel dilime yerleştirin. Ana Araç Çubuğu 'nda Çokgen Denetçi simgesini seçin ve Serbest Çizim Stili - Düzgün eğri veya Çokgenkullanarak tümör sınırlarını çizmeye başlayın.
- Tümör çevresini çizmeyi bitirdikten sonra, ilk ve son noktaları bağlayan eğriyi kapatın, Kabul Et'e basın ve bir sonraki dilimde çizmeye devam edin. Büyük tümör lezyonları için, çizim sürecini hızlandırmak için, bazı eksenel dilimleri atlayın (örneğin, üç) ve lezyon çevresini ara dilimler halinde çizin.
- Lezyon çevre çiziminin sonunda Araçlar - İnterpolasyon Etiketleri'ni seçin, Etiketi tümör lezyonu olarak enterpolasyona ayarlayın ve tümör sınırlarını çizerken eksen yönelimi takip ettiği için tek bir eksen boyunca enterpolasyon yapın.
- Segmentasyon - Segmentasyon Görüntüsünü Kaydet'i seçin ve kaydetmek için Nifti biçimi seçeneğini belirleyerek tümör segmentasyonunu Tumor_mask.nii olarak adlandırın.
7. Tractography analizi
- Difüzyonu ve farklı uzamsal yönleri modellemek için FSL-dtifit işlevini çalıştırın ve aşağıdaki difüzyon tensör haritalarını elde edin: FA.nii, MD.nii ve V1.nii. Tümör ödemi veya infiltrasyon varlığında oluşabilecek anormal difüzyon değerlerine erişmek için bu DTI haritalarını değerlendirin.
- MRtrix3-tckgen işlevini, olasılıksal tractografi gerçekleştirmek ve geçiş lifleri sorunlarını modelleyerek beyaz madde yollarını yeniden oluşturmak için varsayılan "ifod2" ayarıyla çalıştırın31.
- Priori anatomik bilgisine dayanarak "-seed_image" ve "-dahil" seçeneklerini belirleyerek tohum hedefi yaklaşımını benimseyin.
- Tractography için tohum veya hedef olarak ayarlanmış ilgi alanlarını (ROI) manuel olarak çizin. Alternatif olarak, atlas tabanlı ROI'leri kullanın. Mormina et'e bakın. Optik radyasyon sistemi için 32, optik chiasm ve optik kraniyal sinirler için Hales ve ark.33 ve piramit yollar için Testa ve ark.
- FSL-fsleyes görüntü görüntüleyicisini başlatın, Aç'ı seçin ve görsel olarak incelenebilecek görüntüleri seçin.
- FSL- fsleyes görüntüleyicide, Ayar - Orto Görünümü 1'e gidin ve Düzenleme Modu aracını etkinleştirin.
- FSL-fsleyes kalem simgesini tıklatın ve tractography ROI'leri çizin.
- Freesurfer (https://surfer.nmr.mgh.harvard.edu) yazılımını yükleyin.
- Tractography ROI olarak kullanılacak otomatik kortikal bölge segmentasyonunu elde etmek için T1.nii görüntüsünde Freesurfer-Recon-all işlevini çalıştırın.
- Giriş görüntüsü olarak ayarla T1.nii ve referans görüntüsü DTI_b2000.nii olarak ayarlayarak FSL-epi_regregistration işlevini çalıştırın, kayıt çıktı matrisini kaydedin (T1_onto_DTI.mat).
- Parçalanmış ROI'leri DTI_b2000.nii görüntüsüne kaydetmek için elde edilen T1_onto_DTI.matrisini kullanın.
- MRtrix3-tckgen işlevini kullanarak tractografiyi çalıştırın.
- "-template FA.nii" görüntüsündeki ".tck" sistem çıkışını kolaylaştırmak için MRtrix3-tckmap işlevini çalıştırın.
- T1.nii görüntüsünü MNI152_T1_2mm_brain.nii şablonuna doğrusal olarak kaydetmek için FSL-flirt işlevini çalıştırın.
- Çıkış matrisini T1_onto_MNI.mat olarak kaydedin. "-concat" seçeneğini T1_onto_MNI.mat ve T1_onto_DTI.mat olarak ayarlayarak FSL-convert_xfm işlevini çalıştırın, çıkış matrisini DTI_onto_MNI.mat olarak kaydedin.
8. Tractography: yol analizi
- DTI parametrelerinin doğru bir açıklaması için, yüzey yolu geometrisini Laplacian operatörü özellikleri35ile modelleyen Matlab tabanlı algoritma gibi yol algoritmalarını kullanın.
- Matlab yazılımını (https://matlab.mathworks.com) yükleyin ve tüm yol kodunu gelişmekte olan yazarlara isteyin35.
- Alternatif olarak, Matlab lisans gerektirdiği için yol analizi için MRtrix3-tcksample işlevini kullanın.
9.3D işleme görselleştirme
- Surf Ice yazılımını yükleyin (https://www.nitrc.org/plugins/mwiki/index.php/surfice:MainPage).
- Surf Ice komut panelinde, Advanced - Convert voxelwise to mesh 'etıklayın, dönüştürmek için nifti görüntüsünü seçin, elde edilen .obj dosyasını kaydedin.
- Surf Ice komut panelinde Dosya - Aç'ı tıklatın ve 3D ses düzeyi işlemeyi görselleştirmek için .obj dosyasını seçin.
10. Ameliyat öncesi klinik muayeneler
- Erkeklerde ve kadınlarda sırasıyla prolaktin, TSH, freeT4, ACTH, kortizol, GH, LH, FSH ve serum testlerinden oluşan biyo-humoral endokrinolojik değerlendirme yapın.
- Diyabet insipidus varlığını belirlemek için 24 saatlik idrar hacmini ve serum ve idrar osmolalitesini ve sodyum seviyelerini analiz edin.
- Görme keskinliği ölçümü, bilgisayarlı görme alanı değerlendirmesi ve retina optik koherens tomografisi (OCT) dahil olmak üzere oftalmolojik değerlendirme gerçekleştirin.
- Nörolojik fizik muayene yapmak, kilo alımı, açlık hissi, sirkadiyen sıcaklık ritmini değerlendirmek için taşınabilir bir cihaz kullanarak 24 saat boyunca her 2 dakikada bir rektal sıcaklığı sürekli izleme ve 24 saat uyku-uyanıklık döngüsü kaydı (elektroensefalogram, sağ ve sol elektro-okülogram, elektrokardiyogram ve miylohidoid ve sol ve sağ tibialis kaslarının elektromiyogramı dahil) hakkında anamnestik bilgi koleksiyonu ile36, 37,38.
11. Cerrahi planlama
- Ameliyata giden her hasta adayını bir araya getiren bir kollektif ekipte tartışın, tümör segmentasyonu sonuçlarına ve fonksiyonel belâgatlı sinir yapıları ile ilişkisine dayanarak (optik sinirler ve chiasm, hipofiz sapı, üçüncü ventrikül, iç karotis arter, ön serebral arter-ön iletişim arteri (ACA-ACoA) kompleksi, basilar arter, kraniyal sinirler III, IV, VI, mammillary cisimler, beyaz madde yolları, ve fonksiyonel kortikal alanlar) en uygun cerrahi yaklaşımı belirlemek.
- Sinir yapılarının en az yaralanma riski olan cerrahi koridoru seçin39.
- Her durum için güvenli rezeksiyon alanını tanımlayın, kalıcı hasarı önlemek için rezeksiyonun tutuklanması gereken kritik sinir yapısını (chiasm, mammillary gövdesi gibi) lokalize edin39.
- En alakalı MRI dizilerini birleştirin ve ameliyat fazın nöronavigasyon sistemine aktarın.
12. Ameliyat hazırlığı
- Propofol ve remifentanil ile total intravenöz anesteziyi benimseyen genel anesteziye indükle (diğer anestezik ajanların intraoperatif izleme güvenilirliğini etkileyen, yanlış-negatif oranı artıran en kritik faktörler arasında olduğu gösterilmiştir), miyorelaxant40'ıönler.
- Mide veya hava yollarında kan veya sıvı kaçağını önlemek için orofarenksteki gazlı bezlerle oro-trakeal entübasyon yapın41.
- Kraniyal sinirler için motor uyarılmış potansiyellerin (MEP'ler) ve somatosensör çağrışımlı potansiyellerin (SEP'ler) ve serbest çalışan elektromiyografinin (EMG) sürekli kaydı ile nörofizyolojik izlemeyi ayarlayın.42
- Nöronavigasyon sisteminde(Malzeme Tablosu)tractografi rekonstrüksiyonları da dahil olmak üzere MRI verilerini içe aktarın.
- Nöronavigasyon sistemindeki beyin cerrahisi elektromanyetik kayıt modalitesini seçin.
- Nöronavigasyon sistemini hastaya kaydedin, serbest izleme tekniğini veya harici belirteçleri benimseyin.
- Elde edilen kaydın doğruluğunu kontrol edin, dış işaretleyicilerin (örneğin, kulak veya burun) içe aktarılan MRI üzerindeki konumunu kontrol edin; sonuç kabul edilemezse, kaydı tekrarlayın.
- Hastayı yarı oturma pozisyonuna getirin; Mayfield'ın kafasını düzeltmek için kullandığı43'egerek yok.
- Kortikosteroid (endovenöz flebocortid, hastanın ağırlığına bağlı olarak dozaj) ve antibiyotikler (2 g amoksisilin-clavulanik asit)44.
13. Endoskopik endonazal cerrahi
- 0° endoskopla başlayın (Malzeme Masası).
- Naso-septal flaphasat 45.
- Ön sfenoidotomi, ardından posterior septostomi ve etmoidektomi, mümkün olduğunda orta turbinatın korunması ile43.
- Sellar ve tüberkülum kemiğini açın41.
- Üstün intercavernous sinüsün pıhtılaşmasından sonra dura tabakasını bir H şekli ile inzivaya çekin41.
- Tümörü araknoidal düzlemdenayırın 43.
- Tümörü merkezi olarak debulk43.
- Kapsülünü çevredeki diensefalik nöral yapılardan çıkarın, nöronavigasyon rehberliği altında görselleştirilen belagatli yapılara tümör yapışması durumunda rezeksiyonu tutuklayın43.
- Açılı optiklerle cerrahi boşluğukeşfedin( Malzeme Masası )46.
- Bipolar koagülasyon veya hemostatik ajanlarla hemostaz sağlayın.
- Osteo-meningeal açıklığı,43'ünintradural intrakraniyal tabakası ile kapatın.
- Karın yağı ve sonunda kemikle kaplanmış ekstradural bir intrakraniyal dural ikame tabakasıyerleştirin( Malzeme Masası )43.
- Kapağı naso-septal kapak43ile örtün.
14. Histolojik muayene
- Tümör örneklerini %10 formalin ile sabitlenin ve ameliyattan hemen sonra parafin içine gömün.
- Dokuyu 4 μm kalınlığında bölümlere kesin ve hematoksilin ve eozin ile lekeyi kesin. Histolojik tanı, DSÖ'nün beyin tümörleri sınıflandırmasının en son sürümüne dayanmalıdır (2016)47.
- Avidin-biotin etiketleme ve diaminobenzidine'i algılama reaktifi olarak kullanarak otomatik bir immünohistokimyasal boyama aleti ile numune immünohistokimyasal boyama gerçekleştirin. Kraniyofarinjiomlar için anti-beta-catenin, anti-BRAF v600E mutant epitop ve immünohistokimyasal boyama için anti-Ki67 antikorlarını benimseyin (Malzeme Tablosu).
- Ki-67 indeksini pozitif tümör hücrelerinin manuel sayımı ile değerlendirin48.
15. Ameliyat sonrası hasta yönetimi
- Ameliyattan hemen sonra hastayı uyandırın.
- Burun boşluklarını emilebilir ve emilemeyen malzeme ile doldurarak ağızdan kendiliğinden nefes almayı geri kazandırın.
- Yoğun bakımda aşağıdaki 6-12 saat boyunca hayati parametreleri (kan basıncı, kalp atış hızı, oksijen doygunluğu ve bilinç durumu) izleyin.
- 12 saat sonra oral beslenmeyi geri yükleyin.
- 6-9 saat sonra tomografi çekin.
- Heparin tedavisi ile üç gün boyunca yatak istirahatini sürdürin.
- Sıvı dengesini her 12 saatte bir kontrol edin ve serum elektrolitlerini her 24 saatte bir değerlendirin.
- Kortikosteroid tedavisi verin (ilk 24 saatte endovenöz flebocortid ve daha sonra oral kortone asetat 30 +15 mg /gün).
- Ameliyattan sonraki 72 saat içinde gadolinyumlu/gadolinyumsuz bir MRI çektirin.
- Hastayı4.
16. Erken takip
- Ameliyattan 30 gün sonra endokrinolojik değerlendirmenin tamamını tekrarlayın43.
- Oftalmolojik değerlendirmeyi ameliyattan üç ay sonra tekrarlayın43.
- Nörolojik fizik muayene ve sıcaklık ve uyku-uyanıklık ritimleri fonksiyon araştırmalarını ameliyattan üç ay sonra tekrarlayın46.
- Ameliyattan üç ay sonra gadolinyumlu/gadolinyumsuz MRI'ı gerçekleştirin46.
17. Adjuvan terapi
- Erken tümör ilerlemesinin varlığını değerlendirin ve belirtilirse, hastayı radyasyon tedavisine yönlendirin43.
18. Uzun süreli takip
- Klinik, endokrinolojik ve oftalmolojik değerlendirmeleri yılda tekrarlayın43.
- Gadolinyumlu/gadolinyumsuz yıllık MRI'ı gerçekleştirin: tekrarlama durumunda, hasta tekrar ameliyat edilebilir ve daha sonra radyasyon tedavisine veya doğrudan radyoterapi43'eyönlendirilebilir.
Sonuçlar
55 yaşında bir kadın ilerleyici görme bozuklukları ile sundu. Tıbbi geçmişi önemsizdi. Oftalmolojik değerlendirmede görme keskinliğinin bilateral azalması (sağ gözde 6/10 ve sol gözde 8/10) ortaya çıktı ve bilgisayarlı görme alanında tam bitemporal hemianopia görüldü. Nörolojik muayenede daha fazla açık belirgin değildi, ancak hasta son 2-3 ay içinde kalıcı asteni ve açlık ve susuzluk hissinde bir artış olduğunu, 4-5 kg kilo alımı ve idrara çıkma ihtiyacı için gece sık uyanmalar olduğunu bildirdi. Endokrinolojik değerlendirmede santral hiperkortikizm ve diyabet insipidus ortaya konuldu. Hastaya kortikosteroidler (hidrokortizon 30+15 mg/gün ve desmopressin 30+30 μg/gün) uygulandı. 24 saat uyku-uyanıklık döngüsü ve sıcaklık izlemede, hormonal ikame tedavisinin optimizasyonundan sonra önemli bir değişiklik fark edilmedi.
Beyin MRG'leri, kraniyofarinjiyom için ilk hipotez olduğundan şüphelenilen düzensiz polikistik morfoloji ile opto-chiasmatic sarnıcı işgal eden ve 3. ventrikülü istila eden bir supraseller tümör göstermiştir (Şekil 1A-C). Mevcut protokolde gösterildiği gibi ileri görüntüleme analizleri yapıldı. Tümör çekirdek segmentasyonu gadolinyum alımını vurgulamış ve 7,92 cm3 (Şekil 1D-E)hacme karşılık gelmektedir.
Bu hastanın ameliyat öncesi planlamasında en kritik değerlendirmeleri görme yollarıydı. Piramit yollar ayrıca FLAIR T2 ağırlıklı görüntüde tespit edilen sinyal artışının mikroyapısal korelasyonunun doğru yol seviyesinde değerlendirilmesi için yeniden inşa edildi.
Optik yol sistemi rekonstrüksiyonu, özellikle tümör kitlesinin varlığında optik chiasm çıkığı araştırıldı. bilateral optik kraniyal sinirler de yeniden inşa edildi. Beyin, kemikler ve kan damarları arasındaki arayüzde, duyarlılık eserleri optik chiasm'ı optik sinirlere bağlayan liflerin tam olarak yeniden yapılandırılmasına izin vermedi (Şekil 2).
Piramital yollar difüzyusivity profili DTI harita istatistikleri ile araştırılmıştır. İç kapsülün sağ arka uzuv seviyesinde, sol tarafa kıyasla sağ MD ölçüsünün (5.-7. segmentler)% 5'lik birartışına karşılık gelen bir odak FLAIR T2 ağırlıklı hiperintensi mevcuttu (Şekil 3).
Tümör ve nöral yapılar arasındaki bu tür ilişkiler göz önünde bulundurularak endoskopik endonazal genişletilmiş transplant/transtuberculum yaklaşımıseçilmiştir 36. Tümör çıkarma mikrocerrahi iki el tekniği ile gerçekleştirildi. Başlangıçta, tümör merkezi olarak debulked, ayrıca kistik bileşenini boşaltıyordu (Şekil 4). Daha sonra, kraniyofarinjiyomayı sinir yapılarından aşamalı olarak ayırmak, araknoidi bir bölünme düzlemi olarak benimsemek mümkündü (Şekil 5). Ameliyat sonunda hipotalamusun anatomik korunması ile komple tümör çıkarılması sağlanmıştır(Şekil 6). Osteo-dural defektin onarımı abdominal yağ ve naso-septal kapak ile gerçeklenmiştir (Şekil 7).
Ameliyat sonrası seyir olaysız geçti ve hasta dört gün sonra doğru klinik koşullarda taburcu edildi. Tümörün histolojik incelemede adamantinomatöz kraniyofarinjiyoma (WHO grade 1) olduğu ortaya çıktı.
Hasta takipte tam panhypopituitarizm geliştirdi ve hidrokortizon, desmopressin ve levotiroksin ile tam ikame tedavisi altındaydı. Görme açıkları tamamen geriledi ve nörolojik muayenede değişiklik, 24 saat uyku-uyanıklık döngüsü ve sıcaklık izleme tespit edildi. Üç aylık beyin MR'ları, kalıntı veya nüks olmadan tam bir tümör çıkarma gösterdi. Bu nedenle, adjuvan tedavi tavsiye edildi ve hasta yıllık klinik ve nöroradyolojik muayenelerle takip ediliyor(Şekil 8).

Şekil 1. Ameliyat öncesi anatomik MR SEkansları (F/55 yıl). T1 ağırlıklı (A) ve FLAIR T2 ağırlıklı (B) eksenel görünümü ; eksenel (C, D) ve sagittal (E) T1- gadolinyum uygulamadan sonra (0,1 mm/ kg). Gadolinyum ile geliştirilmiş T1 ağırlıklı görüntüye örtülen tümör segmentasyonu (kırmızı) D ve Eolarak gösterilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2. Optik yolların rakografisi ve tümör segmentasyonunun ameliyat öncesi 3D oluşturulması. (A) FLAIR T2 ağırlıklı görüntünün eksenel dilimi optik chiasm tractografisini kaplar, tümöre ön olarak lokalize olur. (B) FLAIR T2 ağırlıklı görüntünün 3D hacimli oluşturulması, eksenel düzlem seçilmesi ve optik yolların sistemografisinin kaplanmış. (C) Beyin yüzeyinin 3D hacimli oluşturulması, optik yolların trakografisi ve kırmızıda tümör segmentasyonu. Tüm panellerin çekigrafi düzenleri RGB yönlülük renk haritası (kırmızı: yanal-yanal, yeşil: ön-arka ve mavi: alt-üstün) ile renklendirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
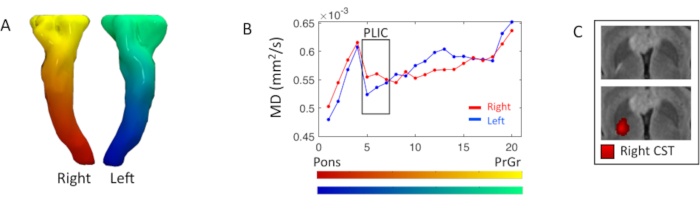
Şekil 3. Piramital yol boyunca DTI ölçüm analizi. (A) Laplacian alt-üstün segmentasyon gradyanını temel alan çift taraflı piramit yolların veya kortikospinal sistemin (CST) 3D işlenmesi. (B) Sağ (kırmızı) ve sol (mavi) CST, kanalın A'daki renk haritalarında görüntülenen yirmi segmente bölünmesinden kaynaklanan difüzyusite (MD) profilleri anlamına gelir; segmentler presenral girusa (PrCr) doğru pons seviyesinde başlar. Kara kutu, iç kapsülün (PLIC) arka eksfolyumundaki(5.-7th)segmentleri vurgular. (C) Flair T2 ağırlıklı görüntünün PLIC düzeyinde, daha parlak bir kırmızı yoğunluğun daha yüksek bir aerodinamik yoğunluğa karşılık geldiği doğru CST bağlantı haritası ile ve olmadan eksenel görünümü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4. İntraoperatif endoskopik görüntüler. (A) 0 ° kapsam, dural açıklıktan sonra, tümör başlangıçta chiasm tarafından ayrıldı ve araknoid bir bölünme düzlemi olarak benimsendi. (B) ve (C), daha sonra merkezi olarak debulked edildi ve kist aşamalı olarak boşaltıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5. İntraoperatif endoskopik görüntüler. (A) 0° kapsam, kraniyofarinjiyom nöronavigasyon yardımıyla araknoidal düzlem tarafından bölünür, tümörü ve sinir yapılarını gösterir (mevcut protokolümüze göre tanımlanır). Bu nedenle, kalıcı hipotalamik hasarları önlemek için mammillary vücutları bağışlanabilir. (B) ve (C) daha sonra, tümörün medial hipotalamik yüzeyler tarafından resectede, bu tür sinirsel yapıya yaralanmamak için herhangi bir çekişten kaçınmak mümkündü. (D) Tümörün ventrikül içi kısmının çıkarılması sırasında, ameliyat sonrası akut hidrosefaliden kaçınmak için serebral su kemeri ve Monro foramina'nın yeniden açılmasında özel bakım yapıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
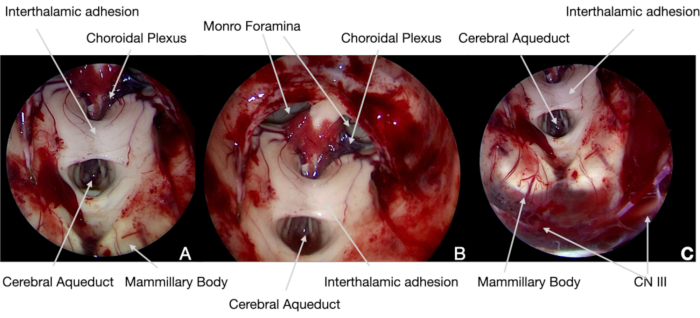
Şekil 6. İntraoperatif endoskopik görüntüler. (A) ve (B) 30° kapsam, ameliyat sonunda, 3rd ventrikülün sinir yapısı, tümörün tamamen çıkarılmasını doğrulamak ve anatomik bütünlüğünü göstermek için açılı optiklerle araştırıldı. (C) Cerrahi alanın alt kısmında, Liliequist zarı altında CN III'ü tanımlamak mümkündü: MEP'ler, SEP'ler ve diğer CN'ler olarak işlevi intraoperatif nörofizyolojik izleme ile sürekli kontrol edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7. İntraoperatif endoskopik görüntüler. (A) 0 ° kapsam, osteo-dural defektin kapatılması, dural ikame, abdominal yağ, sonunda kemik ve naso-septal kapak benimseyen çok katmanlı bir teknik gerektirir. İlk katman, bir dural ikamenin ilk tabakasının intrakraniyal intradural konumlandırılması ile oluşturulmuştır. (B) Aşağıdaki adım cerrahi boşluğu doldurmak için abdominal yağ yerleşimi ile temsil edilir; aşırı paketlemeyi önlemek için özellikle dikkatli olunmalıdır. (C) İkinci dural ikame tabakası yağı örtmek için benimsenmiştir ve sert bir iskele sayesinde kemik veya kıkırdak parçası (conta conta tekniği) olarak pozisyonda tutulabilir. (D) Son olarak, çok katmanlı kapamayı kapatmak için naso-septal kapak veya septum veya orta turbinat serbest greft kullanılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 8. GADOLINYUM uygulamadan sonra MRG, sagittal görünüm T1 ağırlıklı (0,1 mm/kg). (A) Ameliyat öncesi MRI tümörü gösterir. (B) Ameliyat sonrası mammillary vücutlarının anatomik korunması ile tümörün tamamen alınması ve hipotalamik yapılar görülebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Sunulan protokolün uygulanması, 3rd ventrikül istila eden kraniyofarinjiom gibi en zorlu intrakraniyal tümörlerden birinin güvenli ve etkili bir şekilde tedavi edilmesini, muhtemelen yaklaşık bir yüzyıl önce H. Cushing tarafından en şaşırtıcı intrakraniyal neoplazm1olarak tanımlanan bir lezyon için yeni bir ufuk açmasını sağlamıştır. Doğru ameliyat öncesi planlama, gelişmiş MRI tekniklerinin entegre edilmesi ve multidisipliner klinik değerlendirmelerin kombinasyonu, cerrahi stratejiyi uyarlamamıza, en uygun cerrahi koridoru belirlememize ve nöral yapı hasarı riskini en aza indirmemize izin verdi2,49,50,51. Literatürde bildirilen diğer MRI protokollerinden farklı olarak, difüzyon ağırlıklı görüntüler için faz ters kodlama taramaları gibi hızlı dizilerin dahil edilmesi, gelişmiş işlem sonrası düzeltmelere izin verir52. Bu prosedür her zaman, özellikle görüntüleme bozulmalarının bulunduğu yüksek yoğunluklu alanda (örneğin, 3 T veya daha yüksek) benimsenmelidir.
Ayrıca, kısıtlı küresel dekonvolüasyona dayalı olasılıksal bir tractografi yaklaşımının kullanılması, diğer deterministik tractografi modellerine kıyasla fiber rekonstrüksiyon kalitesinde bir artışa izin verdi53. Ayrıca, önerilen 3D render ve nicel analizler ameliyat öncesi hasta değerlendirmesinin doğruluğunu artırdı. Bu nörogörüntüleme çalışması, nörofizyolojik izleme ile birlikte, cerrah için bir rehber temsil etti ve hastaların kalıcı nörolojik açıklarından kaçınmak için cerrahi rezeksiyonun durdurulup durdurulmayacağına ve nerede durdurulmaya karar vermesine yardımcı oldu.
Gerçekten de, kraniyofarinjiomlar için en agresif tümör rezeksiyonu, kalıcı nöral hasardan önce çıkarılan tümörün tutuklanmasından oluşan hipotalamik-sparing tekniği lehine son zamanlarda aşamalı olarak terk edilmiştir54. Bununla birlikte, standart klinik uygulamada, beyin cerrahının tümör çıkarılmasının maksimal güvenli rezeksiyonu ne zaman durduracaklarına karar vermesi, hastayı bir yandan planlanandan daha büyük bir tümör kalıntısı bırakma veya diğer yandan kalıcı bir hipotalamik yaralanmaya neden olma riskine maruz bırakması ve bunun sonucunda yaşam kalitesine zarar vermesi genellikle karmaşıktır.
Sunulan protokol, hipofiz-dienfalik ve kafatası tabanı tümörlerinin yönetimi için pratik ve benimsenmesi kolay bir yöntem sağlamayı amaçlayan klinik ve nöroradyolojik verilerin entegre edilmesi için bir model sağlamıştır. Bununla birlikte, bazı kritik noktalar sunduğunun altını çiziyoruz: yüksek alan (3 T) mıknatıs, yüksek çözünürlüklü kanal bobini ve gelişmiş ön/işleme görüntüleme yazılımı gibi yeterli ekipman ihtiyacı.
Sunulan protokoldeki MRI dizileri de 1,5 T'de edinilebilir, ancak Adım 4'te bildirilen alım parametrelerinin gürültü oranına iyi bir sinyal elde etmek için değiştirilmesi gerekir: difüzyon ağırlıklı diziler için daha düşük bir b değeri önerilir (örneğin, 1000 s/mm2). Ayrıca, önerilen nörogörüntleme analizlerinin uygulanması ve klinik uygulamaya girişleri, özellikle görüntüleme işlemi için hem klinik hem de MRI teknik ve bilgisayar bilimleri uzmanlığı gerektiriyordu. Bildirilen yazılımın çoğu serbestçe kullanılabilir (örneğin, FSL, MRtrix3), ancak belirli veri kümelerini veya görüntüleme analizlerini yönetmek için homebrew işlem hatlarının geliştirilmesi gerekir.
Dahası, diğer kritik nokta, bu teknoloji cerrah için çok önemli bir desteği temsil etse de, öğrenme eğrilerinin yerini alamamasıdır. Bu nedenlerden dolayı, bu ileri cerrahi az veya üçüncül sevk merkezleri, son derece uzmanlaşmış ve adanmış uzmanlar için ayrılmalıdır.
Son olarak, gelecekteki hedef, kraniyal sinirler olarak ekstra-parenkimal beyaz madde yapılarının yeniden inşasını iyileştirmektir. Bu yapıların çekografisi şu anda kraniyal sinirlerin küçük boyutu ve hava ve kemik varlığı için MRI sinyalini önemli ölçüde azaltan duyarlılık eserlerinin varlığı ile bozulmuştur55.
Sonuç olarak, beyin cerrahları ve nörogörüntür ekibi arasındaki sinerjik işbirliği klinik ve araştırma amaçları için çok önemlidir, en yüksek doğrulukla planlamaya her hasta için en etkili cerrahi stratejiyi sağlar ve bu alanda kişiselleştirilmiş tıbbın ilerlemesine katkıda bulunmaktadır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Nöroradyoloji Alanı radyoloji teknisyenlerine ve hemşire personeline, IRCCS Istituto delle Scienze Neurologiche di Bologna'ya ve Koordinatörleri Dr. Maria Grazia Crepaldi'ye işbirlikleri için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BRAF V600E-specific clone VE1 | Ventana | ||
| Dural Substitute | Biodesign, Cook Medical | ||
| Endoscope | Karl Storz, 4mm in diameter, 18 cm in length, Hopkins II – Karl Storz Endoscopy | ||
| Immunohistochemical staining instrument | Ventana Benchmark, Ventana Medical Systems | ||
| MRI | 3T Magnetom Skyra, Siemens Health Care | ||
| Neuronavigator | Stealth Station S8 Surgical Navigation System, MEDTRONIC |
Referanslar
- Wang, A. J., Zaidi, H. A., Laws, E. D. History of endonasal skull base surgery. Journal of Neurosurgical Sciences. 60 (4), 441-453 (2016).
- Kassam, A. B., Gardner, P., Snyderman, C., Mintz, A., Carrau, R. Expanded endonasal approach: fully endoscopic, completely transnasal approach to the middle third of the clivus, petrous bone, middle cranial fossa, and infratemporal fossa. Neurosurgical Focus. 19 (1), 6(2005).
- Schwartz, T. H., Morgenstern, P. F., Anand, V. K. Lessons learned in the evolution of endoscopic skull base surgery. Journal of Neurosurgery. 130 (2), 337-346 (2019).
- Cossu, G., et al. Surgical management of craniopharyngiomas in adult patients: a systematic review and consensus statement on behalf of the EANS skull base section. Acta Neurochirurgica. 162 (5), 1159-1177 (2020).
- Komotar, R. J., Starke, R. M., Raper, D. M., Anand, V. K., Schwartz, T. H. Endoscopic endonasal compared with microscopic transsphenoidal and open transcranial resection of craniopharyngiomas. World Neurosurgery. 77 (2), 329-341 (2012).
- Clark, A. J., et al. Endoscopic surgery for tuberculum sellae meningiomas: a systematic review and meta-analysis. Neurosurgical Review. 36 (3), 349-359 (2013).
- Ditzel Filho, L. F., et al. Endoscopic Endonasal Approach for Removal of Tuberculum Sellae Meningiomas. Neurosurgical Clinics of North America. 26 (3), 349(2015).
- Labidi, M., et al. Clivus chordomas: a systematic review and meta-analysis of contemporary surgical management. Journal of Neurosurgical Science. 60 (4), 476-484 (2016).
- Cannizzaro, D., et al. Microsurgical versus endoscopic trans-sphenoidal approaches for clivus chordoma: a pooled and meta-analysis. Neurosurgical Review. , (2020).
- Fujii, T., Platt, A., Zada, G. Endoscopic Endonasal Approaches to the Craniovertebral Junction: A Systematic Review of the Literature. Journal of Neurological Surgery: Part B Skull Base. 76 (6), 480-488 (2015).
- Tubbs, R. S., Demerdash, A., Rizk, E., Chapman, J. R., Oskouian, R. J. Complications of transoral and transnasal odontoidectomy: a comprehensive review. Child's Nervous System. 32 (1), 55-59 (2016).
- Zoli, M., et al. Endoscopic approaches to orbital lesions: case series and systematic literature review. Journal of Neurosurgery. 3, 1(2020).
- Jensterle, M., et al. Advances in the management of craniopharyngioma in children and adults. Radiology and Oncology. 53 (4), 388-396 (2019).
- Roque, A., Odia, Y. BRAF-V600E mutant papillary craniopharyngioma dramatically responds to combination BRAF and MEK inhibitors. CNS Oncology. 6 (2), 95-99 (2017).
- Marucci, G., et al. Targeted BRAF and CTNNB1 next-generation sequencing allows proper classification of nonadenomatous lesions of the sellar region in samples with limiting amounts of lesional cells. Pituitary. 18 (6), 905-911 (2015).
- Silva, M. A., See, A. P., Essayed, W. I., Golby, A. J., Tie, Y. Challenges and techniques for presurgical brain mapping with functional MRI. NeuroImage Clinical. 17, 794-803 (2017).
- Duffau, H. Lessons from brain mapping in surgery for low-grade glioma: insights into associations between tumor and brain plasticity. The Lancet Neurology. 4 (8), 476-486 (2005).
- Maesawa, S., et al. Evaluation of resting state networks in patients with gliomas: connectivity changes in the unaffected side and its relation to cognitive function. PloS One. 10 (2), 0118072(2015).
- Gonen, T., et al. Intra-operative multi-site stimulation: Expanding methodology for cortical brain mapping of language functions. PloS One. 12 (7), 0180740(2017).
- Pillai, J. J. The evolution of clinical functional imaging during the past 2 decades and its current impact on neurosurgical planning. American Journal of Neuroradiology. 31 (2), 219-225 (2010).
- Bizzi, A. Presurgical mapping of verbal language in brain tumors with functional MR imaging and MR tractography. Neuroimaging Clinics of North America. 19 (4), 573-596 (2009).
- Dell'Acqua, F., Tournier, J. D. Modelling white matter with spherical deconvolution: How and why. NMR in Biomedicine. 32 (4), 3945(2019).
- Maier-Hein, K. H., et al. The challenge of mapping the human connectome based on diffusion tractography. Nature Communications. 8 (1), 1349(2017).
- Costabile, J. D., Alaswad, E., D'Souza, S., Thompson, J. A., Ormond, D. R. Current Applications of Diffusion Tensor Imaging and Tractography in Intracranial Tumor Resection. Frontiers in Oncology. 9, 426(2019).
- Jacquesson, T., et al. Full tractography for detecting the position of cranial nerves in preoperative planning for skull base surgery: technical note. Journal of Neurosurgery. , 1-11 (2019).
- Zolal, A., et al. Comparison of probabilistic and deterministic fiber tracking of cranial nerves. Journal of Neurosurgery. 127 (3), 613-621 (2017).
- Ung, N., et al. A Systematic Analysis of the Reliability of Diffusion Tensor Imaging Tractography for Facial Nerve Imaging in Patients with Vestibular Schwannoma. Journal of Neurological Part B Skull Base. 77 (4), 314-318 (2016).
- Anik, I., et al. Visual Outcome of an Endoscopic Endonasal Transsphenoidal Approach in Pituitary Macroadenomas: Quantitative Assessment with Diffusion Tensor Imaging Early and Long-Term Results. World Neurosurgery. 12, 691-701 (2018).
- Oldfield, R. C. The assessment and analysis of handedness: the Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Yushkevich, P. A., et al. User-Guided Segmentation of Multi-modality Medical Imaging Datasets with ITK-SNAP. Neuroinformatics. 17 (1), 83-102 (2019).
- Tournier, J. D., Calamante, F., Connelly, A. Robust determination of the fibre orientation distribution in diffusion MRI: non-negativity constrained super-resolved spherical deconvolution. NeuroImage. 35 (4), 1459-1472 (2007).
- Mormina, E., et al. Optic radiations evaluation in patients affected by high-grade gliomas: a side-by-side constrained spherical deconvolution and diffusion tensor imaging study. Neuroradiology. 58 (11), 1067-1075 (2016).
- Hales, P. W., et al. Delineation of the visual pathway in paediatric optic pathway glioma patients using probabilistic tractography, and correlations with visual acuity. Neuroimage Clinical. 11 (17), 541-548 (2017).
- Testa, C., et al. The effect of diffusion gradient direction number on corticospinal tractography in the human brain: an along-tract analysis. Magma. 30 (3), 265-280 (2017).
- Talozzi, L., et al. Along-tract analysis of the arcuate fasciculus using the Laplacian operator to evaluate different tractography methods. Magnetic Resonance Imaging. 54, 183-193 (2018).
- Zoli, M., et al. Postoperative outcome of body core temperature rhythm and sleep-wake cycle in third ventricle craniopharyngiomas. Neurosurgical Focus. 41 (6), 12(2016).
- Foschi, M., et al. Site and type of craniopharyngiomas impact differently on 24-hour circadian rhythms and surgical outcome. A neurophysiological evaluation. Autonomic Neuroscience. 208, 126-130 (2017).
- Mojón, A., Fernández, J. R., Hermida, R. C. Chronolab: an interactive software package for chronobiologic time series analysis written for the Macintosh computer. Chronobiology International. 9 (6), 403-412 (1992).
- Hardesty, D. A., Montaser, A. S., Beer-Furlan, A., Carrau, R. L., Prevedello, D. M. Limits of endoscopic endonasal surgery for III ventricle craniopharyngiomas. Journal of Neurosurgical Sciences. 62 (3), 310-321 (2018).
- Lee, W. H., et al. Effect of Dexmedetomidine Combined Anesthesia on Motor evoked Potentials During Brain Tumor Surgery. World Neurosurgery. 123, 280-287 (2019).
- Barazi, S. A., et al. Extended endoscopic transplanum-transtuberculum approach for pituitary adenomas. British Journal of Neurosurgery. 27 (3), 374-382 (2013).
- Singh, H., et al. Intraoperative Neurophysiological Monitoring for Endoscopic Endonasal Approaches to the Skull Base: A Technical Guide. Scientifica. , 1751245(2016).
- Mazzatenta, D., et al. Outcome of Endoscopic Endonasal Surgery in Pediatric Craniopharyngiomas. World Neurosurgery. 134, 277-288 (2020).
- Milanese, L., et al. Antibiotic Prophylaxis in Endoscopic Endonasal Pituitary and Skull Base Surgery. World Neurosurgery. 106, 912-918 (2017).
- Hadad, G., et al. A novel reconstructive technique after endoscopic expanded endonasal approaches: vascular pedicle nasoseptal flap. Laryngoscope. 116 (10), 1882-1886 (2006).
- Zoli, M., et al. Cavernous sinus invasion by pituitary adenomas: role of endoscopic endonasal surgery. Journal of Neurosurgical Sciences. 60 (4), 485-494 (2016).
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Coury, J. R., Davis, B. N., Koumas, C. P., Manzano, G. S., Dehdashti, A. R. Histopathological and molecular predictors of growth patterns and recurrence in craniopharyngiomas: a systematic review. Neurosurgical Review. 43 (1), 41-48 (2020).
- Prieto, R., et al. Craniopharyngioma adherence: a comprehensive topographical categorization and outcome-related risk stratification model based on the methodical examination of 500 tumors. Neurosurgical Focus. 41 (6), 13(2016).
- Cagnazzo, F., Zoli, M., Mazzatenta, D., Gompel, J. J. V. Endoscopic and Microscopic Transsphenoidal Surgery of Craniopharyngiomas: A Systematic Review of Surgical Outcomes Over Two Decades. Journal of Neurological Surgery: part A Central European Neurosurgery. 79 (3), 247-256 (2018).
- Cavallo, L. M., et al. The endoscopic endonasal approach for the management of craniopharyngiomas: a series of 103 patients. Journal of Neurosurgery. 121, 100-113 (2014).
- Andersson, J. L., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. Neuroimage. 20 (2), 870-888 (2003).
- Castellano, A., Cirillo, S., Bello, L., Riva, M., Falini, A. Functional MRI for Surgery of Gliomas. Current Treatment Options in Neurology. 19 (10), 34(2017).
- Elowe-Gruau, E., et al. Childhood craniopharyngioma: hypothalamus-sparing surgery decreases the risk of obesity. Journal of Clinical Endocrinology and Metabolism. 98 (6), 2376-2382 (2013).
- Jacquesson, T., et al. Overcoming Challenges of Cranial Nerve Tractography: A Targeted Review. Neurosurgery. 84 (2), 313-325 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır