Method Article
Papel da Ramografia de Ressonância Magnética em Cirurgia de Base do Crânio Endonasal Endoscópica
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Apresentamos um protocolo para integrar a mania de ressonância magnética difusa no trabalho do paciente para cirurgia endonasal endonasal endoscópica para um tumor de base craniana. Os métodos de adoção desses estudos de neuroimagem nas fases pré e intraoperatória são descritos.
Resumo
A cirurgia endonasal endoscópica ganhou um papel proeminente no manejo de tumores complexos da base craniana. Permite a ressecção de um grande grupo de lesões benignas e malignas através de uma via extra-craniana natural, representada pelas cavidades nasais, evitando retração cerebral e manipulação neurovascular. Isso se reflete na pronta recuperação clínica dos pacientes e pelo baixo risco de sequelas neurológicas permanentes, representando a principal ressalva da cirurgia convencional da base craniana. Esta cirurgia deve ser adaptada a cada caso específico, considerando suas características e relação com estruturas neurais circundantes, principalmente baseadas na neuroimagem pré-operatória. Técnicas avançadas de ressonância magnética, como a tractografia, raramente têm sido adotadas na cirurgia da base do crânio devido a problemas técnicos: processos longos e complicados para gerar reconstruções confiáveis para inclusão no sistema de neuronavigção.
Este artigo tem como objetivo apresentar o protocolo implementado na instituição e destaca a colaboração sinérgica e o trabalho em equipe entre neurocirurgiões e a equipe de neuroimagem (neurologistas, neuroradiologistas, neuropsicólogos, físicos e bioengenheiros) com o objetivo final de selecionar o tratamento ideal para cada paciente, melhorar os resultados cirúrgicos e buscar o avanço da medicina personalizada neste campo.
Introdução
A possibilidade de se aproximar da linha média do crânio e regiões paramedianas através de uma rota anterior, adotando o fossae nasal como cavidades naturais, tem uma longa história, datando de mais de um século1. No entanto, nos últimos 20 anos, a visualização e as tecnologias operacionais melhoraram o suficiente para expandir sua possibilidade de incluir o tratamento dos tumores mais complexos, como meningiomas, chordomas, condrosarcomas e craniopharyngiomas1 devido à (1) introdução do endoscópio, que dá uma visão panorâmica e detalhada 2D/3D dessas regiões ao cirurgião, (2) o desenvolvimento de sistemas de neuronavigação intraoperatória e (3) a implementação de instrumentos cirúrgicos dedicados. Como meticulosamente demonstrado por Kassam et al. e confirmado por múltiplas revisões e meta-análises, as vantagens dessa abordagem cirúrgica são representadas principalmente por suas chances de resseccionar tumores desafiadores da base craniana, evitando qualquer retração cerebral direta ou manipulação nervosa, reduzindo assim o risco de complicações cirúrgicas e sequelas neurológicas e visuais de longo prazo2,3,4, 5,6,7,8,9,10,11,12.
Para múltiplas bases cranianas e tumores pituitário-diencephalic, o objetivo cirúrgico ideal mudou nos últimos anos desde a remoção mais extensa do tumor possível até a remoção mais segura com a preservação das funções neurológicas para preservar a qualidade de vida do paciente3. Essa limitação poderia ser compensada por tratamentos inovadores e eficazes, como a radioterapia (adotando partículas maciças como prótons ou íons de carbono quando apropriado) e, para neoplasias selecionadas, por quimioterapia como inibidores da via BRAF/MEK para o craniofarngiomas13,14,15.
No entanto, para perseguir essas metas, uma avaliação pré-operatória cuidadosa é crucial, para adequar a estratégia cirúrgica à característica específica de cada caso2. Na maioria dos centros, o protocolo pré-operatório de ressonância magnética geralmente é realizado apenas com sequências estruturais padrão, que proporcionam a caracterização morfológica da lesão. No entanto, com essas técnicas nem sempre é possível avaliar a relação anatômica do tumor com estruturas adjacentes de forma confiável3. Além disso, cada paciente pode apresentar diferentes perfis de reorganização funcional induzidos pela patologia detectáveis apenas com a trografia de ressonância magnética difusa e ressonância magnética funcional (RMF), que podem ser utilizados para fornecer orientação tanto no planejamento cirúrgico quanto nas etapas intraoperatórias16,17.
Atualmente, a ressonância magnética é a modalidade de neuroimagem mais utilizada para mapeamento da atividade funcional cerebral e conectividade, como orientação para o planejamento cirúrgico18,19 e para melhorar o desfecho dos pacientes20. FMRI baseada em tarefas é a modalidade de escolha para identificar regiões cerebrais "eloquentes" que estão funcionalmente envolvidas no desempenho específico da tarefa (por exemplo, toques nos dedos, fluência fonêmica), mas não é aplicável para o estudo de tumores de base de crânio.
A maniação de ressonância magnética permite a reconstrução in vivo e não invasiva de conexões cerebrais de matéria branca, bem como nervos cranianos, investigando a estrutura hodológica cerebral21. Diferentes algoritmos de tractografia foram desenvolvidos para reconstruir caminhos axonais ligando perfis de difusividade de moléculas de água, avaliados dentro de cada voxel cerebral. A tractografia determinística segue a direção dominante de difusividade, enquanto a tratoografia probabilística avalia a distribuição de conectividade de possíveis caminhos. Além disso, diferentes modelos podem ser aplicados para avaliar a difusividade dentro de cada voxel, sendo possível definir duas categorias principais: modelos de fibra única, como o modelo tensor de difusão, onde uma única orientação de fibra é avaliada, e modelos de fibra múltipla, como a desconvolução esférica, onde várias orientações de fibra de travessia são reconstruídas22,23. Apesar do debate metodológico sobre a mania de ressonância magnética difusa, sua utilidade no fluxo de trabalho neurocirúrgico está atualmente estabelecida. É possível avaliar a luxação do trato de matéria branca e a distância do tumor, preservando conexões específicas de matéria branca. Além disso, mapas de imagem tensor de difusão (DTI), especialmente anisotropia fracionária (FA) e difusividade média (DM), podem ser aplicados para avaliar alterações microestruturais de matéria branca relacionadas à possível infiltração do tumor e ao monitoramento longitudinal do trato. Todas essas características tornam a tografia de ressonância magnética difusa uma ferramenta poderosa tanto para o planejamento pré-cirúrgico quanto para a tomada de decisões intraoperatórias através dos sistemas de neuronavigação24.
No entanto, a aplicação de técnicas de tractografia à cirurgia de base do crânio tem sido limitada pela necessidade de conhecimento técnico especializado e pelo trabalho demorado para otimizar a aquisição da sequência de ressonância magnética de difusão, o protocolo de análise e a incorporação de resultados de tractografia nos sistemas de neuronavigção25. Por fim, outras limitações devem-se às dificuldades técnicas que estendem essas análises de estruturas de matéria branca intraparenquimal para extra-parenchymal, como nervos cranianos. De fato, apenas estudos recentes apresentaram resultados preliminares tentando integrar ressonância magnética avançada e cirurgia de base do crânio26,27,28.
O presente artigo apresenta um protocolo para o manejo multidisciplinar de tumores pituitário-diencephalic e base do crânio utilizando a trateografia de ressonância magnética difusa. A implementação desse protocolo na instituição resultou da colaboração entre neurocirurgiões, neurocrinologistas e a equipe de neuroimagem (incluindo a expertise clínica e bioinformática) para oferecer uma abordagem multi-axial integrada eficaz a esses pacientes.
No centro, temos protocolos multidisciplinares integrados para o gerenciamento de pacientes com tumores de base craniana, para fornecer a descrição mais informativa possível, e para adequar e personalizar o plano cirúrgico. Mostramos que esse protocolo pode ser adotado tanto no cenário clínico quanto na pesquisa de qualquer paciente com tumor de base craniana para orientar a estratégia de tratamento e melhorar o conhecimento sobre as modificações cerebrais induzidas por essas lesões.
Protocolo
O protocolo segue os padrões éticos do Comitê local de Pesquisa e com a declaração de Helsinque de 1964 e suas alterações posteriores ou padrões éticos comparáveis.
1. Seleção dos pacientes
- Adotar os seguintes critérios de inclusão: pacientes maiores de 18 anos, plenamente colaborando, apresentando um tumor da base craniana, ou região pituitária-diencephalic.
- Exclua pacientes com contraindicação à Ressonância Magnética (ou seja, marcapasso ou material ferromagnético) ou apresentando condições clínicas emergentes (ou seja, hipertensão intracraniana, perda visual aguda que requer cirurgia imediata), ou gestantes, ou pacientes com doença mental, ou aqueles que se recusam explicitamente a participar deste protocolo.
2. Preparação para o exame de ressonância magnética
- Antes do exame de ressonância magnética, administre o formulário de segurança para excluir a contraindicação significativa ao exame e a injeção do agente de contraste: sem materiais ferromagnéticos no corpo, avaliação de dispositivos de ressonância magnética, seguro ou condicional, sem marca-passo, sem lentes de contato visual.
- Se o scanner utilizado para a aquisição da ressonância magnética for de campo alto (por exemplo, 3 T, ver Tabela de Materiais),considere quaisquer possíveis contraindicações adicionais relacionadas, por exemplo, a dispositivos de neuroestimulação.
- Verifique se o paciente tem claustrofobia.
- Certifique-se de que o paciente leu e assinou o termo de consentimento para a ressonância magnética para reconhecer os riscos e benefícios do exame de imagem.
- Que um neuropsicólogo realize uma avaliação geral e uma avaliação neurocognitiva direcionada com base na localização do tumor.
- Administrar o inventário de Edimburgo para avaliar a dominância demãos 29.
3. Posicionamento do paciente no scanner
- Dê tampões de ouvido ao paciente para reduzir o ruído da ressonância magnética.
- Os movimentos da cabeça podem afetar a qualidade da imagem; assim, use almofadas de espuma para reduzir os movimentos da cabeça, imobilizando a cabeça dentro da bobina de ressonância magnética.
- Forneça um botão de alarme de emergência ao paciente em caso de necessidade de interromper o exame.
- Ligue a câmera e o microfone dentro do scanner para monitorar, falar e ouvir o paciente da sala de aquisição de ressonância magnética fora do scanner.
4. Definição do protocolo de ressonância magnética cerebral e parâmetros de aquisição
- Adquira um scanner de alto campo de protocolo multimodal padronizado (1,5 T ou 3T). Os seguintes parâmetros de sequência referem-se a uma ressonância magnética de 3 T, usando uma bobina de matriz de alta densidade do pescoço da cabeça (64 canais).
- Adquira sequências anatômicas de alta resolução e volumosas: administração de agente de contraste pré e pós-gadolínio ponderada em T1 e peso FLAIR T2.
- Para as imagens ponderadas T1 e T2, as imagens contínuas adquirem fatias sagiais contínuas que fornecem resolução isotrópica de 1x1x1 mm3 tempo de varredura de cerca de 5 minutos por sequência.
- Adquira uma sequência de alta resolução ponderada t2 e localize a área tumoral para visualização do nervo craniano: um CISS volutrico (Interferência Construtiva em Estado Constante) com dimensão voxel de 0,5x0,5x0,5 mm3 (tempo de varredura de cerca de 9 minutos).
- Adquira sequências ponderadas por difusão utilizando imagens eco-planar de tiro único (EPI), dimensão voxel de 2x2x2 mm3, 64 direções de gradiente magnético com valor b de 2000 s/mm2, tempo de eco de 98 ms e tempo de relaxamento de 4300 ms.
- Adquira cinco volumes com valor B nulo no início da aquisição ponderada por difusão com direção de codificação de fase definida como anterior-posterior (para imagens ponderadas de difusão, tempo total de varredura de 5 minutos).
- Além disso, adquira três volumes com valor B nulo, mas direção de codificação de fase invertida, posterior-anterior, para corrigir distorções de imagem devido à aquisição do EPI (tempo de varredura de 42 segundos). São adquiridas fatias quase axiais contínuas.
- Adquira sequências adicionais para investigar características específicas do tumor, como ressonância magnética multi ou de voxel localizada na área do tumor.
NOTA: A duração total do tempo de varredura é de cerca de 30 minutos, excluindo a preparação do paciente para o exame de ressonância magnética.
5. Imagens de MR cerebral pré-processamento
- Converta os dados de ressonância magnética do formato de imagem adotado pelos consoles de aquisição de ressonância magnética, DICOM (.dcm), para o formato NIFTI (.nii) utilizado em análises avançadas de imagem.
- Execute a função dcm2niix (https://github.com/rordenlab/dcm2niix). Defina como arquivos de entrada imagens dicom e como saída os arquivos .nii correspondentes: T1.nii, Flair.nii, T1_contrast.nii, DTI_b2000.nii e DTI_b0_flip.nii.
- Instale o software FSL (https://fsl.fmrib.ox.ac.uk/fsl/fslwiki) e MRtrix3 (https://www.mrtrix.org) necessários para as análises avançadas de imagem.
- Registre o Flair.nii e o T1_contrast.nii na imagem T1.nii executando a função FSL-flirt, que realiza um registro linear de imagem.
- Registre a imagem DTI_b2000.nii no T1.nii executando a função FSL-epi_reg, que leva em conta artefatos de distorção de imagem EPI.
- Execute a função de redocupação FSL para corrigir artefatos de direção de codificação de fase apresentando a imagem DTI_b2000.nii. Defina a aquisição de codificação de fase inversa de DTI_b0_flip.nii como o arquivo de entrada "in_main".
- Execute a função MRtrix3-dwidenoise para denoizar imagens com uma modelagem de ruído de componente principal.
- Para corrigir a corrente e o artefato de saída do sinal, execute a função FSL-eddy e para as inhomogeneidades de sinal induzidas por ressonância magnética, a função correta MRtrix3-dwibias.
- Execute a função FSL-bet para remover o sinal do couro cabeludo apresentando a imagem T1.nii e renomeie o arquivo de saída usando o sufixo "_brain": T1_brain.nii.
6. Segmentação de tumores
- Instale o software itk-snap (http://www.itksnap.org) 30.
- Uma vez instalado o software itk-snap, pressione Arquivo - Abra a Imagem Principal e selecione a imagem T1.nii, em seguida, pressione Arquivo - Adicione outra imagem e carregue as imagens Flair.nii e T1_contrast.nii, definindo a opção de sobreposição semi-transparente.
- Inspecione o tumor nas imagens T1.nii, Flair.nii e T1_contrast.nii. Escolha o plano anatômico a seguir ao desenhar a lesão, por exemplo, axial.
- Coloque o ponteiro em uma fatia axial para começar. Na barra de ferramentas principal,selecione o ícone Inspetor de Polígono e comece a desenhar limites tumorais usando o Estilo de Desenho à Mão Livre - Curva Lisa ou Polígono.
- Uma vez terminado o desenho do perímetro tumoral, feche a curva ligando o primeiro e o último pontos, pressione Accept, e continue desenhando na próxima fatia. Para lesões tumorais grandes, para acelerar o processo de desenho, pule algumas fatias axiais (por exemplo, três) e desenhe o perímetro da lesão em fatias intercaladas.
- No final do desenho do perímetro da lesão, selecione Ferramentas - Etiquetas Interpoladas, defina o Rótulo para/com interpolar como a lesão tumoral e o Interpolado ao longo de um único eixo como a orientação do eixo seguiu no desenho dos limites do tumor.
- Selecione Segmentação - Salve a Segmentação Imagem e nomeie a segmentação do tumor como Tumor_mask.nii, selecionando a opção de formato Nifti para salvar.
7. Análise da ramografia
- Execute a função FSL-dtifit para modelar a difusividade e as diferentes direções espaciais e obtenha os seguintes mapas tensor de difusão: FA.nii, MD.nii e V1.nii. Avalie esses mapas de DTI para acessar valores de difusividade anormal que podem ocorrer na presença de edema ou infiltração tumoral.
- Execute a função MRtrix3-tckgen com a configuração padrão "ifod2" para realizar a tractografia probabilística e reconstrua as vias de matéria branca modelando problemas de fibras de cruzamento31.
- Adote uma abordagem de alvo de sementes definindo as opções "-seed_image" e "-incluir" com base no conhecimento anatômico a priori.
- Desenhar manualmente regiões de interesse (ROIs) definidas como sementes ou alvo para a tractografia. Alternativamente, use ROIs baseados em atlas. Veja Mormina et at. 32 para a tractnanação ótica óptica, Hales et al.33 para o quiasmo óptico e nervos cranianos ópticos, e Testa et al.34 para os tratos piramimais.
- Inicie o visualizador de imagens FSL-fsleyes, selecione Abrire escolha imagens para inspecionar visualmente.
- No visualizador FSL-fsleyes, vá para Configuração - Ortho View 1 e ative a ferramenta Editar mode.
- Clique no ícone de lápis FSL-fsleyes e desenhe os ROIs de tractografia.
- Instale o software Freesurfer (https://surfer.nmr.mgh.harvard.edu).
- Execute a função Freesurfer-Recon-all na imagem T1.nii para obter a segmentação automática da região cortical para usar como ROIs de tractografia.
- Execute a função FSL-epi_regregistration, configurando como imagem de entrada o T1.nii e imagem de referência do DTI_b2000.nii, salve a matriz de saída de registro (T1_onto_DTI.mat).
- Use a matriz T1_onto_DTI.mat obtida para registrar os ROIs segmentados na imagem DTI_b2000.nii.
- Execute a tractografia usando a função MRtrix3-tckgen.
- Execute a função MRtrix3-tckmap para converter a saída de tractografia ".tck" simplifica a saída de tractografia na imagem "-template FA.nii".
- Execute a função FSL-flirt para registrar linearmente a imagem T1.nii no modelo MNI152_T1_2mm_brain.nii.
- Salve a matriz de saída como T1_onto_MNI.mat. Execute a função FSL-convert_xfm configurando a opção "-concat" como T1_onto_MNI.mat e T1_onto_DTI.mat, salve a matriz de saída como DTI_onto_MNI.mat.
8. Tractografia: análise along-tract
- Para uma descrição precisa dos parâmetros DTI, use algoritmos along-tract, como o algoritmo baseado em Matlab que modela a geometria do trato de superfície com as propriedades do operador laplaciano35.
- Instale o software Matlab (https://matlab.mathworks.com) e solicite o código alongamento aos autores em desenvolvimento35.
- Alternativamente, use a função MRtrix3-tcksample para análise alongar o trato, pois o Matlab requer uma licença.
Visualização de renderização de 9.3D
- Instale o software Surf Ice (https://www.nitrc.org/plugins/mwiki/index.php/surfice:MainPage).
- No painel de comando Surf Ice, clique em Advanced - Convert voxelwise em malha,selecione a imagem nifti para converter, salve o arquivo .obj resultante.
- No painel de comando Surf Ice, clique em Arquivo - Abrire selecione o arquivo .obj para visualizar a renderização de volume 3D.
10. Exames clínicos pré-operatórios
- Realizar avaliação endocrinológica bio-humoral, consistindo de prolactina, TSH, freeT4, ACTH, cortisol, GH, LH, FSH e testes de soro total testosterona/estradiol, respectivamente em homens e mulheres.
- Analise o volume de urina 24 horas e os níveis de osmolalidade sêmum e urina e sódio para determinar a presença de diabetes insipidus.
- Realizar uma avaliação oftalmológica, incluindo medição de acuidade visual, avaliação de campo visual computadorizada e tomografia de coerência óptica da retina (OUT).
- Realizar um exame físico neurológico, com uma coleção de informações anamnésticas sobre o ganho de peso, a sensação de fome, monitoramento contínuo da temperatura retal a cada 2 minutos por 24 horas usando um dispositivo portátil para avaliar o ritmo de temperatura circadiana, e gravação do ciclo de sono-vigília de 24 horas (incluindo um eletroencefalograma, eletro-oculograma direito e esquerdo, eletrocardiograma e eletromyograma dos músculos milohióides e tibialis esquerdo e direito)36, 37,38.
11. Planejamento cirúrgico
- Discuta em uma equipe colegiada que se encontra com cada paciente candidato à cirurgia, com base nos resultados da segmentação tumoral e na relação com as estruturas neurais eloquentes funcionais (nervos ópticos e quiasmo, talo pituitário, terceiro ventrículo, artéria carótida interna, artéria anterior-anterior comunicando (ACA-ACoA), artéria manjericária, nervos cranianos III, IV, VI, corpos medulares, membranas brancas, e áreas corticais funcionais) para determinar a abordagem cirúrgica mais adequada.
- Selecione o corredor cirúrgico com o risco mínimo de lesões de estruturas neurais39.
- Defina a área de ressecção segura para cada caso, localizando a estrutura neural crítica (como quiasma, corpo mammillary) sob cuja proximidade a ressecção deve ser presa para evitar danos permanentes39.
- Mescle as sequências de ressonância magnética mais relevantes e importe-as no sistema de neuronavigação da fase operacional.
12. Preparação para cirurgia
- Induzir anestesia geral adotando anestesia intravenosa total com propofol e remifentanil (foi demonstrado que os outros agentes anestésicos estão entre os fatores mais críticos que afetam a confiabilidade do monitoramento intraoperatório, aumentando a taxa falsa-negativa), evitando miorelaxant40.
- Realize a intubação oro-traqueal com gazes na orofaringe para evitar vazamento de sangue ou fluido no estômago ou vias aéreas41.
- Configure o monitoramento neurofisiológico, com registro contínuo de potenciais evocados motores (MEPs) e somatosensorial evocados potenciais (SEPs) e eletromyografia de livre duração (EMG) para nervos cranianos.42
- Importar os dados de ressonância magnética, incluindo as reconstruções da tratoografia, no sistema de neuronavigação(Tabela de Materiais).
- Selecione a modalidade de registro eletromagnético da cirurgia cerebral no sistema de neuronavigação.
- Registre o sistema de neuronavigação no paciente, adotando uma técnica de rastreamento livre ou marcadores externos.
- Controlar a precisão do registro alcançado, verificando a posição dos marcadores externos (ou seja, ouvido ou nariz) na ressonância magnética importada; se o resultado não for aceitável, repita o registro.
- Coloque o paciente em posição semi-sentada; O uso de Mayfield para consertar a cabeça não é necessário43.
- Administrar corticosteroide (flebocortid endovenoso, dosagem dependendo do peso do paciente) e antibióticos (2 g de ácido amoxicilina-clavulanic)44.
13. Cirurgia endonasal endonástica endoscópica
- Comece com um endoscópio de 0° (Tabela de Materiais).
- Colher a aba naso-septal45.
- Realizar uma efenoidotomia anterior, seguida de septostomia posterior e ethmoidectomia com preservação do turbinado médio, quando possível43.
- Abra o sellar e tuberculum bone41.
- Incise a camada dura com uma forma de H, após coagulação do seio intercavernous superior41.
- Cutuque o tumor pelo plano aracnoidal43.
- Debuli o tumorcentralmente 43.
- Remova sua cápsula das estruturas neurais diencefálicas circundantes, prendendo a ressecção em caso de adesão tumoral a estruturas eloquentes visualizadas sob orientação de neuronavigição43.
- Explore a cavidade cirúrgica com óptica angular(Tabela de Materiais)46.
- Certifique-se de hemostasia com coagulação bipolar ou agentes hemostáticos.
- Feche a abertura osteo-meningeal com uma camada intracraniana intradural do substituto dural43.
- Coloque uma camada intracraniana extradraniana de substituição dural, andaime com gordura abdominal e, eventualmente, osso(Tabela de Materiais)43.
- Cubra o fechamento com a aba naso-septal43.
14. Exame histológico
- Fixar amostras de tumores com 10% de formalina e incorporá-las em parafina imediatamente após a cirurgia.
- Corte o tecido em seções de 4 μm de espessura e manche com hematoxilina e eosina. O diagnóstico histológico deve baser-se na versão mais recente da classificação da OMS de tumores cerebrais (2016)47.
- Realize a coloração imunohistoquímica da amostra por um instrumento automatizado de coloração imunohistoquímica, usando rotulagem avidin-biotina e diaminobenzidina como reagente de detecção. Para craniopharyngiomas, adote o epitope mutante anti-beta-catina, o epitope mutante anti-BRAF v600E e anticorpos anti-Ki67 para coloração imunohistoquímica(Tabela de Materiais).
- Avalie o índice Ki-67 através da contagem manual de células tumorais positivas48.
15. Gestão pós-cirúrgica do paciente
- Acorde o paciente imediatamente após a cirurgia.
- Restaurar a respiração espontânea da boca preenchendo cavidades nasais com material absorvível e não absorvível.
- Monitore parâmetros vitais (pressão arterial, frequência cardíaca, saturação de oxigênio e estado de consciência) durante as próximas 6-12 horas na UTI.
- Restaure a alimentação oral após 12 horas.
- Faça uma tomografia após 6-9 horas.
- Mantenha o repouso por três dias com tratamento de heparina.
- Controle o equilíbrio do fluido a cada 12 horas e avalie os eletrólitos séricos a cada 24 horas.
- Administre a terapia corticosteroide (flebocortid endovenoso nas primeiras 24 horas e, em seguida, acetato de cortone oral 30 +15 mg/dia).
- Realize uma ressonância magnética com/sem gadolínio dentro de 72 horas após a cirurgia.
- Alta do paciente no4º dia.
16. Acompanhamento antecipado
- Repita a avaliação endocrinológica completa 30 dias após a cirurgia43.
- Repita a avaliação oftalmológica três meses após a cirurgia43.
- Repita o exame físico neurológico e os ritmos de temperatura e sono-vigília funcionam três meses após a cirurgia46.
- Realizar a ressonância magnética com/sem gadolínio três meses após a cirurgia46.
17. Terapia adjuvante
- Avalie a presença de progressão precoce do tumor e, se for indicado, encaminhe o paciente para radioterapia43.
18. Acompanhamento a longo prazo
- Repita as avaliações clínicas, endocrinológicas e oftalmológicas anualmente43.
- Realizar ressonância magnética anual com/sem gadolínio: em caso de recidiva, o paciente pode ser reoperado e, em seguida, encaminhado para radioterapia ou encaminhado diretamente à radioterapia43.
Resultados
Uma mulher de 55 anos apresentava déficits visuais progressivos. Seu histórico médico não era notável. Na avaliação oftalmológica, foi revelada a redução bilateral da acuidade visual (6/10 no olho direito e 8/10 no olho esquerdo) e o campo visual informatizado apresentou hemianopia bitemporal completa. Não foram evidentes mais déficits no exame neurológico, mas o paciente relatou asthenia persistente e aumento da sensação de fome e sede nos últimos 2-3 meses, com ganho de peso de 4-5 kg e despertares frequentes durante a noite para a necessidade de urinar. Na avaliação endocrinológica, foram revelados hipercorticismo central e diabetes insipidus. O paciente foi tratado com corticosteroides (hidrocortisona 30+15 mg/dia e desmopressina 30+30 μg/dia). Em ciclo de sono-vigília de 24 horas e monitoramento da temperatura, não foram notadas alterações significativas após a otimização da terapia hormonal substituta.
A ressonância magnética cerebral demonstrou um tumor supravenário ocupando a cisterna opto-quiasmática e invadindo o 3º ventrículo, com uma morfologia policística irregular, aumentando após o gadolínio, suspeitando como primeira hipótese para um craniofarngioma (Figura 1A-C). Foram realizadas análises avançadas de imagem, conforme ilustrado no protocolo atual. A segmentação do núcleo tumoral destacou a absorção de gadolínio e correspondeu a um volume de 7,92 cm3 (Figura 1D-E).
As vias visuais foram as mais críticas para avaliar no planejamento pré-cirúrgico deste paciente. Os tratos piramimatais também foram reconstruídos para avaliar a correlação microestrutural do aumento de sinal detectado na imagem ponderada flair T2 no nível do trato direito.
Foi investigada a reconstrução da tratoografia da via óptica, particularmente a luxação do quiasma óptico na presença da massa tumoral. Os nervos cranianos ópticos bilaterais também foram reconstruídos. Na interface entre cérebro, ossos e vasos sanguíneos, os artefatos de suscetibilidade não permitiram a reconstrução completa das fibras que ligam o quiasmo óptico aos nervos ópticos(Figura 2).
O perfil de difusividade dos tratos piramiais foi investigado com estatísticas de mapas DTI ao longo do trato. No nível do membro posterior direito da cápsula interna, estava presente uma hiperintensidade focal de peso FLAIR T2, correspondendo a um aumento de 5% da medida de MD direita (5-7segmentos) em relação ao lado esquerdo(Figura 3).
Ao considerar tais relações entre tumor e estruturas neurais, foi escolhida a abordagem endonasal endoscópica de transplante/transtuberculum36. A remoção do tumor foi realizada com uma técnica microcirúrgica de duas mãos. Inicialmente, o tumor foi centralmente desescalado, também drenando seu componente cístico(Figura 4). Posteriormente, foi possível separar progressivamente o craniofarngioma das estruturas neurais, adotando o aracnoide como plano de decote(Figura 5). Ao final da cirurgia, foi realizada a remoção completa do tumor com a preservação anatômica do hipotálamo (Figura 6). A reparação do defeito osteo-dural foi realizada com gordura abdominal e retalho naso-septal(Figura 7).
O curso pós-operatório foi tranquilo, e o paciente teve alta após quatro dias nas condições clínicas certas. O tumor acabou por ser um craniofarngioma adamantinomatous (grau 1 da OMS) no exame histológico.
O paciente desenvolveu panhipopituitarismo completo no seguimento e estava sob terapia de substituição completa com hidrocortisona, desmopressina e levotirexina. Os déficits visuais regrediram totalmente, e não foram detectadas alterações no exame neurológico, ciclo de vigília de 24 horas e monitoramento da temperatura. Três meses de ressonância magnética do cérebro demonstraram uma remoção completa do tumor, sem recorrência ou recorrência. Portanto, nenhum tratamento adjuvante foi aconselhado, e o paciente é acompanhado com exames clínicos e neuroradiológicos anuales(Figura 8).

Figura 1. Sequências de ressonância magnética anatômica pré-operatórias (F/55 anos). Vista axial de peso T1 (A) e flair t2-ponderado(B); axial (C, D) e sagittal (E) T1- após a administração do gadolínio (0,1 mm/kg). A segmentação tumoral (vermelha) sobreposta à imagem ponderada t1 aprimorada por gadolínio é mostrada em D e E. Clique aqui para ver uma versão maior desta figura.

Figura 2. Renderização 3D pré-operatória de tratoografia de vias ópticas e segmentação tumoral. (A) A fatia axial da imagem ponderada flair T2 sobrepõe a tratoografia quiasma óptica, localizada anteriormente ao tumor. (B) renderização de volume 3D da imagem ponderada flair T2, selecionando um plano axial e sobreposta a tractografia de vias ópticas. (C) renderização de volume 3D da superfície cerebral, tratos de vias ópticas e segmentação tumoral em vermelho. Todas as aeronografias dos painéis são coloridas pelo mapa de cores de direcionalidade RGB (vermelho: lateral-lateral, verde: anterior-posterior e azul: inferior-superior). Clique aqui para ver uma versão maior desta figura.
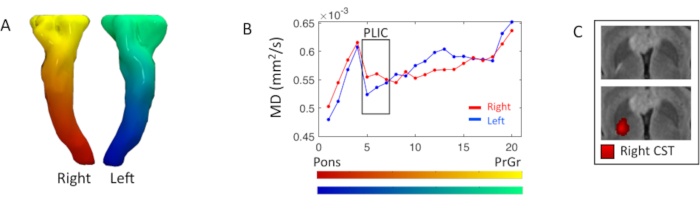
Figura 3. Análise de medida de DTI do tratado piramicular. (A) Renderização 3D dos tratos piramimais bilaterais ou trato corticospinal (CST), colorido com base no gradiente de segmentação laplaciano inferior-superior. (B) Perfis de difusividade média CST (vermelho) e esquerdo (azul) resultantes da particionamento do trato em vinte segmentos exibidos nos mapas de cores em A; os segmentos começam no nível dos pons em direção ao giro pré-central (PrCr). A caixa preta destaca os segmentos no membro posterior da cápsula interna (PLIC) (5a7de dezembro). (C) Visão axial da imagem ponderada flair T2 no nível PLIC, com e sem o mapa de conectividade CST certo, onde uma intensidade vermelha mais brilhante corresponde a uma densidade mais simplificada. Clique aqui para ver uma versão maior desta figura.

Figura 4. Imagens endoscópicas intraoperatórias. (A) escopo 0°, após a abertura dural, o tumor foi inicialmente destacado pelo quiasma, adotando o aracnoide como um plano de decote. (B) e(C), depois, foi centralmente desabotado, e o cisto foi progressivamente drenado. Clique aqui para ver uma versão maior desta figura.

Figura 5. Imagens endoscópicas intraoperatórias. (A) escopo 0°, o craniofarngioma é cortado pelo plano aracnoidal com a ajuda da neuronavigição, mostrando o tumor e as estruturas neurais (identificados de acordo com o nosso protocolo atual). Portanto, os corpos mammillary podem ser poupados para evitar danos hipotalâmicos permanentes. (B) e (C) posteriormente, foi possível resseccionar o tumor pelas superfícies hipotalâmicas medial, evitando quaisquer trações para não ferir tal estrutura neural. (D) Durante a remoção da porção intra-ventricular do tumor, foram pagos cuidados particulares na reabertura do aqueduto cerebral e monro foramina para evitar hidrocefalia aguda pós-operatória. Clique aqui para ver uma versão maior desta figura.
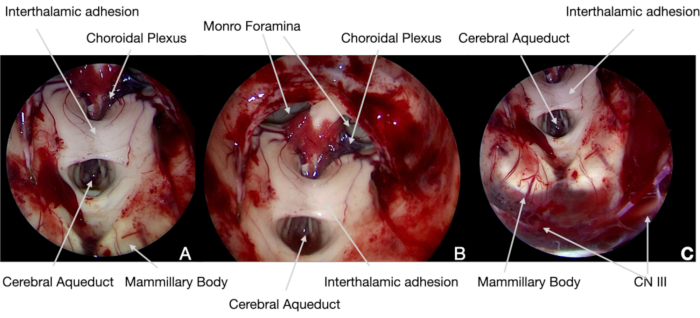
Figura 6. Imagens endoscópicas intraoperatórias. (A) e (B) 30° de escopo, no final da cirurgia, a estrutura neural do ventrículo 3foi explorada com óptica angular para confirmar a remoção completa do tumor e demonstrar sua integridade anatômica. (C) Na parte inferior do campo cirúrgico, foi possível identificar o CN III, sob a membrana Liliequist: sua função, como os MEPs, SEPs e outras CNs, tinha sido continuamente controlada com monitoramento neurofisiológico intraoperatório. Clique aqui para ver uma versão maior desta figura.

Figura 7. Imagens endoscópicas intraoperatórias. (A) escopo 0°, o fechamento do defeito osteo-dural requer uma técnica multicamadas, adotando substituto dural, gordura abdominal, eventualmente osso e retalho naso-septal. A primeira camada é constituída pelo posicionamento intradural intracraniano da primeira camada de um substituto dural. (B) A etapa seguinte é representada pela colocação de gordura abdominal para preencher a cavidade cirúrgica; cuidados particulares devem ser pagos para evitar excesso de embalagem. (C) A segunda camada de substituição dural é adotada para cobrir a gordura, podendo ser mantida em posição graças a um andaime rígido, como um pedaço de osso ou cartilagem (técnica de vedação de junta). (D) Finalmente, a aba naso-septal ou um enxerto livre de septo ou turbinado médio é usado para cobrir o fechamento de várias camadas. Clique aqui para ver uma versão maior desta figura.

Figura 8. Ressonância magnética, vista sagital T1 ponderada após administração de gadolínio (0,1 mm/kg). (A) A ressonância magnética pré-operatória demonstra o tumor. (B) Pós-operatório, a remoção completa do tumor com a preservação anatômica dos corpos mamrários e as estruturas hipotalâmicas são visíveis. Clique aqui para ver uma versão maior desta figura.
Discussão
A aplicação do protocolo apresentado resultou em um tratamento seguro e eficaz de um dos tumores intracranianos mais desafiadores, como um craniofarngioma invadindo o ventrículo3, possivelmente abrindo um novo horizonte para uma lesão que foi definida por H. Cushing cerca de um século atrás como o neoplasma intracraniano mais desconcertante1. A combinação de planejamento pré-operatório preciso, integração de técnicas avançadas de ressonância magnética e avaliações clínicas multidisciplinares nos permitiu adequar a estratégia cirúrgica, identificando o corredor cirúrgico mais adequado e minimizando o risco de danos à estrutura neural2,49,50,51. Ao contrário de outros protocolos de ressonância magnética relatados na literatura, a inclusão de sequências rápidas, como codificações reversas de fase para imagens ponderadas por difusão, permite correções avançadas pós-processamento52. Este procedimento deve ser sempre adotado, especialmente no campo de alta intensidade (por exemplo, 3 T ou superior) onde estão presentes distorções de imagem.
Além disso, o uso de uma abordagem de tratos probabilística baseada na desconvolução esférica restrita permitiu um aumento na qualidade da reconstrução de fibras em comparação com outros modelos de tractografia determinística53. Além disso, a renderização 3D proposta e as análises quantitativas aumentaram a precisão da avaliação do paciente pré-operatório. Este estudo de neuroimagem, juntamente com o monitoramento neurofisiológico, representou um guia para o cirurgião, ajudando-o a decidir se e onde parar a ressecção cirúrgica com o objetivo final de evitar os déficits neurológicos permanentes dos pacientes.
De fato, a ressecção tumoral mais agressiva para craniopharyngiomas foi recentemente progressivamente abandonada em favor de uma técnica de poupança hipotalâmica, consistindo em prender o tumor removido antes de qualquer dano neural permanente54. No entanto, na prática clínica padrão, muitas vezes é complicado para o neurocirurgião decidir quando impedir a remoção do tumor de alcançar a ressecção segura máxima, expondo o paciente ao risco, por um lado, de deixar um remanescente de tumor maior do que o planejado ou, por outro lado, induzir uma lesão hipotalâmica permanente, com consequente perda de vida.
O protocolo apresentado forneceu um modelo de integração de dados clínicos e neuroradiológicos com a intenção de fornecer um método prático e fácil de adotar para o manejo de tumores pituitário-diencefálicos e de base do crânio. No entanto, ressaltamos que ele apresenta alguns pontos críticos: a necessidade de equipamentos adequados, como ímã de campo alto (3 T), bobina de canal de alta resolução e software avançado de imagem pré/processamento.
As sequências de ressonância magnética no protocolo apresentado também são adquiridas em 1,5 T, mas os parâmetros de aquisição relatados na Etapa 4 devem ser modificados para alcançar uma boa relação sinal/ruído: para as sequências ponderadas por difusão, sugere-se um valor b mais baixo (por exemplo, 1000 s/mm2). Além disso, a implementação das análises de neuroimagem propostas e sua introdução na prática clínica exigiram tanto a perícia técnica e de ciência da computação clínica quanto a ressonância magnética, em especial para o processamento de imagens. A maioria do software relatado está livremente disponível (por exemplo, FSL, MRtrix3), mas o desenvolvimento de dutos homebrew é necessário para gerenciar conjuntos de dados específicos ou análises de imagens.
Além disso, o ponto crítico é que, embora essa tecnologia represente um suporte crucial para o cirurgião, ela não poderia substituir sua curva de aprendizado. Por essas razões, esta cirurgia avançada deve ser reservada para poucos ou centros de referência terciários, especialistas altamente especializados e dedicados.
Finalmente, o objetivo futuro é melhorar a reconstrução de estruturas de matéria branca extra-parenchymal, como nervos cranianos. A grafografia dessas estruturas é atualmente prejudicada pela pequena dimensão dos nervos cranianos e pela presença de artefatos de suscetibilidade que reduziram drasticamente o sinal de ressonância magnética para a presença de ar e osso55.
Em conclusão, a colaboração sinérgica entre neurocirurgiões e a equipe de neuroimagem é crucial para fins clínicos e de pesquisa, permitindo ao planejamento com maior precisão a estratégia cirúrgica mais eficaz para cada paciente e contribuindo para o avanço da medicina personalizada neste campo.
Divulgações
Os autores não têm nada a revelar
Agradecimentos
Agradecemos aos técnicos de radiologia e aos enfermeiros da Área de Neuroradiologia, IRCCS Istituto delle Scienze Neurologiche di Bologna, e sua Coordenadora Dra.
Materiais
| Name | Company | Catalog Number | Comments |
| BRAF V600E-specific clone VE1 | Ventana | ||
| Dural Substitute | Biodesign, Cook Medical | ||
| Endoscope | Karl Storz, 4mm in diameter, 18 cm in length, Hopkins II – Karl Storz Endoscopy | ||
| Immunohistochemical staining instrument | Ventana Benchmark, Ventana Medical Systems | ||
| MRI | 3T Magnetom Skyra, Siemens Health Care | ||
| Neuronavigator | Stealth Station S8 Surgical Navigation System, MEDTRONIC |
Referências
- Wang, A. J., Zaidi, H. A., Laws, E. D. History of endonasal skull base surgery. Journal of Neurosurgical Sciences. 60 (4), 441-453 (2016).
- Kassam, A. B., Gardner, P., Snyderman, C., Mintz, A., Carrau, R. Expanded endonasal approach: fully endoscopic, completely transnasal approach to the middle third of the clivus, petrous bone, middle cranial fossa, and infratemporal fossa. Neurosurgical Focus. 19 (1), 6(2005).
- Schwartz, T. H., Morgenstern, P. F., Anand, V. K. Lessons learned in the evolution of endoscopic skull base surgery. Journal of Neurosurgery. 130 (2), 337-346 (2019).
- Cossu, G., et al. Surgical management of craniopharyngiomas in adult patients: a systematic review and consensus statement on behalf of the EANS skull base section. Acta Neurochirurgica. 162 (5), 1159-1177 (2020).
- Komotar, R. J., Starke, R. M., Raper, D. M., Anand, V. K., Schwartz, T. H. Endoscopic endonasal compared with microscopic transsphenoidal and open transcranial resection of craniopharyngiomas. World Neurosurgery. 77 (2), 329-341 (2012).
- Clark, A. J., et al. Endoscopic surgery for tuberculum sellae meningiomas: a systematic review and meta-analysis. Neurosurgical Review. 36 (3), 349-359 (2013).
- Ditzel Filho, L. F., et al. Endoscopic Endonasal Approach for Removal of Tuberculum Sellae Meningiomas. Neurosurgical Clinics of North America. 26 (3), 349(2015).
- Labidi, M., et al. Clivus chordomas: a systematic review and meta-analysis of contemporary surgical management. Journal of Neurosurgical Science. 60 (4), 476-484 (2016).
- Cannizzaro, D., et al. Microsurgical versus endoscopic trans-sphenoidal approaches for clivus chordoma: a pooled and meta-analysis. Neurosurgical Review. , (2020).
- Fujii, T., Platt, A., Zada, G. Endoscopic Endonasal Approaches to the Craniovertebral Junction: A Systematic Review of the Literature. Journal of Neurological Surgery: Part B Skull Base. 76 (6), 480-488 (2015).
- Tubbs, R. S., Demerdash, A., Rizk, E., Chapman, J. R., Oskouian, R. J. Complications of transoral and transnasal odontoidectomy: a comprehensive review. Child's Nervous System. 32 (1), 55-59 (2016).
- Zoli, M., et al. Endoscopic approaches to orbital lesions: case series and systematic literature review. Journal of Neurosurgery. 3, 1(2020).
- Jensterle, M., et al. Advances in the management of craniopharyngioma in children and adults. Radiology and Oncology. 53 (4), 388-396 (2019).
- Roque, A., Odia, Y. BRAF-V600E mutant papillary craniopharyngioma dramatically responds to combination BRAF and MEK inhibitors. CNS Oncology. 6 (2), 95-99 (2017).
- Marucci, G., et al. Targeted BRAF and CTNNB1 next-generation sequencing allows proper classification of nonadenomatous lesions of the sellar region in samples with limiting amounts of lesional cells. Pituitary. 18 (6), 905-911 (2015).
- Silva, M. A., See, A. P., Essayed, W. I., Golby, A. J., Tie, Y. Challenges and techniques for presurgical brain mapping with functional MRI. NeuroImage Clinical. 17, 794-803 (2017).
- Duffau, H. Lessons from brain mapping in surgery for low-grade glioma: insights into associations between tumor and brain plasticity. The Lancet Neurology. 4 (8), 476-486 (2005).
- Maesawa, S., et al. Evaluation of resting state networks in patients with gliomas: connectivity changes in the unaffected side and its relation to cognitive function. PloS One. 10 (2), 0118072(2015).
- Gonen, T., et al. Intra-operative multi-site stimulation: Expanding methodology for cortical brain mapping of language functions. PloS One. 12 (7), 0180740(2017).
- Pillai, J. J. The evolution of clinical functional imaging during the past 2 decades and its current impact on neurosurgical planning. American Journal of Neuroradiology. 31 (2), 219-225 (2010).
- Bizzi, A. Presurgical mapping of verbal language in brain tumors with functional MR imaging and MR tractography. Neuroimaging Clinics of North America. 19 (4), 573-596 (2009).
- Dell'Acqua, F., Tournier, J. D. Modelling white matter with spherical deconvolution: How and why. NMR in Biomedicine. 32 (4), 3945(2019).
- Maier-Hein, K. H., et al. The challenge of mapping the human connectome based on diffusion tractography. Nature Communications. 8 (1), 1349(2017).
- Costabile, J. D., Alaswad, E., D'Souza, S., Thompson, J. A., Ormond, D. R. Current Applications of Diffusion Tensor Imaging and Tractography in Intracranial Tumor Resection. Frontiers in Oncology. 9, 426(2019).
- Jacquesson, T., et al. Full tractography for detecting the position of cranial nerves in preoperative planning for skull base surgery: technical note. Journal of Neurosurgery. , 1-11 (2019).
- Zolal, A., et al. Comparison of probabilistic and deterministic fiber tracking of cranial nerves. Journal of Neurosurgery. 127 (3), 613-621 (2017).
- Ung, N., et al. A Systematic Analysis of the Reliability of Diffusion Tensor Imaging Tractography for Facial Nerve Imaging in Patients with Vestibular Schwannoma. Journal of Neurological Part B Skull Base. 77 (4), 314-318 (2016).
- Anik, I., et al. Visual Outcome of an Endoscopic Endonasal Transsphenoidal Approach in Pituitary Macroadenomas: Quantitative Assessment with Diffusion Tensor Imaging Early and Long-Term Results. World Neurosurgery. 12, 691-701 (2018).
- Oldfield, R. C. The assessment and analysis of handedness: the Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Yushkevich, P. A., et al. User-Guided Segmentation of Multi-modality Medical Imaging Datasets with ITK-SNAP. Neuroinformatics. 17 (1), 83-102 (2019).
- Tournier, J. D., Calamante, F., Connelly, A. Robust determination of the fibre orientation distribution in diffusion MRI: non-negativity constrained super-resolved spherical deconvolution. NeuroImage. 35 (4), 1459-1472 (2007).
- Mormina, E., et al. Optic radiations evaluation in patients affected by high-grade gliomas: a side-by-side constrained spherical deconvolution and diffusion tensor imaging study. Neuroradiology. 58 (11), 1067-1075 (2016).
- Hales, P. W., et al. Delineation of the visual pathway in paediatric optic pathway glioma patients using probabilistic tractography, and correlations with visual acuity. Neuroimage Clinical. 11 (17), 541-548 (2017).
- Testa, C., et al. The effect of diffusion gradient direction number on corticospinal tractography in the human brain: an along-tract analysis. Magma. 30 (3), 265-280 (2017).
- Talozzi, L., et al. Along-tract analysis of the arcuate fasciculus using the Laplacian operator to evaluate different tractography methods. Magnetic Resonance Imaging. 54, 183-193 (2018).
- Zoli, M., et al. Postoperative outcome of body core temperature rhythm and sleep-wake cycle in third ventricle craniopharyngiomas. Neurosurgical Focus. 41 (6), 12(2016).
- Foschi, M., et al. Site and type of craniopharyngiomas impact differently on 24-hour circadian rhythms and surgical outcome. A neurophysiological evaluation. Autonomic Neuroscience. 208, 126-130 (2017).
- Mojón, A., Fernández, J. R., Hermida, R. C. Chronolab: an interactive software package for chronobiologic time series analysis written for the Macintosh computer. Chronobiology International. 9 (6), 403-412 (1992).
- Hardesty, D. A., Montaser, A. S., Beer-Furlan, A., Carrau, R. L., Prevedello, D. M. Limits of endoscopic endonasal surgery for III ventricle craniopharyngiomas. Journal of Neurosurgical Sciences. 62 (3), 310-321 (2018).
- Lee, W. H., et al. Effect of Dexmedetomidine Combined Anesthesia on Motor evoked Potentials During Brain Tumor Surgery. World Neurosurgery. 123, 280-287 (2019).
- Barazi, S. A., et al. Extended endoscopic transplanum-transtuberculum approach for pituitary adenomas. British Journal of Neurosurgery. 27 (3), 374-382 (2013).
- Singh, H., et al. Intraoperative Neurophysiological Monitoring for Endoscopic Endonasal Approaches to the Skull Base: A Technical Guide. Scientifica. , 1751245(2016).
- Mazzatenta, D., et al. Outcome of Endoscopic Endonasal Surgery in Pediatric Craniopharyngiomas. World Neurosurgery. 134, 277-288 (2020).
- Milanese, L., et al. Antibiotic Prophylaxis in Endoscopic Endonasal Pituitary and Skull Base Surgery. World Neurosurgery. 106, 912-918 (2017).
- Hadad, G., et al. A novel reconstructive technique after endoscopic expanded endonasal approaches: vascular pedicle nasoseptal flap. Laryngoscope. 116 (10), 1882-1886 (2006).
- Zoli, M., et al. Cavernous sinus invasion by pituitary adenomas: role of endoscopic endonasal surgery. Journal of Neurosurgical Sciences. 60 (4), 485-494 (2016).
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Coury, J. R., Davis, B. N., Koumas, C. P., Manzano, G. S., Dehdashti, A. R. Histopathological and molecular predictors of growth patterns and recurrence in craniopharyngiomas: a systematic review. Neurosurgical Review. 43 (1), 41-48 (2020).
- Prieto, R., et al. Craniopharyngioma adherence: a comprehensive topographical categorization and outcome-related risk stratification model based on the methodical examination of 500 tumors. Neurosurgical Focus. 41 (6), 13(2016).
- Cagnazzo, F., Zoli, M., Mazzatenta, D., Gompel, J. J. V. Endoscopic and Microscopic Transsphenoidal Surgery of Craniopharyngiomas: A Systematic Review of Surgical Outcomes Over Two Decades. Journal of Neurological Surgery: part A Central European Neurosurgery. 79 (3), 247-256 (2018).
- Cavallo, L. M., et al. The endoscopic endonasal approach for the management of craniopharyngiomas: a series of 103 patients. Journal of Neurosurgery. 121, 100-113 (2014).
- Andersson, J. L., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. Neuroimage. 20 (2), 870-888 (2003).
- Castellano, A., Cirillo, S., Bello, L., Riva, M., Falini, A. Functional MRI for Surgery of Gliomas. Current Treatment Options in Neurology. 19 (10), 34(2017).
- Elowe-Gruau, E., et al. Childhood craniopharyngioma: hypothalamus-sparing surgery decreases the risk of obesity. Journal of Clinical Endocrinology and Metabolism. 98 (6), 2376-2382 (2013).
- Jacquesson, T., et al. Overcoming Challenges of Cranial Nerve Tractography: A Targeted Review. Neurosurgery. 84 (2), 313-325 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados