Method Article
Ruolo della trattografia MRI a diffusione nella chirurgia endoscopica della base cranica endonasale
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Presentiamo un protocollo per integrare la trattografia MRI a diffusione nel work-up del paziente alla chirurgia endoscopica endonasale per un tumore alla base cranica. Vengono descritte le modalità di adozione di questi studi di neuroimaging nelle fasi pre- e intra-operatorie.
Abstract
La chirurgia endoscopica endonasale ha acquisito un ruolo di primo piano nella gestione di tumori complessi della base cranica. Permette la resezione di un ampio gruppo di lesioni benigne e maligne attraverso una via anatomica extracranica naturale, rappresentata dalle cavità nasali, evitando la retrazione cerebrale e la manipolazione neurovascolare. Ciò si riflette nel pronto recupero clinico dei pazienti e nel basso rischio di sequele neurologiche permanenti, che rappresentano il principale avvertimento della chirurgia convenzionale della base cranica. Questo intervento chirurgico deve essere adattato a ciascun caso specifico, considerando le sue caratteristiche e la relazione con le strutture neurali circostanti, per lo più basate sul neuroimaging preoperatorio. Le tecniche avanzate di risonanza magnetica, come la trattografia, sono state raramente adottate nella chirurgia della base cranica a causa di problemi tecnici: processi lunghi e complicati per generare ricostruzioni affidabili per l'inclusione nel sistema di neuronavigazione.
Questo documento mira a presentare il protocollo implementato nell'istituzione e mette in evidenza la collaborazione sinergica e il lavoro di squadra tra neurochirurghi e il team di neuroimaging (neurologi, neuroradiologi, neuropsicologi, fisici e bioingegneri) con l'obiettivo finale di selezionare il trattamento ottimale per ciascun paziente, migliorare i risultati chirurgici e perseguire il progresso della medicina personalizzata in questo campo.
Introduzione
La possibilità di avvicinarsi alla linea mediana della base cranica e alle regioni paramediane attraverso un percorso anteriore, adottando le fosse nasali come cavità naturali, ha una lunga storia, risalente a più di un secolo1. Tuttavia, negli ultimi 20 anni, le tecnologie di visualizzazione e operative sono migliorate abbastanza da espandere la loro possibilità di includere il trattamento dei tumori più complessi come meningiomi, cordomi, condrosarcosmi e craniofaringiomi1 a causa dell'introduzione (1) dell'endoscopio, che offre una visione panoramica e dettagliata 2D / 3D di queste regioni al chirurgo, (2) lo sviluppo di sistemi di neuronavigazione intraoperatoria e (3) l'implementazione di strumenti chirurgici dedicati. Come scrupolosamente dimostrato da Kassam et al. e confermato da molteplici revisioni e meta-analisi, i vantaggi di questo approccio chirurgico sono rappresentati principalmente dalle sue possibilità di resecare tumori della base cranica impegnativi, evitando qualsiasi retrazione cerebrale diretta o manipolazione nervosa, riducendo così il rischio di complicanze chirurgiche e sequele neurologiche e visive a lungo termine2,3,4, 5,6,7,8,9,10,11,12.
Per i tumori multipli della base cranica e ipofisario-diencefali, l'obiettivo chirurgico ideale è cambiato negli ultimi anni dalla più estesa rimozione tumorale possibile alla rimozione più sicura con conservazione delle funzioni neurologiche per preservare la qualità della vita del paziente3. Questa limitazione potrebbe essere compensata da trattamenti adiuvanti innovativi ed efficaci, come la radioterapia (adottando particelle massicce come protoni o ioni carbonio quando appropriato) e, per neoplasie selezionate, dalla chemioterapia come inibitori della via BRAF/MEK per i craniofaringiomi13,14,15.
Tuttavia, per perseguire questi obiettivi, è fondamentale un'attenta valutazione preoperatoria, per adattare la strategia chirurgica alla caratteristica specifica di ciascun caso2. Nella maggior parte dei centri, il protocollo preoperatorio MRI viene solitamente eseguito solo con sequenze strutturali standard, che forniscono la caratterizzazione morfologica della lesione. Tuttavia, con queste tecniche non è sempre possibile valutare in modo affidabile la relazione anatomica del tumore con strutture adiacenti3. Inoltre, ogni paziente può presentare diversi profili di riorganizzazione funzionale indotta dalla patologia rilevabili solo con la trattografia MRI a diffusione e la risonanza magnetica funzionale (fMRI), che possono essere utilizzati per fornire indicazioni sia nella pianificazione chirurgica che nelle fasi intraoperatorie16,17.
Attualmente, la fMRI è la modalità di neuroimaging più comunemente utilizzata per mappare l'attività funzionale e la connettività cerebrale, come guida per la pianificazione chirurgica18,19 e per migliorare l'esito deipazienti 20. La fMRI basata su attività è la modalità di scelta per identificare regioni cerebrali "eloquenti" che sono funzionalmente coinvolte in specifiche prestazioni di attività (ad esempio, battito delle dita, fluidità fonemica), ma non è applicabile per lo studio dei tumori della base cranica.
La trattografia MRI a diffusione consente la ricostruzione in vivo e non invasiva delle connessioni cerebrali della sostanza bianca e dei nervi cranici, indagando la struttura olodologica del cervello21. Sono stati sviluppati diversi algoritmi di trattografia per ricostruire percorsi assonali collegando profili di diffusività delle molecole d'acqua, valutati all'interno di ciascun voxel cerebrale. La trattografia deterministica segue la direzione dominante della diffusività, mentre la trattografia probabilistica valuta la distribuzione della connettività dei possibili percorsi. Inoltre, diversi modelli possono essere applicati per valutare la diffusività all'interno di ciascun voxel, ed è possibile definire due categorie principali: modelli a fibra singola, come il modello del tensore di diffusione, in cui viene valutato un singolo orientamento della fibra, e modelli a fibra multipla, come la deconvoluzione sferica, in cui vengono ricostruiti diversi orientamenti a fibra incrociata22,23. Nonostante il dibattito metodologico sulla trattografia MRI a diffusione, la sua utilità nel flusso di lavoro neurochirurgico è attualmente stabilita. È possibile valutare la lussazione del tratto della sostanza bianca e la distanza dal tumore, preservando specifiche connessioni della sostanza bianca. Inoltre, le mappe di imaging del tensore di diffusione (DTI), in particolare l'anisotropia frazionaria (FA) e la diffusività media (MD), possono essere applicate per valutare le alterazioni microstrutturali della sostanza bianca correlate a possibili infiltrazioni tumorali e per il monitoraggio longitudinale del tratto. Tutte queste caratteristiche rendono la trattografia MRI a diffusione un potente strumento sia per la pianificazione pre-chirurgica che per il processo decisionale intra-operatorio attraverso sistemi di neuronavigazione24.
Tuttavia, l'applicazione delle tecniche di trattografia alla chirurgia della base cranica è stata limitata dalla necessità di conoscenze tecniche specializzate e dal lungo lavoro per ottimizzare l'acquisizione della sequenza MRI di diffusione, il protocollo di analisi e l'incorporazione dei risultati della trattografia nei sistemi di neuronavigazione25. Infine, ulteriori limitazioni sono dovute alle difficoltà tecniche che estendono queste analisi dalle strutture intraarenchimali a extra-parenchimali della sostanza bianca, come i nervi cranici. In effetti, solo studi recenti hanno presentato risultati preliminari che tentano di integrare la risonanza magnetica avanzata e la chirurgia della base cranica26,27,28.
Il presente documento presenta un protocollo per la gestione multidisciplinare dei tumori ipofisario-diencefalico e della base cranica mediante trattografia MRI a diffusione. L'implementazione di questo protocollo nell'istituzione è il risultato della collaborazione tra neurochirurghi, neuro-endocrinologi e il team di neuroimaging (comprese le competenze cliniche e bioinformatiche) per offrire un efficace approccio multiassiale integrato a questi pazienti.
Nel centro, abbiamo integrato protocolli multidisciplinari per la gestione dei pazienti con tumori della base cranica, per fornire la descrizione più informativa possibile e per personalizzare e personalizzare il piano chirurgico. Dimostriamo che questo protocollo può essere adottato sia in ambito clinico che di ricerca per qualsiasi paziente con tumore della base cranica per guidare la strategia di trattamento e migliorare le conoscenze sulle modificazioni cerebrali indotte da queste lesioni.
Protocollo
Il protocollo segue gli standard etici del Comitato di ricerca locale e con la dichiarazione di Helsinki del 1964 e le sue successive modifiche o standard etici comparabili.
1. Selezione dei pazienti
- Adottare i seguenti criteri di inclusione: pazienti di età superiore ai 18 anni, pienamente collaborativi, che presentano un tumore della base cranica o della regione ipofisario-diencefale.
- Escludere i pazienti con controindicazione alla risonanza magnetica (cioè un pacemaker o materiale ferromagnetico) o che presentano condizioni cliniche emergenti (ad esempio, ipertensione intracranica, la perdita visiva acuta che richiede un intervento chirurgico immediato), o donne in gravidanza, o pazienti con malattia mentale, o coloro che rifiutano esplicitamente di partecipare a questo protocollo.
2. Preparazione all'esame MRI
- Prima dell'esame MRI, somministrare il modulo di sicurezza per escludere controindicazioni significative all'esame e all'iniezione di mezzi di contrasto: nessun materiale ferromagnetico nel corpo, valutazione dei dispositivi MRI, sicuro o condizionale, nessun pacemaker, nessuna lente a contatto con gli occhi.
- Se lo scanner utilizzato per l'acquisizione della risonanza magnetica è un campo elevato (ad esempio, 3 T, vedi Tabella dei materiali), considerare eventuali controindicazioni aggiuntive relative, ad esempio, ai dispositivi di neurostimolazione.
- Controllare se il paziente ha claustrofobia.
- Assicurarsi che il paziente abbia letto e firmato il modulo di consenso MRI per riconoscere i rischi e i benefici dell'esame di imaging.
- Avere un neuropsicologo eseguire una valutazione generale e una valutazione neurocognitiva mirata in base alla posizione del tumore.
- Amministrare l'inventario di Edimburgo per valutare la dominanza della maneggevolezza29.
3. Posizionamento del paziente nello scanner
- Dare tappi per le orecchie al paziente per ridurre il rumore della risonanza magnetica.
- I movimenti della testa possono influenzare la qualità dell'immagine; quindi, utilizzare cuscinetti di schiuma per ridurre i movimenti della testa, immobilizzando la testa all'interno della bobina MRI.
- Fornire un pulsante di allarme di emergenza al paziente in caso di necessità di interrompere l'esame.
- Accendere la fotocamera e il microfono all'interno dello scanner per monitorare, parlare e ascoltare il paziente dalla sala di acquisizione DELLA RISONANZA MAGNETICA all'esterno dello scanner.
4. Parametri di impostazione e acquisizione del protocollo MRI cerebrale
- Acquisire uno scanner ad alto campo con protocollo MRI multimodale standardizzato (1,5 T o 3T). I seguenti parametri di sequenza si riferiscono a una risonanza magnetica a 3 T, utilizzando una bobina array ad alta densità testa-collo (64 canali).
- Acquisire sequenze anatomiche volumetriche ad alta risoluzione: somministrazione di mezzi di contrasto pre e post-gadolinio pesati T1 e FLAIR T2.
- Per le immagini pesate T1 e T2 acquisiscono fette sagittali continue che forniscono una risoluzione isotropa di 1x1x1 mm3 tempo di scansione di circa 5 minuti per sequenza.
- Acquisire una sequenza ponderata T2 ad alta risoluzione e localizzare l'area tumorale per la visualizzazione del nervo cranico: un CISS volumetrico (Constructive Interference in Steady State) con dimensione voxel di 0,5x0,5x0,5 mm3 (tempo di scansione di circa 9 minuti).
- Acquisire sequenze ponderate per diffusione utilizzando immagini ecoplanari a scatto singolo (EPI), dimensione voxel di 2x2x2 mm3,64 direzioni del gradiente magnetico con valore b di 2000 s/mm2,tempo di eco di 98 ms e tempo di rilassamento di 4300 ms.
- Acquisire cinque volumi con valore b nullo all'inizio dell'acquisizione ponderata per diffusione con direzione di codifica di fase impostata su anteriore-posteriore (per immagini ponderate per diffusione tempo totale di scansione di 5 minuti).
- Inoltre, acquisire tre volumi con valore b nullo ma direzione di codifica di fase invertita, posteriore-anteriore, per correggere le distorsioni di imaging dovute all'acquisizione EPI (tempo di scansione di 42 secondi). Vengono acquisite fette assiali continue.
- Acquisire sequenze aggiuntive per studiare specifiche caratteristiche tumorali, come la spettroscopia MRI multi- o single-voxel localizzata nell'area tumorale.
NOTA: La durata totale della scansione è di circa 30 minuti, esclusa la preparazione del paziente per l'esame MRI.
5. Pre-elaborazione delle immagini MR cerebrali
- Convertire i dati MRI dal formato di imaging adottato dalle console di acquisizione MRI, DICOM (.dcm), al formato NIFTI (.nii) utilizzato nelle analisi di imaging avanzate.
- Eseguire la funzione dcm2niix (https://github.com/rordenlab/dcm2niix). Impostare come file di input le immagini dicom e come output i file .nii corrispondenti: T1.nii, Flair.nii, T1_contrast.nii, DTI_b2000.nii e DTI_b0_flip.nii.
- Installare i software FSL (https://fsl.fmrib.ox.ac.uk/fsl/fslwiki) e MRtrix3 (https://www.mrtrix.org) necessari per le analisi di imaging avanzate.
- Registrare Flair.nii e T1_contrast.nii nell'immagine T1.nii eseguendo la funzione FSL-flirt, che esegue una registrazione lineare dell'immagine.
- Registrare l'immagine DTI_b2000.nii su T1.nii eseguendo la funzione FSL-epi_reg, che tiene conto degli artefatti di distorsione dell'immagine EPI.
- Eseguire la funzione FSL-topup per correggere gli artefatti della direzione di codifica di fase che presentano l'immagine DTI_b2000.nii. Impostare l'acquisizione della codifica inversa in fase DTI_b0_flip.nii come file di input "in_main".
- Eseguire la funzione MRtrix3-dwidenoise per la denoizzazione delle immagini con una modellazione del rumore dei componenti principali.
- Per correggere la corrente parassidale e l'artefatto di drop-out del segnale, eseguire la funzione FSL-eddy e, per le disomogeneità del segnale indotte dalla bobina MRI, la funzione corretta di MRtrix3-dwibias.
- Eseguire la funzione FSL-bet per rimuovere il segnale scalpo che presenta l'immagine T1.nii e rinominare il file di output utilizzando il suffisso "_brain": T1_brain.nii.
6. Segmentazione del tumore
- Installare il software itk-snap (http://www.itksnap.org) 30.
- Una volta installato il software itk-snap, premere File - Apri immagine principale e selezionare l'immagine T1.nii, quindi premere File - Aggiungi un altro imager e caricare le immagini Flair.nii e T1_contrast.nii, impostando l'opzione di sovrapposizione semitrasparente.
- Ispezionare il tumore nelle immagini T1.nii, Flair.nii e T1_contrast.nii. Scegli il piano anatomico da seguire quando disegni la lesione, ad esempio assiale.
- Posizionare il puntatore in una fetta assiale per iniziare. Nella barra degli strumenti principale, selezionate l'icona Di ispezione poligoni e iniziate a disegnare i confini del tumore utilizzando lo stile di disegno a mano libera - Curva liscia o Poligono.
- Una volta terminato il disegno del perimetro tumorale, chiudere la curva che collega il primo e l'ultimo punto, premere Accettae continuare a disegnare nella fetta successiva. Per le lesioni tumorali di grandi dimensioni, per accelerare il processo di prelievo, saltare alcune fette assiali (ad esempio, tre) e disegnare il perimetro della lesione in fette interlacciate.
- Alla fine del disegno perimetrale della lesione, selezionare Strumenti - Interpola etichette, impostare l'etichetta su/con interpolare come lesione tumorale e interpolare lungo un singolo asse come l'orientamento dell'asse seguito nel disegno dei confini tumorali.
- Selezionare Segmentazione - Salva immagine di segmentazione e denominare la segmentazione del tumore come Tumor_mask.nii selezionando l'opzione formato Nifti da salvare.
7. Analisi trattografica
- Eseguire la funzione FSL-dtifit per modellare la diffusività e le diverse direzioni spaziali e ottenere le seguenti mappe del tensore di diffusione: FA.nii, MD.nii e V1.nii. Valutare queste mappe DTI per accedere a valori di diffusività anormali che possono verificarsi in presenza di edema tumorale o infiltrazione.
- Eseguire la funzione MRtrix3-tckgen con l'impostazione predefinita "ifod2" per eseguire la trattografia probabilistica e ricostruire i percorsi della sostanza bianca modellando i problemi di fibre incrociate31.
- Adottare un approccio seed-target impostando le opzioni "-seed_image" e "-include" basate su conoscenze anatomiche a priori.
- Disegnare manualmente le regioni di interesse (ROI) impostate come seme o destinazione per la trattografia. In alternativa, utilizzare ROI basati su atlante. Vedi Mormina et at. 32 per la trattografia a radiazione ottica, Hales et al.33 per il chiasma ottico e i nervi cranici ottici, e Testa et al.34 per i tratti piramidali.
- Avviare il visualizzatore di immagini FSL-fsleyes, selezionare Aprie scegliere le immagini da ispezionare visivamente.
- Nel visualizzatore FSL-fsleyes, vai a Impostazioni - Ortho View 1 e attiva lo strumento Modifica modalità.
- Fare clic sull'icona a forma di matita FSL-fsleyes e disegnare i ROI della trattografia.
- Installare il software Freesurfer (https://surfer.nmr.mgh.harvard.edu).
- Eseguire la funzione Freesurfer-Recon-all sull'immagine T1.nii per ottenere la segmentazione automatica della regione corticale da utilizzare come ROI trattografici.
- Eseguire la funzione FSL-epi_regregistration, impostando come immagine di input T1.nii e l'immagine di riferimento DTI_b2000.nii, salvare la matrice di output della registrazione (T1_onto_DTI.mat).
- Utilizzare la matrice T1_onto_DTI.mat ottenuta per registrare i ROI segmentati nell'immagine DTI_b2000.nii.
- Eseguire la trattografia utilizzando la funzione MRtrix3-tckgen.
- Eseguire la funzione MRtrix3-tckmap per convertire l'output della trattografia .tck" nell'immagine "-template FA.nii".
- Eseguire la funzione FSL-flirt per registrare linearmente l'immagine T1.nii nel modello MNI152_T1_2mm_brain.nii.
- Salvate la matrice di output come T1_onto_MNI.mat. Eseguire la funzione FSL-convert_xfm impostando l'opzione "-concat" come T1_onto_MNI.mat e T1_onto_DTI.mat, salvare la matrice di output come DTI_onto_MNI.mat.
8. Tractography: analisi lungo il tratto
- Per una descrizione accurata dei parametri DTI, utilizzare algoritmi lungo il tratto, come l'algoritmo basato su Matlab che modella la geometria del tratto di superficie con le proprietà dell'operatore laplaciano35.
- Installare il software Matlab (https://matlab.mathworks.com) e richiedere il codice lungo il tratto agli autori in via di sviluppo35.
- In alternativa, utilizza la funzione MRtrix3-tcksample per l'analisi lungo il tratto poiché Matlab richiede una licenza.
9.3D rendering
- Installare il software Surf Ice (https://www.nitrc.org/plugins/mwiki/index.php/surfice:MainPage).
- Nel pannello di comando Surf Ice, fare clic su Avanzate - Converti voxelwise in mesh, selezionare l'immagine nifti da convertire, salvare il file .obj risultante.
- Nel pannello di comando Surf Ice, fate clic su File - Aprie selezionate il file .obj per visualizzare il rendering del volume 3D.
10. Esami clinici preoperatori
- Eseguire una valutazione endocrinologica bio-umorale, costituita da prolattina, TSH, freeT4, ACTH, cortisolo, GH, LH, FSH e test sierici testosterone totale / estradiolo, rispettivamente negli uomini e nelle donne.
- Analizzare il volume delle urine nelle 24 ore e l'osmolalità sierica e urinaria e i livelli di sodio per determinare la presenza di diabete insipido.
- Eseguire una valutazione oftalmologica, compresa la misurazione dell'acuità visiva, la valutazione computerizzata del campo visivo e la tomografia a coerenza ottica retinica (OCT).
- Eseguire un esame fisico neurologico, con una raccolta di informazioni anamnestiche sull'aumento di peso, la sensazione di fame, monitorare continuamente la temperatura rettale ogni 2 minuti per 24 ore utilizzando un dispositivo portatile per valutare il ritmo della temperatura circadiana e la registrazione del ciclo sonno-veglia di 24 ore (incluso un elettroencefalogramma, elettro-oculogramma destro e sinistro, elettrocardiogramma ed elettromiogramma dei muscoli miloioide e tibiale sinistro e destro)36, 37,38.
11. Pianificazione chirurgica
- Discutere in un team collegiale che incontra ogni paziente candidato alla chirurgia, in base ai risultati della segmentazione tumorale e della relazione con le strutture neurali eloquenti funzionali (nervi ottici e chiasma, gambo ipofisario, terzo ventricolo, arteria carotide interna, complesso arterio cerebrale anteriore-arteria comunicante anteriore (ACA-ACoA), arteria basilare, nervi cranici III, IV, VI, corpi mammillari, tratti della sostanza bianca, e aree corticali funzionali) per determinare l'approccio chirurgico più appropriato.
- Selezionare il corridoio chirurgico con il minimo rischio di lesioni delle strutture neurali39.
- Definire l'area di resezione sicura per ogni caso, localizzando la struttura neurale critica (come chiasma, corpo mammillare) sotto la cui vicinanza la resezione deve essere arrestata per evitare danni permanenti39.
- Unire le sequenze MRI più rilevanti e importarle nel sistema di neuronavigazione della fase operativa.
12. Preparazione chirurgica
- Indurre l'anestesia generale adottando l'anestesia endovenosa totale con propofol e remifentanil (è stato dimostrato che gli altri agenti anestetici sono tra i fattori più critici che influenzano l'affidabilità del monitoraggio intraoperatorio, aumentando il tasso di falsi negativi), evitando il miorilassante40.
- Eseguire l'intubazione oro-tracheale con garze nell'orofaringe per prevenire perdite di sangue o liquidi nello stomaco o nelle vie aeree41.
- Impostare il monitoraggio neurofisiologico, con registrazione continua dei potenziali evocati motori (MEP) e dei potenziali evocati somatosensoriali (SEP) ed elettromiografia a funzionamento libero (EMG) per i nervi cranici.42
- Importare i dati della risonanza magnetica, comprese le ricostruzioni della trattografia, nel sistema di neuronavigazione (Tabella dei materiali).
- Selezionare la modalità di registrazione elettromagnetica della chirurgia cerebrale sul sistema di neuronavigazione.
- Registrare il sistema di neuronavigazione sul paziente, adottando una tecnica di free-tracking o marcatori esterni.
- Controllare l'accuratezza della registrazione raggiunta, controllando la posizione dei marcatori esterni (ad es. orecchio o naso) sulla risonanza magnetica importata; se il risultato non è accettabile, ripetere la registrazione.
- Posizionare il paziente in posizione semi-seduta; L'uso di Mayfield per fissare la testa non è necessario43.
- Somministrare corticosteroidi (flebocortide endovenoso, dosaggio a seconda del peso del paziente) e antibiotici (2 g di acido amoxicillina-clavulanico)44.
13. Chirurgia endoscopica endonasale
- Inizia con un endoscopio a 0° (Tabella dei materiali).
- Raccogli il lembo naso-setto45.
- Eseguire una sfenoidotomia anteriore, seguita da settostomia posteriore ed ethmoidectomia con conservazione del turbinato medio, quando possibile43.
- Aprire l'osso sellar e tubercolare41.
- Incidere lo strato di dura con una forma a H, dopo coagulazione del seno intercavernoso superiore41.
- Scindere il tumore dal piano aracnoidale43.
- Debulk centrale il tumore43.
- Rimuovere la sua capsula dalle strutture neurali diencefaliche circostanti, arrestando la resezione in caso di adesione tumorale a strutture eloquenti visualizzate sotto guida neuronavigazione43.
- Esplorare la cavità chirurgica con ottica angolata (Tabella dei materiali)46.
- Garantire l'emostasi con coagulazione bipolare o agenti emostatici.
- Chiudere l'apertura osteo-meningea con uno strato intradurale intradurale di sostituto durale43.
- Posizionare uno strato intracranico extradurale di sostituto durale, impalcato con grasso addominale ed eventualmente osso (Tabella dei materiali)43.
- Coprire la chiusura con il lembo naso-setto43.
14. Esame istologico
- Fissare i campioni di tumore con il 10% di formalina e incorporarli nella paraffina immediatamente dopo l'intervento chirurgico.
- Tagliare il tessuto in sezioni di spessore 4 μm e macchiare con ematossilina ed eosina. La diagnosi istologica deve essere basata sulla versione più recente della classificazione OMS dei tumori cerebrali (2016)47.
- Eseguire la colorazione immunoistochimica del campione mediante uno strumento di colorazione immunoistochimico automatizzato, utilizzando l'etichettatura avidina-biotina e la diaminobenzidina come reagente di rilevamento. Per i craniofaringiomi, adottare anticorpi anti-beta-catenina, anti-BRAF v600E mutante e anti-Ki67 per la colorazione immunoistochimica (Tabella dei materiali).
- Valutare l'indice Ki-67 attraverso il conteggio manuale delle cellule tumoralipositive 48.
15. Gestione post-chirurgica del paziente
- Svegliare il paziente immediatamente dopo l'intervento chirurgico.
- Ripristina la respirazione spontanea dalla bocca riempiendo le cavità nasali con materiale assorbibile e non assorbibile.
- Monitorare i parametri vitali (pressione sanguigna, frequenza cardiaca, saturazione di ossigeno e stato di coscienza) per le successive 6-12 ore in terapia intensiva.
- Ripristinare l'alimentazione orale dopo 12 ore.
- Eseguire una SCANSIONE TC dopo 6-9 ore.
- Mantenere il riposo a letto per tre giorni con il trattamento con eparina.
- Controllare l'equilibrio dei liquidi ogni 12 ore e valutare gli elettroliti sierici ogni 24 ore.
- Somministrare la terapia con corticosteroidi (flebocortide endovenoso nelle prime 24 ore, e poi cortone acetato orale 30 +15 mg / die).
- Eseguire una risonanza magnetica con / senza gadolinio entro 72 ore dopo l'intervento chirurgico.
- Dimissionere il paziente il4 ° giorno.
16. Follow-up anticipato
- Ripetere la valutazione endocrinologica completa 30 giorni dopo l'interventochirurgico 43.
- Ripetere la valutazione oftalmologica tre mesi dopo l'interventochirurgico 43.
- Ripetere l'esame fisico neurologico e la temperatura e i ritmi sonno-veglia indagini di funzione tre mesi dopo l'interventochirurgico 46.
- Eseguire la risonanza magnetica con/senza gadolinio tre mesi dopo l'intervento chirurgico46.
17. Terapia adiuvante
- Valutare la presenza di progressione precoce del tumore e, se è indicato, indirizzare il paziente alla radioterapia43.
18. Follow-up a lungo termine
- Ripetere le valutazioni cliniche, endocrinologiche e oftalmologiche ogni anno43.
- Eseguire la risonanza magnetica annuale con/senza gadolinio: in caso di recidiva, il paziente può essere ri-operato e quindi riferito alla radioterapia o direttamente riferito alla radioterapia43.
Risultati
Una donna di 55 anni presentava deficit visivi progressivi. La sua storia medica era insignificante. Alla valutazione oftalmologica, è stata rivelata una riduzione bilaterale dell'acuità visiva (6/10 nell'occhio destro e 8/10 nell'occhio sinistro) e il campo visivo computerizzato ha mostrato un'emianopia bitemporale completa. Non sono stati evidenti ulteriori deficit all'esame neurologico, ma il paziente ha riportato astenia persistente e un aumento della sensazione di fame e sete nei precedenti 2-3 mesi, con un aumento di peso di 4-5 kg e frequenti risvegli nella notte per la necessità di urinare. Sulla valutazione endocrinologica, sono stati rivelati ipercorticismo centrale e diabete insipido. Il paziente è stato trattato con corticosteroidi (idrocortisone 30+15 mg/die e desmopressina 30+30 μg/die). Durante il ciclo sonno-veglia di 24 ore e il monitoraggio della temperatura, non sono state notate alterazioni significative dopo l'ottimizzazione della terapia ormonale sostitutiva.
La risonanza magnetica cerebrale ha dimostrato un tumore soprasellare che occupa la cisterna opto-chiasmatica e invade il 3° ventricolo, con morfologia policistica irregolare, potenziante dopo il gadolinio, sospettato come prima ipotesi di un craniofaringioma(Figura 1A-C). Sono state eseguite analisi di imaging avanzate, come illustrato nel protocollo corrente. La segmentazione del nucleo tumorale ha evidenziato l'assorbimento di gadolinio e corrispondeva a un volume di 7,92 cm3 (Figura 1D-E).
I percorsi visivi sono stati i più critici da valutare nella pianificazione pre-chirurgica di questo paziente. I tratti piramidali sono stati inoltre ricostruiti per valutare il correlato microstrutturale dell'aumento del segnale rilevato sull'immagine ponderata FLAIR T2 a livello del tratto destro.
È stata studiata la ricostruzione della trattografia della via ottica, in particolare la lussazione del chiasma ottico in presenza della massa tumorale. Sono stati ricostruiti anche i nervi cranici ottici bilaterali. Nell'interfaccia tra cervello, ossa e vasi sanguigni, gli artefatti di suscettibilità non consentivano la ricostruzione completa delle fibre che collegano il chiasma ottico ai nervi ottici (Figura 2).
Il profilo di diffusività dei tratti piramidali è stato studiato con statistiche di mappe DTI lungo il tratto. A livello dell'arto posteriore destro della capsula interna, era presente un'iperintensità focale pesata FLAIR T2, corrispondente ad un aumento del 5% della misura MD destra(5°-7° segmento) rispetto al lato sinistro (Figura 3).
Considerando tali relazioni tra tumore e strutture neurali, è stato scelto l'approccio endoscopico endonasale esteso al trapianto/transtubercolo36. La rimozione del tumore è stata eseguita con una tecnica microchirurgica a due mani. Inizialmente, il tumore è stato debulked centralmente, drenando anche la sua componente cistica (Figura 4). Successivamente, è stato possibile staccare progressivamente il craniofaringioma dalle strutture neurali, adottando l'aracnoide come piano di scissione (Figura 5). Al termine dell'intervento chirurgico, è stata raggiunta la completa rimozione del tumore con la conservazione anatomica dell'ipotalamo (Figura 6). La riparazione del difetto osteo-durale è stata eseguita con grasso addominale e lembo naso-setto (Figura 7).
Il decorso postoperatorio è stato privo di eventi e il paziente è stato dimesso dopo quattro giorni nelle giuste condizioni cliniche. Il tumore si è rivelato essere un craniofaringioma adamantinomatoso (grado 1 dell'OMS) all'esame istologico.
Il paziente ha sviluppato panipopituitarismo completo al follow-up ed è stato sottoposto a terapia sostitutiva completa con idrocortisone, desmopressina e levotiroxina. I deficit visivi sono completamente regrediti e non sono state rilevate alterazioni all'esame neurologico, il ciclo sonno-veglia di 24 ore e il monitoraggio della temperatura. Tre mesi di risonanza magnetica cerebrale hanno dimostrato una completa rimozione del tumore, senza residui o recidive. Pertanto, non è stato consigliato alcun trattamento adiuvante e il paziente viene seguito con esami clinici e neuroradiologici annuali (Figura 8).

Figura 1. Sequenze anatomiche di risonanza magnetica preoperatoria (F/55 anni). Vista assiale di T1-pesato (A) e FLAIR T2 pesato (B); assiale (C, D) e sagittale (E) T1- dopo somministrazione di gadolinio (0,1 mm/kg). La segmentazione tumorale (rossa) sovrapposta all'immagine pesata T1 potenziata con gadolinio è mostrata in D ed E. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2. Rendering 3D preoperatorio di vie ottiche trattografia e segmentazione tumorale. (A) La fetta assiale dell'immagine pesata FLAIR T2 si sovrappone alla trattografia del chiasma ottico, localizzata anteriormente al tumore. (B) Rendering in volume 3D dell'immagine pesata FLAIR T2, selezionando un piano assiale e sovrapponendo la trattografia delle vie ottiche. (C)Rendering del volume 3D della superficie cerebrale, trattografia delle vie ottiche e segmentazione del tumore in rosso. Tutte le linee di aerodinamica della trattografia dei pannelli sono colorate dalla mappa dei colori della direzionalità RGB (rosso: laterale-laterale, verde: anteriore-posteriore e blu: inferiore-superiore). Fare clic qui per visualizzare una versione più grande di questa figura.
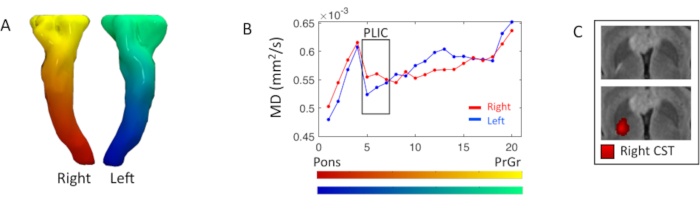
Figura 3. Analisi piramidale lungo il tratto DTI misura. (A) Rendering 3D dei tratti piramidali bilaterali o del tratto corticospinale (CST), colorati in base al gradiente di segmentazione inferiore-superiore laplaciano. (B) Profili CST di destra (rosso) e sinistro (blu) di diffusività media (MD) risultanti dalla suddivisione del tratto in venti segmenti visualizzati nelle mappe a colori in A; i segmenti iniziano a livello del pons verso il giro precentrale (PrCr). La scatola nera evidenzia i segmenti all'arto posteriore della capsula interna (PLIC)(5 °-7°). (C) Vista assiale dell'immagine pesata FLAIR T2 a livello PLIC, con e senza la giusta mappa di connettività CST, dove un'intensità rossa più brillante corrisponde a una densità di streamline più elevata. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4. Immagini endoscopiche intraoperatorie. (A) 0° scope, dopo l'apertura durale, il tumore è stato inizialmente staccato dal chiasma, adottando l'aracnoide come piano di scissione. (B) e (C), in seguito, è stato debulked centralmente, e la cisti è stata progressivamente drenata. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5. Immagini endoscopiche intraoperatorie. (A) 0° ambito, il craniofaringioma viene scisso dal piano aracnoidale con l'aiuto della neuronavigazione, mostrando il tumore e le strutture neurali (identificate secondo il nostro protocollo attuale). Pertanto, i corpi mammillari possono essere risparmiati per evitare danni ipotalamici permanenti. (B) e (C) in seguito, è stato possibile resecare il tumore dalle superfici ipotalamiche mediali, evitando qualsiasi trazione per non danneggiare tale struttura neurale. (D) Durante la rimozione della porzione intra-ventricolare del tumore, è stata prestata particolare attenzione nella riapertura dell'acquedotto cerebrale e del foramina di Monro per evitare l'idrocefalo acuto postoperatorio. Fare clic qui per visualizzare una versione più grande di questa figura.
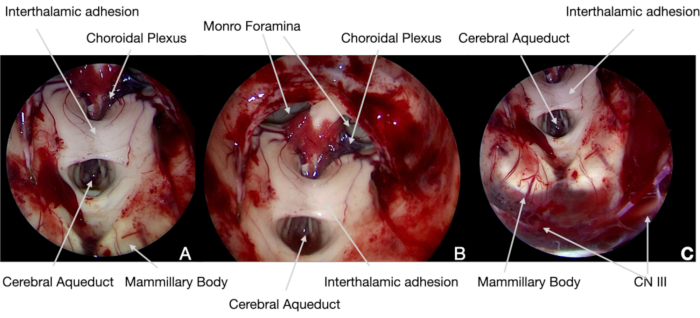
Figura 6. Immagini endoscopiche intraoperatorie. (A) e (B) 30° ambito, al termine dell'intervento chirurgico, la struttura neurale del3° ventricolo è stata esplorata con ottica angolata per confermare la completa rimozione del tumore e dimostrarne l'integrità anatomica. (C)In fondo al campo chirurgico, è stato possibile identificare il CN III, sotto la membrana Liliequist: la sua funzione, in quanto i MEP, i SEP e altri CN, era stata continuamente controllata con il monitoraggio neurofisiologico intraoperatorio. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7. Immagini endoscopiche intraoperatorie. (A) 0° ambito, la chiusura del difetto osteo-durale richiede una tecnica multistrato, adottando sostituto durale, grasso addominale, eventualmente osso, e lembo naso-setto. Il primo strato è costituito dal posizionamento intradurale intradurale del primo strato di un sostituto durale. (B) Il passo successivo è rappresentato dal posizionamento del grasso addominale per riempire la cavità chirurgica; particolare attenzione dovrebbe essere prestata per evitare il sovraimballaggio. (C) Il secondo strato di sostituto durale è adottato per coprire il grasso, e può essere mantenuto in posizione grazie ad un'impalcatura rigida, come un pezzo di osso o cartilagine (tecnica di tenuta della guarnizione). (D) Infine, il lembo naso-setto o un innesto libero di setto o turbinato medio viene utilizzato per coprire la chiusura multistrato. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8. Risonanza magnetica, vista sagittale T1-pesata dopo somministrazione di gadolinio (0,1 mm/kg). (A) La risonanza magnetica preoperatoria dimostra il tumore. (B)Post-operatoriamente, sono visibili la completa rimozione del tumore con la conservazione anatomica dei corpi mammillari e le strutture ipotalamiche. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
L'applicazione del protocollo presentato ha portato a un trattamento sicuro ed efficace di uno dei tumori intracranici più impegnativi come un craniofaringioma che invade il 3° ventricolo, aprendo forse un nuovo orizzonte per una lesione che è stata definita da H. Cushing circa un secolo fa come la neoplasia intracranica più sconcertante1. La combinazione di un'accurata pianificazione preoperatoria, l'integrazione di tecniche avanzate di risonanza magnetica e valutazioni cliniche multidisciplinari ci hanno permesso di personalizzare la strategia chirurgica, identificando il corridoio chirurgico più appropriato e riducendo al minimo il rischio di danni alla struttura neurale2,49,50,51. A differenza di altri protocolli MRI riportati in letteratura, l'inclusione di sequenze veloci, come le scansioni di codifica inversa di fase per immagini ponderate per diffusione, consente correzioni avanzate di post-elaborazione52. Questa procedura dovrebbe sempre essere adottata, specialmente in campo ad alta intensità (ad esempio, 3 T o superiore) in cui sono presenti distorsioni di imaging.
Inoltre, l'uso di un approccio di trattografia probabilistica basato sulla deconvoluzione sferica vincolata ha permesso un aumento della qualità della ricostruzione delle fibre rispetto ad altri modelli di trattografia deterministica53. Inoltre, il rendering 3D proposto e le analisi quantitative hanno aumentato l'accuratezza della valutazione preoperatoria del paziente. Questo studio di neuroimaging, insieme al monitoraggio neurofisiologico, ha rappresentato una guida per il chirurgo, aiutandolo a decidere se e dove interrompere la resezione chirurgica con l'obiettivo finale di evitare deficit neurologici permanenti dei pazienti.
Infatti, la resezione tumorale più aggressiva per craniofaringiomi è stata recentemente progressivamente abbandonata a favore di una tecnica ipotalamo-risparmiante, consistente nell'arrestare il tumore rimosso prima di qualsiasi danno neurale permanente54. Tuttavia, nella pratica clinica standard, è spesso complicato per il neurochirurgo decidere quando interrompere la rimozione del tumore dal raggiungimento della massima resezione sicura, esponendo il paziente al rischio, da un lato, di lasciare un residuo tumorale più grande del previsto o, dall'altro, di indurre una lesione ipotalamico permanente, con conseguente danno di qualità della vita.
Il protocollo presentato ha fornito un modello di integrazione dei dati clinici e neuroradiologici con l'intenzione di fornire un metodo pratico e di facile adozione per la gestione dei tumori ipofisario-diencefalico e della base cranica. Tuttavia, sottolineiamo che presenta alcuni punti critici: la necessità di attrezzature adeguate, come magneti ad alto campo (3 T), bobina di canale ad alta risoluzione e software avanzato di imaging pre / elaborazione.
Anche le sequenze MRI nel protocollo presentato sono acquisibili a 1,5 T, ma i parametri di acquisizione riportati nella Fase 4 devono essere modificati per ottenere un buon rapporto segnale/rumore: per le sequenze ponderate per diffusione, si suggerisce un valore b inferiore (ad esempio, 1000 s/mm2). Inoltre, l'implementazione delle analisi di neuroimaging proposte e la loro introduzione nella pratica clinica hanno richiesto competenze tecniche e informatiche sia cliniche che mriche, in particolare per l'elaborazione dell'imaging. La maggior parte del software riportato è disponibile gratuitamente (ad esempio, FSL, MRtrix3), ma lo sviluppo di pipeline homebrew è necessario per gestire set di dati specifici o analisi di imaging.
Inoltre, l'ulteriore punto critico è che, sebbene questa tecnologia rappresenti un supporto cruciale per il chirurgo, non potrebbe sostituire la loro curva di apprendimento. Per questi motivi, questo intervento chirurgico avanzato dovrebbe essere riservato a pochi o terziari centri di riferimento, specialisti altamente specializzati e dedicati.
Infine, l'obiettivo futuro è quello di migliorare la ricostruzione delle strutture extra-parenchimali della sostanza bianca, come i nervi cranici. La trattografia di queste strutture è attualmente compromessa dalla piccola dimensione dei nervi cranici e dalla presenza di artefatti di suscettibilità che hanno ridotto drasticamente il segnale MRI per la presenza di aria e osso55.
In conclusione, la collaborazione sinergica tra neurochirurghi e il team di neuroimaging è cruciale ai fini clinici e di ricerca, consentendo di pianificare con la massima accuratezza la strategia chirurgica più efficace per ogni paziente e contribuendo al progresso della medicina personalizzata in questo campo.
Divulgazioni
Gli autori non hanno nulla da rivelare
Riconoscimenti
Ringraziamo i tecnici di radiologia e il personale infermieristico dell'Area Neuroradiologia, IRCCS Istituto delle Scienze Neurologiche di Bologna, e la loro Coordinatrice Dott.ssa Maria Grazia Crepaldi, per la collaborazione.
Materiali
| Name | Company | Catalog Number | Comments |
| BRAF V600E-specific clone VE1 | Ventana | ||
| Dural Substitute | Biodesign, Cook Medical | ||
| Endoscope | Karl Storz, 4mm in diameter, 18 cm in length, Hopkins II – Karl Storz Endoscopy | ||
| Immunohistochemical staining instrument | Ventana Benchmark, Ventana Medical Systems | ||
| MRI | 3T Magnetom Skyra, Siemens Health Care | ||
| Neuronavigator | Stealth Station S8 Surgical Navigation System, MEDTRONIC |
Riferimenti
- Wang, A. J., Zaidi, H. A., Laws, E. D. History of endonasal skull base surgery. Journal of Neurosurgical Sciences. 60 (4), 441-453 (2016).
- Kassam, A. B., Gardner, P., Snyderman, C., Mintz, A., Carrau, R. Expanded endonasal approach: fully endoscopic, completely transnasal approach to the middle third of the clivus, petrous bone, middle cranial fossa, and infratemporal fossa. Neurosurgical Focus. 19 (1), 6(2005).
- Schwartz, T. H., Morgenstern, P. F., Anand, V. K. Lessons learned in the evolution of endoscopic skull base surgery. Journal of Neurosurgery. 130 (2), 337-346 (2019).
- Cossu, G., et al. Surgical management of craniopharyngiomas in adult patients: a systematic review and consensus statement on behalf of the EANS skull base section. Acta Neurochirurgica. 162 (5), 1159-1177 (2020).
- Komotar, R. J., Starke, R. M., Raper, D. M., Anand, V. K., Schwartz, T. H. Endoscopic endonasal compared with microscopic transsphenoidal and open transcranial resection of craniopharyngiomas. World Neurosurgery. 77 (2), 329-341 (2012).
- Clark, A. J., et al. Endoscopic surgery for tuberculum sellae meningiomas: a systematic review and meta-analysis. Neurosurgical Review. 36 (3), 349-359 (2013).
- Ditzel Filho, L. F., et al. Endoscopic Endonasal Approach for Removal of Tuberculum Sellae Meningiomas. Neurosurgical Clinics of North America. 26 (3), 349(2015).
- Labidi, M., et al. Clivus chordomas: a systematic review and meta-analysis of contemporary surgical management. Journal of Neurosurgical Science. 60 (4), 476-484 (2016).
- Cannizzaro, D., et al. Microsurgical versus endoscopic trans-sphenoidal approaches for clivus chordoma: a pooled and meta-analysis. Neurosurgical Review. , (2020).
- Fujii, T., Platt, A., Zada, G. Endoscopic Endonasal Approaches to the Craniovertebral Junction: A Systematic Review of the Literature. Journal of Neurological Surgery: Part B Skull Base. 76 (6), 480-488 (2015).
- Tubbs, R. S., Demerdash, A., Rizk, E., Chapman, J. R., Oskouian, R. J. Complications of transoral and transnasal odontoidectomy: a comprehensive review. Child's Nervous System. 32 (1), 55-59 (2016).
- Zoli, M., et al. Endoscopic approaches to orbital lesions: case series and systematic literature review. Journal of Neurosurgery. 3, 1(2020).
- Jensterle, M., et al. Advances in the management of craniopharyngioma in children and adults. Radiology and Oncology. 53 (4), 388-396 (2019).
- Roque, A., Odia, Y. BRAF-V600E mutant papillary craniopharyngioma dramatically responds to combination BRAF and MEK inhibitors. CNS Oncology. 6 (2), 95-99 (2017).
- Marucci, G., et al. Targeted BRAF and CTNNB1 next-generation sequencing allows proper classification of nonadenomatous lesions of the sellar region in samples with limiting amounts of lesional cells. Pituitary. 18 (6), 905-911 (2015).
- Silva, M. A., See, A. P., Essayed, W. I., Golby, A. J., Tie, Y. Challenges and techniques for presurgical brain mapping with functional MRI. NeuroImage Clinical. 17, 794-803 (2017).
- Duffau, H. Lessons from brain mapping in surgery for low-grade glioma: insights into associations between tumor and brain plasticity. The Lancet Neurology. 4 (8), 476-486 (2005).
- Maesawa, S., et al. Evaluation of resting state networks in patients with gliomas: connectivity changes in the unaffected side and its relation to cognitive function. PloS One. 10 (2), 0118072(2015).
- Gonen, T., et al. Intra-operative multi-site stimulation: Expanding methodology for cortical brain mapping of language functions. PloS One. 12 (7), 0180740(2017).
- Pillai, J. J. The evolution of clinical functional imaging during the past 2 decades and its current impact on neurosurgical planning. American Journal of Neuroradiology. 31 (2), 219-225 (2010).
- Bizzi, A. Presurgical mapping of verbal language in brain tumors with functional MR imaging and MR tractography. Neuroimaging Clinics of North America. 19 (4), 573-596 (2009).
- Dell'Acqua, F., Tournier, J. D. Modelling white matter with spherical deconvolution: How and why. NMR in Biomedicine. 32 (4), 3945(2019).
- Maier-Hein, K. H., et al. The challenge of mapping the human connectome based on diffusion tractography. Nature Communications. 8 (1), 1349(2017).
- Costabile, J. D., Alaswad, E., D'Souza, S., Thompson, J. A., Ormond, D. R. Current Applications of Diffusion Tensor Imaging and Tractography in Intracranial Tumor Resection. Frontiers in Oncology. 9, 426(2019).
- Jacquesson, T., et al. Full tractography for detecting the position of cranial nerves in preoperative planning for skull base surgery: technical note. Journal of Neurosurgery. , 1-11 (2019).
- Zolal, A., et al. Comparison of probabilistic and deterministic fiber tracking of cranial nerves. Journal of Neurosurgery. 127 (3), 613-621 (2017).
- Ung, N., et al. A Systematic Analysis of the Reliability of Diffusion Tensor Imaging Tractography for Facial Nerve Imaging in Patients with Vestibular Schwannoma. Journal of Neurological Part B Skull Base. 77 (4), 314-318 (2016).
- Anik, I., et al. Visual Outcome of an Endoscopic Endonasal Transsphenoidal Approach in Pituitary Macroadenomas: Quantitative Assessment with Diffusion Tensor Imaging Early and Long-Term Results. World Neurosurgery. 12, 691-701 (2018).
- Oldfield, R. C. The assessment and analysis of handedness: the Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Yushkevich, P. A., et al. User-Guided Segmentation of Multi-modality Medical Imaging Datasets with ITK-SNAP. Neuroinformatics. 17 (1), 83-102 (2019).
- Tournier, J. D., Calamante, F., Connelly, A. Robust determination of the fibre orientation distribution in diffusion MRI: non-negativity constrained super-resolved spherical deconvolution. NeuroImage. 35 (4), 1459-1472 (2007).
- Mormina, E., et al. Optic radiations evaluation in patients affected by high-grade gliomas: a side-by-side constrained spherical deconvolution and diffusion tensor imaging study. Neuroradiology. 58 (11), 1067-1075 (2016).
- Hales, P. W., et al. Delineation of the visual pathway in paediatric optic pathway glioma patients using probabilistic tractography, and correlations with visual acuity. Neuroimage Clinical. 11 (17), 541-548 (2017).
- Testa, C., et al. The effect of diffusion gradient direction number on corticospinal tractography in the human brain: an along-tract analysis. Magma. 30 (3), 265-280 (2017).
- Talozzi, L., et al. Along-tract analysis of the arcuate fasciculus using the Laplacian operator to evaluate different tractography methods. Magnetic Resonance Imaging. 54, 183-193 (2018).
- Zoli, M., et al. Postoperative outcome of body core temperature rhythm and sleep-wake cycle in third ventricle craniopharyngiomas. Neurosurgical Focus. 41 (6), 12(2016).
- Foschi, M., et al. Site and type of craniopharyngiomas impact differently on 24-hour circadian rhythms and surgical outcome. A neurophysiological evaluation. Autonomic Neuroscience. 208, 126-130 (2017).
- Mojón, A., Fernández, J. R., Hermida, R. C. Chronolab: an interactive software package for chronobiologic time series analysis written for the Macintosh computer. Chronobiology International. 9 (6), 403-412 (1992).
- Hardesty, D. A., Montaser, A. S., Beer-Furlan, A., Carrau, R. L., Prevedello, D. M. Limits of endoscopic endonasal surgery for III ventricle craniopharyngiomas. Journal of Neurosurgical Sciences. 62 (3), 310-321 (2018).
- Lee, W. H., et al. Effect of Dexmedetomidine Combined Anesthesia on Motor evoked Potentials During Brain Tumor Surgery. World Neurosurgery. 123, 280-287 (2019).
- Barazi, S. A., et al. Extended endoscopic transplanum-transtuberculum approach for pituitary adenomas. British Journal of Neurosurgery. 27 (3), 374-382 (2013).
- Singh, H., et al. Intraoperative Neurophysiological Monitoring for Endoscopic Endonasal Approaches to the Skull Base: A Technical Guide. Scientifica. , 1751245(2016).
- Mazzatenta, D., et al. Outcome of Endoscopic Endonasal Surgery in Pediatric Craniopharyngiomas. World Neurosurgery. 134, 277-288 (2020).
- Milanese, L., et al. Antibiotic Prophylaxis in Endoscopic Endonasal Pituitary and Skull Base Surgery. World Neurosurgery. 106, 912-918 (2017).
- Hadad, G., et al. A novel reconstructive technique after endoscopic expanded endonasal approaches: vascular pedicle nasoseptal flap. Laryngoscope. 116 (10), 1882-1886 (2006).
- Zoli, M., et al. Cavernous sinus invasion by pituitary adenomas: role of endoscopic endonasal surgery. Journal of Neurosurgical Sciences. 60 (4), 485-494 (2016).
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Coury, J. R., Davis, B. N., Koumas, C. P., Manzano, G. S., Dehdashti, A. R. Histopathological and molecular predictors of growth patterns and recurrence in craniopharyngiomas: a systematic review. Neurosurgical Review. 43 (1), 41-48 (2020).
- Prieto, R., et al. Craniopharyngioma adherence: a comprehensive topographical categorization and outcome-related risk stratification model based on the methodical examination of 500 tumors. Neurosurgical Focus. 41 (6), 13(2016).
- Cagnazzo, F., Zoli, M., Mazzatenta, D., Gompel, J. J. V. Endoscopic and Microscopic Transsphenoidal Surgery of Craniopharyngiomas: A Systematic Review of Surgical Outcomes Over Two Decades. Journal of Neurological Surgery: part A Central European Neurosurgery. 79 (3), 247-256 (2018).
- Cavallo, L. M., et al. The endoscopic endonasal approach for the management of craniopharyngiomas: a series of 103 patients. Journal of Neurosurgery. 121, 100-113 (2014).
- Andersson, J. L., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. Neuroimage. 20 (2), 870-888 (2003).
- Castellano, A., Cirillo, S., Bello, L., Riva, M., Falini, A. Functional MRI for Surgery of Gliomas. Current Treatment Options in Neurology. 19 (10), 34(2017).
- Elowe-Gruau, E., et al. Childhood craniopharyngioma: hypothalamus-sparing surgery decreases the risk of obesity. Journal of Clinical Endocrinology and Metabolism. 98 (6), 2376-2382 (2013).
- Jacquesson, T., et al. Overcoming Challenges of Cranial Nerve Tractography: A Targeted Review. Neurosurgery. 84 (2), 313-325 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon