Method Article
Papel de la tractografía por resonancia magnética de difusión en la cirugía endoscópica endonasal de la base del cráneo
* Estos autores han contribuido por igual
En este artículo
Resumen
Presentamos un protocolo para integrar la tractografía por resonancia magnética de difusión en el trabajo del paciente hasta la cirugía endonasal endoscópica para un tumor de la base del cráneo. Se describen los métodos para adoptar estos estudios de neuroimagen en las fases pre e intraoperatoria.
Resumen
La cirugía endoscópica endonasal ha ganado un papel destacado en el tratamiento de tumores complejos de la base del cráneo. Permite la resección de un gran grupo de lesiones benignas y malignas a través de una vía anatómica extracraneal natural, representada por las cavidades nasales, evitando la retracción cerebral y la manipulación neurovascular. Esto se refleja en la pronta recuperación clínica de los pacientes y el bajo riesgo de secuelas neurológicas permanentes, lo que representa la principal advertencia de la cirugía convencional de la base del cráneo. Esta cirugía debe adaptarse a cada caso concreto, considerando sus características y relación con las estructuras neuronales circundantes, en su mayoría basadas en neuroimámenes preoperatorios. Las técnicas avanzadas de resonancia magnética, como la tractografía, rara vez se han adoptado en la cirugía de la base del cráneo debido a problemas técnicos: procesos largos y complicados para generar reconstrucciones confiables para su inclusión en el sistema de neuronavegación.
Este trabajo tiene como objetivo presentar el protocolo implementado en la institución y destaca la colaboración sinérgica y el trabajo en equipo entre los neurocirujanos y el equipo de neuroimagen (neurólogos, neurorradiólogos, neuropsicólogos, físicos y bioingenieros) con el objetivo final de seleccionar el tratamiento óptimo para cada paciente, mejorar los resultados quirúrgicos y perseguir el avance de la medicina personalizada en este campo.
Introducción
La posibilidad de acercarse a la base del cráneo de la línea media y las regiones paramedianas a través de una vía anterior, adoptando las fosas nasales como cavidades naturales, tiene una larga historia, que se remonta a más de un siglo1. Sin embargo, en los últimos 20 años, las tecnologías de visualización y operación han mejorado lo suficiente como para ampliar su posibilidad de incluir el tratamiento de los tumores más complejos como meningiomas, cordomas, condrosarcomas y craneofaringiomas1 debido a la (1) introducción del endoscopio, que proporciona una vista panorámica y detallada 2D / 3D de estas regiones al cirujano, (2) el desarrollo de sistemas de neuronavegación intraoperatoria, y (3) la implementación de instrumentos quirúrgicos dedicados. Como lo demostraron minuciosamente Kassam et al. y lo confirmaron múltiples revisiones y metanálisis, las ventajas de este enfoque quirúrgico están representadas principalmente por sus posibilidades de resecar tumores de la base del cráneo desafiantes, evitando cualquier retracción cerebral directa o manipulación nerviosa, reduciendo así el riesgo de complicaciones quirúrgicas y secuelas neurológicas y visuales a largo plazo2,3,4, 5,6,7,8,9,10,11,12.
Para múltiples tumores de base de cráneo y diencefálicos hipofisarios, el objetivo quirúrgico ideal ha cambiado en los últimos años de la extirpación tumoral más extensa posible a la extirpación más segura con preservación de las funciones neurológicas para preservar la calidad de vida del paciente3. Esta limitación podría compensarse con tratamientos adyuvantes innovadores y eficaces, como la radioterapia (adoptando partículas masivas como iones de protones o carbono cuando proceda) y, para neoplasias seleccionadas, mediante quimioterapia como inhibidores de la vía BRAF/MEK para los craneofaringiomas13,14,15.
Sin embargo, para perseguir estos objetivos, es crucial una cuidadosa evaluación preoperatoria, para adaptar la estrategia quirúrgica a la característica específica de cada caso2. En la mayoría de los centros, el protocolo preoperatorio de RM se suele realizar solo con secuencias estructurales estándar, que proporcionan la caracterización morfológica de la lesión. Sin embargo, con estas técnicas no siempre es posible evaluar de forma fiable la relación anatómica del tumor con las estructuras adyacentes3. Además, cada paciente puede presentar diferentes perfiles de reorganización funcional inducidos por patología detectables solo con tractografía por resonancia magnética de difusión y resonancia magnética funcional (fMRI), que pueden utilizarse para proporcionar orientación tanto en la planificación de la cirugía como en los pasos intraoperatorios16,17.
Actualmente, la resonancia magnética funcional es la modalidad de neuroimagen más utilizada para mapear la actividad funcional cerebral y la conectividad, como guía para la planificación quirúrgica18,19 y para mejorar el resultado de los pacientes20. La resonancia magnética funcional basada en tareas es la modalidad de elección para identificar regiones cerebrales "elocuentes" que están funcionalmente involucradas en el desempeño de tareas específicas (por ejemplo, golpeteos con los dedos, fluidez fonémica), pero no es aplicable para el estudio de tumores de la base del cráneo.
La tractografía por resonancia magnética de difusión permite la reconstrucción in vivo y no invasiva de las conexiones cerebrales de la materia blanca, así como de los nervios craneales, investigando la estructura hodológica del cerebro21. Se han desarrollado diferentes algoritmos de tractografía para reconstruir las vías axonales mediante la vinculación de perfiles de difusividad de moléculas de agua, evaluados dentro de cada vóxel cerebral. La tractografía determinista sigue la dirección de la difusividad dominante, mientras que la tractografía probabilística evalúa la distribución de conectividad de las posibles vías. Adicionalmente, se pueden aplicar diferentes modelos para evaluar la difusividad dentro de cada vóxel, y es posible definir dos categorías principales: modelos de fibra única, como el modelo de tensor de difusión, donde se evalúa una orientación de fibra única, y modelos de fibra múltiple, como la deconvolución esférica, donde se reconstruyen varias orientaciones de fibra cruzada22,23. A pesar del debate metodológico sobre la tractografía por resonancia magnética de difusión, actualmente se ha establecido su utilidad en el flujo de trabajo neuroquirúrgico. Es posible evaluar la dislocación del tracto de la materia blanca y la distancia al tumor, preservando las conexiones específicas de la materia blanca. Además, se pueden aplicar mapas de imágenes de tensor de difusión (DTI), especialmente la anisotropía fraccional (FA) y la difusividad media (DM), para evaluar las alteraciones microestructurales de la materia blanca relacionadas con la posible infiltración tumoral y para la monitorización longitudinal del tracto. Todas estas características hacen de la tractografía por resonancia magnética por difusión una potente herramienta tanto para la planificación prequirúrgica como para la toma de decisiones intraoperatorias a través de sistemas de neuronavegación24.
Sin embargo, la aplicación de las técnicas de tractografía a la cirugía de la base del cráneo se ha visto limitada por la necesidad de conocimientos técnicos especializados y el trabajo lento para optimizar la adquisición de la secuencia de resonancia magnética de difusión, el protocolo de análisis y la incorporación de resultados de la tractografía en los sistemas de neuronavegación25. Finalmente, otras limitaciones se deben a las dificultades técnicas para extender estos análisis desde las estructuras intraparenquimatosas hasta las extraparenquimatosas de la materia blanca, como los nervios craneales. De hecho, solo estudios recientes presentaron resultados preliminares que intentaron integrar la resonancia magnética avanzada y la cirugía de la base del cráneo26,27,28.
El presente trabajo presenta un protocolo para el manejo multidisciplinario de tumores hipofisario-diencefálicos y de la base del cráneo mediante tractografía por resonancia magnética de difusión. La implementación de este protocolo en la institución fue el resultado de la colaboración entre neurocirujanos, neuroendocrinólogos y el equipo de neuroimagen (incluyendo experiencia clínica y bioinformática) para ofrecer un enfoque multiaxial integrado efectivo a estos pacientes.
En el centro, hemos integrado protocolos multidisciplinarios para el manejo de pacientes con tumores de la base del cráneo, para proporcionar la descripción más informativa posible, y para adaptar y personalizar el plan quirúrgico. Demostramos que este protocolo puede ser adoptado tanto en el ámbito clínico como en el de investigación para cualquier paciente con tumor de base craneal para guiar la estrategia de tratamiento y mejorar el conocimiento sobre las modificaciones cerebrales inducidas por estas lesiones.
Protocolo
El protocolo sigue los estándares éticos del Comité Local de Investigación y con la declaración de Helsinki de 1964 y sus enmiendas posteriores o estándares éticos comparables.
1. Selección de los pacientes
- Adoptar los siguientes criterios de inclusión: pacientes mayores de 18 años, plenamente colaboradores, que presenten un tumor de la base del cráneo, o región hipofisario-diencefálica.
- Excluir a los pacientes con contraindicación para la resonancia magnética (es decir, un marcapasos o material ferromagnético) o que presenten condiciones clínicas emergentes (es decir, hipertensión intracraneal, la pérdida visual aguda que requiere cirugía inmediata), o mujeres embarazadas, o pacientes con enfermedades mentales, o aquellos que se nieguen explícitamente a participar en este protocolo.
2. Preparación para el examen de resonancia magnética
- Antes del examen de resonancia magnética, administre el formulario de seguridad para excluir la contraindicación significativa para el examen y la inyección de agente de contraste: sin materiales ferromagnéticos en el cuerpo, evaluación de dispositivos de resonancia magnética, seguro o condicional, sin marcapasos, sin lentes de contacto para los ojos.
- Si el escáner utilizado para la adquisición de la resonancia magnética es un campo alto (por ejemplo, 3 T, consulte la Tabla de materiales),considere cualquier posible contraindicación adicional relacionada, por ejemplo, con dispositivos de neuroestimulación.
- Compruebe si el paciente tiene claustrofobia.
- Asegúrese de que el paciente haya leído y firmado el formulario de consentimiento de resonancia magnética para reconocer los riesgos y beneficios del examen por imágenes.
- Haga que un neuropsicólogo realice una evaluación general y una evaluación neurocognitiva dirigida basada en la ubicación del tumor.
- Administrar el inventario de Edimburgo para evaluar el dominio de la mano29.
3. Posicionamiento del paciente en el escáner
- Dé tapones para los oídos al paciente para reducir el ruido de la resonancia magnética.
- Los movimientos de la cabeza pueden afectar la calidad de las imágenes; por lo tanto, use almohadillas de espuma para reducir los movimientos de la cabeza, inmovilizando la cabeza dentro de la bobina de resonancia magnética.
- Proporcione un botón de alarma de emergencia al paciente en caso de necesidad de interrumpir el examen.
- Encienda la cámara y el micrófono dentro del escáner para monitorear, hablar y escuchar al paciente desde la sala de adquisición de resonancia magnética fuera del escáner.
4. Ajuste del protocolo de resonancia magnética cerebral y parámetros de adquisición
- Adquirir un escáner de campo alto con protocolo de resonancia magnética multimodal estandarizado (1,5 T o 3T). Los siguientes parámetros de secuencia se refieren a una resonancia magnética de 3 T, utilizando una bobina de matriz de alta densidad de cabeza-cuello (64 canales).
- Adquirir secuencias anatómicas volumétricas y de alta resolución: administración de agente de contraste pre y post-gadolinio ponderada por T1 y ponderada por FLAIR T2.
- Para las imágenes ponderadas T1 y T2 adquieren cortes sagitales continuos que proporcionan una resolución isotrópica de 1x1x1 mm3 tiempo de escaneo de aproximadamente 5 min por secuencia.
- Adquirir una secuencia ponderada en T2 de alta resolución y localizar el área tumoral para la visualización del nervio craneal: un CISS volumétrico (Interferencia Constructiva en Estado Estacionario) con dimensión de vóxel de 0.5x0.5x0.5 mm3 (tiempo de escaneo de aproximadamente 9 minutos).
- Adquirir secuencias ponderadas por difusión utilizando imágenes eco-planas (EPI) de un solo disparo, dimensión de vóxel de 2x2x2 mm3,64 direcciones de gradiente magnético con valor b de 2000 s/mm2,tiempo de eco de 98 ms y tiempo de relajación de 4300 ms.
- Adquiera cinco volúmenes con valor b nulo al comienzo de la adquisición ponderada por difusión con la dirección de codificación de fase establecida en anterior-posterior (para imágenes ponderadas por difusión tiempo total de escaneo de 5 minutos).
- Adicionalmente, adquirir tres volúmenes con valor b nulo pero dirección de codificación de fase invertida, posterior-anterior, para corregir las distorsiones de imagen debidas a la adquisición de EPI (tiempo de escaneo de 42 segundos). Se adquieren rodajas continuas casi axiales.
- Adquirir secuencias adicionales para investigar características específicas del tumor, como la espectroscopia de resonancia magnética de vóxel múltiple o único localizada en el área del tumor.
NOTA: La duración total del tiempo de escaneo es de aproximadamente 30 minutos, excluyendo la preparación del paciente para el examen de resonancia magnética.
5. Preprocesamiento de imágenes de RESONANCIA cerebral
- Convierta los datos de resonancia magnética del formato de imagen adoptado por las consolas de adquisición de resonancia magnética, DICOM (.dcm), al formato NIFTI (.nii) utilizado en los análisis avanzados de imágenes.
- Ejecute la función dcm2niix (https://github.com/rordenlab/dcm2niix). Establezca como archivos de entrada imágenes dicom y como salida los archivos .nii correspondientes: T1.nii, Flair.nii, T1_contrast.nii, DTI_b2000.nii y DTI_b0_flip.nii.
- Instale el software FSL (https://fsl.fmrib.ox.ac.uk/fsl/fslwiki) y MRtrix3 (https://www.mrtrix.org) necesario para los análisis avanzados de imágenes.
- Registre Flair.nii y T1_contrast.nii en la imagen T1.nii ejecutando la función FSL-flirt, que realiza un registro de imagen lineal.
- Registre la imagen DTI_b2000.nii en T1.nii ejecutando la función FSL-epi_reg, que tiene en cuenta los artefactos de distorsión de imágenes EPI.
- Ejecute la función FSL-topup para corregir los artefactos de dirección de codificación de fase que presentan la imagen DTI_b2000.nii. Establezca la adquisición de codificación de fase inversa DTI_b0_flip.nii como el archivo de entrada "in_main".
- Ejecute la función MRtrix3-dwidenoise para la eliminación de ruido de imágenes con un componente principal de modelado de ruido.
- Para corregir la corriente de Foucault y el artefacto de caída de señal, ejecute la función FSL-eddy, y para las inhomogeneidades de señal inducidas por la bobina de resonancia magnética, la función correcta MRtrix3-dwibias.
- Ejecute la función FSL-bet para eliminar la señal del cuero cabelludo que presenta la imagen T1.nii y cambie el nombre del archivo de salida utilizando el sufijo "_brain": T1_brain.nii.
6. Segmentación tumoral
- Instale el software itk-snap (http://www.itksnap.org) 30.
- Una vez instalado el software itk-snap, presione Archivo - Abrir imagen principal y seleccione la imagen T1.nii, luego presione Archivo - Agregar otro imager y cargue las imágenes Flair.nii y T1_contrast.nii, configurando la opción de superposición semitransparente.
- Inspeccione el tumor en las imágenes T1.nii, Flair.nii y T1_contrast.nii. Elija el plano anatómico a seguir al dibujar la lesión, por ejemplo, axial.
- Coloque el puntero en un segmento axial para comenzar. En la barra de herramientas principal,seleccione el icono Inspector de polígonos y comience a dibujar los límites del tumor utilizando el estilo de dibujo a mano alzada - Curva suave o Polígono.
- Una vez terminado de dibujar el perímetro del tumor, cierre la curva que une el primer y el último punto, pulse Aceptary continúe dibujando en el siguiente segmento. Para lesiones tumorales grandes, para acelerar el proceso de dibujo, omita algunas rodajas axiales (por ejemplo, tres) y dibuje el perímetro de la lesión en rodajas intercaladas.
- Al final del dibujo del perímetro de la lesión, seleccione Herramientas - Interpolar etiquetas, establezca la etiqueta en/con interpolar como la lesión tumoral e Interpolar a lo largo de un solo eje según la orientación del eje seguida al dibujar los límites del tumor.
- Seleccione Segmentación - Guardar imagen de segmentación y asigne a la segmentación del tumor el nombre Tumor_mask.nii seleccionando la opción de formato Nifti para guardar.
7. Análisis de la tractografía
- Ejecute la función FSL-dtifit para modelar la difusividad y las diferentes direcciones espaciales y obtener los siguientes mapas tensoriales de difusión: FA.nii, MD.nii y V1.nii. Evalúe estos mapas DTI para acceder a valores de difusividad anormales que pueden ocurrir en presencia de edema o infiltración tumoral.
- Ejecute la función MRtrix3-tckgen con la configuración predeterminada "ifod2" para realizar una tractografía probabilística y reconstruir las vías de la materia blanca modelando los problemas de fibras cruzadas31.
- Adoptar un enfoque de objetivo semilla estableciendo las opciones "-seed_image" y "-incluir" basadas en el conocimiento anatómico a priori.
- Dibuje manualmente las regiones de interés (ROI) establecidas como semilla u objetivo para la tractografía. Alternativamente, utilice ROI basados en atlas. Véase Mormina et al. 32 para la tractografía de radiación óptica, Hales et al.33 para el quiasma óptico y los nervios craneales ópticos, y Testa et al.34 para los tractos piramidales.
- Inicie el visor de imágenes FSL-fsleyes, seleccione Abriry elija las imágenes que desea inspeccionar visualmente.
- En el visor FSL- fsleyes, vaya a Configuración - Ortho View 1 y active la herramienta Modo de edición.
- Haga clic en el icono del lápiz FSL-fsleyes y dibuje los ROI de la tractografía.
- Instale el software Freesurfer (https://surfer.nmr.mgh.harvard.edu).
- Ejecute la función Freesurfer-Recon-all en la imagen T1.nii para obtener la segmentación automática de la región cortical que se utilizará como ROI de tractografía.
- Ejecute la función FSL-epi_regregistration, configurando como imagen de entrada el T1.nii, y haga referencia a la imagen DTI_b2000.nii, guarde la matriz de salida de registro (T1_onto_DTI.mat).
- Utilice la matriz T1_onto_DTI.mat obtenida para registrar los ROI segmentados en la imagen DTI_b2000.nii.
- Ejecute la tractografía utilizando la función MRtrix3-tckgen.
- Ejecute la función MRtrix3-tckmap para convertir la salida de la tractografía optimizada ".tck" en la imagen "-template FA.nii".
- Ejecute la función FSL-flirt para registrar linealmente la imagen T1.nii en la plantilla MNI152_T1_2mm_brain.nii.
- Guarde la matriz de salida como T1_onto_MNI.mat. Ejecute la función FSL-convert_xfm configurando la opción "-concat" como T1_onto_MNI.mat y T1_onto_DTI.mat, guarde la matriz de salida como DTI_onto_MNI.mat.
8. Tractografía: análisis a lo largo del tracto
- Para obtener una descripción precisa de los parámetros DTI, utilice algoritmos a lo largo del tracto, como el algoritmo basado en Matlab que modela la geometría del tracto superficial con las propiedades del operador laplaciano35.
- Instale el software de Matlab (https://matlab.mathworks.com) y solicite el código a lo largo del tratado a los autores en desarrollo35.
- Alternativamente, utilice la función MRtrix3-tcksample para el análisis a lo largo del tracto, ya que Matlab requiere una licencia.
9.3D renderizado
- Instale el software Surf Ice (https://www.nitrc.org/plugins/mwiki/index.php/surfice:MainPage).
- En el panel de comandos de Surf Ice, haga clic en Avanzado - Convertir voxelwise a malla,seleccione la imagen nifti para convertir, guarde el archivo .obj resultante.
- En el panel de comandos de Surf Ice, haga clic en Archivo - Abriry seleccione el archivo .obj para visualizar la representación del volumen 3D.
10. Exámenes clínicos preoperatorios
- Realizar una evaluación endocrinológica bio-humoral, que consiste en pruebas de prolactina, TSH, freeT4, ACTH, cortisol, GH, LH, FSH y sérica de testosterona total/estradiol, respectivamente en hombres y mujeres.
- Analizar el volumen de orina de 24 horas y los niveles de osmolalidad y sodio en suero y orina para determinar la presencia de diabetes insípida.
- Realizar una evaluación oftalmológica, que incluye medición de la agudeza visual, evaluación computarizada del campo visual y tomografía de coherencia óptica de la retina (OCT).
- Realizar un examen físico neurológico, con una colección de información anamnésica sobre el aumento de peso, la sensación de hambre, el monitoreo continuo de la temperatura rectal cada 2 minutos durante 24 h utilizando un dispositivo portátil para evaluar el ritmo de temperatura circadiana y el registro del ciclo de sueño-vigilia de 24 horas (incluido un electroencefalograma, electrooculograma derecho e izquierdo, electrocardiograma y electromiograma de los músculos tibiales milohioides e izquierdo y derecho)36, 37,38.
11. Planificación quirúrgica
- Discutir en una reunión de equipo colegiado a cada paciente candidato a cirugía, en función de los resultados de la segmentación tumoral y la relación con las estructuras neuronales elocuentes funcionales (nervios ópticos y quiasma, tallo hipofisario, tercer ventrículo, arteria carótida interna, complejo arteria comunicante anterior-arteria cerebral anterior (ACA-ACoA), arteria basilar, nervios craneales III, IV, VI, cuerpos mamilares, tractos de materia blanca, y áreas corticales funcionales) para determinar el abordaje quirúrgico más adecuado.
- Seleccionar el corredor quirúrgico con el mínimo riesgo de lesiones de estructuras neuronales39.
- Definir el área de resección segura para cada caso, localizando la estructura neural crítica (como quiasma, cuerpo mamilar) bajo cuya proximidad se debe detener la resección para evitar daños permanentes39.
- Fusione las secuencias de resonancia magnética más relevantes e impórtelas al sistema de neuronavegación de la fase operatoria.
12. Preparación quirúrgica
- Inducir la anestesia general adoptando anestesia intravenosa total con propofol y remifentanilo (se ha demostrado que los otros agentes anestésicos se encuentran entre los factores más críticos que afectan la fiabilidad de la monitorización intraoperatoria, aumentando la tasa de falsos negativos), evitando el miorelaxante40.
- Realizar intubación oro-traqueal con gasas en la orofaringe para evitar fugas de sangre o líquido en el estómago o las vías respiratorias41.
- Establecer la monitorización neurofisiológica, con registro continuo de potenciales evocados motores (MEPs) y potenciales evocados somatosensoriales (SEPs) y electromiografía de funcionamiento libre (EMG) para nervios craneales42.
- Importar los datos de resonancia magnética, incluidas las reconstrucciones de la tractografía, en el sistema de neuronavegación (Tabla de Materiales).
- Seleccione la modalidad de registro electromagnético de cirugía cerebral en el sistema de neuronavegación.
- Registrar el sistema de neuronavegación en el paciente, adoptando una técnica de seguimiento libre o marcadores externos.
- Controlar la precisión del registro logrado, verificando la posición de los marcadores externos (es decir, oído o nariz) en la resonancia magnética importada; si el resultado no es aceptable, repita el registro.
- Coloque al paciente en una posición semi-sentada; El uso de Mayfield para arreglar la cabeza no es necesario43.
- Administrar corticosteroides (flebocortida endovenoso, dosis dependiendo del peso del paciente) y antibióticos (2 g de ácido amoxicilina-clavulánico)44.
13. Cirugía endoscópica endonasal
- Comience con un endoscopio de 0°(Tabla de materiales).
- Cosecha el colgajo naso-septal45.
- Realizar una esfenoidotomía anterior, seguida de septostomía posterior y etmoidectomía con preservación del cornete medio, cuando sea posible43.
- Abra el hueso selar y tuberculoso41.
- Incise la capa dura con forma de H, después de la coagulación del seno intercavernoso superior41.
- Escindir el tumor por el plano aracnoideo43.
- Citocito central del tumor43.
- Extraer su cápsula de las estructuras neuronales diencefálicas circundantes, deteniendo la resección en caso de adhesión tumoral a estructuras elocuentes visualizadas bajo guía de neuronavegación43.
- Explorar la cavidad quirúrgica con óptica en ángulo (Tabla de Materiales)46.
- Asegurar la hemostasia con coagulación bipolar o agentes hemostáticos.
- Cierre la abertura osteo-meningeal con una capa intracraneal intradural de sustituto dural43.
- Colocar una capa intracraneal extradural de sustituto dural, andamiada con grasa abdominal y eventualmente hueso (Tabla de Materiales)43.
- Cubra el cierre con el colgajo naso-septal43.
14. Examen histológico
- Fije muestras de tumores con formalina al 10% e incruste en parafina inmediatamente después de la cirugía.
- Cortar el tejido en secciones de 4 μm de espesor y teñir con hematoxilina y eosina. El diagnóstico histológico debe basarse en la versión más reciente de la clasificación oms de tumores cerebrales (2016)47.
- Realizar tinción inmunohistoquímica de muestras mediante un instrumento automatizado de tinción inmunohistoquímica, utilizando el etiquetado avidin-biotin y diaminobenzidina como reactivo de detección. Para los craneofaringiomas, adopte anticuerpos anti-beta-catenina, anti-BRAF v600E mutante y anticuerpos anti-Ki67 para la tinción inmunohistoquímica (Tabla de Materiales).
- Evaluar el índice Ki-67 mediante el recuento manual de células tumorales positivas48.
15. Manejo postquirúrgico del paciente
- Despierte al paciente inmediatamente después de la cirugía.
- Restaure la respiración espontánea de la boca llenando las cavidades nasales con material absorbible y no absorbible.
- Monitoree los parámetros vitales (presión arterial, frecuencia cardíaca, saturación de oxígeno y estado de conciencia) durante las siguientes 6-12 horas en la UCI.
- Restaure la alimentación oral después de 12 horas.
- Realice una tomografía computarizada después de 6-9 horas.
- Mantenga reposo en cama durante tres días con tratamiento con heparina.
- Controle el equilibrio de líquidos cada 12 horas y evalúe los electrolitos séricos cada 24 horas.
- Administrar terapia con corticosteroides (flebocortida endovenoso en las primeras 24 horas, y luego acetato de cortona oral 30 + 15 mg / día).
- Realice una resonancia magnética con / sin gadolinio dentro de las 72 horas posteriores a la cirugía.
- Dar de alta al paciente eldía 4.
16. Seguimiento temprano
- Repetir la evaluación endocrinológica completa 30 días después de la cirugía43.
- Repetir la valoración oftalmológica tres meses después de la cirugía43.
- Repetir el examen físico neurológico y las investigaciones de la función de temperatura y ritmos sueño-vigilia tres meses después de la cirugía46.
- Realizar la resonancia magnética con/sin gadolinio tres meses después de la cirugía46.
17. Terapia adyuvante
- Evaluar la presencia de progresión tumoral precoz, y si está indicado, derivar al paciente a radioterapia43.
18. Seguimiento a largo plazo
- Repetir anualmente las evaluaciones clínicas, endocrinológicas y oftalmológicas43.
- Realizar resonancia magnética anual con/sin gadolinio: en caso de recurrencia, el paciente puede ser re-operado y luego referido a radioterapia o directamente referido a radioterapia43.
Resultados
Mujer de 55 años que presentaba déficits visuales progresivos. Su historial médico no era notable. En la evaluación oftalmológica, se reveló una reducción bilateral de la agudeza visual (6/10 en el ojo derecho y 8/10 en el ojo izquierdo), y el campo visual computarizado mostró hemianopia bitemporal completa. No se evidenciaron más déficits en el examen neurológico, pero el paciente informó astenia persistente y un aumento de la sensación de hambre y sed en los 2-3 meses anteriores, con un aumento de peso de 4-5 kg y despertares frecuentes en la noche por la necesidad de orinar. En la evaluación endocrinológica, se reveló hipercorticismo central y diabetes insípida. El paciente fue tratado con corticoides (hidrocortisona 30+15 mg/día y desmopresina 30+30 μg/día). En el ciclo de sueño-vigilia de 24 h y el monitoreo de la temperatura, no se notaron alteraciones significativas después de la optimización de la terapia sustitutiva hormonal.
La resonancia magnética cerebral demostró un tumor supraselar que ocupa la cisterna opto-quiasmática e invade el 3er ventrículo, con una morfología poliquística irregular, potenciando después del gadolinio, sospechada como la primera hipótesis para un craneofaringioma(Figura 1A-C). Se realizaron análisis avanzados de imágenes, como se ilustra en el protocolo actual. La segmentación del núcleo tumoral destacó la captación de gadolinio y correspondió a un volumen de 7,92 cm3 (Figura 1D-E).
Las vías visuales fueron las más críticas a evaluar en la planificación prequirúrgica de este paciente. Los tractos piramidales también se reconstruyeron para evaluar el correlato microestructural del aumento de señal detectado en la imagen ponderada FLAIR T2 a nivel del tracto derecho.
Se investigó la reconstrucción de la tractografía de la vía óptica, particularmente la dislocación del quiasma óptico en presencia de la masa tumoral. También se reconstruyeron los nervios craneales ópticos bilaterales. En la interfaz entre el cerebro, los huesos y los vasos sanguíneos, los artefactos de susceptibilidad no permitieron la reconstrucción completa de las fibras que conectan el quiasma óptico con los nervios ópticos(Figura 2).
El perfil de difusividad de los tractos piramidales se investigó con estadísticas de mapas DTI a lo largo del tracto. A nivel del miembro posterior derecho de la cápsula interna, se presentó una hiperintensidad focal ponderada por FLAIR T2, correspondiente a un aumento del 5% de la medida de DM derecha(5º-7º segmentos) en comparación con el lado izquierdo(Figura 3).
Al considerar tales relaciones entre el tumor y las estructuras neurales, se eligió el abordaje endoscópico de trasplante extendido/transtuberculo36. La extirpación del tumor se realizó con una técnica microquirúrgica a dos manos. Inicialmente, el tumor fue desencabulado centralmente, drenando también su componente quístico (Figura 4). Posteriormente, fue posible separar progresivamente el craneofaringioma de las estructuras neurales, adoptando el aracnoideo como plano de escisión(Figura 5). Al final de la cirugía, se logró la extirpación completa del tumor con la preservación anatómica del hipotálamo (Figura 6). La reparación del defecto osteo-dural se realizó con grasa abdominal y colgajo naso-septal (Figura 7).
El curso postoperatorio fue sin incidentes, y el paciente fue dado de alta después de cuatro días en las condiciones clínicas adecuadas. El tumor resultó ser un craneofaringioma adamantinomatoso (grado 1 de la OMS) en el examen histológico.
El paciente desarrolló panhipopituitarismo completo en el seguimiento y estaba bajo terapia de sustitución completa con hidrocortisona, desmopresina y levotiroxina. Los déficits visuales retrocedieron por completo, y no se detectaron alteraciones en el examen neurológico, el ciclo de sueño-vigilia de 24 horas y el monitoreo de la temperatura. Tres meses de resonancia magnética cerebral demostraron una extirpación completa del tumor, sin remanente ni recurrencia. Por lo tanto, no se aconsejó ningún tratamiento adyuvante, y el paciente es seguido con exámenes clínicos y neurorradológicos anuales (Figura 8).

Figura 1. Secuencias anatómicas preoperatorias de RM (F/55 años). Vista axial de T1 ponderado (A) y FLAIR T2 ponderado (B); axial (C, D) y sagital (E) T1- después de la administración de gadolinio (0,1 mm/kg). La segmentación tumoral (roja) superpuesta a la imagen ponderada en T1 mejorada con gadolinio se muestra en D y E. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Representación 3D preoperatoria de la tractografía de las vías ópticas y la segmentación tumoral. (A) La rebanada axial de la imagen ponderada flair T2 superpone la tractografía de quiasma óptico, localizada anteriormente al tumor. (B) Representación 3D de volumen de la imagen ponderada FLAIR T2, seleccionando un plano axial y superponiendo la tractografía de las vías ópticas. (C) Representación 3D del volumen de la superficie del cerebro, tractografía de vías ópticas y segmentación tumoral en rojo. Todas las líneas de la tractografía de los paneles están coloreadas por el mapa de color de direccionalidad RGB (rojo: lateral-lateral, verde: anterior-posterior y azul: inferior-superior). Haga clic aquí para ver una versión más grande de esta figura.
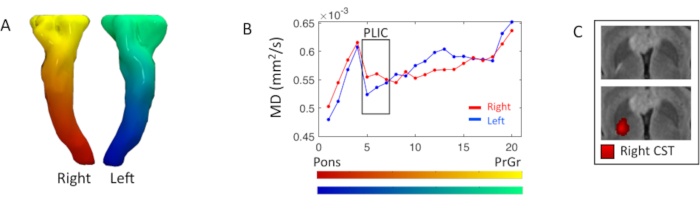
Figura 3. Análisis piramidal de la medida DTI a lo largo del tracto. (A) Representación 3D de los tractos piramidales bilaterales o tracto corticoespinal (CST), coloreado en base al gradiente de segmentación inferior-superior laplaciano. (B) Los perfiles CST de CST derecho (rojo) e izquierdo (azul) significan difusividad (MD) resultantes de la partición del tracto en veinte segmentos mostrados en los mapas de color en A; los segmentos comienzan a nivel de la protuberancia hacia el giro precentral (PrCr). La caja negra resalta los segmentos en la extremidad posterior de la cápsula interna (PLIC)(5º-7º). (C) Vista axial de la imagen ponderada FLAIR T2 en el nivel PLIC, con y sin el mapa de conectividad CST correcto, donde una intensidad roja más brillante corresponde a una mayor densidad aerodinámica. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Imágenes endoscópicas intraoperatorias. (A) 0° alcance, después de la apertura dural, el tumor fue inicialmente desprendido por el quiasma, adoptando el aracnoideo como plano de escisión. (B) y (C), después, se desbulkó centralmente, y el quiste se drenó progresivamente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5. Imágenes endoscópicas intraoperatorias. (A) 0° alcance, el craneofaringioma es escindido por el plano aracnoideo con la ayuda de la neuronavegación, mostrando el tumor y las estructuras neuronales (identificadas según nuestro protocolo actual). Por lo tanto, los cuerpos mamilares se pueden salvar para evitar daños hipotalámicos permanentes. (B) y (C) después, fue posible resecar el tumor por las superficies hipotalámicas mediales, evitando cualquier tracción para no dañar dicha estructura neural. (D) Durante la extirpación de la porción intraventricular del tumor, se prestó especial atención a la reapertura del acueducto cerebral y los forámenes monro para evitar la hidrocefalia aguda postoperatoria. Haga clic aquí para ver una versión más grande de esta figura.
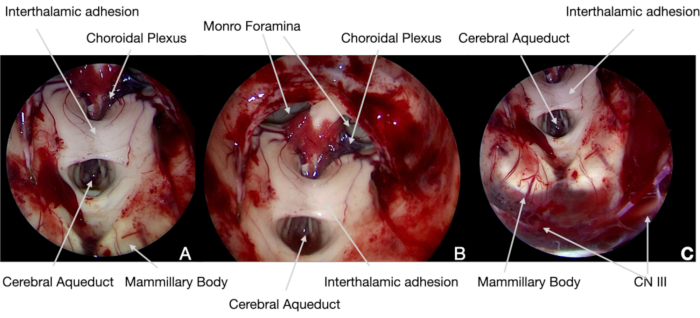
Figura 6. Imágenes endoscópicas intraoperatorias. (A) y (B) 30° alcance, al final de la cirugía, la estructura neural del3er ventrículo ha sido explorada con óptica en ángulo para confirmar la extirpación completa del tumor y demostrar su integridad anatómica. (C) En el fondo del campo quirúrgico, fue posible identificar el CN III, bajo la membrana de Liliequist: su función, ya que los EURODI, los SEP y otros CN, había sido controlada continuamente con monitoreo neurofisiológico intraoperatorio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7. Imágenes endoscópicas intraoperatorias. (A) 0° alcance, el cierre del defecto osteo-dural requiere una técnica multicapa, adoptando sustituto dural, grasa abdominal, eventualmente hueso y colgajo naso-septal. La primera capa está constituida por el posicionamiento intracraneal intradural de la primera capa de un sustituto dural. (B) El siguiente paso está representado por la colocación de grasa abdominal para llenar la cavidad quirúrgica; se debe prestar especial atención para evitar el sobreembalaje. (C) Se adopta la segunda capa de sustituto dural para cubrir la grasa, y se puede mantener en posición gracias a un andamio rígido, como un trozo de hueso o cartílago (técnica de sellado de juntas). (D) Finalmente, se utiliza el colgajo naso-septal o un injerto libre de tabique o cornete medio para cubrir el cierre multicapa. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8. RM, vista sagital ponderada en T1 después de la administración de gadolinio (0,1 mm/kg). (A) La resonancia magnética preoperatoria demuestra el tumor. (B) Postoperatoriamente, la extirpación completa del tumor con la preservación anatómica de los cuerpos mamilares y las estructuras hipotalámicas son visibles. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La aplicación del protocolo presentado resultó en un tratamiento seguro y efectivo de uno de los tumores intracraneales más desafiantes, como un craneofaringioma que invade el3er ventrículo, posiblemente abriendo un nuevo horizonte para una lesión que fue definida por H. Cushing hace aproximadamente un siglo como la neoplasia intracraneal más desconcertante1. La combinación de una planificación preoperatoria precisa, la integración de técnicas avanzadas de resonancia magnética y evaluaciones clínicas multidisciplinares nos han permitido adaptar la estrategia quirúrgica, identificando el corredor quirúrgico más adecuado y minimizando el riesgo de daño a la estructura neural2,49,50,51. A diferencia de otros protocolos de resonancia magnética reportados en la literatura, la inclusión de secuencias rápidas, como las exploraciones de codificación inversa de fase para imágenes ponderadas por difusión, permite correcciones avanzadas de post-procesamiento52. Este procedimiento siempre debe adoptarse, especialmente en un campo de alta intensidad (por ejemplo, 3 T o superior) donde hay distorsiones de imagen presentes.
Además, el uso de un enfoque de tractografía probabilística basado en la deconvolución esférica restringida permitió un aumento en la calidad de la reconstrucción de la fibra en comparación con otros modelos de tractografía determinista53. Además, la representación 3D propuesta y los análisis cuantitativos aumentaron la precisión de la evaluación preoperatoria del paciente. Este estudio de neuroimagen, junto con el seguimiento neurofisiológico, representó una guía para el cirujano, ayudándole a decidir si y dónde detener la resección quirúrgica con el objetivo final de evitar los déficits neurológicos permanentes de los pacientes.
De hecho, la resección tumoral más agresiva para craneofaringiomas ha sido recientemente abandonada progresivamente en favor de una técnica hipotalámica-ahorradora, consistente en detener el tumor extirpado ante cualquier daño neural permanente54. Sin embargo, en la práctica clínica estándar, a menudo es complicado para el neurocirujano decidir cuándo detener la extirpación del tumor para lograr la resección máxima segura, exponiendo al paciente al riesgo, por un lado, de dejar un remanente tumoral más grande de lo planeado o, por otro lado, de inducir una lesión hipotalámica permanente, con el consiguiente detrimento de la calidad de vida.
El protocolo presentado ha proporcionado un modelo de integración de datos clínicos y neurorradiológicos con la intención de proporcionar un método práctico y fácil de adoptar para el tratamiento de los tumores hipofisario-diencefálicos y de la base del cráneo. Sin embargo, subrayamos que presenta algunos puntos críticos: la necesidad de un equipo adecuado, como un imán de alto campo (3 T), una bobina de canal de alta resolución y un software avanzado de imágenes de pre /procesamiento.
Las secuencias de resonancia magnética en el protocolo presentado también son adquiribles a 1,5 T, pero los parámetros de adquisición informados en el Paso 4 deben modificarse para lograr una buena relación señal-ruido: para las secuencias ponderadas por difusión, se sugiere un valor b más bajo (por ejemplo, 1000 s / mm2). Además, la implementación de los análisis de neuroimagen propuestos y su introducción en la práctica clínica requirieron conocimientos técnicos e informáticos clínicos y de resonancia magnética, en particular para el procesamiento de imágenes. La mayoría del software reportado está disponible gratuitamente (por ejemplo, FSL, MRtrix3), pero se requiere el desarrollo de tuberías homebrew para administrar conjuntos de datos específicos o análisis de imágenes.
Además, el punto crítico adicional es que, aunque esta tecnología representa un apoyo crucial para el cirujano, no podría reemplazar su curva de aprendizaje. Por estas razones, esta cirugía avanzada debe reservarse para centros de referencia pocos o terciarios, especialistas altamente especializados y dedicados.
Finalmente, el objetivo futuro es mejorar la reconstrucción de estructuras de materia blanca extra-parenquimatosa, como los nervios craneales. La tractografía de estas estructuras se ve actualmente afectada por la pequeña dimensión de los nervios craneales y por la presencia de artefactos de susceptibilidad que redujeron drásticamente la señal de resonancia magnética para la presencia de aire y hueso55.
En conclusión, la colaboración sinérgica entre neurocirujanos y el equipo de neuroimagen es crucial para fines clínicos y de investigación, permitiendo planificar con la mayor precisión la estrategia quirúrgica más efectiva para cada paciente y contribuyendo al avance de la medicina personalizada en este campo.
Divulgaciones
Los autores no tienen nada que revelar
Agradecimientos
Nos gustaría agradecer a los técnicos de radiología y al personal de enfermería del Área de Neurorradiología, IRCCS Istituto delle Scienze Neurologiche di Bologna, y a su Coordinadora Dra. Maria Grazia Crepaldi, por su colaboración.
Materiales
| Name | Company | Catalog Number | Comments |
| BRAF V600E-specific clone VE1 | Ventana | ||
| Dural Substitute | Biodesign, Cook Medical | ||
| Endoscope | Karl Storz, 4mm in diameter, 18 cm in length, Hopkins II – Karl Storz Endoscopy | ||
| Immunohistochemical staining instrument | Ventana Benchmark, Ventana Medical Systems | ||
| MRI | 3T Magnetom Skyra, Siemens Health Care | ||
| Neuronavigator | Stealth Station S8 Surgical Navigation System, MEDTRONIC |
Referencias
- Wang, A. J., Zaidi, H. A., Laws, E. D. History of endonasal skull base surgery. Journal of Neurosurgical Sciences. 60 (4), 441-453 (2016).
- Kassam, A. B., Gardner, P., Snyderman, C., Mintz, A., Carrau, R. Expanded endonasal approach: fully endoscopic, completely transnasal approach to the middle third of the clivus, petrous bone, middle cranial fossa, and infratemporal fossa. Neurosurgical Focus. 19 (1), 6(2005).
- Schwartz, T. H., Morgenstern, P. F., Anand, V. K. Lessons learned in the evolution of endoscopic skull base surgery. Journal of Neurosurgery. 130 (2), 337-346 (2019).
- Cossu, G., et al. Surgical management of craniopharyngiomas in adult patients: a systematic review and consensus statement on behalf of the EANS skull base section. Acta Neurochirurgica. 162 (5), 1159-1177 (2020).
- Komotar, R. J., Starke, R. M., Raper, D. M., Anand, V. K., Schwartz, T. H. Endoscopic endonasal compared with microscopic transsphenoidal and open transcranial resection of craniopharyngiomas. World Neurosurgery. 77 (2), 329-341 (2012).
- Clark, A. J., et al. Endoscopic surgery for tuberculum sellae meningiomas: a systematic review and meta-analysis. Neurosurgical Review. 36 (3), 349-359 (2013).
- Ditzel Filho, L. F., et al. Endoscopic Endonasal Approach for Removal of Tuberculum Sellae Meningiomas. Neurosurgical Clinics of North America. 26 (3), 349(2015).
- Labidi, M., et al. Clivus chordomas: a systematic review and meta-analysis of contemporary surgical management. Journal of Neurosurgical Science. 60 (4), 476-484 (2016).
- Cannizzaro, D., et al. Microsurgical versus endoscopic trans-sphenoidal approaches for clivus chordoma: a pooled and meta-analysis. Neurosurgical Review. , (2020).
- Fujii, T., Platt, A., Zada, G. Endoscopic Endonasal Approaches to the Craniovertebral Junction: A Systematic Review of the Literature. Journal of Neurological Surgery: Part B Skull Base. 76 (6), 480-488 (2015).
- Tubbs, R. S., Demerdash, A., Rizk, E., Chapman, J. R., Oskouian, R. J. Complications of transoral and transnasal odontoidectomy: a comprehensive review. Child's Nervous System. 32 (1), 55-59 (2016).
- Zoli, M., et al. Endoscopic approaches to orbital lesions: case series and systematic literature review. Journal of Neurosurgery. 3, 1(2020).
- Jensterle, M., et al. Advances in the management of craniopharyngioma in children and adults. Radiology and Oncology. 53 (4), 388-396 (2019).
- Roque, A., Odia, Y. BRAF-V600E mutant papillary craniopharyngioma dramatically responds to combination BRAF and MEK inhibitors. CNS Oncology. 6 (2), 95-99 (2017).
- Marucci, G., et al. Targeted BRAF and CTNNB1 next-generation sequencing allows proper classification of nonadenomatous lesions of the sellar region in samples with limiting amounts of lesional cells. Pituitary. 18 (6), 905-911 (2015).
- Silva, M. A., See, A. P., Essayed, W. I., Golby, A. J., Tie, Y. Challenges and techniques for presurgical brain mapping with functional MRI. NeuroImage Clinical. 17, 794-803 (2017).
- Duffau, H. Lessons from brain mapping in surgery for low-grade glioma: insights into associations between tumor and brain plasticity. The Lancet Neurology. 4 (8), 476-486 (2005).
- Maesawa, S., et al. Evaluation of resting state networks in patients with gliomas: connectivity changes in the unaffected side and its relation to cognitive function. PloS One. 10 (2), 0118072(2015).
- Gonen, T., et al. Intra-operative multi-site stimulation: Expanding methodology for cortical brain mapping of language functions. PloS One. 12 (7), 0180740(2017).
- Pillai, J. J. The evolution of clinical functional imaging during the past 2 decades and its current impact on neurosurgical planning. American Journal of Neuroradiology. 31 (2), 219-225 (2010).
- Bizzi, A. Presurgical mapping of verbal language in brain tumors with functional MR imaging and MR tractography. Neuroimaging Clinics of North America. 19 (4), 573-596 (2009).
- Dell'Acqua, F., Tournier, J. D. Modelling white matter with spherical deconvolution: How and why. NMR in Biomedicine. 32 (4), 3945(2019).
- Maier-Hein, K. H., et al. The challenge of mapping the human connectome based on diffusion tractography. Nature Communications. 8 (1), 1349(2017).
- Costabile, J. D., Alaswad, E., D'Souza, S., Thompson, J. A., Ormond, D. R. Current Applications of Diffusion Tensor Imaging and Tractography in Intracranial Tumor Resection. Frontiers in Oncology. 9, 426(2019).
- Jacquesson, T., et al. Full tractography for detecting the position of cranial nerves in preoperative planning for skull base surgery: technical note. Journal of Neurosurgery. , 1-11 (2019).
- Zolal, A., et al. Comparison of probabilistic and deterministic fiber tracking of cranial nerves. Journal of Neurosurgery. 127 (3), 613-621 (2017).
- Ung, N., et al. A Systematic Analysis of the Reliability of Diffusion Tensor Imaging Tractography for Facial Nerve Imaging in Patients with Vestibular Schwannoma. Journal of Neurological Part B Skull Base. 77 (4), 314-318 (2016).
- Anik, I., et al. Visual Outcome of an Endoscopic Endonasal Transsphenoidal Approach in Pituitary Macroadenomas: Quantitative Assessment with Diffusion Tensor Imaging Early and Long-Term Results. World Neurosurgery. 12, 691-701 (2018).
- Oldfield, R. C. The assessment and analysis of handedness: the Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Yushkevich, P. A., et al. User-Guided Segmentation of Multi-modality Medical Imaging Datasets with ITK-SNAP. Neuroinformatics. 17 (1), 83-102 (2019).
- Tournier, J. D., Calamante, F., Connelly, A. Robust determination of the fibre orientation distribution in diffusion MRI: non-negativity constrained super-resolved spherical deconvolution. NeuroImage. 35 (4), 1459-1472 (2007).
- Mormina, E., et al. Optic radiations evaluation in patients affected by high-grade gliomas: a side-by-side constrained spherical deconvolution and diffusion tensor imaging study. Neuroradiology. 58 (11), 1067-1075 (2016).
- Hales, P. W., et al. Delineation of the visual pathway in paediatric optic pathway glioma patients using probabilistic tractography, and correlations with visual acuity. Neuroimage Clinical. 11 (17), 541-548 (2017).
- Testa, C., et al. The effect of diffusion gradient direction number on corticospinal tractography in the human brain: an along-tract analysis. Magma. 30 (3), 265-280 (2017).
- Talozzi, L., et al. Along-tract analysis of the arcuate fasciculus using the Laplacian operator to evaluate different tractography methods. Magnetic Resonance Imaging. 54, 183-193 (2018).
- Zoli, M., et al. Postoperative outcome of body core temperature rhythm and sleep-wake cycle in third ventricle craniopharyngiomas. Neurosurgical Focus. 41 (6), 12(2016).
- Foschi, M., et al. Site and type of craniopharyngiomas impact differently on 24-hour circadian rhythms and surgical outcome. A neurophysiological evaluation. Autonomic Neuroscience. 208, 126-130 (2017).
- Mojón, A., Fernández, J. R., Hermida, R. C. Chronolab: an interactive software package for chronobiologic time series analysis written for the Macintosh computer. Chronobiology International. 9 (6), 403-412 (1992).
- Hardesty, D. A., Montaser, A. S., Beer-Furlan, A., Carrau, R. L., Prevedello, D. M. Limits of endoscopic endonasal surgery for III ventricle craniopharyngiomas. Journal of Neurosurgical Sciences. 62 (3), 310-321 (2018).
- Lee, W. H., et al. Effect of Dexmedetomidine Combined Anesthesia on Motor evoked Potentials During Brain Tumor Surgery. World Neurosurgery. 123, 280-287 (2019).
- Barazi, S. A., et al. Extended endoscopic transplanum-transtuberculum approach for pituitary adenomas. British Journal of Neurosurgery. 27 (3), 374-382 (2013).
- Singh, H., et al. Intraoperative Neurophysiological Monitoring for Endoscopic Endonasal Approaches to the Skull Base: A Technical Guide. Scientifica. , 1751245(2016).
- Mazzatenta, D., et al. Outcome of Endoscopic Endonasal Surgery in Pediatric Craniopharyngiomas. World Neurosurgery. 134, 277-288 (2020).
- Milanese, L., et al. Antibiotic Prophylaxis in Endoscopic Endonasal Pituitary and Skull Base Surgery. World Neurosurgery. 106, 912-918 (2017).
- Hadad, G., et al. A novel reconstructive technique after endoscopic expanded endonasal approaches: vascular pedicle nasoseptal flap. Laryngoscope. 116 (10), 1882-1886 (2006).
- Zoli, M., et al. Cavernous sinus invasion by pituitary adenomas: role of endoscopic endonasal surgery. Journal of Neurosurgical Sciences. 60 (4), 485-494 (2016).
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Coury, J. R., Davis, B. N., Koumas, C. P., Manzano, G. S., Dehdashti, A. R. Histopathological and molecular predictors of growth patterns and recurrence in craniopharyngiomas: a systematic review. Neurosurgical Review. 43 (1), 41-48 (2020).
- Prieto, R., et al. Craniopharyngioma adherence: a comprehensive topographical categorization and outcome-related risk stratification model based on the methodical examination of 500 tumors. Neurosurgical Focus. 41 (6), 13(2016).
- Cagnazzo, F., Zoli, M., Mazzatenta, D., Gompel, J. J. V. Endoscopic and Microscopic Transsphenoidal Surgery of Craniopharyngiomas: A Systematic Review of Surgical Outcomes Over Two Decades. Journal of Neurological Surgery: part A Central European Neurosurgery. 79 (3), 247-256 (2018).
- Cavallo, L. M., et al. The endoscopic endonasal approach for the management of craniopharyngiomas: a series of 103 patients. Journal of Neurosurgery. 121, 100-113 (2014).
- Andersson, J. L., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. Neuroimage. 20 (2), 870-888 (2003).
- Castellano, A., Cirillo, S., Bello, L., Riva, M., Falini, A. Functional MRI for Surgery of Gliomas. Current Treatment Options in Neurology. 19 (10), 34(2017).
- Elowe-Gruau, E., et al. Childhood craniopharyngioma: hypothalamus-sparing surgery decreases the risk of obesity. Journal of Clinical Endocrinology and Metabolism. 98 (6), 2376-2382 (2013).
- Jacquesson, T., et al. Overcoming Challenges of Cranial Nerve Tractography: A Targeted Review. Neurosurgery. 84 (2), 313-325 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados