Method Article
Rôle de la tractographie par IRM de diffusion dans la chirurgie endoscopique de la base du crâne endonasal
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons un protocole pour intégrer la tractographie par IRM de diffusion dans le travail des patients jusqu’à la chirurgie endoscopique endonasale pour une tumeur à la base du crâne. Les méthodes d’adoption de ces études de neuroimagerie dans les phases pré- et per-opératoires sont décrites.
Résumé
La chirurgie endonasale endoscopique a acquis un rôle de premier plan dans la gestion des tumeurs complexes de la base du crâne. Il permet la résection d’un grand groupe de lésions bénignes et malignes par une voie anatomique extra-crânienne naturelle, représentée par les cavités nasales, évitant la rétraction cérébrale et la manipulation neurovasculaire. Cela se reflète dans la récupération clinique rapide des patients et le faible risque de séquelles neurologiques permanentes, ce qui représente la principale mise en garde de la chirurgie conventionnelle de la base du crâne. Cette chirurgie doit être adaptée à chaque cas spécifique, en tenant compte de ses caractéristiques et de sa relation avec les structures neuronales environnantes, principalement basées sur la neuroimagerie préopératoire. Les techniques avancées d’IRM, telles que la tractographie, ont rarement été adoptées dans la chirurgie de la base du crâne en raison de problèmes techniques: des processus longs et compliqués pour générer des reconstructions fiables à inclure dans le système de neuronavigation.
Cet article vise à présenter le protocole mis en œuvre dans l’établissement et met en évidence la collaboration synergique et le travail d’équipe entre les neurochirurgiens et l’équipe de neuroimagerie (neurologues, neuroradiologues, neuropsychologues, physiciens et bioingénieurs) dans le but final de sélectionner le traitement optimal pour chaque patient, d’améliorer les résultats chirurgicaux et de poursuivre l’avancement de la médecine personnalisée dans ce domaine.
Introduction
La possibilité d’approcher la ligne médiane de base du crâne et les régions paramédiaines par une voie antérieure, en adoptant les fosses nasales comme cavités naturelles, a une longue histoire, remontant à plus d’un siècle1. Cependant, au cours des 20 dernières années, les technologies de visualisation et opératoires se sont suffisamment améliorées pour élargir leur possibilité d’inclure le traitement des tumeurs les plus complexes telles que les méningiomes, les chordomes, les chondrosarcomes et les craniopharyngiomes1 en raison de l’introduction (1) de l’endoscope, qui donne une vue panoramique et détaillée 2D / 3D de ces régions au chirurgien, (2) le développement de systèmes de neuronavigation peropératoires, et (3) la mise en œuvre d’instruments chirurgicaux dédiés. Comme l’ont minutieusement démontré Kassam et al. et confirmé par de multiples revues et méta-analyses, les avantages de cette approche chirurgicale sont principalement représentés par ses chances de réséquer les tumeurs de la base du crâne difficiles, en évitant toute rétraction cérébrale directe ou manipulation nerveuse, réduisant ainsi le risque de complications chirurgicales et de séquelles neurologiques et visuelles à long terme2,3,4, 5,6,7,8,9,10,11,12.
Pour les tumeurs multiples de la base du crâne et de l’hypophyse-diféphale, l’objectif chirurgical idéal a changé au cours des dernières années, passant de l’ablation tumorale la plus étendue possible à l’ablation la plus sûre avec préservation des fonctions neurologiques pour préserver la qualité de vie du patient3. Cette limitation pourrait être compensée par des traitements adjuvants innovants et efficaces, tels que la radiothérapie (adoptant des particules massives telles que des protons ou des ions carbone le cas échéant) et, pour certains néoplasmes, par la chimiothérapie en tant qu’inhibiteurs de la voie BRAF/MEK pour les craniopharyngiomes13,14,15.
Cependant, pour poursuivre ces objectifs, une évaluation préopératoire minutieuse est cruciale, afin d’adapter la stratégie chirurgicale à la spécificité de chaque cas2. Dans la plupart des centres, le protocole préopératoire de l’IRM n’est généralement effectué qu’avec des séquences structurelles standard, qui fournissent la caractérisation morphologique de la lésion. Cependant, avec ces techniques, il n’est pas toujours possible d’évaluer de manière fiable la relation anatomique de la tumeur avec les structures adjacentes3. De plus, chaque patient peut présenter différents profils de réorganisation fonctionnelle induite par la pathologie détectables uniquement avec la tractographie par IRM de diffusion et l’IRM fonctionnelle (IRMf), qui peuvent être utilisées pour fournir des conseils à la fois dans la planification de la chirurgie et dans les étapes peropératoires16,17.
Actuellement, l’IRMf est la modalité de neuroimagerie la plus couramment utilisée pour cartographier l’activité fonctionnelle et la connectivité cérébrales, comme guide pour la planification chirurgicale18,19 et pour améliorer le résultat des patients20. L’IRMf basée sur les tâches est la modalité de choix pour identifier les régions cérébrales « éloquentes » qui sont fonctionnellement impliquées dans la performance de tâches spécifiques (par exemple, tapotement des doigts, fluidité phonémique), mais n’est pas applicable à l’étude des tumeurs de la base du crâne.
La tractographie par IRM de diffusion permet une reconstruction in vivo et non invasive des connexions cérébrales de la substance blanche ainsi que des nerfs crâniens, en étudiant la structure hodologique du cerveau21. Différents algorithmes de tractographie ont été développés pour reconstruire les voies axonales en reliant les profils de diffusivité des molécules d’eau, évalués dans chaque voxel cérébral. La tractographie déterministe suit la direction de diffusivité dominante, tandis que la tractographie probabiliste évalue la distribution de connectivité des voies possibles. En outre, différents modèles peuvent être appliqués pour évaluer la diffusivité au sein de chaque voxel, et il est possible de définir deux catégories principales: les modèles à fibre unique, tels que le modèle de tenseur de diffusion, où une seule orientation de fibre est évaluée, et les modèles à fibres multiples, tels que la déconvolution sphérique, où plusieurs orientations de fibres croisées sont reconstruites22,23. Malgré le débat méthodologique sur la tractographie par IRM de diffusion, son utilité dans le flux de travail neurochirurgical est actuellement établie. Il est possible d’évaluer la luxation du tractus de la substance blanche et la distance à la tumeur, en préservant les connexions spécifiques de la substance blanche. De plus, les cartes d’imagerie par tenseur de diffusion (DTI), en particulier l’anisotropie fractionnaire (FA) et la diffusivité moyenne (MD), peuvent être appliquées pour évaluer les altérations microstructurales de la substance blanche liées à une éventuelle infiltration tumorale et pour la surveillance longitudinale des voies. Toutes ces caractéristiques font de la tractographie irm par diffusion un outil puissant à la fois pour la planification pré-chirurgicale et la prise de décision peropératoire grâce aux systèmes de neuronavigation24.
Cependant, l’application des techniques de tractographie à la chirurgie de la base du crâne a été limitée par le besoin de connaissances techniques spécialisées et le travail fastidieux pour optimiser l’acquisition de séquences IRM de diffusion, le protocole d’analyse et l’intégration des résultats de la tractographie dans les systèmes de neuronavigation25. Enfin, d’autres limitations sont dues aux difficultés techniques qui étendent ces analyses des structures de la substance blanche intraparenchymateuses aux structures extra-parenchymateuses, comme les nerfs crâniens. En effet, seules des études récentes ont présenté des résultats préliminaires tentant d’intégrer l’IRM avancée et la chirurgie de la base du crâne26,27,28.
Le présent article présente un protocole pour la prise en charge multidisciplinaire des tumeurs hypophyso-diocéphales et de la base du crâne à l’aide de la tractographie par IRM de diffusion. La mise en œuvre de ce protocole dans l’établissement est le résultat de la collaboration entre neurochirurgiens, neuro-endocrinologues et l’équipe de neuroimagerie (y compris l’expertise clinique et bioinformatique) pour offrir une approche multiaxiale intégrée efficace à ces patients.
Dans le centre, nous avons intégré des protocoles multidisciplinaires pour la prise en charge des patients atteints de tumeurs de la base du crâne, afin de fournir la description la plus informative possible et d’adapter et de personnaliser le plan chirurgical. Nous montrons que ce protocole peut être adopté à la fois dans le cadre clinique et de recherche pour tout patient atteint d’une tumeur à base du crâne afin de guider la stratégie de traitement et d’améliorer les connaissances sur les modifications cérébrales induites par ces lésions.
Protocole
Le protocole suit les normes éthiques du Comité local de recherche et la déclaration d’Helsinki de 1964 et ses amendements ultérieurs ou des normes éthiques comparables.
1. Sélection des patients
- Adoptez les critères d’inclusion suivants: patients âgés de plus de 18 ans, collaborant pleinement, présentant une tumeur de la base du crâne ou une région hypophyso-difencéphale.
- Exclure les patients présentant une contre-indication à l’IRM (c.-à-d. un stimulateur cardiaque ou du matériel ferromagnétique) ou présentant des conditions cliniques émergentes (c.-à-d. hypertension intracrânienne, perte visuelle aiguë qui nécessite une chirurgie immédiate), ou les femmes enceintes, ou les patients atteints de maladie mentale, ou ceux qui refusent explicitement de participer à ce protocole.
2. Préparation à l’examen IRM
- Avant l’examen IRM, administrer le formulaire de sécurité pour exclure les contre-indications importantes à l’examen et à l’injection d’agent de contraste: pas de matériaux ferromagnétiques dans le corps, évaluation des appareils d’IRM, sûr ou conditionnel, pas de stimulateur cardiaque, pas de lentilles de contact oculaires.
- Si le scanner utilisé pour l’acquisition de l’IRM est un champ élevé (p. ex., 3 T, voir tableau des matériaux),tenez compte de toute contre-indication supplémentaire potentielle liée, par exemple, aux dispositifs de neurostimulation.
- Vérifiez si le patient a une claustrophobie.
- S’assurer que le patient a lu et signé le formulaire de consentement à l’IRM pour reconnaître les risques et les avantages de l’examen d’imagerie.
- Demandez à un neuropsychologue d’effectuer une évaluation générale et une évaluation neurocognitive ciblée en fonction de l’emplacement de la tumeur.
- Administrer l’inventaire d’Édimbourg pour évaluer la domination de la main29.
3. Positionnement du patient dans le scanner
- Donnez des bouchons d’oreilles au patient pour réduire le bruit de l’IRM.
- Les mouvements de la tête peuvent affecter la qualité de l’imagerie; ainsi, utilisez des coussinets en mousse pour réduire les mouvements de la tête, en immobilisant la tête à l’intérieur de la bobine d’IRM.
- Fournir un bouton d’alarme d’urgence au patient en cas de besoin d’interrompre l’examen.
- Allumez la caméra et le microphone à l’intérieur du scanner pour surveiller, parler et écouter le patient depuis la salle d’acquisition IRM à l’extérieur du scanner.
4. Paramètres de réglage et d’acquisition du protocole d’IRM cérébrale
- Acquérir un scanner à haut champ à protocole IRM multimodal standardisé (1,5 T ou 3T). Les paramètres de séquence suivants se réfèrent à une IRM de 3 T, à l’aide d’une bobine de réseau haute densité tête-cou (64 canaux).
- Acquérir des séquences anatomiques à haute résolution et volumétriques : administration d’agents de contraste pré- et post-gadolinium pondérés en T1 et pondérés en T2 FLAIR.
- Pour les images pondérées T1 et T2, acquérir des tranches sagnitales continues offrant une résolution isotrope de 1x1x1 mm3 temps de balayage d’environ 5 min par séquence.
- Acquérir une séquence pondérée en T2 haute résolution et localiser la zone tumorale pour la visualisation du nerf crânien: un CISS volumétrique (interférence constructive à l’état d’équilibre) avec une dimension voxel de 0,5x0,5x0,5 mm3 (temps de balayage d’environ 9 minutes).
- Acquérir des séquences pondérées par diffusion en utilisant des images écho-planaires (EPI) à prise unique, une dimension voxel de 2x2x2 mm3,64 directions de gradient magnétique avec une valeur b de 2000 s/mm2,un temps d’écho de 98 ms et un temps de relaxation de 4300 ms.
- Acquérir cinq volumes avec une valeur b nulle au début de l’acquisition pondérée par diffusion avec une direction de codage de phase définie sur antérieure-postérieure (pour les images pondérées en diffusion temps de numérisation total de 5 minutes).
- De plus, acquérez trois volumes avec une valeur b nulle mais une direction de codage de phase inversée, postérieure-antérieure, pour corriger les distorsions d’imagerie dues à l’acquisition EPI (temps de balayage de 42 secondes). Des tranches continues quasi axiales sont acquises.
- Acquérir des séquences supplémentaires pour étudier des caractéristiques tumorales spécifiques, telles que la spectroscopie IRM multi- ou mono-voxel localisée dans la zone tumorale.
REMARQUE: La durée totale de la numérisation est d’environ 30 minutes, à l’exclusion de la préparation du patient à l’examen IRM.
5. Prétraitement des images IRM cérébrales
- Convertissez les données IRM du format d’imagerie adopté par les consoles d’acquisition IRM, DICOM (.dcm), au format NIFTI (.nii) utilisé dans les analyses d’imagerie avancées.
- Exécutez la fonction dcm2niix (https://github.com/rordenlab/dcm2niix). Définissez comme fichiers d’entrée les images dicom et comme sortie les fichiers .nii correspondants: T1.nii, Flair.nii, T1_contrast.nii, DTI_b2000.nii et DTI_b0_flip.nii.
- Installez les logiciels FSL (https://fsl.fmrib.ox.ac.uk/fsl/fslwiki) et MRtrix3 (https://www.mrtrix.org) nécessaires aux analyses d’imagerie avancées.
- Enregistrez flair.nii et T1_contrast.nii dans l’image T1.nii en exécutant la fonction FSL-flirt, qui effectue un enregistrement d’image linéaire.
- Enregistrez l’image DTI_b2000.nii sur le T1.nii en exécutant la fonction FSL-epi_reg, qui prend en compte les artefacts de distorsion d’imagerie EPI.
- Exécutez la fonction FSL-topup pour corriger les artefacts de direction de codage de phase présentant l’image DTI_b2000.nii. Définissez l’acquisition de codage en phase inverse DTI_b0_flip.nii comme fichier d’entrée « in_main ».
- Exécutez la fonction MRtrix3-dwidenoise pour l’imagerie du débruitage avec une modélisation du bruit des composants principaux.
- Pour corriger les courants de Foucault et l’artefact de perte de signal, exécutez la fonction FSL-Eddy et, pour les inhomogénéités de signal induites par la bobine IRM, la fonction correcte MRtrix3-dwibias.
- Exécutez la fonction FSL-bet pour supprimer le signal du cuir chevelu présentant l’image T1.nii et renommez le fichier de sortie en utilisant le suffixe « _brain »: T1_brain.nii.
6. Segmentation tumorale
- Installez le logiciel itk-snap (http://www.itksnap.org) 30.
- Une fois le logiciel itk-snap installé, appuyez sur Fichier - Ouvrir l’image principale et sélectionnez l’image T1.nii, puis appuyez sur Fichier - Ajouter un autre imageur et téléchargez les images Flair.nii et T1_contrast.nii, en définissant l’option de superposition semi-transparente.
- Inspectez la tumeur dans les images T1.nii, Flair.nii et T1_contrast.nii. Choisissez le plan anatomique à suivre lors du dessin de la lésion, par exemple axial.
- Placez le pointeur dans une tranche axiale pour commencer. Dans la barre d’outils principale, sélectionnez l’icône Inspecteur de polygones et commencez à dessiner les limites tumorales à l’aide du style de dessin à main levée - Courbe lisse ou Polygone.
- Une fois que vous avez terminé de dessiner le périmètre de la tumeur, fermez la courbe reliant le premier et le dernier point, appuyezsur Accepter et continuez à dessiner dans la tranche suivante. Pour les lésions tumorales de grande taille, pour accélérer le processus d’étirage, sautez certaines tranches axiales (par exemple, trois) et dessinez le périmètre de la lésion en tranches entrelacées.
- À la fin du dessin du périmètre de la lésion, sélectionnez Outils - Interpoler les étiquettes, définissez l’étiquette sur/avec interpoler comme lésion tumorale et l’interpolation le long d’un seul axe comme orientation de l’axe suivie pour dessiner les limites de la tumeur.
- Sélectionnez Segmentation - Enregistrer l’image de segmentation et nommez la segmentation tumorale comme Tumor_mask.nii en sélectionnant l’option de format Nifti à enregistrer.
7. Analyse par tractographie
- Exécutez la fonction FSL-dtifit pour modéliser la diffusivité et les différentes directions spatiales et obtenir les cartes de tenseur de diffusion suivantes : FA.nii, MD.nii et V1.nii. Évaluez ces cartes DTI pour accéder à des valeurs de diffusivité anormales qui peuvent survenir en présence d’œdème tumoral ou d’infiltration.
- Exécutez la fonction MRtrix3-tckgen avec le paramètre par défaut " ifod2 » pour effectuer une tractographie probabiliste et reconstruire les voies de la substance blanche en modélisant les problèmes de croisement de fibres31.
- Adoptez une approche seed-target en définissant les options « -seed_image » et « -include » en fonction des connaissances anatomiques a priori.
- Dessinez manuellement les régions d’intérêt (ROI) définies comme graine ou cible pour la tractographie. Vous pouvez également utiliser des retours sur investissement basés sur l’atlas. Voir Mormina et at. 32 pour la tractographie par rayonnement optique, Hales et al.33 pour le chiasme optique et les nerfs crâniens optiques, et Testa et al.34 pour les voies pyramidales.
- Lancez la visionneuse d’images FSL-fsleyes, sélectionnez Ouvriret choisissez les images à inspecter visuellement.
- Dans la visionneuse FSL- fsleyes, accédez à Réglage - Ortho View 1 et activez l’outil Mode d’édition.
- Cliquez sur l’icône du crayon FSL-fsleyes et dessinez les rois de tractographie.
- Installez le logiciel Freesurfer (https://surfer.nmr.mgh.harvard.edu).
- Exécutez la fonction Freesurfer-Recon-all sur l’image T1.nii pour obtenir la segmentation automatique de la région corticale à utiliser comme retour sur investissement de tractographie.
- Exécutez la fonction FSL-epi_regregistration, en définissant comme image d’entrée le T1.nii et l’image de référence le DTI_b2000.nii, enregistrez la matrice de sortie d’enregistrement (T1_onto_DTI.mat).
- Utilisez la matrice T1_onto_DTI.mat obtenue pour enregistrer les rois segmentés dans l’image DTI_b2000.nii.
- Exécutez la tractographie à l’aide de la fonction MRtrix3-tckgen.
- Exécutez la fonction MRtrix3-tckmap pour convertir la sortie de tractographie simplifiée « .tck » dans l’image « -template FA.nii ».
- Exécutez la fonction FSL-flirt pour enregistrer linéairement l’image T1.nii dans le modèle MNI152_T1_2mm_brain.nii.
- Enregistrez la matrice de sortie sous T1_onto_MNI.mat. Exécutez la fonction FSL-convert_xfm en définissant l’option « -concat » comme T1_onto_MNI.mat et T1_onto_DTI.mat, enregistrez la matrice de sortie sous DTI_onto_MNI.mat.
8. Tractographie : analyse le long du tractus
- Pour une description précise des paramètres DTI, utilisez des algorithmes along-tract, tels que l’algorithme basé sur Matlab qui modélise la géométrie du tractus de surface avec les propriétés de l’opérateur laplacien35.
- Installez le logiciel Matlab (https://matlab.mathworks.com) et demandez le code along-tract aux auteurs en développement35.
- Vous pouvez également utiliser la fonction MRtrix3-tcksample pour l’analyse le long du tract, car Matlab nécessite une licence.
Visualisation du rendu 9.3D
- Installez le logiciel Surf Ice (https://www.nitrc.org/plugins/mwiki/index.php/surfice:MainPage).
- Dans le panneau de commande Surf Ice, cliquez sur Avancé - Convertir voxelwise en maillage, sélectionnez l’image nifti à convertir, enregistrez le fichier .obj résultant.
- Dans le panneau de commande Surf Ice, cliquez sur Fichier - Ouvrir, puis sélectionnez le fichier .obj pour visualiser le rendu du volume 3D.
10. Examens cliniques préopératoires
- Effectuer une évaluation endocrinologique bio-humorale, composée de prolactine, TSH, freeT4, ACTH, cortisol, GH, LH, FSH et tests sériques de testostérone totale / estradiol, respectivement chez les hommes et les femmes.
- Analyser le volume d’urine sur 24 heures et les taux d’osmolalité sérique et urinaire et de sodium pour déterminer la présence de diabète insipide.
- Effectuer une évaluation ophtalmologique, y compris la mesure de l’acuité visuelle, l’évaluation informatisée du champ visuel et la tomographie par cohérence optique (OCT) rétinienne.
- Effectuer un examen physique neurologique, avec une collection d’informations anamnestiques sur la prise de poids, la sensation de faim, la surveillance continue de la température rectale toutes les 2 minutes pendant 24 heures à l’aide d’un appareil portable pour évaluer le rythme circadien de la température, et l’enregistrement du cycle veille-sommeil de 24 heures (y compris un électroencéphalogramme, un électro-oculogramme droit et gauche, un électrocardiogramme et un électromyogramme des muscles mylohyoïdes et tibialis gauche et droit)36, 37,38.
11. Planification chirurgicale
- Discuter dans une équipe collégiale rencontrant chaque patient candidat à la chirurgie, en fonction des résultats de la segmentation tumorale et de la relation avec les structures neuronales fonctionnelles éloquentes (nerfs optiques et chiasme, tige hypophysaire, troisième ventricule, artère carotide interne, complexe artéryo-communication antérieur de l’artère cérébrale antérieure (ACA-ACoA), artère basilaire, nerfs crâniens III, IV, VI, corps mammillaires, voies de la substance blanche, et les zones corticales fonctionnelles) pour déterminer l’approche chirurgicale la plus appropriée.
- Sélectionnez le couloir chirurgical avec le risque minimal de blessures des structures neurales39.
- Définir la zone de résection sûre pour chaque cas, en localisant la structure neurale critique (comme le chiasme, le corps mammillaire) sous la proximité de laquelle la résection doit être arrêtée pour éviter des dommages permanents39.
- Fusionnez les séquences IRM les plus pertinentes et importez-les dans le système de neuronavigation de la phase opératoire.
12. Préparation chirurgicale
- Induire une anesthésie générale en adoptant une anesthésie intraveineuse totale avec du propofol et du rémifentanil (il a été démontré que les autres agents anesthésiques sont parmi les facteurs les plus critiques affectant la fiabilité de la surveillance peropératoire, augmentant le taux de faux négatifs), en évitant le myorelaxant40.
- Effectuer une intubation oro-trachéale avec des gazes dans l’oropharynx pour prévenir les fuites de sang ou de liquide dans l’estomac ou les voies respiratoires41.
- Mettre en place la surveillance neurophysiologique, avec enregistrement continu des potentiels évoqués moteurs (MEPs) et des potentiels évoqués somatosensoriels (SEP) et électromyographie libre (EMG) pour les nerfs crâniens.42
- Importer les données IRM, y compris les reconstructions de tractographie, dans le système de neuronavigation (Table des matériaux).
- Sélectionnez la modalité d’enregistrement électromagnétique de la chirurgie cérébrale sur le système de neuronavigation.
- Enregistrez le système de neuronavigation sur le patient, en adoptant une technique de suivi libre ou des marqueurs externes.
- Contrôler l’exactitude de l’enregistrement obtenu, en vérifiant la position des marqueurs externes (c.-à-d. l’oreille ou le nez) sur l’IRM importée; si le résultat n’est pas acceptable, répétez l’enregistrement.
- Placez le patient dans une position semi-assise; L’utilisation de Mayfield pour réparer la tête n’est pas nécessaire43.
- Administrer des corticostéroïdes (flébocortide endoveineux, posologie en fonction du poids du patient) et des antibiotiques (2 g d’amoxicilline-acide clavulanique)44.
13. Chirurgie endoscopique endonasale
- Commencez par un endoscope à 0° (Table des matériaux).
- Récoltez le rabat naso-septal45.
- Effectuer une sphénoïdotomie antérieure, suivie d’une septostomie postérieure et d’une ethmoïdectomie avec préservation du cornet moyen, si possible43.
- Ouvrez le sellaire et l’os tuberculeux41.
- Inciser la couche de dura avec une forme en H, après coagulation du sinus intercaverneux supérieur41.
- Cliver la tumeur par le plan arachnoïdien43.
- Débulquer centralement la tumeur43.
- Retirer sa capsule des structures neurales difencéphales environnantes, arrêtant la résection en cas d’adhésion tumorale à des structures éloquentes visualisées sous guidage neuronavigation43.
- Explorez la cavité chirurgicale avec une optique inclinée (Table des matériaux)46.
- Assurer l’hémostase avec une coagulation bipolaire ou des agents hémostatiques.
- Fermer l’ouverture ostéo-méningée avec une couche intradurale intracrânienne de substitut dural43.
- Placer une couche intracrânienne extradurale de substitut dural, échafaudée de graisse abdominale et éventuellement d’os (Table des matériaux)43.
- Couvrir la fermeture avec le rabat naso-septal43.
14. Examen histologique
- Fixez les échantillons de tumeurs avec 10% de forme et incorporez-les dans de la paraffine immédiatement après la chirurgie.
- Couper le tissu en sections de 4 μm d’épaisseur et tacher avec de l’hématoxyline et de l’éosine. Le diagnostic histologique doit être basé sur la version la plus récente de la classification OMS des tumeurs cérébrales (2016)47.
- Effectuer la coloration immunohistochimique de l’échantillon par un instrument de coloration immunohistochimique automatisé, en utilisant le label avidine-biotine et la diaminobenzidine comme réactif de détection. Pour les craniopharyngiomes, adoptez des anticorps anti-bêta-caténine, anti-BRAF v600E mutants et anti-Ki67 pour la coloration immunohistochimique (Table des matériaux).
- Évaluer l’indice Ki-67 grâce au comptage manuel des cellules tumorales positives48.
15. Prise en charge post-chirurgicale des patients
- Réveillez le patient immédiatement après la chirurgie.
- Restaurez la respiration spontanée de la bouche en remplissant les cavités nasales avec un matériau absorbable et non absorbable.
- Surveillez les paramètres vitaux (pression artérielle, fréquence cardiaque, saturation en oxygène et état de conscience) pendant les 6 à 12 heures suivantes en soins intensifs.
- Rétablir l’alimentation orale après 12 heures.
- Effectuez une tomodensitométrie après 6-9 heures.
- Maintenez le repos au lit pendant trois jours avec un traitement à l’héparine.
- Contrôlez l’équilibre hydrique toutes les 12 heures et évaluez les électrolytes sériques toutes les 24 heures.
- Administrer une corticothérapie (flébocortide endoveineuse dans les premières 24 heures, puis acétate de cortone par voie orale 30 + 15 mg / jour).
- Effectuer une IRM avec/sans gadolinium dans les 72 heures suivant la chirurgie.
- Libérez le patient le 4ème jour.
16. Suivi précoce
- Répétez l’évaluation endocrinologique complète 30 jours après la chirurgie43.
- Répétez l’évaluation ophtalmologique trois mois après la chirurgie43.
- Répétez l’examen physique neurologique et les examens de la fonction de la température et des rythmes veille-sommeil trois mois après la chirurgie46.
- Effectuer l’IRM avec/sans gadolinium trois mois après la chirurgie46.
17. Traitement adjuvant
- Évaluer la présence d’une progression tumorale précoce et, si cela est indiqué, référer le patient à la radiothérapie43.
18. Suivi à long terme
- Répétez les évaluations cliniques, endocrinologiques et ophtalmologiques chaque année43.
- Effectuer une IRM annuelle avec/sans gadolinium : en cas de récidive, le patient peut être réopéré puis référé à la radiothérapie ou directement référé à la radiothérapie43.
Résultats
Une femme de 55 ans présentait des déficits visuels progressifs. Ses antécédents médicaux n’étaient pas remarquables. Lors de l’évaluation ophtalmologique, une réduction bilatérale de l’acuité visuelle (6/10 dans l’œil droit et 8/10 dans l’œil gauche) a été révélée, et le champ visuel informatisé a montré une hémianopie bitemporale complète. Aucun autre déficit n’était évident à l’examen neurologique, mais le patient a signalé une asthénie persistante et une augmentation de la sensation de faim et de soif au cours des 2-3 mois précédents, avec un gain de poids de 4-5 kg et des réveils fréquents dans la nuit pour la nécessité d’uriner. Lors de l’évaluation endocrinologique, l’hypercorticisme central et le diabète insipide ont été révélés. Le patient a été traité avec des corticostéroïdes (hydrocortisone 30 + 15 mg / jour et desmopressine 30 + 30 μg / jour). Sur le cycle veille-sommeil de 24 heures et la surveillance de la température, aucune altération significative n’a été remarquée après l’optimisation de l’hormonothérapie substitutive.
L’IRM cérébrale a démontré une tumeur suprascellaire occupant la citerne opto-chiasmatique et envahissant le 3ème ventricule, avec une morphologie polykystique irrégulière, s’améliorant après le gadolinium, suspectée comme première hypothèse d’un craniopharyngiome(Figure 1A-C). Des analyses d’imagerie avancées ont été effectuées, comme l’illustre le protocole actuel. La segmentation du noyau tumoral a mis en évidence l’absorption de gadolinium et correspondait à un volume de 7,92 cm3 (Figure 1D-E).
Les voies visuelles étaient les plus critiques à évaluer dans la planification pré-chirurgicale de ce patient. Les voies pyramidales ont également été reconstruites pour évaluer le corrélat microstructural de l’augmentation du signal détectée sur l’image pondérée FLAIR T2 au niveau du tractus droit.
La reconstruction par tractographie de la voie optique a été étudiée, en particulier la luxation du chiasme optique en présence de la masse tumorale. Les nerfs crâniens optiques bilatéraux ont également été reconstruits. Dans l’interface entre le cerveau, les os et les vaisseaux sanguins, les artefacts de susceptibilité ne permettaient pas une reconstruction complète des fibres reliant le chiasme optique aux nerfs optiques(Figure 2).
Le profil de diffusivité des voies pyramidales a été étudié à l’aide de statistiques cartographiques DTI le long des voies. Au niveau du membre postérieur droit de la capsule interne, une hyperintensité focale pondérée flair T2 était présente, correspondant à une augmentation de 5% de la mesure de la DM droite(5e-7e segments) par rapport au côté gauche(Figure 3).
En considérant de telles relations entre la tumeur et les structures neuronales, l’approche endoscopique de greffe étendue endonasale / transtuberculum a été choisie36. L’ablation de la tumeur a été réalisée avec une technique microchirurgicale à deux mains. Initialement, la tumeur a été débulquée centralement, drainant également sa composante kystique (Figure 4). Par la suite, il a été possible de détacher progressivement le craniopharyngiome des structures neurales, en adoptant l’arachnoïde comme plan de clivage (Figure 5). À la fin de la chirurgie, l’ablation complète de la tumeur avec la préservation anatomique de l’hypothalamus a été réalisée (Figure 6). La réparation du défaut ostéo-dural a été réalisée avec de la graisse abdominale et un lambeau naso-septal (Figure 7).
Le cours postopératoire s’est déroulé sans incident et le patient a reçu son congé après quatre jours dans les bonnes conditions cliniques. La tumeur s’est avérée être un craniopharyngiome adamantinomateux (grade OMS 1) à l’examen histologique.
Le patient a développé un panhypopituitarisme complet lors du suivi et était sous traitement de substitution complet par l’hydrocortisone, la desmopressine et la lévothyroxine. Les déficits visuels ont complètement régressé et aucune altération de l’examen neurologique, du cycle veille-sommeil de 24 heures et de la surveillance de la température n’a été détectée. Trois mois d’IRM cérébrale ont démontré une ablation complète de la tumeur, sans reste ni récidive. Par conséquent, aucun traitement adjuvant n’a été conseillé et le patient est suivi par des examens cliniques et neuroradiologiques annuels (Figure 8).

Graphique 1. Séquences d’IRM anatomique préopératoire (F/55 ans). Vue axiale de T1 pondéré (A) et FLAIR T2 pondéré (B); axial (C, D) et sagittal (E) T1- après administration de gadolinium (0,1 mm/kg). La segmentation tumorale (rouge) superposée à l’image pondérée en T1 améliorée par le gadolinium est montrée en D et E. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 2. Rendu 3D préopératoire de la tractographie des voies optiques et de la segmentation tumorale. (A) La tranche axiale de l’image pondérée FLAIR T2 superpose la tractographie du chiasme optique, localisée antérieurement à la tumeur. (B) Rendu en volume 3D de l’image pondérée FLAIR T2, sélection d’un plan axial et superposition de la tractographie des voies optiques. (C) Rendu de volume 3D de la surface du cerveau, tractographie des voies optiques et segmentation tumorale en rouge. Toutes les lignes de tractographie des panneaux sont colorées par la carte de couleurs de directionnalité RVB (rouge: latéral-latéral, vert: antérieur-postérieur et bleu: inférieur-supérieur). Veuillez cliquer ici pour voir une version agrandie de cette figure.
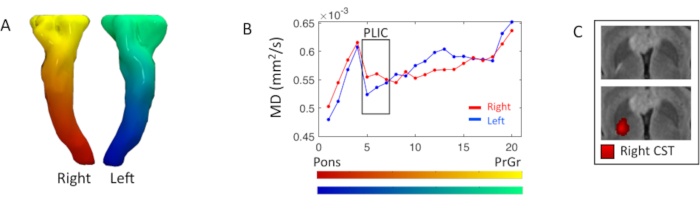
Graphique 3. Analyse pyramidale de la mesure DTI le long du tractus. (A) Rendu 3D des voies pyramidales bilatérales ou du tractus corticospinal (CST), coloré sur la base du gradient de segmentation laplacien inférieur-supérieur. (B)Profils de diffusivité moyenne (MD) CST droite (rouge) et gauche (bleu) résultant du partitionnement du tract en vingt segments affichés dans les cartes de couleurs en A; les segments commencent au niveau des pons vers le gyrus précentral (PrCr). La boîte noire met en évidence les segments au niveau du membre postérieur de la capsule interne (PLIC) (5ème-7ème). (C) Vue axiale de l’image pondérée FLAIR T2 au niveau PLIC, avec et sans la bonne carte de connectivité CST, où une intensité rouge plus vif correspond à une densité de flux plus élevée. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 4. Images endoscopiques peropératoires. (A) 0° scope, après ouverture durale, la tumeur a d’abord été détachée par le chiasme, adoptant l’arachnoïde comme plan de clivage. (B) et (C), par la suite, il a été déboulqué centralement, et le kyste a été progressivement drainé. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 5. Images endoscopiques peropératoires. (A) 0° scope, le craniopharyngiome est clivé par le plan arachnoïdien à l’aide de la neuronavigation, montrant la tumeur et les structures neurales (identifiées selon notre protocole actuel). Par conséquent, les corps mammillaires peuvent être épargnés pour éviter des dommages hypothalamiques permanents. (B) et (C) par la suite, il a été possible de réséquer la tumeur par les surfaces hypothalamiques médiales, en évitant toute traction pour ne pas blesser une telle structure neurale. (D) Lors de l’ablation de la partie intra-ventriculaire de la tumeur, une attention particulière a été accordée à la réouverture de l’aqueduc cérébral et de Monro foramina pour éviter l’hydrocéphalie aiguë postopératoire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
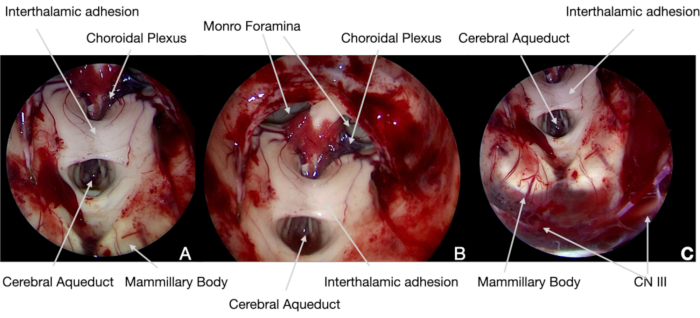
Graphique 6. Images endoscopiques peropératoires. (A) et (B) 30° scope, à la fin de la chirurgie, la structure neurale du3ème ventricule a été explorée avec une optique inclinée pour confirmer l’ablation complète de la tumeur et démontrer son intégrité anatomique. (C) Au bas du champ chirurgical, il a été possible d’identifier le CN III, sous la membrane de Liliequist: sa fonction, en tant que députés européens, SEP et autres NC, avait été contrôlée en permanence par une surveillance neurophysiologique peropératoire. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 7. Images endoscopiques peropératoires. (A) 0° scope, la fermeture du défaut ostéo-dural nécessite une technique multicouche, adoptant un substitut dural, de la graisse abdominale, éventuellement de l’os et du lambeau naso-septal. La première couche est constituée par le positionnement intradural intracrânien de la première couche d’un substitut dural. (B) L’étape suivante est représentée par le placement de la graisse abdominale pour remplir la cavité chirurgicale; un soin particulier doit être fait pour éviter le suremballage. (C) La deuxième couche de substitut dural est adoptée pour recouvrir la graisse, et elle peut être maintenue en position grâce à un échafaudage rigide, comme un morceau d’os ou de cartilage (technique du joint d’étanchéité). (D) Enfin, le lambeau naso-septal ou une greffe libre de septum ou de cornet moyen est utilisé pour recouvrir la fermeture multicouche. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 8. IRM, vue sagittale pondérée T1 après administration de gadolinium (0,1 mm/kg). (A) L’IRM préopératoire démontre la tumeur. (B) Post-opératoire, l’ablation complète de la tumeur avec la préservation anatomique des corps mammillaires et les structures hypothalamiques sont visibles. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’application du protocole présenté a abouti à un traitement sûr et efficace de l’une des tumeurs intracrâniennes les plus difficiles telles qu’un craniopharyngiome envahissant le3ème ventricule, ouvrant peut-être un nouvel horizon pour une lésion définie par H. Cushing il y a environ un siècle comme le néoplasme intracrânien le plus déconcertant1. La combinaison d’une planification préopératoire précise, de l’intégration de techniques d’IRM avancées et d’évaluations cliniques multidisciplinaires nous a permis d’adapter la stratégie chirurgicale, d’identifier le couloir chirurgical le plus approprié et de minimiser le risque de lésions de la structure neurale2,49,50,51. Contrairement à d’autres protocoles d’IRM rapportés dans la littérature, l’inclusion de séquences rapides, telles que les scans de codage inverse de phase pour les images pondérées en diffusion, permet des corrections avancées de post-traitement52. Cette procédure doit toujours être adoptée, en particulier dans un champ de haute intensité (par exemple, 3 T ou plus) où des distorsions d’imagerie sont présentes.
De plus, l’utilisation d’une approche de tractographie probabiliste basée sur une déconvolution sphérique contrainte a permis une augmentation de la qualité de reconstruction des fibres par rapport à d’autres modèles de tractographie déterministe53. En outre, le rendu 3D proposé et les analyses quantitatives ont augmenté la précision de l’évaluation préopératoire du patient. Cette étude de neuroimagerie, ainsi que la surveillance neurophysiologique, ont représenté un guide pour le chirurgien, l’aidant à décider s’il et où arrêter la résection chirurgicale dans le but final d’éviter les déficits neurologiques permanents des patients.
En effet, la résection tumorale la plus agressive pour les craniopharyngiomes a été récemment progressivement abandonnée au profit d’une technique hypothalamique-épargnante, consistant à arrêter la tumeur enlevée avant tout dommage neuronal permanent54. Cependant, dans la pratique clinique standard, il est souvent compliqué pour le neurochirurgien de décider quand empêcher l’ablation de la tumeur d’atteindre la résection maximale sûre, exposant le patient au risque, d’une part, de laisser un reste de tumeur plus grand que prévu ou, d’autre part, d’induire une lésion hypothalamique permanente, avec un préjudice conséquent de la qualité de vie.
Le protocole présenté a fourni un modèle d’intégration des données cliniques et neuroradiologiques dans le but de fournir une méthode pratique et facile à adopter pour la prise en charge des tumeurs hypophysaires-difencéphales et de la base du crâne. Cependant, nous soulignons qu’il présente certains points critiques: la nécessité d’un équipement adéquat, tel qu’un aimant à champ élevé (3 T), une bobine de canal haute résolution et un logiciel d’imagerie de pré/ traitement avancé.
Les séquences IRM du protocole présenté sont également acquérables à 1,5 T, mais les paramètres d’acquisition rapportés à l’étape 4 doivent être modifiés pour obtenir un bon rapport signal/bruit : pour les séquences pondérées en diffusion, une valeur b inférieure est suggérée (par exemple, 1000 s/mm2). De plus, la mise en œuvre des analyses de neuroimagerie proposées et leur introduction dans la pratique clinique nécessitaient une expertise technique et informatique à la fois clinique et IRM, en particulier pour le traitement de l’imagerie. La majorité des logiciels signalés sont disponibles gratuitement (par exemple, FSL, MRtrix3), mais le développement de pipelines homebrew est nécessaire pour gérer des ensembles de données ou des analyses d’imagerie spécifiques.
De plus, l’autre point critique est que, bien que cette technologie représente un soutien crucial pour le chirurgien, elle ne pourrait pas remplacer sa courbe d’apprentissage. Pour ces raisons, cette chirurgie avancée doit être réservée à des centres de référence peu nombreux ou tertiaires, à des spécialistes hautement spécialisés et dédiés.
Enfin, l’objectif futur est d’améliorer la reconstruction des structures extra-parenchymateuses de la substance blanche, comme les nerfs crâniens. La tractographie de ces structures est actuellement altérée par la petite dimension des nerfs crâniens et par la présence d’artefacts de susceptibilité qui ont considérablement réduit le signal IRM pour la présence d’air et d’os55.
En conclusion, la collaboration synergique entre les neurochirurgiens et l’équipe de neuroimagerie est cruciale à des fins cliniques et de recherche, permettant de planifier avec la plus grande précision la stratégie chirurgicale la plus efficace pour chaque patient et contribuant à l’avancement de la médecine personnalisée dans ce domaine.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer
Remerciements
Nous tenons à remercier les techniciens en radiologie et le personnel infirmier de la zone de neuroradiologie, IRCCS Istituto delle Scienze Neurologiche di Bologna, et leur coordinatrice, la Dre Maria Grazia Crepaldi, pour leur collaboration.
matériels
| Name | Company | Catalog Number | Comments |
| BRAF V600E-specific clone VE1 | Ventana | ||
| Dural Substitute | Biodesign, Cook Medical | ||
| Endoscope | Karl Storz, 4mm in diameter, 18 cm in length, Hopkins II – Karl Storz Endoscopy | ||
| Immunohistochemical staining instrument | Ventana Benchmark, Ventana Medical Systems | ||
| MRI | 3T Magnetom Skyra, Siemens Health Care | ||
| Neuronavigator | Stealth Station S8 Surgical Navigation System, MEDTRONIC |
Références
- Wang, A. J., Zaidi, H. A., Laws, E. D. History of endonasal skull base surgery. Journal of Neurosurgical Sciences. 60 (4), 441-453 (2016).
- Kassam, A. B., Gardner, P., Snyderman, C., Mintz, A., Carrau, R. Expanded endonasal approach: fully endoscopic, completely transnasal approach to the middle third of the clivus, petrous bone, middle cranial fossa, and infratemporal fossa. Neurosurgical Focus. 19 (1), 6(2005).
- Schwartz, T. H., Morgenstern, P. F., Anand, V. K. Lessons learned in the evolution of endoscopic skull base surgery. Journal of Neurosurgery. 130 (2), 337-346 (2019).
- Cossu, G., et al. Surgical management of craniopharyngiomas in adult patients: a systematic review and consensus statement on behalf of the EANS skull base section. Acta Neurochirurgica. 162 (5), 1159-1177 (2020).
- Komotar, R. J., Starke, R. M., Raper, D. M., Anand, V. K., Schwartz, T. H. Endoscopic endonasal compared with microscopic transsphenoidal and open transcranial resection of craniopharyngiomas. World Neurosurgery. 77 (2), 329-341 (2012).
- Clark, A. J., et al. Endoscopic surgery for tuberculum sellae meningiomas: a systematic review and meta-analysis. Neurosurgical Review. 36 (3), 349-359 (2013).
- Ditzel Filho, L. F., et al. Endoscopic Endonasal Approach for Removal of Tuberculum Sellae Meningiomas. Neurosurgical Clinics of North America. 26 (3), 349(2015).
- Labidi, M., et al. Clivus chordomas: a systematic review and meta-analysis of contemporary surgical management. Journal of Neurosurgical Science. 60 (4), 476-484 (2016).
- Cannizzaro, D., et al. Microsurgical versus endoscopic trans-sphenoidal approaches for clivus chordoma: a pooled and meta-analysis. Neurosurgical Review. , (2020).
- Fujii, T., Platt, A., Zada, G. Endoscopic Endonasal Approaches to the Craniovertebral Junction: A Systematic Review of the Literature. Journal of Neurological Surgery: Part B Skull Base. 76 (6), 480-488 (2015).
- Tubbs, R. S., Demerdash, A., Rizk, E., Chapman, J. R., Oskouian, R. J. Complications of transoral and transnasal odontoidectomy: a comprehensive review. Child's Nervous System. 32 (1), 55-59 (2016).
- Zoli, M., et al. Endoscopic approaches to orbital lesions: case series and systematic literature review. Journal of Neurosurgery. 3, 1(2020).
- Jensterle, M., et al. Advances in the management of craniopharyngioma in children and adults. Radiology and Oncology. 53 (4), 388-396 (2019).
- Roque, A., Odia, Y. BRAF-V600E mutant papillary craniopharyngioma dramatically responds to combination BRAF and MEK inhibitors. CNS Oncology. 6 (2), 95-99 (2017).
- Marucci, G., et al. Targeted BRAF and CTNNB1 next-generation sequencing allows proper classification of nonadenomatous lesions of the sellar region in samples with limiting amounts of lesional cells. Pituitary. 18 (6), 905-911 (2015).
- Silva, M. A., See, A. P., Essayed, W. I., Golby, A. J., Tie, Y. Challenges and techniques for presurgical brain mapping with functional MRI. NeuroImage Clinical. 17, 794-803 (2017).
- Duffau, H. Lessons from brain mapping in surgery for low-grade glioma: insights into associations between tumor and brain plasticity. The Lancet Neurology. 4 (8), 476-486 (2005).
- Maesawa, S., et al. Evaluation of resting state networks in patients with gliomas: connectivity changes in the unaffected side and its relation to cognitive function. PloS One. 10 (2), 0118072(2015).
- Gonen, T., et al. Intra-operative multi-site stimulation: Expanding methodology for cortical brain mapping of language functions. PloS One. 12 (7), 0180740(2017).
- Pillai, J. J. The evolution of clinical functional imaging during the past 2 decades and its current impact on neurosurgical planning. American Journal of Neuroradiology. 31 (2), 219-225 (2010).
- Bizzi, A. Presurgical mapping of verbal language in brain tumors with functional MR imaging and MR tractography. Neuroimaging Clinics of North America. 19 (4), 573-596 (2009).
- Dell'Acqua, F., Tournier, J. D. Modelling white matter with spherical deconvolution: How and why. NMR in Biomedicine. 32 (4), 3945(2019).
- Maier-Hein, K. H., et al. The challenge of mapping the human connectome based on diffusion tractography. Nature Communications. 8 (1), 1349(2017).
- Costabile, J. D., Alaswad, E., D'Souza, S., Thompson, J. A., Ormond, D. R. Current Applications of Diffusion Tensor Imaging and Tractography in Intracranial Tumor Resection. Frontiers in Oncology. 9, 426(2019).
- Jacquesson, T., et al. Full tractography for detecting the position of cranial nerves in preoperative planning for skull base surgery: technical note. Journal of Neurosurgery. , 1-11 (2019).
- Zolal, A., et al. Comparison of probabilistic and deterministic fiber tracking of cranial nerves. Journal of Neurosurgery. 127 (3), 613-621 (2017).
- Ung, N., et al. A Systematic Analysis of the Reliability of Diffusion Tensor Imaging Tractography for Facial Nerve Imaging in Patients with Vestibular Schwannoma. Journal of Neurological Part B Skull Base. 77 (4), 314-318 (2016).
- Anik, I., et al. Visual Outcome of an Endoscopic Endonasal Transsphenoidal Approach in Pituitary Macroadenomas: Quantitative Assessment with Diffusion Tensor Imaging Early and Long-Term Results. World Neurosurgery. 12, 691-701 (2018).
- Oldfield, R. C. The assessment and analysis of handedness: the Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Yushkevich, P. A., et al. User-Guided Segmentation of Multi-modality Medical Imaging Datasets with ITK-SNAP. Neuroinformatics. 17 (1), 83-102 (2019).
- Tournier, J. D., Calamante, F., Connelly, A. Robust determination of the fibre orientation distribution in diffusion MRI: non-negativity constrained super-resolved spherical deconvolution. NeuroImage. 35 (4), 1459-1472 (2007).
- Mormina, E., et al. Optic radiations evaluation in patients affected by high-grade gliomas: a side-by-side constrained spherical deconvolution and diffusion tensor imaging study. Neuroradiology. 58 (11), 1067-1075 (2016).
- Hales, P. W., et al. Delineation of the visual pathway in paediatric optic pathway glioma patients using probabilistic tractography, and correlations with visual acuity. Neuroimage Clinical. 11 (17), 541-548 (2017).
- Testa, C., et al. The effect of diffusion gradient direction number on corticospinal tractography in the human brain: an along-tract analysis. Magma. 30 (3), 265-280 (2017).
- Talozzi, L., et al. Along-tract analysis of the arcuate fasciculus using the Laplacian operator to evaluate different tractography methods. Magnetic Resonance Imaging. 54, 183-193 (2018).
- Zoli, M., et al. Postoperative outcome of body core temperature rhythm and sleep-wake cycle in third ventricle craniopharyngiomas. Neurosurgical Focus. 41 (6), 12(2016).
- Foschi, M., et al. Site and type of craniopharyngiomas impact differently on 24-hour circadian rhythms and surgical outcome. A neurophysiological evaluation. Autonomic Neuroscience. 208, 126-130 (2017).
- Mojón, A., Fernández, J. R., Hermida, R. C. Chronolab: an interactive software package for chronobiologic time series analysis written for the Macintosh computer. Chronobiology International. 9 (6), 403-412 (1992).
- Hardesty, D. A., Montaser, A. S., Beer-Furlan, A., Carrau, R. L., Prevedello, D. M. Limits of endoscopic endonasal surgery for III ventricle craniopharyngiomas. Journal of Neurosurgical Sciences. 62 (3), 310-321 (2018).
- Lee, W. H., et al. Effect of Dexmedetomidine Combined Anesthesia on Motor evoked Potentials During Brain Tumor Surgery. World Neurosurgery. 123, 280-287 (2019).
- Barazi, S. A., et al. Extended endoscopic transplanum-transtuberculum approach for pituitary adenomas. British Journal of Neurosurgery. 27 (3), 374-382 (2013).
- Singh, H., et al. Intraoperative Neurophysiological Monitoring for Endoscopic Endonasal Approaches to the Skull Base: A Technical Guide. Scientifica. , 1751245(2016).
- Mazzatenta, D., et al. Outcome of Endoscopic Endonasal Surgery in Pediatric Craniopharyngiomas. World Neurosurgery. 134, 277-288 (2020).
- Milanese, L., et al. Antibiotic Prophylaxis in Endoscopic Endonasal Pituitary and Skull Base Surgery. World Neurosurgery. 106, 912-918 (2017).
- Hadad, G., et al. A novel reconstructive technique after endoscopic expanded endonasal approaches: vascular pedicle nasoseptal flap. Laryngoscope. 116 (10), 1882-1886 (2006).
- Zoli, M., et al. Cavernous sinus invasion by pituitary adenomas: role of endoscopic endonasal surgery. Journal of Neurosurgical Sciences. 60 (4), 485-494 (2016).
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Coury, J. R., Davis, B. N., Koumas, C. P., Manzano, G. S., Dehdashti, A. R. Histopathological and molecular predictors of growth patterns and recurrence in craniopharyngiomas: a systematic review. Neurosurgical Review. 43 (1), 41-48 (2020).
- Prieto, R., et al. Craniopharyngioma adherence: a comprehensive topographical categorization and outcome-related risk stratification model based on the methodical examination of 500 tumors. Neurosurgical Focus. 41 (6), 13(2016).
- Cagnazzo, F., Zoli, M., Mazzatenta, D., Gompel, J. J. V. Endoscopic and Microscopic Transsphenoidal Surgery of Craniopharyngiomas: A Systematic Review of Surgical Outcomes Over Two Decades. Journal of Neurological Surgery: part A Central European Neurosurgery. 79 (3), 247-256 (2018).
- Cavallo, L. M., et al. The endoscopic endonasal approach for the management of craniopharyngiomas: a series of 103 patients. Journal of Neurosurgery. 121, 100-113 (2014).
- Andersson, J. L., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. Neuroimage. 20 (2), 870-888 (2003).
- Castellano, A., Cirillo, S., Bello, L., Riva, M., Falini, A. Functional MRI for Surgery of Gliomas. Current Treatment Options in Neurology. 19 (10), 34(2017).
- Elowe-Gruau, E., et al. Childhood craniopharyngioma: hypothalamus-sparing surgery decreases the risk of obesity. Journal of Clinical Endocrinology and Metabolism. 98 (6), 2376-2382 (2013).
- Jacquesson, T., et al. Overcoming Challenges of Cranial Nerve Tractography: A Targeted Review. Neurosurgery. 84 (2), 313-325 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon