Method Article
内視鏡内視鏡頭蓋基外科における拡散MRIトラクトグラフィーの役割
* これらの著者は同等に貢献しました
要約
頭蓋骨基腫瘍の内視鏡的内視鏡手術に至る患者ワークアップに拡散MRIトラクトグラフィーを統合するプロトコルを提示する。術前および術中段階においてこれらの神経イメージング研究を採用するための方法について説明する。
要約
内視鏡内視鏡手術は、複雑な頭蓋骨の基底腫瘍の管理において顕著な役割を果たしている。これは、脳の引き込みおよび神経血管操作を回避し、鼻腔に代表される自然な解剖学的頭蓋外路を介して良性および悪性病変の大規模なグループの切除を可能にする。これは、患者の迅速な臨床回復と永久的な神経学的後遺症のリスクが低く、従来の頭蓋骨ベース手術の主な注意点を表す。この手術は、主に術前の神経イメージングに基づいて、周囲の神経構造との特徴と関係を考慮して、それぞれの特定のケースに合わせて調整する必要があります。トラクトグラフィーなどの高度なMRI技術は、神経ナビゲーションシステムに含まれる信頼性の高い再構築を生成するための長くて複雑なプロセスという技術的な問題のために、頭蓋骨ベース手術で採用されることはほとんどありませんでした。
本論文は、この機関で実施されるプロトコルを提示し、神経外科医と神経イメージングチーム(神経科医、神経放射線科医、神経心理学者、物理学者、バイオエンジニア)との相乗的な協力とチームワークを強調し、各患者に最適な治療法を選択し、外科的結果を改善し、この分野における個別化医療の進歩を追求することを目的とする。
概要
前経路を通って頭蓋骨の基幹正線およびパラメディアン領域に接近する可能性は、鼻窩を自然腔として採用し、1世紀以上前にさかのぼる長い歴史を有する。しかし、過去20年間で、視覚化と手術技術は、これらの領域のパノラマと詳細な2D / 3Dビューを外科医に与える内視鏡の(1)導入による髄膜腫、脊索腫、軟骨肉腫、および頭蓋咽頭腫などの最も複雑な腫瘍の治療を含む可能性を拡大するのに十分に改善されました。 (2)術中神経ナビゲーションシステムの開発、および(3)専用の手術器具の実装。Kassamらによって苦労して示され、複数のレビューとメタ分析によって確認されるように、この外科的アプローチの利点は、主に挑戦的な頭蓋骨ベース腫瘍を切除する機会によって表され、直接的な脳の引き込みや神経操作を避け、外科的合併症および長期的な神経学的および視覚的後遺のリスクを減少させる。 5、6、7、8、9、10、11、12。
複数の頭蓋骨ベースおよび下垂体- 脳症性腫瘍の場合、理想的な外科的目標は、患者の生活の質を維持するための神経機能の保存と神経機能の保存と可能な最も広範な腫瘍除去に過去数年間で変更されました3.この制限は、放射線療法(適切な場合には陽子または炭素イオンなどの巨大な粒子を採用する)などの革新的かつ効果的なアジュバント治療によって補償され得るとともに、選択された新生物に対しては、CRAF/MEK経路の阻害剤としての化学療法によって、CRAF/MEK経路をクラニオヒリンギオマース13,14,15に対して行う。
しかし、これらの目標を追求するためには、術前の注意深い評価が重要であり、各症例の特定の特徴2に合わせて外科戦略を調整する。ほとんどのセンターでは、MRI術前プロトコルは、通常、病変の形態学的特徴を提供する標準的な構造配列でのみ行われる。しかし、これらの技術を用いて、確実に隣接する構造を有する腫瘍の解剖学的関係を確実に評価することは必ずしも可能ではない。さらに、各患者は、拡散MRIトラクトグラフィーおよび機能MRI(fMRI)でのみ検出可能な異なる病理誘発機能再編成プロファイルを提示し得るが、これは手術計画及び術中ステップ16、17の両方で指導を提供するために使用することができる。
現在、fMRIは脳機能活性および接続性をマッピングするための最も一般的に使用される神経イメージングモダリティであり、外科計画18,19のガイダンスとして、患者の転帰を改善するためのガイダンスとして20。タスクベースのfMRIは、特定のタスクのパフォーマンス(例えば、指のタッピング、音素流流性)に機能的に関与する「雄弁な」脳領域を同定するための選択のモダリティであるが、頭蓋骨の基礎腫瘍の研究には適用されない。
拡散MRIトラクトグラフィーは、脳の脳の接続だけでなく、脳の脳の接続だけでなく、脳の脳の接続の生体内および非侵襲的な再構築を可能にし、脳のホドロジー構造21を調査する。各脳ボクセル内で評価される水分子拡散性プロファイルをリンクさせることによって軸索経路を再構築するために、異なるトラクトグラフィーアルゴリズムが開発されている。決定論的なトラクトグラフィーは支配的な拡散性方向に従い、確率的なトラクトグラフィーは可能な経路の結合分布を評価する。さらに、各ボクセル内の拡散率を評価するために異なるモデルを適用することができ、2つの主要なカテゴリを定義することができます:拡散テンソルモデルのような単一繊維モデル、単一繊維配向が評価される場合、および球状デコンボリューションなどの複数繊維モデル、いくつかの交差繊維配向が22、23を再構築する。拡散MRIの学問法についての方法論的議論にもかかわらず、脳神経外科ワークフローにおけるその有用性は現在確立されている。特定の白質の接続を維持し、腫瘍への白物質の割り当てと距離を評価することが可能です。さらに、拡散テンソルイメージング(DTI)マップ、特に分数異方性(FA)および平均拡散性(MD)は、腫瘍浸潤の可能性に関連する微細構造白質の変化を評価し、縦方向の眼道モニタリングのために適用することができる。これらすべての特徴は、拡散MRIのトラクトグラフィーを、神経ナビゲーションシステム24を通じた術前計画および術内意思決定の両方のための強力なツールにする。
しかしながら、カルトラグラフィー技術のスカルカルベース手術への応用は、専門的な技術的知識と、拡散MRI配列取得を最適化するための時間のかかる作業の必要性によって制限されており、分析プロトコル、及び神経ナビゲーションシステム25にトラクトグラフィー結果を組み込む。最後に、さらなる制限は、頭蓋神経として、これらの分析を内在性から接合白物質構造に拡張する技術的な困難によるものです。実際、最近の研究だけが高度なMRIと頭蓋骨ベース手術26、27、28を統合しようとする予備的な結果を提示した。
本論文は、拡散MRIの学問を用いた下垂体-脳症および頭蓋骨の基底腫瘍の学際的管理のためのプロトコルを提示する。このプロトコルの導入は、神経外科医、神経内分泌学者、および神経イメージングチーム(臨床およびバイオインフォマティクスの専門知識を含む)との連携から生じ、これらの患者に効果的な統合的な多軸アプローチを提供した。
センターでは、頭蓋骨の基部腫瘍を有する患者を管理し、可能な限り最も有益な説明を提供し、外科計画を調整し、パーソナライズするための学際的なプロトコルを統合しました。我々は、このプロトコルが治療戦略を導き、これらの病変によって誘発される脳修飾に関する知識を改善するために、頭蓋骨の基底腫瘍を有する患者の臨床および研究の両方に採用できることを示す。
プロトコル
この議定書は、地方研究委員会の倫理基準に従い、1964年のヘルシンキ宣言とその後の改正または同等の倫理基準に従っています。
1. 患者の選択
- 以下の包含基準を採用する:18歳以上の患者、完全に協力し、頭蓋骨の腫瘍を提示する、または下垂体-脳症領域。
- MRIに禁忌(ペースメーカーまたは強磁性体)を有する患者、または創発的な臨床状態(すなわち、頭蓋内圧、即時手術を必要とする急性視覚喪失)、または妊婦、または精神疾患を有する患者、またはこのプロトコルへの参加を明示的に拒否する患者を除外する。
2. MRI検査の準備
- MRI試験の前に、試験および造影剤注射に対する重大な禁忌を排除するために安全フォームを管理する:体内の強磁性材料なし、MRIデバイスの評価、安全または条件付き、ペースメーカーなし、眼科コンタクトレンズなし。
- MRI取得に使用されるスキャナーが高い分野である場合(例えば、3 T、 材料表を参照)、神経刺激装置に関連する潜在的な追加の禁忌を考慮してください。
- 患者が閉所恐怖症であるかどうかを確認します。
- 患者がMRI同意書を読んで署名し、画像検査のリスクと利点を認めるようにします。
- 神経心理学者に腫瘍の位置に基づいて一般的な評価と標的神経認知評価を行うよう依頼する。
- エディンバラの在庫を管理して、利き手の優位性を評価します29.
3. スキャナーにおける患者の位置決め
- MRIノイズを低減するために患者に耳栓を与えます。
- ヘッドの動きは、イメージングの品質に影響を与える可能性があります。したがって、ヘッドの動きを軽減するために発泡パッドを使用し、MRIコイル内部のヘッドを固定します。
- 検査を中断する必要がある場合には、患者に緊急警報ボタンを提供します。
- カメラとマイクをスキャナー内のスイッチでオンにして、スキャナーの外にあるMRI取得室から患者を監視、話し、聴きます。
4. 脳MRIプロトコル設定と取得パラメータ
- 標準化されたマルチモーダルMRIプロトコルハイフィールドスキャナ(1.5 Tまたは3T)を取得します。次のシーケンスパラメータは、ヘッドネックの高密度アレイコイル(64チャンネル)を使用して、3 T MRIを参照します。
- 高解像度および容積解剖配列を取得する:T1加重前およびガドリニウム後の造影剤投与およびFLAIR T2重み付け。
- T1およびT2の加重画像の場合、連続的な矢状スライスを取得し、シーケンスあたり約5分の1x1x1 mm3 スキャン時間の等方性解像度を提供します。
- 高解像度のT2重み付け配列を取得し、脳神経の可視化のために腫瘍領域を局在化します:ボクセル次元0.5x0.5x0.5 mm3( 約9分のスキャン時間)を持つ容積CISS(定常状態における建設的な干渉)。
- シングルショットエコー平面画像(EPI)、2x2x2 mm3のボクセル次元、B値2000 s/mm2の64磁性勾配方向、エコー時間98ms、緩和時間4300msを使用して拡散重み付けシーケンスを取得します。
- 拡散加重取得の開始時にnullb値を持つ5つのボリュームを取得し、位前に設定された位相符号化方向(拡散加重画像の総スキャン時間5分)を使用します。
- さらに、ヌルb値を持つ3つのボリュームを取得するが、逆相符号化方向、後方前部、EPI取得(走査時間42秒)による画像歪みを補正する。連続した軸近傍スライスが取得されます。
- 腫瘍領域に局在するマルチボクセルまたはシングルボクセルMRI分光法などの特定の腫瘍特徴を調査するための追加の配列を取得します。
注: スキャンの合計時間は、MRI 検査の患者の準備を除いて約 30 分です。
5. 脳MR画像前処理
- MRI取得コンソールで採用されているイメージング形式のMRIデータをDICOM(.dcm)から、高度なイメージング解析で使用されるNIFTI形式(.nii)に変換します。
- dcm2niix 関数 (https://github.com/rordenlab/dcm2niix) を実行します。入力ファイルのダイコン画像として設定し、出力として、対応する.niiファイルとして:T1.nii、Flair.nii、T1_contrast.nii、DTI_b2000.nii、DTI_b0_flip.nii。
- 高度なイメージング解析に必要な FSL (https://fsl.fmrib.ox.ac.uk/fsl/fslwiki) および MRtrix3 (https://www.mrtrix.org) ソフトウェアをインストールします。
- Flair.nii と T1_contrast.nii を T1.nii イメージに登録するには、リニア画像登録を実行する FSL-flirt 関数を実行します。
- DTI_b2000.nii イメージを T1.nii に登録するには、図のイメージング歪みアーティファクトを考慮に入れる FSL epi_reg関数を実行します。
- FSL-topup 関数を実行して、DTI_b2000.nii イメージを示す位相エンコード方向アーティファクトを修正します。DTI_b0_flip.nii 逆相エンコード取得を「in_main」入力ファイルとして設定します。
- 主成分ノイズモデリングでノイズ除去を撮像するためのMRtrix3-dwidenoise関数を実行します。
- 渦電流とシグナルドロップアウトアーティファクトを補正するには、FSL-eddy関数を実行し、MRIコイル誘導信号不均一性に対して、MRtrix3-dwibias正しい機能を実行します。
- FSL-bet関数を実行して、T1.niiイメージを表示する頭皮信号を削除し、_brain T1_brain.niiという接尾辞T1_brainを使用して出力ファイルの名前を変更します。
6. 腫瘍セグメンテーション
- itk-snap ソフトウェア (http://www.itksnap.org) 30をインストールします。
- itk-snapソフトウェアがインストールされたら、[ ファイル] - [メインイメージを開く] を押してT1.nii画像を選択し、[ ファイル] - [別のイメージを追加] を押してFlair.niiとT1_contrast.nii画像をアップロードし、半透明のオーバーレイオプションを設定します。
- T1.nii、Flair.nii、およびT1_contrast nii画像の腫瘍を検査します。病変を描画するときに従う解剖面を選択します, 例えば, 軸方向.
- 1 つの軸スライスにポインタを置き、開始します。メイン ツールバーで、[ポリゴン インスペクタ ] アイコンを選択し、[ フリーハンド描画スタイル - スムーズ 曲線] または[ポリゴン] を使用して腫瘍境界の描画を開始します。
- 腫瘍の周囲の描画が完了したら、最初と最後のドットをリンクする曲線を閉じ 、Acceptを押して、次のスライスで描画を続けます。大きな腫瘍病変の場合、描画プロセスを加速し、いくつかの軸スライス(例えば、3つ)をスキップし、インターリーブスライスで病変周囲を描く。
- 病変周囲描画の終わりに、[ツール - ラベル内挿]を選択し、腫瘍病変として 内挿するラベルを 設定し、軸方向が腫瘍境界を描く方向に続くため 、補間を単一軸に沿って 設定します。
- セグメンテーションを選択 - セグメンテーションイメージを保存し、保存するNiftiフォーマットオプションを選択して、腫瘍セグメンテーションにTumor_mask.niiと名前を付けます。
7. トラクトグラフィー解析
- FSL-dtifit 関数を実行して拡散率と異なる空間方向をモデル化し、FA.nii、MD.nii、V1.nii の拡散テンソル マップを取得します。これらのDTIマップを評価して、腫瘍浮腫または浸潤の存在下で発生する可能性のある異常な拡散率値にアクセスします。
- MRtrix3-tckgen関数をデフォルト設定「ifod2」で実行して確率的なトラクトグラフィーを実行し、交差繊維の問題31をモデル化して白質経路を再構築する。
- 事前解剖学的知識に基づいて「-seed_image」および「含める」オプションを設定することで、シードターゲットアプローチを採用する。
- 対象領域 (ROI) を、トラクトグラフィーのシードまたはターゲットとして手動で描画します。または、アトラスベースのROIを使用します。モルミナら で参照してください。視能放射線学用32、光学チアズムおよび視神経用のヘイルズら33、角管用のTestaら34。
- FSL-fsleyes イメージ ビューアーを起動し、[ 開く] を選択して、視覚的に検査するイメージを選択します。
- FSL- fsleys ビューアで 、[設定 - 直交ビュー 1] に移動し、[編集モード] ツールをアクティブにします。
- FSL-fsleyes 鉛筆アイコンをクリックし、トラクトグラフィー ROI を描画します。
- フリーサーファー (https://surfer.nmr.mgh.harvard.edu) ソフトウェアをインストールします。
- T1.nii 画像上でフリーサーファー-Recon-all 関数を実行し、トラクトグラフィー ROI として使用する自動皮質領域セグメンテーションを取得します。
- FSL-epi_regregistration機能を実行し、入力画像T1.niiとして設定し、DTI_b2000.niiを参照画像にして、登録出力行列(T1_onto_DTI.mat)を保存します。
- 取得した T1_onto_DTI.mat マトリクスを使用して、セグメント化された ROI を DTI_b2000.nii イメージに登録します。
- MRtrix3-tckgen 関数を使用して、トラクトグラフィーを実行します。
- MRtrix3-tckmap 関数を実行して、「.tck」を変換すると、"-template FA.nii" イメージのトラクトグラフィー出力が効率化されます。
- fsL-flirt 関数を実行して、T1.nii イメージを MNI152_T1_2mm_brain.nii テンプレートに線形的に登録します。
- 出力行列を T1_onto_MNI.mat として保存します。FSL-convert_xfm関数を実行して、"-concat" オプションを T1_onto_MNI.mat および T1_onto_DTI.mat として設定し、出力行列を DTI_onto_MNI.mat として保存します。
8. トラクトグラフィー:沿道解析
- DTI パラメータを正確に説明するには、ラプラシアン オペレータ プロパティ35を使用してサーフェストラクト ジオメトリをモデル化する Matlab ベースのアルゴリズムなどの、沿道アルゴリズムを使用します。
- Matlab ソフトウェア (https://matlab.mathworks.com) をインストールし、開発中の著者に道に沿ったコードを要求する35.
- または、Matlab がライセンスを必要とするため、MRtrix3-tcksample 関数を使用して、沿道分析を行います。
9.3Dレンダリングの視覚化
- サーフアイスソフトウェア(https://www.nitrc.org/plugins/mwiki/index.php/surfice:MainPage)をインストールします。
- Surf Ice コマンド パネルで、[ 高度 - ボクセルをメッシュに変換] をクリックし、変換する nifti イメージを選択し、生成された .obj ファイルを保存します。
- Surf Ice コマンド パネルで、[ ファイル ] → [開く] をクリックし、.obj ファイルを選択して 3D ボリューム レンダリングを視覚化します。
10. 術前臨床検査
- プロラクチン、TSH、freeT4、ACTH、コルチゾール、GH、LH、FSH、血清検査の男性と女性でそれぞれ、バイオ液性内分泌学的評価を行います。
- 24時間尿量、血清、尿浸透量、ナトリウムレベルを分析し、糖尿病陰湿症の存在を決定します。
- 視力測定、コンピュータ化された視野評価、および眼断層断層撮影(OCT)を含む眼科評価を行う。
- 体重増加に関するアナムネスティック情報の収集、空腹感、概日温度リズムを評価するポータブルデバイスを使用して24時間ごとに直腸温度を継続的に監視し、24時間睡眠覚醒サイクル記録(脳波、右および左脳、心電図、および心筋を含む)を使用して神経学的身体検査を行う 37、38。
11. 外科計画
- 手術に各患者候補を満たす共同チームで議論し、 腫瘍の区分化の結果と機能的雄弁神経構造(視神経およびチアズム、下垂体茎、第3心室、内頚動脈、前脳動脈-前動脈伝達動脈(ACA-ACoA)複合体、白状神経、脳神経III、IV、VI、骨髄、白い体、白い物質、白い物質、 機能皮質領域)を使用して、最も適切な外科的アプローチを決定する。
- 神経構造の傷害のリスクを最小限に抑えた外科廊下を選択する 39.
- 各ケースの安全切除領域を定義し、永久的な損傷を避けるために切除を逮捕しなければならない近接性下の重要な神経構造(キアズム、マムミラリー体など)を局在化する。
- 最も関連性の高いMRIシーケンスをマージし、手術段階のニューロナビゲーションシステムにインポートします。
12. 手術準備
- プロポフォールおよびレミエンタニルを用いて全静脈麻酔を採用した全身麻酔を誘導する(他の麻酔薬が術中モニタリングの信頼性に影響を与える最も重要な因子の一つであることを実証された、偽陰性率を増加させる)、筋弛緩剤40を回避する。
- 腹や気道41内の血液や体液漏れを防ぐために、中咽頭のガーゼで口管を行う。
- 神経生理学的モニタリングを設定し、脳神経の運動誘発電位(MEP)および体性感覚誘発電位(SP)およびフリーランニング筋電図(EMG)を連続的に記録する。
- 神経ナビゲーションシステム(材料表)で、トラクトグラフィの再構築を含むMRIデータをインポートします。
- 脳ナビゲーションシステムの脳外科電磁登録様式を選択します。
- 患者に神経ナビゲーションシステムを登録し、自由追跡技術または外部マーカーを採用する。
- 達成された登録の精度を制御し、インポートされたMRI上の外部マーカー(すなわち、耳または鼻)の位置を確認する。結果が受け入れられない場合は、登録を繰り返します。
- 患者を半座位置に置きます。メイフィールドの頭を固定するための使用は必要ありません43.
- コルチコステロイド(エンドプロベントフレボコルチド、患者の体重に応じて投与量)および抗生物質(2gのアモキシシリン-クラヴラン酸)44を投与する。
13. 内視鏡的内視鏡手術
- 0°の内視鏡(材料表)から始めます。
- ナソ中隔フラップ45を収穫する。
- 前部スフェノイドトミーを行い、続いて中期タービントの保存を伴う後部中隔切り術およびエトマイデクトミーを行う、可能な場合43。
- セラーと結核の骨41を開きます。
- 硬膜層をH字型で切開し、上層洞洞41の凝固後に行う。
- くも膜面43によって腫瘍を切断する。
- 腫瘍43を中央から脱バルクする。
- 周囲のジエンスファリック神経構造からそのカプセルを取り除き、神経ナビゲーション誘導43の下で可視化された雄弁な構造への腫瘍接着の場合に切除を阻止する。
- 角度付き光学(材料表)46で外科腔を探索してください。
- 双極凝固または止血剤で止血を確実に行う。
- 硬膜置換43の硬膜内頭蓋内層で骨髄膜開閉を閉じる。
- 硬膜外頭蓋内層を硬膜置換の代用品に入れ、腹部脂肪と最終的に骨(材料表)43で足場を組む。
- 閉包をナソ中隔フラップ43で覆います。
14. 組織学的検査
- 腫瘍サンプルを10%ホルマリンで固定し、手術直後にパラフィンに埋め込みます。
- 組織を4μmの厚さの切片に切り、ヘマトキシリンとエオジンで染色します。組織学的診断は、脳腫瘍のWHO分類の最新バージョンに基づいている必要があります (2016)47.
- 検出試薬としてアビジンビオチン標識およびジアミノベンジジンを用いて、自動免疫ヒストリカル染色器具による検体免疫染色を行う。卵神経咽頭腫の場合、抗β-カテニン、抗BRAF v600E変異エピトープ、および抗Ki67抗体を免疫組織化学的染色に用いる(材料表)。
- 正腫瘍細胞48の手動カウントを通してKi-67指数を評価する。
15. 手術後の患者管理
- 手術直後に患者を起こします。
- 吸着性および吸収不可能な材料で鼻腔を満たすことによって口からの自発的な呼吸を回復する。
- ICUでの重要なパラメータ(血圧、心拍数、酸素飽和度、意識状態)を、以下の6〜12時間監視します。
- 12時間後に経口給餌を回復する。
- CTスキャンを6~9時間後に実行します。
- ヘパリン治療で3日間の安静を維持します。
- 12時間ごとに流体バランスを制御し、24時間ごとに血清電解質を評価します。
- コルチコステロイド療法(最初の24時間にエンドベントフレボコルチド、そして酢酸コルテン経口30 +15 mg/日)を投与する。
- 手術後72時間以内にガドリニウムを伴う/なしのMRIを行う。
- 4日目に患者を退院する 。
16. 早期フォローアップ
- 手術後30日で完全な内分泌評価を繰り返す43.
- 手術43の3ヶ月後に眼科評価を繰り返す。
- 手術後3ヶ月後に神経学的身体検査と温度と睡眠覚醒リズム機能の調査を繰り返す 46.
- 手術46の3ヶ月後にガドリニウムを伴う/なしでMRIを行う。
17. アジュバント療法
- 早期腫瘍進行の存在を評価し、それが示された場合は、患者に放射線療法43を参照する。
18. 長期フォローアップ
- 臨床、内分泌、および眼科の評価を毎年43を繰り返す。
- ガドリニウムを伴う/またはガドリニウムなしで毎年MRIを行う:再発の場合、患者は再手術され、次いで放射線療法に言及されるか、または直接放射線療法43と呼ばれる。
結果
進歩的な視覚障害を呈した55歳の女性。彼女の病歴は目立たなかった。眼科評価では、視力の両側減少(右目6/10、左目8/10)が明らかにされ、コンピュータ化された視野は完全な二時間性ヘミアノピアを示した。神経学的検査ではそれ以上の赤字は明らかではなかったが、患者は過去2〜3ヶ月間に持続的な失血症と飢餓と渇きの感覚の増加を報告し、体重増加は4〜5kg、排尿の必要性のために夜間に頻繁に目覚めた。内分泌評価では、中枢性高血体症および糖尿病陰湿性が明らかになった。患者はコルチコステロイド(ヒドロコルチゾン30+15mg/日およびデスモプレシン30+30 μg/日)で治療した。24時間睡眠覚醒サイクルおよび温度モニタリングでは、ホルモン代替療法の最適化後に有意な変化は検出されなかった。
脳MRIは、眼球チアスマチックシステルを占め、第3心室に侵入する上頭蓋腫瘍を、不規則な多嚢胞形態で、ガドリニウム後に増強し、腺咽頭腫の最初の仮説として疑われる(図1A-C)現在のプロトコルに示すように、高度なイメージング解析が行われました。腫瘍コアセグメンテーションはガドリニウム取り込み量を強調し、7.92 cm3の体積に対応した(図1D-E)。
視覚経路は、この患者の手術前計画において評価する最も重要であった。ピラミッド型の管はまた、右の管のレベルでFLAIR T2加重画像で検出された信号増加の微小構造相関を評価するために再構築されました。
視経路のトラクトグラフィー再構成、特に腫瘍塊の存在下における視性チアズム転位を調査した。両側視頭蓋神経も再建された。脳、骨、血管の間の界面では、感受性アーティファクトは、視神経に光キアズムを接続する繊維の完全な再構築を可能にしなかった(図2)。
ピラミッド型トラクト拡散性プロファイルを、沿道DTIマップ統計で調査した。内部カプセルの右後肢のレベルでは、焦点FLAIR T2加重高強度が存在し、右側のMD尺度(5番目-7番目のセグメント)の5%の増加に対応する(図3)。
腫瘍と神経構造の関係を考慮することにより、内視鏡的内視鏡拡張移植/経結核アプローチを36.腫瘍除去は、マイクロ外科的両手技術で行った。当初、腫瘍を中央に脱バルクし、嚢胞性成分も排出した(図4)。その後、神経構造からcraniop咽頭腫を徐々に剥離することが可能であったので、切断面としてくも膜を採用した(図5)。手術の終わりに、視床下部の解剖学的保存を伴う完全な腫瘍除去が達成された(図6)。骨デュラル欠損の修復は、腹部脂肪および中隔フラップで行った(図7)。
術後のコースは無事で、患者は適切な臨床状態で4日後に退院した。腫瘍は組織学的検査でアダマンダノマトース頭蓋咽頭腫(WHOグレード1)であることが判明した。
患者はフォローアップで完全な汎ピトイターリズムを発症し、ヒドロコルチゾン、デスモプレシン、およびレボチロキシンによる完全な置換療法を受けていた。視覚障害は完全に後退し、神経学的検査、24時間睡眠覚醒サイクル、および温度モニタリングに変化は検出されなかった。脳MRIの3ヶ月は、残骸や再発なしで、完全な腫瘍除去を実証した。したがって、アジュバント治療は推奨されず、患者は毎年臨床および神経放射線検査を受ける(図8)。

図 1.術前の解剖学的MRI配列(F/55年)。 T1加重(A)とフレアT2加重(B)の軸方向ビューガドリニウム投与後の軸方向(C、D)および矢状(E)T1-ガドリニウム投与後(0.1mm/kg)。ガドリニウム強化T1加重画像に重ね合わせた腫瘍セグメンテーション(赤)を D および Eに示す。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図 2.眼道経管造影と腫瘍分節の術前3Dレンダリング。(A)FLAIR T2加重画像の軸方向スライスは、腫瘍に前局的に局在する視性チアスム・トラクトグラフィーを重ね合わせる。(B)FLAIR T2加重画像の3D容積レンダリング、軸面を選択し、視経路の路面撮影を重ねた。(C) 脳表面の3D容積レンダリング、視経路の経管法、および腫瘍セグメンテーションを赤で表示する。すべてのパネルのトラクトグラフィーの流線は、RGB方向カラーマップ(赤:横方向、緑:前部後部、青:劣った優れた)によって着色されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
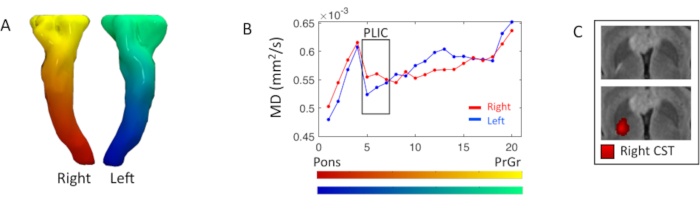
図 3.ピラミッド沿い DTI メジャー解析。(A)ラプラシアン下層セグメンテーション勾配に基づいて着色された両側錐管またはコルチコ脊柱管(CST)の3Dレンダリング。(B) 右 (赤) および左 (青) CST は、A のカラー マップに表示される 20 セグメントに区域を分割した結果、ディフューシリティ (MD) プロファイルを意味します。セグメントは、ポンのレベルから中心頭回(PrCr)に向かって開始します。ブラックボックスは、内部カプセル(PLIC)の後肢のセグメントをハイライトします(5番目-7番目)。(C) PLIC レベルでの FLAIR T2 加重画像の軸方向図で、より明るい赤色の強度がより高い流線密度に対応する、適切な CST 接続マップの有無に関する。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 4.術中内視鏡画像。(A)0°範囲は、硬膜開封後、腫瘍をチアズムによって最初に剥離し、切断面としてくも膜を採用した。(B)と(C)はその後、中央に脱バルクされ、嚢胞は徐々に排出された。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 5.術中内視鏡画像。(A)0°範囲、神経ナビゲーションの助けを借りてクラクノニダル面によってクラクノフィオマが切断され、腫瘍および神経構造(現在のプロトコルに従って同定される)を示す。したがって、マムミラリー体は永久的な視床下部損傷を避けるために免れることができる。(B)及び(C)はその後、内側視床下部表面によって腫瘍を切除することが可能となり、そのような神経構造を傷つけられないようないかなる牽引も避けた。(D) 腫瘍の心室内部分の除去中に、術後急性水頭症を避けるために脳水道管とモンロ・オナミナを再開く際に特に注意が払われた。この図の大きなバージョンを表示するには、ここをクリックしてください。
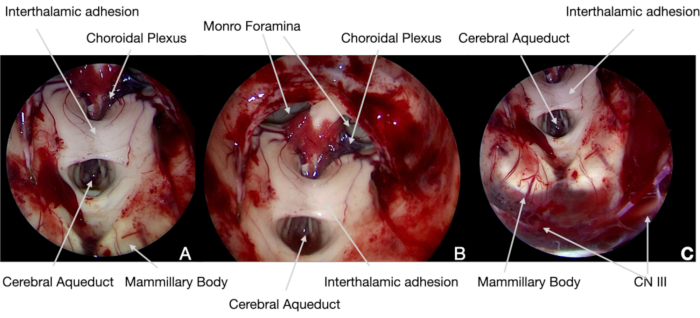
図 6.術中内視鏡画像。(A)および(B)30°スコープは、手術の終わりに、第3心室の神経構造を斜め光学で探索し、完全な腫瘍除去を確認し、その解剖学的完全性を実証した。(C)外科分野の下部では、リリエキスト膜下のCN IIIを同定することが可能であった:その機能は、MEP、SP、および他のCNとして、術中神経生理学的モニタリングで継続的に制御されていた。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 7.術中内視鏡画像。(A)0°の範囲、骨デュラル欠陥の閉鎖は、硬直代、腹部脂肪、最終的に骨、およびナソ中隔フラップを採用する多層技術を必要とする。第1の層は、硬膜置換の第1層の頭蓋内硬膜内位置決めによって構成される。(B)次のステップは、外科腔を満たすために腹部脂肪配置によって表される;過剰梱包を避けるために、特に注意を払う必要があります。(C)硬膜置換の第2層は、脂肪をカバーするために採用され、骨または軟骨の一部として、剛性足場のおかげで位置に維持することができる(ガスケットシール技術)。(D) 最後に、中隔または中タービネートの中隔の外隔フラップまたはフリーグラフトが多層閉鎖をカバーするために使用される。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 8.MRIは、ガドリニウム投与後の矢状視T1重み(0.1mm/kg)である。(A)術前MRIが腫瘍を示す。(B)術後、マミラーリー体の解剖学的保存と視床下部構造を伴う完全な腫瘍除去が見える。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
提示されたプロトコルの適用は、3番目の心室に侵入する頭蓋内腫瘍のような最も困難な頭蓋内腫瘍の1つの安全かつ効果的な治療をもたらし、おそらく約1世紀前にH.クッシングによって最もバッフル性頭蓋内新生物として定義された病変の新しい地平線を開いた。正確な術前計画、高度なMRI技術の統合、および学際的な臨床評価の組み合わせは、最も適切な外科的回廊を特定し、神経構造損傷のリスクを2、49、50、51に最小化する外科的戦略を調整することを可能にしました。文献で報告される他のMRIプロトコルとは異なり、拡散加重画像の位相逆符号化スキャンのような高速配列を含めることにより、高度な後処理補正52が可能となる。この手順は、特にイメージング歪みが存在する高強度フィールド(例えば、3T以上)で、常に採用されるべきです。
また、制約された球状の畳み込みに基づく確率的な経理手法を用い、他の決定論的なトラクトグラフィーモデル53と比較して繊維再構成品質の向上を図る。さらに、提案された3Dレンダリングと定量分析は、術前患者評価の精度を高めます。この神経イメージング研究は、神経生理学的モニタリングと共に、外科医のガイドを表し、患者の永久的な神経学的欠陥を回避するという最終目標を持って外科的切除を停止するかどうか、どこで止めるかを決定するのに役立った。
実際、頭蓋咽頭腫に対する最も積極的な腫瘍切除術は、最近、視床下部温床技術を支持して徐々に放棄され、永久的な神経損傷54の前に腫瘍を逮捕することを含む。しかし、標準的な臨床では、神経外科医が腫瘍除去が最大安全な切除を達成するのを止める時期を決定し、一方で患者を計画よりも大きく残す腫瘍を残すか、一方で永久的な視床下部損傷を誘発し、結果的に生命の質を損なうリスクを決定することはしばしば複雑である。
提示されたプロトコルは下垂体-ジエンスファリックおよび頭蓋骨の基底腫瘍の管理のための実用的で、容易に採用する方法を提供することを意図する臨床および神経放射線データを統合するモデルを提供した。しかし、高磁場(3T)磁石、高解像度チャネルコイル、高度なプリ/プロセシングイメージングソフトウェアなど、適切な機器の必要性という重要なポイントがいくつかあることを強調しています。
提示されたプロトコルのMRI配列も1.5Tで取得可能であるが、ステップ4で報告された集録パラメータは、良好な信号対雑音比を達成するために変更されなければならない:拡散加重配列に関しては、より低いb値が示唆される(例えば、1000s/mm2)。さらに、提案された神経イメージング分析の実施と臨床現場での導入には、特にイメージング処理に対して臨床およびMRIの技術およびコンピュータサイエンスの専門知識が必要でした。報告されたソフトウェアの大半は自由に利用できますが (FSL、MRtrix3 など)、特定のデータセットやイメージング解析を管理するには自作パイプラインの開発が必要です。
さらに、さらに重要な点は、この技術は外科医にとって重要なサポートを表していますが、学習曲線を置き換えることができなかったということです。これらの理由から、この高度な手術は、少数または第三次紹介センター、高度に専門化され、専任の専門家のために予約されるべきです。
最後に、将来の目標は、頭蓋神経としての超接頭白質構造の再構築を改善することです。これらの構造のトラクトグラフィは現在、脳神経の小さな次元によって、かつ、空気および骨55の存在に対するMRIシグナルを劇的に減少させた感受性アーチファクトの存在によって損なわれている。
結論として、脳神経外科医と神経イメージングチームとの相乗的なコラボレーションは、臨床および研究目的にとって極めて重要であり、患者一人一人にとって最も効果的な手術戦略を高精度に計画し、この分野における個別化医療の進歩に貢献する。
開示事項
著者は開示するものは何もない
謝辞
神経放射線領域の放射線技師と看護師のスタッフ、IRCCS Istituto delle Scienze Neurologiche diボローニャ、コーディネーターのマリア・グラツィア・クレパルディ博士の協力に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| BRAF V600E-specific clone VE1 | Ventana | ||
| Dural Substitute | Biodesign, Cook Medical | ||
| Endoscope | Karl Storz, 4mm in diameter, 18 cm in length, Hopkins II – Karl Storz Endoscopy | ||
| Immunohistochemical staining instrument | Ventana Benchmark, Ventana Medical Systems | ||
| MRI | 3T Magnetom Skyra, Siemens Health Care | ||
| Neuronavigator | Stealth Station S8 Surgical Navigation System, MEDTRONIC |
参考文献
- Wang, A. J., Zaidi, H. A., Laws, E. D. History of endonasal skull base surgery. Journal of Neurosurgical Sciences. 60 (4), 441-453 (2016).
- Kassam, A. B., Gardner, P., Snyderman, C., Mintz, A., Carrau, R. Expanded endonasal approach: fully endoscopic, completely transnasal approach to the middle third of the clivus, petrous bone, middle cranial fossa, and infratemporal fossa. Neurosurgical Focus. 19 (1), 6(2005).
- Schwartz, T. H., Morgenstern, P. F., Anand, V. K. Lessons learned in the evolution of endoscopic skull base surgery. Journal of Neurosurgery. 130 (2), 337-346 (2019).
- Cossu, G., et al. Surgical management of craniopharyngiomas in adult patients: a systematic review and consensus statement on behalf of the EANS skull base section. Acta Neurochirurgica. 162 (5), 1159-1177 (2020).
- Komotar, R. J., Starke, R. M., Raper, D. M., Anand, V. K., Schwartz, T. H. Endoscopic endonasal compared with microscopic transsphenoidal and open transcranial resection of craniopharyngiomas. World Neurosurgery. 77 (2), 329-341 (2012).
- Clark, A. J., et al. Endoscopic surgery for tuberculum sellae meningiomas: a systematic review and meta-analysis. Neurosurgical Review. 36 (3), 349-359 (2013).
- Ditzel Filho, L. F., et al. Endoscopic Endonasal Approach for Removal of Tuberculum Sellae Meningiomas. Neurosurgical Clinics of North America. 26 (3), 349(2015).
- Labidi, M., et al. Clivus chordomas: a systematic review and meta-analysis of contemporary surgical management. Journal of Neurosurgical Science. 60 (4), 476-484 (2016).
- Cannizzaro, D., et al. Microsurgical versus endoscopic trans-sphenoidal approaches for clivus chordoma: a pooled and meta-analysis. Neurosurgical Review. , (2020).
- Fujii, T., Platt, A., Zada, G. Endoscopic Endonasal Approaches to the Craniovertebral Junction: A Systematic Review of the Literature. Journal of Neurological Surgery: Part B Skull Base. 76 (6), 480-488 (2015).
- Tubbs, R. S., Demerdash, A., Rizk, E., Chapman, J. R., Oskouian, R. J. Complications of transoral and transnasal odontoidectomy: a comprehensive review. Child's Nervous System. 32 (1), 55-59 (2016).
- Zoli, M., et al. Endoscopic approaches to orbital lesions: case series and systematic literature review. Journal of Neurosurgery. 3, 1(2020).
- Jensterle, M., et al. Advances in the management of craniopharyngioma in children and adults. Radiology and Oncology. 53 (4), 388-396 (2019).
- Roque, A., Odia, Y. BRAF-V600E mutant papillary craniopharyngioma dramatically responds to combination BRAF and MEK inhibitors. CNS Oncology. 6 (2), 95-99 (2017).
- Marucci, G., et al. Targeted BRAF and CTNNB1 next-generation sequencing allows proper classification of nonadenomatous lesions of the sellar region in samples with limiting amounts of lesional cells. Pituitary. 18 (6), 905-911 (2015).
- Silva, M. A., See, A. P., Essayed, W. I., Golby, A. J., Tie, Y. Challenges and techniques for presurgical brain mapping with functional MRI. NeuroImage Clinical. 17, 794-803 (2017).
- Duffau, H. Lessons from brain mapping in surgery for low-grade glioma: insights into associations between tumor and brain plasticity. The Lancet Neurology. 4 (8), 476-486 (2005).
- Maesawa, S., et al. Evaluation of resting state networks in patients with gliomas: connectivity changes in the unaffected side and its relation to cognitive function. PloS One. 10 (2), 0118072(2015).
- Gonen, T., et al. Intra-operative multi-site stimulation: Expanding methodology for cortical brain mapping of language functions. PloS One. 12 (7), 0180740(2017).
- Pillai, J. J. The evolution of clinical functional imaging during the past 2 decades and its current impact on neurosurgical planning. American Journal of Neuroradiology. 31 (2), 219-225 (2010).
- Bizzi, A. Presurgical mapping of verbal language in brain tumors with functional MR imaging and MR tractography. Neuroimaging Clinics of North America. 19 (4), 573-596 (2009).
- Dell'Acqua, F., Tournier, J. D. Modelling white matter with spherical deconvolution: How and why. NMR in Biomedicine. 32 (4), 3945(2019).
- Maier-Hein, K. H., et al. The challenge of mapping the human connectome based on diffusion tractography. Nature Communications. 8 (1), 1349(2017).
- Costabile, J. D., Alaswad, E., D'Souza, S., Thompson, J. A., Ormond, D. R. Current Applications of Diffusion Tensor Imaging and Tractography in Intracranial Tumor Resection. Frontiers in Oncology. 9, 426(2019).
- Jacquesson, T., et al. Full tractography for detecting the position of cranial nerves in preoperative planning for skull base surgery: technical note. Journal of Neurosurgery. , 1-11 (2019).
- Zolal, A., et al. Comparison of probabilistic and deterministic fiber tracking of cranial nerves. Journal of Neurosurgery. 127 (3), 613-621 (2017).
- Ung, N., et al. A Systematic Analysis of the Reliability of Diffusion Tensor Imaging Tractography for Facial Nerve Imaging in Patients with Vestibular Schwannoma. Journal of Neurological Part B Skull Base. 77 (4), 314-318 (2016).
- Anik, I., et al. Visual Outcome of an Endoscopic Endonasal Transsphenoidal Approach in Pituitary Macroadenomas: Quantitative Assessment with Diffusion Tensor Imaging Early and Long-Term Results. World Neurosurgery. 12, 691-701 (2018).
- Oldfield, R. C. The assessment and analysis of handedness: the Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Yushkevich, P. A., et al. User-Guided Segmentation of Multi-modality Medical Imaging Datasets with ITK-SNAP. Neuroinformatics. 17 (1), 83-102 (2019).
- Tournier, J. D., Calamante, F., Connelly, A. Robust determination of the fibre orientation distribution in diffusion MRI: non-negativity constrained super-resolved spherical deconvolution. NeuroImage. 35 (4), 1459-1472 (2007).
- Mormina, E., et al. Optic radiations evaluation in patients affected by high-grade gliomas: a side-by-side constrained spherical deconvolution and diffusion tensor imaging study. Neuroradiology. 58 (11), 1067-1075 (2016).
- Hales, P. W., et al. Delineation of the visual pathway in paediatric optic pathway glioma patients using probabilistic tractography, and correlations with visual acuity. Neuroimage Clinical. 11 (17), 541-548 (2017).
- Testa, C., et al. The effect of diffusion gradient direction number on corticospinal tractography in the human brain: an along-tract analysis. Magma. 30 (3), 265-280 (2017).
- Talozzi, L., et al. Along-tract analysis of the arcuate fasciculus using the Laplacian operator to evaluate different tractography methods. Magnetic Resonance Imaging. 54, 183-193 (2018).
- Zoli, M., et al. Postoperative outcome of body core temperature rhythm and sleep-wake cycle in third ventricle craniopharyngiomas. Neurosurgical Focus. 41 (6), 12(2016).
- Foschi, M., et al. Site and type of craniopharyngiomas impact differently on 24-hour circadian rhythms and surgical outcome. A neurophysiological evaluation. Autonomic Neuroscience. 208, 126-130 (2017).
- Mojón, A., Fernández, J. R., Hermida, R. C. Chronolab: an interactive software package for chronobiologic time series analysis written for the Macintosh computer. Chronobiology International. 9 (6), 403-412 (1992).
- Hardesty, D. A., Montaser, A. S., Beer-Furlan, A., Carrau, R. L., Prevedello, D. M. Limits of endoscopic endonasal surgery for III ventricle craniopharyngiomas. Journal of Neurosurgical Sciences. 62 (3), 310-321 (2018).
- Lee, W. H., et al. Effect of Dexmedetomidine Combined Anesthesia on Motor evoked Potentials During Brain Tumor Surgery. World Neurosurgery. 123, 280-287 (2019).
- Barazi, S. A., et al. Extended endoscopic transplanum-transtuberculum approach for pituitary adenomas. British Journal of Neurosurgery. 27 (3), 374-382 (2013).
- Singh, H., et al. Intraoperative Neurophysiological Monitoring for Endoscopic Endonasal Approaches to the Skull Base: A Technical Guide. Scientifica. , 1751245(2016).
- Mazzatenta, D., et al. Outcome of Endoscopic Endonasal Surgery in Pediatric Craniopharyngiomas. World Neurosurgery. 134, 277-288 (2020).
- Milanese, L., et al. Antibiotic Prophylaxis in Endoscopic Endonasal Pituitary and Skull Base Surgery. World Neurosurgery. 106, 912-918 (2017).
- Hadad, G., et al. A novel reconstructive technique after endoscopic expanded endonasal approaches: vascular pedicle nasoseptal flap. Laryngoscope. 116 (10), 1882-1886 (2006).
- Zoli, M., et al. Cavernous sinus invasion by pituitary adenomas: role of endoscopic endonasal surgery. Journal of Neurosurgical Sciences. 60 (4), 485-494 (2016).
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Coury, J. R., Davis, B. N., Koumas, C. P., Manzano, G. S., Dehdashti, A. R. Histopathological and molecular predictors of growth patterns and recurrence in craniopharyngiomas: a systematic review. Neurosurgical Review. 43 (1), 41-48 (2020).
- Prieto, R., et al. Craniopharyngioma adherence: a comprehensive topographical categorization and outcome-related risk stratification model based on the methodical examination of 500 tumors. Neurosurgical Focus. 41 (6), 13(2016).
- Cagnazzo, F., Zoli, M., Mazzatenta, D., Gompel, J. J. V. Endoscopic and Microscopic Transsphenoidal Surgery of Craniopharyngiomas: A Systematic Review of Surgical Outcomes Over Two Decades. Journal of Neurological Surgery: part A Central European Neurosurgery. 79 (3), 247-256 (2018).
- Cavallo, L. M., et al. The endoscopic endonasal approach for the management of craniopharyngiomas: a series of 103 patients. Journal of Neurosurgery. 121, 100-113 (2014).
- Andersson, J. L., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. Neuroimage. 20 (2), 870-888 (2003).
- Castellano, A., Cirillo, S., Bello, L., Riva, M., Falini, A. Functional MRI for Surgery of Gliomas. Current Treatment Options in Neurology. 19 (10), 34(2017).
- Elowe-Gruau, E., et al. Childhood craniopharyngioma: hypothalamus-sparing surgery decreases the risk of obesity. Journal of Clinical Endocrinology and Metabolism. 98 (6), 2376-2382 (2013).
- Jacquesson, T., et al. Overcoming Challenges of Cranial Nerve Tractography: A Targeted Review. Neurosurgery. 84 (2), 313-325 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved