Method Article
Rolle der Diffusions-MRT-Traktographie in der endoskopischen endonasalen Schädelbasischirurgie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir präsentieren ein Protokoll zur Integration der Diffusions-MRT-Traktographie in die Patientenaufarbeitung zur endoskopischen endonasalen Chirurgie für einen Schädelbasistumor. Die Methoden zur Übernahme dieser Neuroimaging-Studien in der prä- und intraoperativen Phase werden beschrieben.
Zusammenfassung
Die endoskopische endonasale Chirurgie hat eine herausragende Rolle bei der Behandlung komplexer Schädelbasistumoren gespielt. Es ermöglicht die Resektion einer großen Gruppe von gutartigen und bösartigen Läsionen durch einen natürlichen anatomischen extrakraniellen Weg, dargestellt durch die Nasenhöhlen, wodurch Gehirnrückzug und neurovaskuläre Manipulation vermieden werden. Dies spiegelt sich in der sofortigen klinischen Genesung der Patienten und dem geringen Risiko dauerhafter neurologischer Folgeerkrankungen wider, die den Hauptvorbehalt der konventionellen Schädelbasischirurgie darstellen. Diese Operation muss auf jeden spezifischen Fall zugeschnitten sein, unter Berücksichtigung ihrer Merkmale und Beziehung zu den umgebenden neuronalen Strukturen, die meist auf präoperativer Neurobildgebung basieren. Fortgeschrittene MRT-Techniken wie die Traktographie wurden in der Schädelbasischirurgie aufgrund technischer Probleme selten eingesetzt: langwierige und komplizierte Prozesse, um zuverlässige Rekonstruktionen für die Aufnahme in das Neuronavigationssystem zu erstellen.
Dieses Papier zielt darauf ab, das in der Institution implementierte Protokoll vorzustellen und die synergistische Zusammenarbeit und Teamarbeit zwischen Neurochirurgen und dem Neuroimaging-Team (Neurologen, Neuroradiologen, Neuropsychologen, Physiker und Bioingenieure) mit dem Endziel der Auswahl der optimalen Behandlung für jeden Patienten, der Verbesserung der chirurgischen Ergebnisse und der Weiterentwicklung der personalisierten Medizin in diesem Bereich zu unterstreichen.
Einleitung
Die Möglichkeit, sich der Schädelbasis Mittellinie und paramedianen Regionen über einen vorderen Weg zu nähern und die Nasengruben als natürliche Hohlräume anzunehmen, hat eine lange Geschichte, die mehr als ein Jahrhundertzurückreicht 1. In den letzten 20 Jahren haben sich die Visualisierungs- und Operationstechnologien jedoch so weit verbessert, dass sie ihre Möglichkeit der Behandlung der komplexesten Tumoren wie Meningeome, Chordome, Chondrosarkome und Craniopharyngiome1 aufgrund der (1) Einführung des Endoskops erweitern, das dem Chirurgen eine panoramische und detaillierte 2D / 3D-Ansicht dieser Regionen bietet. (2) die Entwicklung intraoperativer Neuronavigationssysteme und (3) die Implementierung spezieller chirurgischer Instrumente. Wie Kassam et al. akribisch gezeigt und durch mehrere Reviews und Metaanalysen bestätigt wurde, werden die Vorteile dieses chirurgischen Ansatzes hauptsächlich durch seine Chancen dargestellt, herausfordernde Schädelbasistumoren zu resezieren, direkte Hirnrückzüge oder Nervenmanipulationen zu vermeiden und so das Risiko von chirurgischen Komplikationen und langfristigen neurologischen und visuellen Folgeerscheinungen zu reduzieren2,3,4. 5,6,7,8,9,10,11,12.
Bei multiplen Schädelbasis- und Hypophysen-Diencephal-Tumoren hat sich das ideale Operationsziel in den letzten Jahren von der umfangreichsten Tumorentfernung zur sichersten Entfernung mit Erhaltung der neurologischen Funktionen zur Erhaltung der Lebensqualität des Patienten gewendet3. Diese Einschränkung könnte durch innovative und wirksame adjuvante Behandlungen wie Strahlentherapie (gegebenenfalls Unternahme massiver Partikel wie Protonen- oder Kohlenstoffionen) und bei ausgewählten Neoplasmen durch Chemotherapie als Inhibitoren des BRAF/MEK-Signalwegs für die Kraniopharyngiome13,14,15ausgeglichen werden.
Um diese Ziele zu verfolgen, ist jedoch eine sorgfältige präoperative Beurteilung entscheidend, um die chirurgische Strategie auf das spezifische Merkmal jedes Falls abzustimmen2. In den meisten Zentren wird das präoperative MRT-Protokoll normalerweise nur mit Standardstruktursequenzen durchgeführt, die die morphologische Charakterisierung der Läsion ermöglichen. Mit diesen Techniken ist es jedoch nicht immer möglich, die anatomische Beziehung des Tumors zu benachbarten Strukturen zuverlässig zu beurteilen3. Darüber hinaus kann jeder Patient unterschiedliche pathologieinduzierte funktionelle Reorganisationsprofile aufweisen, die nur mit Diffusions-MRT-Traktographie und funktioneller MRT (fMRT) nachweisbar sind und sowohl bei der Operationsplanung als auch in den intraoperativen Schritten16,17als Orientierung dienen können.
Derzeit ist fMRT die am häufigsten verwendete Neuroimaging-Modalität zur Kartierung der funktionellen Aktivität und Konnektivität des Gehirns, als Leitfaden für die chirurgische Planung18,19 und zur Verbesserung des Ergebnisses der Patienten20. Die aufgabenbasierte fMRT ist die Modalität der Wahl, um "eloquente" Gehirnregionen zu identifizieren, die funktionell an einer bestimmten Aufgabenausleistung beteiligt sind (z. B. Fingerklopfen, phonemische Geläufigkeit), aber nicht für die Untersuchung von Schädelbasistumoren geeignet sind.
Die Diffusions-MRT-Traktographie ermöglicht in vivo und nichtinvasive Rekonstruktion von Gehirnverbindungen der weißen Substanz sowie Hirnnerven und untersucht die hodologische Struktur des Gehirns21. Verschiedene Traktographiealgorithmen wurden entwickelt, um axonale Wege zu rekonstruieren, indem Wassermolekül-Diffusivitätsprofile verknüpft werden, die in jedem Gehirnvoxel ausgewertet werden. Die deterministische Traktographie folgt der dominanten Diffusivitätsrichtung, während die probabilistische Traktographie die Konnektivitätsverteilung möglicher Wege bewertet. Darüber hinaus können verschiedene Modelle angewendet werden, um die Diffusivität innerhalb jedes Voxels zu bewerten, und es ist möglich, zwei Hauptkategorien zu definieren: Einzelfasermodelle, wie das Diffusionstensormodell, bei dem eine einzelne Faserorientierung ausgewertet wird, und Mehrfasermodelle, wie sphärische Dekonvolution, bei denen mehrere Kreuzungsfaserorientierungen rekonstruiert werden22,23. Trotz der methodischen Debatte über die Diffusions-MRT-Traktographie ist ihr Nutzen im neurochirurgischen Workflow derzeit etabliert. Es ist möglich, die Dislokation des Trakts der weißen Substanz und die Entfernung zum Tumor zu bewerten, wobei spezifische Verbindungen der weißen Substanz erhalten bleiben. Darüber hinaus können Diffusionstensor-Bildgebungskarten (DTI), insbesondere die fraktionierte Anisotropie (FA) und die mittlere Diffusivität (MD), zur Beurteilung mikrostruktureller Veränderungen der weißen Substanz im Zusammenhang mit einer möglichen Tumorinfiltration und zur Längstraktüberwachung angewendet werden. All diese Eigenschaften machen die Diffusions-MRT-Traktographie zu einem leistungsfähigen Werkzeug sowohl für die präoperative Planung als auch für die intraoperative Entscheidungsfindung durch Neuronavigationssysteme24.
Die Anwendung von Traktographietechniken auf die Schädelbasischirurgie wurde jedoch durch den Bedarf an speziellem technischem Wissen und die zeitaufwändige Aufarbeitung zur Optimierung der Diffusions-MRT-Sequenzerfassung, des Analyseprotokolls und der Einbeziehung von Traktographieergebnissen in Neuronavigationssysteme begrenzt25. Weitere Einschränkungen sind schließlich auf die technischen Schwierigkeiten zurückzuführen, diese Analysen von intraparenchymalen auf extraparenchymale Strukturen der weißen Substanz als Hirnnerven auszudehnen. Tatsächlich präsentierten nur neuere Studien vorläufige Ergebnisse, die versuchten, fortgeschrittene MRT- und Schädelbasischirurgie zu integrieren26,27,28.
Die vorliegende Arbeit stellt ein Protokoll für die multidisziplinäre Behandlung von Hypophysen-Diencephal-und Schädel-Basen-Tumoren mittels Diffusions-MRT-Traktographie vor. Die Implementierung dieses Protokolls in der Einrichtung resultierte aus der Zusammenarbeit zwischen Neurochirurgen, Neuroenkernologen und dem Neuroimaging-Team (einschließlich klinischer und bioinformatischer Expertise), um diesen Patienten einen effektiven integrierten multiaxialen Ansatz zu bieten.
Im Zentrum haben wir multidisziplinäre Protokolle für die Behandlung von Patienten mit Schädelbasistumoren integriert, um eine möglichst informative Beschreibung zu liefern und den Operationsplan anzupassen und zu personalisieren. Wir zeigen, dass dieses Protokoll sowohl im klinischen als auch im Forschungsumfeld für jeden Patienten mit einem Schädelbasistumor übernommen werden kann, um die Behandlungsstrategie zu leiten und das Wissen über die durch diese Läsionen induzierten Gehirnmodifikationen zu verbessern.
Protokoll
Das Protokoll folgt den ethischen Standards des Lokalen Forschungskomitees und mit der Helsinki-Erklärung von 1964 und ihren späteren Änderungen oder vergleichbaren ethischen Standards.
1. Auswahl der Patienten
- Nehmen Sie die folgenden Einschlusskriterien an: Patienten, die älter als 18 Jahre sind, vollständig kollaborieren, einen Tumor der Schädelbasis oder eine Hypophysen-Dienzephal-Region präsentieren.
- Schließen Sie Patienten mit Kontraindikation für MRT (d. H. Ein Herzschrittmacher oder ferromagnetisches Material) oder patienten mit emergenten klinischen Zuständen (z. B. intrakranielle Hypertonie, akuter Sehverlust, der eine sofortige Operation erfordert) oder schwangere Frauen oder Patienten mit psychischen Erkrankungen oder diejenigen, die sich ausdrücklich weigern, an diesem Protokoll teilzunehmen, aus.
2. Vorbereitung auf die MRT-Untersuchung
- Verabreichen Sie vor der MRT-Untersuchung das Sicherheitsformular, um eine signifikante Kontraindikation für die Untersuchung und kontrastmittelinjektion auszuschließen: keine ferromagnetischen Materialien im Körper, Bewertung von MRT-Geräten, sicher oder bedingt, kein Herzschrittmacher, keine Augenkontaktlinsen an.
- Wenn es sich bei dem für die MRT-Erfassung verwendeten Scanner um ein hohes Feld handelt (z. B. 3 T, siehe Materialtabelle),sollten Sie mögliche zusätzliche Kontraindikationen berücksichtigen, die sich beispielsweise auf Neurostimulationsgeräte beziehen.
- Überprüfen Sie, ob der Patient Klaustrophobie hat.
- Stellen Sie sicher, dass der Patient die MRT-Einverständniserklärung gelesen und unterschrieben hat, um die Risiken und Vorteile der bildgebungsgebenden Untersuchung zu erkennen.
- Lassen Sie einen Neuropsychologen eine allgemeine Bewertung und eine gezielte neurokognitive Beurteilung basierend auf der Tumorstelle durchführen.
- Verwalten Sie das Edinburgh-Inventar, um die Händigkeitsdominanz zu bewerten29.
3. Positionierung des Patienten im Scanner
- Geben Sie dem Patienten Ohrstöpsel, um MRT-Geräusche zu reduzieren.
- Kopfbewegungen können die Bildqualität beeinträchtigen; Verwenden Sie daher Schaumstoffpolster, um Kopfbewegungen zu reduzieren und den Kopf in der MRT-Spule zu immobilisieren.
- Stellen Sie dem Patienten einen Notfallalarmknopf zur Verfügung, falls die Untersuchung unterbrochen werden muss.
- Schalten Sie die Kamera und das Mikrofon im Inneren des Scanners ein, um den Patienten aus dem MRT-Erfassungsraum außerhalb des Scanners zu überwachen, zu sprechen und zu hören.
4. Einstellung des MRT-Protokolls des Gehirns und Erfassungsparameter
- Erwerben Sie einen standardisierten multimodalen MRT-Protokoll-Hochfeldscanner (1,5 T oder 3T). Die folgenden Sequenzparameter beziehen sich auf eine 3 T MRT unter Verwendung einer Kopf-Hals-Array-Spule mit hoher Dichte (64 Kanäle).
- Erfassen Sie hochauflösende und volumetrische anatomische Sequenzen: T1-gewichtete Prä- und Post-Gadolinium-Kontrastmittel-Verabreichung und FLAIR T2-gewichtete.
- Für T1- und T2-gewichtete Bilder erfassen kontinuierliche sagittale Scheiben mit einer isotropen Auflösung von 1x1x1 mm3 Scanzeit von ca. 5 min pro Sequenz.
- Erfassen Sie eine hochauflösende T2-gewichtete Sequenz und lokalisieren Sie den Tumorbereich für die Visualisierung des Hirnnervs: ein volumetrisches CISS (Constructive Interference in Steady State) mit Voxelmaß von 0,5x0,5x0,5 mm3 (Scanzeit ca. 9 Minuten).
- Erfassen Sie diffusionsgewichtete Sequenzen mit Single-Shot-Echoplanarbildern (EPI), Voxelmaß von 2x2x2 mm3,64 magnetischen Gradientenrichtungen mit einem b-Wert von 2000 s/mm2,einer Echozeit von 98 ms und einer Relaxationszeit von 4300 ms.
- Erfassen Sie fünf Volumes mit Null-b-Wert zu Beginn der diffusionsgewichteten Erfassung mit phasencodierender Richtung, die auf anterior-posterior eingestellt ist (für diffusionsgewichtete Bilder Gesamtscanzeit von 5 Minuten).
- Erfassen Sie zusätzlich drei Volumes mit Null-b-Wert, aber umgekehrter Phasenkodierungsrichtung, posterior-anterior, um Bildverzerrungen aufgrund der EPI-Erfassung zu korrigieren (Scanzeit von 42 Sekunden). Kontinuierliche nearaxiale Scheiben werden erfasst.
- Erwerben Sie zusätzliche Sequenzen, um spezifische Tumormerkmale zu untersuchen, wie z. B. Multi- oder Einzelvoxel-MRT-Spektroskopie, die im Tumorbereich lokalisiert ist.
HINWEIS: Die Gesamtdauer des Scannens beträgt etwa 30 Minuten, ohne die Vorbereitung des Patienten auf die MRT-Untersuchung.
5. Vorverarbeitung von Hirn-MR-Bildern
- Konvertieren Sie die MRT-Daten aus dem von MRT-Erfassungskonsolen übernommenen Bildgebungsformat DICOM (.dcm) in das NIFTI-Format (.nii), das in erweiterten Bildgebungsanalysen verwendet wird.
- Führen Sie die dcm2niix-Funktion aus (https://github.com/rordenlab/dcm2niix). Legen Sie als Eingabedateien dicom-Bilder und als Ausgabe die entsprechenden .nii-Dateien fest: T1.nii, Flair.nii, T1_contrast.nii, DTI_b2000.nii und DTI_b0_flip.nii.
- Installieren Sie die FSL- (https://fsl.fmrib.ox.ac.uk/fsl/fslwiki) und MRtrix3-Software (https://www.mrtrix.org), die für die erweiterten Imaging-Analysen erforderlich ist.
- Registrieren Sie die Datei Flair.nii und T1_contrast.nii in das Bild T1.nii, indem Sie die FSL-flirt-Funktion ausführen, die eine lineare Bildregistrierung durchführt.
- Registrieren Sie das DTI_b2000.nii-Bild in der T1.nii, indem Sie die FSL-epi_reg-Funktion ausführen, die EPI-Verzerrungsartefakte berücksichtigt.
- Führen Sie die FSL-Aufladenfunktion aus, um Phasenkodierungsrichtungsartefakte zu korrigieren, die das DTI_b2000.nii-Bild darstellen. Legen Sie die inverse Phasencodierungserfassung DTI_b0_flip.nii als Eingabedatei "in_main" fest.
- Führen Sie die MRtrix3-dwidenoise-Funktion für die Abbildung der Rauschunterdrückung mit einer Hauptkomponenten-Rauschmodellierung aus.
- Um Wirbelstrom- und Signalabfallartefakt zu korrigieren, führen Sie die FSL-Eddy-Funktion und für MRT-Spulen-induzierte Signalinhomogenitäten die MRtrix3-dwibias-Korrekturfunktion aus.
- Führen Sie die FSL-bet-Funktion aus, um das Kopfhautsignal zu entfernen, das das T1.nii-Bild präsentiert, und benennen Sie die Ausgabedatei mit dem Suffix "_brain" um: T1_brain.nii.
6. Tumorsegmentierung
- Installieren Sie die itk-snap Software (http://www.itksnap.org) 30.
- Sobald die itk-snap-Software installiert ist, drücken Sie Datei - Hauptbild öffnen und wählen Sie das T1.nii-Bild aus, dann drücken Sie Datei - Weiteren Imager hinzufügen und laden Sie die Bilder Flair.nii und T1_contrast.nii hoch, wobei Sie die halbtransparente Overlay-Option festlegen.
- Untersuchen Sie den Tumor in den Bildern T1.nii, Flair.nii und T1_contrast.nii. Wählen Sie die anatomische Ebene, der beim Zeichnen der Läsion zu folgen ist, z. B. axial.
- Platzieren Sie den Zeiger zum Starten in einem axialen Segment. Wählen Sie in der Hauptsymbolleistedas Symbol Polygoninspektor aus, und beginnen Sie mit dem Zeichnen von Tumorgrenzen mithilfe des Freihandzeichnungsstils - Glatte Kurve oder Polygon.
- Wenn Sie mit dem Zeichnen des Tumorumfangs fertig sind, schließen Sie die Kurve, die den ersten und letzten Punkt verbindet, drücken Sie Akzeptieren, und fahren Sie mit dem Zeichnen im nächsten Segment fort. Um den Zeichenprozess zu beschleunigen, überspringen Sie bei großen Tumorläsionen einige axiale Scheiben (z. B. drei) und zeichnen Sie den Läsionsumfang in verschachtelten Scheiben.
- Wählen Sie am Ende der Zeichnung des Läsionsumfangs Werkzeuge - Beschriftungen interpolierenaus, legen Sie die Beschriftung auf/mit interpolieren als Tumorläsion und die Interpolation entlang einer einzelnen Achse als Achsenorientierung fest, die beim Zeichnen der Tumorgrenzen folgt.
- Wählen Sie Segmentierung - Segmentierungsbild speichern und benennen Sie die Tumorsegmentierung als Tumor_mask.nii, indem Sie die Option Nifti-Format zum Speichern auswählen.
7. Traktographische Analyse
- Führen Sie die Funktion FSL-dtifit aus, um die Diffusivität und die verschiedenen räumlichen Richtungen zu modellieren und die folgenden Diffusionstensorkarten abzustellen: FA.nii, MD.nii und V1.nii. Bewerten Sie diese DTI-Karten, um auf abnormale Diffusivitätswerte zuzugreifen, die bei Tumorödemen oder Infiltration auftreten können.
- Führen Sie die MRtrix3-tckgen-Funktion mit der Standardeinstellung "ifod2" aus, um probabilistische Traktografie durchzuführen und die Wege der weißen Substanz zu rekonstruieren, indem Sie kreuzungsübergreifende Faserprobleme31modellieren.
- Verfolgen Sie einen Seed-Target-Ansatz, indem Sie die Optionen "-seed_image" und "-include" basierend auf a priori anatomischen Kenntnissen festlegen.
- Zeichnen Sie manuell Regionen von Interesse (ROIs), die als Seed oder Ziel für die Traktographie festgelegt sind. Alternativ können Sie atlasbasierte ROIs verwenden. Siehe Mormina et at. 32 für die optische Strahlentraktographie, Hales et al.33 für den optischen Chiasmus und die optischen Hirnnerven und Testa et al.34 für die Pyramidenbahnen.
- Starten Sie den FSL-fsleyes Bildbetrachter, wählen Sie Öffnenund wählen Sie Bilder aus, die visuell überprüft werden sollen.
- Gehen Sie im FSL-Fsleyes-Viewer zu Einstellung - Ortho View 1 und aktivieren Sie das Werkzeug Bearbeitungsmodus.
- Klicken Sie auf das FSL-fsleyes Bleistiftsymbol und zeichnen Sie die Traktografie-ROIs.
- Installieren Sie die Freesurfer-Software (https://surfer.nmr.mgh.harvard.edu).
- Führen Sie die Funktion Freesurfer-Recon-all auf dem T1.nii-Bild aus, um die automatische Segmentierung der kortikalen Region zu erhalten, die als Traktografie-ROIs verwendet werden soll.
- Führen Sie die Funktion FSL-epi_regregistration aus, indem Sie als Eingabebild die Datei T1.nii festlegen, und referenzieren Sie das Bild DTI_b2000.nii, speichern Sie die Registrierungsausgabematrix (T1_onto_DTI.mat).
- Verwenden Sie die erhaltene T1_onto_DTI.mat-Matrix, um die segmentierten ROIs für das DTI_b2000.nii-Bild zu registrieren.
- Führen Sie die Traktographie mit der MRtrix3-tckgen-Funktion aus.
- Führen Sie die MRtrix3-tckmap-Funktion aus, um die Traktografieausgabe ".tck" im Bild "-template FA.nii" zu konvertieren.
- Führen Sie die FSL-flirt-Funktion aus, um das T1.nii-Bild linear in der Vorlage MNI152_T1_2mm_brain.nii zu registrieren.
- Speichern Sie die Ausgabematrix unter T1_onto_MNI.mat. Führen Sie die Funktion FSL-convert_xfm aus, indem Sie die Option "-concat" als T1_onto_MNI.mat und T1_onto_DTI.mat setzen, speichern Sie die Ausgabematrix als DTI_onto_MNI.mat.
8. Traktographie: Entlang-Trakt-Analyse
- Für eine genaue Beschreibung von DTI-Parametern verwenden Sie Entlang-Trakt-Algorithmen, z. B. den Matlab-basierten Algorithmus, der die Oberflächentraktgeometrie mit den Laplacian-Operatoreigenschaften35 modelliert.
- Installieren Sie die Matlab-Software (https://matlab.mathworks.com) und fordern Sie den Along-Tract-Code bei den entwicklungsenden Autorenan 35.
- Alternativ können Sie die MRtrix3-tcksample-Funktion für die Analyse entlang des Trakts verwenden, da Matlab eine Lizenz benötigt.
9.3D-Rendering-Visualisierung
- Installieren Sie die Surf Ice Software (https://www.nitrc.org/plugins/mwiki/index.php/surfice:MainPage).
- Klicken Sie im Surf Ice-Befehlsfeld auf Erweitert - Voxelwise in Mesh konvertieren, wählen Sie das zu konvertierende Nifti-Bild aus und speichern Sie die resultierende OBJ-Datei.
- Klicken Sie im Befehlsfenster Surf Ice auf Datei - Öffnen, und wählen Sie die OBJ-Datei aus, um das Rendern des 3D-Volumens zu visualisieren.
10. Präoperative klinische Untersuchungen
- Führen Sie eine biohumorale endokrinologische Beurteilung durch, bestehend aus Prolaktin, TSH, freeT4, ACTH, Cortisol, GH, LH, FSH und Serumtests Gesamttestosteron / Östradiol bei Männern und Frauen.
- Analysieren Sie das 24-Stunden-Urinvolumen sowie die Serum- und Urinosmolalität und den Natriumspiegel, um das Vorhandensein von Diabetes insipidus zu bestimmen.
- Führen Sie eine ophthalmologische Bewertung durch, einschließlich Der Messung der Sehschärfe, der computergestützten Gesichtsfeldbewertung und der retinalen optischen Kohärenztomographie (OCT).
- Führen Sie eine neurologische körperliche Untersuchung durch, mit einer Sammlung von anamnestischen Informationen über Gewichtszunahme, das Hungergefühl, kontinuierliche Überwachung der Rektaltemperatur alle 2 Minuten für 24 Stunden mit einem tragbaren Gerät zur Bewertung des circadianen Temperaturrhythmus und 24-Stunden-Schlaf-Wach-Zyklus-Aufzeichnung (einschließlich Elektroenzephalogramm, rechtes und linkes Elektrookulogramm, Elektrokardiogramm und Elektromyogramm von Mylohyoid- und linken und rechten Tibialismuskeln)36, 37,38.
11. Operationsplanung
- Besprechen Sie in einem kollegialen Team, das jeden Patienten für eine Operation trifft, basierend auf den Ergebnissen der Tumorsegmentierung und der Beziehung zu den funktionellen eloquenten neuronalen Strukturen (Sehnerven und Chiasmus, Hypophysenstiel, dritter Ventrikel, Arteria carotis interna, vordere Hirnarterie-anteriore Kommunikationsarterie (ACA-ACoA), Basilararterie, Hirnnerven III, IV, VI, Mammillärkörper, Trakte der weißen Substanz, und funktionelle kortikale Bereiche), um den am besten geeigneten chirurgischen Ansatz zu bestimmen.
- Wählen Sie den chirurgischen Korridor mit dem minimalen Risiko von Verletzungen neuronaler Strukturen39.
- Definieren Sie den sicheren Resektionsbereich für jeden Fall und lokalisieren Sie die kritische neuronale Struktur (wie Chiasmus, Mammillärkörper), unter deren Nähe die Resektion gestoppt werden muss, um dauerhafte Schäden zu vermeiden39.
- Führen Sie die relevantesten MRT-Sequenzen zusammen und importieren Sie sie in das Neuronavigationssystem der operativen Phase.
12. Vorbereitung der Operation
- Vollnarkose induzieren, indem eine intravenöse Totalanästhesie mit Propofol und Remifentanil angenommen wird (es wurde gezeigt, dass die anderen Anästhetika zu den kritischsten Faktoren gehören, die die Zuverlässigkeit der intraoperativen Überwachung beeinflussen und die falsch-negative Rate erhöhen), Myorelaxant40vermeiden .
- Führen Sie eine oro-tracheale Intubation mit Gazen im Oropharynx durch, um blut- oder flüssigkeitslecks im Magen oder in den Atemwegen zu verhindern41.
- Einrichtung des neurophysiologischen Monitorings mit kontinuierlicher Aufzeichnung motorisch evozierter Potentiale (MEPs) und somatosensorisch evozierter Potentiale (SEPs) und freilaufender Elektromyographie (EMG) für Hirnnerven.42
- Importieren Sie die MRT-Daten einschließlich der Traktographie-Rekonstruktionen in das Neuronavigationssystem (Materialtabelle).
- Wählen Sie die elektromagnetische Registrierungsmodalität der Gehirnchirurgie auf dem Neuronavigationssystem.
- Registrieren Sie das Neuronavigationssystem auf dem Patienten und verwenden Sie eine Free-Tracking-Technik oder externe Marker.
- Kontrolle der Genauigkeit der erreichten Registrierung, Überprüfung der Position externer Marker (z. B. Ohr oder Nase) auf dem importierten MRT; Wenn das Ergebnis nicht akzeptabel ist, wiederholen Sie die Registrierung.
- Platzieren Sie den Patienten in einer halbsitzenden Position; Mayfields Verwendung zur Fixierung des Kopfes ist nicht erforderlich43.
- Kortikosteroid (endovenöses Flebocortid, Dosierung abhängig vom Gewicht des Patienten) und Antibiotika (2 g Amoxicillin-Clavulansäure)44verabreichen.
13. Endoskopische endonasale Chirurgie
- Beginnen Sie mit einem 0° Endoskop (Materialtabelle).
- Ernten Sie die Nasoseptumklappe45.
- Führen Sie eine vordere Sphenoidotomie durch, gefolgt von einer posterioren Septostomie und Ethmoidektomie mit Erhaltung des mittleren Turbinates, wenn möglich43.
- Öffnen Sie den Sellar und den Tuberkulumknochen41.
- Schneiden Sie die Dura-Schicht mit einer H-Form ein, nachdem Sie den oberen interkavernösen Sinus41 gerinnt haben.
- Spalten Sie den Tumor durch die arachnoidale Ebene43.
- Zentral den Tumor entbulen43.
- Entfernen Sie seine Kapsel von den umgebenden zwischenhirnförmigen neuronalen Strukturen und unterbrechen Sie die Resektion im Falle einer Tumoradhäsion an eloquenten Strukturen, die unter Neuronavigationsführung visualisiert werden43.
- Erkunden Sie den Chirurgischen Hohlraum mit abgewinkelter Optik (Materialtabelle)46.
- Stellen Sie die Hämostase mit bipolarer Gerinnung oder hämostatischen Mitteln sicher.
- Schließen Sie die osteomeningeale Öffnung mit einer intraduralen intrakraniellen Schicht Duralersatz43.
- Legen Sie eine extradurale intrakranielle Schicht Duralersatz, gerüst mit Bauchfett und schließlich Knochen (Materialtabelle)43.
- Decken Sie den Verschluss mit der Nasoseptumklappe43 ab.
14. Histologische Untersuchung
- Fixieren Sie Tumorproben mit 10% Formalin und betten Sie sie unmittelbar nach der Operation in Paraffin ein.
- Gewebe in Abschnitte von 4 μm Dicke schneiden und mit Hämatoxylin und Eosin verfärben. Die histologische Diagnose muss auf der neuesten Version der WHO-Klassifikation von Hirntumoren (2016)basieren 47.
- Führen Sie eine immunhistochemische Probenfärbung durch ein automatisiertes immunhistochemisches Färbeinstrument durch, wobei Avidin-Biotin-Markierung und Diaminobenzidin als Nachweisreagenz verwendet werden. Für Craniopharyngiome, nehmen Sie Anti-Beta-Catenin, Anti-BRAF v600E mutierte Epitope und Anti-Ki67 Antikörper für immunhistochemische Färbung (Tabelle der Materialien).
- Bewerten Sie den Ki-67-Index durch die manuelle Zählung positiver Tumorzellen48.
15. Postoperatives Patientenmanagement
- Wecken Sie den Patienten unmittelbar nach der Operation.
- Stellen Sie die spontane Atmung aus dem Mund wieder her, indem Sie die Nasenhöhlen mit resorbierbarem und nicht resorbierbarem Material füllen.
- Überwachen Sie die Vitalparameter (Blutdruck, Herzfrequenz, Sauerstoffsättigung und Bewusstseinszustand) für die folgenden 6-12 Stunden auf der Intensivstation.
- Stellen Sie die orale Fütterung nach 12 Stunden wieder her.
- Führen Sie einen CT-Scan nach 6-9 Stunden durch.
- Halten Sie die Bettruhe für drei Tage mit Heparin-Behandlung.
- Kontrollieren Sie den Flüssigkeitshaushalt alle 12 Stunden und beurteilen Sie alle 24 Stunden die Serumelektrolyte.
- Kortikosteroidtherapie verabreichen (endovenöses Flebocortid in den ersten 24 Stunden und dann orales Cortonacetat 30 + 15 mg / Tag).
- Führen Sie innerhalb von 72 Stunden nach der Operation ein MRT mit/ohne Gadolinium durch.
- Entlassen Sie den Patienten am4. Tag.
16. Frühzeitige Nachbereitung
- Wiederholen Sie die vollständige endokrinologische Beurteilung 30 Tage nach der Operation43.
- Wiederholen Sie die augenärztlichen Untersuchung drei Monate nach der Operation43.
- Wiederholen Sie die neurologische körperliche Untersuchung und Temperatur- und Schlaf-Wach-Rhythmus-Funktionsuntersuchungen drei Monate nach der Operation46.
- Führen Sie die MRT mit/ohne Gadolinium drei Monate nach der Operationdurch 46.
17. Adjuvante Therapie
- Bewerten Sie das Vorhandensein einer frühen Tumorprogression, und wenn es angezeigt ist, überweisen Sie den Patienten zur Strahlentherapie43.
18. Langfristige Nachbereitung
- Wiederholen Sie die klinischen, endokrinologischen und ophthalmologischen Bewertungen jährlich43.
- Jährliche MRT mit/ohne Gadolinium: Bei einem Rezidiv kann der Patient erneut operiert und dann zur Strahlentherapie überwiesen oder direkt zur Strahlentherapie überwiesen werden43.
Ergebnisse
Eine 55-jährige Frau zeigte fortschreitende Sehdefizite. Ihre Krankengeschichte war unauffällig. Bei der ophthalmologischen Beurteilung wurde eine bilaterale Verringerung der Sehschärfe (6/10 auf dem rechten Auge und 8/10 auf dem linken Auge) aufgedeckt, und das computerisierte Gesichtsfeld zeigte eine vollständige bitemporale Hämianopie. Bei der neurologischen Untersuchung waren keine weiteren Defizite erkennbar, aber der Patient berichtete von anhaltender Asthenie und einer Zunahme des Hunger- und Durstgefühls in den letzten 2-3 Monaten, mit einer Gewichtszunahme von 4-5 kg und häufigem Erwachen in der Nacht für die Notwendigkeit zu urinieren. Bei der endokrinologischen Bewertung wurden zentraler Hyperkortizismus und Diabetes insipidus aufgedeckt. Der Patient wurde mit Kortikosteroiden (Hydrocortison 30+15 mg/Tag und Desmopressin 30+30 μg/Tag) behandelt. Beim 24-Stunden-Schlaf-Wach-Zyklus und der Temperaturüberwachung wurden nach der Optimierung der Hormonersatztherapie keine signifikanten Veränderungen festgestellt.
Die MRT des Gehirns zeigte einen suprasellaren Tumor, der die opto-chiasmatische Zisterne besetzte und in den 3. Ventrikel eindrang, mit einer unregelmäßigen polyzystischen Morphologie, die sich nach Gadolinium verstärkte, was als erste Hypothese für ein Kraniopharyngiom vermutet wird (Abbildung 1A-C). Es wurden fortschrittliche bildgebende Analysen durchgeführt, wie im aktuellen Protokoll dargestellt. Die Tumorkernsegmentierung hob die Gadoliniumaufnahme hervor und entsprach einem Volumen von 7,92 cm3 (Abbildung 1D-E).
Die Sehwege waren am kritischsten, um bei der präoperativen Planung dieses Patienten zu bewerten. Die Pyramidenbahnen wurden ebenfalls rekonstruiert, um das mikrostrukturelle Korrelat des Signalanstiegs zu bewerten, der auf dem FLAIR T2-gewichteten Bild auf der Ebene des rechten Trakts festgestellt wurde.
Untersucht wurde die Rekonstruktion der Optikuswegtraktographie, insbesondere die Optik-Chiasm-Dislokation in Gegenwart der Tumormasse. Auch die bilateralen optischen Hirnnerven wurden rekonstruiert. In der Schnittstelle zwischen Gehirn, Knochen und Blutgefäßen ermöglichten Suszeptibilitätsartefakte keine vollständige Rekonstruktion der Fasern, die den optischen Chiasmus mit den Sehnerven verbinden (Abbildung 2).
Das Diffusionsprofil der pyramidalen Trakte wurde mit der DTI-Kartenstatistik entlang des Trakts untersucht. Auf der Ebene der rechten hinteren Extremität der inneren Kapsel war eine fokale FLAIR T2-gewichtete Hyperintensität vorhanden, die einer 5%igen Erhöhung des rechten MD-Maßes(5.-7. Segmente) im Vergleich zur linken Seite entspricht ( Abbildung3).
Unter Berücksichtigung solcher Beziehungen zwischen Tumor und neuronalen Strukturen wurde der endoskopische endonasale erweiterte Transplantations- / Transtuberkulumansatz gewählt36. Die Tumorentfernung wurde mit einer mikrochirurgischen Zwei-Hände-Technik durchgeführt. Zunächst wurde der Tumor zentral debulkiert, wobei auch seine zystische Komponente entwässert wurde (Abbildung 4). Danach war es möglich, das Craniopharyngiom schrittweise von den neuronalen Strukturen zu lösen und das Arachnoidal als Spaltebene anzunehmen (Abbildung 5). Am Ende der Operation wurde eine vollständige Tumorentfernung mit der anatomischen Konservierung des Hypothalamus erreicht (Abbildung 6). Die Reparatur des osteodumalen Defekts wurde mit Bauchfett und Nasenseptumklappe durchgeführt (Abbildung 7).
Der postoperative Verlauf verlief ereignislos und der Patient wurde nach vier Tagen unter den richtigen klinischen Bedingungen entlassen. Der Tumor stellte sich bei histologischer Untersuchung als adamantinomatöses Craniopharyngiom (WHO Grad 1) heraus.
Der Patient entwickelte bei der Nachbeobachtung einen vollständigen Panhypopituitarismus und wurde vollständig mit Hydrocortison, Desmopressin und Levothyroxin substituiert. Sehdefizite gingen vollständig zurück, und es wurden keine Veränderungen bei der neurologischen Untersuchung, dem 24-Stunden-Schlaf-Wach-Zyklus und der Temperaturüberwachung festgestellt. Drei Monate Gehirn-MRT zeigten eine vollständige Tumorentfernung ohne Rest oder Rezidiv. Daher wurde keine adjuvante Behandlung empfohlen, und der Patient wird mit jährlichen klinischen und neuroradiologischen Untersuchungen verfolgt (Abbildung 8).

Abbildung 1. Präoperative anatomische MRT-Sequenzen (F/55 Jahre). Axialansicht von T1-bewertet (A) und FLAIR T2-bewertet (B); axial (C, D) und sagittal (E) T1- nach Gadolinium-Verabreichung (0,1 mm/kg). Die Tumorsegmentierung (rot), die dem Gadolinium-verstärkten T1-gewichteten Bild überlagert ist, ist in D und E dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2. Präoperative 3D-Darstellung der Traktographie der optischen Signalwege und tumorsegmentierung. (A) Axiale Scheibe des FLAIR T2-gewichteten Bildes überlagert die optische Chiasm-Traktographie, die anterior zum Tumor lokalisiert ist. (B) 3D-Volumendarstellung des FLAIR T2-gewichteten Bildes, Auswahl einer axialen Ebene und Überlagerung der optischen Bahnen Traktographie. (C) 3D-Volumendarstellung der Gehirnoberfläche, Traktographie der optischen Signalwege und Tumorsegmentierung in Rot. Alle Traktografie-Stromlinien der Panels werden durch die RGB-Richtungsfarbkarte eingefärbt (rot: lateral-lateral, grün: anterior-posterior und blau: inferior-superior). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
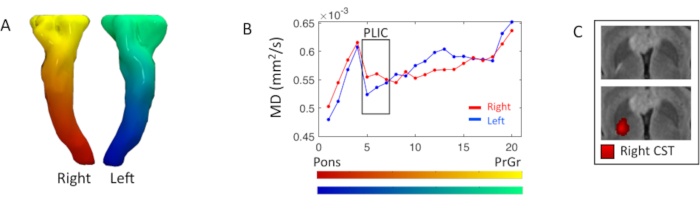
Abbildung 3. Pyramidale DTI-Messanalyse entlang des Trakts. (A) 3D-Darstellung der bilateralen Pyramidenbahnen oder des Kortikospinaltraktes (CST), gefärbt basierend auf dem Laplacian inferior-superior Segmentierungsgradienten. (B) Rechte (rote) und linke (blaue) CST-Mittelwertdiffusivitätsprofile (MD), die sich aus der Aufteilung des Trakts in zwanzig Segmente ergeben, die in den Farbkarten in A angezeigt werden; Segmente beginnen auf Höhe der Pons in Richtung des Präzentralen Gyrus (PrCr). Die Black Box hebt die Segmente an der hinteren Extremität der inneren Kapsel (PLIC) hervor(5.-7.). (C) Axiale Ansicht des FLAIR T2-gewichteten Bildes auf PLIC-Ebene, mit und ohne die richtige CST-Konnektivitätskarte, wobei eine hellere Rotintensität einer höheren Stromliniendichte entspricht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4. Intraoperative endoskopische Bilder. (A) 0° Umfang, nach duraler Öffnung wurde der Tumor zunächst durch den Chiasmus gelöst, wobei das Arachnoidal als Spaltebene angenommen wurde. (B) und (C), danach wurde es zentral debulked, und die Zyste wurde schrittweise entleert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5. Intraoperative endoskopische Bilder. (A) 0 ° Scope, das Craniopharyngiom wird von der arachnoiden Ebene mit Hilfe der Neuronavigation gespalten, die den Tumor und die neuronalen Strukturen (identifiziert nach unserem aktuellen Protokoll) zeigt. Daher können die Brustkörper geschont werden, um dauerhafte Hypothalamusschäden zu vermeiden. (B) und (C) danach war es möglich, den Tumor durch die medialen hypothalamischen Oberflächen zu resezieren, wobei jegliche Traktionen vermieden wurden, um eine solche neuronale Struktur nicht zu verletzen. (D) Bei der Entfernung des intraventrikulären Teils des Tumors wurde besonders darauf geachtet, das zerebrale Aquädukt und die Monro-Foramina wieder zu öffnen, um einen postoperativen akuten Hydrocephalus zu vermeiden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
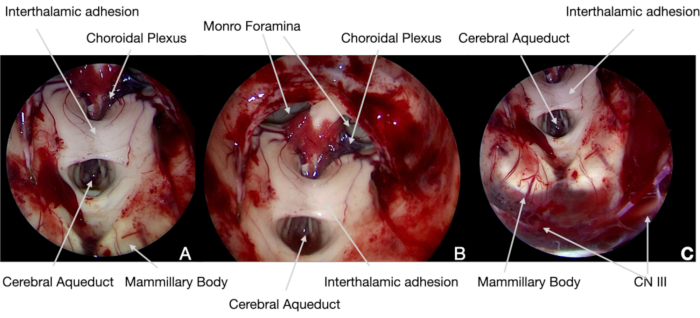
Abbildung 6. Intraoperative endoskopische Bilder. (A) und (B) 30° Umfang, am Ende der Operation wurde die neuronale Struktur des3. Ventrikels mit abgewinkelter Optik untersucht, um die vollständige Tumorentfernung zu bestätigen und seine anatomische Integrität zu demonstrieren. (C) Am unteren Rand des Operationsfeldes konnte die CN III unter der Liliequist-Membran identifiziert werden: Ihre Funktion als MDEP, SEPs und andere CNs wurde kontinuierlich durch intraoperative neurophysiologische Überwachung kontrolliert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7. Intraoperative endoskopische Bilder. (A) 0 ° Umfang, Verschluss des osteodumalen Defekts erfordert eine mehrschichtige Technik, Annahme von Duralersatz, Bauchfett, schließlich Knochen und Nasenseptumlappen. Die erste Schicht besteht aus der intrakraniellen intraduralen Positionierung der ersten Schicht eines Duralersatzes. (B) Der folgende Schritt wird durch die Platzierung von Bauchfett dargestellt, um die chirurgische Höhle zu füllen; Besondere Vorsicht ist geboten, um ein Überpacken zu vermeiden. (C) Die zweite Schicht Duralersatz wird verwendet, um das Fett zu bedecken, und sie kann dank eines starren Gerüsts als Knochen- oder Knorpelstück in Position gehalten werden (Dichtungsdichtungstechnik). (D) Schließlich wird die Nasoseptumklappe oder ein freies Transplantat aus Septum oder mittlerem Turbinat verwendet, um den mehrschichtigen Verschluss abzudecken. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8. MRT, sagittale Ansicht T1-gewichtet nach Gadolinium-Verabreichung (0,1 mm/kg). (A) Präoperative MRT zeigt den Tumor. (B) Postoperativ ist die vollständige Tumorentfernung mit der anatomischen Erhaltung der Mammillarkörper und der hypothalamischen Strukturen sichtbar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Anwendung des vorgestellten Protokolls führte zu einer sicheren und wirksamen Behandlung eines der schwierigsten intrakraniellen Tumoren wie eines Craniopharyngioms, das in den3. Ventrikel eindringt, was möglicherweise einen neuen Horizont für eine Läsion eröffnet, die von H. Cushing vor etwa einem Jahrhundert als das verblüffendste intrakranielle Neoplasma definiert wurde1. Die Kombination aus genauer präoperativer Planung, Integration fortschrittlicher MRT-Techniken und multidisziplinärer klinischer Bewertungen hat es uns ermöglicht, die chirurgische Strategie anzupassen, den am besten geeigneten chirurgischen Korridor zu identifizieren und das Risiko von Schäden an der neuronalen Struktur zu minimieren2,49,50,51. Im Gegensatz zu anderen MRT-Protokollen, über die in der Literatur berichtet wird, ermöglicht die Einbeziehung schneller Sequenzen, wie z. B. Phasenumkehrkodierungsscans für diffusionsgewichtete Bilder, erweiterte Nachbearbeitungskorrekturen52. Dieses Verfahren sollte immer gewählt werden, insbesondere bei Feldern mit hoher Intensität (z. B. 3 T oder höher), bei denen Bildverzerrungen vorhanden sind.
Darüber hinaus ermöglichte die Verwendung eines probabilistischen Traktographieansatzes, der auf einer eingeschränkten sphärischen Dekonvolution basiert, eine Steigerung der Faserrekonstruktionsqualität im Vergleich zu anderen deterministischen Traktographiemodellen53. Außerdem erhöhten das vorgeschlagene 3D-Rendering und quantitative Analysen die Genauigkeit der präoperativen Patientenbewertung. Diese Neuroimaging-Studie stellte zusammen mit der neurophysiologischen Überwachung einen Leitfaden für den Chirurgen dar und half ihm bei der Entscheidung, ob und wo die chirurgische Resektion mit dem Endziel gestoppt werden sollte, die dauerhaften neurologischen Defizite der Patienten zu vermeiden.
In der Tat wurde die aggressivste Tumorresektion für Kraniopharyngiome kürzlich schrittweise zugunsten einer hypothalamisch-schonenden Technik aufgegeben, die darin besteht, den tumoren vor jeder dauerhaften neuronalen Schädigung zu unterbrechen54. In der klinischen Standardpraxis ist es für den Neurochirurgen jedoch oft kompliziert zu entscheiden, wann die Tumorentfernung gestoppt werden soll, um die maximal sichere Resektion zu erreichen, wodurch der Patient einerseits dem Risiko ausgesetzt wird, einen Tumorrest größer als geplant zu hinterlassen oder andererseits eine dauerhafte Hypothalamusverletzung mit daraus resultierender Minderung der Lebensqualität zu verursachen.
Das vorgestellte Protokoll hat ein Modell zur Integration klinischer und neuroradiologischer Daten geliefert, das eine praktische und einfach anzuwendende Methode zur Behandlung von Hypophysen-Dienzephal- und Schädelbasistumoren bieten soll. Wir betonen jedoch, dass es einige kritische Punkte aufzeigt: die Notwendigkeit einer angemessenen Ausrüstung, wie z. B. Hochfeldmagnet (3 T), hochauflösende Kanalspule und fortschrittliche Vor- / Verarbeitungs-Imaging-Software.
Die MRT-Sequenzen im vorgestellten Protokoll sind ebenfalls mit 1,5 T akquirierbar, jedoch müssen die in Schritt 4 berichteten Erfassungsparameter modifiziert werden, um ein gutes Signal-Rausch-Verhältnis zu erreichen: Für die diffusionsgewichteten Sequenzen wird ein niedrigerer b-Wert vorgeschlagen (z.B. 1000 s/mm2). Darüber hinaus erforderte die Umsetzung der vorgeschlagenen Neuroimaging-Analysen und deren Einführung in die klinische Praxis sowohl klinische als auch MRT-technische und informatikwissenschaftliche Expertise, insbesondere für die bildgebende Verarbeitung. Der Großteil der gemeldeten Software ist frei verfügbar (z. B. FSL, MRtrix3), aber die Entwicklung von Homebrew-Pipelines ist erforderlich, um bestimmte Datensätze oder bildgebende Analysen zu verwalten.
Darüber hinaus ist der weitere kritische Punkt, dass diese Technologie zwar eine entscheidende Unterstützung für den Chirurgen darstellt, aber seine Lernkurve nicht ersetzen konnte. Aus diesen Gründen sollte diese fortgeschrittene Operation wenigen oder tertiären Überweisungszentren, hochspezialisierten und engagierten Spezialisten vorbehalten sein.
Schließlich ist das zukünftige Ziel, die Rekonstruktion von extraparenchymalen Strukturen der weißen Substanz als Hirnnerven zu verbessern. Die Traktographie dieser Strukturen ist derzeit durch die geringe Dimension der Hirnnerven und durch das Vorhandensein von Anfälligkeitsartefakten beeinträchtigt, die das MRT-Signal für das Vorhandensein von Luft und Knochen dramatisch reduzierten55.
Zusammenfassend lässt sich sagen, dass die synergistische Zusammenarbeit zwischen Neurochirurgen und dem Neuroimaging-Team für klinische und Forschungszwecke von entscheidender Bedeutung ist, da sie es ermöglicht, die effektivste chirurgische Strategie für jeden Patienten mit höchster Genauigkeit zu planen und zur Weiterentwicklung der personalisierten Medizin in diesem Bereich beizutragen.
Offenlegungen
Die Autoren haben nichts preiszugeben
Danksagungen
Wir danken den Radiologietechnikern und Pflegekräften des Bereichs Neuroradiologie, IRCCS Istituto delle Scienze Neurologiche di Bologna, und ihrer Koordinatorin Dr. Maria Grazia Crepaldi für ihre Zusammenarbeit.
Materialien
| Name | Company | Catalog Number | Comments |
| BRAF V600E-specific clone VE1 | Ventana | ||
| Dural Substitute | Biodesign, Cook Medical | ||
| Endoscope | Karl Storz, 4mm in diameter, 18 cm in length, Hopkins II – Karl Storz Endoscopy | ||
| Immunohistochemical staining instrument | Ventana Benchmark, Ventana Medical Systems | ||
| MRI | 3T Magnetom Skyra, Siemens Health Care | ||
| Neuronavigator | Stealth Station S8 Surgical Navigation System, MEDTRONIC |
Referenzen
- Wang, A. J., Zaidi, H. A., Laws, E. D. History of endonasal skull base surgery. Journal of Neurosurgical Sciences. 60 (4), 441-453 (2016).
- Kassam, A. B., Gardner, P., Snyderman, C., Mintz, A., Carrau, R. Expanded endonasal approach: fully endoscopic, completely transnasal approach to the middle third of the clivus, petrous bone, middle cranial fossa, and infratemporal fossa. Neurosurgical Focus. 19 (1), 6(2005).
- Schwartz, T. H., Morgenstern, P. F., Anand, V. K. Lessons learned in the evolution of endoscopic skull base surgery. Journal of Neurosurgery. 130 (2), 337-346 (2019).
- Cossu, G., et al. Surgical management of craniopharyngiomas in adult patients: a systematic review and consensus statement on behalf of the EANS skull base section. Acta Neurochirurgica. 162 (5), 1159-1177 (2020).
- Komotar, R. J., Starke, R. M., Raper, D. M., Anand, V. K., Schwartz, T. H. Endoscopic endonasal compared with microscopic transsphenoidal and open transcranial resection of craniopharyngiomas. World Neurosurgery. 77 (2), 329-341 (2012).
- Clark, A. J., et al. Endoscopic surgery for tuberculum sellae meningiomas: a systematic review and meta-analysis. Neurosurgical Review. 36 (3), 349-359 (2013).
- Ditzel Filho, L. F., et al. Endoscopic Endonasal Approach for Removal of Tuberculum Sellae Meningiomas. Neurosurgical Clinics of North America. 26 (3), 349(2015).
- Labidi, M., et al. Clivus chordomas: a systematic review and meta-analysis of contemporary surgical management. Journal of Neurosurgical Science. 60 (4), 476-484 (2016).
- Cannizzaro, D., et al. Microsurgical versus endoscopic trans-sphenoidal approaches for clivus chordoma: a pooled and meta-analysis. Neurosurgical Review. , (2020).
- Fujii, T., Platt, A., Zada, G. Endoscopic Endonasal Approaches to the Craniovertebral Junction: A Systematic Review of the Literature. Journal of Neurological Surgery: Part B Skull Base. 76 (6), 480-488 (2015).
- Tubbs, R. S., Demerdash, A., Rizk, E., Chapman, J. R., Oskouian, R. J. Complications of transoral and transnasal odontoidectomy: a comprehensive review. Child's Nervous System. 32 (1), 55-59 (2016).
- Zoli, M., et al. Endoscopic approaches to orbital lesions: case series and systematic literature review. Journal of Neurosurgery. 3, 1(2020).
- Jensterle, M., et al. Advances in the management of craniopharyngioma in children and adults. Radiology and Oncology. 53 (4), 388-396 (2019).
- Roque, A., Odia, Y. BRAF-V600E mutant papillary craniopharyngioma dramatically responds to combination BRAF and MEK inhibitors. CNS Oncology. 6 (2), 95-99 (2017).
- Marucci, G., et al. Targeted BRAF and CTNNB1 next-generation sequencing allows proper classification of nonadenomatous lesions of the sellar region in samples with limiting amounts of lesional cells. Pituitary. 18 (6), 905-911 (2015).
- Silva, M. A., See, A. P., Essayed, W. I., Golby, A. J., Tie, Y. Challenges and techniques for presurgical brain mapping with functional MRI. NeuroImage Clinical. 17, 794-803 (2017).
- Duffau, H. Lessons from brain mapping in surgery for low-grade glioma: insights into associations between tumor and brain plasticity. The Lancet Neurology. 4 (8), 476-486 (2005).
- Maesawa, S., et al. Evaluation of resting state networks in patients with gliomas: connectivity changes in the unaffected side and its relation to cognitive function. PloS One. 10 (2), 0118072(2015).
- Gonen, T., et al. Intra-operative multi-site stimulation: Expanding methodology for cortical brain mapping of language functions. PloS One. 12 (7), 0180740(2017).
- Pillai, J. J. The evolution of clinical functional imaging during the past 2 decades and its current impact on neurosurgical planning. American Journal of Neuroradiology. 31 (2), 219-225 (2010).
- Bizzi, A. Presurgical mapping of verbal language in brain tumors with functional MR imaging and MR tractography. Neuroimaging Clinics of North America. 19 (4), 573-596 (2009).
- Dell'Acqua, F., Tournier, J. D. Modelling white matter with spherical deconvolution: How and why. NMR in Biomedicine. 32 (4), 3945(2019).
- Maier-Hein, K. H., et al. The challenge of mapping the human connectome based on diffusion tractography. Nature Communications. 8 (1), 1349(2017).
- Costabile, J. D., Alaswad, E., D'Souza, S., Thompson, J. A., Ormond, D. R. Current Applications of Diffusion Tensor Imaging and Tractography in Intracranial Tumor Resection. Frontiers in Oncology. 9, 426(2019).
- Jacquesson, T., et al. Full tractography for detecting the position of cranial nerves in preoperative planning for skull base surgery: technical note. Journal of Neurosurgery. , 1-11 (2019).
- Zolal, A., et al. Comparison of probabilistic and deterministic fiber tracking of cranial nerves. Journal of Neurosurgery. 127 (3), 613-621 (2017).
- Ung, N., et al. A Systematic Analysis of the Reliability of Diffusion Tensor Imaging Tractography for Facial Nerve Imaging in Patients with Vestibular Schwannoma. Journal of Neurological Part B Skull Base. 77 (4), 314-318 (2016).
- Anik, I., et al. Visual Outcome of an Endoscopic Endonasal Transsphenoidal Approach in Pituitary Macroadenomas: Quantitative Assessment with Diffusion Tensor Imaging Early and Long-Term Results. World Neurosurgery. 12, 691-701 (2018).
- Oldfield, R. C. The assessment and analysis of handedness: the Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Yushkevich, P. A., et al. User-Guided Segmentation of Multi-modality Medical Imaging Datasets with ITK-SNAP. Neuroinformatics. 17 (1), 83-102 (2019).
- Tournier, J. D., Calamante, F., Connelly, A. Robust determination of the fibre orientation distribution in diffusion MRI: non-negativity constrained super-resolved spherical deconvolution. NeuroImage. 35 (4), 1459-1472 (2007).
- Mormina, E., et al. Optic radiations evaluation in patients affected by high-grade gliomas: a side-by-side constrained spherical deconvolution and diffusion tensor imaging study. Neuroradiology. 58 (11), 1067-1075 (2016).
- Hales, P. W., et al. Delineation of the visual pathway in paediatric optic pathway glioma patients using probabilistic tractography, and correlations with visual acuity. Neuroimage Clinical. 11 (17), 541-548 (2017).
- Testa, C., et al. The effect of diffusion gradient direction number on corticospinal tractography in the human brain: an along-tract analysis. Magma. 30 (3), 265-280 (2017).
- Talozzi, L., et al. Along-tract analysis of the arcuate fasciculus using the Laplacian operator to evaluate different tractography methods. Magnetic Resonance Imaging. 54, 183-193 (2018).
- Zoli, M., et al. Postoperative outcome of body core temperature rhythm and sleep-wake cycle in third ventricle craniopharyngiomas. Neurosurgical Focus. 41 (6), 12(2016).
- Foschi, M., et al. Site and type of craniopharyngiomas impact differently on 24-hour circadian rhythms and surgical outcome. A neurophysiological evaluation. Autonomic Neuroscience. 208, 126-130 (2017).
- Mojón, A., Fernández, J. R., Hermida, R. C. Chronolab: an interactive software package for chronobiologic time series analysis written for the Macintosh computer. Chronobiology International. 9 (6), 403-412 (1992).
- Hardesty, D. A., Montaser, A. S., Beer-Furlan, A., Carrau, R. L., Prevedello, D. M. Limits of endoscopic endonasal surgery for III ventricle craniopharyngiomas. Journal of Neurosurgical Sciences. 62 (3), 310-321 (2018).
- Lee, W. H., et al. Effect of Dexmedetomidine Combined Anesthesia on Motor evoked Potentials During Brain Tumor Surgery. World Neurosurgery. 123, 280-287 (2019).
- Barazi, S. A., et al. Extended endoscopic transplanum-transtuberculum approach for pituitary adenomas. British Journal of Neurosurgery. 27 (3), 374-382 (2013).
- Singh, H., et al. Intraoperative Neurophysiological Monitoring for Endoscopic Endonasal Approaches to the Skull Base: A Technical Guide. Scientifica. , 1751245(2016).
- Mazzatenta, D., et al. Outcome of Endoscopic Endonasal Surgery in Pediatric Craniopharyngiomas. World Neurosurgery. 134, 277-288 (2020).
- Milanese, L., et al. Antibiotic Prophylaxis in Endoscopic Endonasal Pituitary and Skull Base Surgery. World Neurosurgery. 106, 912-918 (2017).
- Hadad, G., et al. A novel reconstructive technique after endoscopic expanded endonasal approaches: vascular pedicle nasoseptal flap. Laryngoscope. 116 (10), 1882-1886 (2006).
- Zoli, M., et al. Cavernous sinus invasion by pituitary adenomas: role of endoscopic endonasal surgery. Journal of Neurosurgical Sciences. 60 (4), 485-494 (2016).
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Coury, J. R., Davis, B. N., Koumas, C. P., Manzano, G. S., Dehdashti, A. R. Histopathological and molecular predictors of growth patterns and recurrence in craniopharyngiomas: a systematic review. Neurosurgical Review. 43 (1), 41-48 (2020).
- Prieto, R., et al. Craniopharyngioma adherence: a comprehensive topographical categorization and outcome-related risk stratification model based on the methodical examination of 500 tumors. Neurosurgical Focus. 41 (6), 13(2016).
- Cagnazzo, F., Zoli, M., Mazzatenta, D., Gompel, J. J. V. Endoscopic and Microscopic Transsphenoidal Surgery of Craniopharyngiomas: A Systematic Review of Surgical Outcomes Over Two Decades. Journal of Neurological Surgery: part A Central European Neurosurgery. 79 (3), 247-256 (2018).
- Cavallo, L. M., et al. The endoscopic endonasal approach for the management of craniopharyngiomas: a series of 103 patients. Journal of Neurosurgery. 121, 100-113 (2014).
- Andersson, J. L., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. Neuroimage. 20 (2), 870-888 (2003).
- Castellano, A., Cirillo, S., Bello, L., Riva, M., Falini, A. Functional MRI for Surgery of Gliomas. Current Treatment Options in Neurology. 19 (10), 34(2017).
- Elowe-Gruau, E., et al. Childhood craniopharyngioma: hypothalamus-sparing surgery decreases the risk of obesity. Journal of Clinical Endocrinology and Metabolism. 98 (6), 2376-2382 (2013).
- Jacquesson, T., et al. Overcoming Challenges of Cranial Nerve Tractography: A Targeted Review. Neurosurgery. 84 (2), 313-325 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten