Method Article
Роль диффузионной МРТ-трактографии в эндоскопической хирургии основания эндоназального черепа
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы представляем протокол для интеграции диффузионной МРТ-трактографии в работу пациента до эндоскопической эндоназальной хирургии опухоли основания черепа. Описаны методы внедрения этих исследований нейровизуализации в пред- и интраоперационной фазах.
Аннотация
Эндоскопическая эндоназальная хирургия приобрела заметную роль в лечении сложных опухолей основания черепа. Он позволяет резекцию большой группы доброкачественных и злокачественных поражений через естественный анатомический внекраниальный путь, представленный носовыми полостями, избегая втягивания мозга и нейрососудистых манипуляций. Это отражается в быстром клиническом выздоровлении пациентов и низком риске постоянных неврологических последствий, что является основным предостережием обычной хирургии основания черепа. Эта операция должна быть адаптирована к каждому конкретному случаю, учитывая ее особенности и отношения с окружающими нервными структурами, в основном основанными на предоперационной нейровизуализации. Передовые методы МРТ, такие как трактография, редко используются в хирургии основания черепа из-за технических проблем: длительных и сложных процессов для создания надежных реконструкций для включения в систему нейронавигации.
Эта статья направлена на представление протокола, реализованного в учреждении, и подчеркивает синергетическое сотрудничество и командную работу между нейрохирургами и командой нейровизуализации (неврологи, нейрорадиологи, нейропсихологи, физики и биоинженеры) с конечной целью выбора оптимального лечения для каждого пациента, улучшения хирургических результатов и продвижения персонализированной медицины в этой области.
Введение
Возможность приблизиться к основанию черепа по средней линии и парамедиальным областям по переднему пути, приняв носовые ямки в качестве естественных полостей, имеет долгую историю, насчитывающую более одного века1. Однако за последние 20 лет технологии визуализации и оперативной деятельности достаточно улучшились, чтобы расширить их возможности включения в лечение наиболее сложных опухолей, таких как менингиомы, хордомы, хондросаркомы и краниофарингиомы1 благодаря (1) введению эндоскопа, который дает хирургу панорамный и подробный 2D/3D вид этих областей, (2) разработка интраоперационных нейронавигационных систем и (3) внедрение специализированных хирургических инструментов. Как кропотливо продемонстрировано Kassam et al. и подтверждено многочисленными обзорами и мета-анализами, преимущества этого хирургического подхода в основном представлены его шансами на резекцию сложных опухолей основания черепа, избегая любого прямого втягивания мозга или нервных манипуляций, тем самым снижая риск хирургических осложнений и долгосрочных неврологических и визуальных последствий2,3,4, 5,6,7,8,9,10,11,12.
Для множественных оснований черепа и гипофизарно-диэнцефальных опухолей идеальная хирургическая цель изменилась в последние годы от самого обширного удаления опухоли до самого безопасного удаления с сохранением неврологических функций для сохранения качества жизни пациента3. Это ограничение может быть компенсировано инновационными и эффективными вспомогательными методами лечения, такими как лучевая терапия (принятие массивных частиц, таких как протоны или ионы углерода, когда это необходимо) и, для выбранных новообразований, химиотерапией в качестве ингибиторов пути BRAF / MEK для краниофарингиом13,14,15.
Однако для достижения этих целей крайне важна тщательная предоперационная оценка, чтобы адаптировать хирургическую стратегию к конкретной особенности каждого случая2. В большинстве центров предоперационный протокол МРТ обычно выполняется только со стандартными структурными последовательностями, которые обеспечивают морфологическую характеристику поражения. Однако с помощью этих методик не всегда можно достоверно оценить анатомическую связь опухоли со смежными структурами3. Кроме того, у каждого пациента могут присутствовать различные профили функциональной реорганизации, вызванные патологией, которые можно обнаружить только с помощью диффузионной МРТ-трактографии и функциональной МРТ (фМРТ), которые могут быть использованы для обеспечения руководства как при планировании операции, так и на интраоперационных этапах16,17.
В настоящее время фМРТ является наиболее часто используемым методом нейровизуализации для картирования функциональной активности и связности мозга в качестве руководства для хирургического планирования18,19 и для улучшения исхода пациентов20. ФМРТ на основе задач является модальностью выбора для выявления «красноречивых» областей мозга, которые функционально участвуют в выполнении конкретной задачи (например, постукивание пальцем, фонематическая беглость), но не применимы для изучения опухолей основания черепа.
Диффузионная МРТ-трактография позволяет in vivo и неинвазивно реконструировать соединения белого вещества мозга, а также черепные нервы, исследуя ходологическую структуру мозга21. Различные алгоритмы трактографии были разработаны для реконструкции аксональных путей путем связывания профилей диффузии молекул воды, оцениваемых в каждом вокселе мозга. Детерминированная трактография следует направлению доминирующей диффузии, тогда как вероятностная трактография оценивает возможное распределение связности путей. Кроме того, для оценки диффузионной способности в пределах каждого вокселя могут применяться различные модели, и можно определить две основные категории: модели с одним волокном, такие как модель диффузионного тензора, где оценивается ориентация одного волокна, и модели с несколькими волокнами, такие как сферическая деконволюция, где реконструируются несколько ориентаций кросс-волокна22,23. Несмотря на методологические дебаты о диффузионной трактографии МРТ, ее полезность в нейрохирургическом рабочем процессе в настоящее время установлена. Можно оценить дислокацию тракта белого вещества и расстояние до опухоли, сохраняя специфические связи белого вещества. Кроме того, карты диффузионной тензорной визуализации (DTI), особенно фракционной анизотропии (FA) и средней диффузии (MD), могут быть применены для оценки микроструктурных изменений белого вещества, связанных с возможной инфильтрацией опухоли, и для мониторинга продольных путей. Все эти особенности делают диффузионную МРТ-трактографию мощным инструментом как для предоперационного планирования, так и для интраоперационного принятия решений с помощью нейронавигационных систем24.
Однако применение методов трактографии к хирургии основания черепа было ограничено потребностью в специализированных технических знаниях и трудоемкой работе по оптимизации сбора последовательностей диффузионной МРТ, протокола анализа и включения результатов трактографии в системы нейронавигации25. Наконец, дальнейшие ограничения связаны с техническими трудностями, распространяющими эти анализы от внутрипаренхимальных до экстра-паренхимальных структур белого вещества, таких как черепные нервы. Действительно, только недавние исследования представили предварительные результаты, пытающиеся интегрировать передовую МРТ и хирургию основания черепа26,27,28.
В настоящей работе представлен протокол многодисциплинарного лечения гипофизарно-диэнцефальных опухолей и опухолей основания черепа с использованием диффузионной МРТ-трактографии. Внедрение этого протокола в учреждении стало результатом сотрудничества между нейрохирургами, нейроэндокринологами и командой нейровизуализации (включая клиническую и биоинформатику), чтобы предложить эффективный интегрированный многоосевой подход к этим пациентам.
В центре мы интегрировали междисциплинарные протоколы для лечения пациентов с опухолями основания черепа, чтобы обеспечить максимально информативное описание, а также адаптировать и персонализировать хирургический план. Мы показываем, что этот протокол может быть принят как в клинических, так и в исследовательских условиях для любого пациента с опухолью основания черепа, чтобы направлять стратегию лечения и улучшать знания о модификациях мозга, вызванных этими поражениями.
протокол
Протокол соответствует этическим стандартам Местного исследовательского комитета и Хельсинкской декларации 1964 года и ее последующим поправкам или сопоставимым этическим стандартам.
1. Подбор пациентов
- Примите следующие критерии включения: пациенты старше 18 лет, полностью сотрудничающие, представляющие опухоль основания черепа или гипофизарно-диэнцефальной области.
- Исключить пациентов с противопоказанием к МРТ (т.е. кардиостимулятором или ферромагнитным материалом) или с возникающими клиническими состояниями (т.е. внутричерепной гипертензией, острой потерей зрения, требующей немедленного хирургического вмешательства), или беременных женщин, или пациентов с психическими заболеваниями, или тех, кто явно отказывается от участия в этом протоколе.
2. Подготовка к МРТ-обследованию
- Перед МРТ-обследованием ввести форму безопасности, чтобы исключить существенные противопоказания к обследованию и инъекции контрастного вещества: отсутствие ферромагнитных материалов в организме, оценка аппаратов МРТ, безопасная или условная, отсутствие кардиостимулятора, отсутствие глазных контактных линз.
- Если сканер, используемый для получения МРТ, является высокопольным (например, 3 Тл, см. Таблицу материалов),рассмотрите любые потенциальные дополнительные противопоказания, связанные, например, с устройствами нейростимуляции.
- Проверьте, есть ли у пациента клаустрофобия.
- Убедитесь, что пациент прочитал и подписал форму согласия на МРТ, чтобы признать риски и преимущества обследования.
- Попросить нейропсихолога выполнить общую оценку и целевую нейрокогнитивную оценку на основе расположения опухоли.
- Администрирование эдинбургского инвентаря для оценки доминирования рук29.
3. Позиционирование пациента в сканере
- Дайте беруши пациенту, чтобы уменьшить шум МРТ.
- Движения головы могут повлиять на качество изображения; таким образом, используйте поролоновые прокладки для уменьшения движений головы, обездвиживая голову внутри катушки МРТ.
- Предоставьте экстренную тревожную кнопку пациенту в случае необходимости прервать обследование.
- Включите камеру и микрофон внутри сканера, чтобы контролировать, говорить и слушать пациента из комнаты сбора МРТ за пределами сканера.
4. Настройка и получение параметров протокола МРТ головного мозга
- Приобретите стандартизированный мультимодальный сканер высокого поля по протоколу МРТ (1,5 Т или 3 Тл). Следующие параметры последовательности относятся к МРТ 3 Т с использованием катушки массива высокой плотности «голова-шея» (64 канала).
- Приобретайте анатомические последовательности высокого разрешения и объемные анатомические последовательности: T1-взвешенное пре- и постгадолиний контрастное вещество и FLAIR T2-взвешенное.
- Для Т1 и Т2 взвешенные изображения получают непрерывные сагиттальные срезы, обеспечивающие изотропное разрешение 1x1x1мм3 время сканирования около 5 мин на последовательность.
- Получить Т2-взвешенную последовательность высокого разрешения и локализовать область опухоли для визуализации черепного нерва: объемный CISS (Constructive Interference in Steady State) с размером вокселя 0,5x0,5x0,5мм3 (время сканирования около 9 минут).
- Получение диффузионно-взвешенных последовательностей с использованием однокастровых эхо-планарных изображений (EPI), воксельных размеров 2x2x2 мм3,64 направлений магнитного градиента со значением b 2000с/мм2,временем эха 98 мс и временем релаксации 4300 мс.
- Получите пять томов с нулевым b-значением в начале диффузионно-взвешенного захвата с направлением фазового кодирования, заданным на передне-заднее (для диффузионно-взвешенных изображений общее время сканирования 5 минут).
- Кроме того, приобретите три тома с нулевым b-значением, но обратным направлением кодирования фазы, задним-передним, чтобы исправить искажения изображения из-за получения EPI (время сканирования 42 секунды). Приобретаются сплошные околоосевые срезы.
- Приобретите дополнительные последовательности для исследования специфических особенностей опухоли, таких как мульти- или одновоксельная МРТ-спектроскопия, локализованная в области опухоли.
ПРИМЕЧАНИЕ: Общая продолжительность сканирования составляет около 30 минут, исключая подготовку пациента к МРТ-обследованию.
5. Предварительная обработка изображений МРТ мозга
- Преобразуйте данные МРТ из формата визуализации, принятого консолями сбора МРТ, DICOM (.dcm), в формат NIFTI (.nii), используемый в расширенном анализе изображений.
- Запустите функцию dcm2niix (https://github.com/rordenlab/dcm2niix). Установите в качестве входных файлов dicom изображения и в качестве выходных соответствующие файлы .nii: T1.nii, Flair.nii, T1_contrast.nii, DTI_b2000.nii и DTI_b0_flip.nii.
- Установите программное обеспечение FSL (https://fsl.fmrib.ox.ac.uk/fsl/fslwiki) и MRtrix3 (https://www.mrtrix.org), необходимое для расширенного анализа изображений.
- Зарегистрируйте Flair.nii и T1_contrast.nii в образе T1.nii, запустив функцию FSL-flirt, которая выполняет линейную регистрацию изображения.
- Зарегистрируйте изображение DTI_b2000.nii в T1.nii, запустив функцию FSL-epi_reg, которая учитывает артефакты искажения изображений EPI.
- Запустите функцию FSL-topup, чтобы исправить артефакты направления фазового кодирования, представляющие образ DTI_b2000.nii. Задайте получение обратной фазовой кодировки DTI_b0_flip.nii в качестве входного файла «in_main».
- Запустите функцию MRtrix3-dwidenoise для шумоподавления изображений с помощью моделирования шума основного компонента.
- Чтобы исправить вихреток и артефакт выпадения сигнала, запустите функцию FSL-eddy, а для неоднородностей сигнала, индуцированного катушкой МРТ, правильную функцию MRtrix3-dwibias.
- Запустите функцию FSL-bet, чтобы удалить сигнал скальпа, представляющий изображение T1.nii, и переименуйте выходной файл с помощью суффикса «_brain»: T1_brain.nii.
6. Сегментация опухоли
- Установите программное обеспечение itk-snap (http://www.itksnap.org) 30.
- После установки программного обеспечения itk-snap нажмите Файл - Открыть основное изображение и выберите изображение T1.nii, затем нажмите Файл - Добавить другой имиджер и загрузите изображения Flair.nii и T1_contrast.nii, установив полупрозрачную опцию наложения.
- Осмотрите опухоль на снимках T1.nii, Flair.nii и T1_contrast.nii. Выберите анатомическую плоскость, которую нужно соблюдать при рисовании поражения, например, осевую.
- Поместите указатель в один осевой фрагмент для начала. На главной панели инструментовщелкните значок Инспектор полигонов и начните рисовать границы опухолей с помощью стиля рисования от руки — сглаженная кривая или полигон.
- После завершения рисования периметра опухоли закройте кривую, связывающую первую и последнюю точки, нажмите Accept, и продолжите рисование в следующем фрагменте. Для больших опухолевых поражений, чтобы ускорить процесс рисования, пропустите несколько осевых срезов (например, три) и нарисуйте периметр поражения чередуемыми срезами.
- В конце рисунка периметра поражения выберите Инструменты - Интерполировать метки, установите Метку на/с интерполяцией в качестве поражения опухоли и Интерполяцию вдоль одной оси в качестве ориентации оси, следуя при рисовании границ опухоли.
- Выберите Сегментация - Сохранить изображение сегментации и назовите сегментацию опухоли как Tumor_mask.nii, выбрав параметр формата Nifti для сохранения.
7. Трактографический анализ
- Запустите функцию FSL-dtifit для моделирования диффузионности и различных пространственных направлений и получите следующие тензорные карты диффузии: FA.nii, MD.nii и V1.nii. Оцените эти карты DTI для доступа к аномальным значениям диффузионной диффузии, которые могут возникать при наличии опухолевого отека или инфильтрации.
- Запустите функцию MRtrix3-tckgen с настройкой по умолчанию «ifod2» для выполнения вероятностной трактографии и реконструкции путей белого вещества путем моделирования проблем пересечения волокон31.
- Принять подход, основанный на посевных показателях, установив варианты «-seed_image» и «-include», основанные на априорных анатомических знаниях.
- Вручную рисуйте интересующих областей (ROI), заданных в качестве начального или целевого для трактографии. В качестве альтернативы можно использовать ROI на основе атласа. См. Мормина и др. 32 для трактографии оптического излучения, Hales et al.33 для зрительного хиазма и зрительных черепных нервов и Testa et al.34 для пирамидных трактов.
- Запустите средство просмотра изображений FSL-fsleyes, выберите Открытьи выберите изображения для визуального просмотра.
- В средстве просмотра FSL-fsleyes перейдите в настройку Настройка - Ortho View 1 и активируйте инструмент Режим редактирования.
- Щелкните значок карандаша FSL-fsleyes и нарисуйте рентабельность инвестиций в трактографию.
- Установите программное обеспечение Freesurfer (https://surfer.nmr.mgh.harvard.edu).
- Запустите функцию Freesurfer-Recon-all на изображении T1.nii, чтобы получить автоматическую сегментацию кортикальной области для использования в качестве ROI трактографии.
- Запустите функцию FSL-epi_regregistration, установив в качестве входного изображения T1.nii, а ссылочный образ DTI_b2000.nii, сохраните матрицу вывода регистрации (T1_onto_DTI.mat).
- Используйте полученную матрицу T1_onto_DTI.mat для регистрации сегментированных ROI в образе DTI_b2000.nii.
- Запустите трактографию с помощью функции MRtrix3-tckgen.
- Запустите функцию MRtrix3-tckmap, чтобы преобразовать вывод трактографии ".tck" в изображение "-template FA.nii".
- Запустите функцию FSL-flirt, чтобы линейно зарегистрировать изображение T1.nii в шаблоне MNI152_T1_2mm_brain.nii.
- Сохраните выходную матрицу как T1_onto_MNI.mat. Запустите функцию FSL-convert_xfm, установив параметр "-concat" как T1_onto_MNI.mat и T1_onto_DTI.mat, сохраните выходную матрицу как DTI_onto_MNI.mat.
8. Трактография: анализ по урочищам
- Для точного описания параметров DTI используйте алгоритмы вдоль тракта, такие как алгоритм на основе Matlab, который моделирует геометрию поверхностного тракта со свойствами оператора Лапласа35.
- Установите программное обеспечение Matlab (https://matlab.mathworks.com) и запросите код вдоль тракта авторам-разработчикам35.
- Кроме того, можно использовать функцию MRtrix3-tcksample для анализа вдоль тракта, поскольку Matlab требует лицензии.
Визуализация рендеринга 9.3D
- Установите программное обеспечение Surf Ice (https://www.nitrc.org/plugins/mwiki/index.php/surfice:MainPage).
- В панели команд Surf Ice нажмите «Дополнительно» - «Конвертировать воксель в сетку»,выберите изображение nifti для преобразования, сохраните полученный файл .obj.
- На панели команд Surf Ice нажмите кнопку Файл - Открытьи выберите OBJ-файл, чтобы визуализировать 3D-рендеринг тома.
10. Предоперационные клинические обследования
- Выполняют биогуморальную эндокринологическую оценку, состоящую из пролактина, ТТГ, фриТ4, АКТГ, кортизола, ГР, ЛГ, ФСГ и сывороточных тестов на общий тестостерон/эстрадиол соответственно у мужчин и женщин.
- Проанализируйте 24-часовой объем мочи и осмоляльность сыворотки и мочи и уровень натрия, чтобы определить наличие несахарного диабета.
- Выполните офтальмологическую оценку, включая измерение остроты зрения, компьютерную оценку поля зрения и оптическую когерентную томографию сетчатки (ОКТ).
- Провести неврологическое физическое обследование, со сбором анамнестических сведений о наборе веса, ощущении голода, непрерывно контролировать ректальную температуру каждые 2 мин в течение 24 ч с помощью портативного устройства для оценки циркадного температурного ритма и записью цикла сна-бодрствования 24 ч (включая электроэнцефалограмму, правую и левую электроокулограмму, электрокардиограмму и электромиограмму милогиоидной и левой и правой большеберцовых мышц)36, 37,38.
11. Хирургическое планирование
- Обсудить в коллегиальной команде встречу каждого пациента-кандидата на операцию, основываясь на результатах сегментации опухоли и взаимосвязи с функциональными красноречивой нервной структурой (зрительные нервы и хиазм, стебель гипофиза, третий желудочек, внутренняя сонная артерия, передняя мозговая артерия-передняя сообщаемая артерия (ACA-ACoA), базилярная артерия, черепные нервы III, IV, VI, маммиллярные тела, тракты белого вещества, и функциональные коркообразные участки) для определения наиболее подходящего хирургического подхода.
- Выберите хирургический коридор с минимальным риском травм нервных структур39.
- Определите безопасную область резекции для каждого случая, локализовав критическую нейронную структуру (например, хиазм, маммиллярное тело), при приближении которой резекция должна быть остановлена, чтобы избежать необратимого повреждения39.
- Объедините наиболее релевантные последовательности МРТ и импортируйте их в систему нейронавигации операционной фазы.
12. Подготовка к операции
- Индуцировать общую анестезию, принимая тотальную внутривенную анестезию пропофолом и ремифентанилом (было продемонстрировано, что другие анестетики являются одними из наиболее критических факторов, влияющих на надежность интраоперационного мониторинга, увеличивая ложноотрицательную частоту), избегая миорелаксанта40.
- Выполняют оро-трахеальную интубацию марлей в ротоглотке для предотвращения утечки крови или жидкости в желудке или дыхательных путях41.
- Настройка нейрофизиологического мониторинга с непрерывной регистрацией двигательных вызванных потенциалов (MEP) и соматосенсорных вызванных потенциалов (SEPs) и свободно работающей электромиографии (EMG) для черепных нервов.42
- Импорт данных МРТ, включая реконструкции трактографии, в систему нейронавигации(Таблица материалов).
- Выберите метод электромагнитной регистрации операции головного мозга в системе нейронавигации.
- Зарегистрируйте систему нейронавигации на пациенте, приняв технику свободного отслеживания или внешние маркеры.
- Контролировать точность достигнутой регистрации, проверяя положение внешних маркеров (т.е. уха или носа) на импортируемой МРТ; если результат не приемлем, повторите регистрацию.
- Поместите больного в полусидячее положение; Использование Мэйфилда для фиксации головы не нужно43.
- Назначают кортикостероиды (эндовенозные флебокортиды, дозировка в зависимости от веса пациента) и антибиотики (2 г амоксициллин-клавулановой кислоты)44.
13. Эндоскопическая эндоназальная хирургия
- Начните с эндоскопа 0°(Таблица материалов).
- Заготавливают назо-септальный клапан45.
- Выполняют переднюю сфеноидотомию с последующей задней септостомией и этмоидэктомию с сохранением средней носовой части, по возможности43.
- Открывают селлар и туберкулезную кость41.
- Разрезать слой твердой мозговой оболочки с Н-образной формой, после коагуляции верхнего межкаменного синуса41.
- Расщепление опухоли арахноидальной плоскостью43.
- Централизованно дебулько опухоль43.
- Удалить его капсулу из окружающих диэнцефальных нервных структур, остановку резекции в случае адгезии опухоли к красноречивым структурам, визуализируемым под руководством нейронавигации43.
- Исследуйте хирургическую полость с угловой оптикой (Таблица материалов)46.
- Обеспечить гемостаз с помощью биполярной коагуляции или гемостатических средств.
- Закройте остеоменингеальное отверстие внутридуральным внутричерепным слоем дурального заменителя43.
- Поместите экстрадуральный внутричерепной слой дурального заменителя, покрытый брюшным жиром и в конечном итоге костью(Таблица материалов)43.
- Накройте застежку назо-перегородчатой заслонкой43.
14. Гистологическое исследование
- Зафиксируйте образцы опухолей 10% формалином и встройте их в парафин сразу после операции.
- Разрезать ткань на участки толщиной 4 мкм и окрашивать гематоксилином и эозином. Гистологический диагноз должен основываться на самой последней версии классификации опухолей головного мозга ВОЗ (2016)47.
- Выполняйте иммуногистохимическое окрашивание образцов с помощью автоматизированного иммуногистохимического окрашивающего инструмента, используя маркировку авидин-биотин и диаминобензидин в качестве реагента обнаружения. Для краниофарингиомы примите анти-бета-катенин, анти-BRAF v600E мутантный эпитоп и анти-Ki67 антитела для иммуногистохимического окрашивания(Таблица материалов).
- Оцените индекс Ki-67 с помощью ручного подсчета положительных опухолевых клеток48.
15. Послеоперационное ведение пациентов
- Разбудить пациента сразу после операции.
- Восстановить спонтанное дыхание изо рта, заполнив носовые полости рассасывающимся и нерассасывающимся материалом.
- Контролировать жизненно важные параметры (артериальное давление, частоту сердечных сокращений, насыщение кислородом и состояние сознания) в течение следующих 6-12 часов в отделении интенсивной терапии.
- Восстановить пероральное питание через 12 часов.
- Выполните компьютерную томографию через 6-9 часов.
- Поддерживайте постельный режим в течение трех дней с помощью лечения гепарином.
- Контролируйте баланс жидкости каждые 12 часов и оценивайте сывороточные электролиты каждые 24 часа.
- Назначают кортикостероидную терапию (эндовенозный флебокортид в первые 24 часа, а затем перорально кортона ацетат 30 +15 мг/сут).
- Выполните МРТ с/без гадолиния в течение 72 часов после операции.
- Выписывают больного на4-й день.
16. Раннее наблюдение
- Повторите полную эндокринологическую оценку через 30 дней после операции43.
- Повторить офтальмологическую оценку через три месяца после операции43.
- Повторите неврологическое физическое обследование и исследования функции температуры и ритмов сна-бодрствования через три месяца после операции46.
- Выполните МРТ с/без гадолиния через три месяца после операции46.
17. Адъювантная терапия
- Оценить наличие ранней опухолевой прогрессии, и если она показана, направить пациента на лучевуютерапию 43.
18. Долгосрочное наблюдение
- Повторяйте клинические, эндокринологические и офтальмологические оценки ежегодно43раза.
- Выполнять ежегодную МРТ с/без гадолиния: в случае рецидива пациента можно повторно оперировать, а затем направить на лучевую терапию или непосредственно направить на лучевую терапию43.
Результаты
У 55-летней женщины прогрессирующий дефицит зрения. Ее история болезни была ничем не примечательна. При офтальмологической оценке было выявлено двустороннее снижение остроты зрения (6/10 в правом глазу и 8/10 в левом глазу), а компьютеризированное поле зрения показало полную гемианопию. При неврологическом обследовании дальнейших дефицитов не наблюдалось, но пациент сообщал о стойкой астении и усилении чувства голода и жажды в предыдущие 2-3 месяца, с увеличением веса на 4-5 кг и частыми пробуждениями ночью из-за необходимости мочеиспускания. При эндокринологической оценке выявлены центральный гиперкортицизм и несахарный диабет. Пациента лечили кортикостероидами (гидрокортизон 30+15 мг/сут и десмопрессин 30+30 мкг/сут). На 24-часовом цикле сна-бодрствования и мониторинге температуры после оптимизации гормональной заместительной терапии не было замечено никаких существенных изменений.
МРТ головного мозга продемонстрировала надбеллярную опухоль, занимающая опто-хиазматическую цистерну и вторгающуюся в 3-й желудочек, с нерегулярной поликистозной морфологией, усиливающейся после гадолиния, подозреваемой как первая гипотеза для краниофарингиомы(рисунок 1A-C). Были проведены расширенные анализы изображений, как показано в текущем протоколе. Сегментация ядра опухоли выделяла поглощение гадолиния и соответствовала объему 7,92см3 (рисунок 1D-E).
Зрительные пути были наиболее важными для оценки при предоперационном планировании этого пациента. Пирамидальные тракты также были реконструированы для оценки микроструктурного коррелята увеличения сигнала, обнаруженного на взвешенном по FLAIR T2 изображении на уровне правого тракта.
Исследована реконструкция трактографии зрительного пути, в частности вывих хиазма зрительного нерва в присутствии опухолевой массы. Также были реконструированы двусторонние зрительные черепно-мозговые нервы. В интерфейсе между мозгом, костями и кровеносными сосудами артефакты восприимчивости не позволяли провести полную реконструкцию волокон, соединяющих зрительный хиазм с зрительными нервами(рисунок 2).
Исследован профиль диффузности пирамидных трактов с помощью статистики карты ДТИ по урочищам. На уровне правой задней конечности внутренней капсулы присутствовала фокальная гиперинтензия, взвешенная по Т2-ти ФЭР, соответствующая увеличению на 5% правого показателя МД (5-7-й сегменты) по сравнению с левой стороной(рисунок 3).
Рассматривая такие взаимосвязи между опухолевыми и нервными структурами, был выбран эндоскопический эндоназальный расширенный подход трансплантата/транстуберкуля36. Удаление опухоли проводилось микрохирургической техникой двумя руками. Первоначально опухоль была централизованно обестойлена, также дренируя ее кистозный компонент(рисунок 4). После этого удалось постепенно отсоединить краниофарингиому от нейронных структур, приняв арахноид в качестве плоскости расщепления(рисунок 5). В конце операции было достигнуто полное удаление опухоли с анатомической сохранностью гипоталамуса(рисунок 6). Восстановление костно-дурального дефекта проводили абдоминальным жиром и назо-перегородчатым лоскутом(рисунок 7).
Послеоперационное течение прошло без каких-то событий, и пациент был выписан через четыре дня в правильных клинических условиях. Опухоль оказалась адамантиноматозной краниофарингиомой (ВОЗ 1 степени) при гистологическом исследовании.
У пациента развился полный пангипопитуитаризм при последующем наблюдение и он находился под полной заместительной терапией гидрокортизоном, десмопрессином и левотироксином. Зрительный дефицит полностью регрессировал, и никаких изменений при неврологическом обследовании, 24-ч цикле сна-бодрствования и контроле температуры обнаружено не было. Три месяца МРТ головного мозга продемонстрировали полное удаление опухоли без остатков или рецидивов. Поэтому не было рекомендовано адъювантное лечение, и пациент проходит ежегодные клинические и нейрорадиологические обследования(рисунок 8).

Рисунок 1. Предоперационные анатомические последовательности МРТ (F/55 лет). Осевой вид Т1-взвешенного(А)и FLAIR Т2-взвешенного(В); осевой(C, D)и сагиттальный(E)T1- после введения гадолиния (0,1 мм/кг). Сегментация опухоли (красная), наложенная на изображение, усиленное гадолинием Т1, показано в D и E. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2. Предоперационный 3D-рендеринг трактографии зрительных путей и сегментации опухоли. (A)Осевой срез взвешенного изображения FLAIR T2 накладывается на оптическую хиазмовую трактографию, локализованную с передней частью опухоли. (B) 3D объемный рендеринг FLAIR T2-взвешенного изображения, выбор осевой плоскости и наложение трактатографии оптических путей. (C) 3D-объемный рендеринг поверхности мозга, трактография оптических путей и сегментация опухоли красным цветом. Все обтекаемые трактографии панелей окрашены цветовой картой направленности RGB (красный: боковой-латеральный, зеленый: передний-задний и синий: нижний-верхний). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
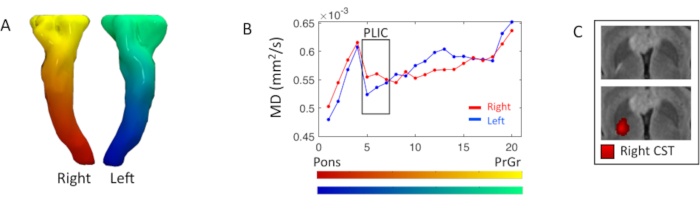
Рисунок 3. Анализ пирамидальных продольных измерений ДТИ. (A)3D-рендеринг двусторонних пирамидных трактов или кортикоспинального тракта (CST), окрашенный на основе лапласовского нижне-верхнего сегментации градиента. (B)правый (красный) и левый (синий) профили средней диффузии CST (MD), полученные в результате разделения тракта на двадцать сегментов, отображаемых на цветовых картах в A; сегменты начинаются на уровне понсов по направлению к прецентральной извилине (PrCr). Черный ящик выделяет сегменты на задней конечности внутренней капсулы (PLIC)(5-7-й). (C)Осевой вид взвешенного по flair T2 изображения на уровне PLIC, с правильной картой подключения CST и без нее, где более яркая красная интенсивность соответствует более высокой плотности обтекаемости. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4. Интраоперационные эндоскопические снимки. (A)0° прицел, после дурального вскрытия опухоль первоначально отделялась хиазмом, принимая арахноидальную часть в качестве плоскости расщепления. (B) и (C), после этого он был централизованно дебуклеирован, и киста была постепенно дренирована. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5. Интраоперационные эндоскопические снимки. (A)0° область, краниофарингиома расщепляется арахноидальной плоскостью с помощью нейронавигации, показывая опухоль и нервные структуры (идентифицированные в соответствии с нашим текущим протоколом). Поэтому маммиллярные тела можно пощадить, чтобы избежать постоянных повреждений гипоталамии. (B)и(C)после этого можно было резецировать опухоль медиалевыми гипоталамиковыми поверхностями, избегая каких-либо вытяжек, чтобы не повредить такую нейронную структуру. Вовремя удаления внутрижелудочковой части опухоли особое внимание уделялось повторному открытию церебрального акведука и Monro foramina, чтобы избежать послеоперационной острой гидроцефалии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
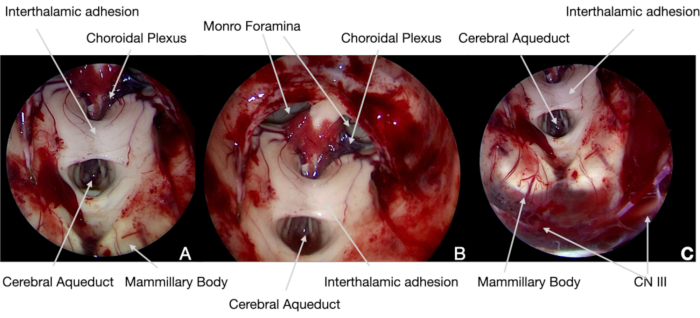
Рисунок 6. Интраоперационные эндоскопические снимки. (A)и(B)30° в пределах, в конце операции нейронная структура3-го желудочка была исследована с помощью угловой оптики для подтверждения полного удаления опухоли и демонстрации ее анатомической целостности. Внижней части хирургического поля можно было идентифицировать CN III под мембраной Лилиеквиста: его функция, поскольку депутаты Европарламента, SEP и другие CNs постоянно контролировались с помощью интраоперационного нейрофизиологического мониторинга. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7. Интраоперационные эндоскопические снимки. (A)0° область, закрытие остео-дурального дефекта требует многослойной техники, принимая дуральный заменитель, брюшной жир, в конечном итоге кость и носо-перегородчатый лоскут. Первый слой состоит из внутричерепного интрадурального позиционирования первого слоя дурального заменителя. (B)Следующий этап представлен размещением брюшного жира для заполнения хирургической полости; особое внимание следует уделять, чтобы избежать переупаковки. (C)Второй слой дурального заменителя принят для покрытия жира, и его можно поддерживать в положении благодаря жесткому каркасу, в виде куска кости или хряща (метод уплотнения прокладки). (D)Наконец, назо-перегородчатый лоскут или свободный трансплантат перегородки или средней носовой кости используется для покрытия многослойного закрытия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 8. МРТ, сагиттальный вид Т1-взвешенный после введения гадолиния (0,1 мм/кг). (A) Предоперационная МРТ демонстрирует опухоль. (B) После операции видно полное удаление опухоли с анатомической сохранностью маммиллярных тел и гипоталамических структур. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Применение представленного протокола привело к безопасному и эффективному лечению одной из самых сложных внутричерепных опухолей, таких как краниофарингиома, вторгающаяся в3-й желудочек, возможно, открывая новый горизонт для поражения, которое было определено Х. Кушингом около века назад как самое сбивающее с толку внутричерепное новообразование1. Сочетание точного предоперационного планирования, интеграции передовых методов МРТ и междисциплинарных клинических оценок позволило нам адаптировать хирургическую стратегию, определив наиболее подходящий хирургический коридор и минимизировав риск повреждения нервной структуры2,49,50,51. В отличие от других протоколов МРТ, о которых сообщалось в литературе, включение быстрых последовательностей, таких как сканирование фазового обратного кодирования для диффузионных взвешенных изображений, позволяет вносить расширенные исправления постобработки52. Эта процедура всегда должна быть принята, особенно в поле высокой интенсивности (например, 3 Тл или выше), где присутствуют искажения изображения.
Более того, использование вероятностного трактографического подхода, основанного на ограниченной сферической деконволюции, позволило повысить качество реконструкции волокон по сравнению с другими детерминированными моделями трактографии53. Кроме того, предложенный 3D-рендеринг и количественные анализы повысили точность предоперационной оценки пациента. Это исследование нейровизуализации вместе с нейрофизиологическим мониторингом представляло собой руководство для хирурга, помогая ему решить, следует ли и где остановить хирургическую резекцию с конечной целью избежать постоянного неврологического дефицита пациентов.
Действительно, наиболее агрессивная резекция опухоли для краниофарингиомы была недавно постепенно отменена в пользу гипоталамико-щадящей техники, состоящей в остановке опухоли, удаленной до любого постоянного повреждения нервнойнерва 54. Однако в стандартной клинической практике нейрохирургу часто сложно решить, когда остановить удаление опухоли от достижения максимально безопасной резекции, подвергая пациента риску, с одной стороны, оставить остаток опухоли больше, чем планировалось, или, с другой стороны, индуцировать постоянную гипоталамическую травму с последующим ущербом для качества жизни.
Представленный протокол обеспечил модель интеграции клинических и нейрорадиологических данных, намереваясь обеспечить практический и простой в использовании метод лечения гипофизарно-диэнцефальных опухолей и опухолей основания черепа. Тем не менее, мы подчеркиваем, что в нем представлены некоторые критические моменты: потребность в адекватном оборудовании, таком как магнит высокого поля (3 Т), катушка канала высокого разрешения и передовое программное обеспечение для предварительной обработки изображений.
Последовательности МРТ в представленном протоколе также приобретаемы при 1,5 Тл, но параметры сбора, представленные на этапе 4, должны быть изменены для достижения хорошего отношения сигнал/шум: для диффузионно-взвешенных последовательностей предлагается более низкое значение b (например, 1000с/мм2). Кроме того, внедрение предлагаемых анализов нейровизуализации и их внедрение в клиническую практику требовало как клинической, так и МРТ технической и компьютерной экспертизы, в частности для обработки изображений. Большая часть представленного программного обеспечения находится в свободном доступе (например, FSL, MRtrix3), но для управления конкретными наборами данных или анализа изображений требуется разработка доморощеннических конвейеров.
Более того, еще одним критическим моментом является то, что, хотя эта технология представляет собой решающую поддержку для хирурга, она не может заменить их кривую обучения. По этим причинам эта передовая хирургия должна быть зарезервирована для нескольких или третичных справочных центров, узкоспециализированных и преданных своему делу специалистов.
Наконец, будущей целью является улучшение реконструкции внечерепных структур белого вещества, таких как черепные нервы. Трактография этих структур в настоящее время нарушается из-за небольшой размерности черепных нервов и из-за наличия артефактов восприимчивости, которые резко снижают сигнал МРТ для присутствия воздуха и кости55.
В заключение, синергетическое сотрудничество между нейрохирургами и командой нейровизуализации имеет решающее значение для клинических и исследовательских целей, позволяя с максимальной точностью планировать наиболее эффективную хирургическую стратегию для каждого пациента и способствуя развитию персонализированной медицины в этой области.
Раскрытие информации
Авторам нечего раскрывать
Благодарности
Мы хотели бы поблагодарить техников и медсестер по радиологии в области нейрорадиологии IRCCS Istituto delle Scienze Neurologiche di Bologna и их координатора д-ра Марию Грацию Крепалди за их сотрудничество.
Материалы
| Name | Company | Catalog Number | Comments |
| BRAF V600E-specific clone VE1 | Ventana | ||
| Dural Substitute | Biodesign, Cook Medical | ||
| Endoscope | Karl Storz, 4mm in diameter, 18 cm in length, Hopkins II – Karl Storz Endoscopy | ||
| Immunohistochemical staining instrument | Ventana Benchmark, Ventana Medical Systems | ||
| MRI | 3T Magnetom Skyra, Siemens Health Care | ||
| Neuronavigator | Stealth Station S8 Surgical Navigation System, MEDTRONIC |
Ссылки
- Wang, A. J., Zaidi, H. A., Laws, E. D. History of endonasal skull base surgery. Journal of Neurosurgical Sciences. 60 (4), 441-453 (2016).
- Kassam, A. B., Gardner, P., Snyderman, C., Mintz, A., Carrau, R. Expanded endonasal approach: fully endoscopic, completely transnasal approach to the middle third of the clivus, petrous bone, middle cranial fossa, and infratemporal fossa. Neurosurgical Focus. 19 (1), 6(2005).
- Schwartz, T. H., Morgenstern, P. F., Anand, V. K. Lessons learned in the evolution of endoscopic skull base surgery. Journal of Neurosurgery. 130 (2), 337-346 (2019).
- Cossu, G., et al. Surgical management of craniopharyngiomas in adult patients: a systematic review and consensus statement on behalf of the EANS skull base section. Acta Neurochirurgica. 162 (5), 1159-1177 (2020).
- Komotar, R. J., Starke, R. M., Raper, D. M., Anand, V. K., Schwartz, T. H. Endoscopic endonasal compared with microscopic transsphenoidal and open transcranial resection of craniopharyngiomas. World Neurosurgery. 77 (2), 329-341 (2012).
- Clark, A. J., et al. Endoscopic surgery for tuberculum sellae meningiomas: a systematic review and meta-analysis. Neurosurgical Review. 36 (3), 349-359 (2013).
- Ditzel Filho, L. F., et al. Endoscopic Endonasal Approach for Removal of Tuberculum Sellae Meningiomas. Neurosurgical Clinics of North America. 26 (3), 349(2015).
- Labidi, M., et al. Clivus chordomas: a systematic review and meta-analysis of contemporary surgical management. Journal of Neurosurgical Science. 60 (4), 476-484 (2016).
- Cannizzaro, D., et al. Microsurgical versus endoscopic trans-sphenoidal approaches for clivus chordoma: a pooled and meta-analysis. Neurosurgical Review. , (2020).
- Fujii, T., Platt, A., Zada, G. Endoscopic Endonasal Approaches to the Craniovertebral Junction: A Systematic Review of the Literature. Journal of Neurological Surgery: Part B Skull Base. 76 (6), 480-488 (2015).
- Tubbs, R. S., Demerdash, A., Rizk, E., Chapman, J. R., Oskouian, R. J. Complications of transoral and transnasal odontoidectomy: a comprehensive review. Child's Nervous System. 32 (1), 55-59 (2016).
- Zoli, M., et al. Endoscopic approaches to orbital lesions: case series and systematic literature review. Journal of Neurosurgery. 3, 1(2020).
- Jensterle, M., et al. Advances in the management of craniopharyngioma in children and adults. Radiology and Oncology. 53 (4), 388-396 (2019).
- Roque, A., Odia, Y. BRAF-V600E mutant papillary craniopharyngioma dramatically responds to combination BRAF and MEK inhibitors. CNS Oncology. 6 (2), 95-99 (2017).
- Marucci, G., et al. Targeted BRAF and CTNNB1 next-generation sequencing allows proper classification of nonadenomatous lesions of the sellar region in samples with limiting amounts of lesional cells. Pituitary. 18 (6), 905-911 (2015).
- Silva, M. A., See, A. P., Essayed, W. I., Golby, A. J., Tie, Y. Challenges and techniques for presurgical brain mapping with functional MRI. NeuroImage Clinical. 17, 794-803 (2017).
- Duffau, H. Lessons from brain mapping in surgery for low-grade glioma: insights into associations between tumor and brain plasticity. The Lancet Neurology. 4 (8), 476-486 (2005).
- Maesawa, S., et al. Evaluation of resting state networks in patients with gliomas: connectivity changes in the unaffected side and its relation to cognitive function. PloS One. 10 (2), 0118072(2015).
- Gonen, T., et al. Intra-operative multi-site stimulation: Expanding methodology for cortical brain mapping of language functions. PloS One. 12 (7), 0180740(2017).
- Pillai, J. J. The evolution of clinical functional imaging during the past 2 decades and its current impact on neurosurgical planning. American Journal of Neuroradiology. 31 (2), 219-225 (2010).
- Bizzi, A. Presurgical mapping of verbal language in brain tumors with functional MR imaging and MR tractography. Neuroimaging Clinics of North America. 19 (4), 573-596 (2009).
- Dell'Acqua, F., Tournier, J. D. Modelling white matter with spherical deconvolution: How and why. NMR in Biomedicine. 32 (4), 3945(2019).
- Maier-Hein, K. H., et al. The challenge of mapping the human connectome based on diffusion tractography. Nature Communications. 8 (1), 1349(2017).
- Costabile, J. D., Alaswad, E., D'Souza, S., Thompson, J. A., Ormond, D. R. Current Applications of Diffusion Tensor Imaging and Tractography in Intracranial Tumor Resection. Frontiers in Oncology. 9, 426(2019).
- Jacquesson, T., et al. Full tractography for detecting the position of cranial nerves in preoperative planning for skull base surgery: technical note. Journal of Neurosurgery. , 1-11 (2019).
- Zolal, A., et al. Comparison of probabilistic and deterministic fiber tracking of cranial nerves. Journal of Neurosurgery. 127 (3), 613-621 (2017).
- Ung, N., et al. A Systematic Analysis of the Reliability of Diffusion Tensor Imaging Tractography for Facial Nerve Imaging in Patients with Vestibular Schwannoma. Journal of Neurological Part B Skull Base. 77 (4), 314-318 (2016).
- Anik, I., et al. Visual Outcome of an Endoscopic Endonasal Transsphenoidal Approach in Pituitary Macroadenomas: Quantitative Assessment with Diffusion Tensor Imaging Early and Long-Term Results. World Neurosurgery. 12, 691-701 (2018).
- Oldfield, R. C. The assessment and analysis of handedness: the Edinburgh inventory. Neuropsychologia. 9 (1), 97-113 (1971).
- Yushkevich, P. A., et al. User-Guided Segmentation of Multi-modality Medical Imaging Datasets with ITK-SNAP. Neuroinformatics. 17 (1), 83-102 (2019).
- Tournier, J. D., Calamante, F., Connelly, A. Robust determination of the fibre orientation distribution in diffusion MRI: non-negativity constrained super-resolved spherical deconvolution. NeuroImage. 35 (4), 1459-1472 (2007).
- Mormina, E., et al. Optic radiations evaluation in patients affected by high-grade gliomas: a side-by-side constrained spherical deconvolution and diffusion tensor imaging study. Neuroradiology. 58 (11), 1067-1075 (2016).
- Hales, P. W., et al. Delineation of the visual pathway in paediatric optic pathway glioma patients using probabilistic tractography, and correlations with visual acuity. Neuroimage Clinical. 11 (17), 541-548 (2017).
- Testa, C., et al. The effect of diffusion gradient direction number on corticospinal tractography in the human brain: an along-tract analysis. Magma. 30 (3), 265-280 (2017).
- Talozzi, L., et al. Along-tract analysis of the arcuate fasciculus using the Laplacian operator to evaluate different tractography methods. Magnetic Resonance Imaging. 54, 183-193 (2018).
- Zoli, M., et al. Postoperative outcome of body core temperature rhythm and sleep-wake cycle in third ventricle craniopharyngiomas. Neurosurgical Focus. 41 (6), 12(2016).
- Foschi, M., et al. Site and type of craniopharyngiomas impact differently on 24-hour circadian rhythms and surgical outcome. A neurophysiological evaluation. Autonomic Neuroscience. 208, 126-130 (2017).
- Mojón, A., Fernández, J. R., Hermida, R. C. Chronolab: an interactive software package for chronobiologic time series analysis written for the Macintosh computer. Chronobiology International. 9 (6), 403-412 (1992).
- Hardesty, D. A., Montaser, A. S., Beer-Furlan, A., Carrau, R. L., Prevedello, D. M. Limits of endoscopic endonasal surgery for III ventricle craniopharyngiomas. Journal of Neurosurgical Sciences. 62 (3), 310-321 (2018).
- Lee, W. H., et al. Effect of Dexmedetomidine Combined Anesthesia on Motor evoked Potentials During Brain Tumor Surgery. World Neurosurgery. 123, 280-287 (2019).
- Barazi, S. A., et al. Extended endoscopic transplanum-transtuberculum approach for pituitary adenomas. British Journal of Neurosurgery. 27 (3), 374-382 (2013).
- Singh, H., et al. Intraoperative Neurophysiological Monitoring for Endoscopic Endonasal Approaches to the Skull Base: A Technical Guide. Scientifica. , 1751245(2016).
- Mazzatenta, D., et al. Outcome of Endoscopic Endonasal Surgery in Pediatric Craniopharyngiomas. World Neurosurgery. 134, 277-288 (2020).
- Milanese, L., et al. Antibiotic Prophylaxis in Endoscopic Endonasal Pituitary and Skull Base Surgery. World Neurosurgery. 106, 912-918 (2017).
- Hadad, G., et al. A novel reconstructive technique after endoscopic expanded endonasal approaches: vascular pedicle nasoseptal flap. Laryngoscope. 116 (10), 1882-1886 (2006).
- Zoli, M., et al. Cavernous sinus invasion by pituitary adenomas: role of endoscopic endonasal surgery. Journal of Neurosurgical Sciences. 60 (4), 485-494 (2016).
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Coury, J. R., Davis, B. N., Koumas, C. P., Manzano, G. S., Dehdashti, A. R. Histopathological and molecular predictors of growth patterns and recurrence in craniopharyngiomas: a systematic review. Neurosurgical Review. 43 (1), 41-48 (2020).
- Prieto, R., et al. Craniopharyngioma adherence: a comprehensive topographical categorization and outcome-related risk stratification model based on the methodical examination of 500 tumors. Neurosurgical Focus. 41 (6), 13(2016).
- Cagnazzo, F., Zoli, M., Mazzatenta, D., Gompel, J. J. V. Endoscopic and Microscopic Transsphenoidal Surgery of Craniopharyngiomas: A Systematic Review of Surgical Outcomes Over Two Decades. Journal of Neurological Surgery: part A Central European Neurosurgery. 79 (3), 247-256 (2018).
- Cavallo, L. M., et al. The endoscopic endonasal approach for the management of craniopharyngiomas: a series of 103 patients. Journal of Neurosurgery. 121, 100-113 (2014).
- Andersson, J. L., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. Neuroimage. 20 (2), 870-888 (2003).
- Castellano, A., Cirillo, S., Bello, L., Riva, M., Falini, A. Functional MRI for Surgery of Gliomas. Current Treatment Options in Neurology. 19 (10), 34(2017).
- Elowe-Gruau, E., et al. Childhood craniopharyngioma: hypothalamus-sparing surgery decreases the risk of obesity. Journal of Clinical Endocrinology and Metabolism. 98 (6), 2376-2382 (2013).
- Jacquesson, T., et al. Overcoming Challenges of Cranial Nerve Tractography: A Targeted Review. Neurosurgery. 84 (2), 313-325 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены