Method Article
Kök Hücre Tedavisi Için Post-miyokard Enfarktüsü Kalp Yetmezliği Domuz Modeli Oluşturma
Bu Makalede
Özet
Biz hücre tabanlı tedaviler için kök hücrelerin intramiyokardiyal uygulama etkisini ve güvenliğini test etmek için sol circumflex arter tıkanıklığı ve hızlı pacing tarafından indüklenen kalp yetmezliği bir domuz modeli kurmak için çalıştı.
Özet
Miyokard enfarktüsü (MI) sonrası kalp yetmezliği (HF) tedavisinde ilerlemeler kaydedilmiş olsa da, MI sonrası HF tüm dünyada mortalite ve morbiditenin en önemli nedenlerinden biri olmaya devam etmektedir. MI sonrası kardiyak onarım ve sol ventrikül fonksiyonunun iyileştirilmesi için hücre tabanlı tedaviler önemli ölçüde dikkat çekmiştir. Buna göre, bu hücre naklinin güvenliği ve etkinliği klinik kullanımdan önce HF'nin klinik öncesi büyük hayvan modelinde test edilmelidir. Domuzlar yaygın kalp büyüklüğü ve koroner anatomi açısından insanlara benzerlik nedeniyle kardiyovasküler hastalık araştırma için kullanılır. Bu nedenle sol circumflex arterin (LCX) kapalı göğüs koroner balon oklüzyonu kullanılarak domuz kronik HF modelinin oluşturulması için etkili bir protokol sunmaya çalıştık ve ardından kalp pili implantasyonu ile indüklenen hızlı ventrikül pacing'i sunmaya çalıştık. Sekiz hafta sonra, kök hücreler peri-infarkt bölgesinde intramiyokardiyal enjeksiyon ile uygulandı. Daha sonra enfarktüs boyutu, hücre sağkalım ve sol ventrikül fonksiyonu (ekokardiyografi, hemodinamik parametreler ve elektrofizyoloji dahil) değerlendirildi. Bu çalışma kök hücre tedavisi için istikrarlı bir preklinik büyük hayvan HF modeli kurulmasına yardımcı olur.
Giriş
Kardiyovasküler hastalıklar, özellikle koroner arter hastalığı (CAD), Hong Kong ve dünya çapında1morbidite ve mortalite önemli nedeni olmaya devam etmektedir. Hong Kong'da 2012'den 2017'ye kadar Hastane Otoritesi bünyesinde tedavi edilen CAD hastası sayısında%26'lıkbir artış öngörülüyordu. Tüm KAD'ler arasında akut miyokard enfarktüsü (MI) önde gelen ölüm nedeni ve kalp yetmezliği (HF) gibi sonraki komplikasyonlardır. Bunlar önemli tıbbi, sosyal ve finansal yüklere katkıda bulunur. MI olan hastalarda, trombolitik tedavi veya primer perkütan koroner girişim (PCI) hayatı korumada etkili bir tedaviyöntemidir, ancak bu tedaviler sadece MI sırasında kardiyomiyosit (CM) kaybını azaltabilir. Mevcut tedaviler kardiyak fibrozis, miyokardiyal remodeling, kardiyak aritmi ve sonunda kalp yetmezliğine yol açan CMs kalıcı kaybı doldurmak mümkün değildir. 1 yıl sonrası MI'de mortalite oranı %7 civarındadır ve %20'den fazla hastada HF3gelişir. Son dönem HF hastalarında, kalp nakli tek etkili tedavi yöntemidir, ancak mevcut organ sıkıntısı ile sınırlıdır. MI Sonrası HF'nin gelişimini tersine çevirmek için yeni tedaviler gereklidir. Sonuç olarak, hücre tabanlı tedavi mi aşağıdaki HF bozulmuş CM'ler ve iyileştirici sol ventrikül (LV) fonksiyonu onarmak için cazip bir yaklaşım olarak kabul edilir. Daha önceki çalışmalarımızda kök hücre naklinin MI4,,5küçük hayvan modellerinde direkt intramiyokardiyal transplantasyon sonrası kalp fonksiyonlarının iyileşmesi için yararlı olduğu bulunmuştur. Bu nedenle klinik kullanımdan önce kök hücre naklinin etkinliğini ve güvenliğini daha fazla test etmek için standart laştırılmış klinik öncesi büyük hayvan HF protokollerine ihtiyaç vardır.
Son yıllarda kök hücre tedavisi için kardiyovasküler araştırmalarda domuz yaygın kullanımı tanık olmuştur. HF domuzlar kardiyak boyutu, ağırlık, ritim, fonksiyon ve koroner arter anatomisi açısından insanlara benzerlik nedeniyle çeviri araştırma umut verici bir modeldir. Ayrıca, domuz HF modelleri CM metabolizması açısından MI HF sonrası hastaları taklit edebilir, elektrofizyolojik özellikleri, ve iskemik koşullar altında nöroendokrin değişiklikler6. Burada sunulan protokol, sol circumflex arter (LCX) kapalı göğüs koroner balon oklüzyonu ve ardından kalp pili implantasyonu ile indüklenen hızlı pacing kullanan, standart domuz HF modeli kullanır. Çalışma da post-MI HF tedavisi için kök hücrelerin intramiyokardiyal uygulama rotasını optimize eder. Amaç, şiddetli CAD'li hastalar için klinik olarak uygun tedaviler geliştirmek için kullanılabilecek kronik miyokard enfarktüsü bir domuz hayvan modeli üretmektir.
Protokol
Tüm hayvan deneyleri, ABD Ulusal Sağlık Enstitüleri tarafından yayınlanan Laboratuvar Hayvanlarının Bakımı ve Kullanımı Rehberi ve Hong Kong Üniversitesi yönetmelikleri uyarınca gerçekleştirildi ve protokol Hong Kong Üniversitesi'nde Canlı Hayvanların Eğitim ve Araştırmada Kullanımı Komitesi (CULTAR) tarafından onaylandı.
NOT: Bu çalışmada 35-40 kg (9-12 aylık) ağırlığında dişi çiftlik domuzları kullanılmıştır. Bu deneyin akış şeması Şekil 1'degösterilmiştir.
1. Cerrahi işlemler
- Anestezi ve hayvanın hazırlanması
- Hızlı 12 saat için hayvanlar ve deney den önce 4 saat su yoksunluğu tabi.
- Domuzları 20 mL normal salinde hazırlanan intramüsküler kiremit+zolezepam (2-7 mg/kg) ve ksilazin (0.5-1 mg/kg) enjeksiyonu ile anestezi edin. Hayvanın palpebral reflekslerini yok olana kadar izleyin.
- Domuz un saçlarını çıkarın ve bölüm 1.3-1.5 için boyun ve kasık deri sterilize. Operasyon alanını %70 etanol ve betadin ile 3 x dezenfekte edin.
- Domuz trakeaiçine 7 mm endotrakeal tüp yerleştirin ve kulak vena içine 22 G venöz indwelling iğne yerleştirin.
- Ameliyat masasına domuz taşıyın ve bir supine pozisyonda yerleştirin. Endotrakeal tüpü solunum cihazına bağlayın ve mekanik olarak havalandırın (inspiratuar/ekspiratuar zaman oranı 1:2) isofluran (%1.5-%2.0 inhalasyon) ve oksijen (0.5-1.5 L/dk inhalasyon) ile hayvan.
- Yüzey elektrokardiyogramını ve kan basıncını izleyin ve elektrofizyoloji kayıt sistemleri aracılığıyla kalp hızını, kalp ritmini ve arteriyel kan basıncını sürekli olarak izleyin.
- Ekokardiyografi
- Sol lateral decubitus pozisyonuna domuz taşıyın ve masaya düzeltmek.
- Prob'u perikardiyal bölgeye koyun ve 2D ve M-mod görüntüleme dahil olmak üzere seri ekokardiyografi, yüksek çözünürlüklü ekokardiyografik sistem ve bazal da 3-9 MHz transdüser kullanarak, hücre naklinden önce ve hücre naklinden 8 hafta sonra(Ek Şekil 1).
- Ticari yazılım kullanarak elde edilen tüm görüntüleri analiz edin. LV son diyastolik boyutunu (LVEDD), LV end-sistolik boyutu (LVESD), LV son diyastolik hacmi (LVEDV), LV end-sistolik hacim (LVESV), LV ejeksiyon fraksiyonu (LVEF) ve standart ekokardiyografik görüntüler parasternal uzun eksen görünümünden elde edildikten sonra duvar kalınlığını hesaplayın.
NOT: Tüm off-line analizler bir bilgisayar iş istasyonu kullanılarak başka bir bağımsız operatör tarafından yapılmıştır. Ölçümlerin farklı gözlemciler arasındaki değişkenliği 20 tekrarlanan rastgele görüntüye dayanarak %4 idi. Tüm ekokardiyografik ölçümler Amerikan Ekokardiyografi Derneği önerileridoğrultusunda yapıldı.
- Kalp pili implantasyonu
- Supine pozisyonuna domuz taşıyın ve kayışları ile masada domuz uzuvları düzeltmek.
- Karotis üçgeninde doğru karotis arter ve juguler ven bulun (sternokleidomastoid arkasında ve stylohyoid ile çevrili, digastrik kas, ve omohyoid) ve steril koşullar altında hemostatik forseps ile sağ karotis arter ve juguler ven izole(Ek Şekil 2). Sağ karotis arter ve juguler ven distal ucunu ligate. 2-0 Vicryl ile iki kas dikin.
- Sağ juguler ven bir anjiyocath ile kanülve x-ışını rehberliğinde sağ ventrikül e doğru bir kalp pili kurşun eklemek(Şekil 2).
- Forceps kullanarak sternokleidomastoid ve ön pulkas izole. İki kas arasında bir kalp pili implant ve 2-0 ipek ile iki kas dikmek. Kalp pilini lidere bağlayın.
- Kalp pilini, transplantasyondan sonra bir kalp pili jeneratörü tarafından VVI modunu (35 bpm) yedeklemek üzere yeniden programla.
- Mi indüksiyondan 4 hafta sonra bir kalp pili jeneratörü tarafından HF'yi indüklemek için hızlı ventrikül pacing (150 atım/dk) uygulayın. Ardından kalp pilini 8 haftalıkta yedek VVI moduna geri ayarlayın.
- İnvaziv basınç hacmi döngü analizi
NOT: LV fonksiyonundaki değişiklikleri değerlendirmek için hücre naklinden önce ve hücre naklinden 8 hafta sonra baseline invaziv hemodinamik değerlendirme yapın.- Femoral üçgende sağ femoral arter ve femoral ven izole (inguinal ligament ile çevrili, sartorius kas, ve adductor longus kas)(Ek Şekil 2).
- Bir anjiyocath ile sağ femoral arter Cannulate ve anjiyocath yoluyla arter içine bir kılavuz tel yerleştirin. Anjiyocath çıkarın ve kılavuz tel gözetiminde arter içine bir 9F kılıf kanül. Kılavuz kabloyu çıkarın.
- Adım 1.4.2'de açıklandığı gibi sağ femoral ven 12F kılıf ile kanül. X-ışını rehberliğinde inferior vena kava (IVC) içine yerleştirilen 12F kılıf bir balon kateter yerleştirin.
- İzotonik tuzlu bir cihazda 7 Fr basınç hacmi (PV) kateterini PV sinyal işlemcisi ile kalibre edin.
- X-ışını kılavuzu altında yerleştirilen 9F kılıftan PV kateterini LV apeksine takın. Ventilasyonun askıya alınması ve PV sinyal işlemcisi ile sol ventrikül maksimal pozitif basınç türevi (+dP/dt), son sistolik basınç (ESP) ve son diyastolik basınçları (EDP) ölçün.
- IVC'nin tıkanması sırasında PV sinyal işlemcisi tarafından son sistolik basınç-hacim ilişkisini (ESPVR) ölçün.
- İşlem tamamlandığında havalandırmayı yeniden başlatın.
- MI indüksiyonu
- İntravenöz olarak ventriküler aritmileri önlemek için MI indüksiyonundan önce hayvana amiodaron (5 mg/kg intravenöz olarak 1 saat üzerinden 5 mg/kg) ve lidokain (1.5 mg/kg intravenöz bolus) uygulayın.
- Adım 1.4.3'te belirtildiği gibi sağ karotid arteri 8F kılıf ile kanüle.
- Standart C kol floroskopi ekipmanı tarafından yönlendirilen yerleştirilmiş kılıf aracılığıyla 6F JR4 tel üstü kılavuz kateter ile koroner anjiyografi yapın.
- Sol circumflex koroner arter (LCX) distal perkütan transluminal koroner anjiyoplasti ile ilk kalın marjinal dalı (PTCA) dilatasyon balon kateter enflasyonu X-Ray rehberliğinde(Şekil 2).
- LCX'i engellemek için balon kateterinden 10 mL'lik bir şırıngaile hazırlanan 3 mL tuzlu su ile karıştırılmış 700 m sünger mikrokürenin 1 mL'sini enjekte edin, ardından balonu söndürün ve tıkanıklığı doğrulamak için anjiyogram yapın.
- Başarılı tam tıkanıklık elde etmek için enjeksiyon işlemini tekrarlayın.
- Kardiyak aritmileri tespit etmek için hayvankalp hızını ve ritmini izleyin. Ventriküler fibrilasyon olduysa, 150-300 J şoklar kullanarak bir sinüs ritmi yeniden kurmak için harici, bifhasic defibrilatör kullanın.
- Kök hücre enjeksiyonu
- Rastgele iki farklı gruba kalp fonksiyonu (LVEF <% 40) önemli bozukluğu olan tüm hayvanları iki farklı gruba: 2 x 108 insan kaynaklı pluripotent kök hücre kaynaklı mezenkimal kök hücreleri (hiPSC-MSCs) ve hiPSC-MSCs almazsınız diğer intramiyokal uygulama alacaksınız.
- HiPSC-MSC'leri intramiyokal transplantasyon için normal saline 2 mL olarak hazırlayın. İntramiyokardiyal hiPSC-MSC transplantasyonundan önce bölüm 1.1'de belirtilen anestezi ve hayvan hazırlama adımlarını tekrarlayın, bu kez apeks beat alanı etrafında 10 cm sterilize edin. Bir retraktör ile 4-5 interkostal alanda sol torakotomi gerçekleştirin. Enfarktlı lateral duvarı ortaya çıkarmak için perikardiyotomi yapın.
NOT: Kesi uzunluğu 10-12 cm idi. - Kültür ortamını(Malzeme Tablosu) bir grup hayvana veya diğer gruba 2 x 108 hiPSC-MSC'ye(Şekil 3)yönetmek için enfarktüs alanı nın çevresinde 5-8 intramiyokiyal enjeksiyon (enjeksiyon başına~0,3 mL) kullanın. Dikkatle kanama riskini azaltmak için koroner arterlerin herhangi bir hasar önlemek.
- Demir tel ile interkostal alanı kapatın ve 2-0 ipek ile kas tabakası kapatın. 2-0 vicryl ile deri altı doku ve deri dikin.
- İntrakardiyak programlanmış elektriksel stimülasyon
- Hücre transplantasyonu tedavisi sonrası ventriküler tachyarrhythmia 'nın (VT) indüklenebilirliğini değerlendirmek için programlanabilir bir uyarıcı kullanarak programlanmış elektriksel stimülasyon yapın.
- Tüm hayvanları kurban etmeden önce femoral ven ile sağ ventrikül abuna 6F elektrofizyolojik kateter yerleştirin.
- İntrakardiyak kayıtları yüzey elektrokardiyogram yol açar I, II ve III elektrofizyolojik kayıt sistemi üzerinde 200 mm/s hızında görüntüleyin. Bir uyarıcı kullanarak diyastolik eşiğin 2 x'inde 2 ms darbe genişliği sunun.
- İki tahrik döngüsü uzunluğunda (200 ms ve 300 ms) sekiz uyarandan oluşan bir tempolu tren (S1) ve ardından bir (S2) veya iki (S2 ve S3) erken ekstra uyaran lar sunun.
- Ventriküler etkili refrakter dönem veya aritmi indüklenene kadar ardışık olarak bağlantı aralıklarını kısaltın. Indüklen sürdürülebilir VT (>10 s) varlığına dikkat edin.
2. Postoperatif protokol
- Ameliyat sonrası tıp
- HF için konvansiyonel farmakolojik tedaviler gerçekleştirin. Kısacası, oral olarak tüm hayvanlara günlük metoprolol succinate (25 mg) ve ramipril (2.5 mg) uygulayın.
- İntramüsküler enrofloksasin (5 mg/kg) ve buprenorfin (0.01 mg/kg) enfeksiyonu önlemek ve ağrıyı dindirmek için ameliyattan sonra 1 hafta boyunca tüm hayvanlara günlük olarak uygulayın.
- İmmünolojik reddi en aza indirmek için, oral olarak bir steroid (40 mg / gün ağızdan) ve siklosporin (200 mg / gün ağızdan) tüm hayvanlara uygulayın 3 gün hücre nakli için önce 8 hafta.
- Enfarkt boyutu değerlendirmesi
- Deney sonunda hayvanları aşırı dozda dorminal (pentobarbital sodyum, 100 mg/kg, IV) ile ötenazi edin.
- Göğsü aç ve kalbi topla. Kalbi %0.9 tuzlu suyla durula.
- Lv enine yönde 1 cm kalınlıkta neşter ile seri kesit LV doku örnekleri.
- Duvar kalınlığını ve enfarktüs alanını ölçmek için enfarktüs miyokardiyum içeren dilimlerin bölümlerini seçin.
- Bu dilimlerin görüntüsünü yakalayın ve ticari görüntü analiz yazılımı kullanarak duvar kalınlığını ve enfarkt alanını nicel olarak analiz edin.
- Bir ay boyunca 4 °C'de %10 formalin ile dokuyu düzeltin. Dokuyu parafin içine, bitişik ve uzak enfarktüs bölgelerine (~1 cm2 adet) gömün. Histolojik inceleme için bir mikrotom kullanarak 5 μm dilimler halinde bölüm.
- Hücre sağkalım
- İmmünohistokimyasal boyama ile ekilen hücrelerin engraftment anti-insan nükleer antijen (HNA) üretici tarafından sağlanan protokole göre tespit.
- Görüntüyü her hayvandaki beş rastgele alanda üç farklı bölümde yakalayın ve peri-infarkt bölgesindeki pozitif hücreleri nicel olarak analiz edin.
NOT: Görüntü yakalama sistemi ve görüntü analiz yazılımı, kalp bölümlerinin görüntülerini yakalamak ve analiz etmek için kullanılmıştır.
Sonuçlar
Ölüm
Bu çalışmada toplam 24 domuz kullanılmıştır. Üçü sürekli VT nedeniyle MI indüksiyonsırasında öldü. Bir hayvan açık kalp ameliyatında yara kanaması nedeniyle hücre enjeksiyonu için öldü. İki hayvan şiddetli enfeksiyon yüzünden öldü. İki hayvan hafif EF azaltma (LVEF azaltma > taban çizgisinin% 40) nedeniyle dışlandı. Sonuç olarak, 16 hayvan tüm çalışma protokolünü tamamladı.
Kardiyak fonksiyon ve remodeling
Seri ekokardiyografik inceleme, LVEF'nin bazal da %68.23 ± 3.52'den %39.37 ± 3.22'ye düştüğünü gösterdi. LVEDD, MI indüksiyonundan 8 hafta sonra 3,6 ± 0,5 'den 4,8 ± 0,4'e ve LVESD önemli ölçüde 2,5 ± 0,3'ten 3,9 ± 0,4 'e(Şekil 4A)yükseldi. LVEF ve LVESD, transplantasyondan 8 hafta sonra hiPSC-MSCs grubunda sırasıyla %52.9 ± 4.27 ve 3.3 ± 0.3'e, MI durumuna göre anlamlı olarak iyileşmiştir(Şekil 4A).
+dP/dt ve ESPVR, MI indüksiyonundan 8 hafta sonra bazal 1.325 ± 63 mmHg/s ve bazsatırda 3.9 ± 0.4'ten 978 ± 45 mmHg/s'ye ve 1.8 ± 0.2'ye önemli ölçüde düştü. HiPSC-MSC'lerin intramiyokardiyal uygulaması, iPSC-MSCs transplantasyonundan 8Figure 4Bhafta sonra +dP/dt ve ESPVR'ı 1,127.4 ± 50 mmHg/s'ye ve 2.6 ± 0.3'e yükseltti.
Enfarkt duvar kalınlığı
Ortalama LV enfarktüs duvar kalınlığı her hayvanda 5-7 seri 1 cm kalınlık kesit örneklerinden ölçüldü(Şekil 5). LV enfarktüs yüzdesi %16 ± 2 idi.
Transplantasyon sonrası Hücre Sağkalımı
Transplantasyondan 8 hafta sonra enfarktüs bölgesinde enjeksiyon bölgesinde hücre sağkalım yoktu, ancak peri-infarkt bölgesinde az sayıda sağkalım hiPSC-MsC görüldü(Şekil 6).
İndüksal ventrikül aritmi
İndüklenebilir sürekli ventriküler tachyarrhythmias insidansı hf olan hayvanlarda kolayca artabilir (10% taban çizgisi vs% 75 8 hafta MI indüksiyonsonra). HiPSC-MSCs transplantasyonu, vt'ye yatkınlığı azaltmak için altta yatan miyokard idrakini anlamlı olarak değiştirmez (hiPSC-MSCs grubunda %62.5 hiPSK-MSCs intramiyokardiyal uygulamasından 8 hafta sonra, Şekil 7).
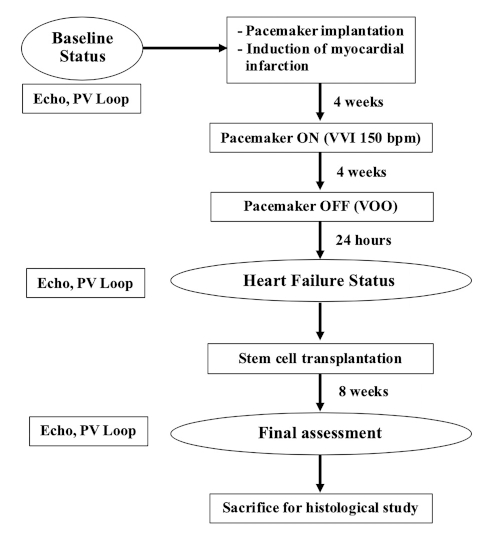
Şekil 1: Deneyin akış şeması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
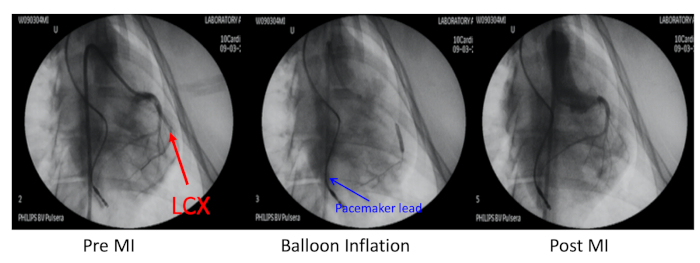
Şekil 2: Miyokard enfarktüsünün domuz modeli. Miyokard enfarktüsü (MI) domuz modeli sol circumflex koroner arter embolizasyonu ile indüklenen (LCX, kırmızı ok) ilk obtuse marjinal dalı distal. Bu koroner arter balon şişirme ve 700 μm mikroküre enjeksiyonu ile tıkanmış oldu. Mi öncesi, balon şişirme ve post-MI'de koroner anjiyografi sağ karotis arter üzerinden 6F JR4 kılavuz kateter ile yapıldı. Kalp pili kurşun sağ ventrikül duvar (mavi ok) içine yerleştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
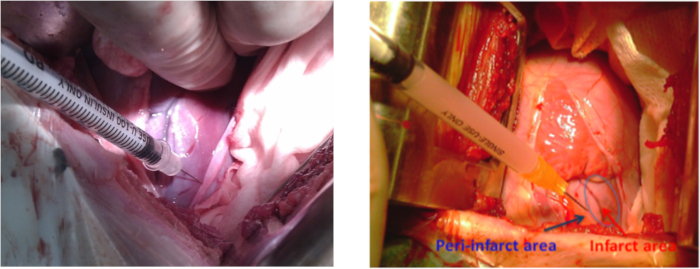
Şekil 3: MI bir domuz modelinde hücre nakli. Sol torakotomi sırasında sol ventrikül infarkt alanı etrafında lateral duvarda Hücre enjeksiyon siteleri. Mavi ok peri-enfarkt alanını, kırmızı ok ise enfarkt alanını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
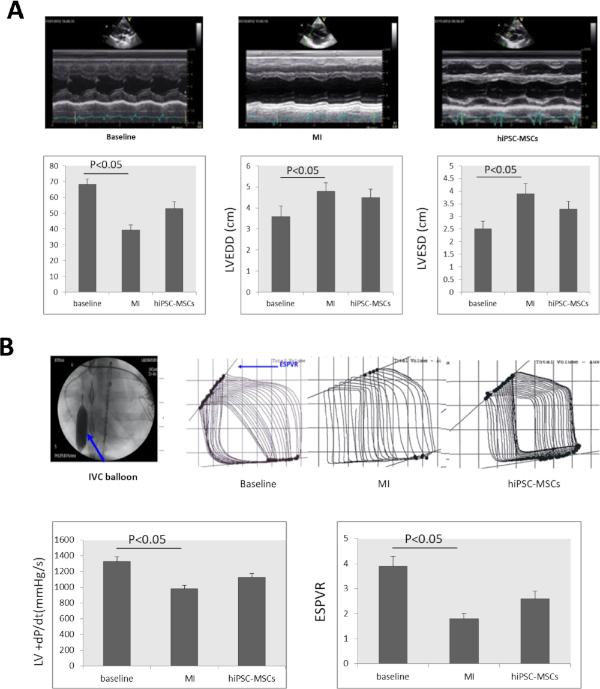
Şekil 4: MI'den sonra kalp fonksiyonu değişir. (A) Temel, MI ve hücre naklinde LV M-mod ekokardiyogram görüntüsü. LVEF, LVEDD, LVESD MI indüksiyonundan 8 hafta sonra anlamlı olarak azalmış ve hücre naklinden 8 hafta sonra hiPSC-MsCs grubunda anlamlı olarak artmıştır. (B) Kalp yetmezliği olan domuzların kardiyak fonksiyonlarını değerlendirmek için +dP/dt değeri ve ESPVR PV sinyal işlemcisi ile ölçüldü. Inferior vena kava (IVC) ESPVR değerlendirmesi sırasında balon şişirme (mavi ok) tarafından tıkanmış oldu. Hem +dP/dt hem de ESPVR MI indüksiyonundan sonra anlamlı olarak azalmış, transplantasyondan 8 hafta sonra hiPSC-MSC gruplarında anlamlı olarak artmıştır. ANOVA'yı öğrenci-Newman-Keuls sonrası hoc testi (SPSS, sürüm 14) takip etti ve anlamlılık için α = 0.05 ile kullanıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: MI'den sonra enfarkt alanı değişir. LV enine yön örnekleri infarktlı miyokardiyum içeren her kalpte 1 cm kalınlıkta kesitlenmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
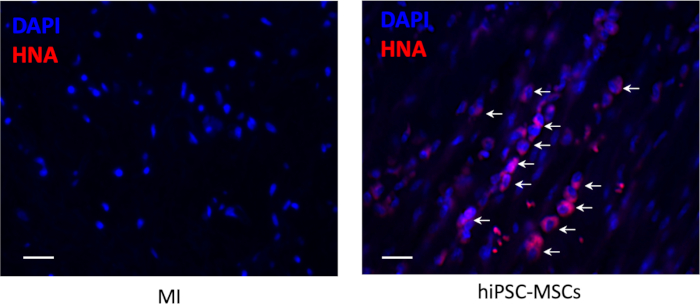
Şekil 6: Transplantasyon sonrası hücre sağkalım. Nakledilen hiPSC-MSC'lerin engraftment anti-insan nükleer antijen (kırmızı renk) için immünohistokimyasal boyama tarafından tespit edildi. Ölçek çubuğu = 100 μm. Oklar pozitif hücreleri temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7: Sürekli ventriküler tachyarrhythmias insidansı. (A) Ventriküler tachyarrhythmias (VT, kırmızı ok) in vivo intrakardiyak programlanmış elektriksel stimülasyon tarafından indüklenen. (B) MI indüksiyon sonrası VT insidansı anlamlı olarak artmıştır. Hücre nakli VT insidansını artırmadı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Ek Şekil 1: Ekokardiyogram edinimi. Sol panel hayvanın konumunu gösterir. Sağ panel sonda konumunu gösterir. Orta panel bu pozisyonun altındaki ekokardiyografik görüntüyü gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
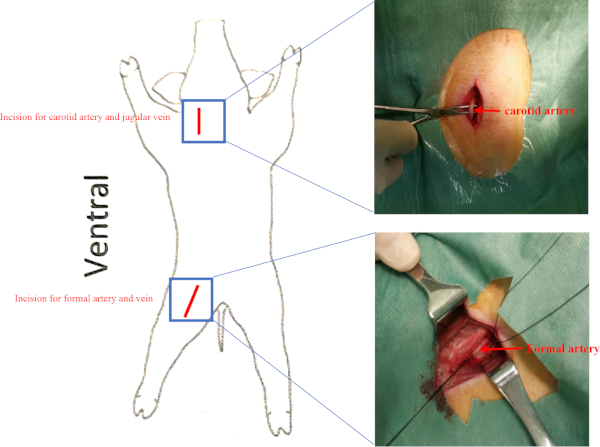
Ek Şekil 2: Gemilerin konumu. Domuzlar supine pozisyonuna yerleştirildi. Karotis arter ve femoral arter insizyonlar kırmızı çizgi olarak sunulmaktadır. Juguler ven ve femoral ven sırasıyla karotis arter ve femoral arter altında idi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Standart hayvan modelleri patofizyolojisi ve hastalıkların mekanizmaları anlamak ve yeni terapötik test için son derece önemlidir. Protokolümüz sol circumflex arter tıkanıklığı ve hızlı pacing tarafından indüklenen HF bir domuz modeli kurar. MI indüksiyonundan sekiz hafta sonra hayvanlarda LVEF, LVEDD, LVESD, +dP/dt ve ESPVR'da önemli bir bozulma gelişti. Bu protokol aynı zamanda intramiyokardiyal enjeksiyon ile kalp rejenerasyonu için kök hücre tedavisi nin uygulama yöntemini de test ediyor. Enfarktüs boyutu, kardiyak sistolik ve diyastolik fonksiyon değerlendirilir. Bu çalışma, klinik olgulara benzer kök hücre tedavisi için istikrarlı ve tekrarlanabilir preklinik büyük hayvan HF modeli nin oluşturulmasına yardımcı olur.
LCX tıkanıklığı ve hızlı pacing yaygın olarak bizim önceki çalışmalarda HF hayvan modelleri oluşturmak için kullanılmıştır7,8. LCX distal ilk kalın marjinal dalı tıkanmış, hızlı sağ ventrikül pacing 4 hafta izledi. Miyokardismi mi sırasında kardiyomiyosit kaybına neden olur, hangi kardiyak fibrozis neden olur, miyokardiyal remodeling, ve kardiyak aritmi. Önemli LV genişlemesi ventriküler pacing sonuçları, sol ventrikül kontrility noniskemik bozukluk, ve şiddetli LV disfonksiyonu9,10. Daha uzun iskemi süreleri ve hızlı tempo, çevirisel araştırmalar için aşamalı deneysel, düşük çıkışlı HF modeli üretir. Önceki çalışmalarda MI10indükleyerek kalp yetmezliği modelleri kuruldu. Ancak, şiddetli MI mortalitesi daha yüksekti ve MI'nin LVEF azalması kararsızdı. Bu nedenle, kardiyak fonksiyon önemli bozulma neden LCX tıkanıklığı sonra hızlı sağ ventrikül pacing uygulayın. Daha önceki çalışmalarımızda da görüleceği gibi, burada sunulan model kararlı enfarktüs boyutu verir ve bu modelin LVEF en az% 40 normal6,7,,8altında azalır. Daha az enfeksiyon ve kanama olsaydı, model başarı oranımız %80 civarında olabilirdi.
Kök hücrelerin klinik uygulamasının önündeki en büyük engellerden biri, transplantasyon sonrası yetersiz sağkalım ve engreftasyonlardır. Son klinik çalışmalar ve meta-analiz11,12,13,14,15 bu tedavisonrasında LV fonksiyonu veya enfarktüs boyutunda tutarlı bir iyileşme göstermek için başarısız oldu. Olası nedenlerden biri nakledilen hücrelerin düşük sağkalım oranıdır. Optimal bir uygulama yönteminin keşfedilmesi kök hücre tedavilerinde kritik bir rol oynar. Hücre transplantasyonunun üç yöntemini karşılaştıran intramiyokardiyal uygulama, yüksek hücre retansiyonu nedeniyle intravenöz ve intrakoroner uygulamadan daha etkilidir16,17. Bu nedenle bu çalışmada iPSC-MSC satımı için intramiyokardiyal bir uygulama yolu seçtik. Ekokardiyografik sonuçlar ve invaziv hemodinamik sonuçlar, hücre naklinden 8 hafta sonra iPSC-MSC'lerin intramiyokardiyal uygulamasının MI HF sonrası domuzların LV fonksiyonunu iyilediğini göstermiştir. İmmünsupresif ilaçların (steroid ve siklosporin) uygulanmasına rağmen peri-infarkt alanında sadece birkaç nakledilen hücre saptandı. Enjekte edilen alanın etrafındaki enfarktüs alanında hayatta kalan bir hücre tespit edilmedi. Önceki çalışmalarda da transplantasyon,18, 19,1920,21transplantasyon sonrası enfarktüslü miyokardiyumkök hücrelerin inson derece küçük bir bölümünü bulduk . İnmiyokardiyal uygulama sırasında hücre kaybı deneysel sonuçları etkileyebilir. Yönetim yöntemlerinin nasıl geliştirilen ve ikamet oranının nasıl artırılabildiğini ileride yapılacak çalışmalarda açıklığa kavuşturulmalıdır.
Güvenlik, özellikle aritmiogenez, hücre tabanlı tedaviler ile klinik uygulama ile ilgili bir diğer hayati endişe. Yakın zamanda yapılan çalışmamız, insan embriyokök hücresinin (hESC) türetilmiş KMS intramiyokardiyal uygulamasının spontan non-sustained ventriküler tachyarrhythmias4insidansını artırdığını göstermiştir. MI HF sonrası porsin modelimizde, kalp pilinden telemetri takibi ile kaydedilen spontan non-sustained ventriküler tachyarrhythmia (rate >180 bpm ve >12 beats) insidansı MI indüksiyonundan sonra %25 idi, ancak sürekli VT kolayca indüklenilebiliyordu (%80). Bu çalışmada hiPSC-MSCs uygulaması ile veya hiPSC'siz ani ölüm insidansı değişmemiştir. Ayrıca hiPSC-MSC transplantasyonu altta yatan miyokard idrakini ventriküler aritmilere yatkınlığı azaltmak veya artırmak için değiştirmedi. Bu sonuç, büyük hayvan kronik HF modeli hücre güvenliği değerlendirmesi için kullanılabilir düşündürmektedir.
Enfeksiyon ve kanamadan kaçınmak, başarılı hayvan modeli nin kurulması açısından son derece önemlidir. Kanama riskini azaltmak için, koroner arterler ve kardiyak damarlar herhangi bir hasar önlemek için dikkat edilmelidir. İki hayvan şiddetli enfeksiyondan öldüğünden, uygun bir postoperatif tıbbi strateji yararlı olacaktır. Burada, aşağıdaki gibi bir postoperatif tıbbi strateji sağlamak: Intramüsküler enrofloksasin (7.5 mg /kg, SID) ve buprenorfin (0.02 mg /kg, BID) oral olarak amoksicillin / Clavulanic Asit (12.5mg / kg, SID) ve Carprofen (2 mg / kg, SID) tüm hayvanlara 1 hafta boyunca ameliyat sonrası enfeksiyon ve ağrıyı önlemek için yönetmek.
Özetle, mevcut yöntem hücre tabanlı tedaviler için kalp yetmezliği istikrarlı ve tekrarlanabilir klinik olarak ilgili büyük hayvan modeli sağlar.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar hayvan deneyleri sırasında mükemmel teknik destek için Alfreda ve Kung Tak Chung kabul.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amiodarone | Mylan | - | - |
| Anaesthetic machines and respirator | Drager | Fabius plus XL | - |
| Angiocath | Becton Dickinson | 381147 | - |
| Anti-human nuclear antigen | abcam | ab19118 | - |
| Axio Plus image capturing system | Zeiss | Axioskop 2 PLUS | Axioskop 2 plus |
| AxioVision Rel. 4.5 software | Zeiss | - | - |
| Baytril | Bayer | - | enrofloxacin |
| Betadine | Mundipharma | - | - |
| CardioLab Electrophysiology Recording Systems | GE Healthcare | G220f | - |
| Culture media | MesenCult | 05420 | - |
| Cyclosporine | Novartis | - | - |
| Defibrillator | GE Healthcare | CardioServ | - |
| Dorminal | TEVA | - | - |
| Echocardiographic system | GE Vingmed | Vivid i | - |
| EchoPac software | GE Vingmed | - | - |
| Electrophysiological catheter | Cordis Corp | - | - |
| Embozene Microsphere | Boston Scientific | 17020-S1 | 700 μm |
| Endotracheal tube | Vet Care | VCPET70PCW | Size 7 |
| Ethanol | VWR chemicals | 20821.33 | - |
| Formalin | Sigma | HT501320 | 10% |
| IVC balloon Dilatation Catheter | Boston Scientific | 3917112041 | Mustang |
| JR4 guiding catheter | Cordis Corp | 67208200 | 6F |
| Lidocaine | Quala | - | - |
| Mersilk | Ethicon | W584 | 2-0 |
| Metoprolol succinate | Wockhardt | - | - |
| Microtome | Leica | RM2125RT | - |
| Mobile C arm fluoroscopy equipment | GE Healthcare | OEC 9900 Elite | - |
| Pacemaker | St Jude Medical | PM1272 | Assurity MRI pacemaker |
| Pacemaker generator | St Jude Medical | Merlln model 3330 | - |
| Pressure-volume catheter | CD Leycom | CA-71103-PL | 7F |
| Pressure–volume signal processor | CD Leycom | SIGMA-M | - |
| Programmable Stimulator | Medtronic Inc | 5328 | - |
| PTCA Dilatation balloon Catheter | Boston Scientific | H7493919120250 | MAVERICK over the wire |
| Ramipril | TEVA | - | - |
| Sheath introducer | Cordis Corp | 504608X | 8F, 9F, 12F |
| Steroid | Versus Arthritis | - | - |
| Temgesic | Nindivior | - | buprenorphine |
| Venous indwelling needle | TERUMO | SR+OX2225C | 22G |
| Vicryl | Ethicon | VCP320H | 2-0 |
| Xylazine | Alfasan International B.V. | - | - |
| Zoletil | Virbac New Zealand Limited | - | tiletamine+zolezepam |
Referanslar
- Mozaffarian, D., et al. Heart disease and stroke statistics-2015 update: a report from the American Heart Association. Circulation. 131, e29 (2015).
- Hospital Authority. . Hospital Authority Statistical Report 2013. , (2013).
- Cung, T. T., et al. Cyclosporine before PCI in Patients with Acute Myocardial Infarction. The New England Journal of Medicine. 373 (11), 1021-1031 (2015).
- Liao, S. Y., et al. Proarrhythmic risk of embryonic stem cell-derived cardiomyocyte transplantation in infarcted myocardium. Heart Rhythm. 7, 1852-1859 (2010).
- Liao, S. Y., et al. Overexpression of Kir2.1 channel in embryonic stem cell-derived cardiomyocytes attenuates posttransplantation proarrhythmic risk in myocardial infarction. Heart Rhythm. 10, 273-282 (2013).
- Liu, Y., et al. Thoracic spinal cord stimulation improves cardiac contractile function and myocardial oxygen consumption in a porcine model of ischemic heart failure. Journal of Cardiovascular Electrophysiology. 23, 534-540 (2012).
- Liao, S. Y., et al. Improvement of Myocardial Function Following Catheter-Based Renal Denervation in Heart Failure. JACC: Basic to Translational Science. 2 (3), 270-281 (2017).
- Liao, S. Y., et al. Remodelling of cardiac sympathetic re-innervation with thoracic spinal cord stimulation improves left ventricular function in a porcine model of heart failure. Europace. 17 (12), 1875-1883 (2015).
- Daehnert, I., Rotzsch, C., Wiener, M., Schneider, P. Rapid right ventricular pacing is an alternative to adenosine in catheter interventional procedures for congenital heart disease. Heart. 90 (9), 1047-1050 (2004).
- Hála, P., et al. Tachycardia-Induced Cardiomyopathy as a Chronic Heart Failure Model in Swine. Journal of Visualized Experiments. (132), e57030 (2018).
- Santoso, T., et al. Endomyocardial implantation of autologous bone marrow mononuclear cells in advanced ischemic heart failure: a randomized placebo-controlled trial (END-HF). Journal of Cardiovascular Translational Research. 7, 545-552 (2014).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network. Effect of intracoronary delivery of autologous bone marrow mononuclear cells 2 to 3 weeks following acute myocardial infarction on left ventricular function: the LateTIME randomized trial. Journal of the American Medical Association. 306, 2110-2119 (2011).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network (CCTRN). Effect of the use and timing of bone marrow mononuclear cell delivery on left ventricular function after acute myocardial infarction: the TIME randomized trial. Journal of the American Medical Association. 308, 2380-2389 (2012).
- de Jong, R., Houtgraaf, J. H., Samiei, S., Boersma, E., Duckers, H. J. Intracoronary stem cell infusion after myocardial infarction. A meta-analysis and update on clinical trials. Circulation: Cardiovascular Interventions. 7, 156-167 (2014).
- Nowbar, A. N., et al. DAMASCENE writing group. Discrepancies in autologous bone marrow stem cell trials and enhancement of ejection fraction (DAMASCENE): weighted regression and meta-analysis. British Medical Journal. 348, g2688 (2014).
- Kanelidis, A. J., Premer, C., Lopez, J., Balkan, W., Hare, J. M. Route of Delivery Modulates the Efficacy of Mesenchymal Stem Cell Therapy for Myocardial Infarction: A Meta-Analysis of Preclinical Studies and Clinical Trials. Circulation Research. 120 (7), 1139-1150 (2017).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112 (9 Suppl), I150-I156 (2005).
- Hu, X., et al. A Large-Scale Investigation of Hypoxia-Preconditioned Allogeneic Mesenchymal Stem Cells for Myocardial Repair in Nonhuman Primates: Paracrine Activity Without Remuscularization. Circulation Research. 118, 970-983 (2016).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Martens, A., et al. Substantial early loss of induced pluripotent stem cells following transplantation in myocardial infarction. Artificial Organs. 38, 978-984 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538, 388-391 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır