Method Article
幹細胞治療のための心筋梗塞後心不全の豚モデルの確立
要約
左屈折性動脈閉塞と急速なペーシングによって引き起こされる心不全の豚モデルを確立し、細胞ベースの治療法に対する幹細胞の筋膜内投与の効果と安全性をテストすることを目的とした。
要約
心筋梗塞(MI)に続く心不全(HF)の治療において進歩が達成されているが、MIに続くHFは、世界中の死亡率および罹患率の主要な原因の1つである。心臓修復のための細胞ベースの治療法とMI後の左心室機能の改善はかなりの注目を集めています。したがって、これらの細胞移植の安全性および有効性は、臨床使用前にHFの前臨床大動物モデルで試験されるべきである。豚は、心臓の大きさと冠状動脈解剖学の面で人間との類似性のために心血管疾患の研究に広く使用されています。そこで、左回折動脈の閉じた胸部冠状バルーン閉塞(LCX)を用いたブタ慢性HFモデルの確立に有効なプロトコルを提示し、続いてペースメーカーの移植によって誘発される急速な心室ペーシングを求めた。8週間後、幹細胞は梗塞周辺領域で心筋内注射によって投与された。次に梗塞サイズ、細胞生存、および左心室機能(心エコー検査、血行力学パラメータ、および電気生理学を含む)を評価した。本研究は、幹細胞治療のための安定した前臨床前の大型動物HFモデルを確立するのに役立つ。
概要
心血管疾患、特に冠動脈疾患(CAD)は、香港および世界で罹患率および死亡率の主な原因であり続ける1.香港では、病院当局の下で治療を受けたCAD患者数の2012年から2017年までの26%の増加が予測された。すべてのCADの中で、急性心筋梗塞(MI)は心不全(HF)などの死亡およびそれに続く合併症の主要な原因である。これらは、重大な医療、社会的、財政的負担に貢献します。MI患者では、血栓溶解療法または一次経皮的冠動脈介入(PCI)は生命を維持するのに有効な治療法であるが、これらの治療法はMI中の心筋細胞(CM)の損失を減らすだけである。利用可能な治療は、心臓線維症、心筋リモデリング、心臓不整脈、および最終的に心不全につながるCMの永久的な損失を補充することができません。1年後MIの死亡率は約7%で、20%以上の患者がHF3を発症している。末期のHF患者では、心臓移植は有効な唯一の治療であるが、利用可能な臓器の不足によって制限される。新しい治療法は、ポストMI HFの開発を逆転させるために必要です。その結果、細胞系療法は、障害のあるCMを修復し、MIに続くHFにおける左心室(LV)機能を改善するための魅力的なアプローチと考えられている。我々の以前の研究では、幹細胞移植は、MI44,55の小動物モデルにおける直接心筋移植後の心臓機能改善に有益であることがわかった。標準化された前臨床前の大きい動物のHFの議定書は従って臨床使用の前に幹細胞移植の有効性および安全性をさらにテストするために必要である。
ここ数十年、幹細胞療法の心臓血管研究における豚の広範な使用を目撃しています。HF豚は、心臓のサイズ、体重、リズム、機能、冠動脈解剖学の観点から人間との類似性のために、翻訳研究の有望なモデルです。さらに、ブタHFモデルは、CM代謝、電気生理学的特性、および虚血状態下での神経内分泌変化の点でポストMI HF患者を模倣することができる6。ここで提示されるプロトコルは、このような標準化された豚HFモデルを使用し、左回折動脈(LCX)の閉胸冠動脈バルーン閉塞を採用し、その後ペースメーカーの移植によって誘導される急速なペーシングを採用する。この研究はまた、ポストMI HFの治療のための幹細胞の筋膜内投与の経路を最適化する。目的は、重症CAD患者に臨床的に関連する治療法を開発するために使用することができる慢性心筋梗塞のブタ動物モデルを生成することです。
プロトコル
すべての動物実験は、米国国立衛生研究所が香港大学の国立衛生および規制で発表した実験動物のケアと使用ガイドに従って行われ、この議定書は香港大学の教育研究における生きた動物の使用に関する委員会(CULTAR)によって承認されました。
注:この研究には、体重35〜40kg(9-12ヶ月)の雌養豚が使用されました。この実験のフローチャートを 図 1に示します。
1. 外科的処置
- 動物の麻酔と準備
- 動物を12時間速くし、実験の前に4時間水の剥奪を受ける。
- 通常の生理食前の20 mLで調製したタイルアミン+ゾレゼパム(2-7 mg/kg)およびキシラジン(0.5-1 mg/kg)の筋肉内注射を通じてブタを麻酔します。動物の手のひらの反射を、それらが欠けるまで監視します。
- 豚の毛を取り除き、首の皮膚とセクション1.3-1.5の鼠径部を殺菌します。操作領域3xを70%エタノールおよびベタジンで消毒する。
- 7mmの気管チューブをブタ気管に入れ、耳の静脈に22G静脈内留針を入れる。
- 豚を手術台に移動し、サピイン位置に配置します。気管内チューブを呼吸器に接続し、機械換気(吸気/発呼時間比1:2)イソフルラン(1.5%-2.0%吸入)と酸素(0.5-1.5 L/分吸入)を有する動物を接続します。
- 表面心電図と血圧を監視し、電気生理学記録システムを介して心拍数、心臓リズム、および動脈血圧を継続的に監視します。
- 心エコー撮影
- 豚を左横の褥瘡の位置に移動し、テーブルの上に固定します。
- プローブを心膜領域に置き、2DおよびMモードイメージングを含むシリアル心エコー検査を行い、高解像心エコーシステムと3〜9MHzトランスデューサをベースラインで使用し、細胞移植前および細胞移植後8週間(補足図1)を行う。
- 市販のソフトウェアを使用して、取得したすべての画像を分析します。LV末端拡張期寸法(LVEDD)、LV末端収縮期寸法(LVESD)、LV末端拡張期容積(LVEDV)、LV末端収縮量(LVESV)、LV放出画分(LVEF)、および標準心エコー画像後の壁厚さを、パラシュタル長軸図から計算します。
注: すべてのオフライン解析は、コンピュータワークステーションを使用して別の独立したオペレータによって行われました。異なる観察者間の測定値の変動は、20の繰り返されたランダム画像に基づいて4%であった。すべての心エコー測定は、米国心エコー学会の勧告に従って行われた。
- ペースメーカーの移植
- 豚をサピーヌの位置に移動し、テーブルの上の豚の手足をストラップで固定します。
- 頸動脈三角形(胸膜筋の後ろ、スチロヒヨード、ジガスト筋、オモヒドイドに囲まれた)の右頸動脈と頸静脈を見つけ、生殖不能状態下で右頸動脈および頸静脈を止血圧力差で分離する(図2)。右頸動脈と頸静脈の遠位端をリゲートします。2-0ヴィクリルで2つの筋肉を縫います。
- 右頸静脈を血管炎でカニュールし、X線ガイダンスの下で右心室にペースメーカーを挿入する(図2)。
- 鉗子を使用して胸骨筋と前鱗癬筋を分離する。2つの筋肉の間にペースメーカーを植え付け、2-0シルクで2つの筋肉を縫います。ペースメーカーをリードに接続します。
- 移植後にペースメーカーの発電機でVVIモード(35bpm)をバックアップするようにペースメーカーを再プログラムします。
- MI誘導の4週間後にペースメーカーの発電機によってHFを誘発するために急速な心室のペーシング(150拍/分)を適用する。その後、ペースメーカーをバックアップVVIモードを8週間に戻します。
- 侵襲的圧力量ループ解析
注意:細胞移植前、細胞移植後8週間、LV機能の変化を評価するために、ベースラインで侵襲的な血行力学的評価を行います。- 大腿骨三角形(りぎりな靭帯、サルトリウス筋、内転筋長筋に囲まれた)で右大腿動脈と大腿静脈を単離する(補足図2)。
- 右大腿動脈を血管カスでカニュール化し、血管カスを介して動脈にガイドワイヤーを配置する。血管を取り除き、ガイドワイヤーの指導の下で動脈に9Fシースをカニューレートします。ガイドワイヤを取り外します。
- ステップ1.4.2に記載されているように、右大腿静脈を12Fシースでカニュールする。配置された12Fシースからバルーンカテーテルを下の静脈(IVC)にX線誘導の下に挿入します。
- 7 Fr圧力量(PV)カテーテルをPV信号プロセッサで等張生理食合にキャリブレーションします。
- PVカテーテルをX線ガイダンスの下に配置された9FシースからLVの頂点に挿入します。換気を中断し、PV信号プロセッサで左心室最大正圧誘導体(+dP/dt)、終期収縮期圧(ESP)、およびエンド拡張期圧(EDP)を測定します。
- IVCの閉塞時にPV信号プロセッサによるエンドシストリック圧容積関係(ESPVR)を測定します。
- 手順が終了したら、換気を再開します。
- MIの誘導
- アミオダロン(5mg/kgを1時間以上静脈内に静脈内)とリドカイン(1.5mg/kg静脈内ボーラス)を心室不整脈の誘導前に動物に静脈内投与する。
- ステップ1.4.3で述べたように8Fの鞘で右頸動脈をカニューレートする。
- 標準的なC腕の透視検査装置によって導かれる置かれた外装を介して6F JR4のワイヤー通しのガイドカテーテルを通して冠状血管造影を行う。
- X線ガイダンスの下で、左角折性冠動脈(LCX)を経皮的な経年冠動脈形成術(PTCA)拡張バルーンカテーテルインフレで第1の閉塞性限界枝に遠位する(図2)。
- バルーンカテーテルを介して10mLのシリンで調製した生理食音3mLと混合した700μmスポンジマイクロスフィアの1mLを注入し、バルーンを収縮させ、血管造影を行い、閉塞を確認します。
- 正常に完全な閉塞を達成するために注入手順を繰り返します。
- 動物の心拍数とリズムを監視して、心臓不整脈を検出します。心室細動が起こった場合は、外部の二ファシ性除細動器を使用して、150-300 Jショックを使用して中症のリズムを再確立します。
- 幹細胞注射
- 心臓機能の顕著な障害を持つすべての動物(MI誘導後8週間で40%)を2つの異なるグループに無作為に割り当てる:1つは2 x 108 ヒト人工多能性幹細胞由来の多発性幹細胞(hiPSC-MCC)の心筋内投与を受けるもの、およびhiPSC-MSCを受け取らない他のグループである。
- ヒプスカ-MSCを正常生理的な生理学的な移植のために2 mLで準備する。筋膜内hiPSC-MSP移植の前に、セクション1.1に記載されている麻酔および動物の調製手順を繰り返し、今度は頂点ビート領域の周りに10cmを殺菌する。リトラクターで4-5肋間空間で左の左の分腔間のトミーを行う。心膜切り術を行い、梗塞横壁を露出する。
注:切開の長さは10〜12cmであった。 - 梗塞領域の周りに5-8の心筋注射(約0.3 mL)を使用して、培養培地(材料表)を1つの群の動物または2 x 108 hiPSC-MCCを他方の群に投与する(図3)。any出血のリスクを減らすために、冠状動脈への損傷を慎重に避けてください。
- 鉄のワイヤーで肋間空間を閉じ、2-0シルクで筋肉層を閉じます。皮下組織と皮膚を2-0ビクリルで縫う。
- 心臓内プログラムによる電気刺激
- プログラム可能な刺激装置を用いてプログラムされた電気刺激を行い、細胞移植療法後の心室頻脈(VT)の不助振を評価する。
- すべての動物を犠牲にする前に、大腿静脈を介して右心室の頂点に6F電気生理学的カテーテルを挿入します。
- 200mm/sの速度で電気生理学的記録システム上の表面心電図の導きI、II、およびIIIとの心臓内の記録を表示する。刺激装置を使用して、2倍の拡張期の閾値で2ミリ秒のパルス幅を提供する。
- 2つのドライブサイクル長(200 msと300 ms)で8回の刺激(S1)のペーシングトレインを提供し、次に1つ(S2)または2(S2およびS3)早期の余分な刺激を提供します。
- 心室有効難治期または不整脈が誘発されるまで、結合間隔を順次短くする。誘導可能な持続VT(>10 s)の存在に注意してください。
2. 術後プロトコル
- 術後医療
- HFのための従来の薬理学的療法を行う。簡単に, 経口はメトプロロールコハク酸 (25 mg) とラミプリル (2.5 mg) を毎日すべての動物に投与します。
- 感染を予防し、痛みを和らげるために、手術後1週間、毎日すべての動物にエンロフロキサシン(5mg/kg)とブプレノルフィン(0.01mg/kg)を筋肉内投与する。
- 免疫学的拒絶反応を最小限に抑えるために、ステロイド(40mg/日経口)およびシクロスポリン(200mg/日経口)を細胞移植の3日前から8週間後まで全ての動物に経口投与する。
- 梗塞サイズ評価
- 実験の最後にドーミナル(ペントバルビタールナトリウム、100mg/kg、IV)の過剰摂取によって動物を安楽死させる。
- 胸を開き、心臓を収集します。0.9%生理食いで心臓をすすい。
- LV横方向の厚さ1cmのメスを有するLV組織サンプルを連続的に切片する。
- 梗塞した心筋を含むスライスの部分を選択して、壁の厚さと梗塞領域を測定します。
- これらのスライスの画像をキャプチャし、商業画像解析ソフトウェアを使用して、壁の厚さと梗塞領域を定量的に分析します。
- 4°Cで10%ホルマリンで1ヶ月間組織を固定します。組織内に組織を埋め込み、隣接し、かつ梗塞部位(約1cm2 個)にパラフィンに埋め込む。組織学的検査のためにミクロトームを用いて5μmのスライスにセクション。
- 細胞生存
- 抗ヒト核抗原(HNA)による免疫染色により移植細胞の生着を、製造業者が提供するプロトコルに従って検出する。
- 各動物の5つのランダムフィールドで3つの異なるセクションに画像をキャプチャし、梗塞部内の陽性細胞を定量的に分析します。
注:画像キャプチャシステムと画像解析ソフトウェアは、心臓セクションの画像をキャプチャして分析するために使用されました。
結果
死亡 率
この研究では合計24匹の豚が使用された。そのうちの3つは、持続的なVTのためにMI誘導中に死亡した。1匹の動物が創傷出血のために細胞注射のための開胸手術で死亡した。重症感染のため2匹の動物が死亡した。EFの減少(LVEFの減少>ベースラインの40%)のために2匹の動物が除外された。その結果、16匹の動物が全研究プロトコルを完成させた。
心臓機能とリモデリング
連続心エコー検査では、LVEFがベースラインで68.23±3.52%から39.37±3.22%に有意に減少した。LVEDDは3.6±0.5から4.8±0.4に大幅に増加し、LVESDはMI誘導後8週間で2.5±0.3から3.9±0.4(図4A)に大幅に増加した。 LVEFおよびLVESDは、移植後8週間のhiPSC-MSP群でそれぞれ52.9±4.27%および3.3±0.3に大幅に改善した(図4A)。
+dP/dtおよびESPVRは、MI誘導後8週間でベースラインの1,325±63mmHg/sおよび3.9±0.4から978±45mmHg/sおよび1.8±0.2に大幅に減少した。 hiPSC-MCsの筋膜内投与は、IPSC-MSC移植後8週間で+dP/dtおよびESPVRを1,127.4±50mmHg/sに増加させ、2.6±0.3をMIステータスと比較した(図4B)。
梗塞壁厚
平均LV梗塞壁厚は、各動物の5~7通りのシリアル1cm厚さセクションサンプルから測定した(図5)。LV梗塞の割合は16±2%であった。
移植後の細胞生存
移植後8週間の梗塞領域では、注射部位の周りに細胞生存はなかったが、少数の生存休止状態のhiPSC-MSPが梗塞周辺領域に見えた(図6)。
誘導性心室不整脈
誘発性持続性心室頻脈の発生率は、HFを有する動物で容易に増加することができる(ベースラインで10%対75%MI誘導後8週間)。hiPSC-MSP移植は、VTに対する感受性を低下させるために基礎となる心筋基質を有意に改変しない(hiPSC-CSCs群では62.5%hiPSC-CSCsの心内投与後8週間、図7)。
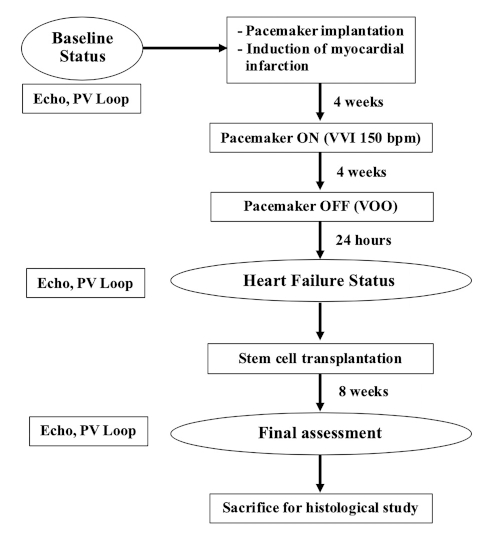
図1:実験のフローチャート。この図の大きなバージョンを表示するには、ここをクリックしてください。
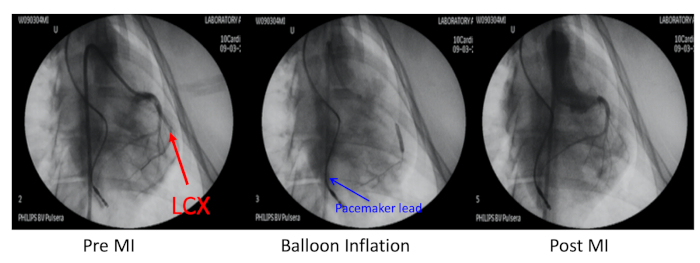
図2:心筋梗塞のブタモデル 心筋梗塞(MI)のブタモデルは、左回折冠動脈(LCX、赤矢印)の第1の閉塞限界枝に遠位の塞栓によって誘導された。この冠状動脈は、バルーンインフレーションと700 μmマイクロスフィアの注入で閉塞しました。前MI、バルーンインフレーション、およびポストMIにおける冠動脈造影を、右頸動脈を介して6F JR4誘導カテーテルを介して行った。ペースメーカーのリードは右心室壁(青い矢印)に挿入されました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
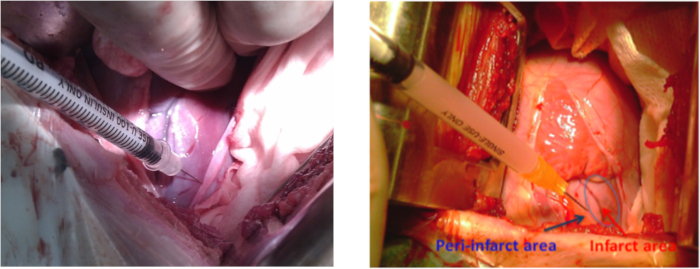
図3:MIのブタモデルにおける細胞移植 左口腔間術の際に左心室の梗塞領域の周りの側壁に細胞注入部位。青い矢印は梗塞周辺を示し、赤い矢印は梗塞領域を示す。 この図の大きなバージョンを表示するには、ここをクリックしてください。
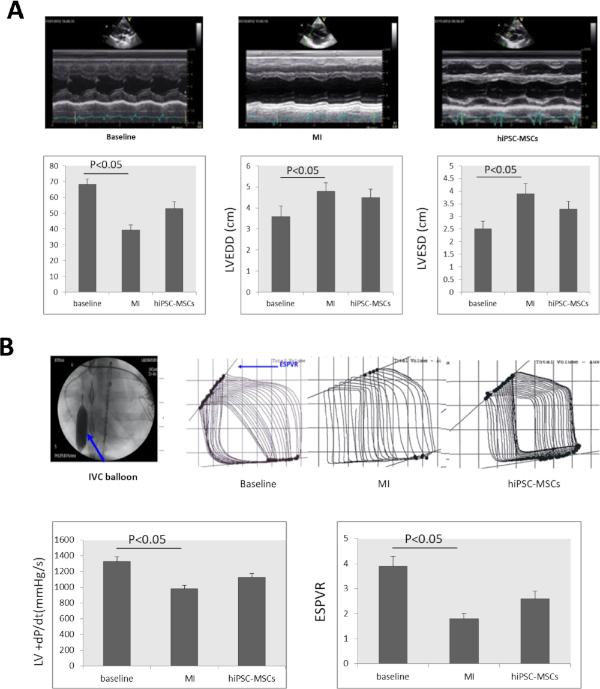
図4:MI後に心臓機能が変化する。(A)ベースライン、MI、および細胞移植におけるLV Mモード心エコー図画像。LVEF,LVEDD,LVESDはMI誘導後8週間で有意に減少し,細胞移植後8週間のhiPSC-MSP群では有意に増加した.(B)心不全を有する豚の心機能を評価するために、+dP/dt値およびESPVRをPV信号プロセッサで測定した。下の大静脈(IVC)は、ESPVR評価中にバルーンインフレ(青い矢印)によって閉塞されました。+dP/dtとESPVRの両方がMI誘導後に有意に減少し、移植後8週間のhiPSC-MSC群で有意に増加した。ANOVAの後に学生-ニューマン・キュースのポストホックテスト(SPSS、バージョン14)が有意のためにα = 0.05で使用されました。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:梗塞領域がMI後に変化する。 梗塞した心筋を含む各心臓の1cm厚で切片されたLV横方向サンプル。 この図の大きなバージョンを表示するには、ここをクリックしてください。
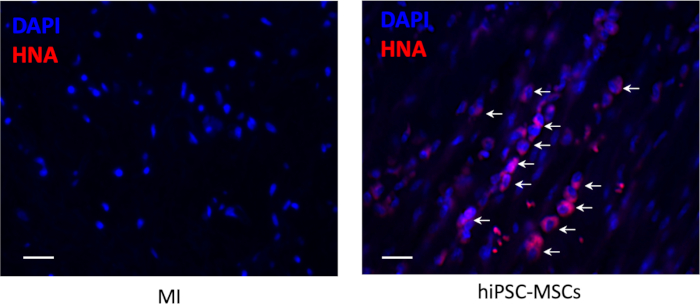
図6:移植後の細胞生存率。 移植したhiPSC-MSPの生着は、抗ヒト核抗原(赤色)に対する免疫物質化学的染色によって検出された。スケールバー= 100 μm矢印は正のセルを表します。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図7:持続的な心室頻脈の発生率。(A)脳室頻脈性不整脈(VT、赤矢印)により誘導される生体内心臓内プログラム電気刺激。(B) MI誘導後にVTの発生率が有意に増加した。細胞移植はVTの発生率を増加させなかった。この図の大きなバージョンを表示するには、ここをクリックしてください。

補足図1:心エコー図の取得 左パネルは動物の位置を示します。右側のパネルにプローブの位置が表示されます。中央のパネルには、この位置の下の心エコー画像が表示されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
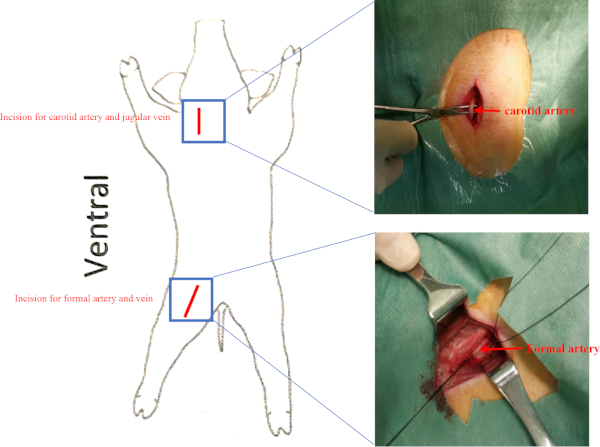
補足図2:船舶の位置 豚は、サピネの位置に配置されました。頸動脈および大腿動脈の切開は赤い線として提示される。頸静脈と大腿静脈はそれぞれ頸動脈と大腿動脈の下にあった。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
標準的な動物モデルは、疾患の病態生理学とメカニズムを理解し、新しい治療法をテストすることが最も重要です。我々のプロトコルは左の屈曲の動脈閉塞および急速なペーシングによって誘発されるHFのブタモデルを確立する。MIの誘導の8週間後、動物はLVEF、LVEDD、LVESD、+dP/dt、およびESPVRの有意な障害を発症した。このプロトコルはまた、心筋内注射による心臓再生のための幹細胞療法の投与方法をテストする。梗塞サイズ、および心収縮期および拡張期機能が評価される。この研究は、臨床症例に似た幹細胞治療のための安定した再現性のある前臨床大動物HFモデルを確立するのに役立つ。
LCXの閉塞と急速なペーシングは、我々の以前の研究77、88でHFの動物モデルを作成するために広く使用されてきた。最初の鈍い限界枝へのLCX遠位は閉塞し、続いて4週間の急速な右心室ペーシングが続いた。心筋虚血は、心臓線維症、心筋リモデリング、および心臓不整脈を引き起こすMI中の心筋細胞の損失をもたらす。心室ペーシングは、重要なLV拡張、左心室収縮性の非虚血性障害、および重度のLV機能不全99、1010をもたらす。虚血と急速なペーシングの長い期間は、翻訳研究のための進歩的な実験的低出力HFモデルを生成する。これまでの研究は、MI10を誘導することによって心不全モデルを確立した。しかし、重症のMIの死亡率は高く、MIのLVEF減少は不安定であった。したがって、LCX閉塞後の急速右心室ペーシングを適用して、心機能の重大な障害を誘発する。我々の以前の研究で見ることができるように、ここで提示されたモデルは安定した梗塞サイズを生み出し、このモデルのLVEFは少なくとも40%の正常66、7、87,8を下回る。感染や出血が少なければ、私たちのモデルの成功率は約80%であった可能性があります。
幹細胞の臨床応用の大きなハードルの1つは、移植後の生存率と生着の悪さです。最近の臨床研究およびメタ分析1111、12、13、14、15は、そのような治療に続くLV機能または梗塞サイズの一貫した改善を実証することができなかった。,12,13,14,15潜在的な理由の1つは、移植された細胞の生存率が低い。最適な投与方法を発見することは、幹細胞療法において重要な役割を果たす。細胞移植の3つの方法を比較すると、心筋内投与は、細胞保持率16,17,17の高さによる静脈内および冠動脈内投与よりも効率的である。そこで、本研究ではiPSC-MSCの送達のための心筋内投与経路を選択した。心エコーの結果と侵襲的な血行学的結果は、iPSC-MSPの心筋内投与が細胞移植後8週間後にポストMI HFブタのLV機能を改善したことを示した。免疫抑制薬(ステロイドおよびシクロスポリン)の投与にもかかわらず、梗塞周辺領域では移植された細胞はほんのわずかしか検出されなかった。注入部位の梗塞周辺では生存細胞は検出されなかった。以前の研究では、移植後の梗塞心筋内の幹細胞の極めて小さな部分も発見されています18,,19,,20, 21.,21心筋内投与中の細胞喪失は、実験結果に影響を与える可能性がある。管理方法を改善し、居住率を高める方法は、今後の研究で明確化すべきである。
安全性、特に不整脈形成は、細胞ベースの治療法を用いた臨床実践に関するもう一つの重要な懸念事項である。我々の最近の研究は、ヒト胚幹細胞(hESC)由来のCMの心筋内投与が自発的な非持続性心室頻脈不整脈の発生率を増加させたことを示した。当社のポストMI HFブタブタモデルでは、ペースメーカーからのテレメトリモニタリングによって記録された自発的な非持続性心室頻脈(レート>180 bpmおよび>12ビート)の発生率はMI誘導後に25%であったが、持続VTは容易に誘発され得る(80%)。本研究では、hiPSC-CSCs投与の有無にかかわらず、突然死の発生率は変わらない。さらに、hiPSC-MSC移植は、心室性不整脈に対する感受性を低下または増加させるために基礎となる心筋基質を改変しなかった。この結果は、大型動物慢性HFモデルが細胞安全性評価に使用できることを示唆している。
感染の回避と出血は、動物モデルの確立を成功させるために最も重要です。出血のリスクを減らすために、冠状動脈および心臓静脈への損傷を避けるために注意を払うべきである。2匹の動物が重篤な感染症で死亡したので、適切な術後医療戦略が恩恵を受けるだろう。ここでは、筋肉内にエンロフロキサシン(7.5mg/kg、SID)とブプレノルフィン(0.02 mg/kg、BID)を経口投与するアモキシシリン/クラヴラン酸(12.5mg/kg、SID)およびカルプロフェン(2mg/kg、SID)を手術後に全ての動物に投与し、1週間後に全ての痛みを軽減する術後の医療戦略を提供します。
要約すると、現在の方法は、細胞ベースの治療法のための心不全の安定した、再現可能な臨床的に関連する大きな動物モデルを提供する。
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、動物実験中の優れた技術サポートについて、アルフレダとカン・タク・チュンを認めている。
資料
| Name | Company | Catalog Number | Comments |
| Amiodarone | Mylan | - | - |
| Anaesthetic machines and respirator | Drager | Fabius plus XL | - |
| Angiocath | Becton Dickinson | 381147 | - |
| Anti-human nuclear antigen | abcam | ab19118 | - |
| Axio Plus image capturing system | Zeiss | Axioskop 2 PLUS | Axioskop 2 plus |
| AxioVision Rel. 4.5 software | Zeiss | - | - |
| Baytril | Bayer | - | enrofloxacin |
| Betadine | Mundipharma | - | - |
| CardioLab Electrophysiology Recording Systems | GE Healthcare | G220f | - |
| Culture media | MesenCult | 05420 | - |
| Cyclosporine | Novartis | - | - |
| Defibrillator | GE Healthcare | CardioServ | - |
| Dorminal | TEVA | - | - |
| Echocardiographic system | GE Vingmed | Vivid i | - |
| EchoPac software | GE Vingmed | - | - |
| Electrophysiological catheter | Cordis Corp | - | - |
| Embozene Microsphere | Boston Scientific | 17020-S1 | 700 μm |
| Endotracheal tube | Vet Care | VCPET70PCW | Size 7 |
| Ethanol | VWR chemicals | 20821.33 | - |
| Formalin | Sigma | HT501320 | 10% |
| IVC balloon Dilatation Catheter | Boston Scientific | 3917112041 | Mustang |
| JR4 guiding catheter | Cordis Corp | 67208200 | 6F |
| Lidocaine | Quala | - | - |
| Mersilk | Ethicon | W584 | 2-0 |
| Metoprolol succinate | Wockhardt | - | - |
| Microtome | Leica | RM2125RT | - |
| Mobile C arm fluoroscopy equipment | GE Healthcare | OEC 9900 Elite | - |
| Pacemaker | St Jude Medical | PM1272 | Assurity MRI pacemaker |
| Pacemaker generator | St Jude Medical | Merlln model 3330 | - |
| Pressure-volume catheter | CD Leycom | CA-71103-PL | 7F |
| Pressure–volume signal processor | CD Leycom | SIGMA-M | - |
| Programmable Stimulator | Medtronic Inc | 5328 | - |
| PTCA Dilatation balloon Catheter | Boston Scientific | H7493919120250 | MAVERICK over the wire |
| Ramipril | TEVA | - | - |
| Sheath introducer | Cordis Corp | 504608X | 8F, 9F, 12F |
| Steroid | Versus Arthritis | - | - |
| Temgesic | Nindivior | - | buprenorphine |
| Venous indwelling needle | TERUMO | SR+OX2225C | 22G |
| Vicryl | Ethicon | VCP320H | 2-0 |
| Xylazine | Alfasan International B.V. | - | - |
| Zoletil | Virbac New Zealand Limited | - | tiletamine+zolezepam |
参考文献
- Mozaffarian, D., et al. Heart disease and stroke statistics-2015 update: a report from the American Heart Association. Circulation. 131, e29 (2015).
- Hospital Authority. . Hospital Authority Statistical Report 2013. , (2013).
- Cung, T. T., et al. Cyclosporine before PCI in Patients with Acute Myocardial Infarction. The New England Journal of Medicine. 373 (11), 1021-1031 (2015).
- Liao, S. Y., et al. Proarrhythmic risk of embryonic stem cell-derived cardiomyocyte transplantation in infarcted myocardium. Heart Rhythm. 7, 1852-1859 (2010).
- Liao, S. Y., et al. Overexpression of Kir2.1 channel in embryonic stem cell-derived cardiomyocytes attenuates posttransplantation proarrhythmic risk in myocardial infarction. Heart Rhythm. 10, 273-282 (2013).
- Liu, Y., et al. Thoracic spinal cord stimulation improves cardiac contractile function and myocardial oxygen consumption in a porcine model of ischemic heart failure. Journal of Cardiovascular Electrophysiology. 23, 534-540 (2012).
- Liao, S. Y., et al. Improvement of Myocardial Function Following Catheter-Based Renal Denervation in Heart Failure. JACC: Basic to Translational Science. 2 (3), 270-281 (2017).
- Liao, S. Y., et al. Remodelling of cardiac sympathetic re-innervation with thoracic spinal cord stimulation improves left ventricular function in a porcine model of heart failure. Europace. 17 (12), 1875-1883 (2015).
- Daehnert, I., Rotzsch, C., Wiener, M., Schneider, P. Rapid right ventricular pacing is an alternative to adenosine in catheter interventional procedures for congenital heart disease. Heart. 90 (9), 1047-1050 (2004).
- Hála, P., et al. Tachycardia-Induced Cardiomyopathy as a Chronic Heart Failure Model in Swine. Journal of Visualized Experiments. (132), e57030 (2018).
- Santoso, T., et al. Endomyocardial implantation of autologous bone marrow mononuclear cells in advanced ischemic heart failure: a randomized placebo-controlled trial (END-HF). Journal of Cardiovascular Translational Research. 7, 545-552 (2014).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network. Effect of intracoronary delivery of autologous bone marrow mononuclear cells 2 to 3 weeks following acute myocardial infarction on left ventricular function: the LateTIME randomized trial. Journal of the American Medical Association. 306, 2110-2119 (2011).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network (CCTRN). Effect of the use and timing of bone marrow mononuclear cell delivery on left ventricular function after acute myocardial infarction: the TIME randomized trial. Journal of the American Medical Association. 308, 2380-2389 (2012).
- de Jong, R., Houtgraaf, J. H., Samiei, S., Boersma, E., Duckers, H. J. Intracoronary stem cell infusion after myocardial infarction. A meta-analysis and update on clinical trials. Circulation: Cardiovascular Interventions. 7, 156-167 (2014).
- Nowbar, A. N., et al. DAMASCENE writing group. Discrepancies in autologous bone marrow stem cell trials and enhancement of ejection fraction (DAMASCENE): weighted regression and meta-analysis. British Medical Journal. 348, g2688 (2014).
- Kanelidis, A. J., Premer, C., Lopez, J., Balkan, W., Hare, J. M. Route of Delivery Modulates the Efficacy of Mesenchymal Stem Cell Therapy for Myocardial Infarction: A Meta-Analysis of Preclinical Studies and Clinical Trials. Circulation Research. 120 (7), 1139-1150 (2017).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112 (9 Suppl), I150-I156 (2005).
- Hu, X., et al. A Large-Scale Investigation of Hypoxia-Preconditioned Allogeneic Mesenchymal Stem Cells for Myocardial Repair in Nonhuman Primates: Paracrine Activity Without Remuscularization. Circulation Research. 118, 970-983 (2016).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Martens, A., et al. Substantial early loss of induced pluripotent stem cells following transplantation in myocardial infarction. Artificial Organs. 38, 978-984 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538, 388-391 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved