Method Article
建立干细胞治疗心肌梗塞心力衰竭的猪模型
摘要
我们寻求建立一个猪模型的心力衰竭引起的左环弹性动脉阻塞和快速起搏,以测试心肌内给给干细胞的效果和安全性的细胞为基础的疗法。
摘要
虽然在心肌梗塞(MI)后心力衰竭的治疗方面已取得进步,但MI后HF仍然是全世界死亡和发病的主要原因之一。MI后心脏修复和改善左心室功能的细胞疗法引起了相当大的关注。因此,这些细胞移植的安全性和有效性应在临床使用前在HF的临床前大型动物模型中进行测试。猪由于在心脏大小和冠状动脉解剖学方面与人类相似,被广泛用于心血管疾病研究。因此,我们寻求提出一个有效的方案,建立一个猪慢性HF模型使用封闭胸冠状动脉闭塞的左环弹性动脉(LCX),其次是快速心室起搏诱导与心脏起搏器植入。八周后,干细胞通过心肌注射在近腹区施用。然后评估梗塞大小、细胞存活率和左心室功能(包括心电图、血流动力学参数和电生理学)。本研究有助于建立一个稳定的临床前大型动物HF模型的干细胞治疗。
引言
心血管疾病,特别是冠状动脉疾病,仍然是香港及全球1月1日发病和死亡的主要原因。在香港,由2012至2017年,在医院管理局接受治疗的CAD病人人数预计增加26%。在所有病症中,急性心肌梗塞 (MI) 是导致死亡和随后的并发症(如心力衰竭 (HF))的主要原因。这些都带来了巨大的医疗、社会和财政负担。在 MI 患者中,血栓整流治疗或初级皮下冠状动脉干预 (PCI) 是保护生命的有效疗法,但这些疗法只能减少 MI 期间心肌细胞 (CM) 损失。可用的治疗方法无法补充CMs的永久性损失,导致心脏纤维化、心肌重塑、心律失常,并最终心力衰竭。MI后1年的死亡率约为7%,超过20%的患者患有HF3。在末期HF患者中,心脏移植是唯一可用的有效疗法,但受可用器官短缺的有限。新颖的疗法是扭转后MIHF的发展所必需的。因此,基于细胞的治疗被认为是一种有吸引力的方法,以修复受损的CMs和改善左心室(LV)功能在HF后MI。我们先前的研究发现,在MI4、5,的小动物模型中直接进行心肌移植后,干细胞移植对心脏功能的改善是有益的。因此,需要标准化的临床前大型动物HF方案,以进一步测试干细胞移植在临床使用前的有效性和安全性。
近几十年来,猪在心血管研究中的广泛使用,用于干细胞治疗。HF猪是一个很有前途的转化研究模式,由于其在心脏大小、体重、节律、功能和冠状动脉解剖方面与人类相似。此外,猪HF模型可以模仿后MIHF患者在CM代谢,电生理特性,神经内分泌变化在缺血条件下6。此处提出的协议使用这种标准化的猪HF模型,采用左环状动脉(LCX)的闭胸冠状气球闭塞,随后由心脏起搏器植入诱导的快速起搏。该研究还优化了干细胞在心肌内注射的路径,用于治疗后MI HF。其目的是制作慢性心肌梗塞的猪动物模型,可用于开发与严重 CAD 患者临床相关的治疗方法。
研究方案
所有动物实验都按照美国国家卫生研究院和香港大学法规所公布的《实验室动物护理和使用指南》进行,该议定书已获香港大学活动物教学及研究使用委员会(CULTAR)批准。
注:本研究使用体重35-40公斤(9-12个月大)的雌性农场猪。此实验的流程图如图 1 所示。
1. 外科手术
- 动物的麻醉和准备
- 禁食动物12小时,在实验前被水剥夺4小时。
- 通过用20 mL正常盐水(2-7毫克/千克)和Xylazine(0.5-1毫克/千克)的肌肉注射麻醉猪。监测动物的苍白反应,直到它们缺席。
- 去除猪的头发,对颈部和腹股沟的皮肤进行消毒,用于第1.3-1.5节。用70%乙醇和β丁对作业区域进行3倍消毒。
- 将一个 7 mm 的气管管放入猪气管中,将 22 G 静脉内孔注射针放入耳道中。
- 将猪移动到操作台上,并放在一个向上的位置。将气管管连接到呼吸器和机械通气(呼吸/呼气时间比1:2),动物与异氟兰(1.5%-2.0%吸入)和氧气(0.5-1.5 L/min吸入)。
- 通过电生理学记录系统监测表面心电图和血压,持续监测心率、心律和动脉血压。
- 超声 心动 图
- 将猪移动到左侧的二角体位置,并固定在桌子上。
- 将探头放在心上区域,在细胞移植前和细胞移植后8周使用高分辨率超声心动图系统和基线上的3-9 MHz传感器进行串行超声心动图,包括2D和M模式成像(补充图1)。
- 使用商业软件分析所有获得的图像。从准星长轴视图获取标准超声心动图后,计算 LV 端形舒张尺寸 (LVEDD)、LV 端形收缩尺寸 (LVESD)、LV 端形舒张体积 (LVEDV)、LV 端形收缩体积 (LVESV)、LV 喷射分数 (LVEF) 和壁厚。
注:所有在线分析由另一个独立操作员使用计算机工作站进行。根据20个重复的随机图像,不同观测者之间的测量值变异性为4%。所有超声心动量测量都是按照美国超声心动图学会的建议进行的。
- 起搏器植入
- 将猪移动到上肢位置,用带子将猪的四肢固定在桌子上。
- 在胡萝卜三角形中定位右胡萝卜状动脉和血管静脉(在尾体三角形后面,周围是软骨肌、结节肌和软体),并在无菌条件下用止血钳分离右胡萝卜状动脉和血管静脉(补充图2)。将右胡萝卜动脉和血管的后端拉开。以 2: 0 维里尔的两块肌肉。
- 用血管结节将右血管插入右血管,并在 X 射线指导下插入心脏起搏器引线到右心室(图 2)。
- 使用钳子隔离胸骨肌肽和前部规模肌肉。在两块肌肉之间植入一个心脏起搏器,用2-0的丝绸缝制两块肌肉。将心脏起搏器连接到引线。
- 移植后,通过心脏起搏器发生器重新编程心脏起搏器以备份 VVI 模式 (35 bpm)。
- 应用快速心室起搏(150 节拍/分钟),在 MI 感应后 4 周通过心脏起搏器发生器诱导 HF。然后将心脏起搏器设置回备份 VVI 模式 8 周。
- 侵入性压力体积回路分析
注:在基线、细胞移植前和细胞移植后8周进行侵入性血动力评估,以评估LV功能的变化。- 在股骨三角形中分离右股动脉和股骨静脉(被内侧韧带、沙体肌和加法器长骨肌包围)(补充图2)。
- 用血管瘤将右股动脉拉大,然后通过血管瘤将导线插入动脉。取出血管,在导线的指导下将 9F 护套插入动脉。拆下导线。
- 如步骤 1.4.2 所述,使用 12F 护套可对右侧股骨静脉进行测量。在 X 射线指导下,将气球导管从放置的 12F 护套插入劣质的 Vena 卡瓦 (IVC) 中。
- 使用 PV 信号处理器在同位素盐水中校准 7 Fr 压力体积 (PV) 导管。
- 在 X 射线引导下,从放置的 9F 护套将 PV 导管插入 LV 顶点。使用 PV 信号处理器暂停通风并测量左心室最大正压导数 (+dP/dt)、端收缩压 (ESP) 和最终舒张压 (EDP)。
- 在 IVC 遮挡期间,由 PV 信号处理器测量端收缩压体积关系 (ESPVR)。
- 过程完成后重新启动通风。
- MI 的诱导
- 在MI诱导之前,静脉注射给动物注射阿米奥达龙(5毫克/千克静脉注射超过1小时)和利多卡因(1.5毫克/千克静脉注射脂),以防止心室心律失常。
- 如步骤 1.4.3 中所述,用 8F 护套将右侧胡萝卜动脉进行扫描。
- 通过 6F JR4 线导导管,通过由标准 C 臂荧光镜设备引导的放置护套进行冠状动脉造影。
- 在 X 射线指导下,左环状冠状动脉 (LCX) 与皮下透骨血管成形术 (PTCA) 分离气球导管膨胀处关闭至第一个迟钝边缘分支(图2)。
- 注入 1 mL 的 700 μm 海绵微球,与 10 mL 注射器中制备的 3 mL 盐水混合,通过气球导管阻止 LCX,然后放气气球并进行动物图检查以确认遮挡。
- 重复喷射过程,实现完全堵塞。
- 监测动物心率和节奏,以检测心律失常。如果发生心室颤动,使用外部双相除颤器使用 150-300 J 冲击重新建立鼻窦节律。
- 干细胞注射
- 随机将所有心脏功能明显受损的动物(LVEF < 40%在MI诱导后8周)分配给两个不同的组:一组接受2 x 108 人类诱导多能干细胞衍生的细胞(hiPSC-MSCs)的心肌内给用,另一组不会接受hiPSC-MSC。
- 在2mL的正常盐水中准备hiPSC-MSC进行心内移植。在心肌内 hiPSC-MSC 移植之前,重复第 1.1 节中提到的麻醉和动物准备步骤,这次在顶点节拍区域周围消毒 10 厘米。使用缩回器在 4-5 成本间空间进行左胸切除术。进行心内切除术,以暴露梗死的横向壁。
注:切口长度为10-12厘米。 - 在梗塞区域周围使用5-8次心肌注射(每注射约0.3 mL),Table of Materials对一组动物进行培养介质(材料表),或向另一组动物施用2 x 108个hiPSC-MSC(图3)。小心避免对冠状动脉的任何损害,以减少出血的风险。
- 用铁丝关闭间空间,用2-0丝关闭肌肉层。用 2 - 0 的维克里布皮下组织和皮肤。
- 心内编程电刺激
- 使用可编程刺激器执行编程电刺激,以评估细胞移植治疗后心室性。
- 在牺牲所有动物之前,通过股骨静脉将 6F 电生理导管插入右心室顶点。
- 在电生理记录系统中以 200 mm/s 的速度显示具有表面心电图引线 I、II 和 III 的心内记录。使用刺激器以 2 倍的舒张阈值提供 2 ms 脉冲宽度。
- 在两个驱动周期长度(200 ms 和 300 ms)内提供八个刺激 (S1) 的起搏列车,然后是一个 (S2) 或两个 (S2 和 S3) 过早的额外刺激。
- 顺序缩短耦合间隔,直到心室有效耐火期或心律失常被诱导。请注意存在可抑制的持续 VT (>10 s)。
2. 术后协议
- 术后医学
- 对HF进行常规药理疗法。简言之,每天口头给所有动物施用甲醇(25毫克)和拉米普利(2.5毫克)。
- 手术后1周内,每天每天给所有动物服用环丙沙星(5毫克/千克)和丁丙诺啡(0.01毫克/千克),以防止感染和缓解疼痛。
- 为了尽量减少免疫排斥,口服类固醇(40毫克/天口服)和环孢素(200毫克/天口服)给所有动物从细胞移植前3天到8周后。
- 梗塞大小评估
- 在实验结束时,过量服用宿舍(五巴比钠,100毫克/千克,IV),使动物安乐死。
- 打开胸膛,收集心脏。用0.9%盐水冲洗心脏。
- 串行部分LV组织样品与手术刀在1厘米厚的LV横向。
- 选择包含法外菌的切片部分,以测量壁厚和法外区域。
- 利用商业图像分析软件捕捉这些切片的图像,定量分析壁厚和梗塞区域。
- 在4°C下将组织固定在10%的甲醛中一个月。将组织嵌入石蜡中、相邻和远离梗塞点(±1 厘米2 片)。使用微原子进行组织学检查,切成5μm切片。
- 细胞生存
- 根据制造商提供的协议,通过使用抗人体核抗原(HNA)的免疫组织化学染色来检测移植细胞的移植情况。
- 在每个动物的五个随机场中分三个不同部分捕获图像,并定量分析近游带的正细胞。
注:图像采集系统和图像分析软件用于捕捉和分析心脏部分的图像。
结果
死亡率
这项研究共使用了24头猪。其中三人在 MI 诱导期间因持续 Vt 死亡。一只动物因伤口出血在开胃手术中因细胞注射而死亡。两只动物因严重感染死亡。由于 EF 的轻微减少(LVEF 减少 > 基线的 40%),两种动物被排除在外。结果,16只动物完成了整个研究方案。
心脏功能和重塑
串行超声心动图检查显示,LVEF显著下降,从基线的68.23~3.52%降至39.37~3.22%。LVEDD显著增加从3.6×0.5到4.8×0.4和LVESD显著增加从2.5×0.3到3.9×0.4(图4A)在8周后上岗。 与MI状态(图4A)相比,在移植8周后的hiPSC-MSCs组中,LVEF和LVESD分别显著改善到52.9~4.27%和3.3~0.3。Figure 4
+dP/dt 和 ESPVR 显著下降,从 1,325 × 63 mmHg/s 和 3.9 × 0.4 在基线到 978 × 45 mmHg/s 和 1.8 × 0.2 在诱导 MI 后 8 周。 与MI状态相比,hiPSC-MSC的心肌内给用将+dP/dt和ESPVR增加到1,127.4×50 mmHg/s和2.6±0.3。与MI状态相比(图4B)。
法特壁厚
从每种动物的5-7个连续1厘米厚度部分样本中测量出平均LV梗塞壁厚(图5)。LV 梗死的百分比为 16 ~ 2%。
移植后细胞存活率
移植8周后,注射部位周围没有细胞存活,但少数存活的hiPSC-MSC在梗塞区可见(图6)。
不可抑制心室心律失常
在有HF的动物中,诱导性持续心室性心室性心律失常的发病率很容易增加(基线为10%,而MI诱导后8周为75%)。hiPSC-MSC移植不会显著改变基础心肌基板,以减少对VT的易感性(hiPSC-MSC组62.5%在hiPSC-MSC心肌内给用8周后,图7)。
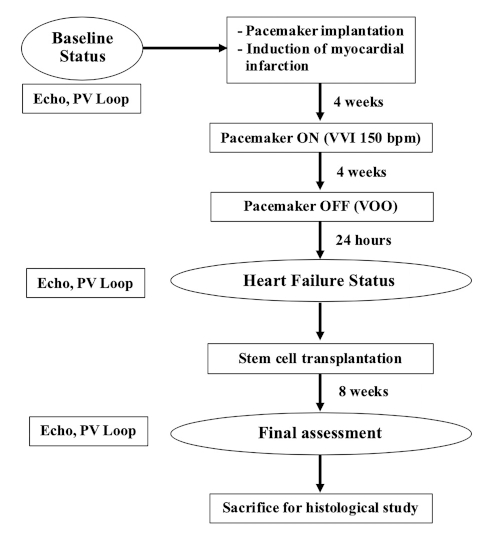
图1:实验流程图。请单击此处查看此图的较大版本。
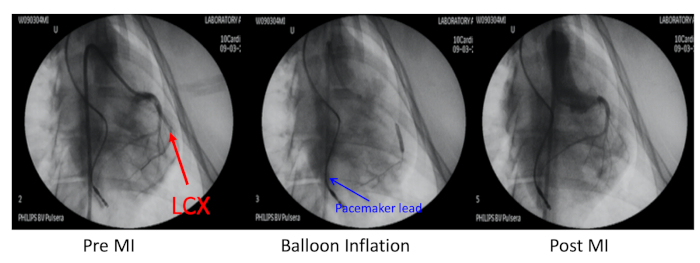
图2:心肌梗死猪模型。 心肌梗塞(MI)的猪模型是由左环状冠状动脉(LCX,红箭)的栓塞引起的,远至第一个迟钝边缘分支。这种冠状动脉被气球膨胀和700μm微球的注射所遮挡。在MI前、气球膨胀和后MI的冠状血管造影通过6F JR4引导导管通过右冠状动脉进行。心脏起搏器引线插入右心室壁(蓝色箭头)。 请单击此处查看此图的较大版本。
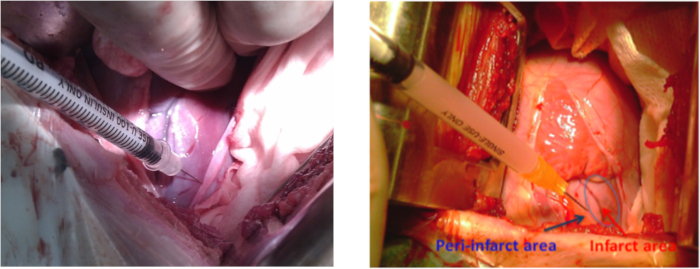
图3:MI猪模型中的细胞移植。 在左胸腔切除术期间,左心室梗塞周围横向壁的细胞注射部位。蓝色箭头显示近法区域,红色箭头显示梗塞区域。 请单击此处查看此图的较大版本。
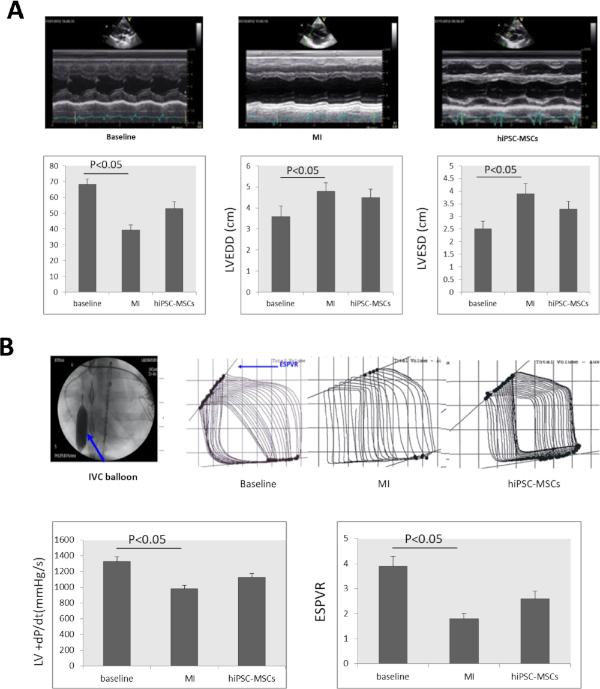
图4:MI后心脏功能改变。 (A) 基线、MI 和细胞移植处的 LV M 模式超声心动图图像。LVEF、LVEDD、LVESD在MI诱导后8周显著减少,在细胞移植后8周在hiPSC-MSC组显著增加。(B) 为了评估心力衰竭猪的心脏功能,使用光伏信号处理器测量+dP/dt值和ESPVR。在ESPVR评估期间,劣质的维纳卡瓦(IVC)被气球膨胀(蓝色箭头)遮挡。在MI诱导后,+dP/dt和ESPVR显著减少,移植8周后hiPSC-MSC组显著增加。ANOVA 之后是学生- 纽曼 - 库尔斯临时测试 (SPSS, 版本 14) 用于 = = 0.05 的重要性。 请单击此处查看此图的较大版本。

图 5:MI 后,内法区域发生变化。 LV横向样品在每颗心脏中分段1厘米厚,含有梗死的心肌。 请单击此处查看此图的较大版本。
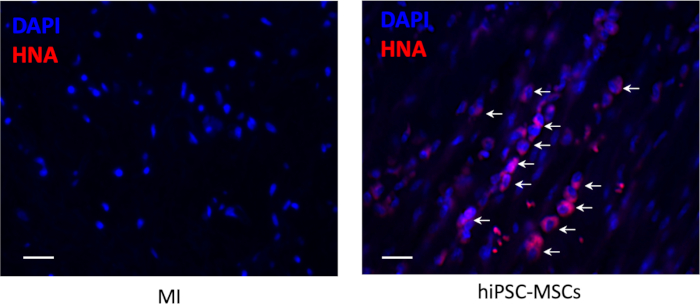
图6:移植后细胞存活。 移植的hiPSC-MSCs的移植通过免疫组织化学染色检测出抗人核抗原(红色)。比例线 = 100 μm。箭头表示正单元格。 请单击此处查看此图的较大版本。

图7:持续心室性心律失常的发病率。 (A) 心室性心律失常(VT,红箭)由体内心内编程电刺激引起。(B) MI诱导后VT的发生率显著上升。细胞移植没有增加VT的发病率。 请单击此处查看此图的较大版本。

补充图1:超声心动图采集。 左侧面板显示动物的位置。右面板显示探头位置。中间面板显示此位置下的超声心动图图像。 请单击此处查看此图的较大版本。
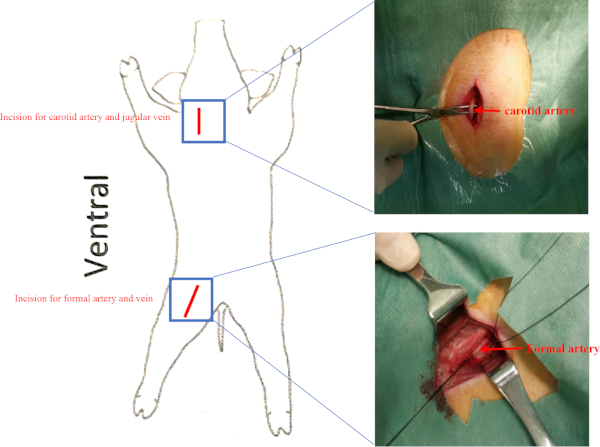
补充图2:船舶位置。 猪被置于超级位置。心肌动脉和股骨动脉的切口呈现为红线。血管静脉和股骨静脉分别位于心肌动脉和股骨动脉下方。 请单击此处查看此图的较大版本。
讨论
标准动物模型对于了解疾病的病理生理学和机制以及测试新的治疗方法至关重要。我们的协议建立了由左环状动脉阻塞和快速起搏诱导的HF猪模型。在MI诱导八周后,这些动物对LVEF、LVEDD、LVESD、+dP/dt和ESPVR有显著损伤。该协议还测试了干细胞治疗的真菌方法,通过心内注射促进心脏再生。评估梗塞大小以及心脏收缩和舒张功能。本研究有助于建立一个稳定且可重复的临床前大型动物HF模型,用于干细胞治疗,与临床病例类似。
LCX堵塞和快速起搏已被广泛使用,以创建HF的动物模型在以前的研究7,7,8。LCX 到第一个迟钝边缘分支的 LCX 被遮挡,随后是 4 周的右心室快速起搏。肌酸缺血导致MI期间心肌细胞流失,导致心脏纤维化、心肌重塑和心律失常。心室起搏导致显著的LV扩张,左心室收缩的非缺血损伤,以及严重的LV功能障碍,9,10。延长缺血期和快速起搏产生一个渐进的实验低输出HF模型进行转化研究。先前的研究通过诱导MI10建立了心力衰竭模型。然而,严重MI的死亡率较高,MI的LVEF减少不稳定。因此,我们在LCX堵塞后应用快速右心室起搏,以诱发心脏功能的显著损伤。正如我们之前的研究中所示,此处显示的模型可产生稳定的梗塞尺寸,该模型的 LVEF 至少降低到 40% 的正常6、7、8,7,以下。如果感染和出血减少,我们的模型成功率可能约为80%。
干细胞临床应用的主要障碍之一是干细胞在移植后存活率和移植率低。最近的临床研究和荟萃分析11,12,13,14,15未能证明任何持续改善的LV功能或梗塞大小后,这种治疗。11,12,13,14,15其中一个潜在的原因是移植细胞的存活率低。发现最佳的治疗方法在干细胞治疗中起着至关重要的作用。比较细胞移植的三种方法,由于细胞保留率较高,心内给药比静脉注射和宫内给药16效率更高。因此,我们在本研究中选择了 iPSC-MSC 交付的心肌内管理路径。超声心动图结果和侵入性血流动力学结果表明,iPSC-MSC的肌内部管理在细胞移植8周后改善了MI后HF猪的LV功能。尽管服用了免疫抑制药物(类固醇和环孢素),但仅发现少数移植细胞在梗塞区。在注射地点周围的梗塞区域未检测到幸存的细胞。先前的研究还发现,,移植18、19、20、21后,19,在梗塞的骨髓中干细胞中,干细胞的极小部分。心肌内输血期间细胞损失可能会影响实验结果。如何改进管理方法,提高居住率,应在未来的研究中加以阐明。
安全性,尤其是心律失常,是细胞疗法临床实践的另一个至关重要的问题。我们最近的研究表明,人类胚胎干细胞(hESC)衍生的心肌内给发增加自发性非持续心室性心律失常4的发生率。在我们的 MI 后 HF 猪模型中,从心脏起搏器的遥测监测记录的自发性非持续心室心室性心律失常(速率 >180 bpm 和 >12 节拍)的发生率为 25%,但持续 VT 很容易诱发(80%)。在这项研究中,在不进行hiPSC-MSC管理的情况下,突然死亡的发生率保持不变。此外,hiPSC-MSCs移植没有修改基础心肌底,以减少或增加心室心律失常的易感性。结果表明,大型动物慢性HF模型可用于细胞安全评估。
避免感染和出血对于成功建立动物模型至关重要。为了降低出血的风险,应注意避免对冠状动脉和心脏静脉的任何损害。由于两只动物死于严重感染,适当的术后医疗策略将受益。在这里,我们提供如下术后医疗策略:肌肉内管理环丙沙星(7.5毫克/千克, SID)和丁丙诺啡(0.02毫克/千克,BID)结合口头管理阿莫西林/克拉夫拉尼奇酸(12.5毫克/千克,SID)和卡普罗芬(2毫克/千克,SID)给所有动物手术后1周,以防止感染和缓解疼痛。
综上关于目前的方法为细胞疗法提供了一种稳定且可重复的临床相关大型动物模型心力衰竭。
披露声明
作者没有什么可透露的。
致谢
作者感谢阿尔弗雷达和孔德忠在动物实验中的出色技术支持。
材料
| Name | Company | Catalog Number | Comments |
| Amiodarone | Mylan | - | - |
| Anaesthetic machines and respirator | Drager | Fabius plus XL | - |
| Angiocath | Becton Dickinson | 381147 | - |
| Anti-human nuclear antigen | abcam | ab19118 | - |
| Axio Plus image capturing system | Zeiss | Axioskop 2 PLUS | Axioskop 2 plus |
| AxioVision Rel. 4.5 software | Zeiss | - | - |
| Baytril | Bayer | - | enrofloxacin |
| Betadine | Mundipharma | - | - |
| CardioLab Electrophysiology Recording Systems | GE Healthcare | G220f | - |
| Culture media | MesenCult | 05420 | - |
| Cyclosporine | Novartis | - | - |
| Defibrillator | GE Healthcare | CardioServ | - |
| Dorminal | TEVA | - | - |
| Echocardiographic system | GE Vingmed | Vivid i | - |
| EchoPac software | GE Vingmed | - | - |
| Electrophysiological catheter | Cordis Corp | - | - |
| Embozene Microsphere | Boston Scientific | 17020-S1 | 700 μm |
| Endotracheal tube | Vet Care | VCPET70PCW | Size 7 |
| Ethanol | VWR chemicals | 20821.33 | - |
| Formalin | Sigma | HT501320 | 10% |
| IVC balloon Dilatation Catheter | Boston Scientific | 3917112041 | Mustang |
| JR4 guiding catheter | Cordis Corp | 67208200 | 6F |
| Lidocaine | Quala | - | - |
| Mersilk | Ethicon | W584 | 2-0 |
| Metoprolol succinate | Wockhardt | - | - |
| Microtome | Leica | RM2125RT | - |
| Mobile C arm fluoroscopy equipment | GE Healthcare | OEC 9900 Elite | - |
| Pacemaker | St Jude Medical | PM1272 | Assurity MRI pacemaker |
| Pacemaker generator | St Jude Medical | Merlln model 3330 | - |
| Pressure-volume catheter | CD Leycom | CA-71103-PL | 7F |
| Pressure–volume signal processor | CD Leycom | SIGMA-M | - |
| Programmable Stimulator | Medtronic Inc | 5328 | - |
| PTCA Dilatation balloon Catheter | Boston Scientific | H7493919120250 | MAVERICK over the wire |
| Ramipril | TEVA | - | - |
| Sheath introducer | Cordis Corp | 504608X | 8F, 9F, 12F |
| Steroid | Versus Arthritis | - | - |
| Temgesic | Nindivior | - | buprenorphine |
| Venous indwelling needle | TERUMO | SR+OX2225C | 22G |
| Vicryl | Ethicon | VCP320H | 2-0 |
| Xylazine | Alfasan International B.V. | - | - |
| Zoletil | Virbac New Zealand Limited | - | tiletamine+zolezepam |
参考文献
- Mozaffarian, D., et al. Heart disease and stroke statistics-2015 update: a report from the American Heart Association. Circulation. 131, e29 (2015).
- Hospital Authority. . Hospital Authority Statistical Report 2013. , (2013).
- Cung, T. T., et al. Cyclosporine before PCI in Patients with Acute Myocardial Infarction. The New England Journal of Medicine. 373 (11), 1021-1031 (2015).
- Liao, S. Y., et al. Proarrhythmic risk of embryonic stem cell-derived cardiomyocyte transplantation in infarcted myocardium. Heart Rhythm. 7, 1852-1859 (2010).
- Liao, S. Y., et al. Overexpression of Kir2.1 channel in embryonic stem cell-derived cardiomyocytes attenuates posttransplantation proarrhythmic risk in myocardial infarction. Heart Rhythm. 10, 273-282 (2013).
- Liu, Y., et al. Thoracic spinal cord stimulation improves cardiac contractile function and myocardial oxygen consumption in a porcine model of ischemic heart failure. Journal of Cardiovascular Electrophysiology. 23, 534-540 (2012).
- Liao, S. Y., et al. Improvement of Myocardial Function Following Catheter-Based Renal Denervation in Heart Failure. JACC: Basic to Translational Science. 2 (3), 270-281 (2017).
- Liao, S. Y., et al. Remodelling of cardiac sympathetic re-innervation with thoracic spinal cord stimulation improves left ventricular function in a porcine model of heart failure. Europace. 17 (12), 1875-1883 (2015).
- Daehnert, I., Rotzsch, C., Wiener, M., Schneider, P. Rapid right ventricular pacing is an alternative to adenosine in catheter interventional procedures for congenital heart disease. Heart. 90 (9), 1047-1050 (2004).
- Hála, P., et al. Tachycardia-Induced Cardiomyopathy as a Chronic Heart Failure Model in Swine. Journal of Visualized Experiments. (132), e57030 (2018).
- Santoso, T., et al. Endomyocardial implantation of autologous bone marrow mononuclear cells in advanced ischemic heart failure: a randomized placebo-controlled trial (END-HF). Journal of Cardiovascular Translational Research. 7, 545-552 (2014).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network. Effect of intracoronary delivery of autologous bone marrow mononuclear cells 2 to 3 weeks following acute myocardial infarction on left ventricular function: the LateTIME randomized trial. Journal of the American Medical Association. 306, 2110-2119 (2011).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network (CCTRN). Effect of the use and timing of bone marrow mononuclear cell delivery on left ventricular function after acute myocardial infarction: the TIME randomized trial. Journal of the American Medical Association. 308, 2380-2389 (2012).
- de Jong, R., Houtgraaf, J. H., Samiei, S., Boersma, E., Duckers, H. J. Intracoronary stem cell infusion after myocardial infarction. A meta-analysis and update on clinical trials. Circulation: Cardiovascular Interventions. 7, 156-167 (2014).
- Nowbar, A. N., et al. DAMASCENE writing group. Discrepancies in autologous bone marrow stem cell trials and enhancement of ejection fraction (DAMASCENE): weighted regression and meta-analysis. British Medical Journal. 348, g2688 (2014).
- Kanelidis, A. J., Premer, C., Lopez, J., Balkan, W., Hare, J. M. Route of Delivery Modulates the Efficacy of Mesenchymal Stem Cell Therapy for Myocardial Infarction: A Meta-Analysis of Preclinical Studies and Clinical Trials. Circulation Research. 120 (7), 1139-1150 (2017).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112 (9 Suppl), I150-I156 (2005).
- Hu, X., et al. A Large-Scale Investigation of Hypoxia-Preconditioned Allogeneic Mesenchymal Stem Cells for Myocardial Repair in Nonhuman Primates: Paracrine Activity Without Remuscularization. Circulation Research. 118, 970-983 (2016).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Martens, A., et al. Substantial early loss of induced pluripotent stem cells following transplantation in myocardial infarction. Artificial Organs. 38, 978-984 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538, 388-391 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。