Method Article
Erstellung eines Schweinemodells für postmyokarde Infarkt-Herzinsuffizienz für die Stammzellbehandlung
In diesem Artikel
Zusammenfassung
Wir versuchten, ein Schweinemodell für Herzinsuffizienz zu etablieren, das durch linke Zirkumflexarterienverstopfung und schnelles Tempo verursacht wurde, um die Wirkung und Sicherheit der intramyokardialen Verabreichung von Stammzellen für zellbasierte Therapien zu testen.
Zusammenfassung
Obwohl Fortschritte bei der Behandlung von Herzinsuffizienz (HF) nach Myokardinfarkt (MI) erzielt wurden, ist HF nach MI nach wie vor eine der Hauptursachen für Mortalität und Morbidität auf der ganzen Welt. Zellbasierte Therapien zur Herzreparatur und Verbesserung der linksventrikulären Funktion nach MI haben erhebliche Aufmerksamkeit erregt. Dementsprechend sollte die Sicherheit und Wirksamkeit dieser Zelltransplantationen in einem präklinischen Großtiermodell von HF vor der klinischen Anwendung getestet werden. Schweine sind weit verbreitet für Herz-Kreislauf-Erkrankungen Forschung aufgrund ihrer Ähnlichkeit mit menschenähnlichen in Bezug auf Herzgröße und koronare Anatomie verwendet. Daher versuchten wir, ein wirksames Protokoll für die Etablierung eines chronischen HF-Modells mit geschlossener Koronatorei-Ballonokklusion der linken Berundungsarterie (LCX) vorzulegen, gefolgt von einem schnellen ventrikulären Tempo, das mit einer Herzschrittmacherimplantation induziert wurde. Acht Wochen später wurden die Stammzellen durch intramyokardiale Injektion im Periinfarktbereich verabreicht. Anschließend wurden die Infarktgröße, das Zellüberleben und die linksventrikuläre Funktion (einschließlich Echokardiographie, hämodynamische Parameter und Elektrophysiologie) bewertet. Diese Studie hilft, ein stabiles präklinisches HF-Großtier-HF-Modell für die Stammzellbehandlung zu etablieren.
Einleitung
Herz-Kreislauf-Erkrankungen, insbesondere koronare Herzkrankheit (CAD), sind nach wie vor die Hauptursache für Morbidität und Sterblichkeit in Hongkong und weltweit1. In Hongkong wurde ein Anstieg der Zahl der CAD-Patienten, die unter der Hospital Authority behandelt wurden, von 2012 bis 2017 um26% prognostiziert. Unter allen CADs ist akuter Myokardinfarkt (MI) eine der Hauptursachen für den Tod und nachfolgende Komplikationen, wie Herzinsuffizienz (HF). Diese tragen zu erheblichen medizinischen, sozialen und finanziellen Belastungen bei. Bei Patienten mit MI ist eine thrombolytische Therapie oder primäre perkutane koronare Intervention (PCI) eine wirksame Therapie zur Erhaltung des Lebens, aber diese Therapien können nur den Kardiomyozytenverlust (CM) während des MI reduzieren. Die verfügbaren Behandlungen sind nicht in der Lage, den dauerhaften Verlust von CMs wieder aufzufüllen, was zu Herzfibrose, Myokardumbau, Herzrhythmusstörungen und schließlich Herzinsuffizienz führt. Die Sterblichkeitsrate bei 1 Jahr nach dem MI liegt bei etwa 7%, wobei mehr als 20% der Patienten HF3entwickelten. Bei HF-Patienten im Endstadium ist die Herztransplantation die einzige verfügbare wirksame Therapie, die jedoch durch einen Mangel an verfügbaren Organen begrenzt wird. Neuartige Therapien sind notwendig, um die Entwicklung von Post-MI HF umzukehren. Infolgedessen wird die zellbasierte Therapie als attraktiver Ansatz zur Reparatur der beeinträchtigten CMs und zur Linderung der linksventrikulären (LV) Funktion in HF nach MI betrachtet. Unsere früheren Studien fanden heraus, dass die Stammzelltransplantation für die Verbesserung der Herzfunktion nach direkter Intramyokardieinininininininininat in Kleintiermodellen von MI4,5von Vorteil ist. Standardisierte präklinische HF-Protokolle für Großtiere sind daher erforderlich, um die Wirksamkeit und Sicherheit der Stammzelltransplantation vor der klinischen Anwendung weiter zu testen.
In den letzten Jahrzehnten wurde der weit verbreitete Einsatz von Schweinen in der Kardiovaskulären Forschung für die Stammzelltherapie miterlebt. HF-Schweine sind aufgrund ihrer Ähnlichkeit mit dem Menschen in Bezug auf Herzgröße, Gewicht, Rhythmus, Funktion und koronare Anatomie ein vielversprechendes Modell der translationalen Forschung. Darüber hinaus können Schweine-HF-Modelle Post-MI HF-Patienten in Bezug auf CM-Stoffwechsel, elektrophysiologische Eigenschaften und neuroendokrine Veränderungen unter ischämischen Bedingungen imitieren6. Das hier vorgestellte Protokoll verwendet ein solches standardisiertes Schweine-HF-Modell, das eine geschlossene Koronatorei-Ballonokklusion der linken Zirkumflexarterie (LCX) verwendet, gefolgt von einem schnellen Tempo, das durch Herzschrittmacherimplantation induziert wird. Die Studie optimiert auch den Weg der intramyokardialen Verabreichung von Stammzellen für die Behandlung von Post-MI HF. Ziel ist es, ein Schweinetiermodell mit chronischem Myokardinfarkt zu erstellen, das zur Entwicklung von Behandlungen verwendet werden kann, die für Patienten mit schwerem CAD klinisch relevant sind.
Protokoll
Alle Tierversuche wurden in Übereinstimmung mit dem Leitfaden für die Pflege und Verwendung von Labortieren durchgeführt, der von den US National Institutes of Health und Denkvorschriften der Universität Hongkong veröffentlicht wurde, und das Protokoll wurde vom Committee on the Use of Live Animals in Teaching and Research (CULTAR) an der University of Hong Kong genehmigt.
HINWEIS: Für diese Studie wurden weibliche Zuchtschweine mit einem Gewicht von 35-40 kg (9-12 Monate alt) verwendet. Das Flussdiagramm dieses Experiments ist in Abbildung 1dargestellt.
1. Chirurgische Eingriffe
- Anästhesie und Zubereitung des Tieres
- Fasten Sie die Tiere für 12 h und unterliegen Wasserentzug für 4 h vor dem Experiment.
- Anästhesisieren Sie die Schweine durch eine intramuskuläre Injektion von Tiletamin+Zolezepam (2-7 mg/kg) und Xylazin (0,5-1 mg/kg), die in 20 ml normaler Saline hergestellt werden. Überwachen Sie die palpebralen Reflexe des Tieres, bis sie fehlen.
- Entfernen Sie die Haare des Schweins und sterilisieren Sie die Haut am Hals und die Leistengegend für abschnitte 1.3-1.5. Desinfizieren Sie den Operationsbereich 3x mit 70% Ethanol und Betadin.
- Legen Sie ein 7 mm Endotrachealrohr in die Schweinetrachea und legen Sie eine 22 G venöse Innedinnenadel in die Ohrvena.
- Bewegen Sie das Schwein auf den Operationstisch und platzieren Sie es in einer Rückenlage. Verbinden Sie das Endotrachealrohr mit dem Beatmungsgerät und belüften Sie das Tier mechanisch (inspitorisches/expiratorisches Zeitverhältnis 1:2), das Tier mit Isofluran (1,5%-2,0% Inhalation) und Sauerstoff (0,5-1,5 l/min Inhalation).
- Überwachen Sie das Oberflächenelektrokardiogramm und den Blutdruck und überwachen Sie kontinuierlich die Herzfrequenz, den Herzrhythmus und den arteriellen Blutdruck über elektrophysiologische Aufzeichnungssysteme.
- Echokardiographie
- Bewegen Sie das Schwein auf die linke seitliche Dekubitusposition und fixieren Sie es auf dem Tisch.
- Setzen Sie die Sonde auf die Perikardregion und führen Sie serielle Echokardiographie, einschließlich 2D- und M-Modus-Bildgebung, mit einem hochauflösenden echokardiographischen System und einem 3-9 MHz-Wandler an der Basislinie, vor der Zelltransplantation und 8 Wochen nach der Zelltransplantation durch (Ergänzende Abbildung 1).
- Analysieren Sie alle erhaltenen Bilder mit kommerzieller Software. Berechnen Sie die LV-End-Diastolische Dimension (LVEDD), DIE LV-Endsystol-Dimension (LVESD), das LV-Enddiastolische Volumen (LVEDV), das LV-Endsystolvolumen (LVESV), die LV-Auswurffraktion (LVEF) und die Wanddicke nach standardechokardiographischen Standardbildern werden aus der parasternalen Langachsenansicht erhalten.
HINWEIS: Alle Off-Line-Analysen wurden von einem anderen unabhängigen Betreiber über eine Computerarbeitsstation durchgeführt. Die Variabilität der Messungen zwischen verschiedenen Beobachtern betrug 4% basierend auf 20 wiederholten zufälligen Bildern. Alle echokardiographischen Messungen wurden in Übereinstimmung mit den Empfehlungen der American Society of Echocardiography durchgeführt.
- Pacemaker-Implantation
- Bewegen Sie das Schwein in die Rückenlage und fixieren Sie die Gliedmaßen des Schweins auf dem Tisch mit Gurten.
- Finden Sie die richtige Karotisarterie und Jugularvene im Karotisdreieck (hinter dem Sternocleidomastoid und umgeben vom Stylohyoid, dem Digastric Muskel und dem Omohyoid) und isolieren Sie die rechte Halsschlagader und juguläre Vene mit hämostatischen Zangen unter sterilen Bedingungen (Ergänzungsfigur 2). Ligate das distale Ende der rechten Halsschlagader und Jugular Vene. Nähen Sie die beiden Muskeln mit 2:0 Vicryl.
- Die rechte Jugularvene mit einem Angiocath ankern und unter Röntgenführung eine Herzschrittmacherführung in die rechte Herzkammer setzen (Abbildung 2).
- Isolieren Sie das Sternocleidomastoid und den vorderen Schuppenmuskel mit Zangen. Implantieren Sie einen Herzschrittmacher zwischen den beiden Muskeln und nähen Sie die beiden Muskeln mit 2-0 Seide. Verbinden Sie den Herzschrittmacher an die Spitze.
- Programmieren Sie den Herzschrittmacher nach der Transplantation neu, um den VVI-Modus (35 bpm) durch einen Herzschrittmachergenerator zu sichern.
- Tragen Sie schnelles ventrikuläres Tempo (150 Schläge/min) auf, um HF durch einen Herzschrittmachergenerator 4 Wochen nach MI-Induktion zu induzieren. Stellen Sie dann den Herzschrittmacher wieder auf Backup VVI-Modus auf 8 Wochen.
- Invasive Druckvolumenschleifenanalyse
HINWEIS: Führen Sie eine invasive hämodynamische Bewertung zu Beginn, vor der Zelltransplantation und 8 Wochen nach der Zelltransplantation durch, um Veränderungen der LV-Funktion zu bewerten.- Isolieren Sie die rechte Femoralarterie und Femoral Vene im Oberschenkeldreieck (umgeben von leisten, Sartorius-Muskel, und Adduktoren-Longus-Muskel) (Ergänzungsfigur 2).
- Kanülieren Sie die rechte Femoralarterie mit einem Angiocath und legen Sie einen Führerdraht in die Arterie über den Angiocath. Entfernen Sie den Angiocath und können Sie unter Anleitung des Führungsdrahtes eine 9F-Hülle in die Arterie einbauen. Entfernen Sie den Führungsdraht.
- Kanülieren Sie die rechte Femoralvene mit einem 12F Mantel, wie in Schritt 1.4.2 beschrieben. Setzen Sie einen Ballonkatheter aus dem platzierten 12F Mantel unter Röntgenführung in die unterlegene Vena cava (IVC) ein.
- Kalibrieren Sie einen 7 Fr Druckvolumenkatheter (PV) in isotonischer Kochung mit einem PV-Signalprozessor.
- Setzen Sie den PV-Katheter aus dem platzierten 9F-Mantel unter Röntgenführung in den LV-Apex ein. Unterbrechen Sie die Belüftung und messen Sie die linksventrikuläre maximale Positivdruckableitung (+dP/dt), den endsystolischen Druck (ESP) und den enddiastolischen Drücken (EDP) mit dem PV-Signalprozessor.
- Messen Sie die End-Systol-Druck-Volumen-Beziehung (ESPVR) durch den PV-Signalprozessor während der Okklusion des IVC.
- Starten Sie die Belüftung neu, wenn der Vorgang abgeschlossen ist.
- Induktion von MI
- Intravenös Amiodaron (5 mg/kg intravenös über 1 h) und Lidocain (1,5 mg/kg intravenöser Bolus) vor der Induktion von MI an das Tier weitergeben, um ventrikuläre Arrhythmien zu verhindern.
- Kanülieren Sie die rechte Halsschlagader mit einem 8F Mantel, wie in Schritt 1.4.3 erwähnt.
- Führen Sie die koronare Angiographie über einen 6F JR4-Über-den-Draht-Führungskatheter über den platzierten Mantel durch Standard-C-Armfluoroskopie-Geräte.
- Die linke Zirkumflex-Herzkranzgefäße (LCX) distal zum ersten stumpfen Randzweig mit perkutaner transluminale koronarer Angioplastie (PTCA) Dilatation Ballonkatheterinflation unter Röntgenführung (Abbildung 2).
- Injizieren Sie 1 ml 700 m Schwammmikrosphären gemischt mit 3 ml Saline, die in einer 10 ml Spritze hergestellt werden, durch den Ballonkatheter, um den LCX zu blockieren, dann den Ballon zu entleeren und ein Angiogramm durchzuführen, um die Okklusion zu bestätigen.
- Wiederholen Sie den Injektionsvorgang, um eine erfolgreiche vollständige Verstopfung zu erreichen.
- Überwachen Sie die Herzfrequenz und den Rhythmus des Tieres, um Herzrhythmusstörungen zu erkennen. Wenn Kammerflimmern aufgetreten ist, verwenden Sie einen externen, biphasischen Defibrillator, um einen Sinusrhythmus mit 150-300 J-Schocks wiederherzustellen.
- Stammzellinjektion
- Ordnen Sie alle Tiere mit bemerkenswerter Beeinträchtigung der Herzfunktion (LVEF < 40% nach 8 Wochen nach der Induktion von MI) zufällig zwei verschiedenen Gruppen zu: eine, die die intramyokardiale Verabreichung von 2 x 108 humaninduzierten pluripotenten mesenchymalen Stammzellen (hiPSC-MSCs) erhält, und die andere, die keine HiPSC-MSCs erhält.
- Bereiten Sie die HiPSC-MSCs in 2 ml normaler Saline für die intramyokardiale Transplantation vor. Wiederholen Sie vor der intratramyokardialen HiPSC-MSCs-Transplantation die in Abschnitt 1.1 genannten Anästhesie- und Tierpräparationsschritte, diesmal sterilisieren sie 10 cm um den Scheitelpunkt. Führen Sie die linke Thorakotomie im 4-5 interkostalen Raum mit einem Retraktor durch. Führen Sie eine Perikardiotomie durch, um die infarktierte Seitenwand freizulegen.
HINWEIS: Die Länge des Schnittes betrug 10-12 cm. - Verwenden Sie 5-8 intramyokardiale Injektionen (0,3 ml pro Injektion) um den Infarktbereich, um kulturmedium (Materialtabelle) einer Gruppe von Tieren oder 2 x 108 hiPSC-MSCs der anderen Gruppe zu verabreichen (Abbildung 3). Vermeiden Sie sorgfältig Schäden an den Herzkranzgefäßen, um das Blutungsrisiko zu reduzieren.
- Schließen Sie den interkostalen Raum mit Eisendraht und schließen Sie die Muskelschicht mit 2-0 Seide. Nähen Sie das Unterhautgewebe und die Haut mit 2-0 Vicryl.
- Intrakardial programmierte elektrische Stimulation
- Führen Sie eine programmierte elektrische Stimulation mit einem programmierbaren Stimulator durch, um die Induzierbarkeit der ventrikulären Tachyarrhythmie (VT) nach der Zelltransplantationstherapie zu beurteilen.
- Setzen Sie einen elektrophysiologischen 6F-Katheter über die femorale Vene in die rechte ventrikuläre Spitze ein, bevor Sie alle Tiere opfern.
- Zeigen Sie die intrakardialen Aufnahmen mit den Oberflächenelektrokardiogrammleitungen I, II und III auf dem elektrophysiologischen Aufzeichnungssystem mit einer Geschwindigkeit von 200 mm/s an. Liefern Sie mit einem Stimulator eine Pulsbreite von 2 ms bei 2x der diastolischen Schwelle.
- Liefern Sie einen Schrittzug von acht Stimuli (S1) auf zwei Fahrzykluslängen (200 ms und 300 ms), gefolgt von einem (S2) oder zwei (S2 und S3) vorzeitigen zusätzlichen Reizen.
- Verkürzen Sie sequenziell die Kopplungsintervalle, bis eine ventrikuläre effektive Feuerfestperiode oder Arrhythmie induziert wird. Beachten Sie das Vorhandensein von induzierbaren anhaltenden VT (>10 s).
2. Postoperatives Protokoll
- Postoperative Medizin
- Führen Sie konventionelle pharmakologische Therapien für HF durch. In Kürze, oral verabreichen Metoprolol Succinat (25 mg) und Ramipril (2,5 mg) an alle Tiere täglich.
- Intramuskulär Enrofloxacin (5 mg/kg) und Buprenorphin (0,01 mg/kg) täglich 1 Woche nach der Operation an alle Tiere verabreichen, um infektionen zu verhindern und Schmerzen zu lindern.
- Um die immunologische Abstoßung zu minimieren, oral verabreichen Sie ein Steroid (40 mg/Tag oral) und Cyclosporin (200 mg/Tag oral) an alle Tiere von 3 Tage vor der Zelltransplantation bis 8 Wochen danach.
- Infarktgrößenbewertung
- Euthanisieren Sie die Tiere durch eine Überdosierung von dorminal (Pentobarbital-Natrium, 100 mg/kg, IV) am Ende des Experiments.
- Öffnen Sie die Brust und sammeln Sie das Herz. Spülen Sie das Herz in 0,9% Saline.
- Serial-Sektion LV-Gewebeproben mit einem Skalpell mit 1 cm Dicke in LV-Querrichtung.
- Wählen Sie Teile der Scheiben aus, die das infarktierte Myokard enthalten, um die Wanddicke und den Infarktbereich zu messen.
- Erfassen Sie das Bild dieser Scheiben und analysieren Sie die Wanddicke und den Infarktbereich mit kommerzieller Bildanalysesoftware.
- Fixieren Sie das Gewebe in 10% Formalin bei 4 °C für einen Monat. Einbetten des Gewebes in Paraffin, nebenan und abgelegen zu den Infarktstellen (ca. 1 cm2 Stück). Schnitt in 5 m Scheiben mit einem Mikrotome zur histologischen Untersuchung.
- Zellüberleben
- Nachweis der Transplantation der transplantierten Zellen durch immunhistochemische Färbung mit antihumanem Kernantigen (HNA) gemäß dem vom Hersteller vorgelegten Protokoll.
- Erfassen Sie das Bild in drei verschiedenen Abschnitten an fünf zufälligen Feldern in jedem Tier und analysieren Sie quantitativ die positiven Zellen in der Peri-Infarkt-Zone.
HINWEIS: Das Bildaufnahmesystem und die Bildanalysesoftware wurden verwendet, um die Bilder der Herzabschnitte zu erfassen und zu analysieren.
Ergebnisse
Sterblichkeit
Insgesamt wurden in dieser Studie 24 Schweine verwendet. Drei von ihnen starben während der MI-Induktion aufgrund einer anhaltenden VT. Ein Tier starb in der Operation am offenen Herzen für die Zellinjektion aufgrund von Wundblutungen. Zwei Tiere starben an den Verletzungen. Zwei Tiere wurden aufgrund einer leichten EF-Reduktion ausgeschlossen (LVEF-Reduktion > 40 % des Ausgangswerts). Damit absolvierten 16 Tiere das gesamte Studienprotokoll.
Herzfunktion und Umbau
Die serielle echokardiographische Untersuchung zeigte, dass LVEF signifikant von 68,23 bis 3,52 % zu Beginn auf 39,37 bis 3,22 % zurückging. LVEDD stieg signifikant von 3,6 x 0,5 auf 4,8 x 0,4 und LVESD signifikant von 2,5 x 0,3 auf 3,9 x 0,4 (Abbildung 4A) nach 8 Wochen nach der Induktion von MI. LVEF und LVESD verbesserten sich in der HiPSC-MSCs-Gruppe 8 Wochen nach der Transplantation signifikant auf 52,9 x 4,27 % bzw. 3,3 x 0,3 , verglichen mit dem MI-Status (Abbildung 4A).
Der +dP/dt und der ESPVR verringerten sich signifikant von 1.325 x 63 mmHg/s und 3,9 x 0,4 zu Beginn auf 978 x 45 mmHg/s und 1,8 x 0,2 nach 8 Wochen nach der Induktion von MI. Die intramyokardiale Verabreichung von hiPSC-MSCs erhöhte die +dP/dt und ESPVR auf 1.127,4 x 50 mmHg/s und 2,6 x 0,3 nach 8 Wochen nach der iPSC-MSCs-Transplantation im Vergleich zum MI-Status(Abbildung 4B).
Infarktwanddicke
Die durchschnittliche LV-Infarktwanddicke wurde von 5-7 seriell 1 cm Dickenschnittproben in jedem Tier gemessen (Abbildung 5). Der Prozentsatz des LV-Infarkts betrug 16 bis 2 %.
Zellüberleben nach der Transplantation
8 Wochen nach der Transplantation gab es kein Zellüberleben um die Injektionsstelle im Infarktbereich, aber eine kleine Anzahl der Überlebens-HiPSC-MSCs waren im Periinfarktbereich sichtbar (Abbildung 6).
Induzierbare ventrikuläre Arrhythmie
Die Inzidenz von induzierbaren anhaltenden ventrikulären Tachyarrhythmien konnte leicht bei Tieren mit HF erhöht werden (10% zu Beginn vs. 75% 8 Wochen nach der Induktion von MI). Die HiPSC-MSCs-Transplantation verändert das zugrunde liegende Myokardsubstrat nicht signifikant, um die Anfälligkeit für VT zu reduzieren (62,5% in hiPSC-MSCs Gruppe 8 Wochen nach intramyokarder Verabreichung von HiPSC-MSCs, Abbildung 7).
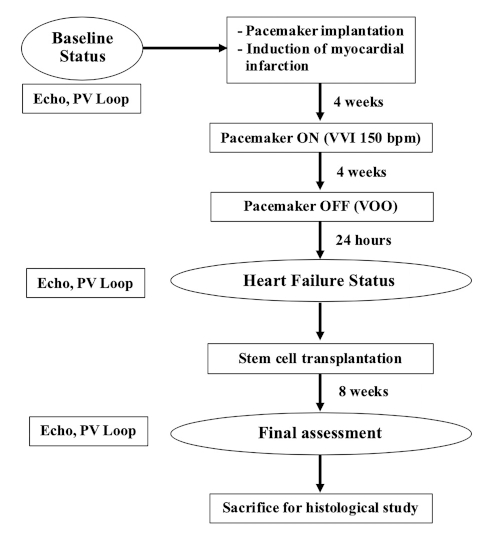
Abbildung 1: Flussdiagramm des Experiments. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
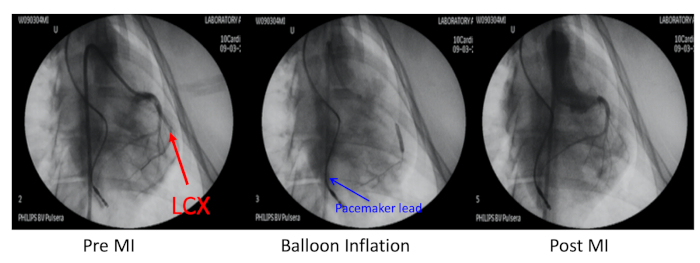
Abbildung 2: Porcine-Modell des Myokardinfarkts. Das Porcine-Modell des Myokardinfarkts (MI) wurde durch die Embolisierung der linken Zirkumflex-Herzkranzgefäße (LCX, roter Pfeil) zum ersten stumpfen Randzweig distal induziert. Diese koronare Arterie wurde mit Balloninflation und einer Injektion von 700 m Mikrosphären überdrüssungsverhänsiert. Die koronare Angiographie vor dem MI, Balloninflation und Post-MI wurde über einen 6F JR4-Führungskatheter über die rechte Halsschlagader durchgeführt. Die Schrittmacher-Führung wurde in die rechte Ventrikelwand (blauer Pfeil) eingeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
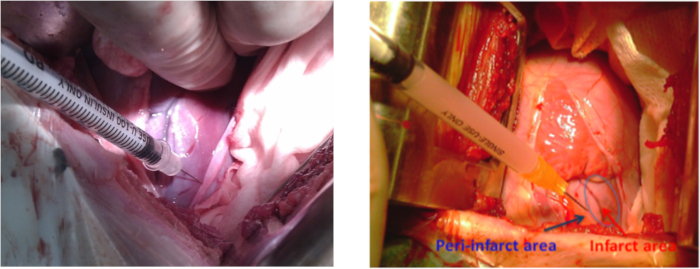
Abbildung 3: Zelltransplantation in einem Schweinemodell von MI. Zellinjektionsstellen an der Seitenwand um den Infarktbereich des linken Ventrikels während der linken Thorakotomie. Der blaue Pfeil zeigt den Peri-Infarkt-Bereich und der rote Pfeil den Infarktbereich. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
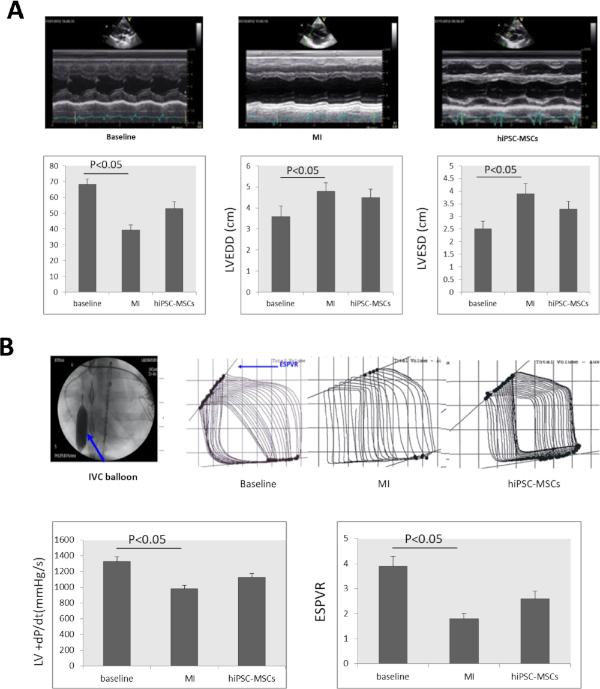
Abbildung 4: Herzfunktion ändert sich nach MI. (A) Ein LV M-Modus-Echokardiogrammbild bei Baseline-, MI- und Zelltransplantation. LVEF, LVEDD, LVESD verringerten sich signifikant 8 Wochen nach MI-Induktion und signifikant in der hiPSC-MSCs-Gruppe 8 Wochen nach der Zelltransplantation. (B) Zur Beurteilung der Herzfunktion der Schweine mit Herzinsuffizienz wurden der +dP/dt-Wert und der ESPVR mit einem PV-Signalprozessor gemessen. Die unterlegene Vena cava (IVC) wurde während der ESPVR-Bewertung durch Balloninflation (blauer Pfeil) verdeckt. Sowohl das +dP/dt als auch das ESPVR verringerten sich nach MI-Induktion signifikant und nahmen dann 8 Wochen nach der Transplantation in den hiPSC-MSC-Gruppen signifikant zu. ANOVA gefolgt von Student-Newman-Keuls Post-hoc-Tests (SPSS, Version 14) wurde für signifikanzmitenwertes wert mit 0,05 verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Infarktbereich ändert sich nach MI. LV-Querrichtungsproben mit einer Dicke von 1 cm in jedem Herz, das ingeschriebenes Myokard enthält. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
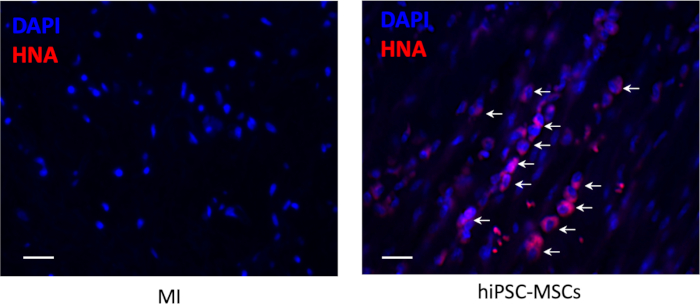
Abbildung 6: Zellüberleben nach der Transplantation. Die Transplantation der transplantierten hiPSC-MSCs wurde durch immunhistochemische Färbung für antihumanes kernnukleares Antigen (rote Farbe) nachgewiesen. Skalenbalken = 100 m. Pfeile stellen positive Zellen dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Die Inzidenz enthoben ventrikulärer Tachyarrhythmien. (A) Venriculartyarrhythmien (VT, roter Pfeil), die durch in vivo intrakardiale programmierte elektrische Stimulation induziert werden. (B) Die Inzidenz von VT stieg nach MI-Induktion signifikant an. Die Zelltransplantation hat die Inzidenz von VT nicht erhöht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Ergänzende Abbildung 1: Echokardiogramm-Erfassung. Die linke Seite zeigt die Position des Tieres. Das rechte Panel zeigt die Sondenposition an. Das mittlere Panel zeigt das echokardiographische Bild unter dieser Position. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
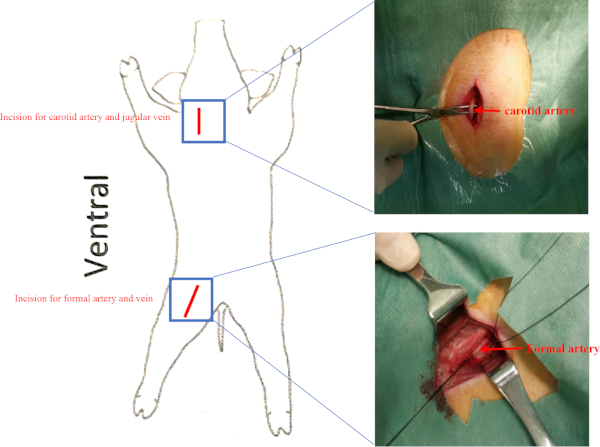
Ergänzende Abbildung 2: Lage der Gefäße. Schweine wurden in die Supine-Position gebracht. Schnitte für die Halsschlagader und die Oberschenkelarterie werden als rote Linie dargestellt. Die Jugularvene und die Femoralvene befanden sich unter der Halsschlagader bzw. der Oberschenkelarterie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Standard-Tiermodelle sind von größter Bedeutung, um die Pathophysiologie und Mechanismen von Krankheiten zu verstehen und neuartige Therapeutika zu testen. Unser Protokoll legt ein Schweinemodell von HF fest, das durch linke Zirkumflexarterienverstopfung und schnelles Tempo induziert wird. Acht Wochen nach der Induktion von MI entwickelten die Tiere eine signifikante Beeinträchtigung von LVEF, LVEDD, LVESD, +dP/dt und ESPVR. Dieses Protokoll testet auch die Verabreichungsmethode der Stammzelltherapie zur Herzregeneration durch intramyokardiale Injektion. Die Infarktgröße und die herzsystolische und diastolische Funktion werden ausgewertet. Diese Studie hilft dabei, ein stabiles und reproduzierbares präklinisches HF-Großtier-HF-Modell für die Stammzellbehandlung zu etablieren, das klinischen Fällen ähnelt.
LCX-Blockade und Schnelltempo wurden in unseren früheren Studien7,8ausgiebig verwendet, um Tiermodelle von HF zu erstellen. Der LCX distal bis zum ersten stumpfen Randzweig wurde okkludiert, gefolgt von 4 Wochen schneller rechtventrikulärer Stimulation. Myocardium Ischämie führt zum Verlust von Kardiomyozyten während MI, die Herzfibrose verursacht, Myokardumumbau, und Herzrhythmusstörungen. Ventrikuläres Tempo führt zu signifikanter LV-Dilatation, nonischem Beeinträchtigung der linksventrikulären Kontraktilität und schwerer LV-Dysfunktion9,10. Längere Dauern der Ischämie und schnelles Tempo ergeben ein progressives experimentelles HF-Modell mit niedrigem Ausgang für die translationale Forschung. Frühere Studien etablierten Herzinsuffizienzmodelle, indem sie MI10induzieren. Die Sterblichkeit schwerer MI war jedoch höher und die LVEF-Reduktion von MI war instabil. Daher wenden wir eine schnelle rechtsventrikuläre Stimulation nach LCX-Verstopfung an, um eine signifikante Beeinträchtigung der Herzfunktion zu induzieren. Wie aus unseren früheren Studien hervorgeht, ergibt das hier vorgestellte Modell eine stabile Infarktgröße, und der LVEF dieses Modells wird auf mindestens unter 40% normal6,7,8reduziert. Hätte es weniger Infektionen und Blutungen gegeben, hätte unsere Modellerfolgsrate bei etwa 80 % liegen können.
Eine der größten Hürden für die klinische Anwendung von Stammzellen ist ihr schlechtes Überleben und ihre Transplantation nach der Transplantation. Jüngste klinische Studien und Meta-Analysen11,12,13,14,15 haben keine konsistente Verbesserung der LV-Funktion oder Infarktgröße nach einer solchen Therapie nachgewiesen. Einer der möglichen Gründe ist die niedrige Überlebensrate transplantierter Zellen. Die Entdeckung einer optimalen Verabreichungsmethode spielt bei Stammzelltherapien eine entscheidende Rolle. Vergleichder der drei Methoden der Zelltransplantation ist die intramyokardiale Verabreichung aufgrund der höheren Zellretention16,17effizienter als die intravenöse und intrakoronare Verabreichung. Daher haben wir in dieser Studie eine intramyokardiale Verabreichungsroute für die IPSC-MSCs-Bereitstellung ausgewählt. Echokarographische Ergebnisse und invasive hämodynamische Ergebnisse zeigten, dass die intramyokardiale Verabreichung von iPSC-MSCs die LV-Funktion von Post-MI HF-Schweinen 8 Wochen nach der Zelltransplantation verbessert. Trotz der Verabreichung von immunsuppressiven Medikamenten (ein Steroid und Cyclosporin) wurden nur wenige transplantierte Zellen im Periinfarktbereich nachgewiesen. Im Infarktbereich um die injizierte Stelle wurde keine überlebende Zelle nachgewiesen. Frühere Studien haben auch einen extrem kleinen Teil der Stammzellen im infarktierten Myokard nach der Transplantationgefunden 18,19,20,21. Zellverlust während der intramyokardialen Verabreichung könnte die experimentellen Ergebnisse beeinflussen. Wie die Verwaltungsmethoden verbessert und die Aufenthaltsquote erhöht werden kann, sollte in künftigen Studien geklärt werden.
Sicherheit, insbesondere Arrhythmogenese, ist ein weiteres wichtiges Anliegen in Bezug auf die klinische Praxis mit zellbasierten Therapien. Unsere jüngste Studie hat gezeigt, dass die intramyokardiale Verabreichung von humanen Embryostammzellen (hESC) abgeleiteten CMs die Inzidenz von spontanen nicht-anhaltenden ventrikulären Tachyarrhythmienerhöht 4. In unserem Post-MI HF-Schweinemodell betrug die Inzidenz von spontaner nicht-anhaltender ventrikulärer Tachyarrhythmie (Rate >180 bpm und >12 Schläge), die durch Telemetrieüberwachung des Herzschrittmachers aufgezeichnet wurde, 25%, aber eine nachhaltige VT konnte leicht induziert werden (80%). In dieser Studie bleibt die Inzidenz des plötzlichen Todes unverändert mit oder ohne HiPSC-MSCs-Administration. Darüber hinaus hat die HiPSC-MSCs-Transplantation das zugrunde liegende Myokardsubstrat nicht geändert, um die Anfälligkeit für ventrikuläre Arrhythmien zu reduzieren oder zu erhöhen. Dieses Ergebnis legt nahe, dass das große chronische HF-Modell für die Zellsicherheitsbewertung verwendet werden könnte.
Die Vermeidung von Infektionen und Blutungen sind für eine erfolgreiche Tiermodelleinrichtung von größter Bedeutung. Um das Blutungsrisiko zu verringern, sollte darauf geachtet werden, Schäden an Herzkranzgefäßen und Herzvenen zu vermeiden. Da zwei Tiere an einer schweren Infektion starben, wird eine angemessene postoperative medizinische Strategie von Nutzen sein. Hier bieten wir eine postoperative medizinische Strategie wie folgt: Intramuskulär verabreichen Enrofloxacin (7,5 mg/kg, SID) und Buprenorphin (0,02 mg/kg, BID) kombiniert mit oral verabreichendem Amoxycillin/Clavulansäure (12,5mg/kg, SID) und Carprofen (2 mg/kg, SID) an alle Tiere 1 Woche nach der Operation, um eine Infektion zu verhindern und zu lindern.
Zusammenfassend lässt sich sagen, dass die aktuelle Methode ein stabiles und reproduzierbares klinisch relevantes Großtiermodell für zellbasierte Therapien bietet.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren würdigen Alfreda und Kung Tak Chung für ihre hervorragende technische Unterstützung bei den Tierversuchen.
Materialien
| Name | Company | Catalog Number | Comments |
| Amiodarone | Mylan | - | - |
| Anaesthetic machines and respirator | Drager | Fabius plus XL | - |
| Angiocath | Becton Dickinson | 381147 | - |
| Anti-human nuclear antigen | abcam | ab19118 | - |
| Axio Plus image capturing system | Zeiss | Axioskop 2 PLUS | Axioskop 2 plus |
| AxioVision Rel. 4.5 software | Zeiss | - | - |
| Baytril | Bayer | - | enrofloxacin |
| Betadine | Mundipharma | - | - |
| CardioLab Electrophysiology Recording Systems | GE Healthcare | G220f | - |
| Culture media | MesenCult | 05420 | - |
| Cyclosporine | Novartis | - | - |
| Defibrillator | GE Healthcare | CardioServ | - |
| Dorminal | TEVA | - | - |
| Echocardiographic system | GE Vingmed | Vivid i | - |
| EchoPac software | GE Vingmed | - | - |
| Electrophysiological catheter | Cordis Corp | - | - |
| Embozene Microsphere | Boston Scientific | 17020-S1 | 700 μm |
| Endotracheal tube | Vet Care | VCPET70PCW | Size 7 |
| Ethanol | VWR chemicals | 20821.33 | - |
| Formalin | Sigma | HT501320 | 10% |
| IVC balloon Dilatation Catheter | Boston Scientific | 3917112041 | Mustang |
| JR4 guiding catheter | Cordis Corp | 67208200 | 6F |
| Lidocaine | Quala | - | - |
| Mersilk | Ethicon | W584 | 2-0 |
| Metoprolol succinate | Wockhardt | - | - |
| Microtome | Leica | RM2125RT | - |
| Mobile C arm fluoroscopy equipment | GE Healthcare | OEC 9900 Elite | - |
| Pacemaker | St Jude Medical | PM1272 | Assurity MRI pacemaker |
| Pacemaker generator | St Jude Medical | Merlln model 3330 | - |
| Pressure-volume catheter | CD Leycom | CA-71103-PL | 7F |
| Pressure–volume signal processor | CD Leycom | SIGMA-M | - |
| Programmable Stimulator | Medtronic Inc | 5328 | - |
| PTCA Dilatation balloon Catheter | Boston Scientific | H7493919120250 | MAVERICK over the wire |
| Ramipril | TEVA | - | - |
| Sheath introducer | Cordis Corp | 504608X | 8F, 9F, 12F |
| Steroid | Versus Arthritis | - | - |
| Temgesic | Nindivior | - | buprenorphine |
| Venous indwelling needle | TERUMO | SR+OX2225C | 22G |
| Vicryl | Ethicon | VCP320H | 2-0 |
| Xylazine | Alfasan International B.V. | - | - |
| Zoletil | Virbac New Zealand Limited | - | tiletamine+zolezepam |
Referenzen
- Mozaffarian, D., et al. Heart disease and stroke statistics-2015 update: a report from the American Heart Association. Circulation. 131, e29 (2015).
- Hospital Authority. . Hospital Authority Statistical Report 2013. , (2013).
- Cung, T. T., et al. Cyclosporine before PCI in Patients with Acute Myocardial Infarction. The New England Journal of Medicine. 373 (11), 1021-1031 (2015).
- Liao, S. Y., et al. Proarrhythmic risk of embryonic stem cell-derived cardiomyocyte transplantation in infarcted myocardium. Heart Rhythm. 7, 1852-1859 (2010).
- Liao, S. Y., et al. Overexpression of Kir2.1 channel in embryonic stem cell-derived cardiomyocytes attenuates posttransplantation proarrhythmic risk in myocardial infarction. Heart Rhythm. 10, 273-282 (2013).
- Liu, Y., et al. Thoracic spinal cord stimulation improves cardiac contractile function and myocardial oxygen consumption in a porcine model of ischemic heart failure. Journal of Cardiovascular Electrophysiology. 23, 534-540 (2012).
- Liao, S. Y., et al. Improvement of Myocardial Function Following Catheter-Based Renal Denervation in Heart Failure. JACC: Basic to Translational Science. 2 (3), 270-281 (2017).
- Liao, S. Y., et al. Remodelling of cardiac sympathetic re-innervation with thoracic spinal cord stimulation improves left ventricular function in a porcine model of heart failure. Europace. 17 (12), 1875-1883 (2015).
- Daehnert, I., Rotzsch, C., Wiener, M., Schneider, P. Rapid right ventricular pacing is an alternative to adenosine in catheter interventional procedures for congenital heart disease. Heart. 90 (9), 1047-1050 (2004).
- Hála, P., et al. Tachycardia-Induced Cardiomyopathy as a Chronic Heart Failure Model in Swine. Journal of Visualized Experiments. (132), e57030 (2018).
- Santoso, T., et al. Endomyocardial implantation of autologous bone marrow mononuclear cells in advanced ischemic heart failure: a randomized placebo-controlled trial (END-HF). Journal of Cardiovascular Translational Research. 7, 545-552 (2014).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network. Effect of intracoronary delivery of autologous bone marrow mononuclear cells 2 to 3 weeks following acute myocardial infarction on left ventricular function: the LateTIME randomized trial. Journal of the American Medical Association. 306, 2110-2119 (2011).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network (CCTRN). Effect of the use and timing of bone marrow mononuclear cell delivery on left ventricular function after acute myocardial infarction: the TIME randomized trial. Journal of the American Medical Association. 308, 2380-2389 (2012).
- de Jong, R., Houtgraaf, J. H., Samiei, S., Boersma, E., Duckers, H. J. Intracoronary stem cell infusion after myocardial infarction. A meta-analysis and update on clinical trials. Circulation: Cardiovascular Interventions. 7, 156-167 (2014).
- Nowbar, A. N., et al. DAMASCENE writing group. Discrepancies in autologous bone marrow stem cell trials and enhancement of ejection fraction (DAMASCENE): weighted regression and meta-analysis. British Medical Journal. 348, g2688 (2014).
- Kanelidis, A. J., Premer, C., Lopez, J., Balkan, W., Hare, J. M. Route of Delivery Modulates the Efficacy of Mesenchymal Stem Cell Therapy for Myocardial Infarction: A Meta-Analysis of Preclinical Studies and Clinical Trials. Circulation Research. 120 (7), 1139-1150 (2017).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112 (9 Suppl), I150-I156 (2005).
- Hu, X., et al. A Large-Scale Investigation of Hypoxia-Preconditioned Allogeneic Mesenchymal Stem Cells for Myocardial Repair in Nonhuman Primates: Paracrine Activity Without Remuscularization. Circulation Research. 118, 970-983 (2016).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Martens, A., et al. Substantial early loss of induced pluripotent stem cells following transplantation in myocardial infarction. Artificial Organs. 38, 978-984 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538, 388-391 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten