Method Article
Establecer un modelo porcino de infarto de infarto post-miocardio insuficiencia cardíaca para el tratamiento de células madre
En este artículo
Resumen
Buscamos establecer un modelo porcino de insuficiencia cardíaca inducida por la obstrucción de la arteria circunfleja izquierda y un ritmo rápido para probar el efecto y la seguridad de la administración intramiocardial de células madre para terapias basadas en células.
Resumen
Aunque se han logrado avances en el tratamiento de la insuficiencia cardíaca (HF) después del infarto de miocardio (MI), la IC después de la MI sigue siendo una de las principales causas de mortalidad y morbilidad en todo el mundo. Las terapias basadas en células para la reparación cardíaca y la mejora de la función ventricular izquierda después de la MI han atraído una atención considerable. En consecuencia, la seguridad y eficacia de estos trasplantes de células debe probarse en un modelo animal grande preclínico de IC antes del uso clínico. Los cerdos son ampliamente utilizados para la investigación de enfermedades cardiovasculares debido a su similitud con los seres humanos en términos de tamaño del corazón y anatomía coronaria. Por lo tanto, buscamos presentar un protocolo eficaz para el establecimiento de un modelo de IC crónica porcina utilizando la oclusión del balón coronario de pecho cerrado de la arteria circunfleja izquierda (LCX), seguido de un ritmo ventricular rápido inducido con la implantación del marcapasos. Ocho semanas más tarde, las células madre fueron administradas por inyección intramiocardio en el área de peri-infarto. A continuación, se evaluó el tamaño del infarto, la supervivencia celular y la función ventricular izquierda (incluyendo ecocardiografía, parámetros hemodinámicos y electrofisiología). Este estudio ayuda a establecer un modelo estable de HF animal grande preclínico para el tratamiento de células madre.
Introducción
Las enfermedades cardiovasculares, la enfermedad de las arterias coronarias (CAD) en particular, siguen siendo la principal causa de morbilidad y mortalidad en Hong Kong y en todo el mundo1. En Hong Kong, se proyectó un aumento del 26% entre 2012 y 2017 del número de pacientes con CAD tratados en el marco de la Autoridad Hospitalaria2. Entre todos los CAT, el infarto agudo de miocardio (MI) es una de las principales causas de muerte y complicaciones posteriores, como la insuficiencia cardíaca (HF). Estos contribuyen a cargas médicas, sociales y financieras significativas. En pacientes con MI, la terapia trombolítica o la intervención coronaria percutánea primaria (PCI) es una terapia eficaz para preservar la vida, pero estas terapias solo pueden reducir la pérdida de cardiomiocitos (CM) durante la E. Los tratamientos disponibles son incapaces de reponer la pérdida permanente de CM, lo que conduce a fibrosis cardíaca, remodelación miocárdica, arritmia cardíaca y, finalmente, insuficiencia cardíaca. La tasa de mortalidad a 1 año después de mima es de alrededor del 7% con más del 20% de los pacientes que desarrollan IC3. En pacientes con IC en etapa terminal, el trasplante de corazón es la única terapia efectiva disponible, pero está limitada por la escasez de órganos disponibles. Las terapias novedosas son necesarias para revertir el desarrollo de la IC post-MI. Como resultado, la terapia basada en células se considera un enfoque atractivo para reparar los CM deteriorados y mejorar la función ventricular izquierda (LV) en la IC después de la MI. Nuestros estudios previos encontraron que el trasplante de células madre es beneficioso para la mejora de la función cardíaca después del trasplante intramiocardio directo en modelos animales pequeños de MI4,,5. Por lo tanto, se necesitan protocolos estandarizados preclínicos de LCA para animales grandes para probar aún más la eficacia y seguridad del trasplante de células madre antes del uso clínico.
En las últimas décadas se ha visto el uso generalizado de cerdos en la investigación cardiovascular para la terapia con células madre. Los cerdos HF son un modelo prometedor de investigación traslacional debido a su similitud con los seres humanos en términos de tamaño cardíaco, peso, ritmo, función y anatomía de la arteria coronaria. Además, los modelos de IC porcino pueden imitar a los pacientes con IC post-MI en términos de metabolismo de CM, propiedades electrofisiológicas y cambios neuroendocrinos en condiciones isquémicas6. El protocolo presentado aquí utiliza un modelo de HF de cerdo estandarizado, empleando una oclusión de globo coronario de pecho cerrado de la arteria circunflex izquierda (LCX) seguida de un ritmo rápido inducido por la implantación del marcapasos. El estudio también optimiza la vía de administración intramiocardial de células madre para el tratamiento de la IC post-MI. El propósito es producir un modelo animal porcino de infarto crónico de miocardio que se puede utilizar para desarrollar tratamientos que sean clínicamente relevantes para pacientes con CAD grave.
Protocolo
Todos los experimentos con animales se realizaron de acuerdo con la Guía para el Cuidado y Uso de Animales de Laboratorio publicada por los Institutos Nacionales de Salud de los Estados Unidos y los reglamentos de la Universidad de Hong Kong, y el protocolo fue aprobado por el Comité para el Uso de Animales Vivos en La Enseñanza y la Investigación (CULTAR) en la Universidad de Hong Kong.
NOTA: Para este estudio se utilizaron cerdos de granja hembra de 35-40 kg (9-12 meses de edad). El diagrama de flujo de este experimento se muestra en la Figura 1.
1. Procedimientos quirúrgicos
- Anestesia y preparación del animal
- Ayunar los animales durante 12 h y sujetos a la privación de agua durante 4 horas antes del experimento.
- Anestesiar a los cerdos a través de una inyección intramuscular de teja+zolezepam (2-7 mg/kg) y xilazina (0,5-1 mg/kg) preparada en 20 ml de solución salina normal. Monitoree los reflejos palpebrales del animal hasta que estén ausentes.
- Retire el pelo del cerdo y esterilizar la piel en el cuello y la ingle para las secciones 1.3-1.5. Desinfectar el área de operación 3x con 70% de etanol y betadina.
- Coloque un tubo endotraqueal de 7 mm en la tráquea porcina y coloque una aguja venosa de 22 G en la vena del oído.
- Mueva el cerdo a la mesa de operaciones y colóquelo en una posición supina. Conecte el tubo endotraqueal al respirador y ventile mecánicamente (relación de tiempo inspiratorio/espiratorio 1:2) al animal con isoflurano (1,5%-2,0% inhalación) y oxígeno (0,5-1,5 L/min inhalación).
- Supervise el electrocardiograma superficial y la presión arterial, y controle continuamente la frecuencia cardíaca, el ritmo cardíaco y la presión arterial a través de sistemas de registro electrofisiología.
- Ecocardiografía
- Mueva el cerdo a la posición del decúbito lateral izquierdo y fije en la mesa.
- Coloque la sonda en la región pericárdica y realice ecocardiografía en serie, incluyendo imágenes en modo 2D y M, utilizando un sistema ecocardiográfico de alta resolución y un transductor de 3-9 MHz al inicio, antes del trasplante celular y 8 semanas después del trasplante celular (Figura complementaria 1).
- Analizar todas las imágenes obtenidas utilizando software comercial. Calcule la dimensión diastólica final (LVEDD), la dimensión sistólica final de LV (LVESD), el volumen diastólico final de LV (LVEDV), el volumen sistólico final lv (LVESV), la fracción de eyección del LV (LVEF) y el espesor de la pared después de obtener imágenes ecocardiográficas estándar de la vista de eje largo parasternal.
NOTA: Todos los análisis fuera de línea fueron realizados por otro operador independiente utilizando una estación de trabajo informática. La variabilidad de las mediciones entre diferentes observadores fue del 4% sobre la base de 20 imágenes aleatorias repetidas. Todas las mediciones ecocardiográficas se realizaron de acuerdo con las recomendaciones de la Sociedad Americana de Ecocardiografía.
- Implantación del marcapasos
- Mueva el cerdo a la posición supina y fije las extremidades del cerdo en la mesa con correas.
- Localice la arteria carótida derecha y la vena yugular en el triángulo carótido (detrás del esternocleidomastoideo y rodeado por el estehioides, el músculo diestrico y el omohyoid) y aísle la arteria carótida derecha y la vena yugular con fórceps hemostáticos en condiciones estériles (Figura suplementaria 2). Ligar el extremo distal de la arteria carótida derecha y la vena yugular. Coser los dos músculos con 2-0 Vicryl.
- Canular la vena yugular derecha con una angiocath e insertar un marcapasos que conduce al ventrículo derecho bajo la guía de rayos X (Figura 2).
- Aísle el esternocleidomastoideo y el músculo de la escala anterior utilizando fórceps. Implantar un marcapasos entre los dos músculos y coser los dos músculos con 2-0 de seda. Conecte el marcapasos al plomo.
- Reprogramar el marcapasos para hacer una copia de seguridad del modo VVI (35 bpm) mediante un generador de marcapasos después del trasplante.
- Aplicar un ritmo ventricular rápido (150 latidos/min) para inducir la IC por un generador de marcapasos 4 semanas después de la inducción de MI. A continuación, vuelva a colocar el marcapasos en modo VVI de copia de seguridad a las 8 semanas.
- Análisis de bucle de volumen de presión invasivo
NOTA: Realice una evaluación hemodinámica invasiva al inicio, antes del trasplante celular y 8 semanas después del trasplante celular para evaluar los cambios en la función del VL.- Aislar la arteria femoral derecha y la vena femoral en el triángulo femoral (rodeado por el ligamento inguinal, el músculo sartorius y el músculo aductor longus) (Figura suplementaria 2).
- Cannula la arteria femoral derecha con una angiocath y coloca un cable guía en la arteria a través de la angiocath. Retire la angiocato y cúmule una vaina 9F en la arteria bajo la guía del alambre guía. Retire el cable guía.
- Cannular la vena femoral derecha con una vaina 12F como se describe en el paso 1.4.2. Inserte un catéter de globo de la vaina 12F colocada en la vena cava inferior (IVC) bajo guía de rayos X.
- Calibre un catéter de volumen de presión (PV) de 7 fr en solución salina isotónica con un procesador de señal fotovoltaica.
- Inserte el catéter fotovoltaico en el ápice del LV desde la vaina 9F colocada bajo la guía de rayos X. Suspenda la ventilación y mida el derivado de presión positiva máxima ventricular izquierda (+dP/dt), la presión sistólica final (ESP) y las presiones diastólicas finales (EDP) con el procesador de señal fotovoltaica.
- Mida la relación presión-volumen sistólica final (ESPVR) por el procesador de señal fotovoltaica durante la oclusión del CIV.
- Reinicie la ventilación cuando finalice el procedimiento.
- Inducción de MI
- Administrar por vía intravenosa amiodarona (5 mg/kg por vía intravenosa durante 1 h) y lidocaína (1,5 mg/kg de bolo intravenoso) al animal antes de la inducción de MI para prevenir arritmias ventriculares.
- Cannula la arteria carótida derecha con una vaina 8F como se menciona en el paso 1.4.3.
- Realice la angiografía coronaria a través de un catéter guía 6F JR4 sobre el alambre a través de la vaina colocada guiada por el equipo de fluoroscopia estándar del brazo C.
- Ocluir la arteria coronaria circunfleja izquierda (LCX) distal a la primera rama marginal obtusa con angioplastia coronaria transluminal percutánea (PTCA) dilatación inflación del catéter del globo de dilatación bajo la guía de rayos X (Figura 2).
- Inyectar 1 ml de microesferas de esponja de 700 m mezcladas con 3 ml de solución salina preparadas en una jeringa de 10 ml a través del catéter de globo para bloquear el LCX, luego desinflar el globo y realizar una angiografía para confirmar la oclusión.
- Repita el procedimiento de inyección para lograr un bloqueo completo y exitoso.
- Controla la frecuencia cardíaca y el ritmo cardíacos de los animales para detectar arritmias cardíacas. Si ocurrió una fibrilación ventricular, utilice un desfibrilador bifásico externo para restablecer un ritmo sinusal usando 150-300 choques J.
- Inyección de células madre
- Asigne aleatoriamente todos los animales con notable deterioro de la función cardíaca (LVEF < 40% a las 8 semanas después de la inducción de MI) a dos grupos diferentes: uno que recibirá administración intramiocardio de 2 x 108 células madre mesenquimales derivadas de células madre inducidas por humanos (hiPSC-MSC), y el otro que no recibirá hiPSC-MSC.
- Preparar los hiPSC-MSC en 2 ml de solución salina normal para trasplante intramiocardio. Antes del trasplante intramiocardio hiPSC-MSCs, repita los pasos de anestesia y preparación animal mencionados en la sección 1.1, esta vez esterilizando 10 cm alrededor de la zona del latido del ápice. Realizar la toracotomía izquierda en el espacio intercostal 4-5 con un retractor. Realice la pericardiotomía para exponer la pared lateral infarto.
NOTA: La longitud de la incisión fue de 10-12 cm. - Utilice 5-8 inyecciones intramiocardio (0,3 ml por inyección) alrededor de la zona infarto para administrar el medio de cultivo(Tabla de materiales) a un grupo de animales o 2 x 108 hiPSC-MSC al otro grupo ( Figura3). Evite cuidadosamente cualquier daño a las arterias coronarias para reducir el riesgo de hemorragia.
- Cierra el espacio intercostal con alambre de hierro y cierra la capa muscular con seda 2-0. Coser el tejido subcutáneo y la piel con 2-0 vicril.
- Estimulación eléctrica programada intracardiaca
- Realizar estimulación eléctrica programada utilizando un estimulador programable para evaluar la inducibilidad de la taquiarritmia ventricular (V) después de la terapia de trasplante celular.
- Inserte un catéter electrofisiológico 6F en el ápice ventricular derecho a través de la vena femoral antes de sacrificar todos los animales.
- Visualice las grabaciones intracardiacas con los cables de electrocardiograma de superficie I, II y III en el sistema de grabación electrofisiológica a una velocidad de 200 mm/s. Proporcione un ancho de pulso de 2 ms a 2 veces el umbral diastólico usando un estimulador.
- Entregar un tren de ritmo de ocho estímulos (S1) en dos longitudes de ciclo de accionamiento (200 ms y 300 ms), seguido de uno (S2) o dos (S2 y S3) estímulos adicionales prematuros.
- Acortar secuencialmente los intervalos de acoplamiento hasta que se induzca un período refractario o arritmia eficaz ventricular. Tenga en cuenta la presencia de VT sostenido inducible (>10 s).
2. Protocolo postoperatorio
- Medicina postoperatoria
- Realizar terapias farmacológicas convencionales para la IC. En resumen, administrar por vía oral metoprolol succinato (25 mg) y ramipril (2,5 mg) a todos los animales diariamente.
- Administrar intramuscularmente enrofloxacino (5 mg/kg) y buprenorfina (0,01 mg/kg) a todos los animales diariamente durante 1 semana después de la cirugía para prevenir la infección y aliviar el dolor.
- Para minimizar el rechazo inmunológico, administrar por vía oral un esteroide (40 mg/día por vía oral) y ciclosporina (200 mg/día por vía oral) a todos los animales desde 3 días antes del trasplante celular hasta 8 semanas después.
- Evaluación del tamaño del infarto
- Eutanasiar a los animales mediante una sobredosis de dorminal (pentobarbital sódico, 100 mg/kg, IV) al final del experimento.
- Abre el pecho y recoge el corazón. Enjuague el corazón en un 0,9% de solución salina.
- Muestras de tejido LV de sección en serie con un bisturí a 1 cm de espesor en la dirección transversal del VI.
- Seleccione partes de las rebanadas que contienen el miocardio infarto para medir el espesor de la pared y el área de infarto.
- Capture la imagen de estas rebanadas y analice cuantitativamente el grosor de la pared y el área de infarto utilizando un software de análisis de imágenes comerciales.
- Fijar el tejido en 10% de formalina a 4 oC durante un mes. Incrustar el tejido dentro, adyacente y remoto a los sitios de infarto (1 cm2 piezas) en parafina. Secise en rodajas de 5 m utilizando un microtomo para el examen histológico.
- Supervivencia celular
- Detectar el injerto de las células trasplantadas mediante tinción inmunohistoquímica con antígeno nuclear antihumano (HNA) según el protocolo proporcionado por el fabricante.
- Capture la imagen en tres secciones diferentes en cinco campos aleatorios en cada animal y analice cuantitativamente las células positivas en la zona peri-infarto.
NOTA: El sistema de captura de imágenes y el software de análisis de imágenes se utilizaron para capturar y analizar las imágenes de las secciones del corazón.
Resultados
Mortalidad
En este estudio se utilizaron un total de 24 cerdos. Tres de ellos murieron durante la inducción de MI debido a la VT sostenida. Un animal murió en la cirugía a corazón abierto para la inyección celular debido al sangrado de la herida. Dos animales murieron a causa de una infección grave. Dos animales fueron excluidos debido a una ligera reducción de EF (reducción de la FEVI > 40% de la línea de base). Como resultado, 16 animales completaron todo el protocolo de estudio.
Función cardíaca y remodelación
El examen ecocardiográfico en serie mostró que la FEVI disminuyó significativamente de 68,23 a 3,52% al inicio hasta el 39,37 - 3,22%. La LVEDD aumentó significativamente de 3,6 a 0,5 a 4,8 a 0,4 y la LVESD aumentó significativamente de 2,5 a 0,3 a 3,9 a 0,4(Figura 4A) a las 8 semanas después de la inducción de LA MI. La FEVI y la LVESD mejoraron significativamente a 52,9 a 4,27% y 3,3 a 0,3 respectivamente en el grupo hiPSC-MSC 8 semanas después del trasplante, en comparación con el estado de MI(Figura 4A).
El +dP/dt y el ESPVR disminuyeron significativamente de 1.325 a 63 mmHg/s y de 3,9 a 0,4 al inicio a 978 a 45 mmHg/s y a 1,8 a 0,2 a 8 semanas después de la inducción de MI. La administración intramiocardio de hiPSC-MSC aumentó el +dP/dt y ESPVR a 1.127,4 a 50 mmHg/s y 2,6 a 0,3 a las 8 semanas después del trasplante de iPSC-MSC, en comparación con el estado mi(Figura 4B).
Espesor de la pared de Infarct
El espesor medio de la pared del infarto de LV se midió a partir de muestras de sección de 5-7 cm de espesor en serie en cada animal (Figura 5). El porcentaje de infarto de VL fue de 16 a 2%.
Supervivencia celular después del trasplante
No hubo supervivencia celular alrededor del lugar de inyección en el área del infarto 8 semanas después del trasplante, pero un pequeño número de los hiPSC-MSC de supervivencia fueron visibles en el área peri-infarto (Figura 6).
Arritmia ventricular inducible
La incidencia de taquirritmias ventriculares sostenidas inducibles podría aumentar fácilmente en animales con IC (10% al inicio frente a 75% 8 semanas después de la inducción de MI). El trasplante hiPSC-MSC no modifica significativamente el sustrato miocárdico subyacente para reducir la susceptibilidad a la VT (62,5% en el grupo hiPSC-MSCs 8 semanas después de la administración intramiocardial de hiPSC-MSC, Figura 7).
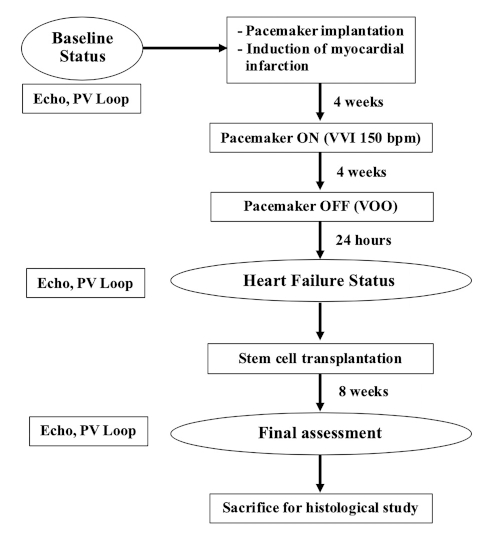
Figura 1: Diagrama de flujo del experimento. Haga clic aquí para ver una versión más grande de esta figura.
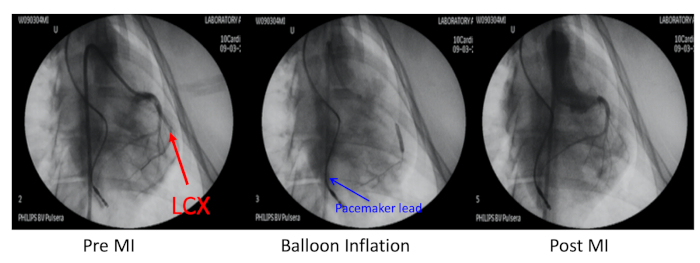
Figura 2: Modelo porcino de infarto de miocardio. El modelo porcino de infarto de miocardio (MI) fue inducido por embolización de la arteria coronaria circunfleja izquierda (LCX, flecha roja) distal a la primera rama marginal obtusa. Esta arteria coronaria fue ocluida con inflado de globo y una inyección de microesferas de 700 m. La angiografía coronaria en pre-MI, inflación de globos y post-MI se realizó a través de un catéter guía 6F JR4 a través de la arteria carótida derecha. El plomo del marcapasos se insertó en la pared del ventrículo derecho (flecha azul). Haga clic aquí para ver una versión más grande de esta figura.
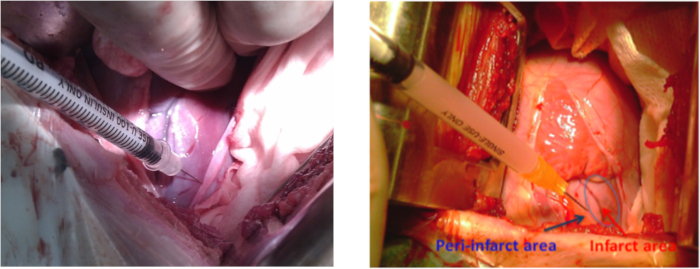
Figura 3: Trasplante celular en un modelo porcino de MI. Sitios de inyección celular en la pared lateral alrededor del área del infarto del ventrículo izquierdo durante la toracotomía izquierda. La flecha azul muestra el área peri-infarto y la flecha roja muestra el área del infarto. Haga clic aquí para ver una versión más grande de esta figura.
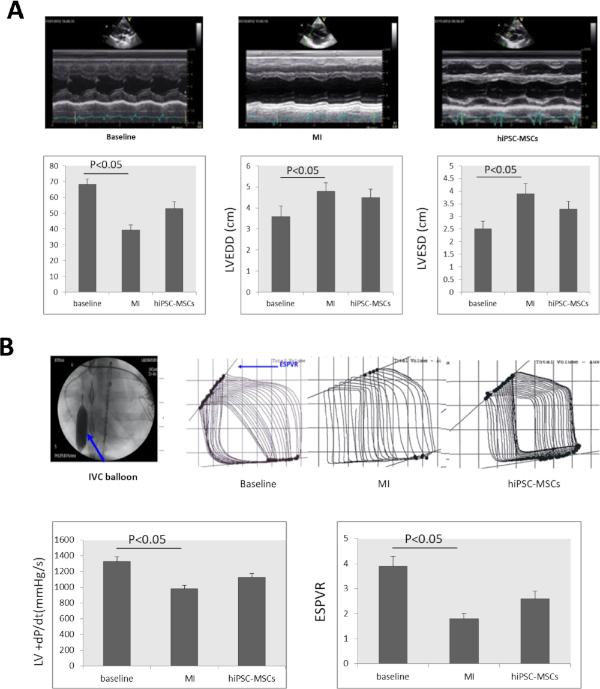
Figura 4: La función cardíaca cambia después de MI. (A) Una imagen de ecocardiograma en modo M LV al inicio, MI y trasplante celular. LA FEVI, LVEDD, LVESD disminuyeron significativamente 8 semanas después de la inducción de MI y aumentaron significativamente en el grupo hiPSC-MSC 8 semanas después del trasplante celular. (B) Para evaluar la función cardiaca de los cerdos con insuficiencia cardíaca, el valor +dP/dt y el ESPVR se midieron con un procesador de señal fotovoltaica. La vena cava inferior (IVC) fue ocluida por inflación de globos (flecha azul) durante la evaluación ESPVR. Tanto el +dP/dt como el ESPVR disminuyeron significativamente después de la inducción de MI, y luego aumentaron significativamente en los grupos hiPSC-MSC 8 semanas después del trasplante. ANOVA seguido de Student-Newman-Keuls post hoc testing (SPSS, versión 14) se utilizó con el valor de 0.05 para la importancia. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: El área de Infarto cambia después de MI. Lv muestras de dirección transversal seccionadas a 1 cm de espesor en cada corazón que contiene miocardio infarto. Haga clic aquí para ver una versión más grande de esta figura.
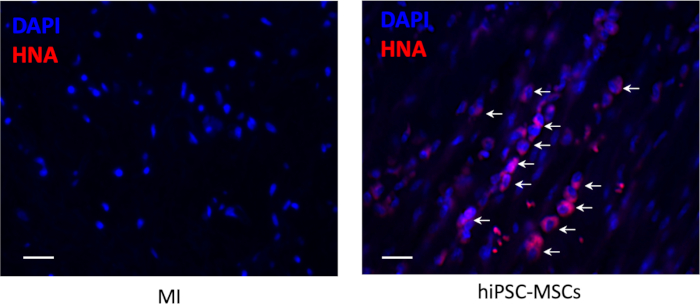
Figura 6: Supervivencia celular después del trasplante. El injerto de los hiPSC-MSC trasplantados se detectó mediante tinción inmunohistoquímica para antígeno nuclear antihumano (color rojo). Barra de escala a 100 m. Las flechas representan celdas positivas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Las incidencias de taquiarritmias ventriculares sostenidas. (A) Taquiarritmias ventriculares (VT, flecha roja) inducidas por estimulación eléctrica programada intracardiaca in vivo. (B) La incidencia de VT aumentó significativamente después de la inducción de MI. El trasplante celular no aumentó la incidencia de VT. Haga clic aquí para ver una versión más grande de esta figura.

Figura complementaria 1: Adquisición de ecocardiogramas. El panel izquierdo muestra la posición del animal. El panel derecho muestra la posición de la sonda. El panel central muestra la imagen ecocardiográfica bajo esta posición. Haga clic aquí para ver una versión más grande de esta figura.
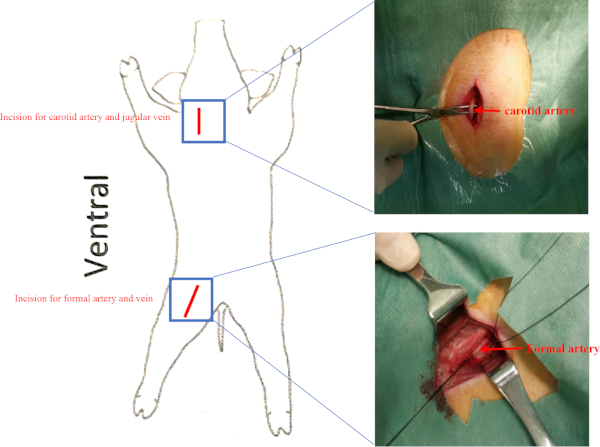
Figura suplementaria 2: Ubicación de los buques. Los cerdos fueron colocados en posición supina. Las incisiones para la arteria carótida y la arteria femoral se presentan como una línea roja. La vena yugular y la vena femoral estaban debajo de la arteria carótida y la arteria femoral respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los modelos animales estándar son de suma importancia para entender la fisiopatología y los mecanismos de las enfermedades y probar nuevas terapias. Nuestro protocolo establece un modelo porcino de HF inducido por el bloqueo de la arteria circunfleja izquierda y el ritmo rápido. Ocho semanas después de la inducción de MI, los animales desarrollaron un deterioro significativo de la FEVI, LVEDD, LVESD, +dP/dt y ESPVR. Este protocolo también prueba el método de administración de la terapia con células madre para la regeneración cardíaca mediante inyección intramiocardio. Se evalúa el tamaño del infarto y la función sistólica y diastólica cardíaca. Este estudio ayuda a establecer un modelo de IC animal grande preclínico estable y reproducible para el tratamiento con células madre, que es similar a los casos clínicos.
El bloqueo de LCX y el ritmo rápido se han utilizado ampliamente para crear modelos animales de HF en nuestros estudios anteriores7,,8. La LCX distal a la primera rama marginal obtusa fue ocluida, seguida de 4 semanas de ritmo ventricular derecho rápido. La isquemia del miocardio produce la pérdida de cardiomiocitos durante la MI, que causa fibrosis cardíaca, remodelación del miocardio y arritmia cardíaca. El ritmo ventricular da como resultado una dilatación significativa del VI, un deterioro no no osonmico de la contractilidad ventricular izquierda y una disfunción grave del VL9,,10. Las duraciones más largas de la isquemia y el ritmo rápido producen un modelo experimental progresivo de HF de baja producción para la investigación traslacional. Estudios previos establecieron modelos de insuficiencia cardíaca induciendo MI10. Sin embargo, la mortalidad de MI grave fue mayor y la reducción de la FEVI de la MI fue inestable. Por lo tanto, aplicamos un ritmo ventricular derecho rápido después de la obstrucción de la LCX para inducir un deterioro significativo de la función cardíaca. Como se puede ver en nuestros estudios anteriores, el modelo presentado aquí produce un tamaño estable de infarto, y la FEVI de este modelo se reduce al menos por debajo del 40% normal6,7,8. Si hubiera habido menos infecciones y sangrado, nuestra tasa de éxito modelo podría haber sido de alrededor del 80%.
Uno de los principales obstáculos para la aplicación clínica de las células madre es su pobre supervivencia e injerto después del trasplante. Estudios clínicos recientes y metanálisis11,12,13,14,15 no han demostrado ninguna mejora consistente en la función de la VL o el tamaño del infarto después de dicha terapia. Una de las posibles razones es la baja tasa de supervivencia de las células trasplantadas. Descubrir un método de administración óptimo desempeña un papel fundamental en las terapias con células madre. Comparando los tres métodos de trasplante celular, la administración intramiocardio es más eficiente que la administración intravenosa e intracoronaria debido a una mayor retención celular16,,17. Por lo tanto, seleccionamos una vía de administración intramiocardio para la entrega de iPSC-MSC en este estudio. Los resultados ecocardiográficos y los resultados hemodinámicos invasivos demostraron que la administración intramiocardial de iPSC-MSC mejoró la función IV de los cerdos hf post-MI 8 semanas después del trasplante celular. A pesar de la administración de fármacos inmunosupresores (un esteroide y ciclosporina), sólo se detectaron unas pocas células trasplantadas en el área de peri-infarto. No se detectó ninguna célula sobreviviente en el área infartada alrededor del sitio inyectado. Estudios anteriores también han encontrado una porción extremadamente pequeña de células madre en el miocardio infarto después del trasplante18,19,20,21. La pérdida celular durante la administración intramiocardio puede afectar los resultados experimentales. La forma de mejorar los métodos de administración y aumentar la tasa de residencia debe aclararse en estudios futuros.
La seguridad, especialmente la arritmogénesis, es otra preocupación vital con respecto a la práctica clínica con terapias basadas en células. Nuestro estudio reciente demostró que la administración intramiocardial de células madre embrionarias humanas (hESC) derivan CM aumentó la incidencia de taquiarritmias ventriculares no sostenidas espontáneas4. En nuestro modelo porcino post-MI HF, la incidencia de taquiarritmia ventricular no sostenida espontánea (tasa >180 bpm y >12 latidos) registrada por la monitorización de telemetría del marcapasos fue del 25% después de la inducción de MI, pero la VT sostenida podría inducirse fácilmente (80%). En este estudio, la incidencia de muerte súbita permanece inalterada con o sin administración de hiPSC-MSC. Además, el trasplante de hiPSC-MSC no modificó el sustrato miocárdico subyacente para reducir o aumentar la susceptibilidad a las arritmias ventriculares. Este resultado sugiere que el modelo de IC crónica de animales grandes podría utilizarse para la evaluación de la seguridad celular.
La evitación de infecciones y hemorragias es de suma importancia para el establecimiento exitoso de modelos animales. Para reducir el riesgo de hemorragia, se debe prestar atención para evitar cualquier daño a las arterias coronarias y las venas cardíacas. Dado que dos animales murieron de infección grave, se beneficiará una estrategia médica postoperatoria adecuada. Aquí, proporcionamos una estrategia médica postoperatoria como se indica a continuación: Administración intramuscular de enrofloxacino (7,5 mg/kg, SID) y buprenorfina (0,02 mg/kg, BID) combinados con administración oral de Amoxycilina/ácido clavulánico (12,5 mg/kg, SID) y carprofeno (2 mg/kg, SID) a todos los animales durante 1 semana después de la cirugía para prevenir la infección y aliviar el dolor.
En resumen, el método actual proporciona un modelo animal grande estable y reproducible clínicamente relevante de insuficiencia cardíaca para terapias basadas en células.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores reconocen a Alfreda y Kung Tak Chung por su excelente apoyo técnico durante los experimentos con animales.
Materiales
| Name | Company | Catalog Number | Comments |
| Amiodarone | Mylan | - | - |
| Anaesthetic machines and respirator | Drager | Fabius plus XL | - |
| Angiocath | Becton Dickinson | 381147 | - |
| Anti-human nuclear antigen | abcam | ab19118 | - |
| Axio Plus image capturing system | Zeiss | Axioskop 2 PLUS | Axioskop 2 plus |
| AxioVision Rel. 4.5 software | Zeiss | - | - |
| Baytril | Bayer | - | enrofloxacin |
| Betadine | Mundipharma | - | - |
| CardioLab Electrophysiology Recording Systems | GE Healthcare | G220f | - |
| Culture media | MesenCult | 05420 | - |
| Cyclosporine | Novartis | - | - |
| Defibrillator | GE Healthcare | CardioServ | - |
| Dorminal | TEVA | - | - |
| Echocardiographic system | GE Vingmed | Vivid i | - |
| EchoPac software | GE Vingmed | - | - |
| Electrophysiological catheter | Cordis Corp | - | - |
| Embozene Microsphere | Boston Scientific | 17020-S1 | 700 μm |
| Endotracheal tube | Vet Care | VCPET70PCW | Size 7 |
| Ethanol | VWR chemicals | 20821.33 | - |
| Formalin | Sigma | HT501320 | 10% |
| IVC balloon Dilatation Catheter | Boston Scientific | 3917112041 | Mustang |
| JR4 guiding catheter | Cordis Corp | 67208200 | 6F |
| Lidocaine | Quala | - | - |
| Mersilk | Ethicon | W584 | 2-0 |
| Metoprolol succinate | Wockhardt | - | - |
| Microtome | Leica | RM2125RT | - |
| Mobile C arm fluoroscopy equipment | GE Healthcare | OEC 9900 Elite | - |
| Pacemaker | St Jude Medical | PM1272 | Assurity MRI pacemaker |
| Pacemaker generator | St Jude Medical | Merlln model 3330 | - |
| Pressure-volume catheter | CD Leycom | CA-71103-PL | 7F |
| Pressure–volume signal processor | CD Leycom | SIGMA-M | - |
| Programmable Stimulator | Medtronic Inc | 5328 | - |
| PTCA Dilatation balloon Catheter | Boston Scientific | H7493919120250 | MAVERICK over the wire |
| Ramipril | TEVA | - | - |
| Sheath introducer | Cordis Corp | 504608X | 8F, 9F, 12F |
| Steroid | Versus Arthritis | - | - |
| Temgesic | Nindivior | - | buprenorphine |
| Venous indwelling needle | TERUMO | SR+OX2225C | 22G |
| Vicryl | Ethicon | VCP320H | 2-0 |
| Xylazine | Alfasan International B.V. | - | - |
| Zoletil | Virbac New Zealand Limited | - | tiletamine+zolezepam |
Referencias
- Mozaffarian, D., et al. Heart disease and stroke statistics-2015 update: a report from the American Heart Association. Circulation. 131, e29 (2015).
- Hospital Authority. . Hospital Authority Statistical Report 2013. , (2013).
- Cung, T. T., et al. Cyclosporine before PCI in Patients with Acute Myocardial Infarction. The New England Journal of Medicine. 373 (11), 1021-1031 (2015).
- Liao, S. Y., et al. Proarrhythmic risk of embryonic stem cell-derived cardiomyocyte transplantation in infarcted myocardium. Heart Rhythm. 7, 1852-1859 (2010).
- Liao, S. Y., et al. Overexpression of Kir2.1 channel in embryonic stem cell-derived cardiomyocytes attenuates posttransplantation proarrhythmic risk in myocardial infarction. Heart Rhythm. 10, 273-282 (2013).
- Liu, Y., et al. Thoracic spinal cord stimulation improves cardiac contractile function and myocardial oxygen consumption in a porcine model of ischemic heart failure. Journal of Cardiovascular Electrophysiology. 23, 534-540 (2012).
- Liao, S. Y., et al. Improvement of Myocardial Function Following Catheter-Based Renal Denervation in Heart Failure. JACC: Basic to Translational Science. 2 (3), 270-281 (2017).
- Liao, S. Y., et al. Remodelling of cardiac sympathetic re-innervation with thoracic spinal cord stimulation improves left ventricular function in a porcine model of heart failure. Europace. 17 (12), 1875-1883 (2015).
- Daehnert, I., Rotzsch, C., Wiener, M., Schneider, P. Rapid right ventricular pacing is an alternative to adenosine in catheter interventional procedures for congenital heart disease. Heart. 90 (9), 1047-1050 (2004).
- Hála, P., et al. Tachycardia-Induced Cardiomyopathy as a Chronic Heart Failure Model in Swine. Journal of Visualized Experiments. (132), e57030 (2018).
- Santoso, T., et al. Endomyocardial implantation of autologous bone marrow mononuclear cells in advanced ischemic heart failure: a randomized placebo-controlled trial (END-HF). Journal of Cardiovascular Translational Research. 7, 545-552 (2014).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network. Effect of intracoronary delivery of autologous bone marrow mononuclear cells 2 to 3 weeks following acute myocardial infarction on left ventricular function: the LateTIME randomized trial. Journal of the American Medical Association. 306, 2110-2119 (2011).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network (CCTRN). Effect of the use and timing of bone marrow mononuclear cell delivery on left ventricular function after acute myocardial infarction: the TIME randomized trial. Journal of the American Medical Association. 308, 2380-2389 (2012).
- de Jong, R., Houtgraaf, J. H., Samiei, S., Boersma, E., Duckers, H. J. Intracoronary stem cell infusion after myocardial infarction. A meta-analysis and update on clinical trials. Circulation: Cardiovascular Interventions. 7, 156-167 (2014).
- Nowbar, A. N., et al. DAMASCENE writing group. Discrepancies in autologous bone marrow stem cell trials and enhancement of ejection fraction (DAMASCENE): weighted regression and meta-analysis. British Medical Journal. 348, g2688 (2014).
- Kanelidis, A. J., Premer, C., Lopez, J., Balkan, W., Hare, J. M. Route of Delivery Modulates the Efficacy of Mesenchymal Stem Cell Therapy for Myocardial Infarction: A Meta-Analysis of Preclinical Studies and Clinical Trials. Circulation Research. 120 (7), 1139-1150 (2017).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112 (9 Suppl), I150-I156 (2005).
- Hu, X., et al. A Large-Scale Investigation of Hypoxia-Preconditioned Allogeneic Mesenchymal Stem Cells for Myocardial Repair in Nonhuman Primates: Paracrine Activity Without Remuscularization. Circulation Research. 118, 970-983 (2016).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Martens, A., et al. Substantial early loss of induced pluripotent stem cells following transplantation in myocardial infarction. Artificial Organs. 38, 978-984 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538, 388-391 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados