Method Article
Istituzione di un modello suina di infarto post-miocardico per il trattamento delle cellule staminali
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Abbiamo cercato di stabilire un modello suine di insufficienza cardiaca indotta dal blocco dell'arteria circumflex sinistra e dal rapido ritmo per testare l'effetto e la sicurezza della somministrazione intramiocardiale delle cellule staminali per terapie basate sulle cellule.
Abstract
Anche se sono stati raggiunti progressi nel trattamento dell'insufficienza cardiaca (HF) dopo l'infarto miocardico (MI), HF dopo MI rimane una delle principali cause di mortalità e morbilità in tutto il mondo. Le terapie a base cellulare per la riparazione cardiaca e il miglioramento della funzione ventricolare sinistra dopo l'MI hanno attirato notevole attenzione. Di conseguenza, la sicurezza e l'efficacia di questi trapianti di cellule devono essere testate in un modello animale preclinico di grandi dimensioni di HF prima dell'uso clinico. I maiali sono ampiamente utilizzati per la ricerca sulle malattie cardiovascolari a causa della loro somiglianza con gli esseri umani in termini di dimensioni cardiache e anatomia coronarica. Pertanto, abbiamo cercato di presentare un protocollo efficace per la creazione di un modello HF cronico porcina utilizzando l'occlusione a palloncino coronarico a torso chiuso dell'arteria circumflex sinistra (LCX), seguita da un rapido ritmo ventricolare indotto dall'impianto del pacemaker. Otto settimane dopo, le cellule staminali sono state somministrate mediante iniezione intramiocardia nell'area peri-infarta. Poi sono state valutate le dimensioni dell'infarto, la sopravvivenza cellulare e la funzione ventricolare sinistra (compresa l'ecocardiografia, i parametri emodinamici e l'elettrofisiologia). Questo studio aiuta a stabilire un modello stabile preclinico di grandi animali HF per il trattamento delle cellule staminali.
Introduzione
Le malattie cardiovascolari, in particolare la malattia coronarica (CAD), rimangono la principale causa di morbilità e mortalità a Hong Kong e nel mondo1. A Hong Kong, un aumento del 26% dal 2012 al 2017 del numero di pazienti CAD trattati sotto l'Autorità Ospedaliera èstato proiettato 2. Tra tutti i CAD, l'infarto miocardico acuto (MI) è una delle principali cause di morte e complicazioni successive, come l'insufficienza cardiaca (HF). Questi contribuiscono a notevoli oneri medici, sociali e finanziari. Nei pazienti con MI, la terapia trombolitica o l'intervento coronarica percutaneo primario (PCI) è una terapia efficace per preservare la vita, ma queste terapie possono solo ridurre la perdita di cardiomiocito (CM) durante l'MI. I trattamenti disponibili non sono in grado di ricostituire la perdita permanente di CMs, che porta alla fibrosi cardiaca, al rimodellamento miocardico, all'aritmia cardiaca e infine all'insufficienza cardiaca. Il tasso di mortalità a 1 anno dopo l'MI è di circa il 7% con oltre il 20% di pazienti che sviluppano HF3. Nei pazienti con HF in fase finale, il trapianto di cuore è l'unica terapia efficace disponibile, ma è limitata dalla carenza di organi disponibili. Sono necessarie nuove terapie per invertire lo sviluppo di HF post-MI. Di conseguenza, la terapia cellulare è considerata un approccio interessante per riparare le C compromesse e migliorare la funzione ventricolare sinistra (LV) in HF dopo MI. I nostri studi precedenti hanno scoperto che il trapianto di cellule staminali è utile per il miglioramento della funzione cardiaca dopo il trapianto intramiocardiale diretto in piccoli modelli animali di MI4,5. Sono quindi necessari protocolli HF di grandi animali preclinici standardizzati per testare ulteriormente l'efficacia e la sicurezza del trapianto di cellule staminali prima dell'uso clinico.
Negli ultimi decenni è stato assistito all'uso diffuso di suini nella ricerca cardiovascolare per la terapia con cellule staminali. I maiali HF sono un modello promettente di ricerca traslazione a causa della loro somiglianza con gli esseri umani in termini di dimensioni cardiache, peso, ritmo, funzione e anatomia coronarica. Inoltre, i modelli HF di porcina possono imitare i pazienti post-MI HF in termini di metabolismo CM, proprietà elettrofisiologiche e cambiamenti neuroendocrini in condizioni ischemiche6. Il protocollo qui presentato utilizza un modello HF suini standardizzato, che impiega un'occlusione a palloncino coronarica a torso chiuso dell'arteria circonflessa sinistra (LCX) seguita da un ritmo rapido indotto dall'impianto del pacemaker. Lo studio ottimizza anche il percorso della somministrazione intramiocardiale delle cellule staminali per il trattamento dell'HF post-MI. Lo scopo è quello di produrre un modello animale porcina di infarto miocardico cronico che può essere utilizzato per sviluppare trattamenti che sono clinicamente rilevanti per i pazienti con CAD grave.
Protocollo
Tutti gli esperimenti sugli animali sono stati eseguiti in conformità con la Guida per la cura e l'uso degli animali da laboratorio pubblicata dai National Institutes of Health e dai regolamenti dell'Università di Hong Kong, e il protocollo è stato approvato dal Comitato sull'uso degli animali vivi nell'insegnamento e nella ricerca (CULTAR) presso l'Università di Hong Kong.
NOTA: per questo studio sono stati utilizzati suini da allevamento di sesso femminile del peso di 35-40 kg (9-12 mesi). Il diagramma di flusso di questo esperimento è illustrato nella Figura 1.
1. Procedure chirurgiche
- Anestesia e preparazione dell'animale
- Velocizza gli animali per 12 h e soggetti a privazione d'acqua per 4 h prima dell'esperimento.
- Anestesizzare i suini attraverso un'iniezione intramuscolare di tiletamine-zolezepam (2-7 mg/kg) e xylazina (0,5-1 mg/kg) preparati in 20 mL di salina normale. Monitorare i riflessi palpebri dell'animale fino a quando non sono assenti.
- Togliere i capelli del maiale e sterilizzare la pelle al collo e all'inguine per le sezioni 1.3-1.5. Disinfettare l'area di funzionamento 3x con 70% di etanolo e betadina.
- Inserire un tubo endotracheale da 7 mm nella trachea dei suri e inserire un ago di 22 G nell'orecchio vena.
- Spostare il maiale sul tavolo operatorio e posizionarlo in posizione supina. Collegare il tubo endotracheale al respiratore e ventilare meccanicamente (rapporto tempospiratorio/spiratorio 1:2) l'animale con isoflurane (1,5%-2,0% di inalazione) e ossigeno (0,5-1,5 L/min inalazione).
- Monitorare l'elettrocardiogramma superficiale e la pressione sanguigna e monitorare continuamente la frequenza cardiaca, il ritmo cardiaco e la pressione arteriosa attraverso sistemi di registrazione elettrofisiologia.
- Ecocardiografia
- Spostare il maiale nella posizione del decubito laterale sinistro e fissare sul tavolo.
- Mettere la sonda sulla regione pericardica ed eseguire l'ecocardiografia seriale, compresa l'imaging in modalità 2D e M, utilizzando un sistema ecocardiografico ad alta risoluzione e un trasduttore da 3-9 MHz alla linea di base, prima del trapianto di cellule e 8 settimane dopo il trapianto di cellule (Figura supplementare 1).
- Analizzare tutte le immagini ottenute utilizzando un software commerciale. Calcolare la dimensione diastolica finale LV (LVEDD), la dimensione end-sintolica LV (LVESD), il volume diastolico finale LV (LVEDV), il volume distolico finale LV (LVESV), la frazione di espulsione LV (LVEF) e lo spessore della parete dopo che le immagini ecocardiografiche standard vengono ottenute dalla vista parasternale dell'asse lungo.
NOTA: tutte le analisi off-line sono state condotte da un altro operatore indipendente utilizzando una workstation per computer. La variabilità delle misurazioni tra diversi osservatori era del 4% basata su 20 immagini casuali ripetute. Tutte le misurazioni ecocardiografiche sono state eseguite in conformità con le raccomandazioni dell'American Society of Echocardiography.
- Impianto pacemaker
- Spostare il maiale in posizione supina e fissare gli arti del maiale sul tavolo con le cinghie.
- Individuare l'arteria carotide destra e la vena giugulare nel triangolo carotide (dietro lo sternocleidomastoide e circondato dallo stylohyoide, il muscolo digastrico e l'omoidoide) e isolare l'arteria carotide destra e la vena giugulare con forceppo emostatico in condizioni sterili (Figura supplementare 2). Ligate l'estremità distale dell'arteria carotide destra e vena giugulare. Cucire i due muscoli con 2-0 Vicryl.
- Cannulate la vena giugulare destra con un angiocath e inserire un pacemaker piombo al ventricolo destro sotto guida a raggi X (Figura 2).
- Isolare lo sternocleidomastoid e il muscolo scaleno anteriore utilizzando le forceccie. Impiantare un pacemaker tra i due muscoli e cucire i due muscoli con seta 2-0. Collegare il pacemaker al piombo.
- Riprogrammare il pacemaker per eseguire il backup della modalità VVI (35 bpm) da un generatore di pacemaker dopo il trapianto.
- Applicare una stimolazione ventricolare rapida (150 battiti/min) per indurre HF da un generatore di pacemaker 4 settimane dopo l'induzione mi. Quindi impostare il pacemaker di nuovo alla modalità VVI di backup a 8 settimane.
- Analisi del ciclo del volume di pressione invasiva
NOTA: Eseguire una valutazione emodinamica invasiva al basale, prima del trapianto di cellule e 8 settimane dopo il trapianto di cellule per valutare i cambiamenti nella funzione LV.- Isolare l'arteria femorale destra e la vena femorale nel triangolo femorale (circondato dal legamento inguinale, dal muscolo sartorio e dal muscolo adduttore longus) (Figura supplementare2).
- Cannulate l'arteria femorale destra con un angiocath e inserire un filo guida nell'arteria attraverso l'angiocath. Rimuovere l'angiocata e puònulate una fasa 9F nell'arteria sotto la guida del filo guida. Rimuovere il filo guida.
- Cannulate la vena femorale destra con una mannaia 12F come descritto al punto 1.4.2. Inserire un catetere a palloncino dalla fosera 12F posizionata nella vena cava inferiore (IVC) sotto la guida a raggi X.
- Calibrare un catetere a volume di pressione (PV) da 7 Fr in salina isotonica con un processore di segnale fotovoltaico.
- Inserire il catetere fotovoltaico nell'apice LV dalla fosera 9F posizionata sotto la guida a raggi X. Sospendere la ventilazione e misurare la derivata a pressione massima positiva ventricolare sinistra (dP/dt), pressione end-sitolica (ESP) e pressioni end-diastolica (EDP) con il processore del segnale fotovoltaico.
- Misurare la relazione pressione-volume sistolica finale (ESPVR) da parte del processore del segnale PV durante l'occlusione dell'IVC.
- Riavviare la ventilazione al termine della procedura.
- Induzione di MI
- Somministrare per via endovenosa amiodarone (5 mg/kg per via endovenosa sopra 1 h) e lidocaina (1,5 mg/kg di bolo endovenoso) all'animale prima dell'induzione di MI per prevenire aritmie ventricolari.
- Cannulate l'arteria carotide destra con una mannaia 8F come indicato al punto 1.4.3.
- Eseguire l'angiografia coronarica attraverso un catetere guida over-the-wire 6F JR4 tramite la foca posizionata guidata da apparecchiature standard di fluoroscopia del braccio C.
- Occlude l'arteria coronaria circonflessa sinistra (LCX) distale al primo ramo marginale ottuso con angioplastica coronarica transluminale percutanea (PTCA) dilatazione a palloncino inflazione sotto la guida a raggi X (Figura 2).
- Iniettare 1 mL di microsfere di spugna da 700 m mescolate con 3 mL di salina preparate in una siringa da 10 mL attraverso il catetere a palloncino per bloccare l'LCX, quindi sgonfiare il palloncino ed eseguire un angiogramma per confermare l'occlusione.
- Ripetere la procedura di iniezione per ottenere un blocco completo riuscito.
- Monitorare la frequenza cardiaca e il ritmo degli animali per rilevare le aritmie cardiache. Se si è verificato una fibrillazione ventricolare, utilizzare un defibrillatore bifasico esterno per ristabilire un ritmo del seno utilizzando shock 150-300 J.
- Iniezione di cellule staminali
- Assegnare casualmente tutti gli animali con notevole compromissione della funzione cardiaca (LVEF < 40% a 8 settimane dopo l'induzione di MI) a due gruppi diversi: uno che riceverà la somministrazione intramiocardica di 2 x 108 cellule staminali pluripotenti indotte dall'uomo (hiPSC-MSC), e l'altro che non riceverà hiPSC-MSC.
- Preparare l'hiPSC-MSCs in 2 mL di salina normale per il trapianto intramiocardiale. Prima del trapianto di hiPSC-MSCs intramiocardiale, ripetere l'anestesia e i passaggi di preparazione degli animali menzionati nella sezione 1.1, questa volta sterilizzando 10 cm intorno all'area di battito dell'apice. Eseguire la toracotomia sinistra nello spazio intercostale 4-5 con un retrattore. Eseguire pericardiotomia per esporre la parete laterale infarto.
NOTA: La lunghezza dell'incisione era di 10-12 cm. - Utilizzare 5-8 iniezioni intramiocardali (0,3 mL per iniezione) intorno all'area infartata per somministrare il mezzo dicoltura( Tabella dei materiali ) a un gruppo di animali o 2 x 108 hiPSC-MSC all'altro gruppo(Figura 3). Evitare con attenzione qualsiasi danno alle arterie coronarie per ridurre il rischio di emorragia.
- Chiudere lo spazio intercostale con filo di ferro e chiudere lo strato muscolare con seta 2-0. Cucire il tessuto sottocutaneo e la pelle con 2-0 vicryl.
- Stimolazione elettrica programmata Intracardiac
- Eseguire la stimolazione elettrica programmata utilizzando uno stimolatore programmabile per valutare l'indubilità della tachyarrhythmia ventricolare (VT) dopo la terapia di trapianto cellulare.
- Inserire un catetere elettrofisiologico 6F nell'apice ventricolare destro attraverso la vena femorale prima di sacrificare tutti gli animali.
- Visualizzare le registrazioni intratracardiac con l'elettrocardiogramma superficiale I, II e III sul sistema di registrazione elettrofisiologica ad una velocità di 200 mm/s. Fornire una larghezza di impulso di 2 ms a 2x la soglia diastolica utilizzando uno stimolatore.
- Consegnare un treno di stimolazione di otto stimoli (S1) a due lunghezze del ciclo di azionamento (200 ms e 300 ms), seguito da uno (S2) o due (S2 e S3) stimoli extra prematuri.
- Abbreviare in sequenza gli intervalli di accoppiamento fino a quando non viene indotto un periodo refrattario efficace ventricolare o aritmia. Si noti la presenza di VT sostenuto inducibile (>10 s).
2. Protocollo postoperatorio
- Medicina postoperatoria
- Eseguire terapie farmacologiche convenzionali per HF. In breve, somministrare per via orale metoprololo succinato (25 mg) e ramiprile (2.5 mg) a tutti gli animali al giorno.
- Somministrare intramuscolare enrofloxacina (5 mg/kg) e buprenorfina (0,01 mg/kg) a tutti gli animali al giorno per 1 settimana dopo l'intervento chirurgico per prevenire l'infezione e alleviare il dolore.
- Per ridurre al minimo il rigetto immunologico, somministrare per via orale uno steroide (40 mg/giorno per via orale) e la ciclosporina (200 mg/giorno per via orale) a tutti gli animali da 3 giorni prima del trapianto di cellule a 8 settimane dopo.
- Valutazione delle dimensioni infarto
- Eutanasia gli animali da un sovradosaggio di dorminale (sodio pentobarbitale, 100 mg/kg, IV) alla fine dell'esperimento.
- Apri il petto e raccogli il cuore. Sciacquare il cuore in 0,9% salina.
- Sezione seriale campioni di tessuto LV con un bisturi a spessori di 1 cm nella direzione trasversale LV.
- Selezionare parti delle fette che contengono il miocardio infarto per misurare lo spessore della parete e l'area infarta.
- Catturare l'immagine di queste sezioni e analizzare quantitativamente lo spessore della parete e l'area infarta utilizzando un software di analisi delle immagini commerciali.
- Fissare il tessuto in formalina 10% a 4 gradi centigradi per un mese. Incorporare il tessuto all'interno, adiacente e remoto nei siti infarti (pezzi di 1 cm2) in paraffina. Sezione in 5 fette di zm utilizzando un microtomo per l'esame istologico.
- Sopravvivenza cellulare
- Rilevare l'innesto delle cellule trapiantate mediante colorazione immunohistochimica con antigene nucleare anti-umano (HNA) secondo il protocollo fornito dal produttore.
- Catturare l'immagine in tre diverse sezioni in cinque campi casuali in ogni animale e analizzare quantitativamente le cellule positive nella zona peri-infarta.
NOTA: il sistema di acquisizione immagini e il software di analisi delle immagini sono stati utilizzati per acquisire e analizzare le immagini delle sezioni cardiache.
Risultati
Mortalità
In questo studio sono stati utilizzati 24 suini. Tre di loro sono morti durante l'induzione mi a causa di VT sostenuta. Un animale è morto nell'intervento a cuore aperto per iniezione cellulare a causa di sanguinamento della ferita. Due animali sono morti a causa di una grave infezione. Due animali sono stati esclusi a causa di una leggera riduzione del MEF (riduzione LVEF > 40% del basale). Di conseguenza, 16 animali hanno completato l'intero protocollo di studio.
Funzione cardiaca e ristrutturazione
L'esame ecocardiografico seriale ha mostrato che LVEF è diminuito significativamente da 68,23 , 3,52% al basale a 39,37 , 3,22%. LVEDD è aumentato in modo significativo da 3,6 a 0,5 a 4,8 x 0,4 e LVESD è aumentato significativamente da 2,5 a 0,3 a 3,9 x 0,4(Figura 4A )a8 settimane dopo l'induzione di MI. LVEF e LVESD sono notevolmente migliorati a 52,9 , rispettivamente 4,27% e 3,3 , 0,3 nel gruppo hiPSC-MSCs 8 settimane dopo il trapianto, rispetto allo stato MI(Figura 4A).
L'espp/dt e l'ESPVR sono diminuiti in modo significativo da 1.325 x 63 mmHg/s e 3,9 , 0,4 al basale a 978 x 45 mmHg/s e 1,8 x 0,2 a 8 settimane dopo l'induzione di MI. La somministrazione intramiocardiale di hiPSC-MSCs ha aumentato il valore di 1.127,4 mmHg/s e 2,6 mmHg/s e 2,6 x 0,3 a 8 settimane dopo il trapianto di iPSC-MSCs, rispetto allo stato MI(Figura 4B).
Spessore della parete infarto
Lo spessore medio della parete infarto LV è stato misurato da 5-7 campioni di sezione di spessore seriale di 1 cm in ogni animale (Figura 5). La percentuale di infarto LV è stata del 16 %
Sopravvivenza cellulare dopo il trapianto
Non c'era sopravvivenza cellulare intorno al sito di iniezione nell'area dell'infarto 8 settimane dopo il trapianto, ma un piccolo numero di hiPSC-MSC di sopravvivenza erano visibili nell'area peri-infarct (Figura 6).
Aritmia ventricolare inducibile
L'incidenza di tachyarrhythmias ventricolari sostenuti inducibili potrebbe essere facilmente aumentata negli animali con HF (10% al basale contro 75% 8 settimane dopo l'induzione di MI). Il trapianto di hiPSC-MSCs non modifica in modo significativo il substrato miocardiale sottostante per ridurre la suscettibilità a VT (62,5% nel gruppo hiPSC-MSCs 8 settimane dopo l'amministrazione intramiocardiale di hiPSC-MSCs, Figura 7).
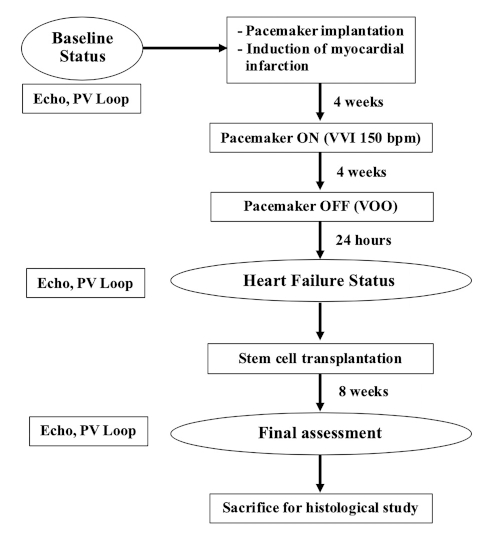
Figura 1: diagramma di flusso dell'esperimento. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
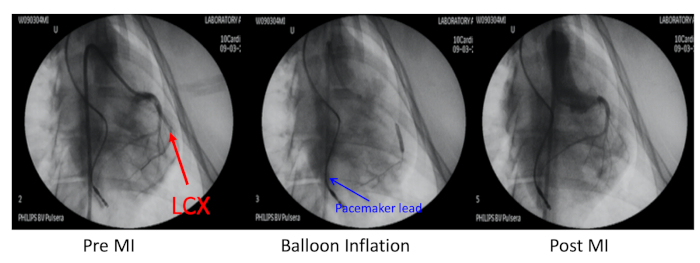
Figura 2: Modello porcina di infarto miocardico. Il modello porcina dell'infarto miocardico (MI) è stato indotto dall'embolizzazione dell'arteria coronaria circonflessa sinistra (LCX, freccia rossa) distale al primo ramo marginale ottuso. Questa arteria coronaria è stata occlusa con l'inflazione dei palloncini e un'iniezione di microsfere di 700 m. L'angiografia coronarica pre-MI, l'inflazione dei palloncini e il post-MI sono stati eseguiti attraverso un catetere guida 6F JR4 attraverso l'arteria carotidea destra. Il piombo del pacemaker è stato inserito nella parete del ventricolo destro (freccia blu). Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
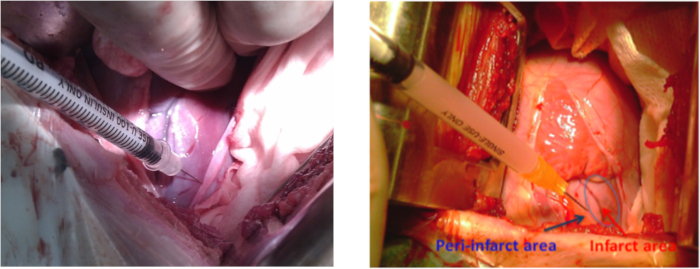
Figura 3: Trapianto di cellule in un modello di sucina di MI. Siti di iniezione cellulare nella parete laterale intorno all'area infarta del ventricolo sinistro durante la toracotomia sinistra. La freccia blu mostra l'area peri-infarta e la freccia rossa mostra l'area infarta. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
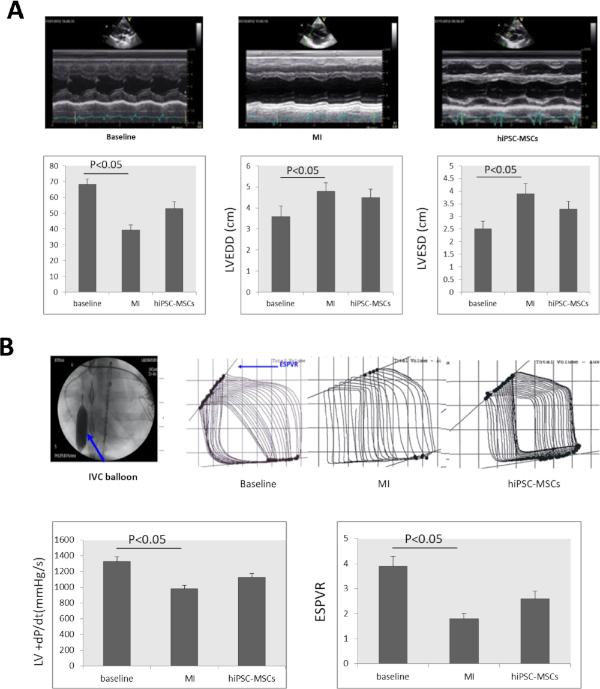
Figura 4: La funzione del cuore cambia dopo MI. (A) Un'immagine ecocardiogramma in modalità LV M al basale, MI e trapianto di cellule. LVEF, LVEDD, LVESD è diminuito significativamente 8 settimane dopo l'induzione di MI e significativamente aumentato nel gruppo hiPSC-MSCs 8 settimane dopo il trapianto di cellule. (B) Per valutare la funzione cardiaca dei suini con insufficienza cardiaca, il valore di dP/dt e l'ESPVR sono stati misurati con un processore di segnale PV. La vena cava inferiore (IVC) è stata occlusa dall'inflazione del palloncino (freccia blu) durante la valutazione ESPVR. Sia l'ESPVR che l'ESPVR sono diminuiti in modo significativo dopo l'induzione dell'MI, per poi aumentare significativamente nei gruppi hiPSC-MSC 8 settimane dopo il trapianto. ANOVA seguito da Student-Newman-Keuls post-test ad hoc (SPSS, versione 14) è stato utilizzato con il valore di 0,05 dollari. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: L'area infarta cambia dopo MI. Campioni di direzione trasversale LV sezionati a spessori di 1 cm in ogni cuore contenente miocardio infarto. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
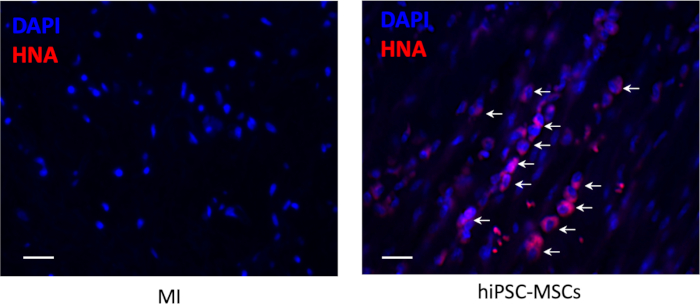
Figura 6: Sopravvivenza cellulare dopo il trapianto. L'innesto dell'hiPSC-MSCs trapiantato è stato rilevato da una colorazione immunohistochimica per l'antigene nucleare antigene antigene nucleare (colore rosso). Barra della scala di 100 m. Le frecce rappresentano celle positive. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: L'incidenza di tachyarrhythmias ventricolari sostenute. (A) Tachyarrhythmias ventricolare (VT, freccia rossa) indotta da in vivo intracardiac stimolazione elettrica programmata. (B) L'incidenza di VT è aumentata significativamente dopo l'induzione mi. Il trapianto di cellule non ha aumentato l'incidenza di TT. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.

Figura supplementare 1: acquisizione di ecocardiogramma. Il pannello sinistro mostra la posizione dell'animale. Il pannello destro mostra la posizione della sonda. Il pannello centrale mostra l'immagine ecocardiografica sotto questa posizione. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
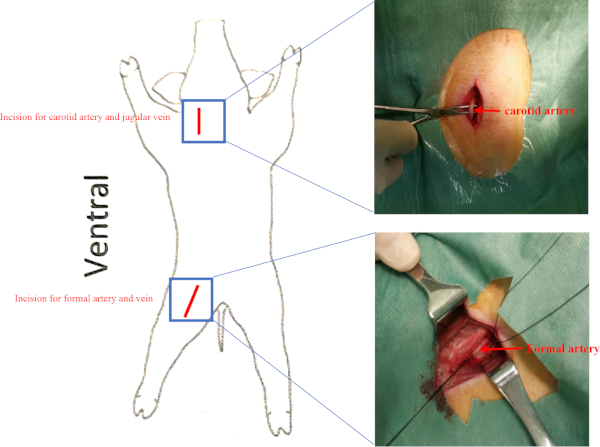
Figura supplementare 2: Posizione delle navi. I maiali sono stati collocati in posizione supina. Le incisioni per l'arteria carotidea e l'arteria femorale sono presentate come una linea rossa. La vena giugulare e la vena femorale erano rispettivamente sotto l'arteria carotidea e l'arteria femorale. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
I modelli animali standard sono di fondamentale importanza per comprendere la fisiofisiologia e i meccanismi delle malattie e testare nuove terapie. Il nostro protocollo stabilisce un modello porcino di HF indotto dal blocco dell'arteria circumflex sinistra e dal rapido ritmo. Otto settimane dopo l'induzione di MI, gli animali hanno sviluppato una compromissione significativa di LVEF, LVEDD, LVESD, .dP/dt ed ESPVR. Questo protocollo testa anche il metodo di somministrazione della terapia con cellule staminali per la rigenerazione cardiaca mediante iniezione intramiocardica. Vengono valutate le dimensioni dell'infarto e la funzione sistolica e diastolica cardiaca. Questo studio aiuta a stabilire un modello di HF animale preclinico stabile e riproducibile per il trattamento delle cellule staminali, che è simile ai casi clinici.
Il blocco LCX e il ritmo rapido sono stati ampiamente utilizzati per creare modelli animali di HF nei nostri studi precedenti7,8. La LCX distale al primo ramo marginale ottuso è stata occlusa, seguita da 4 settimane di rapido ritmo ventricolare destro. L'ischemia del miocardio provoca la perdita di cardiomiociti durante l'MI, che causa fibrosi cardiaca, rimodellamento miocardica e aritmia cardiaca. Il ritmo ventricolare si traduce in una significativa dilatazione LV, compromissione non ischemica della contrattilità ventricolare sinistra e grave disfunzione LV9,10. Durate più lunghe di ischemia e ritmo rapido producono un modello sperimentale HF sperimentale progressivo per la ricerca trasslazione. Studi precedenti hanno stabilito modelli di insufficienza cardiaca inducendo MI10. Tuttavia, la mortalità di MI grave era più alta e la riduzione LVEF di MI era instabile. Pertanto, applichiamo un rapido ritmo ventricolare destro dopo il blocco LCX per indurre una significativa compromissione della funzione cardiaca. Come si può vedere nei nostri studi precedenti, il modello qui presentato produce dimensioni infarte stabili, e il LVEF di questo modello è ridotto ad almeno al di sotto del 40% normale6,7,8. Se ci fossero state meno infezioni e sanguinamento, il nostro tasso di successo del modello avrebbe potuto essere di circa l'80%.
Uno dei principali ostacoli all'applicazione clinica delle cellule staminali è la loro scarsa sopravvivenza e l'innesto dopo il trapianto. Recenti studi clinici e meta-analisi11,12,13,14,15 nonsono riusciti a dimostrare alcun miglioramento costante nella funzione LV o dimensione infarto a seguito di tale terapia. Uno dei motivi potenziali è il basso tasso di sopravvivenza delle cellule trapiantate. Scoprire un metodo di somministrazione ottimale svolge un ruolo fondamentale nelle terapie con cellule staminali. Confrontando i tre metodi di trapianto cellulare, la somministrazione intramiocardia è più efficiente della somministrazione endovenosa ed endocarronaria a causa di una maggioreritenzione cellulare 16,17. Pertanto, in questo studio è stato selezionato un percorso di somministrazione intramiocardia per la consegna di iPSC-MSC. I risultati ecocardiografici e i risultati emodinamici invasivi hanno dimostrato che la somministrazione intramiocardiale di iPSC-MSCs ha migliorare la funzione LV dei suini HF post-MI 8 settimane dopo il trapianto di cellule. Nonostante la somministrazione di farmaci immunosoppressivi (uno steroide e ciclosporina), solo poche cellule trapiantate sono state rilevate nella zona peri-infarct. Nessuna cellula sopravvissuta è stata rilevata nell'area infartata intorno al sito iniettato. Studi precedenti hanno anche trovato una porzione estremamente piccola di cellule staminali nel miocardio infarto dopo il trapianto18,19,20,21. La perdita cellulare durante l'amministrazione intramiocardiale potrebbe influenzare i risultati sperimentali. Come migliorare i metodi di somministrazione e aumentare il tasso di residenza dovrebbe essere chiarito in studi futuri.
La sicurezza, in particolare l'aritmonesi, è un'altra preoccupazione vitale per quanto riguarda la pratica clinica con terapie basate sulle cellule. Il nostro recente studio ha dimostrato che la somministrazione intramiocardica di cellule staminali embrionali umane (hESC) derivate da CM ha aumentato l'incidenza di tachyarrhythmias ventricolari spontanea nonsostenuta 4. Nel nostro modello di porcina post-MI HF, l'incidenza della tachyarrhythmia ventricolare spontanea non sostenuta (tasso >180 bpm e >12 battiti) registrata dal monitoraggio della telemetria dal pacemaker è stata del 25% dopo l'induzione mi, ma il VT sostenuto potrebbe essere facilmente indotto (80%). In questo studio, l'incidenza della morte improvvisa rimane invariata con o senza somministrazione di hiPSC-MSC. Inoltre, il trapianto di hiPSC-MSCs non ha modificato il substrato miocardico sottostante per ridurre o aumentare la suscettibilità alle aritmie ventricolari. Questo risultato suggerisce che il modello HF cronico di grandi dimensioni potrebbe essere utilizzato per la valutazione della sicurezza cellulare.
Evitare l'infezione e l'emorragia sono di fondamentale importanza per la creazione di modelli animali di successo. Per ridurre il rischio di emorragia, si dovrebbe prestare attenzione per evitare danni alle arterie coronarie e alle vene cardiache. Poiché due animali sono morti di grave infezione, una strategia medica postoperativa appropriata ne trarrà beneficio. Qui, forniamo una strategia medica postoperatoria come di seguito: Intramuscularly amministrare enrofloxacina (7.5 mg/kg, SID) e buprenorfina (0,02 mg/kg, BID) combinati con somministrazione orale Amoxycillin/Acido Clavulanico (12.5mg/kg, SID) e Carprofen (2 mg/kg, SID) a tutti gli animali per 1 settimana dopo l'intervento chirurgico per prevenire l'infezione e alleviare il dolore.
In sintesi, l'attuale metodo fornisce un modello animale di grande insufficienza cardiaca stabile e riproducibile clinicamente rilevante per le terapie basate sulle cellule.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori riconoscono Alfreda e Kung Tak Chung per il loro eccellente supporto tecnico durante gli esperimenti sugli animali.
Materiali
| Name | Company | Catalog Number | Comments |
| Amiodarone | Mylan | - | - |
| Anaesthetic machines and respirator | Drager | Fabius plus XL | - |
| Angiocath | Becton Dickinson | 381147 | - |
| Anti-human nuclear antigen | abcam | ab19118 | - |
| Axio Plus image capturing system | Zeiss | Axioskop 2 PLUS | Axioskop 2 plus |
| AxioVision Rel. 4.5 software | Zeiss | - | - |
| Baytril | Bayer | - | enrofloxacin |
| Betadine | Mundipharma | - | - |
| CardioLab Electrophysiology Recording Systems | GE Healthcare | G220f | - |
| Culture media | MesenCult | 05420 | - |
| Cyclosporine | Novartis | - | - |
| Defibrillator | GE Healthcare | CardioServ | - |
| Dorminal | TEVA | - | - |
| Echocardiographic system | GE Vingmed | Vivid i | - |
| EchoPac software | GE Vingmed | - | - |
| Electrophysiological catheter | Cordis Corp | - | - |
| Embozene Microsphere | Boston Scientific | 17020-S1 | 700 μm |
| Endotracheal tube | Vet Care | VCPET70PCW | Size 7 |
| Ethanol | VWR chemicals | 20821.33 | - |
| Formalin | Sigma | HT501320 | 10% |
| IVC balloon Dilatation Catheter | Boston Scientific | 3917112041 | Mustang |
| JR4 guiding catheter | Cordis Corp | 67208200 | 6F |
| Lidocaine | Quala | - | - |
| Mersilk | Ethicon | W584 | 2-0 |
| Metoprolol succinate | Wockhardt | - | - |
| Microtome | Leica | RM2125RT | - |
| Mobile C arm fluoroscopy equipment | GE Healthcare | OEC 9900 Elite | - |
| Pacemaker | St Jude Medical | PM1272 | Assurity MRI pacemaker |
| Pacemaker generator | St Jude Medical | Merlln model 3330 | - |
| Pressure-volume catheter | CD Leycom | CA-71103-PL | 7F |
| Pressure–volume signal processor | CD Leycom | SIGMA-M | - |
| Programmable Stimulator | Medtronic Inc | 5328 | - |
| PTCA Dilatation balloon Catheter | Boston Scientific | H7493919120250 | MAVERICK over the wire |
| Ramipril | TEVA | - | - |
| Sheath introducer | Cordis Corp | 504608X | 8F, 9F, 12F |
| Steroid | Versus Arthritis | - | - |
| Temgesic | Nindivior | - | buprenorphine |
| Venous indwelling needle | TERUMO | SR+OX2225C | 22G |
| Vicryl | Ethicon | VCP320H | 2-0 |
| Xylazine | Alfasan International B.V. | - | - |
| Zoletil | Virbac New Zealand Limited | - | tiletamine+zolezepam |
Riferimenti
- Mozaffarian, D., et al. Heart disease and stroke statistics-2015 update: a report from the American Heart Association. Circulation. 131, e29 (2015).
- Hospital Authority. . Hospital Authority Statistical Report 2013. , (2013).
- Cung, T. T., et al. Cyclosporine before PCI in Patients with Acute Myocardial Infarction. The New England Journal of Medicine. 373 (11), 1021-1031 (2015).
- Liao, S. Y., et al. Proarrhythmic risk of embryonic stem cell-derived cardiomyocyte transplantation in infarcted myocardium. Heart Rhythm. 7, 1852-1859 (2010).
- Liao, S. Y., et al. Overexpression of Kir2.1 channel in embryonic stem cell-derived cardiomyocytes attenuates posttransplantation proarrhythmic risk in myocardial infarction. Heart Rhythm. 10, 273-282 (2013).
- Liu, Y., et al. Thoracic spinal cord stimulation improves cardiac contractile function and myocardial oxygen consumption in a porcine model of ischemic heart failure. Journal of Cardiovascular Electrophysiology. 23, 534-540 (2012).
- Liao, S. Y., et al. Improvement of Myocardial Function Following Catheter-Based Renal Denervation in Heart Failure. JACC: Basic to Translational Science. 2 (3), 270-281 (2017).
- Liao, S. Y., et al. Remodelling of cardiac sympathetic re-innervation with thoracic spinal cord stimulation improves left ventricular function in a porcine model of heart failure. Europace. 17 (12), 1875-1883 (2015).
- Daehnert, I., Rotzsch, C., Wiener, M., Schneider, P. Rapid right ventricular pacing is an alternative to adenosine in catheter interventional procedures for congenital heart disease. Heart. 90 (9), 1047-1050 (2004).
- Hála, P., et al. Tachycardia-Induced Cardiomyopathy as a Chronic Heart Failure Model in Swine. Journal of Visualized Experiments. (132), e57030 (2018).
- Santoso, T., et al. Endomyocardial implantation of autologous bone marrow mononuclear cells in advanced ischemic heart failure: a randomized placebo-controlled trial (END-HF). Journal of Cardiovascular Translational Research. 7, 545-552 (2014).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network. Effect of intracoronary delivery of autologous bone marrow mononuclear cells 2 to 3 weeks following acute myocardial infarction on left ventricular function: the LateTIME randomized trial. Journal of the American Medical Association. 306, 2110-2119 (2011).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network (CCTRN). Effect of the use and timing of bone marrow mononuclear cell delivery on left ventricular function after acute myocardial infarction: the TIME randomized trial. Journal of the American Medical Association. 308, 2380-2389 (2012).
- de Jong, R., Houtgraaf, J. H., Samiei, S., Boersma, E., Duckers, H. J. Intracoronary stem cell infusion after myocardial infarction. A meta-analysis and update on clinical trials. Circulation: Cardiovascular Interventions. 7, 156-167 (2014).
- Nowbar, A. N., et al. DAMASCENE writing group. Discrepancies in autologous bone marrow stem cell trials and enhancement of ejection fraction (DAMASCENE): weighted regression and meta-analysis. British Medical Journal. 348, g2688 (2014).
- Kanelidis, A. J., Premer, C., Lopez, J., Balkan, W., Hare, J. M. Route of Delivery Modulates the Efficacy of Mesenchymal Stem Cell Therapy for Myocardial Infarction: A Meta-Analysis of Preclinical Studies and Clinical Trials. Circulation Research. 120 (7), 1139-1150 (2017).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112 (9 Suppl), I150-I156 (2005).
- Hu, X., et al. A Large-Scale Investigation of Hypoxia-Preconditioned Allogeneic Mesenchymal Stem Cells for Myocardial Repair in Nonhuman Primates: Paracrine Activity Without Remuscularization. Circulation Research. 118, 970-983 (2016).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Martens, A., et al. Substantial early loss of induced pluripotent stem cells following transplantation in myocardial infarction. Artificial Organs. 38, 978-984 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538, 388-391 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon