Method Article
Создание свиной модели пост-миокарда инфаркт сердечной недостаточности для лечения стволовых клеток
В этой статье
Резюме
Мы стремились установить свиную модель сердечной недостаточности, вызванной блокированием левой окружной артерии и быстрыми темпами, чтобы проверить эффект и безопасность внутримыокарда администрирования стволовых клеток для клеточной терапии.
Аннотация
Хотя были достигнуты успехи в лечении сердечной недостаточности (HF) после инфаркта миокарда (MI), HF после MI остается одной из основных причин смертности и заболеваемости во всем мире. Клеточной терапии для сердечного ремонта и улучшения функции левого желудочка после ИМ привлекли значительное внимание. Соответственно, безопасность и эффективность этих клеточных трансплантаций должны быть проверены в доклинической модели крупных животных HF до клинического использования. Свиньи широко используются для исследования сердечно-сосудистых заболеваний из-за их сходства с людьми с точки зрения размера сердца и коронарной анатомии. Поэтому мы стремились представить эффективный протокол для создания свиной хронической модели HF с использованием закрытого грудного коронарного шара окклюзии левой окружной артерии (LCX), а затем быстрый желудочковый темп индуцированных с имплантацией кардиостимулятора. Восемь недель спустя стволовые клетки вводились путем инъекций внутримиокарда в пери-инфарктной области. Затем оценивались размер инфаркта, выживаемость клеток и функция левого желудочка (включая эхокардиографию, гемодинамические параметры и электрофизиологию). Это исследование помогает создать стабильную доклинциалистическую модель HF крупного животного для лечения стволовыми клетками.
Введение
Сердечно-сосудистые заболевания, ишемическая болезнь сердца (КАД), в частности, остаются основной причиной заболеваемости и смертности в Гонконге и во всеммире 1. В Гонконге, 26% увеличение с 2012 по 2017 год число пациентов CAD лечение в рамках больницы администрации прогнозируется2. Среди всех CADs, острый инфаркт миокарда (MI) является основной причиной смерти и последующих осложнений, таких как сердечная недостаточность (HF). Они способствуют значительному медицинскому, социальному и финансовому бремени. У пациентов с ИМ тромболитическая терапия или первичное перкутанное коронарное вмешательство (PCI) является эффективной терапией в сохранении жизни, но эти методы лечения могут только уменьшить потерю кардиомиоцитов (СМ) во время ИМ. Доступные методы лечения не в состоянии пополнить постоянную потерю СМ, что приводит к сердечному фиброзу, миокардам, сердечной аритмии и, в конечном итоге, сердечной недостаточности. Уровень смертности в 1-летний пост-MI составляет около 7% с более чем 20% пациентов, развивающихся HF3. У пациентов с HF на конечной стадии трансплантация сердца является единственной доступной эффективной терапией, но она ограничена нехваткой доступных органов. Новые методы лечения необходимы, чтобы обратить вспять развитие пост-MI HF. В результате, клеточной терапии считается привлекательным подходом для ремонта поврежденных CMs и улучшить функцию левого желудочка (LV) в HF после MI. Наши предыдущие исследования показали, трансплантации стволовых клеток, чтобы быть полезным для улучшения функции сердца после прямой трансплантации интрамиокарда в малых животных моделей MI4,5. Таким образом, стандартизированные доклинические протоколы HF крупных животных необходимы для дальнейшего тестирования эффективности и безопасности трансплантации стволовых клеток перед клиническим использованием.
Последние десятилетия стали свидетелями широкого использования свиней в сердечно-сосудистых исследований для терапии стволовыми клетками. HF свиней являются перспективной моделью трансляционных исследований из-за их сходства с людьми с точки зрения размера сердца, вес, ритм, функция, и анатомии коронарной артерии. Кроме того, свиные модели HF могут имитировать пост-MI HF пациентов с точки зрения метаболизма CM, электрофизиологические свойства, и нейроэндокринные изменения в ишемическихусловиях 6. Протокол, представленный здесь, использует такую стандартизированную модель свиньи HF, используя окклюзию коронарного шара закрытой грудной клетки левой окружной артерии (LCX), за которой следует быстрый темп, вызванный имплантацией кардиостимулятора. Исследование также оптимизирует маршрут внутримиокарда введения стволовых клеток для лечения пост-MI HF. Цель состоит в том, чтобы произвести свиной животных модель хронического инфаркта миокарда, которые могут быть использованы для разработки методов лечения, которые являются клинически актуальными для пациентов с тяжелой CAD.
протокол
Все эксперименты на животных проводились в соответствии с Руководством по уходу и использованию лабораторных животных, опубликованным Национальными институтами здравоохранения США и правилами Гонконгского университета, и протокол был одобрен Комитетом по использованию живых животных в обучении и исследованиях (CULTAR) в Университете Гонконга.
ПРИМЕЧАНИЕ: Для этого исследования были использованы самки сельскохозяйственных свиней весом 35-40 кг (9-12 месяцев). На рисунке 1 показана куча этого эксперимента.
1. Хирургические процедуры
- Анестезия и подготовка животного
- Быстрый животных в течение 12 ч и при условии лишения воды в течение 4 ч до эксперимента.
- Анестезия свиней путем внутримышечной инъекции плитки-золезепама (2-7 мг/кг) и ксилазина (0,5-1 мг/кг), приготовленного в 20 мл нормального солевого раствора. Следите за палебральными рефлексами животного до тех пор, пока они не будут отсутствовать.
- Удалите свиные волосы и стерилизовать кожу на шее и паху для разделов 1.3-1.5. Дезинфицировать зону операции 3x с 70% этанола и бетадина.
- Поместите 7 мм эндотрахеальной трубки в свиной трахеи и место 22 G венозной иглы в ухо вены.
- Перемести свинью на операционный стол и поместите в положение на спине. Подключите эндотрахеаленовую трубку к респиратору и механически проветрите (коэффициент времени дыхания/срока действия 1:2) животное с изофлураном (1,5%-2,0% вдыхания) и кислородом (0,5-1,5 л/мин).
- Мониторинг поверхностной электрокардиограммы и артериального давления, а также непрерывно контролировать пульс, сердечный ритм и артериальное кровяное давление с помощью электрофизиологических систем записи.
- Эхокардиография
- Перемести свинью в левое боковое положение декубита и зафикси на столе.
- Поместите зонд в перикардиалную область и выполните серийную эхокардиографию, включая 2D и M-режим изображения, используя эхокардиографическую систему высокого разрешения и трансдуцер 3-9 МГц на базовом уровне, до трансплантации клеток и через 8 недель после трансплантации клетки(дополнительный рисунок 1).
- Проанализируйте все полученные изображения с помощью коммерческого программного обеспечения. Рассчитайте энд-диастолическое измерение LV (LVEDD), LV энд-систолическое измерение (LVESD), LV энд-диастолический объем (LVEDV), LV энд-систолический объем (LVESV), LV фракции выброса (LVEF), и толщина стены после стандартных эхокардиографических изображений получены из парастерналальной длинной оси зрения.
ПРИМЕЧАНИЕ: Все офф-лайн анализы были проведены другим независимым оператором с помощью компьютерной рабочей станции. Вариативность измерений между различными наблюдателями составила 4% на основе 20 повторных случайных изображений. Все эхокардиографические измерения проводились в соответствии с рекомендациями Американского общества эхокардиографии.
- Имплантация кардиостимулятора
- Перемести свинью в положение на спине и зафиксив конечности свиньи на столе ремнями.
- Найдите правую соонную артерию и яремную вену в сонной артерии треугольника (за стерноклеидомастоидом и окруженный стилохоидом, дигастрической мышцей и омохиоидом) и изолируйте правую сонную артерию и яремную вену с гемостическими силами в стерильныхусловиях (дополнительный рисунок 2). Ligate дистальный конец правой сонной артерии и яремной вены. Sew две мышцы с 2-0 Vicryl.
- Cannulate правой яремной вены с ангиокатом и вставить кардиостимулятор привести к правому желудоку под рентгеновским руководством (Рисунок 2).
- Изолировать стерноклеидомастоид и передней шкалы мышц с помощью миппов. Имплантировать кардиостимулятор между двумя мышцами и шить две мышцы с 2-0 шелка. Подключите кардиостимулятор к свинцу.
- Перепрограммировать кардиостимулятор для резервного копирования VVI режиме (35 bpm) генератором кардиостимулятора после трансплантации.
- Нанесите быстрый желудочковый темп (150 ударов/мин), чтобы вызвать HF генератором кардиостимулятора через 4 недели после индукции MI. Затем установите кардиостимулятор обратно в резервный режим VVI на 8 недель.
- Инвазивный анализ цикла громкости давления
ПРИМЕЧАНИЕ: Выполните инвазивную гемодинамическую оценку на базовом уровне, до трансплантации клеток и через 8 недель после трансплантации клеток для оценки изменений в функции LV.- Изолировать правую бедренную артерию и бедренную вену в бедренной кости треугольника (окруженный паховой связки, мышцы сартория, и мышцы аддуктора longus) (Дополнительный рисунок 2).
- Cannulate правой бедренной артерии с ангиокат и место направляющий провод в артерию через ангиокат. Удалите ангиокат и cannulate 9F оболочки в артерию под руководством руководства. Удалите направляющий провод.
- Cannulate правой бедренной вены с 12F оболочки, как описано в шаге 1.4.2. Вставьте воздушный шар катетер из размещены 12F оболочки в нижней полой вены (IVC) под рентгеновским руководством.
- Калибруйте катетер 7 Fr-объем давления (PV) в изотоническом солевом растворе с процессором сигнала PV.
- Вставьте pv катетер в вершину LV из помещенной оболочки 9F под рентгеновским наведением. Приостановить вентиляцию и измерить левое желудочковое положительное давление производной (DP/dt), энд-систолическое давление (ESP), и энд-диастолическое давление (EDP) с процессором сигнала.
- Измерьте конец систолической связи давления и громкости (ESPVR) процессором сигнала П.В. во время окклюзии IVC.
- Перезапустить вентиляцию по завершения процедуры.
- Индукция MI
- Внутривенно вводят амиодарон (5 мг/кг внутривенно более 1 ч) и лидокаин (1,5 мг/кг внутривенного болюса) животному перед индукцией ИМ для предотвращения желудочковой аритмии.
- Cannulate правой сонной артерии с 8F оболочки, как упоминалось в шаге 1.4.3.
- Выполните коронарную ангиографию через катетер 6F JR4 с помощью помещенной оболочки, управляемой стандартным оборудованием флюороскопии руки C.
- Окклюде левой окружной коронарной артерии (LCX) дистал к первой тупой маргинальной ветви с перкутанной транслюминальной коронарной ангиопластики (PTCA) дилатации воздушный шар катетер инфляции под рентгеновским руководством (Рисунок 2).
- Ввись 1 мл 700 мкм губки микросферы смешивается с 3 мл солевого раствора, подготовленного в 10 мл шприца через воздушный шар катетер, чтобы заблокировать LCX, затем сдуть воздушный шар и выполнить ангиограмму, чтобы подтвердить окклюзии.
- Повторите процедуру инъекций для достижения успешной полной блокировки.
- Мониторинг сердечного ритма и ритма животных для обнаружения сердечной аритмии. Если фибрилляция желудочков произошла, используйте внешний, бифазный дефибриллятор, чтобы восстановить синусовый ритм с помощью 150-300 J потрясений.
- Инъекция стволовых клеток
- Случайным образом назначить всех животных с заметным нарушением функции сердца (LVEF Lt; 40% на 8 недель после индукции ИМ) в двух различных группах: одна, которая будет получать интрамиокарда администрации 2 х 108 человека индуцированной плюрипотентных стволовых клеток полученных мезенхимальных стволовых клеток (hiPSC-MSCs), а другой, который не будет получать hiPSC-MSCs.
- Подготовка hiPSC-MSCs в 2 мл нормального солевого раствора для интрамиокарда трансплантации. Перед трансплантацией интрамиокарда hiPSC-MSCs повторите анестезию и шаги по приготовлению животных, упомянутые в разделе 1.1, на этот раз стерилизовав 10 см вокруг верхней области удара. Выполните левую торакотомию в межреберном пространстве 4-5 с помощью ретрактора. Выполните перикардиотомию, чтобы разоблачить инфаркт боковой стенки.
ПРИМЕЧАНИЕ: Длина разреза составила 10-12 см. - Используйте 5-8 инъекций внутримиокарда (0,3 мл за инъекцию) вокруг инфоктуальнойTable of Materials области для управления культурой среды (Таблица материалов ) к одной группе животных или 2 х 108 hiPSC-MSCs к другой группе(рисунок 3). Тщательно избегайте каких-либо повреждений коронарных артерий, чтобы уменьшить риск кровоизлияния. any
- Закройте межреберное пространство железной проволокой и закройте мышечный слой 2-0 шелком. Sew подкожной ткани и кожи с 2-0 vicryl.
- Интракардиак запрограммирован электрической стимуляции
- Выполните запрограммированную электрическую стимуляцию с помощью программируемого стимулятора для оценки неодобряемости желудочковой тахиаритмии (VT) после трансплантационной терапии клеток.
- Вставьте электрофизиологический катетер 6F в правую желудочковой вершину через бедренную вену, прежде чем пожертвовать всеми животными.
- Отображение внутрикардных записей с помощью поверхностной электрокардиограммы приводит I, II и III к электрофизиологической системе записи со скоростью 200 мм/с. Доставка 2 мс шириной пульса в 2x диастолический порог с помощью стимулятора.
- Доставка ходить поезд из восьми стимулов (S1) на два диска длины цикла (200 мс и 300 мс), а затем один (S2) или два (S2 и S3) преждевременных дополнительных стимулов.
- Последовательно сокращать интервалы соединения до желудочковой эффективный огнеупорный период или аритмия индуцируется. Обратите внимание на наличие неодобовательного устойчивого VT (Nogt;10 s).
2. Послеоперационный протокол
- Послеоперационная медицина
- Выполните обычные фармакологические методы лечения HF. Короче говоря, устно управлять metoprolol succinate (25 мг) и рамиприл (2,5 мг) для всех животных ежедневно.
- Внутримышечно вводят энрофлоксацин (5 мг/кг) и бупренорфин (0,01 мг/кг) всем животным ежедневно в течение 1 недели после операции, чтобы предотвратить инфекцию и облегчить боль.
- Чтобы свести к минимуму иммунологическое отторжение, в устной форме вводят стероид (40 мг/день в устной форме) и циклоспорин (200 мг/день в устной форме) всем животным от 3 дней до трансплантации клеток до 8 недель после.
- Оценка размера инфаркта
- Усыплять животных передозировкой общежития (пентобарбитальный натрий, 100 мг/кг, IV) в конце эксперимента.
- Откройте грудь и соберите сердце. Промыть сердце в 0,9% солевого раствора.
- Серийно раздел LV образцы тканей со скальпелем толщиной 1 см в поперечном направлении LV.
- Выберите части ломтиков, которые содержат инфаркт миокарда для измерения толщины стены и области инфаркта.
- Захват изображения этих ломтиков и количественно анализировать толщину стены и области инфаркта с помощью коммерческого программного обеспечения анализа изображений.
- Исправить ткани в 10% формалин при 4 градусов по Цельсию в течение месяца. Встраивание ткани внутри, прилегающей и удаленной к участкам инфаркта (1см 2 штуки) в парафин. Раздел на 5 мкм ломтиками с использованием микротома для гистологического исследования.
- Выживание клеток
- Обнаружить присвещание пересаженных клеток иммуногистохимическим окрашивание анти-человеческим ядерным антигеном (HNA) в соответствии с протоколом, предоставленным производителем.
- Захват изображения в трех различных разделах на пяти случайных полях в каждом животном и количественно анализировать положительные клетки в пери-инфарктной зоне.
ПРИМЕЧАНИЕ: Система захвата изображений и программное обеспечение для анализа изображений были использованы для захвата и анализа изображений секций сердца.
Результаты
Смертности
Всего в исследовании было использовано 24 свиньи. Трое из них скончались во время индукции МИ из-за устойчивой VT. Одно животное умерло во время операции на открытом сердце для инъекций клеток из-за кровотечения из раны. Два животных умерли от тяжелой инфекции. Два животных были исключены из-за небольшого сокращения EF (сокращение LVEF В результате 16 животных завершили весь протокол исследования.
Сердечная функция и реконструкция
Серийная эхокардиографическая экспертиза показала, что LVEF значительно снизился с 68,23 и 3,52% на базовом уровне до 39,37 и 3,22%. LVEDD значительно увеличился с 3,6 - 0,5 до 4,8 - 0,4, а LVESD значительно увеличился с 2,5 - 0,3 до 3,9 - 0,4(рисунок 4А)через 8 недель после индукции МИ. LVEF и LVESD значительно улучшились до 52,9 и 4,27% и 3,3 и 0,3 соответственно в группе hiPSC-MSCs через 8 недель после трансплантации, по сравнению со статусом MI(рисунок 4A).
ОдП/дт и ESPVR значительно снизились с 1325 х 63 мм рт. ст. и 3,9 0,4 на базовом уровне до 978 х 45 мм рт. ст. и 1,8 0,2 на 8 недель после индукции МИ. Интрамиокардное администрирование hiPSC-MSC увеличило й dP/dt и ESPVR до 1127,4 мм рт. ст. и 2,6 0,3 на 8 недель после трансплантации iPSC-MSC, по сравнению со статусом MI(рисунок 4B).
Толщина стены infarct
Средняя толщина lv infarct стены была измерена от 5-7 серийных 1 см толщиной секции образцов в каждом животном(рисунок 5). Процент инфаркта LV составил 16 и 2%.
Выживание клеток после трансплантации
Существовал не выживаемость клеток вокруг места инъекции в области инфаркта 8 недель после трансплантации, но небольшое количество выживания hiPSC-MSCs были видны в пери-инарктной области (Рисунок 6).
Неудобная желудочительная аритмия
Заболеваемость индуцированная устойчивая желудочковой тахиаритмии может быть легко увеличена у животных с HF (10% на базовом уровне против 75% через 8 недель после индукции ИМ). Трансплантация hiPSC-MSCs не изменяет существенно базовый субстрат миокарда, чтобы уменьшить восприимчивость к VT (62,5% в группе hiPSC-MSCs через 8 недель после внутримысмиокардного введения hiPSC-MSCs, рисунок 7).
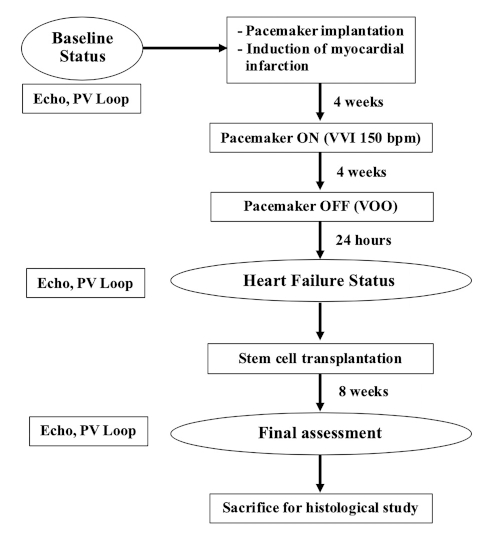
Рисунок 1: Диаграмма потока эксперимента. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
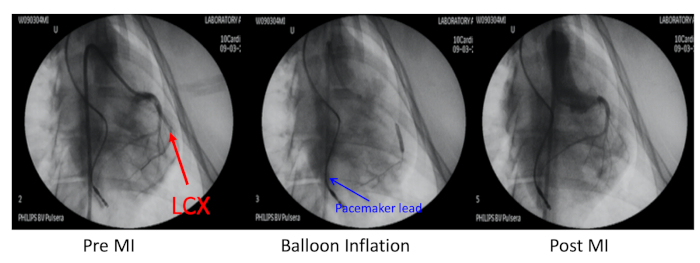
Рисунок 2: Свиная модель инфаркта миокарда. Свиная модель инфаркта миокарда (МИ) была вызвана эмболизацией левой окружной коронарной артерии (LCX, красная стрелка) дистальной до первой тупой маргинальной ветви. Эта коронарная артерия была окклюдирована баллонной инфляцией и инъекцией микросфер в 700 мкм. Коронарная ангиография в до-MI, воздушный шар инфляции, и после МИ была выполнена через 6F JR4 руководящий катетер через правую сонную артерию. Свинец кардиостимулятора был вставлен в правую желудочковой стенку (синяя стрелка). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
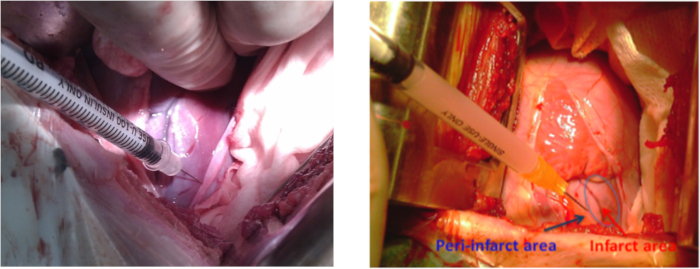
Рисунок 3: Пересадка клеток в свиной модели МИ. Места инъекций клеток на боковой стенке вокруг области инфаркта левого желудочка во время левой торакотомии. Синяя стрелка показывает область пери-инфаркта, а красная стрелка показывает область инфаркта. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
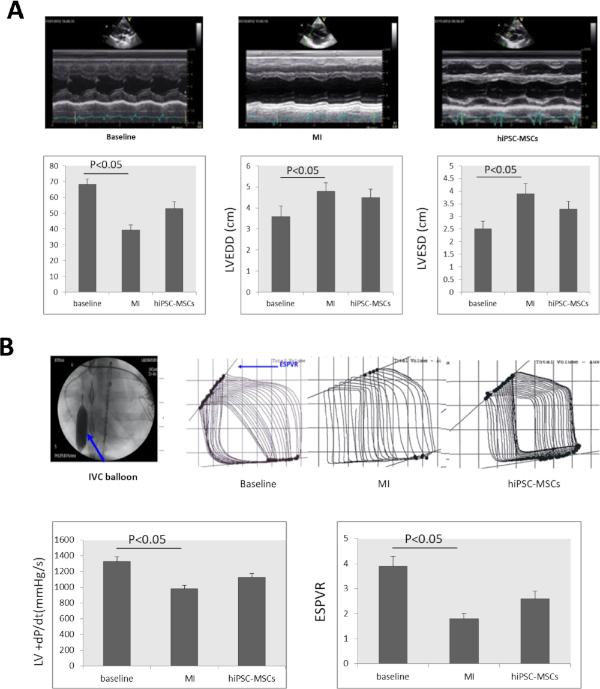
Рисунок 4: Функция сердца меняется после MI. (A)LV M-режим эхокардиограммы изображения на базовом уровне, MI, и трансплантации клеток. LVEF, LVEDD, LVESD значительно снизилась через 8 недель после индукции MI и значительно увеличилась в группе hiPSC-MSCs через 8 недель после трансплантации клеток. (B)Для оценки сердечной функции свиней с сердечной недостаточностью, значение ДЗП/ДТ и ESPVR были измерены с помощью процессора сигнала П.В. Нижняя кава вены (IVC) была окклюдирована инфляцией воздушных шаров (голубая стрелка) во время оценки ESPVR. И ОДП/ДТ, и ESPVR значительно снизились после индукции MI, а затем значительно увеличились в группах hiPSC-MSC через 8 недель после трансплантации. ANOVA следуют Студент-Ньюман-Keuls после специального тестирования (SPSS, версия 14) был использован с No 0,05 для значения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Изменения области инфаркта после MI. Образцы поперечного направления LV, сеяные толщиной 1 см в каждом сердце, содержат инфаркт миокарда. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
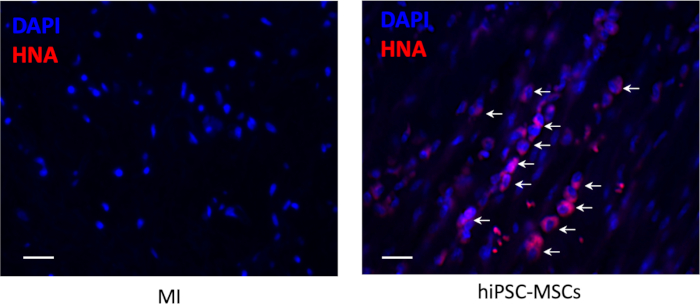
Рисунок 6: Выживаемость клеток после трансплантации. При пересадке hiPSC-MSCs было обнаружено иммуногистохимическое окрашивание дляанти-человеческого ядерного антигена (красного цвета). Шкала бар 100 мкм. Стрелки представляют положительные клетки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 7: Случаи устойчивых желудочковых тахиаритмий. (A)Вентрикулярные тахиаритмии (VT, красная стрелка), индуцированные in vivo интракардиак запрограммированной электрической стимуляции. (B)Заболеваемость VT значительно увеличилась после индукции MI. Трансплантация клеток не увеличивает заболеваемость VT. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Дополнительная цифра 1: Приобретение эхокардиограммы. Левая панель показывает положение животного. Правая панель показывает положение зонда. Средняя панель показывает эхокардиографическое изображение под этим положением. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
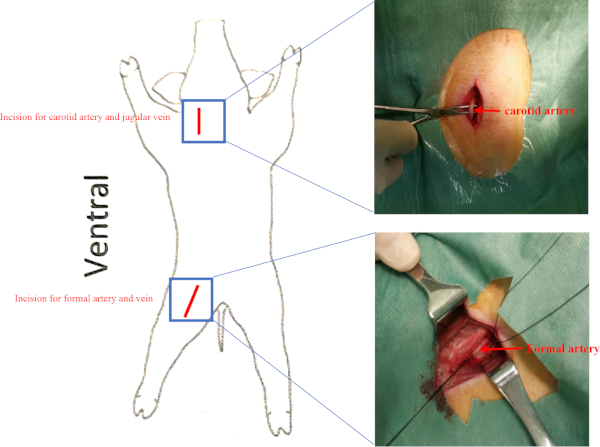
Дополнительная цифра 2: Расположение судов. Свиньи были помещены в положение лежа. Разрезы для сонной артерии и бедренной артерии представлены как красная линия. Яремная вена и бедренная вена находились под сонной артерией и бедренной артерией соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Стандартные модели животных имеют первостепенное значение для понимания патофизиологии и механизмов заболеваний и тестирования новых терапевтических средств. Наш протокол устанавливает свиную модель HF, вызванную блокированием левой окружной артерии и быстрым темпом. Через восемь недель после индукции МИ у животных развились значительные нарушения LVEF, LVEDD, LVESD, DP/dt и ESPVR. Этот протокол также тестирует метод введения терапии стволовыми клетками для регенерации сердца путем инъекций внутримыокарда. Оцениваются инфарктный размер и сердечная систолическая и диастолическая функция. Это исследование помогает создать стабильную и воспроизводимую доклиническую модель HF крупного животного для лечения стволовыми клетками, которая похожа на клинические случаи.
Блокировка LCX и быстрый темп широко используется для создания животных моделей HF в наших предыдущихисследованиях 7,8. LCX дистал к первой тупой маргинальной ветви был occluded, а затем 4 недели быстрого правого желудочка ходить. Ишемия миокарда приводит к потере кардиомиоцитов во время ИМ, что вызывает сердечный фиброз, миокарда ремоделирования, и сердечной аритмии. Вентрикулярный темп приводит к значительному расширение LV, неишемические нарушения левого желудочка контрактности, и тяжелые дисфункции LV9,10. Более длительные продолжительности ишемии и быстрого темпа производят прогрессивную экспериментальную модель HF низкой мощности для трансляционных исследований. Предыдущие исследования установили модели сердечной недостаточности, вызывая MI10. Тем не менее, смертность от тяжелой ИМ была выше, и сокращение МИ LVEF было нестабильным. Поэтому мы применяем быстрый правый желудочковый темп после блокировки LCX, чтобы вызвать значительное нарушение сердечной функции. Как видно из наших предыдущих исследований, представленная здесь модель дает стабильный размер инфаркта, а LVEF этой модели снижается как минимум до 40%нормального 6,,7,,8. Если бы было меньше инфекций и кровотечений, наш показатель успеха модели мог бы быть около 80%.
Одним из основных препятствий на пути клинического применения стволовых клеток является их плохое выживание и при пересадка после трансплантации. Недавние клинические исследования имета-анализ 11,12,13,14,15 не смогли продемонстрировать каких-либо последовательных улучшений в функции LV или инфаркт размер после такой терапии. Одной из потенциальных причин является низкая выживаемость пересаженных клеток. Обнаружение оптимального метода администрирования играет решающую роль в терапии стволовыми клетками. Сравнивая три метода трансплантации клеток, интрамиокарда введение является более эффективным, чем внутривенное и внутрикоронное введение из-за более высокойудержания клеток 16,17. Поэтому в данном исследовании мы выбрали маршрут интрамиокарда для доставки iPSC-MSC. Эхокардиографические результаты и инвазивные гемодинамические результаты показали, что интрамиокардиальное администрирование iPSC-MSCs улучшено LV функции свиней после МИ HF через 8 недель после трансплантации клеток. Несмотря на введения иммуносупрессивных препаратов (стероид и циклоспорин), только несколько пересаженных клеток были обнаружены в пери-инфарктной области. В инфарктированной области вокруг инъекций не было обнаружено ни одной выжившей клетки. Предыдущие исследования также обнаружили крайне небольшую часть стволовых клеток в инфаркте миокарда послетрансплантации 18,,19,,20,,21. Потеря клеток во время введения внутримиокарда может повлиять на экспериментальные результаты. Как улучшить методы администрирования и повысить уровень проживания следует уточнить в будущих исследованиях.
Безопасность, особенно аритмии, является еще одной жизненно важной проблемой в отношении клинической практики с клеточной терапии. Наше недавнее исследование показало, что интрамиокарда введения стволовых клеток эмбриона человека (HESC), полученных CMs увеличили заболеваемость спонтанной не-устойчивой желудочковой тахиаритмии4. В нашей модели свинины после МИ HF заболеваемость спонтанной неисповещенной желудочковой тахиаритмией (тариф 180 bpm и 12 ударов), зарегистрированная мониторингом телеметрии от кардиостимулятора, составила 25% после индукции MI, но устойчивый VT можно было легко индуцировать (80%). В этом исследовании, частота внезапной смерти остается неизменной с или без hiPSC-MSCs администрации. Кроме того, трансплантация hiPSC-MSC не модифицировать основной субстрат миокарда, чтобы уменьшить или увеличить восприимчивость к желудочковой аритмии. Этот результат позволяет предположить, что большая хроническая модель HF животных может быть использована для оценки безопасности клеток.
Избежание инфекции и кровоизлияния имеют первостепенное значение для успешного создания модели животных. Чтобы снизить риск кровоизлияния, следует обратить внимание, чтобы избежать каких-либо повреждений коронарных артерий и сердечных вен. Поскольку два животных умерли от тяжелой инфекции, будет выгодна соответствующая послеоперационная медицинская стратегия. Здесь мы предоставляем послеоперационную медицинскую стратегию, как ниже: Внутримышечно управлять энрофлоксацин (7,5 мг/кг, СИД) и бупренорфин (0,02 мг/кг, BID) в сочетании с перорально вводят амоксициллин/клавулановую кислоту (12,5 мг/кг, СИД) и карпрофен (2 мг/кг, СИД) всем животным в течение 1 недели после операции по профилактике инфекции и облегчению боли.
Таким образом, нынешний метод обеспечивает стабильную и воспроизводимую клинически релевантную крупную модель сердечной недостаточности для клеточной терапии.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Авторы признают Альфреду и Кунг Так Чунга за отличную техническую поддержку во время экспериментов на животных.
Материалы
| Name | Company | Catalog Number | Comments |
| Amiodarone | Mylan | - | - |
| Anaesthetic machines and respirator | Drager | Fabius plus XL | - |
| Angiocath | Becton Dickinson | 381147 | - |
| Anti-human nuclear antigen | abcam | ab19118 | - |
| Axio Plus image capturing system | Zeiss | Axioskop 2 PLUS | Axioskop 2 plus |
| AxioVision Rel. 4.5 software | Zeiss | - | - |
| Baytril | Bayer | - | enrofloxacin |
| Betadine | Mundipharma | - | - |
| CardioLab Electrophysiology Recording Systems | GE Healthcare | G220f | - |
| Culture media | MesenCult | 05420 | - |
| Cyclosporine | Novartis | - | - |
| Defibrillator | GE Healthcare | CardioServ | - |
| Dorminal | TEVA | - | - |
| Echocardiographic system | GE Vingmed | Vivid i | - |
| EchoPac software | GE Vingmed | - | - |
| Electrophysiological catheter | Cordis Corp | - | - |
| Embozene Microsphere | Boston Scientific | 17020-S1 | 700 μm |
| Endotracheal tube | Vet Care | VCPET70PCW | Size 7 |
| Ethanol | VWR chemicals | 20821.33 | - |
| Formalin | Sigma | HT501320 | 10% |
| IVC balloon Dilatation Catheter | Boston Scientific | 3917112041 | Mustang |
| JR4 guiding catheter | Cordis Corp | 67208200 | 6F |
| Lidocaine | Quala | - | - |
| Mersilk | Ethicon | W584 | 2-0 |
| Metoprolol succinate | Wockhardt | - | - |
| Microtome | Leica | RM2125RT | - |
| Mobile C arm fluoroscopy equipment | GE Healthcare | OEC 9900 Elite | - |
| Pacemaker | St Jude Medical | PM1272 | Assurity MRI pacemaker |
| Pacemaker generator | St Jude Medical | Merlln model 3330 | - |
| Pressure-volume catheter | CD Leycom | CA-71103-PL | 7F |
| Pressure–volume signal processor | CD Leycom | SIGMA-M | - |
| Programmable Stimulator | Medtronic Inc | 5328 | - |
| PTCA Dilatation balloon Catheter | Boston Scientific | H7493919120250 | MAVERICK over the wire |
| Ramipril | TEVA | - | - |
| Sheath introducer | Cordis Corp | 504608X | 8F, 9F, 12F |
| Steroid | Versus Arthritis | - | - |
| Temgesic | Nindivior | - | buprenorphine |
| Venous indwelling needle | TERUMO | SR+OX2225C | 22G |
| Vicryl | Ethicon | VCP320H | 2-0 |
| Xylazine | Alfasan International B.V. | - | - |
| Zoletil | Virbac New Zealand Limited | - | tiletamine+zolezepam |
Ссылки
- Mozaffarian, D., et al. Heart disease and stroke statistics-2015 update: a report from the American Heart Association. Circulation. 131, e29 (2015).
- Hospital Authority. . Hospital Authority Statistical Report 2013. , (2013).
- Cung, T. T., et al. Cyclosporine before PCI in Patients with Acute Myocardial Infarction. The New England Journal of Medicine. 373 (11), 1021-1031 (2015).
- Liao, S. Y., et al. Proarrhythmic risk of embryonic stem cell-derived cardiomyocyte transplantation in infarcted myocardium. Heart Rhythm. 7, 1852-1859 (2010).
- Liao, S. Y., et al. Overexpression of Kir2.1 channel in embryonic stem cell-derived cardiomyocytes attenuates posttransplantation proarrhythmic risk in myocardial infarction. Heart Rhythm. 10, 273-282 (2013).
- Liu, Y., et al. Thoracic spinal cord stimulation improves cardiac contractile function and myocardial oxygen consumption in a porcine model of ischemic heart failure. Journal of Cardiovascular Electrophysiology. 23, 534-540 (2012).
- Liao, S. Y., et al. Improvement of Myocardial Function Following Catheter-Based Renal Denervation in Heart Failure. JACC: Basic to Translational Science. 2 (3), 270-281 (2017).
- Liao, S. Y., et al. Remodelling of cardiac sympathetic re-innervation with thoracic spinal cord stimulation improves left ventricular function in a porcine model of heart failure. Europace. 17 (12), 1875-1883 (2015).
- Daehnert, I., Rotzsch, C., Wiener, M., Schneider, P. Rapid right ventricular pacing is an alternative to adenosine in catheter interventional procedures for congenital heart disease. Heart. 90 (9), 1047-1050 (2004).
- Hála, P., et al. Tachycardia-Induced Cardiomyopathy as a Chronic Heart Failure Model in Swine. Journal of Visualized Experiments. (132), e57030 (2018).
- Santoso, T., et al. Endomyocardial implantation of autologous bone marrow mononuclear cells in advanced ischemic heart failure: a randomized placebo-controlled trial (END-HF). Journal of Cardiovascular Translational Research. 7, 545-552 (2014).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network. Effect of intracoronary delivery of autologous bone marrow mononuclear cells 2 to 3 weeks following acute myocardial infarction on left ventricular function: the LateTIME randomized trial. Journal of the American Medical Association. 306, 2110-2119 (2011).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network (CCTRN). Effect of the use and timing of bone marrow mononuclear cell delivery on left ventricular function after acute myocardial infarction: the TIME randomized trial. Journal of the American Medical Association. 308, 2380-2389 (2012).
- de Jong, R., Houtgraaf, J. H., Samiei, S., Boersma, E., Duckers, H. J. Intracoronary stem cell infusion after myocardial infarction. A meta-analysis and update on clinical trials. Circulation: Cardiovascular Interventions. 7, 156-167 (2014).
- Nowbar, A. N., et al. DAMASCENE writing group. Discrepancies in autologous bone marrow stem cell trials and enhancement of ejection fraction (DAMASCENE): weighted regression and meta-analysis. British Medical Journal. 348, g2688 (2014).
- Kanelidis, A. J., Premer, C., Lopez, J., Balkan, W., Hare, J. M. Route of Delivery Modulates the Efficacy of Mesenchymal Stem Cell Therapy for Myocardial Infarction: A Meta-Analysis of Preclinical Studies and Clinical Trials. Circulation Research. 120 (7), 1139-1150 (2017).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112 (9 Suppl), I150-I156 (2005).
- Hu, X., et al. A Large-Scale Investigation of Hypoxia-Preconditioned Allogeneic Mesenchymal Stem Cells for Myocardial Repair in Nonhuman Primates: Paracrine Activity Without Remuscularization. Circulation Research. 118, 970-983 (2016).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Martens, A., et al. Substantial early loss of induced pluripotent stem cells following transplantation in myocardial infarction. Artificial Organs. 38, 978-984 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538, 388-391 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены