Method Article
줄기 세포 치료를위한 심근 경색 심부전의 돼지 모델 설립
요약
우리는 좌측 경부 동맥 막힘과 세포 기반 치료를 위한 줄기 세포의 심혈 투여의 효과 및 안전성 을 테스트하기 위해 신속한 속도에 의해 유도된 심부전의 돼지 모델을 확립하고자 했습니다.
초록
심근 경색 (MI)에 따라 심부전 (HF)의 치료에 발전이 달성되었지만 MI에 이어 HF는 전 세계적으로 사망률과 이환율의 주요 원인 중 하나입니다. MI 후 심장 수리 및 왼쪽 심실 기능의 개선을 위한 세포 기반 치료는 상당한 관심을 끌고 있다. 따라서, 이러한 세포 이식의 안전성과 효능은 임상 사용 전에 HF의 전임상 대형 동물 모델에서 시험되어야 한다. 돼지는 심장 크기와 관상 동맥 해부학의 관점에서 인간에 그들의 유사성 때문에 심장 혈관 질병 연구에 널리 사용 됩니다. 따라서, 좌측 일경동맥(LCX)의 폐쇄형 관상동맥 폐색을 이용하여 돼지 만성 HF 모델의 확립을 위한 효과적인 프로토콜을 제시하고, 그 다음으로 심박동기 이식으로 유도된 급속한 심실 조도를 제시했다. 8 주 후, 줄기 세포는 peri-infarct 영역에서 내심 내 주분에 의해 관리되었다. 그런 다음 경색 크기, 세포 생존 및 좌심실 기능(에코카피오그래피, 혈역학 파라미터 및 전기 생리학 포함)을 평가하였다. 이 연구는 줄기 세포 치료를위한 안정적인 전임상 대형 동물 HF 모델을 확립하는 데 도움이됩니다.
서문
심혈관 질환, 관상 동맥 질환 (CAD) 특히 홍콩및 전 세계1에서이환율과 사망률의 주요 원인으로 남아 있습니다. 홍콩에서는 2012년부터 2017년까지 병원 당국에 따라 치료된 CAD 환자 수의 26% 증가를예상했습니다. 모든 CAD 중, 급성 심근 경색 (MI)은 심장 마비 (HF)와 같은 사망 및 후속 합병증의 주요 원인입니다. 이들은 중요한 의학, 사회적, 재정적 인 부담에 기여합니다. MI를 가진 환자에서, 혈전 성 요법 또는 1 차적인 경피 관상 동맥 내정간섭 (PCI)는 생명을 보존에 있는 효과적인 치료입니다, 그러나 이 치료는 MI 도중 심근세포 (CM) 손실을 감소시킬 수 있습니다. 유효한 처리는 심장 섬유증, 심근 리모델링, 심장 부정맥 및 결국 심부전으로 이끌어 내는 CMs의 영원한 손실을 보충할 수 없습니다. 1년 후 MI의 사망률은 약 7%이며 20% 이상의 환자가 HF3을개발하고 있다. 말기 HF 환자에서 심장 이식은 유일하게 유효한 치료법이지만 사용 가능한 장기의 부족에 의해 제한됩니다. 새로운 치료법은 MI 이후 HF의 개발을 되돌리기 위해 필요합니다. 그 결과, 세포 기반 치료는 MI 다음 HF에서 손상된 CM을 복구하고 왼쪽 심실(LV) 기능을 개량하는 매력적인 접근법으로 간주됩니다. 우리의 이전 연구는 MI4의작은 동물 모델에서 직접 내트라미니카원 이식 후 심장 기능 개선에 도움이 되는 줄기 세포이식을 발견,5. 표준화된 전임상 대형 동물 HF 프로토콜은 임상 사용 전에 줄기 세포 이식의 효능및 안전성 을 추가로 테스트하는 데 필요합니다.
최근 수십 년 줄기 세포 치료에 대 한 심장 혈관 연구에서 돼지의 광범위 한 사용을 목격 했다. HF 돼지는 심장 크기, 체중, 리듬, 기능 및 관상 동맥 해부학의 관점에서 인간과 유사하기 때문에 번역 연구의 유망한 모델입니다. 더욱이, 돼지 HF 모델은 CM 대사, 전기생리학적 특성 및 허혈성 조건 하에서 신경 내분비 변화의 관점에서 MI 후 HF 환자를 모방할 수 있다6. 여기에 제시된 프로토콜은 이러한 표준화된 돼지 HF 모델을 사용하며, 좌측 순환동맥(LCX)의 폐쇄형 관상 동맥 열구를 사용하고, 이어서 심박동기 이식에 의해 유도된 신속한 속도를 채용한다. 연구 결과는 또한 포스트 MI HF의 처리를 위한 줄기 세포의 심근 관리의 경로를 낙관합니다. 목적은 심각한 CAD를 가진 환자를 위해 임상적으로 관련있는 처리를 개발하기 위하여 이용될 수 있는 만성 심근 경색의 돼지 동물 모형을 생성하는 것입니다.
프로토콜
모든 동물 실험은 홍콩 대학의 미국 국립 보건 및 규정에 의해 출판 된 실험실 동물의 관리 및 사용에 대한 가이드에 따라 수행되었으며, 이 프로토콜은 홍콩 대학의 교육 및 연구 (CULTAR)에서 살아있는 동물 사용위원회에 의해 승인되었습니다.
참고: 35-40kg(9-12개월)의 암컷 농장 돼지가 이 연구에 사용되었습니다. 이 실험의 순서도는 도 1에표시됩니다.
1. 외과 적 절차
- 동물의 마취 및 준비
- 동물을 12시간 동안 빠르게 하고 실험 전에 4시간 동안 물 박탈을 받습니다.
- 일반 식염수 20mL에서 제조된 타일타민+졸제팜(2-7 mg/kg)과 자일라진(0.5-1 mg/kg)의 근육 주사를 통해 돼지를 마취시킵니다. 동물의 팔페브랄 반사신경이 없을 때까지 모니터링합니다.
- 돼지의 머리카락을 제거하고 목과 사타구니의 피부를 살균하여 1.3-1.5 섹션을 위해 합니다. 70%의 에탄올과 베타딘으로 작동 영역을 3배 소독합니다.
- 7mm 내막튜브를 돼지 기관체에 넣고 22G 정맥을 귀 베나에 넣습니다.
- 돼지를 수술대에 옮기고 척추 위치에 놓습니다. 내막튜브를 호흡보호구에 연결하고 기계적으로 환기(호흡/만료 시간 비율 1:2) 이소플루란(1.5%-2.0% 흡입)과 산소(0.5-1.5 L/min 흡입)를 가진 동물과 함께 한다.
- 표면 심전도 및 혈압을 모니터링하고 전기 생리학 기록 시스템을 통해 심박수, 심장 리듬 및 동맥 혈압을 지속적으로 모니터링합니다.
- 에코카르디그래피
- 돼지를 왼쪽 측면 탈구 위치로 이동하고 테이블에 고정합니다.
- 심근 부위에 프로브를 배치하고 2D 및 M 모드 이미징을 포함한 직렬 에코카디오그래피를 수행하여 고해상도 심초음파 시스템과 기준선에서 3-9 MHz 트랜스듀서를 사용하여 세포 이식 전 및 세포 이식 후 8주(보충도 1)를수행한다.
- 상용 소프트웨어를 사용하여 얻은 모든 이미지를 분석합니다. LV 종횡확장기치(LVEDD), LV 단변 수축기 치수(LVESD), LV 엔드-수축기 부피(LVEDV), LV 단변 수축부(LVESV), LV 배출 분획(LVEF), 표준 심전도 이미지 후 벽 두께를 계산하여 파라골 긴 축 뷰에서 얻을 수 있다.
참고: 모든 오프라인 분석은 컴퓨터 워크스테이션을 사용하여 다른 독립 작업자에 의해 수행되었습니다. 서로 다른 관찰자 간의 측정 의 가변성은 20 개의 반복된 임의 이미지를 기반으로 4 %였습니다. 모든 심초음파 측정은 미국 에코카르디그래피학 학회 권고에 따라 수행되었습니다.
- 맥박 조정기 이식
- 돼지를 척추 위치로 옮기고 테이블에 있는 돼지의 팔다리를 끈으로 고정합니다.
- 경동맥 삼각형(sternocleidomastoid 뒤에 스티로하이드, 디거스근육, 오모효이드로 둘러싸인 후)에서 오른쪽 경동맥과 경정맥을 찾아멸조건하에서 혈전성힘으로 오른쪽 경동맥과 경정맥을분리한다(보충도 2). 오른쪽 경동맥과 경정맥의 말단끝을 리게이트한다. 2-0 비릴로 두 근육을 바느질.
- 협심증으로 오른쪽 경정맥을 수선하고 X선안내(그림 2)에서오른쪽 심실로 이어지는 심박동기를 삽입한다.
- 삼골류와 전방 스케일린 근육을 집게를 사용하여 분리합니다. 두 근육 사이에 맥박 조정기를 이식하고 2-0 실크로 두 근육을 바느질합니다. 페이스 메이커를 리드에 연결합니다.
- 이식 후 심박동기 생성기로 VVI 모드(35bpm)를 백업하도록 심박동기를 다시 프로그래밍합니다.
- MI 유도 후 4주 후 심박조율기 발생기로 HF를 유도하기 위해 신속한 심실 진도(150비트/분)를 적용한다. 그런 다음 페이스 메이커를 다시 백업 VVI 모드로 8 주에 설정합니다.
- 침습압력볼륨 루프 분석
참고: 세포 이식 전, 세포 이식 후 8주 동안 기준선에서 침습적인 혈역학 적 평가를 수행하여 LV 기능의 변화를 평가합니다.- 대퇴 삼각형에서 올바른 대퇴 동맥과 대퇴 정맥을 분리합니다 (인기구 인대, 사르토리우스 근육 및 보조근에 둘러싸여 있음)(보충 도 2).
- 앙고카와 오른쪽 대퇴 동맥을 수강하고 앙미오카트를 통해 동맥에 가이드 와이어를 배치합니다. 앙미카를 제거하고 가이드 와이어의 지도하에 동맥에 9F 칼집을 캐너레이. 가이드와이어를 제거합니다.
- 1.4.2 단계에서 설명된 바와 같이 12F 칼집으로 올바른 대퇴정맥을 수분한다. 배치된 12F 칼집에서 열등한 베나 카바(IVC)에 X선 안내하에 풍선 카테터를 삽입합니다.
- PV 신호 프로세서를 사용하여 동위 원소식용염으로 7Fr 압력 볼륨(PV) 카테터를 교정합니다.
- X 선 지침하에 배치된 9F 칼집에서 PV 카테터를 LV 정점에 삽입합니다. 환기를 일시 중단하고 PV 신호 프로세서를 사용하여 좌심실 최대 양압 유도체(+dP/dt), 최종 수축기 압력(ESP), 최종 확장기 압력(EDP)을 측정합니다.
- IVC의 폐색 시 PV 신호 프로세서에 의해 최종 수축기 압력 볼륨 관계(ESPVR)를 측정합니다.
- 절차가 완료되면 환기를 다시 시작합니다.
- MI 의 유도
- 심실 부정맥을 방지하기 위해 MI의 유도 전에 동물에게 아미오다론 (5 mg / kg 정맥 내 정맥 내) 및 리도카인 (1.5 mg / kg 정맥 볼루스)을 정맥 내 부정맥을 방지하기 위해 정맥 내 부정맥을 예방하기 위해 정맥 내 성비야를 투여합니다.
- 1.4.3 단계에서 언급한 바와 같이 8F 칼집으로 올바른 경동맥을 캐너레이트한다.
- 표준 C 암 형광술 장비에 의해 유도 배치 된 칼집을 통해 6F JR4 오버 더 와이어 안내 카테터를 통해 관상 동맥 혈관 조영술을 수행합니다.
- 왼쪽 일류 관상 동맥(LCX)을 경피성 원형 관상 동맥(PTCA) 팽창 풍선 카테터 인플레이션을 X선지침(그림 2)으로분리하여 첫 번째 난관류 한계 지점에 탈구하였다.
- LCX를 차단하기 위해 풍선 카테터를 통해 10mL 주사기로 제조된 식염수 3mL과 혼합된 700 μm 스폰지 마이크로스피어 의 1mL을 주입한 다음 풍선을 수축시키고 폐색을 확인하기 위해 혈관그램을 수행합니다.
- 성공적인 완전한 막힘을 달성하기 위해 주입 절차를 반복합니다.
- 동물 심박수와 리듬을 모니터링하여 심장 부정맥을 감지합니다. 심실 세동이 발생하면 외부 의 쌍면 제세동기를 사용하여 150-300 J 충격을 사용하여 부비동 리듬을 재확립하십시오.
- 줄기 세포 주입
- 심장 기능의 주목할만한 손상을 가진 모든 동물을 무작위로 할당 (LVEF & 40% MI의 유도 후 8 주) 두 개의 다른 그룹에: 2 x 108 인간 유도 만능 줄기 세포 유래 메젠키말 줄기 세포의 내트라미니 심근 관리를받을 것이다 하나 (hiPSC-MSC), 그리고 다른 하나는 hiPSC-MSC를받지 않습니다.
- 자궁 내 이식을위한 정상 식염수의 2 mL에서 hiPSC-MSC를 준비합니다. 자궁 내 hiPSC-MSC 이식 전에, 항 1.1에 언급 된 마취 및 동물 준비 단계를 반복, 이번에는 정점 비트 영역 주위에 10cm 살균. 4-5늑간 공간에서 레트랙터와 함께 왼쪽 토라코토미를 수행합니다. 경각심을 발휘하여 경각선 벽을 노출합니다.
참고: 절개 길이는 10-12cm였습니다. - 5-8 개의 내트라미카르원 주사(주사당 ~0.3mL)를 사용하여 한Table of Materials 군또는 다른 그룹에 2 x 108 hiPSC-MSC를 투여하여 배양 배지(재료표)를 투여한다(도 3). 조심스럽게 any 출혈의 위험을 줄이기 위해 관상 동맥에 손상을 피하십시오.
- 철철철로 늑간 공간을 닫고 2-0 실크로 근육 층을 닫습니다. 피하 조직과 피부를 2-0 비릴로 바느질합니다.
- 심장 내 프로그래밍 전기 자극
- 프로그램 가능한 자극기를 사용하여 프로그래밍된 전기 자극을 수행하여 세포 이식 요법 후 심실 타키야르리듬(VT)의 유도성을 평가합니다.
- 모든 동물을 희생하기 전에 대퇴 정맥을 통해 오른쪽 심실 정점에 6F 전기 생리학적 카테터를 삽입합니다.
- 표면 심전도 리드 I, II 및 III를 200mm/s의 속도로 전기 생리적 기록 시스템에 표시합니다. 자극기를 사용하여 확장기 임계값의 2배에서 2ms 펄스 폭을 전달합니다.
- 두 드라이브 사이클 길이(200ms 및 300ms)에서 8개의 자극(S1)의 속도 열차를 전달한 다음 1개(S2) 또는 2개(S2 및 S3) 조기 추가 자극을 제공합니다.
- 심실 유효 내화 기간 또는 부정맥이 유도될 때까지 커플링 간격을 순차적으로 단축한다. 유도 할 수없는 지속 VT (>10 s)의 존재를 유의하십시오.
2. 수술 후 프로토콜
- 수술 후 의학
- HF에 대한 기존의 약리학적 치료를 수행합니다. 간단히 말해서, 경구로 메토프로롤 간결 (25 mg) 및 라미프릴 (2.5 mg)을 매일 모든 동물에게 투여하십시오.
- 근육질으로 엔로플로록사신(5 mg/kg)과 부프레노르핀(0.01 mg/kg)을 수술 후 1주일 동안 모든 동물에게 투여하여 감염을 예방하고 통증을 완화합니다.
- 면역학적 거부를 최소화하기 위해, 구두로 스테로이드를 관리 (40 mg/day 구두로) 및 사이클로스 포린 (200 mg/day 구두로) 모든 동물에 3 세포 이식 전에 일 8 주 후.
- 경색 크기 평가
- 실험이 끝나면 도미날(펜토바르비탈 나트륨, 100 mg/kg, IV)을 과다 복용하여 동물을 안락사시하십시오.
- 가슴을 열고 심장을 수집합니다. 0.9% 식염수로 심장을 헹도 헹도 됩니다.
- LV 횡방향에서 1cm 두께의 메스가 있는 LV 조직 샘플을 연속적으로 절개합니다.
- 경색 심근을 포함하는 슬라이스의 일부를 선택하여 벽 두께와 경색 영역을 측정합니다.
- 이러한 슬라이스의 이미지를 캡처하고 상업용 이미지 분석 소프트웨어를 사용하여 벽 두께와 경색 영역을 정량적으로 분석합니다.
- 한 달 동안 4 °C에서 10 % 포르말린으로 조직을 고정하십시오. 파라핀의 경소 부위(~1cm 2개)에 인접한2 조직을 포함시합니다. 조직학적 검사를 위해 미세 토메를 사용하여 5 μm 슬라이스로 단면.
- 세포 생존
- 제조자가 제공하는 프로토콜에 따라 항인간 핵항원(HNA)을 사용하여 면역히스토케미칼 염색에 의해 이식된 세포의 이식을 검출한다.
- 각 동물의 5개의 무작위 필드에서 3개의 다른 섹션으로 이미지를 캡처하고 peri-infarct 영역에서 양수 세포를 정량적으로 분석합니다.
참고: 이미지 캡처 시스템 및 이미지 분석 소프트웨어는 하트 섹션의 이미지를 캡처하고 분석하는 데 사용되었습니다.
결과
사망률
총 24마리의 돼지가 이 연구에서 사용되었습니다. 그 중 3명은 지속적인 VT 로 인해 MI 유도 중에 사망했습니다. 한 동물은 상처 출혈로 인해 세포 주입을 위한 개방 심장 수술에서 사망했습니다. 심각한 감염으로 인해 두 마리의 동물이 사망했습니다. 두 마리의 동물은 약간의 EF 감소(LVEF 감소 > 기준선 40%)로 인해 제외되었습니다. 그 결과, 16마리의 동물이 전체 연구 프로토콜을 완료했습니다.
심장 기능 및 리모델링
연쇄 심초음파 검사결과 LVEF는 기준선에서 68.23 ±3.52%에서 39.37 ±3.22%로 크게 감소한 것으로 나타났다. LVEDD는 MI 유도 후 8주 만에 3.6±0.5에서 4.8±0.4로 크게 증가했으며, LVESD는 2.5±0.3에서 3.9±0.4(도Figure 44A)로크게 증가했다. LVEF 및 LVESD는 MI 상태(도4A)에비해 이식 후 8주 후 hiPSC-MSCs 그룹에서 각각 52.9±4.27% 및 3.3±0.3으로 크게 개선되었다.Figure 4
+dP/dt 및 ESPVR은 MI 유도 후 8주에서 기준선에서 1,325±63 mmHg/s 및 3.9±0.4에서 978 ±45 mmHg/s, 1.8 ±0.2로 크게 감소하였다. hiPSC-MSC의 내트라메카심 투여는 IPSC-MSC 이식 후 8주에서 +dP/dt 및 ESPVR을 1,127.4±50 mmHg/s로, 2.6±0.3으로 증가시켰으며, MI상태(그림 4B)와비교하였다.
경색 벽 두께
평균 LV 경색 벽 두께는 각 동물의 5-7 직렬 1cm 두께 섹션샘플(그림 5)에서측정하였다. LV 경색의 백분율은 16 ± 2%였다.
이식 후 세포 생존
이식 후 8주 동안 광원 부위에 세포 생존이 없었지만, 소수의 생존 hiPSC-MSC가 페리-광원 지역에서 보였다(도6).
유도성 심실 부정맥
유도 가능한 지속적인 심실 타키야르리듬의 발생률은 HF를 가진 동물에서 쉽게 증가할 수 있습니다(기준선에서 10% 대 75% 8주 후 MI 의 유도 후). hiPSC-MSC 이식은 VT에 대한 감수성을 줄이기 위해 기본 심근 기판을 크게 수정하지 않습니다(hiPSC-MSC 그룹에서 8주 후 hiPSC-MSCs 그룹에서 62.5%, 그림 7).
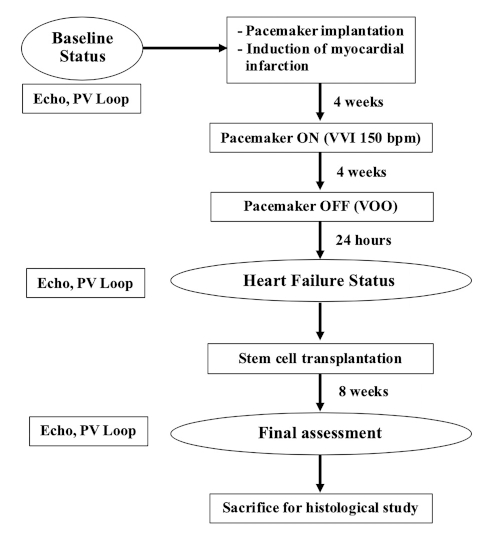
그림 1: 실험의 흐름 차트입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
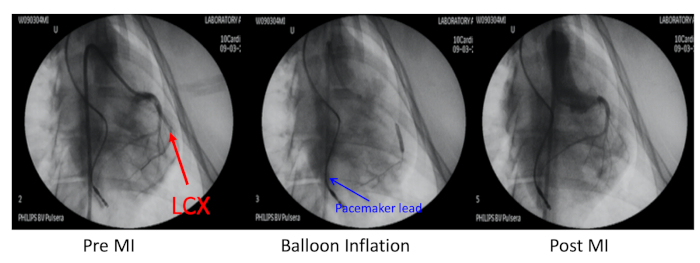
그림 2: 심근 경색의 돼지 모델. 심근 경색 (MI)의 돼지 모델은 제 1 난해 한계 가지에 대한 좌측 정관 동맥 (LCX, 적색 화살표)의 색전화에 의해 유도되었다. 이 관상 동맥은 풍선 인플레이션과 700 μm 마이크로스피어의 주입으로 가려졌습니다. MI 이전, 풍선 인플레이션 및 포스트 MI의 관상 동맥 학공은 오른쪽 경동맥을 통해 카테터를 안내하는 6F JR4를 통해 수행되었습니다. 심박조율기 리드는 오른쪽 심실 벽(파란색 화살표)에 삽입되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
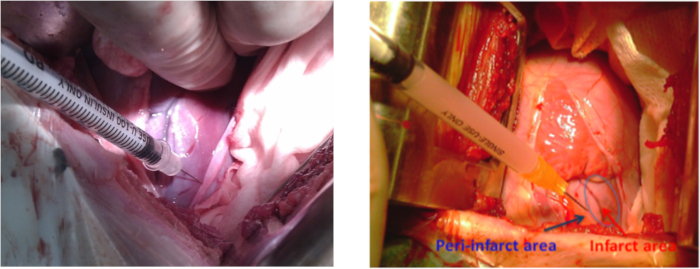
도 3: MI의 돼지 모델에서 세포 이식. 왼쪽 심실의 중간 영역 주위 측면 벽에 세포 주입 사이트 왼쪽 소라 코 토 절제술. 파란색 화살표는 peri-infarct 영역을 표시하고 빨간색 화살표는 경색 영역을 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
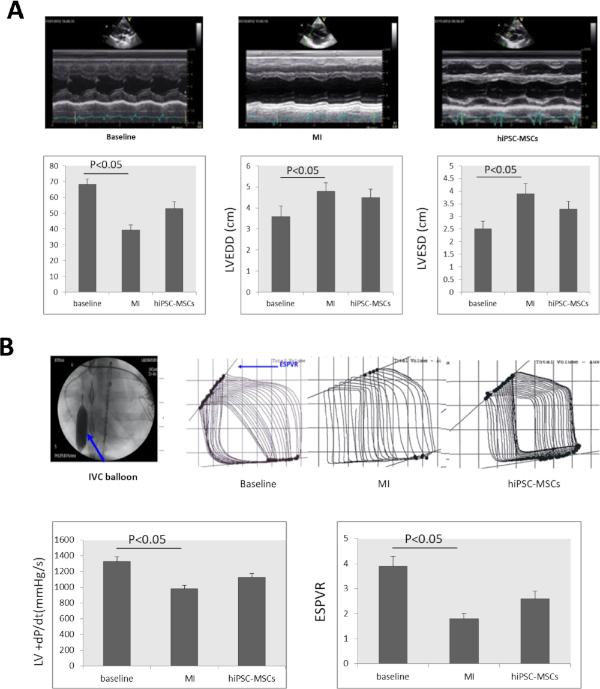
그림 4: MI 후 심장 기능이 변경됩니다. (A)기준선, MI 및 세포 이식에서 LV M 모드 심초음파 영상. LVEF, LVEDD, LVESD는 MI 유도 후 8주 만에 크게 감소했으며, 세포 이식 후 8주 후에 hiPSC-MSCs 그룹에서 현저히 증가했다. (B)심부전을 가진 돼지의 심장 기능을 평가하기 위해, +dP/dt 값 및 ESPVR은 PV 신호 프로세서로 측정하였다. 열등한 베나 카바(IVC)는 ESPVR 평가 중에 풍선 인플레이션(파란색 화살표)에 의해 가려졌습니다. +dP/dt와 ESPVR 은 MI 유도 후 크게 감소한 후 이식 후 8주 후에 hiPSC-MSC 그룹에서 현저히 증가하였다. ANOVA다음으로 학생-뉴먼-쿨스 포스트 호크 테스트(SPSS, 버전 14)가 α = 0.05로 사용되어 의미가 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: MI 후 경색 영역이 변경됩니다. 경색 심근을 포함하는 각 심혼에 있는 1cm 두께로 단면된 LV 횡방향 견본. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
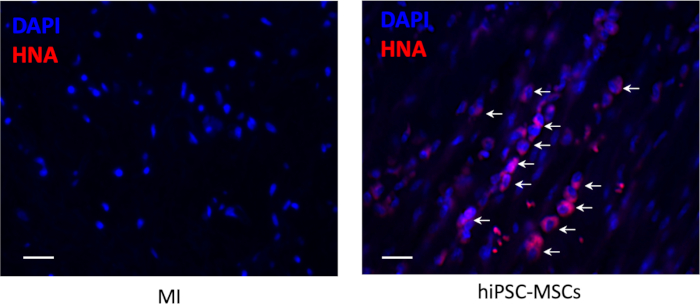
도 6: 이식 후 세포 생존. 이식된 hiPSC-MSC의 이식은 면역히스토케미칼 염색항-인간 핵항원(적색)에 의해 검출되었다. 스케일 바 = 100 μm. 화살표는 양수 세포를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 지속적인 심실 타키야르 리듬의 발생률. (A)생체 내 심장 프로그래밍 전기 자극에 의해 유도된 심실 타키야르리듬(VT, 적색 화살표). (B)MI 유도 후 VT의 발생률이 크게 증가하였다. 세포 이식은 VT의 발생률을 증가시키지 않았다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

보충 도 1: 심초음파 취득. 왼쪽 패널은 동물의 위치를 보여줍니다. 오른쪽 패널은 프로브 위치를 표시합니다. 중간 패널은 이 위치에서 심초음파 영상을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
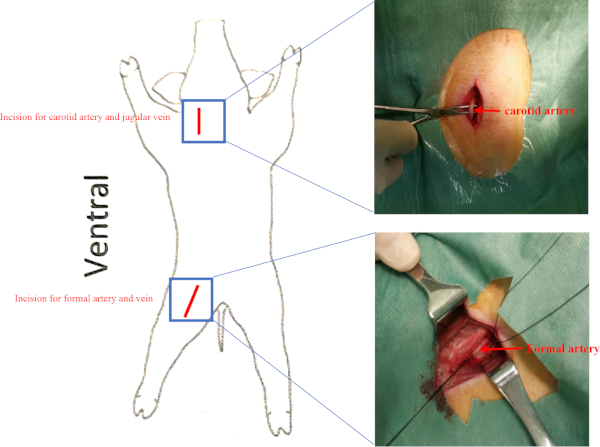
보충 도 2: 선박의 위치. 돼지는 척추 위치에 배치되었다. 경동맥과 대퇴동맥에 대한 절개는 레드라인으로 제시된다. 경정맥과 대퇴정맥은 각각 경동맥과 대퇴동맥 아래에 있었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
표준 동물 모델은 질병의 병리학 및 메커니즘을 이해하고 새로운 치료법을 테스트하는 것이 가장 중요합니다. 우리의 프로토콜은 왼쪽 경부 동맥 막힘과 빠른 속도에 의해 유도 된 HF의 돼지 모델을 설정합니다. MI의 유도 후 8 주, 동물은 LVEF의 상당한 손상을 개발, LVEDD, LVESD, +dP / dt, 그리고 ESPVR. 이 프로토콜은 또한 심혼 주사에 의하여 심혼 재생을 위한 줄기 세포 치료의 관리 방법을 시험합니다. 경색 크기, 심장 수축기 및 확장기 기능이 평가됩니다. 이 연구는 임상 사례와 유사한 줄기 세포 치료를위한 안정적이고 재현 가능한 전임상 대형 동물 HF 모델을 확립하는 데 도움이됩니다.
LCX 막힘과 급속한 속도는 이전 연구에서 HF의 동물 모델을 만들기 위해 광범위하게 사용되어 왔다7,,8. LCX는 첫 번째 obtuse 한계 지점에 대한 단면이 가려져 있었고, 4주 동안 급속한 우심실 진도가 뒤따랐습니다. 심근 허혈은 심장 섬유증, 심근 리모델링 및 심장 부정맥을 일으키는 MI 도중 심근세포의 손실을 초래합니다. 심실 진도는 좌심실 수축의 상당한 LV 팽창, 비화학적 손상, 및 심한 LV 기능 장애9,,10을초래한다. 허혈과 빠른 속도의 긴 기간은 번역 연구를위한 진보적 인 실험 적 출력 HF 모델을 생성합니다. 이전 연구는 MI10을유도하여 심부전 모델을 확립했다. 그러나, 가혹한 MI의 사망률은 더 높았고 MI의 LVEF 감소는 불안정했습니다. 따라서 LCX 막힘 후 급속한 우심실 속도를 적용하여 심장 기능의 중대한 손상을 유도합니다. 우리의 이전 연구에서 볼 수 있듯이, 여기에 제시 된 모델은 안정적인 경색 크기를 산출하고,이 모델의 LVEF는 적어도 40 % 정상6,7,7,8이하로 감소된다. 감염과 출혈이 적었더면 모델 성공률은 약 80%였을 것입니다.
줄기 세포의 임상 적용에 주요 장애물 중 하나는 그들의 가난한 생존 및 이식 다음 이식. 최근 임상 연구 및 메타 분석11,,12,,13,,14,,15는 이러한 치료에 따른 LV 기능 또는 경색 크기에서 일관된 개선을 입증하지 못했다. 잠재적인 이유 중 하나는 이식 된 세포의 낮은 생존율입니다. 최적의 투여 방법을 발견하는 것은 줄기 세포 치료에 중요한 역할을합니다. 세포 이식의 세 가지 방법을 비교, 내트라메라심 투여는 더 높은 세포 보유에 의한 정맥 내 투여보다 더 효율적입니다16,,17. 따라서, 우리는이 연구에서 iPSC-MSC 전달을위한 내트라메디카심관리 경로를 선택했습니다. 심초음파 결과 및 침습적인 혈역학 적 결과는 iPSC-MSCs의 내트라모니카간 투여가 세포 이식 후 8주 후에 MI 후 HF 돼지의 LV 기능을 개선한다는 것을 입증했습니다. 면역 억제 약물 (스테로이드및 사이클로스포린)의 투여에도 불구하고, 단지 몇 이식 된 세포는 peri-infarct 영역에서 검출되었다. 주입된 부위 주변의 경외 지역에서 생존 셀이 발견되지 않았습니다. 이전 연구는 또한 이식 후 경색 심근에서 줄기 세포의 극히 작은 부분을 발견했다18,,19,,20,,21. 내트라메료 심근 투여 중 세포 손실은 실험 결과에 영향을 줄 수 있습니다. 관리 방법을 개선하고 체류율을 높이는 방법은 향후 연구에서 명확히 해야 합니다.
안전, 특히 부정맥 발생은 세포 기반 치료법을 가진 임상 사례와 관련된 또 다른 중요한 관심사입니다. 최근 연구는 인간 배아 줄기 세포(hESC)의 인트라미카르탈 투여가 자발적인 비지속성 심실 타키야르리듬(4)의 발생률을 증가시키는 것으로 나타났습니다.4 우리의 포스트 MI HF 돼지 모델에서, 맥박 조정기에서 원격 측정 모니터링에 의해 기록 된 자발적인 비 지속성 심실 tachyarrhythmia (속도 >180 bpm 및 gt;12 비트)의 발생률은 MI 유도 후 25 %였지만 지속적인 VT는 쉽게 유도 될 수 있었습니다 (80%). 이 연구에서, 갑작스런 죽음의 부각은 hiPSC-MSC 행정의 유무에 관계없이 변경되지 않습니다. 더욱이, hiPSC-MSC 이식은 심실 부정맥에 대한 감수성을 줄이거나 증가시키기 위해 근본적인 심근 기판을 수정하지 않았다. 이 결과는 큰 동물 만성 HF 모형이 세포 안전 평가를 위해 사용될 수 있었다는 것을 건의합니다.
감염과 출혈의 회피는 성공적인 동물 모형 설립에 가장 중요합니다. 출혈의 위험을 줄이기 위해 관상 동맥과 심장 정맥에 손상을 피하기 위해주의를 기울여야합니다. 두 동물이 심한 감염으로 사망함에 따라 적절한 수술 후 의료 전략이 도움이 될 것입니다. 여기서, 우리는 아래와 같이 수술 후 의료 전략을 제공합니다 : 근육으로 엔로플로스카신 (7.5 mg / kg, SID) 및 부프레노르핀 (0.02 mg / kg, BID)과 구두 투여 암옥시 실린 / 클라불란 산 (12.5mg / kg, SID) 및 카프로펜 (2 mg / kg, SID) 및 카프로펜 (2 mg/ kg, SID) 및 카프로펜 (2 mg/ kg, SID) 및 카프로펜 (2 mg/ kg) 및 카프로펜 (2 mg/kg) 및 카프로펜 (2 mg/kg) 및 카프로펜 (2 mg/ kg) 및 카프로펜 (2 mg/ kg) 및 카프로펜 (2 mg/kg) 및 카프로펜 (1 주일 후 통증 완화)
요약하자면, 현재의 방법은 세포 기반 치료법에 대한 심부전의 안정적이고 재현 가능한 임상적으로 관련된 대형 동물 모델을 제공한다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 동물 실험 중 뛰어난 기술 적 지원에 대한 알프레다와 쿵탁 정을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| Amiodarone | Mylan | - | - |
| Anaesthetic machines and respirator | Drager | Fabius plus XL | - |
| Angiocath | Becton Dickinson | 381147 | - |
| Anti-human nuclear antigen | abcam | ab19118 | - |
| Axio Plus image capturing system | Zeiss | Axioskop 2 PLUS | Axioskop 2 plus |
| AxioVision Rel. 4.5 software | Zeiss | - | - |
| Baytril | Bayer | - | enrofloxacin |
| Betadine | Mundipharma | - | - |
| CardioLab Electrophysiology Recording Systems | GE Healthcare | G220f | - |
| Culture media | MesenCult | 05420 | - |
| Cyclosporine | Novartis | - | - |
| Defibrillator | GE Healthcare | CardioServ | - |
| Dorminal | TEVA | - | - |
| Echocardiographic system | GE Vingmed | Vivid i | - |
| EchoPac software | GE Vingmed | - | - |
| Electrophysiological catheter | Cordis Corp | - | - |
| Embozene Microsphere | Boston Scientific | 17020-S1 | 700 μm |
| Endotracheal tube | Vet Care | VCPET70PCW | Size 7 |
| Ethanol | VWR chemicals | 20821.33 | - |
| Formalin | Sigma | HT501320 | 10% |
| IVC balloon Dilatation Catheter | Boston Scientific | 3917112041 | Mustang |
| JR4 guiding catheter | Cordis Corp | 67208200 | 6F |
| Lidocaine | Quala | - | - |
| Mersilk | Ethicon | W584 | 2-0 |
| Metoprolol succinate | Wockhardt | - | - |
| Microtome | Leica | RM2125RT | - |
| Mobile C arm fluoroscopy equipment | GE Healthcare | OEC 9900 Elite | - |
| Pacemaker | St Jude Medical | PM1272 | Assurity MRI pacemaker |
| Pacemaker generator | St Jude Medical | Merlln model 3330 | - |
| Pressure-volume catheter | CD Leycom | CA-71103-PL | 7F |
| Pressure–volume signal processor | CD Leycom | SIGMA-M | - |
| Programmable Stimulator | Medtronic Inc | 5328 | - |
| PTCA Dilatation balloon Catheter | Boston Scientific | H7493919120250 | MAVERICK over the wire |
| Ramipril | TEVA | - | - |
| Sheath introducer | Cordis Corp | 504608X | 8F, 9F, 12F |
| Steroid | Versus Arthritis | - | - |
| Temgesic | Nindivior | - | buprenorphine |
| Venous indwelling needle | TERUMO | SR+OX2225C | 22G |
| Vicryl | Ethicon | VCP320H | 2-0 |
| Xylazine | Alfasan International B.V. | - | - |
| Zoletil | Virbac New Zealand Limited | - | tiletamine+zolezepam |
참고문헌
- Mozaffarian, D., et al. Heart disease and stroke statistics-2015 update: a report from the American Heart Association. Circulation. 131, e29(2015).
- Hospital Authority. Hospital Authority Statistical Report 2013. , Hong Kong. (2013).
- Cung, T. T., et al. Cyclosporine before PCI in Patients with Acute Myocardial Infarction. The New England Journal of Medicine. 373 (11), 1021-1031 (2015).
- Liao, S. Y., et al. Proarrhythmic risk of embryonic stem cell-derived cardiomyocyte transplantation in infarcted myocardium. Heart Rhythm. 7, 1852-1859 (2010).
- Liao, S. Y., et al. Overexpression of Kir2.1 channel in embryonic stem cell-derived cardiomyocytes attenuates posttransplantation proarrhythmic risk in myocardial infarction. Heart Rhythm. 10, 273-282 (2013).
- Liu, Y., et al. Thoracic spinal cord stimulation improves cardiac contractile function and myocardial oxygen consumption in a porcine model of ischemic heart failure. Journal of Cardiovascular Electrophysiology. 23, 534-540 (2012).
- Liao, S. Y., et al. Improvement of Myocardial Function Following Catheter-Based Renal Denervation in Heart Failure. JACC: Basic to Translational Science. 2 (3), 270-281 (2017).
- Liao, S. Y., et al. Remodelling of cardiac sympathetic re-innervation with thoracic spinal cord stimulation improves left ventricular function in a porcine model of heart failure. Europace. 17 (12), 1875-1883 (2015).
- Daehnert, I., Rotzsch, C., Wiener, M., Schneider, P. Rapid right ventricular pacing is an alternative to adenosine in catheter interventional procedures for congenital heart disease. Heart. 90 (9), 1047-1050 (2004).
- Hála, P., et al. Tachycardia-Induced Cardiomyopathy as a Chronic Heart Failure Model in Swine. Journal of Visualized Experiments. (132), e57030(2018).
- Santoso, T., et al. Endomyocardial implantation of autologous bone marrow mononuclear cells in advanced ischemic heart failure: a randomized placebo-controlled trial (END-HF). Journal of Cardiovascular Translational Research. 7, 545-552 (2014).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network. Effect of intracoronary delivery of autologous bone marrow mononuclear cells 2 to 3 weeks following acute myocardial infarction on left ventricular function: the LateTIME randomized trial. Journal of the American Medical Association. 306, 2110-2119 (2011).
- Traverse, J. H., et al. Cardiovascular Cell Therapy Research Network (CCTRN). Effect of the use and timing of bone marrow mononuclear cell delivery on left ventricular function after acute myocardial infarction: the TIME randomized trial. Journal of the American Medical Association. 308, 2380-2389 (2012).
- de Jong, R., Houtgraaf, J. H., Samiei, S., Boersma, E., Duckers, H. J. Intracoronary stem cell infusion after myocardial infarction. A meta-analysis and update on clinical trials. Circulation: Cardiovascular Interventions. 7, 156-167 (2014).
- Nowbar, A. N., et al. DAMASCENE writing group. Discrepancies in autologous bone marrow stem cell trials and enhancement of ejection fraction (DAMASCENE): weighted regression and meta-analysis. British Medical Journal. 348, g2688(2014).
- Kanelidis, A. J., Premer, C., Lopez, J., Balkan, W., Hare, J. M. Route of Delivery Modulates the Efficacy of Mesenchymal Stem Cell Therapy for Myocardial Infarction: A Meta-Analysis of Preclinical Studies and Clinical Trials. Circulation Research. 120 (7), 1139-1150 (2017).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112 (9 Suppl), I150-I156 (2005).
- Hu, X., et al. A Large-Scale Investigation of Hypoxia-Preconditioned Allogeneic Mesenchymal Stem Cells for Myocardial Repair in Nonhuman Primates: Paracrine Activity Without Remuscularization. Circulation Research. 118, 970-983 (2016).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Martens, A., et al. Substantial early loss of induced pluripotent stem cells following transplantation in myocardial infarction. Artificial Organs. 38, 978-984 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538, 388-391 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유