Method Article
Sabit Görüntüleme prometafaz ve Metafaz Mayoz ve I Teknikleri
Bu Makalede
Özet
We present protocols for the collection, preparation, and imaging of mature Drosophila oocytes. These methods allow the visualization of chromosome behavior and spindle assembly and function during meiosis.
Özet
Chromosome segregation in human oocytes is error prone, resulting in aneuploidy, which is the leading genetic cause of miscarriage and birth defects. The study of chromosome behavior in oocytes from model organisms holds much promise to uncover the molecular basis of the susceptibility of human oocytes to aneuploidy. Drosophila melanogaster is amenable to genetic manipulation, with over 100 years of research, community, and technique development. Visualizing chromosome behavior and spindle assembly in Drosophila oocytes has particular challenges, however, due primarily to the presence of membranes surrounding the oocyte that are impenetrable to antibodies. We describe here protocols for the collection, preparation, and imaging of meiosis I spindle assembly and chromosome behavior in Drosophila oocytes, which allow the molecular dissection of chromosome segregation in this important model organism.
Giriş
The study of meiosis is sometimes described as the "genetics of genetics". This is because the fundamental properties of chromosome inheritance and independent assortment are carried out through the segregation of chromosomes during gamete production. An important demonstration of the chromosome theory of inheritance came in 1916 from the work of Calvin Bridges in Drosophila melanogaster1. This and other classical genetics studies in Drosophila contributed greatly to our understanding of genetics. Cytological examination of meiotic chromosomes in Drosophila oocytes, however, has been challenging. This is primarily because immunofluorescence of late-stage Drosophila oocytes, when the spindle assembles and chromosomes are oriented for segregation, is hampered by the presence of membranes that render the oocyte impenetrable to antibodies.
Despite this challenge, Drosophila oocytes remain an attractive model for the study of chromosome behavior and spindle assembly. This is because of the powerful genetic tools available in Drosophila, but also because the oocytes arrest at metaphase I, when the chromosomes are oriented and the spindle is fully formed. This facilitates the collection and examination of large numbers of oocytes at this important stage of cell division. In addition, a simple model organism that is amenable to genetic manipulation for the study of oocyte chromosome segregation can provide an important contribution to our understanding of human reproductive health. Errors in chromosome number are the leading genetic cause of miscarriage and birth defects in humans2. A majority of these errors can be traced to the oocyte and are correlated with increasing maternal age. The average age of mothers in the U.S. has been increasing, making this a major public health concern.
We describe here methods for the cytological examination of Drosophila oocytes, including a demonstration of how to remove the oocyte membranes. These methods are modifications of protocols first described by Theurkauf and Hawley3, Zou et al.4, and Dernburg et al.5. We also include methods for the enrichment of different stages of oocytes, based on a protocol first described by Gilliland et al.6. Finally, we add instructions for the drug treatment of Drosophila oocytes. Together, these methods allow the cytological investigation of oocyte chromosome segregation and spindle assembly in Drosophila.
Protokol
Not: Aksi belirtilmediği sürece, işlemler oda sıcaklığında gerçekleştirilir. Sıcaklık kontrollü inkübatör sinek yetiştirme için sıcaklıkları korumak için kullanılan ve aksi belirtilmediği sürece haçlar vardır.
1. hazırlıklar
- Sinekler hazırlayın.
- oosit koleksiyonları prometafaz zenginleştirilmiş.
- Net yetişkin sağlıklı, genç stok veya çapraz kültürlerinden uçar. 25 ° C'de iki gün için yaş şişe.
Not: Genellikle, iki sağlıklı şişe yeterli olacaktır, daha çok bazı çapraz kültürler için gerekli olabilir, ancak. - İki gün sonra, şişe (bu noktada, 0 ila 2 gün geçmiş) ~ 100 ila 300 kadın toplar. kadın bakire olması gerekmez. Bir şişenin yanına maya hamur dab ekleyin ve 30 kadın ve mayalı şişeleri içine 10 ila 15 erkek her koyun. 25 ° C'de iki gün için yaş şişeler.
- Net yetişkin sağlıklı, genç stok veya çapraz kültürlerinden uçar. 25 ° C'de iki gün için yaş şişe.
- Oosit Koleksiyonlar metafaz zenginleştirilmiş.
- Hisse senedi veya çapraz KÜLTÜR gelen ~ 100 ila 300 kadın toplamakes. Bir şişenin yanına maya hamur dab ekleyin ve 30 kadın yer mayalı şişe içine (ilave hiçbir erkek ile birlikte) her biri. 25 ° C 'de üç ila beş gün için yaş şişeler.
- oosit koleksiyonları prometafaz zenginleştirilmiş.
- Çözümler hazırlayın.
Not: Aksi belirtilmediği sürece, Solutions, oda sıcaklığında süresiz depolanabilir.- Robb tampon Modifiye hazırlama (5x): 500 mM HEPES, 500 mM sukroz, 275 mM sodyum asetat, 200 mM potasyum asetat, 50 mM glukoz, 6 mM magnezyum klorid, 5 mM kalsiyum klorid. 7.4 pH değerini elde etmek için potasyum hidroksit: 8 sodyum hidroksit: 10 K 11 kullanın. filtrasyon ile sterilize; kaynatmayın. -20 ° C'de saklayın. ~ 1x Robb'un oosit başına hazırlık 200 ml hazırlamak için gerekli olarak çözülme.
- Tespit Çözümleri.
- Seçenek # 1: formaldehit / heptan tespit hazırlayın. Sabitleme tampon hazırlayın: 1x Fosfat tamponlu tuz (PBS) artı 150 mM sukroz. kullanmak için, 687,5 ul Sabitleme Tampon ve 312,5 ul% 16 formaldehit ile taze yapmakoosit hazırlık başına.
DİKKAT: Davlumbaz formaldehit çözümlerini kullanırken eldiven giyin. kurumsal kurallarına göre bertaraf edilmelidir. - Seçenek # 2: formaldehit / kakodilat tespit hazırlayın. Düzeltme Mix hazırlayın: 250 mM sükroz, 100 mM potasyum asetat (pH 7.5), 25 mM sodyum asetat (pH 7.0) ve 25 mM EGTA (pH 8.0). kullanmak için, 400 ul taze karışımı saptamak yapmak 100 ul potasyum kakodilat (1 M, pH 7.2), ve oosit prep 500 ul% 16 formaldehid.
DİKKAT: Potasyum kakodilat Arsenik içerir.
- Seçenek # 1: formaldehit / heptan tespit hazırlayın. Sabitleme tampon hazırlayın: 1x Fosfat tamponlu tuz (PBS) artı 150 mM sukroz. kullanmak için, 687,5 ul Sabitleme Tampon ve 312,5 ul% 16 formaldehit ile taze yapmakoosit hazırlık başına.
- 1x PBS artı% 1 veya% 0.05 Triton X-100 PBS / Triton X-100 hazırlayın. 4 ° C'de saklayın.
- 1 x PBS, (ağ / hac)% 0.5 BSA ve% 0.1 Tween-20: PBS-Tween 20 Sığır Serum Albumin (BSA) (PTB) hazırlayın. bir hafta boyunca 4 ° C'de saklanabilir.
- Situ Hibridizasyon (FISH) Çözümleri floresan.
- Hazırlama 20X Sodyum klorür-sodyum sitrat (SSC): 3 M sodyum klorür ve 0.3 M sodyum sitrat.
- Hazırlama 2x SSC-Tween-20 (SSCT) 2X SSC artı% 0.1 Tween-20. oosit hazırlık başına taze ~ 20 ml olun.
- formamid çözümler hazırlayın: 2 x SSC,% 0.1 Tween-20, ayrıca formamid. 1 ml% 20 formamid, 0.5 mL% 40 formamid, ve oosit hazırlık başına 2 ml% 50 formamid, taze olun.
DİKKAT: Davlumbaz formamid çözümlerini kullanırken eldiven giyin. kurumsal kurallarına göre bertaraf edilmelidir. - (Ağırlık / hacim) 2X SSC,% 50 formamid,% 10 dekstran sülfat: hibridizasyon çözeltisi hazırlayın. 4 ° C'de saklayın.
- BALIK Probes.
- Order HPLC ile arıtma sahip oligonükleotid (dizileri için Tablo 1 'e bakınız) ve 5' flüoresan modifikasyonu (örneğin Cy3 veya Cy5) istenen. 50 ng / | il Tris-EDTA (TE) içinde süspanse edin.
NOT: Her zaman ışık maruz oligos koruyun.
- Order HPLC ile arıtma sahip oligonükleotid (dizileri için Tablo 1 'e bakınız) ve 5' flüoresan modifikasyonu (örneğin Cy3 veya Cy5) istenen. 50 ng / | il Tris-EDTA (TE) içinde süspanse edin.
Geç evre Drosophila Oosit 2. Koleksiyonu
- Gibi plastik ve cam sopa intakt membranlı Drosophila oositlerin öncesi kat bir 5 ml tüp ve PTB ile oosit hazırlık başına bir süspanse içinde.
- karbon dioksit ile tüm ~ 100 ila 300 mayalı sinekler uyutmak ve ~ 100 ml 1x Robb'un Tamponu içeren bir blender ekleyin. Darbe üç kez (~ 1 sn her). aktivasyonunu önlemek için NOT: Alternatif olarak, oosit dişilerden el-disseke edilebilir. Bu yöntemin avantajı, daha az kadın gerektirmesidir. Ancak, bakım hipoksi 7 ile bağlantılı bozulmaları önlemek için sadece birkaç dakikaya kadar karbon dioksite maruz sınırlamak için dikkat edilmelidir.
- Büyük beden parçalarını kaldırmak için 250 ml behere büyük örgü (~ 1.500 mm) süzülür. Birçok bozulmamış karnı yine örgü, yeniden eziyet ek Robb'un Tampon kullanarak malzeme ve filtre üzerinde kalırsa. Daha sonra mümkün olduğunca büyük vücut parçaları gibi birçok kaldırarak, üst tabaka aspire ~ 2 dk dinlendiriniz.
- Fi250 ml'lik bir cam kaba, küçük elek (~ 300 um) vasıtasıyla ltresi. Ek Robb adlı ve kaplamalı Pasteur pipet kullanarak ilk beher dışına kalan oosit durulayın. yerleşmek ~ 3 dk edelim; oosit dışarı razı olacak. Aspire off ama ~ 10 ml.
- kaplanmış 5 ml tüp içine sığacak kadar 10 ml kadar dökün. , Yerleşmek sıvı kaldırmak ve kalanı tekrar edelim. Ek Robb adlı ve kaplamalı Pasteur pipet kullanarak kaptan dışarı kalan oosit durulayın. 3-5 dakika ~ 5 ml tüp dinlendiriniz.
3. İlaç Tedavileri (İsteğe bağlı)
- Coat her oosit hazırlık için PTB ile ikinci 5 ml tüp. 1 ml Robb birbirlerinin oosit hazırlık için, her (Tablo 2), uygun bir çözücü (kontrol) ya da ilaç ekleyin.
- İkinci kaplanmış 5 ml tüp içine bölünmüş oositler. , Yerleşmek Let sıvı kaldırmak ve bir tüp içine 1 ml Robb en artı çözücü eklemek ve 1 ml Robb en artı ilaç ikinci tüpe. Ilaç tedavisi (Tablo 2) uygun zaman miktarı için Nutate. Let yerleşmek.
4. Sabitleme
- Aspire tüm sıvı ve hemen 1 ml Fix ekleyin.
- Seçenek # 1: Formaldehit / heptan sabitleme (Fixation Tampon artı% 5 formaldehit).
- Bir nutator 2.5 dakika için düzelt. 1 mi heptan ve 1 dakika vorteksleyin ekleyin. yerleşmek ~ 1 dk olsun.
- tüm sıvı çıkarın ve sonra PBS 1x 1 ml ekleyin. Vortex 30 sn. yerleşmek ~ 1 dk olsun.
- tüm sıvı çıkarın ve sonra 1x PBS ile tüp doldurun.
Not: Oositler hemen kullanılabilir ya da oda sıcaklığında birkaç saat boyunca nutator tutulabilir.
- Seçenek # 2: Formaldehit / kakodilat sabitleme (Mix artı% 8 formaldehit ve 100 mM kakodilat Fix).
- Bir nutator 6 dakika düzelt. 2 dakika dinlendiriniz. sıvı çıkarın ve sonra 1x PBS ile tüp doldurun.
Not: Oositler hemen kullanılabilir ya da oda sıcaklığında birkaç saat boyunca nutator tutulabilir.
- Bir nutator 6 dakika düzelt. 2 dakika dinlendiriniz. sıvı çıkarın ve sonra 1x PBS ile tüp doldurun.
5. Membranlar çıkarma ( "Rolling")
- kaplanmış yeniden süspanse kullanarak, bir cam slayt buzlu (kumlanmış) kısmına ~ 500 ila 1000 oosit ekleyin. tüm vücut parçaları ve yabancı madde kullanarak forseps çıkarın. oosit kurumasına izin vermeyin; gerektiğinde 1x PBS ilave edin.
- Periyodik mikroskop altında ilerleyişini kontrol (. En iyi şekilde çalışır oosit genelinde lamel kenarına sürükleyerek) kaldırılır tüm membranların kadar oosit ve yavaşça "roll" oosit üstünde bir lamel yerleştirin gerektiğinde daha 1x PBS ekledi. oosit yok edecek çok fazla basınç olarak özen gösterin.
NOT: immünfloresans sadece, (immünofloresan olan veya olmayan) FISH için Adım 6 ile devam için, Adım 7 ile devam edin.
Drosophila OOSİT 6. Antikor Boyama
- Ekstraksiyon ve Engelleme
- ~ 15 mi, PBS /% 1 Triton X-100 ihtiva eden 15 ml konik bir tüp içine haddelenmiş oosit durulayın. en az 1.5 saat için bu çözüm ve en fazla 2 saat içinde Nutate oositler.Bu adım, antikor nüfuz etmesini sağlar.
- oosit ~ 2 dk dinlendiriniz. Mümkün olduğunca çok sayıda membran ile birlikte sıvı çıkarın, daha sonra PBS ekleme /% 0.05 Triton X-100.
NOT: Zarlar haddelenmiş oosit daha yavaş geçer. - oosit ~ 2 dk yerleşmek izin, sonra tüm ama ~ 1 ml sıvı kaldırmak. Transfer oosit 1.5 ml tüp mezun oldu ve kalan sıvı çıkarın. 1 saat boyunca bloke etmek ve nutate 1 mi ATB ekleyin.
- antikor Boyama
- Embriyoların karşı sekonder antikor Ön emilim.
Not: Bu adım, Drosophila proteinleri ile spesifik olmayan antikor reaksiyonları arka plan boyaması ortadan kaldırır.- Toplayın ve tipik prosedür 8 uyarınca Drosophila embriyolar (~ 25 ul) düzeltmek. -20 ° C'de metanol içinde depolayın.
- , Embriyolardan, metanolün çıkması, 15 dakika boyunca 800 ul metanol artı PBS 1X 200 ul ve nutate ekleyin. süpernatan 500 ul çıkarın ve PBS 1X 500 ul ile değiştirin. Daha sonra 15 dakika boyunca nutate. (Yıkar ~ 1 saat olmak üzere toplam) iki kez tekrarlayın ve sonra PTB bitirmek.
Not: Embriyolar hemen kullanılabilir ya da oda sıcaklığında birkaç saat boyunca nutator tutulabilir. - , Sıvı çıkarın oosit hazırlık başına 200 ul PTB ile doldurun ve uygun dilüsyonlarda floresan etiketli sekonder antikor ekleyin (son hacim 300 ul olacağını göz önünde bulundurarak;. Adım 7.4) Nutate 4 ° C'de gece boyunca (tercih edilir) ya da 3 ila 4 saat boyunca oda sıcaklığında karıştırılmıştır.
Not: önceden absorbe antikorlar Aşama 6.2.4 kullanılacaktır.
NOT: mümkün olduğu kadar floresan antikorlar eklenmiştir kez karanlıkta örnekleri tutun.
- , Oosit sıvıyı çıkarmak 300 ul PTB ile doldurun ve uygun dilüsyonlarda primer antikorlar ekleyin. 4 ° C'de bir gece boyunca Nutate (tercih edilir) ya da 3 ila 4 saat boyunca oda sıcaklığında karıştırılmıştır.
- Yıkama 1 ml PTB 15 dakika her biri için dört kez oosit.
- Kaldıroosit, sıvı, embriyolar (sekonder antikor önceden absorbe) üstte yüzen madde 200 ul ekle. Ardından 300 ul PTB ile doldurun. 3 ila 4 saat (tercihen) veya gece boyunca 4 ° C'de oda sıcaklığında Nutate.
- 1 mi PTB ile 15 dakika boyunca bir kez oosit yıkayın, sıvıyı ayırın. Daha sonra, 7 dakika boyunca 0.5 ul Hoechst 33342 ve 500 ul PTB ve nutate ekleyin.
- 1 mi PTB ile her biri 15 dakika için iki kere oosit yıkayın.
Not: Oositler hemen slayt üzerine monte edilebilir veya görüntüleme için hazır olana kadar 4 ° C'de PTB depolanabilir.
- Embriyoların karşı sekonder antikor Ön emilim.
7. BALIK (Above Adım 5 Devam)
- ~ 15 ml 2x SSCT içeren 15 ml konik tüp içine yuvarlandı oosit durulayın. oosit ~ 2 dk dinlendiriniz. 0.5 ml sıvı mümkün olduğu kadar çok membran ile birlikte tüm ama ~ çıkarın.
NOT: Zarlar haddelenmiş oosit daha yavaş geçer. - Transferi 0.5 ml tüp oosit ve kalan sıvıyı çıkarın. Arda eklemek ve 500 ul kaldırmak% 20,% 40,% 50 formamid çözeltiler, her çözelti içinde 10 dakika için nutating.
NOT: Oositler formamid yüksek oranları ile yavaş geçer. - daha sonra 1 5 saat boyunca 37 ° C'de 500 ul% 50 formamid çözeltisi ve nutate ekleyin sıvıyı ayırın.
NOT: Daha uzun inkubasyon daha sonda penetrasyon ile sonuçlanır. - En fazla 100 ° den ul oosit bırakarak sıvı çıkarın ve 36 ul hibridizasyon çözeltisi artı prob 2 ul (50 ng / | il) ve 2 ul su veya 2. prob (Tablo 1) 2 ul ekle.
- gece boyunca 37 ° C'de su banyosunda kuluçkaya bırakılır, ardından 3 dakika boyunca (FISH için) ya da 20 dakika (balık artı immünofloresan), 80 ° C, 91 ° C de inkübe edilir.
Not: Bu adımlar, bir PCR gerçekleştirilebilir. - sıvı çıkarmayın. 1 saat boyunca 37 ° C'de 500 ul% 50 formamid çözeltisi ve nutate ekleyin.
- , Sıvı kaldırmak, yerleşmek Let 500 ul% 50 formamid çözüm ekleyin, bir1 saat süre ile 37 ° C 'de D nutate.
- , Sıvının çıkması, yerleşmek izin 10 dakika için oda sıcaklığında 500 ul% 20 formamid çözeltisi ve nutate ekleyin.
- (Tekrarlama birkaç kez ters, sonra sıvı ekleyin kaldır, yerleşmek izin verin.) 500 ul 2x SSCT üç hızlı yıkar gerçekleştirin yerleşmek edelim, sıvı kaldırmak, daha sonra 4 saat boyunca 500 ul ATB ve nutate ekleyin.
8. Antikor Boyama FISH sonra
- , Oosit sıvıyı çıkarmak 300 ul PTB ile doldurun ve FITC konjuge 10 ul anti-α-tubulin antikor ekleyin. Seçenek olarak ise, diğer antikorlar, yukarıda protokol izlenerek, kullanılabilir. gece boyunca, oda sıcaklığında Nutate.
- daha sonra, 7 dakika boyunca 0.5 ul Hoechst 33342 ve 500 ul PTB ve nutate ekleyin sıvının çıkması, 500 ul PTB ile 15 dakika boyunca bir kez oosit yıkayın.
- 500 ul PTB ile her biri 15 dakika için iki kere oosit yıkayın.
Not: Oositler hemen slayt üzerine monte edilebilir ya da hazır olana kadar 4 ° C'de PTB depolanabilirgörüntüleme. mümkün olduğu kadar floresan antikorlar eklenmiştir kez karanlıkta oosit tutun.
| Tekrarlama Ad | Kromozom | Oligo Sırası * |
| 359 | X | GGGATCGTTAGCACTGGTAATTAGCTGC |
| AACAC | 2 | AACACAACACAACACAACACAACACAACACAACACAACAC |
| dodeka | 3 | CCCGTACTGGTCCCGTACTCGGTCCCGTACTCGGT |
| 1.686 | 2 + 3 | AATAACATAGAATAACATAGAATAACATAG |
| AATAT | 4 (+ Y) | AATATAATATAATATAATATAATATAATAT |
| * Eric Joyce, kişisel iletişim, Sullivan ve ark diğer dizilerden 359 dizisi. 8 | ||
Tablo 1: Drosophila sentromerine tekrarlar için FISH probları.
| İlaç | çözücü | stok konsantrasyonu | Nihai konsantrasyon | Tedavinin zamanı | Efekt |
| kolşisin | etanol | 125 mM | 150 uM | 10 dakika ya da 30 dakika | olmayan kinetochore (10 dakika) 9 veya Tüm (30 dakika) mikrotübül destabilize |
| paklitaksel | DMSO | 10 mM | 10 uM | 10 dk | mikrofona stabilizerotubules |
| Binucleine 2 | DMSO | 25 mM | 25 uM | 20 dakika | Aurora B kinaz 10 inhibe |
Tablo 2: İlaç tedavisi.
Sonuçlar
Burada tarif edilen metodlar mayoz üç aşamadan (Şekil 1) temsil eden geç evre Drosophila oosit toplama neden olur. Profaz Oositler karyosome (Şekil 1A) çevreleyen bölgede tübülin sinyal eksikliği ile görünür çekirdek zarfına varlığı ile ayırt edilir. Prometafaz nükleer zarf arıza sırasında iğ monte ediyor sonra dönemdir. Prometafaz sırasında karyosome, farklı bir şekil alır, ana karyosome kütlesi (Şekil 1B) ayrı 4. kromozomlar ile genellikle ince uzun olma. Prometafaz Drosophila oosit doğal yumurtlama kadar tutuklama hangi metafaz, ile son bulur. Metafaz oosit olarak, karyosome yuvarlak şekil (Şekil 1C) içine geri aldı.
Biz burada m açıklamakö n- tem prometafaz veya metafaz ya oosit için zenginleştirmek için Drosophila kadın yumurtlama hızını değiştirmek için. Neredeyse tamamen yumurta döşeme ortadan bakire Drosophila kadın, gelen metafaz zenginleştirilmiş koleksiyonları veya koleksiyon, öncelikle yuvarlak karyosome (Şekil 2B) gösterirken prometafaz zenginleştirilmiş koleksiyonlardan oosit sık uzun karyosome (Şekil 2A) göstermektedir. İlginçtir ki, prometafaz zenginleştirilmiş koleksiyonları da genellikle Drosophila prometafaz ve metafaz arasındaki karyosome ve mil değişimi hem 9 oosit düşündüren, çok daha sağlam iğ göstermektedir.
Şekil 3 Burada açıklanan iki Protokoller temsilcisi görüntüleri gösterir. , CENP-C (sentromerlere göstermek için) ve INCENP (merkezi mili göstermek için) oosit kullanılmıştır α-tubulin karşı antikorlar (milini göstermek için) FO sabitlenmişrmaldehyde / heptan (Şekil 3A). 2. kromozom (AACAC) ve 3. kromozom (dodeka) tekrarlayan sentromerik dizileri için sondalar formaldehid / kakodilat ve sabit oosit kullanılmıştır FISH protokolü (Şekil 3B) 'e uygun bir α-tubulin antikor ile eş-boyandı. dodeka prob kromozomun başına tek bir odak noktası olarak görünürken AACAC probu gibi çeşitli kümelenmiş odaklar görünür. 10 dakika süre ile 150 uM kolşisin ile muamele Oositler formaldehid / heptan (Şekil 3C) ile tespit edildi. Bu tedavi sentromer etiketli odaklar DNA'yı temas tüm mikrotübül hangi sonuçları, en olmayan kinetochore-Mikrotübülleri ortadan kaldırır. Oositler mili mikrotübüller (Şekil 3D) 10 uM sitoplazmada 10 dakika göster aşırı mikrotübüllerin için paklitaksel, ancak çok az etki ile muamele edilmiştir. 20 dakika boyunca 25 mM Binucleine 2 ile tedavi oosit Aurora B kinaz gösterisi tam kaybı engellemek içinMil mikrotübüller (Şekil 3E).
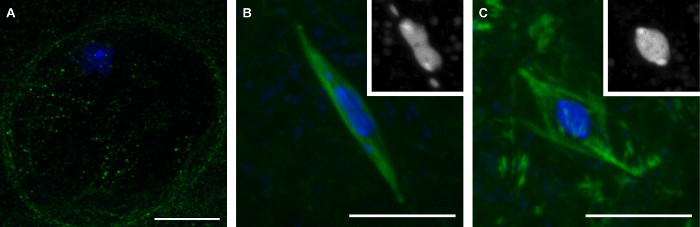
Şekil 1: Olgun Drosophila oosit Üç aşamaları:. Profaz, prometafaz ve metafaz profaz Drosophila oosit Konfokal görüntüler (A), prometafaz (B) ve mayoz I. DNA metafaz (C) mavi gösterilir ve tübülin olduğunu birleştirilmiş görüntülerde yeşil gösterilen. (B) ve (C) 'de Insets beyaz DNA göstermektedir. Ölçek çubukları 10 mikron =. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 2:Drosophila oositlerin Prometaphase- vs metafaz zenginleştirilmiş koleksiyonları. Prometafaz zenginleştirilmiş (A) Drosophila oosit Konfokal görüntüler ya da metafaz-zenginleştirilmiş (B) koleksiyonları. DNA mavi gösterilir ve tübülin yeşil gösterilir. Ölçek çubukları 10 mikron =. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
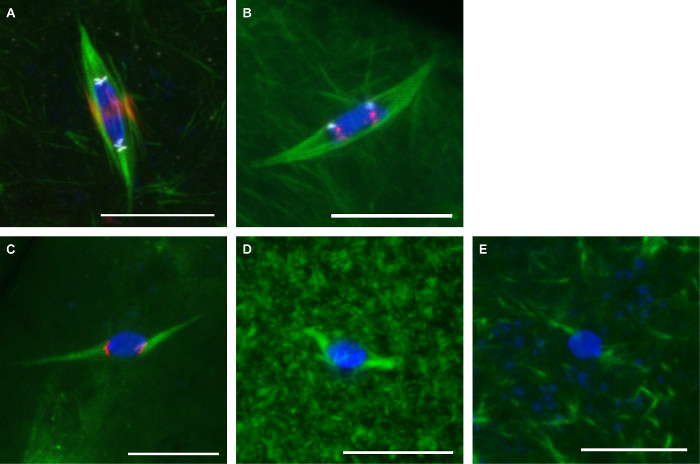
Şekil 3: Drosophila oositlerin Antikor boyama, FISH ve ilaç tedavileri yeşil mavi DNA ve tubulin ile Drosophila oosit Konfokal görüntüler.. Ölçek çubukları 10 mikron =. Formaldehyd (A) immünofloresanskırmızı INCENP (merkez mili) ve beyaz CENP-C (sentromerler) e / heptan sabitleme. Beyaz gösterilen kırmızı ve Dodeca gösterilen AACAC ile formaldehit / kakodilat sabitleme (B) FISH. Kırmızı gösterilir CENP-C ile 10 dakika süreyle 150 uM kolşisin ile (C) tedavisi. 20 dakika (E) için 10 dakika (D) veya 25 uM Binucleine 2 10 mcM paklitaksel ile tedavi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
Drosophila Oositler evreleme
bir ince uzun karyosome genellikle metafaz oositlerden prometafaz ayırt karyosome şeklini kullanarak, prometafaz oositlerinde görülmekle birlikte sorunlu olabilir. prometafaz sırasında, karyosome, yuvarlak bir şekil olarak başlar uzar ve daha sonra oosit metafaz tutuklama yaklaştıkça bir yuvarlak şekle geri çekilir. Bu, pek çok prometafaz oositler uzatılmış karyosome yok demektir. mutant ya da ilaçla tedavi oosit incelendiğinde ek olarak, karyosome şekil oosit sahneye bu yöntemi kullanarak engelleyen, etkilenebilir. Diğer belirteçler bu aşamalar şu anda mevcut değildir ayırt etmek, çünkü biz prometafaz veya metafaz ya oosit için zenginleştirmek için Drosophila kadın yumurtlama hızını işlemek için yukarıda açıklanan yöntemi kullanın. mantığı olduğunu oosit prometafaz zaman belirli bir miktar ve zaman arr belirsiz bir miktarda harcama eğeryavaş yumurta döşeme metafaz için zenginleştirecek ise yumurtlama, daha sonra hızlı bir yumurtlama kadar sürer metafaz ested, prometafaz oosit daha yüksek bir yüzdesi doğru çarpık olacaktır. Bakire dişi toplamak veya Gilliland ve arkadaşları tarafından tarif edildiği gibi, 2 gün daha kısa bir zaman dilimi içinde kadın toplar. 6 için gerekli olan çaba miktarı, prometafaz oositlerinde kayda değer bir artışı ile ödüllendirilir değildir. Sırt uzantıları membranlar ile birlikte kaldırılır olarak bu protokol ile hazırlanan oosit sahneye dorsal uzantıları kullanmak da mümkün değildir. Bu yöntemi kullanarak% 100 kesinlik ile bireysel oosit sahneye mümkün olmasa da, elde edilen veriler prometafaz zenginleştirilmiş ya da metafaz-zenginleştirilmiş koleksiyonlar bu farklı aşamalarında 9 hakkında sonuçlara varmak için birlikte alınabilir.
Onlar yumurtalık geçmesine kadar Drosophila oosit döllenmiş değildir; Bu nedenle, oositler th için toplanan içinBurada anlatılan e protokolleri yumurtlama öncesi alınan oosit incelemek, bu oosit döllenmiş olmamıştır. yumurtalık ile Geçiş da aktive ederek ve hücre döngüsü ilerlemesini sürdürmek için oosit neden olur. Ben 11,12 var, ama bu protokolün kapsamı dışındadır metafaz sonra Yöntemleri hücre döngüsü aşamalarını incelemek için.
Sabitleme Yöntemi Hususlar
Biz geç evre Drosophila oosit sabitlenmesi için iki ayrı yöntemler açıklanmaktadır. Formaldehid / kakodilat tespit metodunun ilk Theurkauf ve Hawley 3 ve formaldehid / heptan sabitleme yöntemi ile tanımlanan ilk Zou ve ark., 4 tarafından tarif edilmiştir. Buna ek olarak, üçüncü bir yöntem (metanol tespit) bazı 13 tarafından kullanılan, ancak burada açıklanan değildir. formaldehid / heptan sabitleme formaldehid / kakodilat kıyasla sonra oosit membran çıkarılması biraz daha zordur. Bu bağımlı olduğundan "yuvarlanan" dirlamel ve oosit ve formaldehit / heptan tespitin arasındaki sürtünme ile ilgili oosit daha kaygan hale getirir. biz denedim antikorların çoğunluğu için en iyi çalışır çünkü bu ilave zorluk rağmen, yeni antikorlar test tespit yönteminin bizim ilk tercihi formaldehit / heptan olduğunu. formaldehid / heptan sabitleme de başarılı olmasına rağmen, diğer yandan, esas olarak membran kaldırma kolaylığı için, FISH için formaldehit / kakodilat tespit tercih ederim. Bu yöntemlerin her ikisi de, metanol tespit daha oosit morfolojisi korumak ve bu nedenle yalnızca formaldehit-esaslı sabitleme yöntemlerine dirençli antikorların durumlarda metanol tespiti önerilir.
Burada anlatılan protokoller yani oosit membran kaldırılmasıyla, antikor penetrasyon mükellef olgun Drosophila oosit işlemek için etkili yöntemler göstermek için, sabit görüntüleme odaklanmak. Membran remo için alternatif yöntemlerval mümkündür (forseps 14 veya sonikasyon 13 kullanarak); Ancak, biz en verimli ve güvenilir bir yöntem olarak "yuvarlanan" bulmak. Canlı görüntüleme için teknikler de başka bir yerde 14-16 açıklanan ve bu protokol kapsamı dışındadır edilmiştir.
BALIK öneriler
Drosophila oositlerde BALIK ilk Dernburg ve ark., 5 tarafından tarif edilmiştir. Bu protokol yoğunlaştırılmış oosit kromozom prob hibridizasyon için en uygun koşulları sağlamak için tasarlanmış, ancak orijinal protokol immünofloresan için en uygun değildi. Yukarıda anlatılan yöntem öncelikle FISH gerçekleştirirken kullandığımız budur α-tubulin, antikor boyama geliştirmek için yaptık uyarlamalar içerir. 80 ° C ile denatürasyon adımı (adım 7.5) sıcaklığının düşürülmesi için diğer antikorlar için gerekli olabilir.
Burada listelenen sondalar içindirsentromer yakın heterokromatinli tekrarlayan diziler. Bu diziler oldukça tekrarlayıcı olduğundan, sondalar birden yerlere tavlama ve toplu sinyaller oldukça güçlüdür. yoğunlaştırılmış karyosome bulunan iken biz muhtemelen çünkü kromozomların benzersiz yapısı, ökromatin içinde dizileri için sondalar ile küçük bir başarı oldu.
Görüntüleme
Olgun Drosophila oosit çoğu organizmaların oosit gibi, büyük, tek hücrelerdir. Bu da tek bir çekirdek içeren sitoplazmada büyük hacimli olduğu anlamına gelir. Genellikle sadece korteks yakın dorsal uzantıları altında bulunan Neyse ki, aynı zamanda Drosophila bir karyosome olarak bilinen bu çekirdek, kolayca tespit edilebilir. dorsal uzantıları oosit membranların birlikte kaldırılır, ancak karyosome hala oosit kortekste küçük çimen bularak bulunabilir nerede ekleri once idi. En iyi görüntü bu hedefe karyosome yakın yerleştirir beri lamel bakan bu çimen ile monte edilmiş oosit elde edilir. öncesinde montaj için bu yönde oosit düzenlemek mümkün olsa da, biz rastgele birçok oosit monte ve sonra tercih edilen yönde olanlar için slayt aramak için tercih ediyorum.
gelecek Uygulamaları
Gelecekte güvenilir prometafaz I ve metafaz I iğ ayırt belirteçler tanımlamak için önemli olacaktır. daha güvenilir gibi aynı zamanda hazırlama sorunları var sahne zenginleştirilmiş oosit veya canlı görüntüleme, çok sayıda görüntüleme gibi daha emek yoğun alternatifleri, bağımlılığı azaltacak oosit sahne için güçlü olmak. Bu yöntem yeni araçlar değiştirmek veya gen ürünlerini nakavt kullanılabilir hale Drosophila genetik gelişmeler yararlanmak için kullanılabilecek temel bir yöntemdir. Bu yöntemleri içerirdoğrudan yeni ilaçlar veya hedeflenen bozulma stratejileri ile protein etkinliğini hedef. Buna ek olarak, bu yöntemler, öz değişmesine ait iğ görüntüleme bunlarla sınırlı değildir. oosit içindeki herhangi bir yapı, örneğin aktin hücre iskeletinin olarak, bu yöntemler kullanılarak analiz edilebilir.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
We thank Christian Lehner for providing the CENP-C antibody and Eric Joyce for recommendations on FISH. Work in the McKim lab was funded by a grant from NIH (GM101955).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 ml conical tubes | Various | ||
| 16% formaldehyde | Ted Pella, Inc. | 18505 | HAZARDOUS; once opened, discard after one month |
| 250 ml beakers | Various | ||
| 5 ml tubes | Various | ||
| active dry yeast | Various | mix with water to make a paste the consistency of peanut butter | |
| anti-α-tubulin antibody conjugated to FITC | Sigma | F2168 | clone DM1A |
| Binucleine 2 | Sigma | B1186 | HAZARDOUS |
| blender | Various | ||
| bovine serum albumin | Sigma | A4161 | |
| calcium chloride | Various | ||
| colchicine | Sigma | C-9754 | HAZARDOUS |
| coverslips | VWR | 48366-227 | No. 1 1/2 |
| dextran sulfate | Various | ||
| DMSO | Various | ||
| EGTA | Various | ||
| ethanol | Various | ||
| forceps | Ted Pella, Inc. | 5622 | Dumont tweezers high precision grade style 5 |
| formamide | Sigma | 47670-250ML-F | |
| glass slides | VWR | 48312-003 | |
| glucose | Various | ||
| graduated 1.5 ml tubes | Various | ||
| HEPES | VWR | EM-5330 | available from several venders |
| Hoechst 33342 | Various | ||
| magnesium chloride | Various | ||
| methanol | Various | ||
| large mesh (~1,500 µm) | VWR | AA43657-NK | variety of formats and other suppliers, 12 or 14 mesh |
| small mesh (~300 µm) | Spectrum labs | 146 424 | variety of formats, e.g., 146 422 or 146 486 |
| nutator | Various | ||
| Pasteur pipets | Various | ||
| potassium acetate | Various | ||
| Cacodylic acid | Sigma | C0125 | HAZARDOUS; alternatively, sodium cacodylate may be substituted |
| potassium hydroxide | Various | ||
| sodium acetate | Various | ||
| sodium chloride | Various | ||
| sodium citrate | Various | ||
| sodium hydroxide | Various | ||
| sucrose | Various | ||
| taxol (paclitaxel) | Sigma | T1912 | HAZARDOUS |
| Triton X-100 | Fisher | PI-28314 | |
| Tween 20 | Fisher | PI-28320 | |
| vortex | Various |
Referanslar
- Bridges, C. B. Non-disjunction as proof of the chromosome theory of heredity. Genetics. 1 (1), 1-52 (1916).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Theurkauf, W. E., Hawley, R. S. Meiotic spindle assembly in Drosophila females: behavior of nonexchange chromosomes and the effects of mutations in the nod kinesin-like protein. J Cell Biol. 116 (5), 1167-1180 (1992).
- Zou, J., Hallen, M. A., Yankel, C. D., Endow, S. A. A microtubule-destabilizing kinesin motor regulates spindle length and anchoring in oocytes. J Cell Biol. 180 (3), 459-466 (2008).
- Dernburg, A. F., Sedat, J. W., Hawley, R. S. Direct evidence of a role for heterochromatin in meiotic chromosome segregation. Cell. 86 (1), 135-146 (1996).
- Gilliland, W. D., Hughes, S. F., Vietti, D. R., Hawley, R. S. Congression of achiasmate chromosomes to the metaphase plate in Drosophila melanogaster oocytes. Dev Biol. 325 (1), 122-128 (2009).
- Gilliland, W. D., et al. Hypoxia transiently sequesters mps1 and polo to collagenase-sensitive filaments in Drosophila prometaphase oocytes. PLoS One. 4 (10), e7544(2009).
- Sullivan, W., Ashburner, M., Hawley, R. S. Drosophila Protocols. , Cold Spring Harbor Laboratory Press. (2000).
- Radford, S. J., Hoang, T. L., Głuszek, A. A., Ohkura, H., McKim, K. S. Lateral and End-On Kinetochore Attachments Are Coordinated to Achieve Bi-orientation in Drosophila Oocytes. PLoS Genet. 11 (10), e1005605(2015).
- Smurnyy, Y., Toms, A. V., Hickson, G. R., Eck, M. J., Eggert, U. S. Binucleine 2, an isoform-specific inhibitor of Drosophila Aurora B kinase, provides insights into the mechanism of cytokinesis. ACS Chem Biol. 5 (11), 1015-1020 (2010).
- Mahowald, A. P., Goralski, T. J., Caulton, J. H. In vitro activation of Drosophila eggs. Dev Biol. 98 (2), 437-445 (1983).
- Page, A. W., Orr-Weaver, T. L. Activation of the meiotic divisions in Drosophila oocytes. Dev Biol. 183 (2), 195-207 (1997).
- Tavosanis, G., Llamazares, S., Goulielmos, G., Gonzalez, C. Essential role for gamma-tubulin in the acentriolar female meiotic spindle of Drosophila. EMBO J. 16 (8), 1809-1819 (1997).
- Endow, S. A., Komma, D. J. Spindle dynamics during meiosis in Drosophila oocytes. J Cell Biol. 137 (6), 1321-1336 (1997).
- Matthies, H. J., Clarkson, M., Saint, R. B., Namba, R., Hawley, R. S. Drosophila Protocols. Sullivan, W., Ashburner, M., Hawley, R. S. , Cold Spring Harbor Laboratory Press. 67-85 (2000).
- Colombié, N., et al. Dual roles of Incenp crucial to the assembly of the acentrosomal metaphase spindle in female meiosis. Development. 135 (19), 3239-3246 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır