Method Article
تقنيات التصوير طليعة الطور والطورية من الانقسام الاختزالي الأول في مجال الاتصالات الأرضية
In This Article
Summary
We present protocols for the collection, preparation, and imaging of mature Drosophila oocytes. These methods allow the visualization of chromosome behavior and spindle assembly and function during meiosis.
Abstract
Chromosome segregation in human oocytes is error prone, resulting in aneuploidy, which is the leading genetic cause of miscarriage and birth defects. The study of chromosome behavior in oocytes from model organisms holds much promise to uncover the molecular basis of the susceptibility of human oocytes to aneuploidy. Drosophila melanogaster is amenable to genetic manipulation, with over 100 years of research, community, and technique development. Visualizing chromosome behavior and spindle assembly in Drosophila oocytes has particular challenges, however, due primarily to the presence of membranes surrounding the oocyte that are impenetrable to antibodies. We describe here protocols for the collection, preparation, and imaging of meiosis I spindle assembly and chromosome behavior in Drosophila oocytes, which allow the molecular dissection of chromosome segregation in this important model organism.
Introduction
The study of meiosis is sometimes described as the "genetics of genetics". This is because the fundamental properties of chromosome inheritance and independent assortment are carried out through the segregation of chromosomes during gamete production. An important demonstration of the chromosome theory of inheritance came in 1916 from the work of Calvin Bridges in Drosophila melanogaster1. This and other classical genetics studies in Drosophila contributed greatly to our understanding of genetics. Cytological examination of meiotic chromosomes in Drosophila oocytes, however, has been challenging. This is primarily because immunofluorescence of late-stage Drosophila oocytes, when the spindle assembles and chromosomes are oriented for segregation, is hampered by the presence of membranes that render the oocyte impenetrable to antibodies.
Despite this challenge, Drosophila oocytes remain an attractive model for the study of chromosome behavior and spindle assembly. This is because of the powerful genetic tools available in Drosophila, but also because the oocytes arrest at metaphase I, when the chromosomes are oriented and the spindle is fully formed. This facilitates the collection and examination of large numbers of oocytes at this important stage of cell division. In addition, a simple model organism that is amenable to genetic manipulation for the study of oocyte chromosome segregation can provide an important contribution to our understanding of human reproductive health. Errors in chromosome number are the leading genetic cause of miscarriage and birth defects in humans2. A majority of these errors can be traced to the oocyte and are correlated with increasing maternal age. The average age of mothers in the U.S. has been increasing, making this a major public health concern.
We describe here methods for the cytological examination of Drosophila oocytes, including a demonstration of how to remove the oocyte membranes. These methods are modifications of protocols first described by Theurkauf and Hawley3, Zou et al.4, and Dernburg et al.5. We also include methods for the enrichment of different stages of oocytes, based on a protocol first described by Gilliland et al.6. Finally, we add instructions for the drug treatment of Drosophila oocytes. Together, these methods allow the cytological investigation of oocyte chromosome segregation and spindle assembly in Drosophila.
Protocol
يتم تنفيذ الإجراءات في درجة حرارة الغرفة ما لم يذكر خلاف ذلك: مذكرة. وتستخدم حاضنات التحكم في درجة حرارته للحفاظ على درجات الحرارة لتربية ذبابة ويعبر ما لم يذكر خلاف ذلك.
1. التحضيرات
- إعداد الذباب.
- مجموعات بويضة طليعة الطور التالي التخصيب.
- الذباب الكبار واضحا من الشباب الأصحاء الأسهم أو عبر الثقافات. زجاجات العمر لمدة يومين عند 25 درجة مئوية.
ملاحظة: عموما زجاجتين صحية تكفي، على الرغم من أن أكثر قد تكون هناك حاجة لبعض الثقافات عبر. - بعد يومين، وجمع ~ 100-300 الإناث (الذين هم 0-2 أيام من العمر في هذه النقطة) من الزجاجات. الإناث لا تحتاج إلى أن تكون العذارى. إضافة لمسة من معجون الخميرة إلى جانب قارورة ووضع 30 من الإناث و 10 إلى 15 من الذكور كل في قارورة yeasted. قارورة العمر لمدة يومين عند 25 درجة مئوية.
- الذباب الكبار واضحا من الشباب الأصحاء الأسهم أو عبر الثقافات. زجاجات العمر لمدة يومين عند 25 درجة مئوية.
- الطورية التخصيب مجموعة سيت.
- جمع ~ 100-300 الإناث من الأسهم أو عبر الثقافيهوفاق. إضافة لمسة من معجون الخميرة إلى جانب قارورة ووضع 30 الإناث كل (مع عدم وجود الذكور المضافة) في قارورة yeasted. قارورة العمر لمدة ثلاثة إلى خمسة أيام عند 25 درجة مئوية.
- مجموعات بويضة طليعة الطور التالي التخصيب.
- إعداد الحلول.
ملاحظة: قد تكون مخزنة حلول أجل غير مسمى في درجة حرارة الغرفة، ما لم يذكر خلاف ذلك.- استعد التعديل العازلة روب ل(5X): 500 ملي HEPES، 500 ملي السكروز، 275 ملي خلات الصوديوم، 200 ملي خلات البوتاسيوم، 50 ملي الجلوكوز، كلوريد المغنيسيوم 6 مم، و 5 ملي كلوريد الكالسيوم. استخدام 10 N 11: 8 هيدروكسيد الصوديوم: هيدروكسيد البوتاسيوم لجلب الرقم الهيدروجيني إلى 7.4. تعقيم عن طريق الترشيح. لا الأوتوكلاف. تخزين في درجة حرارة -20 درجة مئوية. ذوبان الجليد عند الحاجة لإعداد ~ 200 مل من 1X روب نصيب بويضة الإعدادية.
- حلول التثبيت.
- الخيار رقم 1: إعداد الفورمالديهايد / هيبتان التثبيت. إعداد التثبيت العازلة: مخزنة المالحة الفوسفات 1X (PBS)، بالإضافة إلى 150 ملي السكروز. لاستخدام، وجعل جديدة مع 687.5 ميكرولتر التثبيت العازلة و312.5 ميكرولتر 16٪ الفورمالديهايدفي الإعدادية بويضة.
تنبيه: ارتداء قفازات أثناء استخدام حلول الفورمالديهايد في غطاء الدخان. التخلص من النفايات وفقا للمبادئ التوجيهية المؤسسية. - الخيار رقم 2: إعداد الفورمالديهايد / كاكوديلات التثبيت. إعداد فيكس ميكس: 250 ملم السكروز، 100 ملي البوتاسيوم خلات (7.5 درجة الحموضة)، و 25 ملي خلات الصوديوم (7.0 درجة الحموضة)، و 25 ملي EGTA (8.0 درجة الحموضة). لاستخدام، وجعل جديدة مع 400 ميكرولتر إصلاح ميكس، 100 ميكرولتر كاكوديلات البوتاسيوم (1 م، ودرجة الحموضة 7.2)، و 500 ميكرولتر 16٪ الفورمالديهايد في الإعدادية بويضة.
تنبيه: كاكوديلات البوتاسيوم يحتوي على الزرنيخ.
- الخيار رقم 1: إعداد الفورمالديهايد / هيبتان التثبيت. إعداد التثبيت العازلة: مخزنة المالحة الفوسفات 1X (PBS)، بالإضافة إلى 150 ملي السكروز. لاستخدام، وجعل جديدة مع 687.5 ميكرولتر التثبيت العازلة و312.5 ميكرولتر 16٪ الفورمالديهايدفي الإعدادية بويضة.
- إعداد برنامج تلفزيوني / تريتون X-100: برنامج تلفزيوني 1X بالإضافة إلى 1٪ أو 0.05٪ تريتون X-100. تخزينها في 4 درجات مئوية.
- إعداد برنامج تلفزيوني توين 20-الأبقار مصل الزلال (BSA) (PTB): برنامج تلفزيوني 1X، 0.5٪ BSA (ث ت /)، و 0.1٪ توين-20. ويمكن تخزينها في 4 درجة مئوية لمدة أسبوع واحد.
- مضان في حلول التهجين الموضعي (FISH).
- إعداد 20X الصوديوم كلوريد الصوديوم السيترات (SSC): 3 M كلوريد الصوديوم و 0.3 M سيترات الصوديوم.
- إعداد 2X SSC-توين-20 (SSCT): 2X SSC بالإضافة إلى 0.1٪ توين-20. جعل جديدة، ~ 20 مل لكل الإعدادية بويضة.
- إعداد الحلول الفورماميد: 2X SSC، 0.1٪ توين 20، بالإضافة إلى الفورماميد. جعل طازجة، 1 مل 20٪ الفورماميد، 0.5 مل 40٪ الفورماميد، و 2 مل 50٪ الفورماميد في الإعدادية بويضة.
تنبيه: ارتداء قفازات أثناء استخدام حلول الفورماميد في غطاء الدخان. التخلص من النفايات وفقا للمبادئ التوجيهية المؤسسية. - يعد حل التهجين: 2X SSC، 50٪ الفورماميد، و 10٪ كبريتات ديكستران (ث / ت). تخزينها في 4 درجات مئوية.
- تحقيقات الأسماك.
- [أليغنوكليوتيد النظام (انظر الجدول رقم 1 لمتواليات) مع تنقية HPLC والمرجوة 5 'تعديل فلوري (على سبيل المثال، و Cy3 أو Cy5). resuspend في تريس، EDTA (TE) في 50 نانوغرام / ميكرولتر.
ملاحظة: حماية oligos من التعرض للضوء في جميع الأوقات.
- [أليغنوكليوتيد النظام (انظر الجدول رقم 1 لمتواليات) مع تنقية HPLC والمرجوة 5 'تعديل فلوري (على سبيل المثال، و Cy3 أو Cy5). resuspend في تريس، EDTA (TE) في 50 نانوغرام / ميكرولتر.
2. جمع في وقت متأخر من مرحلة ذبابة الفاكهة البويضات
- مثل البويضات ذبابة الفاكهة مع الأغشية سليمة ستلتزم البلاستيك والزجاج، قبل معطف داخل أنبوب واحد 5 مل والماصة باستور واحد لكل الإعدادية بويضة مع PTB.
- تخدير جميع ~ 100-300 الذباب yeasted مع ثاني أكسيد الكربون وإضافة إلى خلاط تحتوي على ~ 100 مل 1X العازلة روب ل. نبض ثلاث مرات (~ 1 ثانية لكل منهما). إبقاء البويضات والتي روب ل <20 دقيقة لتجنب التنشيط.
ملاحظة: بدلا من ذلك، البويضات يمكن تسليم تشريح-من الإناث. وميزة هذا الأسلوب هو أنه يتطلب أقل من الإناث. ومع ذلك، يجب توخي الحذر للحد من التعرض لغاز ثاني أكسيد الكربون لبضع دقائق فقط لتجنب القطع الأثرية مرتبطة بنقص الأكسجة 7. - تصفية من خلال شبكة كبيرة (~ 1500 ميكرون) إلى 250 مل دورق لإزالة أجزاء الجسم الكبيرة. إذا لا تزال العديد من بطون سليمة على مواد شبكة، وإعادة طحن باستخدام إضافية العازلة روب، ووالفلتر مرة أخرى. دعونا تسوية ~ 2 دقيقة، ثم نضح من الطبقة العليا، وإزالة أكبر عدد ممكن من أجزاء الجسم كبيرة ممكن.
- فايlter من خلال شبكة صغيرة (~ 300 ميكرون) في كوب 250 مل. شطف المتبقية البويضات من الكأس الأول باستخدام إضافي لروب والمغلفة باستور الماصة. دعونا تسوية ~ 3 دقائق. والبويضات يستقر بها. نضح قبالة جميع ولكن ~ 10 مل.
- صب أكبر قدر من 10 مل كما سوف تناسب المغلفة أنبوب 5 مل. دعونا تسوية، وإزالة السائل، وكرر مع بقية. شطف البويضات المتبقية من الدورق باستخدام إضافية روب والمغلفة باستور الماصة. دعونا تسوية في 5 مل أنبوب ل~ 3-5 دقيقة.
3. العلاج بالعقاقير (اختياري)
- معطف الثاني أنبوب 5 مل مع PTB لكل الإعدادية بويضة. إضافة مذيب مناسب (السيطرة) أو المخدرات إلى 1 مل روب في كل لكل الإعدادية بويضة (الجدول 2).
- البويضات انقسم الى المغلفة الثانية أنبوب 5 مل. دعونا تسوية، وإزالة السائل، وإضافة 1 مل من روب بالإضافة إلى المذيبات في أنبوب واحد وفي 1 مل روب بالإضافة إلى المخدرات في أنبوب الثاني. Nutate لكمية مناسبة من الوقت لمعالجة مدمني المخدرات (الجدول 2). Lوآخرون تسوية.
4. التثبيت
- نضح قبالة كل السائل وعلى الفور إضافة 1 مل الإصلاح.
- الخيار رقم 1: الفورمالديهايد / تثبيت هيبتان (التثبيت العازلة بالإضافة إلى 5٪ الفورمالديهايد).
- إصلاح مقابل 2.5 دقيقة على nutator. إضافة 1 مل هيبتان ودوامة 1 دقيقة. دعونا تسوية ~ 1 دقيقة.
- إزالة جميع السائل، ثم إضافة 1 مل برنامج تلفزيوني 1X. دوامة 30 ثانية. دعونا تسوية ~ 1 دقيقة.
- إزالة جميع السائل، ومن ثم ملء الأنبوب مع برنامج تلفزيوني 1X.
ويمكن استخدام البويضات على الفور أو تبقى على nutator لعدة ساعات في درجة حرارة الغرفة: ملاحظة.
- الخيار رقم 2: الفورمالديهايد / كاكوديلات تثبيت (فيكس ميكس بالإضافة إلى 8٪ الفورمالديهايد و 100 كاكوديلات ملم).
- إصلاح لمدة 6 دقائق على nutator. دعونا تسوية 2 دقيقة. إزالة السائل، ومن ثم ملء الأنبوب مع برنامج تلفزيوني 1X.
ويمكن استخدام البويضات على الفور أو تبقى على nutator لعدة ساعات في درجة حرارة الغرفة: ملاحظة.
- إصلاح لمدة 6 دقائق على nutator. دعونا تسوية 2 دقيقة. إزالة السائل، ومن ثم ملء الأنبوب مع برنامج تلفزيوني 1X.
5. إزالة الأغشية ( "المتداول")
- باستخدام المغلفة باستور الماصة، إضافة ~ 500 إلى 1000 البويضات إلى الجزء بلوري (الرمال انتقد) من شريحة زجاجية. إزالة جميع أجزاء الجسم وملقط المواد باستخدام الدخيلة. لا تدع البويضات تجف. إضافة برنامج تلفزيوني 1X عند الضرورة.
- وضع ساترة على أعلى من البويضات وبلطف البويضات "لفة" حتى جميع أغشية يتم إزالة (سحب حافة ساترة عبر البويضات يعمل على نحو أفضل.) فحص دوري التقدم تحت المجهر، إضافة المزيد من برنامج تلفزيوني 1X الضرورة. رعاية مثل الكثير من الضغط سوف يدمر البويضات.
ملاحظة: للحصول المناعي فقط، تستمر مع الخطوة 6. بالنسبة للأسماك (مع أو بدون المناعي)، تواصل مع الخطوة 7.
6. تلوين الأجسام المضادة من ذبابة الفاكهة البويضات
- استخراج والحجب
- شطف البويضات توالت في أنبوب مخروطي 15 مل تحتوي على ~ 15 مل PBS / 1٪ تريتون X-100. البويضات Nutate في هذا الحل لمدة لا تقل عن 1.5 ساعة ولا يزيد عن 2 ساعة.هذه الخطوة تتيح اختراق الأجسام المضادة.
- السماح البويضات تستقر ~ 2 دقيقة. إزالة السائل جنبا إلى جنب مع العديد من الأغشية وقت ممكن، ثم إضافة برنامج تلفزيوني / 0.05٪ تريتون X-100.
ملاحظة: سوف الأغشية يستقر أبطأ من البويضات تدحرجت. - اسمحوا البويضات تستقر ~ 2 دقيقة، ثم إزالة كافة ولكن ~ 1 مل السائل. نقل البويضات لتخرج أنبوب 1.5 مل وإزالة ما تبقى السائل. إضافة 1 مل PTB من أجل الحيلولة دون وnutate لمدة 1 ساعة.
- الأجسام المضادة تلطيخ
- قبل امتصاص الأجسام المضادة الثانوية ضد الأجنة.
ملاحظة: هذه الخطوة يلغي تلوين الخلفية من التفاعلات الأجسام المضادة غير محددة مع البروتينات ذبابة الفاكهة.- جمع وتحديد الأجنة ذبابة الفاكهة (~ 25 ميكرولتر) في إجراء نموذجي 8. تخزين في الميثانول في -20 درجة مئوية.
- إزالة الميثانول من الأجنة، إضافة 800 ميكرولتر الميثانول بالإضافة إلى 200 ميكرولتر برنامج تلفزيوني 1X، وnutate لمدة 15 دقيقة. إزالة 500 ميكرولتر من طاف واستبدالها مع 500 ميكرولتر برنامج تلفزيوني 1X. ثم nutate لمدة 15 دقيقة. كرر مرتين (أي ما مجموعه ~ 1 ساعة يغسل)، وبعد ذلك تنتهي في PTB.
ملاحظة: الأجنة يمكن استخدامها على الفور أو الاحتفاظ بها على nutator لعدة ساعة في درجة حرارة الغرفة. - إزالة السائل، وملء مع PTB إلى 200 ميكرولتر في الإعدادية بويضة، وإضافة الأجسام المضادة الثانوية fluorescently المسمى في التخفيفات المناسبة (مع الأخذ في الاعتبار أن الحجم النهائي سيكون 300 ميكرولتر؛ انظر الخطوة 7.4) Nutate في 4 درجات مئوية خلال الليل (الأفضل) أو في درجة حرارة الغرفة لمدة 3 إلى 4 ساعات.
ملاحظة: سيتم استخدام الأجسام المضادة استيعابها مسبقا في الخطوة 6.2.4.
ملاحظة: حافظ على عينات في الظلام قدر الإمكان مرة واحدة تم إضافة الأجسام المضادة الفلورسنت.
- إزالة السائل من البويضات، وملء مع PTB إلى 300 ميكرولتر وإضافة الأجسام المضادة الأولية في التخفيفات المناسبة. Nutate في 4 درجات مئوية خلال الليل (الأفضل) أو في درجة حرارة الغرفة لمدة 3 إلى 4 ساعات.
- غسل البويضات أربع مرات لمدة 15 دقيقة لكل منهما مع 1 مل PTB.
- إزالةالسائل من البويضات، إضافة 200 ميكرولتر من طاف من الأجنة (قبل يمتص الأجسام المضادة الثانوية). ثم ملء مع PTB إلى 300 ميكرولتر. Nutate في درجة حرارة الغرفة لمدة 3 إلى 4 ساعات (الأفضل) أو عند 4 درجات مئوية خلال الليل.
- غسل البويضات مرة واحدة لمدة 15 دقيقة مع 1 مل PTB، وإزالة السائل. ثم يضاف 0.5 ميكرولتر هويشت 33342 و 500 PTB ميكرولتر وnutate لمدة 7 دقائق.
- غسل البويضات مرتين لمدة 15 دقيقة لكل منهما مع 1 مل PTB.
ملاحظة: قد يتم تنظيمها البويضات على شريحة فورا أو قد تكون مخزنة في PTB في 4 درجات مئوية لتصبح جاهزة للتصوير.
- قبل امتصاص الأجسام المضادة الثانوية ضد الأجنة.
7. FISH (تابع من الخطوة 5 أعلاه)
- شطف البويضات توالت في أنبوب مخروطي 15 مل تحتوي على 15 مل ~ 2X SSCT. السماح البويضات تستقر ~ 2 دقيقة. إزالة كافة ولكن ~ 0.5 مل السائل جنبا إلى جنب مع العديد من الأغشية ممكن.
ملاحظة: سوف الأغشية يستقر أبطأ من البويضات تدحرجت. - نقل البويضات إلى 0.5 مل أنبوب وإزالة ما تبقى السائل. تباعا إضافة وإزالة 500 ميكرولتر20٪، 40٪، و 50٪ حلول الفورماميد، الإيماء لمدة 10 دقيقة في كل حل.
ملاحظة: سوف البويضات يستقر أبطأ مع نسب أعلى من الفورماميد. - إزالة السائل، ثم تضاف حل الفورماميد 500 ميكرولتر 50٪، وnutate عند 37 درجة مئوية لمدة 1-5 ساعة.
ملاحظة: أطول حضانات تؤدي إلى اختراق أفضل التحقيق. - إزالة السائل، مخلفة وراءها ما لا يزيد عن 100 ~ البويضات ميكرولتر وإضافة 36 ميكرولتر حل التهجين زائد 2 ميكرولتر من التحقيق (50 نانوغرام / ميكرولتر) و 2 ميكرولتر من الماء أو 2 ميكرولتر من التحقيق الثانية 2 (الجدول 1).
- احتضان عند 91 درجة مئوية لمدة 3 دقائق (FISH فقط) أو 80 درجة مئوية لمدة 20 دقيقة (FISH زائد المناعي)، تليها الحضانة في 37 ° C حمام الماء بين عشية وضحاها.
ملاحظة: قد يتم تنفيذ هذه الخطوات في thermocycler. - لا تقم بإزالة السائل. إضافة 500 ميكرولتر 50٪ محلول الفورماميد وnutate عند 37 درجة مئوية لمدة 1 ساعة.
- دعونا تسوية، وإزالة السائل، إضافة 500 ميكرولتر 50٪ محلول الفورماميد، لد nutate عند 37 درجة مئوية لمدة 1 ساعة.
- دعونا تسوية، وإزالة السائل، إضافة حل الفورماميد 500 ميكرولتر 20٪، وnutate في درجة حرارة الغرفة لمدة 10 دقيقة.
- تنفيذ ثلاث يغسل سريعة في 500 ميكرولتر 2X SSCT (السماح تسوية، إزالة ثم إضافة السائل، عكس عدة مرات، وتكرار.) واسمحوا تسوية، وإزالة السائل، ثم إضافة 500 ميكرولتر PTB وnutate لمدة 4 ساعة.
8. تلوين الأجسام المضادة بعد FISH
- إزالة السائل من البويضات، وملء مع PTB إلى 300 ميكرولتر وإضافة 10 ميكرولتر مكافحة α-تويولين الضد مترافق FITC. بدلا من ذلك، والأجسام المضادة الأخرى يمكن استخدامها، بعد بروتوكول أعلاه. Nutate في درجة حرارة الغرفة بين عشية وضحاها.
- غسل البويضات مرة واحدة لمدة 15 دقيقة مع 500 ميكرولتر PTB، وإزالة السائل، ثم يضاف 0.5 ميكرولتر هويشت 33342 و 500 PTB ميكرولتر وnutate لمدة 7 دقائق.
- غسل البويضات مرتين لمدة 15 دقيقة لكل منهما مع 500 ميكرولتر PTB.
قد يتم تنظيمها البويضات على شريحة فورا أو قد تكون مخزنة في PTB في 4 درجات مئوية لتصبح جاهزة لل: ملاحظةالتصوير. إبقاء البويضات في الظلام قدر الإمكان مرة واحدة تم إضافة الأجسام المضادة الفلورسنت.
| تكرار اسم | كروموسوم | بنسبة ضئيلة تسلسل * |
| 359 | X | GGGATCGTTAGCACTGGTAATTAGCTGC |
| AACAC | 2 | AACACAACACAACACAACACAACACAACACAACACAACAC |
| dodeca | 3 | CCCGTACTGGTCCCGTACTCGGTCCCGTACTCGGT |
| 1.686 | 2 + 3 | AATAACATAGAATAACATAGAATAACATAG |
| AATAT | 4 (+ Y) | AATATAATATAATATAATATAATATAATAT |
| * 359 تسلسل من إريك جويس، والاتصالات الشخصية، سلاسل أخرى من سوليفان وآخرون. 8 | ||
الجدول 1: تحقيقات FISH ليكرر القسيم المركزي ذبابة الفاكهة.
| عقار | مذيب | تركيز الأسهم | التركيز النهائي | وقت العلاج | تأثير |
| الكولشيسين | الإيثانول | 125 ملي | 150 ميكرومتر | 10 دقيقة أو 30 دقيقة | زعزعة الاستقرار في غير الحيز الحركي (10 دقيقة) 9 أو كل (30 دقيقة) ميكروتثبول |
| باكليتاكسيل | [دمس] | 10 ملي | 10 ميكرومتر | 10 دقائق | استقرار هيئة التصنيع العسكريrotubules |
| Binucleine 2 | [دمس] | 25 ملي | 25 ميكرومتر | 20 دقيقة | تمنع كيناز أورورا B 10 |
الجدول 2: العلاج من تعاطي المخدرات.
النتائج
سوف الأساليب التي وصفناها هنا يؤدي إلى مجموعة من المراحل المتأخرة من البويضات ذبابة الفاكهة تمثل ثلاث مراحل الانقسام الاختزالي (الشكل 1). وتتميز البويضات في الطور الأول من وجود الغلاف النووي، وهو أمر واضح بسبب عدم وجود إشارة تويولين في المنطقة المحيطة جسيم نووي (الشكل 1A). طليعة الطور التالي هو فترة ما بعد انهيار الغلاف النووي خلالها تجميع المغزل. خلال طليعة الطور التالي، وجسيم نووي يفترض الشكل المميز، لتصبح ممدود في كثير من الأحيان مع الصبغيات ال 4 وبصرف النظر عن جسيم نووي الكتلة الرئيسية (الشكل 1B). ويخلص طليعة الطور التالي مع الطورية، الذي البويضات ذبابة الفاكهة تعتقل بشكل طبيعي حتى الإباضة. في البويضات الطورية، وقد سحبوا جسيم نووي في شكل دائري (الشكل 1C).
وصفنا هنا مethods لمعالجة سرعة وضع البيض للإناث ذبابة الفاكهة لتخصيب البويضات لاما في طليعة الطور أو الطورية. البويضات من مجموعات المخصب طليعة الطور-كثيرا ما تظهر جسيم نووي ممدود (الشكل 2A)، في حين مجموعات الطورية التخصيب أو مجموعات من إناث ذبابة الفاكهة البكر، التي تقضي تماما تقريبا وضع البيض، تظهر في المقام الأول على جسيم نووي الجولة (الشكل 2B). ومن المثير للاهتمام، ومجموعات المخصب طليعة الطور التالي أيضا وعادة ما تظهر مغزل أكثر قوة، مما يشير إلى أن كلا من تغير جسيم نووي والمغزل بين طليعة الطور والطورية في ذبابة الفاكهة البويضات 9.
ويبين الشكل 3 صور تمثيلية من البروتوكولين هو موضح هنا. أجسام مضادة ضد α تويولين (لإظهار المغزل)، استخدمت CENP-C (لإظهار القسيم)، وINCENP (لإظهار مغزل المركزي) على البويضات ثابتة مع FOrmaldehyde / هيبتان (الشكل 3A). استخدمت تحقيقات للتسلسل القسيم المركزي المتكررة على كروموسوم 2 الثانية (AACAC) وكروموسوم 3 الثالثة (dodeca) على البويضات ثابتة مع الفورمالدهايد / كاكوديلات وشارك الملطخة مع الأجسام المضادة α تويولين وفقا لبروتوكول FISH (الشكل 3B). يظهر التحقيق AACAC عن العديد من بؤر تتجمع في حين يظهر التحقيق dodeca كمحور واحد لكل كروموسوم. تم إصلاحها البويضات تعامل مع 150 الكولشيسين ميكرومتر لمدة 10 دقيقة مع الفورمالديهايد / هيبتان (الشكل 3C). هذا العلاج يزيل معظم غير الحيز الحركي-الأنابيب الدقيقة، مما يؤدي في جميع الأنابيب الدقيقة الاتصال الحمض النووي في بؤر المسمى السنترومير. البويضات تعامل مع 10 باكليتاكسيل ميكرومتر لمدة 10 دقيقة عرض الأنابيب الدقيقة المفرطة في السيتوبلازم، ولكن تأثير يذكر على الأنابيب الدقيقة المغزل (الشكل 3D). البويضات تعامل مع 25 ميكرومتر Binucleine 2 لمدة 20 دقيقة لتمنع فقدان أورورا كيناز B تظهر كاملةميكروتثبول المغزل (الشكل 3E).
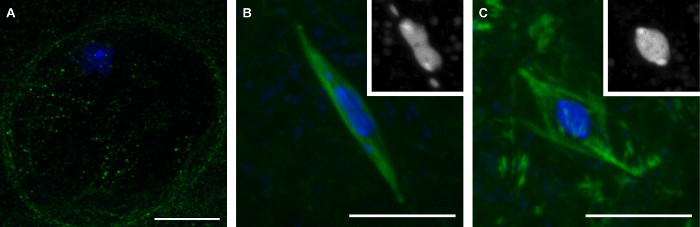
الشكل 1: ثلاث مراحل من البويضات ذبابة الفاكهة الناضجة: الطور الأول، طليعة الطور التالي، والطورية الصور متحد البؤر من البويضات ذبابة الفاكهة في الطور الأول (A)، طليعة الطور التالي (B)، والطورية (ج) من الانقسام الاختزالي الأول الحمض النووي هو مبين باللون الأزرق وتويولين هو يظهر باللون الأخضر في الصور المدمجة. إدراجات في الفقرة (ب) و (ج) تبين الحمض النووي باللون الأبيض. الحانات النطاق = 10 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2:Prometaphase- مقابل مجموعات الطورية التخصيب من البويضات ذبابة الفاكهة. الصور متحد البؤر من البويضات ذبابة الفاكهة من التخصيب طليعة الطور التالي (A) أو (B) مجموعات التخصيب الطورية. يظهر الحمض النووي في الزرقاء ويرد تويولين باللون الأخضر. الحانات النطاق = 10 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
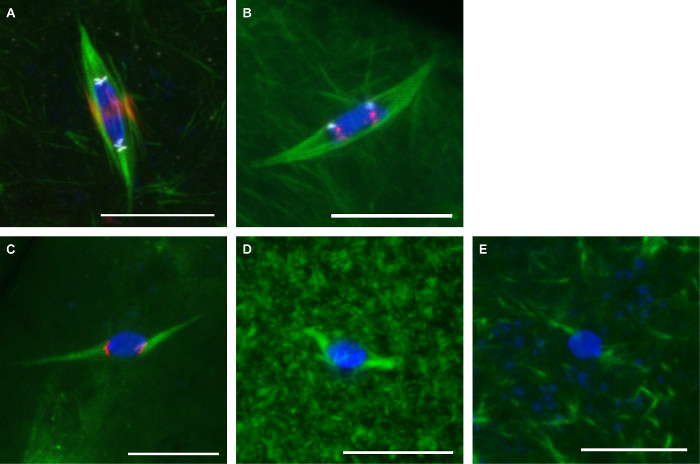
الشكل (3): تلوين الأجسام المضادة والأسماك، والمخدرات العلاج من البويضات ذبابة الفاكهة الصور متحد البؤر من البويضات ذبابة الفاكهة مع الحمض النووي في الزرقاء وتويولين باللون الأخضر. الحانات النطاق = 10 ميكرون. (A) المناعي في فورمالدهيده / هيبتان التثبيت مع INCENP (المغزل المركزي) باللون الأحمر وCENP-C (القسيم) باللون الأبيض. (ب) FISH في تثبيت الفورمالديهايد / كاكوديلات مع AACAC هو مبين في dodeca الأحمر ويظهر باللون الأبيض. (ج) علاج مع 150 الكولشيسين ميكرومتر لمدة 10 دقيقة مع CENP-C هو موضح باللون الأحمر. العلاج مع باكليتاكسيل 10 ميكرومتر لمدة 10 دقيقة (D) أو 25 ميكرومتر Binucleine 2 لمدة 20 دقيقة (E). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
انطلاق ذبابة الفاكهة البويضات
على الرغم من أن جسيم نووي ممدود غالبا ما ينظر في البويضات طليعة الطور التالي، وذلك باستخدام جسيم نووي شكل للتمييز طليعة الطور التالي من البويضات الطورية يمكن أن يكون مشكلة. خلال طليعة الطور التالي، يبدأ جسيم نووي كما شكل دائري، يستطيل، ومن ثم تتراجع إلى شكل دائري مع اقتراب البويضة اعتقال الطورية. وهذا يعني أن العديد من البويضات طليعة الطور التالي لم يكن لديك جسيم نووي ممدود. وبالإضافة إلى ذلك، إذا يتم فحص البويضات متحولة أو المعالجة المخدرات، قد تتأثر جسيم نووي الشكل، والحيلولة دون استخدام هذا الأسلوب لتنظيم البويضات. لأن علامات أخرى للتمييز هذه المراحل ليست متاحة حاليا، ونحن نستخدم طريقة المذكورة أعلاه للتلاعب في سرعة وضع البيض للإناث ذبابة الفاكهة لتخصيب البويضات لاما في طليعة الطور أو الطورية. الأساس المنطقي هو أنه إذا كان البويضات تنفق مبلغ محدد من الوقت في طليعة الطور التالي، وعلى مبلغ غير محددة من الزمن آرسوف ested في الطورية، الذي يستمر حتى وضع البيض، ثم أكثر السريع وضع البيض تحرف نحو نسبة أعلى من البويضات طليعة الطور التالي، في حين أبطأ وضع البيض ستغني عن الطورية. مقدار الجهد المطلوب لجمع الإناث البكر أو جمع الإناث على مدى زمني أقصر من 2 أيام، كما وصفها جيليلاند وآخرون. 6، لا تكافأ بزيادة ملموسة في البويضات طليعة الطور التالي. ومن المستحيل أيضا استخدام الزوائد الظهرية لتنظيم البويضات التي أعدت لهذا البروتوكول كما يتم إزالة الزوائد الظهرية جنبا إلى جنب مع الأغشية. على الرغم من أنه ليس من الممكن تنظيم البويضات الفردية مع 100٪ اليقين باستخدام هذا الأسلوب، وبيانات من طليعة الطور التالي مخصب أو مجموعات التخصيب الطورية يمكن اتخاذها معا لاستخلاص النتائج حول هذه المراحل المختلفة 9.
لا يتم إخصاب البويضات ذبابة الفاكهة حتى أنها تمر من خلال قناة البيض. لذلك، لأن البويضات التي تم جمعها عن عشربروتوكولات البريد الموصوفة هنا فحص البويضات تؤخذ قبل وضع البيض، لم يتم إخصابها هذه البويضات. المرور عبر قناة البيض يسبب أيضا البويضة لتفعيل واستئناف تقدم دورة الخلية. طرق لدراسة مراحل دورة الخلية بعد الطورية أنا موجود 11،12، ولكن خارج نطاق هذا البروتوكول.
اعتبارات طريقة التثبيت
وصفنا طريقتين منفصلة للتثبيت من المراحل المتأخرة من البويضات ذبابة الفاكهة. وكان أول وصف طريقة تثبيت الفورمالديهايد / كاكوديلات التي كتبها Theurkauf وهولي 3 وطريقة تثبيت الفورمالديهايد / هيبتان وصفت لأول مرة من قبل زو وآخرون. 4. وبالإضافة إلى ذلك، يتم استخدام الأسلوب الثالث (الميثانول التثبيت) قبل نحو 13، ولكن ليس هو موضح هنا. إزالة الأغشية بويضة إلى حد ما أكثر صعوبة بعد الفورمالديهايد / هيبتان تثبيت مقارنة الفورمالديهايد / كاكوديلات. وذلك لأن "المتداول" تعتمدالصورة على الاحتكاك بين ساترة والبويضة، والفورمالديهايد / هيبتان تثبيت يجعل البويضات أكثر زلق. وعلى الرغم من هذه الصعوبة وأضاف، لدينا الخيار الأول لطريقة التثبيت عند اختبار الأجسام المضادة الجديدة الفورمالديهايد / هيبتان لأنه يعمل على نحو أفضل بالنسبة لغالبية الأجسام المضادة التي حاولنا. من ناحية أخرى، ونحن نفضل الفورمالديهايد / كاكوديلات تثبيت للأسماك، في المقام الأول لسهولة إزالة غشاء، على الرغم من الفورمالديهايد / هيبتان التثبيت كانت ناجحة أيضا. كل من هذه الأساليب الحفاظ على بويضة التشكل أفضل من تثبيت الميثانول، وبالتالي فإننا نوصي الميثانول تثبيت فقط في الحالات الأجسام المضادة التي يتم صهر للطرق التثبيت القائم على الفورمالديهايد.
وتركز البروتوكولات المذكورة هنا على التصوير الثابت، من أجل إثبات وسائل فعالة لتقديم البويضات ذبابة الفاكهة الناضجة قابلة للاختراق الأجسام المضادة، أي من خلال إزالة الأغشية بويضة. طرق بديلة لريمو الغشاءفال (باستخدام ملقط 14 أو صوتنة 13) ممكنة. ومع ذلك، نجد "المتداول" لتكون الطريقة الأكثر كفاءة وموثوق بها. كما تم وصفها تقنيات التصوير الحي في أماكن أخرى 14-16 وتقع خارج نطاق هذا البروتوكول.
توصيات FISH
FISH في البويضات ذبابة الفاكهة وصفت في الأصل من قبل Dernburg وآخرون. 5. وقد تم تصميم هذا البروتوكول لتوفير الظروف المثلى لتحقيق التهجين للصبغيات الخلية البيضية المختصرة، ولكن كان البروتوكول الأصلي ليس الأمثل لالمناعي. الطريقة المذكورة أعلاه يتضمن التعديلات التي أدخلناها على تعزيز تلطيخ الضد من α تويولين، وهو في المقام الأول ما نستخدمه عند تنفيذ FISH. عن الأجسام المضادة الأخرى، وخفض درجة حرارة خطوة تمسخ (الخطوة 7.5) من 80 درجة مئوية قد تكون ضرورية.
تحقيقات المذكورة هنا هي لتسلسل المتكررة في المغاير بالقرب من القسيم. لأن هذه المتتاليات هي تكرار للغاية، وتحقيقات يصلب إلى أماكن متعددة وإشارات جماعية قوية جدا. لقد حققنا نجاحا يذكر مع تحقيقات للتسلسل في كروماتين حقيقي، ربما بسبب بنية فريدة من نوعها من الكروموسومات بينما الواردة في جسيم نووي المكثف.
التصوير
البويضات الناضجة ذبابة الفاكهة، مثل البويضات لمعظم الكائنات الحية، هي كبيرة الخلايا، واحدة. وهذا يعني أن هناك كمية كبيرة من السيتوبلازم الذي يحتوي على نواة واحدة. لحسن الحظ، هذه النواة، التي تعرف أيضا باسم جسيم نووي في ذبابة الفاكهة، ويمكن تحديدها بسهولة كما يقع عادة فقط تحت الزوائد الظهرية قريبة من القشرة. تتم إزالة الزوائد الظهرية جنبا إلى جنب مع أغشية الخلية البيضية، ولكن لا يزال لجسيم نووي يكون موجودا من خلال إيجاد ديفت صغيرة في قشرة البويضة حيث الزوائد سكانت الامتحانات التنافسية الوطنية. ويتم الحصول على أفضل الصور من البويضات التي تم تنظيمها مع هذا ديفت التي تواجه ساترة لأن هذا يضع جسيم نووي الأقرب إلى الهدف. على الرغم من أنه قد يكون من الممكن لترتيب البويضات في هذا التوجه قبل تركيب، ونحن نفضل لتركيب العديد من البويضات بشكل عشوائي ومن ثم البحث في شريحة لتلك الموجودة في التوجه المفضل.
التطبيقات المستقبلية
في المستقبل سيكون من المهم تحديد علامات تميز موثوق طليعة الطور الأول والطورية أنا مغزل. أن تكون قادرة على استضافة أكثر موثوقية البويضات سوف يقلل من الاعتماد على المزيد من العمل المكثف البدائل، مثل التصوير أعداد كبيرة من البويضات التخصيب مرحلة أو التصوير الحي، التي لديها أيضا مشاكل انطلاق لها. هذا الأسلوب هو الطريقة الأساسية التي يمكن استخدامها للاستفادة من التقدم في مجال علم الوراثة ذبابة الفاكهة عندما تصبح الأدوات الجديدة المتاحة لتعديل أو خروج المغلوب منتجات الجين. ويشمل ذلك الطرقاستهداف مباشرة نشاط البروتين مع أدوية جديدة أو استراتيجيات تدهور المستهدفة. وبالإضافة إلى ذلك، فإن هذه الأساليب لا يقتصر على تصوير مغزل الانتصافي. أي بنية داخل البويضة، مثل الهيكل الخلوي الأكتين، يمكن تحليلها باستخدام هذه الأساليب.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Christian Lehner for providing the CENP-C antibody and Eric Joyce for recommendations on FISH. Work in the McKim lab was funded by a grant from NIH (GM101955).
Materials
| Name | Company | Catalog Number | Comments |
| 15 ml conical tubes | Various | ||
| 16% formaldehyde | Ted Pella, Inc. | 18505 | HAZARDOUS; once opened, discard after one month |
| 250 ml beakers | Various | ||
| 5 ml tubes | Various | ||
| active dry yeast | Various | mix with water to make a paste the consistency of peanut butter | |
| anti-α-tubulin antibody conjugated to FITC | Sigma | F2168 | clone DM1A |
| Binucleine 2 | Sigma | B1186 | HAZARDOUS |
| blender | Various | ||
| bovine serum albumin | Sigma | A4161 | |
| calcium chloride | Various | ||
| colchicine | Sigma | C-9754 | HAZARDOUS |
| coverslips | VWR | 48366-227 | No. 1 1/2 |
| dextran sulfate | Various | ||
| DMSO | Various | ||
| EGTA | Various | ||
| ethanol | Various | ||
| forceps | Ted Pella, Inc. | 5622 | Dumont tweezers high precision grade style 5 |
| formamide | Sigma | 47670-250ML-F | |
| glass slides | VWR | 48312-003 | |
| glucose | Various | ||
| graduated 1.5 ml tubes | Various | ||
| HEPES | VWR | EM-5330 | available from several venders |
| Hoechst 33342 | Various | ||
| magnesium chloride | Various | ||
| methanol | Various | ||
| large mesh (~1,500 µm) | VWR | AA43657-NK | variety of formats and other suppliers, 12 or 14 mesh |
| small mesh (~300 µm) | Spectrum labs | 146 424 | variety of formats, e.g., 146 422 or 146 486 |
| nutator | Various | ||
| Pasteur pipets | Various | ||
| potassium acetate | Various | ||
| Cacodylic acid | Sigma | C0125 | HAZARDOUS; alternatively, sodium cacodylate may be substituted |
| potassium hydroxide | Various | ||
| sodium acetate | Various | ||
| sodium chloride | Various | ||
| sodium citrate | Various | ||
| sodium hydroxide | Various | ||
| sucrose | Various | ||
| taxol (paclitaxel) | Sigma | T1912 | HAZARDOUS |
| Triton X-100 | Fisher | PI-28314 | |
| Tween 20 | Fisher | PI-28320 | |
| vortex | Various |
References
- Bridges, C. B. Non-disjunction as proof of the chromosome theory of heredity. Genetics. 1 (1), 1-52 (1916).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Theurkauf, W. E., Hawley, R. S. Meiotic spindle assembly in Drosophila females: behavior of nonexchange chromosomes and the effects of mutations in the nod kinesin-like protein. J Cell Biol. 116 (5), 1167-1180 (1992).
- Zou, J., Hallen, M. A., Yankel, C. D., Endow, S. A. A microtubule-destabilizing kinesin motor regulates spindle length and anchoring in oocytes. J Cell Biol. 180 (3), 459-466 (2008).
- Dernburg, A. F., Sedat, J. W., Hawley, R. S. Direct evidence of a role for heterochromatin in meiotic chromosome segregation. Cell. 86 (1), 135-146 (1996).
- Gilliland, W. D., Hughes, S. F., Vietti, D. R., Hawley, R. S. Congression of achiasmate chromosomes to the metaphase plate in Drosophila melanogaster oocytes. Dev Biol. 325 (1), 122-128 (2009).
- Gilliland, W. D., et al. Hypoxia transiently sequesters mps1 and polo to collagenase-sensitive filaments in Drosophila prometaphase oocytes. PLoS One. 4 (10), e7544(2009).
- Sullivan, W., Ashburner, M., Hawley, R. S. Drosophila Protocols. , Cold Spring Harbor Laboratory Press. (2000).
- Radford, S. J., Hoang, T. L., Głuszek, A. A., Ohkura, H., McKim, K. S. Lateral and End-On Kinetochore Attachments Are Coordinated to Achieve Bi-orientation in Drosophila Oocytes. PLoS Genet. 11 (10), e1005605(2015).
- Smurnyy, Y., Toms, A. V., Hickson, G. R., Eck, M. J., Eggert, U. S. Binucleine 2, an isoform-specific inhibitor of Drosophila Aurora B kinase, provides insights into the mechanism of cytokinesis. ACS Chem Biol. 5 (11), 1015-1020 (2010).
- Mahowald, A. P., Goralski, T. J., Caulton, J. H. In vitro activation of Drosophila eggs. Dev Biol. 98 (2), 437-445 (1983).
- Page, A. W., Orr-Weaver, T. L. Activation of the meiotic divisions in Drosophila oocytes. Dev Biol. 183 (2), 195-207 (1997).
- Tavosanis, G., Llamazares, S., Goulielmos, G., Gonzalez, C. Essential role for gamma-tubulin in the acentriolar female meiotic spindle of Drosophila. EMBO J. 16 (8), 1809-1819 (1997).
- Endow, S. A., Komma, D. J. Spindle dynamics during meiosis in Drosophila oocytes. J Cell Biol. 137 (6), 1321-1336 (1997).
- Matthies, H. J., Clarkson, M., Saint, R. B., Namba, R., Hawley, R. S. Drosophila Protocols. Sullivan, W., Ashburner, M., Hawley, R. S. , Cold Spring Harbor Laboratory Press. 67-85 (2000).
- Colombié, N., et al. Dual roles of Incenp crucial to the assembly of the acentrosomal metaphase spindle in female meiosis. Development. 135 (19), 3239-3246 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved