Method Article
Tecniche di Imaging Prometafase e metafase della meiosi I nel fisso
In questo articolo
Riepilogo
We present protocols for the collection, preparation, and imaging of mature Drosophila oocytes. These methods allow the visualization of chromosome behavior and spindle assembly and function during meiosis.
Abstract
Chromosome segregation in human oocytes is error prone, resulting in aneuploidy, which is the leading genetic cause of miscarriage and birth defects. The study of chromosome behavior in oocytes from model organisms holds much promise to uncover the molecular basis of the susceptibility of human oocytes to aneuploidy. Drosophila melanogaster is amenable to genetic manipulation, with over 100 years of research, community, and technique development. Visualizing chromosome behavior and spindle assembly in Drosophila oocytes has particular challenges, however, due primarily to the presence of membranes surrounding the oocyte that are impenetrable to antibodies. We describe here protocols for the collection, preparation, and imaging of meiosis I spindle assembly and chromosome behavior in Drosophila oocytes, which allow the molecular dissection of chromosome segregation in this important model organism.
Introduzione
The study of meiosis is sometimes described as the "genetics of genetics". This is because the fundamental properties of chromosome inheritance and independent assortment are carried out through the segregation of chromosomes during gamete production. An important demonstration of the chromosome theory of inheritance came in 1916 from the work of Calvin Bridges in Drosophila melanogaster1. This and other classical genetics studies in Drosophila contributed greatly to our understanding of genetics. Cytological examination of meiotic chromosomes in Drosophila oocytes, however, has been challenging. This is primarily because immunofluorescence of late-stage Drosophila oocytes, when the spindle assembles and chromosomes are oriented for segregation, is hampered by the presence of membranes that render the oocyte impenetrable to antibodies.
Despite this challenge, Drosophila oocytes remain an attractive model for the study of chromosome behavior and spindle assembly. This is because of the powerful genetic tools available in Drosophila, but also because the oocytes arrest at metaphase I, when the chromosomes are oriented and the spindle is fully formed. This facilitates the collection and examination of large numbers of oocytes at this important stage of cell division. In addition, a simple model organism that is amenable to genetic manipulation for the study of oocyte chromosome segregation can provide an important contribution to our understanding of human reproductive health. Errors in chromosome number are the leading genetic cause of miscarriage and birth defects in humans2. A majority of these errors can be traced to the oocyte and are correlated with increasing maternal age. The average age of mothers in the U.S. has been increasing, making this a major public health concern.
We describe here methods for the cytological examination of Drosophila oocytes, including a demonstration of how to remove the oocyte membranes. These methods are modifications of protocols first described by Theurkauf and Hawley3, Zou et al.4, and Dernburg et al.5. We also include methods for the enrichment of different stages of oocytes, based on a protocol first described by Gilliland et al.6. Finally, we add instructions for the drug treatment of Drosophila oocytes. Together, these methods allow the cytological investigation of oocyte chromosome segregation and spindle assembly in Drosophila.
Protocollo
Nota: Le procedure sono eseguite a temperatura ambiente salvo diversamente indicato. incubatori a temperatura controllata sono utilizzati per mantenere temperature per volare allevamento e attraversa se non diversamente specificato.
1. preparati
- Preparare mosche.
- Prometafase arricchito collezioni ovocita.
- Cancella adulto vola da sani, giovani stock o trasversali culture. bottiglie di età per due giorni a 25 ° C.
NOTA: Generalmente due bottiglie sani sarà sufficiente, anche se più può essere necessaria per alcune culture trasversali. - Dopo due giorni, raccogliere ~ 100 a 300 femmine (che vanno da 0 a 2 giorni di età, a questo punto) dalle bottiglie. Le femmine non hanno bisogno di essere vergini. Aggiungere una piccola quantità di pasta di lievito al lato di una fiala e inserire 30 femmine e 10 a 15 maschi ciascuno nelle fiale yeasted. fiale di età per due giorni a 25 ° C.
- Cancella adulto vola da sani, giovani stock o trasversali culture. bottiglie di età per due giorni a 25 ° C.
- Metafase-arricchito ovociti Collezioni.
- Raccogliere ~ 100 a 300 femmine a magazzino o cross cultures. Aggiungere una piccola quantità di pasta di lievito al lato di una fiala e posizionare 30 femmine ogni (senza maschi aggiunti) nelle fiale yeasted. fiale di età per tre-cinque giorni a 25 ° C.
- Prometafase arricchito collezioni ovocita.
- Preparare soluzioni.
Nota: Le soluzioni possono essere conservate indefinitamente a temperatura ambiente, se non diversamente indicato.- Preparare Modified Buffer di Robb (5x): 500 mM HEPES, 500 mM di saccarosio, 275 mM acetato di sodio, acetato di potassio 200 mM, 50 mM di glucosio, 6 mM cloruro di magnesio, cloruro di calcio e 5 mM. Utilizzare 10 N 11: 8 idrossido di sodio: idrossido di potassio per portare il pH a 7,4. Sterilizzare per filtrazione; Non sterilizzare in autoclave. Conservare a -20 ° C. Scongelare come necessario per preparare ~ 200 ml di 1x Robb per ovocita prep.
- Soluzioni fissazione.
- Opzione # 1: Preparare la formaldeide / fissazione eptano. Preparare Fixation Buffer: soluzione salina 1x tampone fosfato (PBS) più 150 mM saccarosio. Per utilizzare, rendere fresco con 687,5 ml Fixation Buffer e 312,5 ml 16% di formaldeideper ovocita prep.
ATTENZIONE: Indossare guanti durante l'utilizzo di soluzioni di formaldeide in una cappa aspirante. Smaltire i rifiuti secondo le linee guida istituzionali. - Opzione # 2: Preparare la formaldeide / fissazione cacodilato. Preparare Mix Fix: 250 mm saccarosio, 100 mM acetato di potassio (pH 7,5), 25 mM di sodio acetato (pH 7,0), e 25 mM EGTA (pH 8,0). Per utilizzare, fare fresco con 400 ml Fix Mix, 100 cacodilato ml di potassio (1 M, pH 7,2), e 500 microlitri di formaldeide al 16% per ovocita prep.
ATTENZIONE: cacodilato potassio contiene arsenico.
- Opzione # 1: Preparare la formaldeide / fissazione eptano. Preparare Fixation Buffer: soluzione salina 1x tampone fosfato (PBS) più 150 mM saccarosio. Per utilizzare, rendere fresco con 687,5 ml Fixation Buffer e 312,5 ml 16% di formaldeideper ovocita prep.
- Preparare PBS / Triton X-100: 1x PBS + 1% o 0,05% Triton X-100. Conservare a 4 ° C.
- Preparare PBS-Tween 20-Bovine Serum Albumin (BSA) (PTB): 1x PBS, 0,5% BSA (w / v), e 0,1% Tween-20. Può essere conservato a 4 ° C per una settimana.
- Ibridazione in situ fluorescente (FISH) Solutions.
- Preparare 20X Sodio cloruro-sodio citrato (SSC): 3 M di cloruro di sodio e 0,3 M di sodio citrato.
- Preparare 2x SSC-Tween-20 (SSCT): 2x SSC più 0,1% di Tween-20. Fare freschi, ~ 20 ml per ovocita prep.
- Preparare soluzioni formammide: 2x SSC, 0,1% Tween-20, più formammide. Fare fresco, 1 ml 20% formammide, 0,5 ml 40% formammide, e 2 ml di 50% formammide per ovocita prep.
ATTENZIONE: Indossare guanti durante l'utilizzo di soluzioni formammide in una cappa aspirante. Smaltire i rifiuti secondo le linee guida istituzionali. - Preparare la soluzione di ibridazione: 2x SSC, 50% formammide, e il 10% di solfato di destrano (w / v). Conservare a 4 ° C.
- Sonde pesce.
- Ordine oligonucleotidi (vedi Tabella 1 per le sequenze) con la purificazione HPLC e desiderato 5 modifica 'fluorescente (per esempio, Cy3 o Cy5). Risospendere in Tris-EDTA (TE) a 50 ng / ml.
NOTA: Proteggere oligonucleotidi da esposizione alla luce in ogni momento.
- Ordine oligonucleotidi (vedi Tabella 1 per le sequenze) con la purificazione HPLC e desiderato 5 modifica 'fluorescente (per esempio, Cy3 o Cy5). Risospendere in Tris-EDTA (TE) a 50 ng / ml.
2. Raccolta di ritardo-fase di Drosophila ovociti
- Come ovociti Drosophila con membrane intatte si attacca alla plastica e vetro, pre-rivestire l'interno di un tubo 5 ml e una pipetta Pasteur per ovocita preparazione con PTB.
- Anestetizzare tutti ~ 100 a 300 mosche yeasted con anidride carbonica e aggiungere ad un frullatore contenente ~ 100 ml di 1x tampone di Robb. Pulse tre volte (~ 1 sec ciascuno). Mantenere gli ovociti in Robb di per <20 min per evitare l'attivazione.
NOTA: In alternativa, gli ovociti possono essere sezionati a mano dalle femmine. Il vantaggio di questo metodo è che richiede meno femmine. Tuttavia, la cura deve essere presa per limitare l'esposizione al biossido di carbonio a solo pochi minuti per evitare artefatti associata con ipossia 7. - Filtrare maglie larghe (~ 1.500 micron) in 250 ml bicchiere per rimuovere grandi parti del corpo. Se molti addomi intatte rimangono ancora sul materiale della maglia, ri-macinare con ulteriore buffer di Robb, e filtro. Lasciare riposare ~ 2 min, poi aspirare al largo strato superiore, eliminando come molti dei grandi parti del corpo il più possibile.
- Filtro attraverso piccoli mesh (~ 300 micron) in un becher da 250 ml. Risciacquare rimanenti ovociti su primo bicchiere usando aggiuntivo di Robb e rivestito Pasteur pipetta. Lasciare riposare ~ 3 min; ovociti si depositerà fuori. Aspirare fuori tutti ma ~ 10 ml.
- Versare la maggior quantità di 10 ml, come si inserisce nel tubo rivestito da 5 ml. Lasciare riposare, rimuovere il liquido, e ripetere con resto. Risciacquare ovociti rimanenti di coppa con ulteriore Pasteur pipetta di Robb e rivestito. Lasciate stabilirsi in 5 ml di tubo per ~ 3-5 minuti.
3. Trattamenti farmacologici (Opzionale)
- Coat un secondo tubo 5 ml con PTB per ogni preparazione ovocita. Aggiungere solvente appropriato (controllo) o farmaco per 1 ml di Robb ciascuno per ogni prep ovocita (Tabella 2).
- ovociti diviso in seconda rivestito tubo 5 ml. Lasciare riposare, rimuovere il liquido e aggiungere 1 ml di Robb più solventi in un tubo e 1 ml di Robb più farmaco nel secondo tubo. Nutate un'adeguata quantità di tempo per il trattamento farmacologico (Tabella 2). Let stabilirsi.
4. Fissazione
- Aspirare fuori tutto il liquido e subito aggiungere 1 ml Fix.
- Opzione # 1: Formaldeide / eptano fissazione (fissazione Buffer più 5% di formaldeide).
- Fix per 2,5 minuti su un nutator. Aggiungere 1 ml di eptano e vortex 1 min. Lasciare riposare ~ 1 min.
- Rimuovere tutto il liquido, e quindi aggiungere 1 ml di PBS 1x. Vortex 30 sec. Lasciare riposare ~ 1 min.
- Rimuovere tutto il liquido, e quindi riempire il tubo con PBS 1x.
NOTA: Gli oociti possono essere utilizzati immediatamente o conservare sul nutator per diverse ore a temperatura ambiente.
- Opzione # 2: la fissazione Formaldeide / cacodilato (Fix Mix più 8% di formaldeide e 100 mm cacodilato).
- Fix per 6 minuti su un nutator. Lasciare riposare 2 minuti. Rimuovere il liquido, e quindi riempire il tubo con PBS 1x.
NOTA: Gli oociti possono essere utilizzati immediatamente o conservare sul nutator per diverse ore a temperatura ambiente.
- Fix per 6 minuti su un nutator. Lasciare riposare 2 minuti. Rimuovere il liquido, e quindi riempire il tubo con PBS 1x.
5. Rimozione Membrane ( "Rolling")
- Utilizzando rivestito pipetta Pasteur, aggiungere ~ 500 a 1.000 ovociti alla parte (sabbiato) smerigliato di un vetrino. Rimuovere tutte le parti del corpo e dei materiali con pinze estranei. Non lasciate che gli ovociti asciugare; aggiungere 1x PBS come necessario.
- Posizionare un vetrino in cima degli ovociti e delicatamente ovociti "Roll", fino tutte le membrane vengono rimossi (trascinando il bordo del vetrino attraverso gli ovociti funziona meglio.) Controllare periodicamente i progressi sotto il microscopio, l'aggiunta più 1x PBS, se necessario. Fare attenzione a come troppa pressione distruggerà gli ovociti.
NOTA: Per immunofluorescenza solo continuare con il passo 6. Per il pesce (con o senza immunofluorescenza), passare al punto 7.
6. Anticorpo colorazione di Drosophila ovociti
- Estrazione e Blocco
- Risciacquare ovociti arrotolato in un tubo da 15 ml contenente ~ 15 ml di PBS / 1% Triton X-100. ovociti Nutate in questa soluzione per non meno di 1,5 ore e non più di 2 ore.Questo passaggio consente la penetrazione degli anticorpi.
- Lasciate ovociti stabilirsi ~ 2 min. Rimuovere il liquido insieme con il maggior numero possibile di membrane, quindi aggiungere PBS / 0,05% Triton X-100.
NOTA: Le membrane si depositerà più lento di ovociti laminati. - Lasciate ovociti depositano ~ 2 minuti, quindi rimuovere tutti tranne ~ 1 ml di liquido. ovociti Trasferire graduato da 1,5 ml di tubo e rimuovere il liquido restante. Aggiungere 1 ml PTB per il blocco e nutate per 1 ora.
- colorazione degli anticorpi
- Pre-assorbimento di anticorpi secondari contro embrioni.
NOTA: Questo passaggio elimina la colorazione di fondo da non specifici anticorpi interazioni con le proteine di Drosophila.- Raccogliere e risolvere embrioni di Drosophila (~ 25 microlitri) per procedura tipica 8. Conservare in metanolo a -20 ° C.
- Rimuovere metanolo da embrioni, aggiungere 800 ml di metanolo più 200 ml 1x PBS, e nutate per 15 min. Togliere 500 ml di surnatante e sostituire con 500 microlitri PBS 1x. Poi nutate per 15 min. Ripetere due volte (per un totale di ~ 1 ora di lavaggi) e quindi completare in PTB.
NOTA: Gli embrioni possono essere utilizzati immediatamente o mantenimento in nutator per diverse ore a temperatura ambiente. - Rimuovere liquido, riempire con PTB a 200 ml per ovocita di preparazione, e aggiungere anticorpi secondari fluorescenza marcata in opportune diluizioni (tenendo presente che il volume finale sarà di 300 ml;. Vedi punto 7.4) Nutate a 4 ° C per una notte (preferibile) oa temperatura ambiente per 3 a 4 ore.
NOTA: Gli anticorpi pre-assorbito saranno utilizzati nel passaggio 6.2.4.
NOTA: I campioni al buio per quanto possibile, una volta sono stati aggiunti anticorpi fluorescenti.
- Rimuovere il liquido da ovociti, riempire con PTB a 300 ml, e aggiungere anticorpi primari a diluizioni appropriate. Nutate a 4 ° C per una notte (preferibile) oa temperatura ambiente per 3 a 4 ore.
- Lavare ovociti quattro volte per 15 minuti ciascuno con 1 ml PTB.
- Rimuovereliquido da ovociti, aggiungere 200 ml di surnatante da embrioni (pre-assorbito anticorpi secondari). Poi riempire con PTB a 300 ml. Nutate a temperatura ambiente per 3 a 4 ore (preferibile) sia a 4 ° C durante la notte.
- Lavare ovociti una volta per 15 minuti con 1 ml PTB, rimuovere il liquido. Quindi aggiungere 0,5 ml Hoechst 33342 e 500 microlitri PTB e nutate per 7 minuti.
- Lavare ovociti due volte per 15 minuti ciascuno con 1 ml PTB.
NOTA: ovociti possono essere montati su una slitta immediatamente o possono essere conservati in PTB a 4 ° C fino al momento imaging.
- Pre-assorbimento di anticorpi secondari contro embrioni.
7. FISH (continuare dal punto 5 di cui sopra)
- Risciacquare ovociti laminati in un tubo da 15 ml contenente 15 ml ~ 2x SSCT. Lasciate ovociti stabilirsi ~ 2 min. Rimuovere tutti ma ~ 0,5 ml di liquido lungo con il maggior numero possibile di membrane.
NOTA: Le membrane si depositerà più lento di ovociti laminati. - Trasferimento ovociti a 0,5 ml di tubo e rimuovere il liquido restante. Successivamente aggiungere e rimuovere 500 microlitri20%, 40%, e 50% formammide soluzioni, oscillante per 10 min in ciascuna soluzione.
NOTA: Gli oociti si depositerà più lento con percentuali più elevate di formammide. - Rimuovere il liquido, quindi aggiungere soluzione formammide 500 microlitri 50%, e nutate a 37 ° C per 1 a 5 ore.
NOTA: più lunga incubazione si traducono in una migliore penetrazione della sonda. - Rimuovere il liquido, lasciando non più di ~ 100 microlitri oociti, e aggiungere la soluzione di ibridazione 36 microlitri più 2 ml di sonda (50 ng / ml) e 2 ml di acqua o 2 microlitri di una sonda 2 nd (Tabella 1).
- Incubare a 91 ° C per 3 min (solo FISH) o 80 ° C per 20 min (FISH più immunofluorescenza), seguita da incubazione in un bagno d'acqua a 37 ° C durante la notte.
NOTA: Questi passaggi possono essere eseguite in un termociclatore. - Non rimuovere il liquido. Aggiungere 500 microlitri soluzione al 50% formammide e nutate a 37 ° C per 1 ora.
- Lasciare riposare, rimuovere il liquido, aggiungere la soluzione formammide 500 microlitri 50%, und nutate a 37 ° C per 1 ora.
- Lasciare riposare, rimuovere il liquido, aggiungere la soluzione formammide 500 microlitri 20%, e nutate a temperatura ambiente per 10 min.
- Eseguire tre lavaggi rapidi in 500 microlitri 2x SSCT (lasciare riposare, eliminare e aggiungere liquido, capovolgere diverse volte, ripetere.) Lasciare riposare, rimuovere il liquido, quindi aggiungere 500 microlitri PTB e nutate per 4 ore.
8. colorazione degli anticorpi dopo la FISH
- Rimuovere il liquido da ovociti, riempire con PTB a 300 ml e aggiungere 10 ml di anticorpi anti-α-tubulina coniugato con FITC. In alternativa, altri anticorpi possono essere utilizzati, seguendo il protocollo sopra. Nutate a temperatura ambiente per una notte.
- Lavare ovociti una volta per 15 minuti con 500 microlitri PTB, rimuovere il liquido, quindi aggiungere 0,5 ml Hoechst 33342 e 500 microlitri PTB e nutate per 7 minuti.
- Lavare ovociti due volte per 15 minuti ciascuno con 500 microlitri PTB.
NOTA: Gli oociti possono essere montati su una slitta immediatamente o possono essere conservati in PTB a 4 ° C fino al momentoimaging. Mantenere ovociti al buio per quanto possibile, una volta sono stati aggiunti anticorpi fluorescenti.
| Ripetere Nome | Cromosoma | Oligo Sequenza * |
| 359 | X | GGGATCGTTAGCACTGGTAATTAGCTGC |
| AACAC | 2 | AACACAACACAACACAACACAACACAACACAACACAACAC |
| dodeca | 3 | CCCGTACTGGTCCCGTACTCGGTCCCGTACTCGGT |
| 1.686 | 2 + 3 | AATAACATAGAATAACATAGAATAACATAG |
| AATAT | 4 (+ Y) | AATATAATATAATATAATATAATATAATAT |
| * 359 sequenza di Eric Joyce, comunicazione personale, altre sequenze di Sullivan et al. 8 | ||
Tabella 1: sonde FISH per Drosophila ripete centromeriche.
| Droga | Solvente | la concentrazione della | concentrazione finale | Tempo di trattamento | Effetto |
| colchicina | etanolo | 125 mm | 150 pM | 10 min o 30 min | destabilizzare non cinetocore (10 min) 9 o tutti i microtubuli (30 min) |
| paclitaxel | DMSO | 10 mM | 10 mM | 10 minuti | stabilizzare microtubules |
| Binucleine 2 | DMSO | 25 mM | 25 micron | 20 min | inibire Aurora B chinasi 10 |
Tabella 2: Trattamento farmacologico.
Risultati
I metodi che abbiamo descritto qui comporterà la raccolta di fase tardo-ovociti Drosophila che rappresentano tre fasi della meiosi (Figura 1). Gli ovociti in profase si distinguono per la presenza della membrana nucleare, che è visibile dalla mancanza di segnale di tubulina nella regione circostante il cariosoma (Figura 1A). Prometafase è il periodo dopo la rottura membrana nucleare durante il quale le assembla mandrino. Durante prometafase, il cariosoma assume una caratteristica forma, diventando allungata spesso con il 4 ° cromosomi a parte la massa cariosoma principale (Figura 1B). Prometafase si conclude con metafase, in cui gli ovociti di Drosophila naturalmente arresto fino ovulazione. In ovociti in metafase, il cariosoma è ritratta in una forma rotonda (Figura 1C).
Descriviamo qui metodi di manipolare la velocità di deposizione delle uova delle femmine di Drosophila per arricchire di ovociti sia in prometafase o metafase. Gli ovociti provenienti da collezioni prometafase-arricchite mostrano spesso il cariosoma allungata (Figura 2A), mentre le collezioni in metafase arricchito o collezioni di femmine vergini di Drosophila, che eliminano quasi completamente la deposizione delle uova, mostrano in primo luogo il cariosoma rotondo (Figura 2B). È interessante notare che, collezioni prometafase-arricchite anche in genere mostrano molto più robusto mandrini, suggerendo che sia il cambiamento cariosoma e il mandrino tra prometafase e metafase in Drosophila ovociti 9.
La figura 3 mostra immagini rappresentative dei due protocolli descritti qui. Anticorpi contro α-tubulina (per mostrare il mandrino), CENP-C (per mostrare centromeri), e INCENP (per mostrare il fuso centrale) sono stati utilizzati su ovociti fissati con formaldehyde / eptano (Figura 3A). Sonde per le sequenze centromeriche ripetitive sul cromosoma 2 ° (AACAC) e 3 ° cromosoma (dodeca) sono stati utilizzati su ovociti fissate con formaldeide / cacodilato e co-colorate con un anticorpo α-tubulina secondo il protocollo FISH (Figura 3B). La sonda AACAC appare come molti focolai cluster mentre la sonda dodeca appare come un singolo fuoco per cromosoma. Gli ovociti trattate con 150 mM colchicina per 10 minuti sono stati fissati con formaldeide / eptano (Figura 3C). Questo trattamento elimina la maggior parte non cinetocoro-microtubuli, che si traduce in tutti microtubuli contattano il DNA a foci centromero-marcato. Gli ovociti trattati con 10 mM paclitaxel per 10 min spettacolo microtubuli eccessivi nel citoplasma, ma poco effetto sui microtubuli del fuso (Figura 3D). Gli ovociti trattati con 25 mM Binucleine 2 per 20 minuti per inibire la perdita di Aurora B chinasi spettacolo completo dimicrotubuli del fuso (Figura 3E).
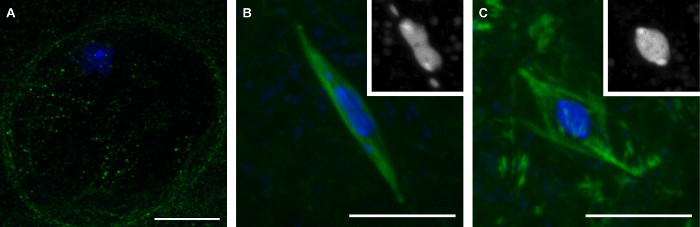
Figura 1: Tre fasi di maturi ovociti Drosophila:. Profase, Prometafase, e Metaphase immagini confocale di ovociti di Drosophila in profase (A), prometafase (B), e metafase (C) della meiosi I. DNA è mostrato in blu e tubulina è mostrato in verde in fusione di immagini. Inserti in (B) e (C) mostrano DNA in bianco. Barre di scala = 10 micron. Clicca qui per vedere una versione più grande di questa figura.

Figura 2:Prometaphase- vs. collezioni metafase arricchita di ovociti Drosophila. Immagini confocali di ovociti Drosophila da prometafase arricchito (A) o collezioni (B) in metafase arricchita. DNA è mostrato in blu e tubulina è mostrato in verde. Barre di scala = 10 micron. Clicca qui per vedere una versione più grande di questa figura.
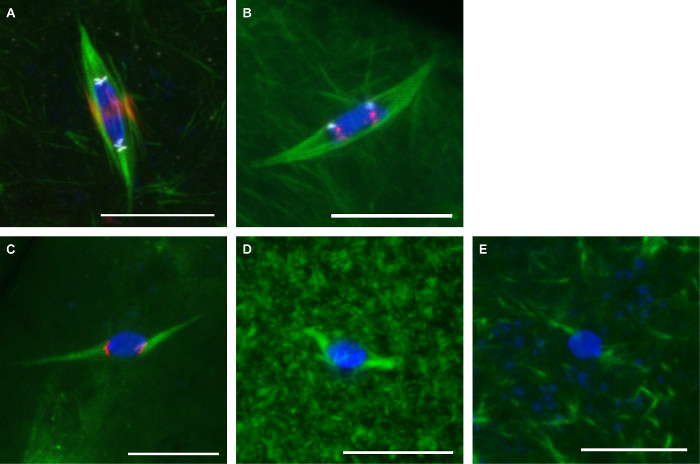
Figura 3: colorazione anticorpo, pesce, droga e trattamenti di ovociti Drosophila immagini confocale di ovociti Drosophila con DNA in blu e tubulina in verde.. Barre di scala = 10 micron. (A) immunofluorescenza in formaldeide/ Eptano fissaggio e con INCENP (fuso centrale) in rosso e CENP-C (centromeri) in bianco. (B) FISH in formaldeide / cacodilato fissazione con AACAC mostrato in dodeca rosso e mostrato in bianco. (C) Il trattamento con 150 micron colchicina per 10 minuti con CENP-C indicato in rosso. Il trattamento con 10 mM paclitaxel per 10 min (D) o 25 micron Binucleine 2 per 20 min (E). Clicca qui per vedere una versione più grande di questa figura.
Discussione
Messa in scena Drosophila ovociti
Anche se un cariosoma allungata è spesso visto in ovociti prometafase, utilizzando cariosoma forma di distinguere prometafase da ovociti in metafase può essere problematico. Durante prometafase, il cariosoma inizia come una forma rotonda, si allunga, e poi si ritrae ad una forma rotonda come l'ovocita si avvicina l'arresto metafase. Ciò significa che molti ovociti prometafase non hanno un cariosoma allungata. Inoltre, se gli ovociti mutanti o trattati con farmaci vengono esaminati, cariosoma forma può essere influenzata, precludendo usando questo metodo per mettere in scena ovociti. Perché altri marcatori per distinguere queste fasi non sono al momento disponibili, usiamo il metodo sopra descritto per manipolare la velocità di deposizione delle uova delle femmine di Drosophila per arricchire di ovociti sia in prometafase o metafase. La logica è che se gli ovociti spendere un determinato periodo di tempo in prometafase, e una quantità di tempo indefinito arrsati in metafase, che dura fino a quando la deposizione delle uova, quindi più rapida deposizione delle uova sarà inclinare verso una maggiore percentuale di ovociti prometafase, mentre più lenta deposizione delle uova arricchirà per metafase. La quantità di sforzo richiesto per raccogliere femmine vergini o raccogliere le femmine nel corso di un periodo di tempo più breve di 2 giorni, come descritto da Gilliland et al. 6, non è ricompensato da un sensibile aumento ovociti prometafase. E 'anche possibile utilizzare le appendici dorsali di mettere in scena ovociti preparati con questo protocollo come appendici dorsali vengono rimossi con le membrane. Anche se non è possibile mettere in scena i singoli ovociti con certezza al 100% con questo metodo, i dati provenienti da prometafase-arricchiti o raccolte in metafase-arricchito possono essere presi insieme per trarre conclusioni su queste diverse fasi 9.
Ovociti Drosophila non vengono fecondati fino a che non passano attraverso il oviduct; Pertanto, perché gli ovociti raccolti per the protocolli descritti qui esaminare ovociti prelevati prima deposizione delle uova, questi ovociti non sono stati fecondati. Il passaggio attraverso il oviduct provoca anche l'ovocita per attivare e riprendere la progressione del ciclo cellulare. I metodi per esaminare le fasi del ciclo cellulare dopo metafase esisto 11,12, ma sono al di fuori del campo di applicazione di questo protocollo.
Considerazioni metodo di fissazione
Descriviamo due metodi distinti per la fissazione di fase tardo-Drosophila ovociti. Il metodo di fissazione formaldeide / cacodilato è stato descritto da Theurkauf e Hawley 3 e il metodo di fissazione formaldeide / eptano prima è stata descritta da Zou et al. 4. Inoltre, un terzo metodo (metanolo fissazione) è utilizzato da circa 13, ma non descritti qui. La rimozione delle membrane ovocita è un po 'più difficile dopo la formaldeide / eptano fissaggio rispetto alla formaldeide / cacodilato. Questo perché "rolling" dipendonos sul attrito tra il vetrino e ovociti, e la formaldeide / fissazione eptano rende gli ovociti più scivoloso. Nonostante questa difficoltà aggiunta, la nostra prima scelta del metodo di fissazione, quando la sperimentazione di nuovi anticorpi è la formaldeide / eptano perché funziona meglio per la maggior parte degli anticorpi che abbiamo provato. D'altra parte, preferiamo formaldeide / cacodilato fissazione per FISH, principalmente per la facilità di rimozione della membrana, anche se formaldeide / eptano fissaggio ha avuto successo. Entrambi questi metodi preservare ovociti morfologia meglio di fissazione metanolo, e pertanto si consiglia la fissazione metanolo solo nei casi di anticorpi che sono refrattari a metodi di fissazione a base di formaldeide.
I protocolli descritti qui Focus on Imaging fisso, al fine di dimostrare metodi efficaci per rendere mature ovociti Drosophila suscettibili alla penetrazione degli anticorpi, in particolare attraverso la rimozione delle membrane ovocita. Metodi alternativi per remo membranaval (con pinze 14 o sonicazione 13) sono possibili; tuttavia, troviamo "rolling" per essere il metodo più efficiente e affidabile. Le tecniche per immagini dal vivo sono state descritte altrove 14-16 e sono al di fuori del campo di applicazione di questo protocollo.
Raccomandazioni FISH
FISH in ovociti di Drosophila è stato originariamente descritto da Dernburg et al. 5. Questo protocollo è stato progettato per fornire le condizioni ottimali per la sonda di ibridazione ai cromosomi ovocita abbreviato, ma il protocollo originale non era ottimale per immunofluorescenza. Il metodo sopra descritto comprende adattamenti che abbiamo fatto per migliorare la colorazione degli anticorpi di α-tubulina, che è in primo luogo ciò che usiamo durante l'esecuzione di FISH. Per altri anticorpi, abbassando la temperatura della fase di denaturazione (Passo 7.5) da 80 ° C può essere necessario.
Le sonde qui elencati sono per lasequenze ripetitive nel eterocromatina in prossimità dei centromeri. Dato che queste sequenze sono altamente ripetitive, le sonde temprare a più posti ed i segnali collettive sono piuttosto forti. Abbiamo avuto poco successo con sonde per le sequenze in eucromatina, forse a causa della struttura unica dei cromosomi, mentre contenuta nel cariosoma condensata.
Imaging
Ovociti Drosophila matura, come gli ovociti della maggior parte degli organismi, sono grandi, singole cellule. Ciò significa che vi è un grande volume di citoplasma che contiene un singolo nucleo. Fortunatamente, questo nucleo, noto anche come un cariosoma in Drosophila, può essere facilmente identificato come si trova di solito appena sotto le appendici dorsali vicino alla corteccia. Le appendici dorsali vengono rimossi con le membrane dell'ovocita, ma il cariosoma possono ancora essere situati trovando il piccolo divot nella corteccia ovocita in cui le appendici once erano. Le migliori immagini sono ottenute da ovociti che sono stati montati con questa zolla di fronte al vetrino, poiché ciò colloca il cariosoma più vicina all'obiettivo. Anche se può essere possibile organizzare gli ovociti in questo orientamento prima del montaggio, preferiamo montare molti ovociti casuale e quindi cercare il vetrino per quelli con l'orientamento preferito.
Applicazioni future
In futuro sarà importante per identificare i marcatori che distinguono in modo affidabile prometafase I e metafase I mandrini. Essere in grado di mettere in scena in modo più affidabile gli ovociti ridurrà la dipendenza maggiore intensità di lavoro alternative, come l'imaging un gran numero di ovociti stadio arricchito o immagini dal vivo, che ha anche i suoi problemi di sosta. Questo metodo è un metodo di base che può essere utilizzato per sfruttare i progressi nel campo della genetica di Drosophila come nuovi strumenti diventano disponibili per modificare o mettere fuori prodotti genici. Questo include metodidi indirizzare direttamente l'attività della proteina con nuovi farmaci o strategie di degradazione mirate. Inoltre, questi metodi non sono limitati a l'imaging mandrini meiotici. Qualsiasi struttura ai ovocita, come il citoscheletro actina, potrebbe essere analizzato utilizzando questi metodi.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
We thank Christian Lehner for providing the CENP-C antibody and Eric Joyce for recommendations on FISH. Work in the McKim lab was funded by a grant from NIH (GM101955).
Materiali
| Name | Company | Catalog Number | Comments |
| 15 ml conical tubes | Various | ||
| 16% formaldehyde | Ted Pella, Inc. | 18505 | HAZARDOUS; once opened, discard after one month |
| 250 ml beakers | Various | ||
| 5 ml tubes | Various | ||
| active dry yeast | Various | mix with water to make a paste the consistency of peanut butter | |
| anti-α-tubulin antibody conjugated to FITC | Sigma | F2168 | clone DM1A |
| Binucleine 2 | Sigma | B1186 | HAZARDOUS |
| blender | Various | ||
| bovine serum albumin | Sigma | A4161 | |
| calcium chloride | Various | ||
| colchicine | Sigma | C-9754 | HAZARDOUS |
| coverslips | VWR | 48366-227 | No. 1 1/2 |
| dextran sulfate | Various | ||
| DMSO | Various | ||
| EGTA | Various | ||
| ethanol | Various | ||
| forceps | Ted Pella, Inc. | 5622 | Dumont tweezers high precision grade style 5 |
| formamide | Sigma | 47670-250ML-F | |
| glass slides | VWR | 48312-003 | |
| glucose | Various | ||
| graduated 1.5 ml tubes | Various | ||
| HEPES | VWR | EM-5330 | available from several venders |
| Hoechst 33342 | Various | ||
| magnesium chloride | Various | ||
| methanol | Various | ||
| large mesh (~1,500 µm) | VWR | AA43657-NK | variety of formats and other suppliers, 12 or 14 mesh |
| small mesh (~300 µm) | Spectrum labs | 146 424 | variety of formats, e.g., 146 422 or 146 486 |
| nutator | Various | ||
| Pasteur pipets | Various | ||
| potassium acetate | Various | ||
| Cacodylic acid | Sigma | C0125 | HAZARDOUS; alternatively, sodium cacodylate may be substituted |
| potassium hydroxide | Various | ||
| sodium acetate | Various | ||
| sodium chloride | Various | ||
| sodium citrate | Various | ||
| sodium hydroxide | Various | ||
| sucrose | Various | ||
| taxol (paclitaxel) | Sigma | T1912 | HAZARDOUS |
| Triton X-100 | Fisher | PI-28314 | |
| Tween 20 | Fisher | PI-28320 | |
| vortex | Various |
Riferimenti
- Bridges, C. B. Non-disjunction as proof of the chromosome theory of heredity. Genetics. 1 (1), 1-52 (1916).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Theurkauf, W. E., Hawley, R. S. Meiotic spindle assembly in Drosophila females: behavior of nonexchange chromosomes and the effects of mutations in the nod kinesin-like protein. J Cell Biol. 116 (5), 1167-1180 (1992).
- Zou, J., Hallen, M. A., Yankel, C. D., Endow, S. A. A microtubule-destabilizing kinesin motor regulates spindle length and anchoring in oocytes. J Cell Biol. 180 (3), 459-466 (2008).
- Dernburg, A. F., Sedat, J. W., Hawley, R. S. Direct evidence of a role for heterochromatin in meiotic chromosome segregation. Cell. 86 (1), 135-146 (1996).
- Gilliland, W. D., Hughes, S. F., Vietti, D. R., Hawley, R. S. Congression of achiasmate chromosomes to the metaphase plate in Drosophila melanogaster oocytes. Dev Biol. 325 (1), 122-128 (2009).
- Gilliland, W. D., et al. Hypoxia transiently sequesters mps1 and polo to collagenase-sensitive filaments in Drosophila prometaphase oocytes. PLoS One. 4 (10), e7544(2009).
- Sullivan, W., Ashburner, M., Hawley, R. S. Drosophila Protocols. , Cold Spring Harbor Laboratory Press. (2000).
- Radford, S. J., Hoang, T. L., Głuszek, A. A., Ohkura, H., McKim, K. S. Lateral and End-On Kinetochore Attachments Are Coordinated to Achieve Bi-orientation in Drosophila Oocytes. PLoS Genet. 11 (10), e1005605(2015).
- Smurnyy, Y., Toms, A. V., Hickson, G. R., Eck, M. J., Eggert, U. S. Binucleine 2, an isoform-specific inhibitor of Drosophila Aurora B kinase, provides insights into the mechanism of cytokinesis. ACS Chem Biol. 5 (11), 1015-1020 (2010).
- Mahowald, A. P., Goralski, T. J., Caulton, J. H. In vitro activation of Drosophila eggs. Dev Biol. 98 (2), 437-445 (1983).
- Page, A. W., Orr-Weaver, T. L. Activation of the meiotic divisions in Drosophila oocytes. Dev Biol. 183 (2), 195-207 (1997).
- Tavosanis, G., Llamazares, S., Goulielmos, G., Gonzalez, C. Essential role for gamma-tubulin in the acentriolar female meiotic spindle of Drosophila. EMBO J. 16 (8), 1809-1819 (1997).
- Endow, S. A., Komma, D. J. Spindle dynamics during meiosis in Drosophila oocytes. J Cell Biol. 137 (6), 1321-1336 (1997).
- Matthies, H. J., Clarkson, M., Saint, R. B., Namba, R., Hawley, R. S. Drosophila Protocols. Sullivan, W., Ashburner, M., Hawley, R. S. , Cold Spring Harbor Laboratory Press. 67-85 (2000).
- Colombié, N., et al. Dual roles of Incenp crucial to the assembly of the acentrosomal metaphase spindle in female meiosis. Development. 135 (19), 3239-3246 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon