Method Article
Методы для работы с изображениями прометафазе и метафазе мейоза I в фиксированных
В этой статье
Резюме
We present protocols for the collection, preparation, and imaging of mature Drosophila oocytes. These methods allow the visualization of chromosome behavior and spindle assembly and function during meiosis.
Аннотация
Chromosome segregation in human oocytes is error prone, resulting in aneuploidy, which is the leading genetic cause of miscarriage and birth defects. The study of chromosome behavior in oocytes from model organisms holds much promise to uncover the molecular basis of the susceptibility of human oocytes to aneuploidy. Drosophila melanogaster is amenable to genetic manipulation, with over 100 years of research, community, and technique development. Visualizing chromosome behavior and spindle assembly in Drosophila oocytes has particular challenges, however, due primarily to the presence of membranes surrounding the oocyte that are impenetrable to antibodies. We describe here protocols for the collection, preparation, and imaging of meiosis I spindle assembly and chromosome behavior in Drosophila oocytes, which allow the molecular dissection of chromosome segregation in this important model organism.
Введение
The study of meiosis is sometimes described as the "genetics of genetics". This is because the fundamental properties of chromosome inheritance and independent assortment are carried out through the segregation of chromosomes during gamete production. An important demonstration of the chromosome theory of inheritance came in 1916 from the work of Calvin Bridges in Drosophila melanogaster1. This and other classical genetics studies in Drosophila contributed greatly to our understanding of genetics. Cytological examination of meiotic chromosomes in Drosophila oocytes, however, has been challenging. This is primarily because immunofluorescence of late-stage Drosophila oocytes, when the spindle assembles and chromosomes are oriented for segregation, is hampered by the presence of membranes that render the oocyte impenetrable to antibodies.
Despite this challenge, Drosophila oocytes remain an attractive model for the study of chromosome behavior and spindle assembly. This is because of the powerful genetic tools available in Drosophila, but also because the oocytes arrest at metaphase I, when the chromosomes are oriented and the spindle is fully formed. This facilitates the collection and examination of large numbers of oocytes at this important stage of cell division. In addition, a simple model organism that is amenable to genetic manipulation for the study of oocyte chromosome segregation can provide an important contribution to our understanding of human reproductive health. Errors in chromosome number are the leading genetic cause of miscarriage and birth defects in humans2. A majority of these errors can be traced to the oocyte and are correlated with increasing maternal age. The average age of mothers in the U.S. has been increasing, making this a major public health concern.
We describe here methods for the cytological examination of Drosophila oocytes, including a demonstration of how to remove the oocyte membranes. These methods are modifications of protocols first described by Theurkauf and Hawley3, Zou et al.4, and Dernburg et al.5. We also include methods for the enrichment of different stages of oocytes, based on a protocol first described by Gilliland et al.6. Finally, we add instructions for the drug treatment of Drosophila oocytes. Together, these methods allow the cytological investigation of oocyte chromosome segregation and spindle assembly in Drosophila.
протокол
Примечание: Процедуры выполняются при комнатной температуре, если не указано иное. Терморегулируемая инкубаторы используются для поддержания температуры для мух разведению и крестов, если не указано иное.
1. Подготовка
- Подготовить Мухи.
- Прометафазе обогащенные коллекции ооцитов.
- Очистить взрослых мух от здоровых, молодых фондовых или кросс-культур. Возраст бутылки в течение двух дней при 25 ° C.
Примечание: Как правило, два здоровых бутылки будет достаточно, хотя и более могут быть необходимы для некоторых перекрестных культур. - Через два дня, собирать ~ 100 до 300 самок (которые составляют от 0 до 2 дней в этой точке) из бутылки. Женщины не должны быть девственницами. Добавить мазок дрожжевой пасты на стороне флакона и помещают 30 женщин и от 10 до 15 самцов, каждый в дрожжевого флаконах. Возраст флаконах в течение двух дней при 25 ° C.
- Очистить взрослых мух от здоровых, молодых фондовых или кросс-культур. Возраст бутылки в течение двух дней при 25 ° C.
- Метафаза обогащенный ооцита Коллекции.
- Соберите 100 ~ до 300 самок на складе или кросс КУЛЬТУРАэс. Добавить мазок дрожжевой пасты на стороне флакона и поместить 30 женщин каждый (без добавленных самцов) в дрожжевого флаконах. Возраст флаконах в течение трех-пяти дней, при 25 ° C.
- Прометафазе обогащенные коллекции ооцитов.
- Подготовка решения.
Примечание: Растворы можно хранить неопределенно долго при комнатной температуре, если не указано иное.- Готовят модифицированным буфером Робб (5x): 500 мМ HEPES, 500 мМ сахарозы, 275 мМ ацетат натрия, 200 мМ ацетата калия, 50 мМ глюкозы, 6 мМ хлорида магния и 5 мМ хлорида кальция. Используйте 10 Н 11: 8: гидроксид натрия гидроксид калия, чтобы довести рН до 7,4. Стерилизовать фильтрацией; не автоклав. Хранить при -20 ° C. Оттепель по мере необходимости для подготовки ~ 200 мл на ооцит преп 1x Робб.
- Фиксирующие решения.
- Вариант № 1: Подготовьте формальдегид / гептан фиксации. Готовят Fixation буфер: 1x забуференный фосфатом физиологический раствор (PBS) плюс 150 мМ сахарозы. Чтобы использовать, сделайте свежий с 687,5 мкл Фиксирование буфера и 312,5 мкл 16% формальдегидана ооцит преп.
ВНИМАНИЕ: Надевайте перчатки при использовании растворов формальдегида в вытяжном шкафу. Утилизация отходов в соответствии с ведомственным руководящим принципам. - Вариант № 2: Подготовить формальдегид / какодилате фиксации. Подготовка Фикс смеси: 250 мМ сахарозы, 100 мМ ацетата калия (рН 7,5), 25 мМ ацетата натрия (рН 7,0), и 25 мМ EGTA (рН 8,0). Для того, чтобы использовать, чтобы свежие 400 мкл Fix Mix, 100 мкл какодилат калия (1 М, рН 7,2), и 500 мкл 16% формальдегида на ооцит преп.
ВНИМАНИЕ: Калий какодилат содержит мышьяк.
- Вариант № 1: Подготовьте формальдегид / гептан фиксации. Готовят Fixation буфер: 1x забуференный фосфатом физиологический раствор (PBS) плюс 150 мМ сахарозы. Чтобы использовать, сделайте свежий с 687,5 мкл Фиксирование буфера и 312,5 мкл 16% формальдегидана ооцит преп.
- Готовят PBS / Triton X-100: 1X PBS плюс 1% или 0,05% Triton X-100. Хранить при температуре 4 ° С.
- Готовят PBS-Tween 20-бычьего сывороточного альбумина (БСА) (PTB): 1x PBS, 0,5% бычьего сывороточного альбумина (вес / объем) и 0,1% Tween-20. Можно хранить при температуре 4 ° С в течение одной недели.
- Флуоресценцию в гибридизация (FISH) Solutions.
- Приготовьте хлорид натрия-20X цитрата натрия (SSC): 3 М хлорида натрия и 0,3 М цитрат натрия.
- Приготовьте 2 x SSC-твин-20 (ЦФСС): 2 x SSC плюс 0,1% твин-20. Сделайте свежие, 20 мл ~ на ооцит преп.
- Подготовка формамида решения: 2x SSC, 0,1% Tween-20, плюс формамида. Сделать свежий, 1 мл 20% формамид, 0,5 мл 40% формамида, и 2 мл 50% формамида на ооцит преп.
ВНИМАНИЕ: Надевайте перчатки при использовании формамида решений в вытяжном шкафу. Утилизация отходов в соответствии с ведомственным руководящим принципам. - Подготовка раствора гибридизации: 2х SSC, 50% формамиде и 10% сульфата декстрана (вес / объем). Хранить при температуре 4 ° С.
- FISH зондами.
- Заказать олигонуклеотиды (см таблицу 1 для последовательностей) с очисткой ВЭЖХ и желательно 5 'флуоресцентный модификации (например, Cy3 или Cy5). Ресуспендируют в Трис-ЭДТА (ТЭ) при 50 нг / мкл.
ПРИМЕЧАНИЕ: Защита от олиго воздействия света во все времена.
- Заказать олигонуклеотиды (см таблицу 1 для последовательностей) с очисткой ВЭЖХ и желательно 5 'флуоресцентный модификации (например, Cy3 или Cy5). Ресуспендируют в Трис-ЭДТА (ТЭ) при 50 нг / мкл.
2. Сбор поздних стадий дрозофилы ооцитов
- В виде Drosophila ооциты с мембранами интактных будет придерживаться пластика и стекла, предварительно смажьте внутри одного 5 мл трубки и один Пастера пипеткой на ооцит преп с ПТБ.
- Обезболить все 100 ~ 300 до дрожжевого мух с диоксидом углерода и добавляют в смеситель, содержащий ~ 100 мл 1x буфер Робб. Импульсные три раза (~ 1 сек каждый). Держите ооциты в Робб для <20 мин, чтобы избежать активации.
Примечание: В качестве альтернативы ооциты могут быть вручную рассекали от самок. Преимущество этого способа состоит в том, что она требует меньше самок. Тем не менее, необходимо соблюдать осторожность , чтобы ограничить воздействие углекислого газа лишь несколько минут , чтобы избежать артефактов , связанных с гипоксией 7. - Фильтр через большие сетки (~ 1500 мкм) в 250 мл мензурку для удаления больших частей тела. Если многие неповрежденные животы остаются на сетки, повторно молотилки материала с использованием дополнительного буфера Робб и фильтр снова. Пусть оседать ~ 2 мин, затем Аспирируйте от верхнего слоя, удаляя как многие из больших частей тела, как это возможно.
- Fiчерез фильтр малой сетки (~ 300 мкм) в химический стакан емкостью 250 мл. Промойте оставшиеся ооциты выхода из первого мензурку с использованием дополнительных Робб и покрытую Пастера пипетку. Пусть оседают ~ 3 мин; ооциты будут оседать. Аспирируйте от всех, но ~ 10 мл.
- Налейте столько, сколько из 10 мл, как будет вписываться с покрытием 5 мл трубки. Пусть отстояться, удалить жидкость и повторите с остатком. Промыть оставшиеся ооцитов из мензурку с использованием дополнительного Пастера пипетку Робб и с покрытием. Пусть осесть в 5 мл пробирке в течение ~ 3-5 мин.
3. медикаментозное лечение (необязательно)
- Покройте второй 5 мл трубка с PTB для каждого ооцита преп. Добавить соответствующий растворитель (контроль) или лекарственное средство по 1 мл Робб каждый для каждого ооцита преп (таблица 2).
- Split ооциты во вторую покрытую 5 мл трубки. Пусть отстояться, удалить жидкость, и добавьте 1 мл Робб плюс растворителя в одну пробирку и 1 мл Робб плюс препарат во вторую пробирку. Качаться на соответствующее количество времени для лекарственной терапии (таблица 2). Lи др осесть.
4. Закрепление
- Аспирируйте от всей жидкости и сразу же добавить 1 мл Fix.
- Вариант № 1: Формальдегид / гептан крепление (Фиксирование буфера плюс 5% формальдегида).
- Закрепить в течение 2,5 мин на nutator. Добавить 1 мл гептана и вихревую 1 мин. Пусть оседать ~ 1 мин.
- Удалите всю жидкость, а затем добавляют 1 мл 1x PBS. Vortex 30 сек. Пусть оседать ~ 1 мин.
- Удалите всю жидкость, а затем заполнить трубку с 1x PBS.
Примечание: ооциты могут быть использованы непосредственно или храниться на nutator в течение нескольких часов при комнатной температуре.
- Вариант № 2: Формальдегид / какодилат крепление (Fix Mix плюс 8% формальдегида и 100 мМ какодилат).
- Закрепить в течение 6 минут на nutator. Пусть оседать 2 мин. Удалите жидкость, а затем заполнить трубку с 1x PBS.
Примечание: ооциты могут быть использованы непосредственно или храниться на nutator в течение нескольких часов при комнатной температуре.
- Закрепить в течение 6 минут на nutator. Пусть оседать 2 мин. Удалите жидкость, а затем заполнить трубку с 1x PBS.
5. Удаление Мембраны ( "Роллинг")
- Использование покрытого Пастера пипетку, добавьте ~ 500 до 1000 ооцитов к матовым (пескоструйная обработка) части предметного стекла. Удалите все части тела и посторонний материал, с помощью пинцета. Не позволяйте ооциты высохнуть; добавить 1X PBS в случае необходимости.
- Поместите покровное на вершине ооцитов и мягко "Ролл" ооцитов, пока все мембраны удаляются (перетягиванием края покровного через ооцитов работает лучше всего.) Периодически проверяйте прогресс под микроскопом, добавляя больше 1X PBS по мере необходимости. Будьте осторожны, как слишком большое давление разрушит ооциты.
Примечание: Только для иммунофлюоресценции, перейдите к шагу 6. Для рыбы (с иммунофлуоресценции или без него), перейдите к шагу 7.
6. Антитело Окрашивание Drosophila ооцитов
- Добыча и блокировка
- Полоскание свернутые ооцитов в 15 мл коническую пробирку, содержащую ~ 15 мл PBS / 1% Тритон Х-100. Качаться ооциты в этом растворе в течение не менее 1,5 ч и не более 2 часов.Этот шаг позволяет проникновение антител.
- Пусть ооциты оседать ~ 2 мин. Удалить жидкость вместе с таким количеством мембран, как это возможно, а затем добавить PBS / 0,05% Triton X-100.
Примечание: Мембраны будет располагаться медленнее, чем рулонных ооцитов. - Пусть ооциты оседать ~ 2 мин, а затем удалить все, кроме ~ 1 мл жидкости. Передача ооциты закончил 1,5 мл трубку и удалить оставшуюся жидкость. Добавляют 1 мл РТВ для блокирования и качаться в течение 1 часа.
- Антитело Окрашивание
- Предварительное поглощение вторичных антител против эмбрионов.
Примечание: Этот шаг устраняет фоновое окрашивание от неспецифических взаимодействий антител с Drosophila белков.- Собрать и закрепить Drosophila эмбрионов (~ 25 мкл) за типичной процедуре 8. Хранить в метаноле при температуре от -20 & deg; С.
- Удаления метанола из эмбрионов, добавляют 800 мкл метанола плюс 200 мкл 1X PBS, и качаться в течение 15 мин. Удалить 500 мкл супернатанта и заменить 500 мкл 1x PBS, Затем качаться в течение 15 мин. Повторите два раза (в общей сложности ~ 1 час стирок), а затем закончить в РТВ.
Примечание: Эмбрионы могут быть использованы непосредственно или храниться на nutator в течение нескольких часов при комнатной температуре. - Удалите жидкость, залить РТВ 200 мкл на ооцитов стадии подготовки, а также добавить флуоресцентно-меченых вторичных антител в соответствующих разведений (имея в виду, что окончательный объем будет 300 мкл, см. Шаг 7.4) качаться при 4 ° С в течение ночи (предпочтительно) или при комнатной температуре в течение от 3 до 4 часов.
Примечание: предварительно абсорбируют антитела будут использованы на этапе 6.2.4.
Примечание: Хранить образцы в темноте, насколько это возможно, как только флуоресцентные антитела были добавлены.
- Удалите жидкость из ооцитов, залить РТВ до 300 мкл, и добавить первичные антитела в соответствующих разведений. Качаться при 4 ° С в течение ночи (предпочтительно) или при комнатной температуре в течение от 3 до 4 часов.
- Мытье ооцитов четыре раза в течение 15 мин каждый раз с 1 мл РТВ.
- Удалитьжидкость из ооцитов, добавьте 200 мкл супернатанта из эмбрионов (предварительно абсорбируют вторичными антителами). Затем залить РТВ до 300 мкл. Качаться при комнатной температуре в течение от 3 до 4 ч (предпочтительно) или при 4 ° С в течение ночи.
- Вымойте ооциты один раз в течение 15 мин с 1 мл РТВ, удалить жидкость. Затем добавьте 0,5 мкл Hoechst 33342 и 500 мкл РТВ и качаться в течение 7 мин.
- Вымойте ооциты дважды в течение 15 мин каждый раз с 1 мл РТВ.
Примечание: ооциты могут быть смонтированы на салазках непосредственно или могут быть сохранены в РТВ при 4 ° С до готовности для работы с изображениями.
- Предварительное поглощение вторичных антител против эмбрионов.
7. FISH (Продолжайте с шага 5 выше)
- Полоскание свернутые ооцитов в 15 мл коническую пробирку, содержащую ~ 15 мл 2x SSCT. Пусть ооциты оседать ~ 2 мин. Удалить все, но ~ 0,5 мл жидкости наряду с таким количеством мембран, как это возможно.
Примечание: Мембраны будет располагаться медленнее, чем рулонных ооцитов. - Передача ооцитов до 0,5 мл трубки и удалить оставшуюся жидкость. Последовательно добавлять и удалять 500 мкл20%, 40%, и 50% растворы формамид, нутационное в течение 10 мин в каждом растворе.
Примечание: ооциты будет располагаться медленнее с более высоким процентным содержанием формамида. - Удалить жидкость, затем добавляют 500 мкл 50% -ного раствора формамида и качаться при 37 ° С в течение от 1 до 5 часов.
Примечание: Более инкубирование приводит к лучшему проникновению зонда. - Удалить жидкость, оставив после не более чем ~ 100 мкл ооцитах, и добавить 36 мкл раствора гибридизации плюс 2 мкл зонда (50 нг / мкл) и 2 мкл воды или 2 мкл 2 - й пробы (таблица 1).
- Инкубировать при 91 ° С в течение 3 мин (только рыба) или 80 ° С в течение 20 мин (FISH плюс иммунофлюоресценции), с последующей инкубацией в водяной бане C 37 ° в течение ночи.
Примечание: Эти шаги могут быть выполнены в амплификатор. - Не удаляйте жидкость. Добавить 500 мкл 50% -ного раствора формамида, и качаться при 37 ° С в течение 1 часа.
- Пусть отстояться, удалить жидкость, добавить 500 мкл 50% -ного раствора формамида, А.Н.d качаться при 37 ° С в течение 1 часа.
- Пусть оседать, удалить жидкость, добавьте 500 мкл 20% -ного раствора формамида и качаться при комнатной температуре в течение 10 мин.
- Выполните три быстрых промывок в 500 мкл 2х ЦФСС (пусть отстояться, удалите затем добавить жидкость, инвертировать несколько раз, повторите.) Пусть отстояться, удалить жидкость, затем добавьте 500 мкл РТВ и качаться в течение 4 часов.
8. Антитело Окрашивание после FISH
- Удалите жидкость из ооцитов, залить РТВ до 300 мкл, и добавляют 10 мкл анти-альфа-тубулина антитела, конъюгированного с FITC. В качестве альтернативы, другие антитела могут быть использованы, следующие выше протокола. Качаться при комнатной температуре в течение ночи.
- Промыть ооцитах один раз в течение 15 мин с 500 мкл РТВ, удалить жидкость, затем добавляют 0,5 мкл Hoechst 33342 и 500 мкл РТВ и качаться в течение 7 мин.
- Вымойте ооциты дважды в течение 15 минут каждый с 500 мкл РТВ.
Примечание: ооциты могут быть смонтированы на салазках непосредственно или могут быть сохранены в РТВ при температуре 4 ° С до готовности кизображений. Хранить ооцитов в темноте как можно больше раз флуоресцентные антитела были добавлены.
| Повторить Имя | хромосома | Последовательность Oligo * |
| 359 | Икс | GGGATCGTTAGCACTGGTAATTAGCTGC |
| AACAC | 2 | AACACAACACAACACAACACAACACAACACAACACAACAC |
| додека- | 3 | CCCGTACTGGTCCCGTACTCGGTCCCGTACTCGGT |
| 1,686 | 2 + 3 | AATAACATAGAATAACATAGAATAACATAG |
| AATAT | 4 (+ Y) | AATATAATATAATATAATATAATATAATAT |
| * 359 Последовательность от Eric Joyce, личного общения, другие последовательности из Sullivan и др. 8 | ||
Таблица 1: FISH зонды для дрозофилы центромерных повторами.
| лекарственный | растворитель | концентрация Фото | Конечная концентрация | Время лечения | эффект |
| колхицин | спирт этиловый | 125 мМ | 150 мкМ | 10 мин или 30 мин | дестабилизировать не-кинетохор (10 мин) 9 или все (30 мин) микротрубочки |
| паклитаксел | ДМСО | 10 мМ | 10 мкМ | 10 минут | стабилизировать микрофонrotubules |
| Binucleine 2 | ДМСО | 25 мМ | 25 мкМ | 20 мин | ингибирования Aurora B киназы 10 |
Таблица 2: Медикаментозное лечение.
Результаты
Методы , которые мы описали здесь приведет к сбору поздних стадий дрозофилы ооцитов , представляющих три стадии мейоза (рис 1). Яйцеклетки в профазе отличаются наличием ядерной оболочки, который виден отсутствием сигнала тубулина в области , окружающей кариозома (Фигура 1А). Прометафазе это период после распада ядерной оболочки, в течение которого компонует шпинделя. Во время прометафазе, то кариозома принимает характерную форму, становясь часто вытянуты с 4 - й хромосомы отдельно от основной массы кариозома (рис 1В). Прометафазе завершается метафазе, на котором Drosophila ооциты , естественно , не арестовывать до овуляции. В метафазных ооцитов, то кариозома Отвод в круглую форму (рис 1C).
Мы описываем здесь мethods манипулировать скорость откладки яиц дрозофилы самок для обогащения ооцитов либо в прометафазе или метафазе. Яйцеклетки из прометафазы обогащенных коллекции часто показывают удлиненные кариозома (рис 2А) , тогда как метафазных обогащенные коллекции или коллекции из девственных самок дрозофилы, которые почти полностью устраняют яйцекладки, в первую очередь показывают круглую кариозома (рис 2B). Интересно, что прометафазы обогащенные коллекции также , как правило , показывают гораздо более надежные шпинделей, предполагая , что оба кариозома и шпинделя изменения между прометафазе и метафазы в Drosophila ооцитов 9.
На рисунке 3 показаны репрезентативные изображения из двух протоколов , описанных здесь. Антитела против альфа-тубулина (показать шпиндель), CENP-C (показать центромеры) и INCENP (показать центральный шпиндель) были использованы на ооциты фиксировали фоrmaldehyde / гептан (Фиг.3А). Зонды для повторяющихся центромерных последовательностей на 2 - й хромосомы (AACAC) и 3 - й хромосомы (додека) использовались на ооцитах фиксированных формальдегидом / какодилате и со-окрашивали альфа-тубулина антителом в соответствии с протоколом FISH (фиг.3В). AACAC зонд выглядит как несколько кластерный фокусы в то время как додека- зонд выглядит как один фокус на хромосому. Ооциты обрабатывали 150 мкМ колхицина в течение 10 мин фиксировали формальдегидом / гептан (рис 3C). Эта процедура устраняет большинство не кинетохор-микротрубочки, в результате чего во всех микротрубочек, контактирующих с ДНК на центромерных меченных фокусов. Ооциты обрабатывали 10 мкМ паклитакселом в течение 10 мин проявлять излишнюю микротрубочек в цитоплазме, но мало влияет на микротрубочки веретена (рис 3D). Ооциты обрабатывали 25 мкМ Binucleine 2 в течение 20 мин для ингибирования Aurora B киназы показать полную потерюшпиндель микротрубочки (рис. 3е)
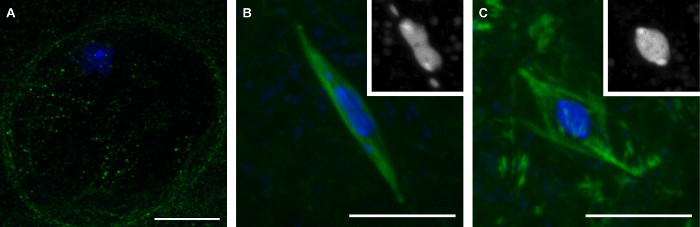
Рисунок 1: Три стадии зрелых ооцитов дрозофилы:. Профаза, прометафазе и Метафаза Конфокальные образы Drosophila ооцитов в профазе (A), прометафазы (B), и метафазы (С) мейоза I. ДНК показаны синим цветом и тубулина показанные в зеленом цвете в присоединяемых изображениях. Вставки в (В) и (С) показывают ДНК в белом цвете. Шкала бар = 10 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Фигура 2:Prometaphase- против метафазных обогащенные коллекции Drosophila ооцитов. Конфокальной образы Drosophila ооцитов из прометафазы-обогащенного (А) или метафазных обогащенный (B) коллекции. ДНК показана синим и тубулина отображается зеленым цветом. Шкала бар = 10 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
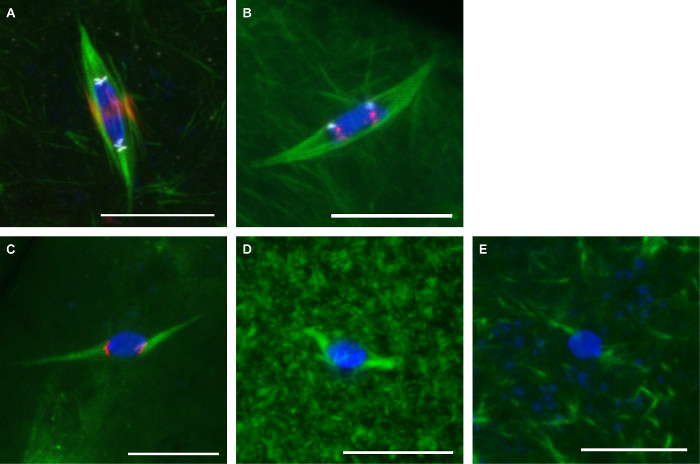
Рисунок 3: Антитело окрашивания, FISH, и лекарственные методы лечения Drosophila ооцитов конфокальной образы Drosophila ооцитов с ДНК в синем и тубулина в зеленом цвете.. Шкала бар = 10 мкм. (A) Иммунофлуоресценции в формальдегиде / гептан крепление с INCENP (центральный шпиндель) в красном и CENP-C (центромеры) в белом. (B) FISH в формальдегид / какодилатном фиксации с AACAC показаны красным и додека- , показанной на белом. (С) Лечение с помощью 150 мкМ колхицина в течение 10 мин с CENP-С , как показано в красном цвете. Лечение с помощью 10 мкМ паклитакселом в течение 10 мин (D) или 25 мкМ Binucleine 2 в течение 20 мин (E). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Поэтапное Drosophila ооцитов
Хотя удлиненный кариозома часто рассматривается в прометафазных ооцитов, используя кариозома форму, чтобы отличить прометафазы от метафазных ооцитов может быть проблематичным. Во время прометафазе, то кариозома начинается как круглой формы, удлиняется, а затем втягивается в круглую форму, как яйцеклетка приближается к метафазного ареста. Это означает, что многие прометафазе ооциты не имеют вытянутую кариозома. Кроме того, если рассматриваются мутантные или наркотиков обработанных ооциты, кариозома форма может быть затронута, исключающих с помощью этого метода к стадии ооциты. Потому что другие маркеры , чтобы выделить эти этапы в настоящее время не доступны, мы используем метод , описанный выше , чтобы управлять скоростью яйцекладки дрозофилы самок для обогащения ооцитов либо в прометафазе или метафазе. Смысл заключается в том, что если ооциты тратить определенное количество времени в прометафазе и неопределенное количество времени обрресоваться в метафазе, которая продолжается до откладки яиц, а затем более быстрое яйцекладки будет перекос в сторону более высокий процент прометафазных ооцитов, а медленнее яйцекладка обогатит для метафазы. Объем работ , необходимых для сбора девственных самок или собирать самок в течение более короткого периода времени , чем 2 -х дней, как описано Гиллиленд и др. 6, не вознаграждается заметным увеличением прометафазных ооцитов. Кроме того, невозможно использовать спинные придатки к стадии ооциты, полученные с этим протоколом, как спинные придатки удаляются вместе с мембранами. Несмотря на то, что невозможно ставить индивидуальные ооциты со 100% уверенностью , используя этот метод, данные из прометафазы обогащенного или метафазных обогащенные коллекции могут быть взяты вместе , чтобы сделать выводы об этих различных этапах 9.
Drosophila ооциты не оплодотворены , пока они не проходят через яйцевод; Поэтому, так как ооциты собирают для гое протоколы, описанные здесь, изучить ооциты сделанные до яйцекладки, эти ооциты не оплодотворены. Прохождение через яйцевод также вызывает яйцеклетку для активации и возобновления прогрессию клеточного цикла. Методы изучения этапов клеточного цикла после того, как метафазы I существуют 11,12, но выходят за рамки этого протокола.
Фиксирование Метод Соображения
Мы опишем два отдельные методы для фиксации поздней стадии Drosophila ооцитов. Способ фиксации формальдегида / какодилат впервые был описан Theurkauf и Hawley 3 и способа фиксации формальдегида / гептан была впервые описана Zou и соавт. 4. Кроме того, третий способ (метанол фиксация) используется примерно на 13, но не описано здесь. Удаление ооцитов мембран несколько сложнее после того, как формальдегид / гептан фиксации по сравнению с формальдегидом / какодилате. Это происходит потому, что "прокатки" зависитs на трение между покровным и ооцитов, а также формальдегид / фиксации гептана делает ооциты более скользкой. Несмотря на это дополнительные трудности, наш первый выбор метода фиксации при тестировании новых антител является формальдегид / гептан, потому что она лучше всего работает для большинства антител, которые мы пробовали. С другой стороны, мы предпочитаем формальдегид / какодилате фиксации для рыб, в первую очередь для облегчения удаления мембраны, хотя формальдегид / гептан фиксация также была успешной. Оба этих метода сохранения ооцитов морфологии лучше, чем метанол фиксации, и поэтому мы рекомендуем метанол фиксацию только в случаях антитела, которые невосприимчивы к формальдегиду на основе методов фиксации.
Описанные здесь протоколы сосредоточены на фиксированной визуализации, для того , чтобы продемонстрировать эффективные методы для визуализации зрелых ооцитов дрозофилы поддаются проникновению антител, а именно за счет удаления ооцитов мембран. Альтернативные методы мембранного RemoВэл ( с помощью щипцов 14 или ультразвуковую обработку 13) возможны; Тем не менее, мы находим "прокатки", чтобы быть наиболее эффективным и надежным способом. Методы для живого изображения также были описаны в другом месте 14-16 и выходят за рамки этого протокола.
FISH Рекомендации
Рыбу в Drosophila ооцитов первоначально был описан Дернбурга и др. 5. Этот протокол был разработан, чтобы обеспечить оптимальные условия для гибридизации зонда к конденсированной ооцитов хромосом, но оригинальный протокол не был оптимальным для иммунофлуоресценции. Описанный выше способ включает в себя приспособления, которые мы сделали, чтобы усилить окрашивание антител альфа-тубулина, который в первую очередь то, что мы используем при выполнении рыбы. Для других антител, понижая температуру стадии денатурации (шаг 7,5) от 80 ° С, может быть необходимым.
Зонды, перечисленные здесь дляповторяющиеся последовательности в гетерохроматина вблизи центромеры. Поскольку эти последовательности являются очень повторяющиеся, зонды отжигать в нескольких местах и коллективные сигналы достаточно сильны. Мы имели мало успеха с зондами для последовательностей в эухроматином, возможно, из-за уникальной структуры хромосом в то время как содержащиеся в конденсированной кариозома.
обработки изображений
Зрелые ооциты Drosophila, как ооцитов большинства организмов, крупные, одиночные клетки. Это означает, что существует большой объем цитоплазмы, который содержит одно ядро. К счастью, это ядро, также известный как кариозома у дрозофилы, могут быть легко идентифицированы как это , как правило , находится непосредственно под спинных придатков близко к коре головного мозга. Спинные придатки удаляются вместе с ооцитов мембран, но кариозома все еще может быть расположен, найдя небольшую дерн в ооцитов коре, где придатки ость были. Лучшие снимки получаются из ооцитов, которые были установлены с этим дерн, обращенной к покровным, поскольку это помещает кариозома ближе к цели. Хотя это может быть возможным организовать ооциты в этой ориентации перед монтажом, мы предпочитаем устанавливать много ооцитов случайным образом, а затем искать слайд для тех, кто в предпочтительной ориентации.
Будущие приложения
В будущем это будет важно определить маркеры, которые надежно различать прометафазе I и метафазы I шпинделей. Будучи в состоянии более надежно этап ооциты позволит снизить зависимость от более трудоемких альтернатив, таких как визуализация большого количества сценических обогащенного ооцитов или живого изображения, что также имеет свои проблемы постановки. Этот метод является основным методом , который может быть использован , чтобы воспользоваться достижениями в области генетики дрозофилы , как новые инструменты становятся доступными для изменения или выбивают генных продуктов. Это включает в себя методынепосредственно целевой активности белка с новыми препаратами или целевых стратегий деградации. Кроме того, эти способы не ограничиваются формирующим изображение мейоза шпинделей. Любая структура в ооцитах, такие как цитоскелета, могут быть проанализированы с помощью этих методов.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
We thank Christian Lehner for providing the CENP-C antibody and Eric Joyce for recommendations on FISH. Work in the McKim lab was funded by a grant from NIH (GM101955).
Материалы
| Name | Company | Catalog Number | Comments |
| 15 ml conical tubes | Various | ||
| 16% formaldehyde | Ted Pella, Inc. | 18505 | HAZARDOUS; once opened, discard after one month |
| 250 ml beakers | Various | ||
| 5 ml tubes | Various | ||
| active dry yeast | Various | mix with water to make a paste the consistency of peanut butter | |
| anti-α-tubulin antibody conjugated to FITC | Sigma | F2168 | clone DM1A |
| Binucleine 2 | Sigma | B1186 | HAZARDOUS |
| blender | Various | ||
| bovine serum albumin | Sigma | A4161 | |
| calcium chloride | Various | ||
| colchicine | Sigma | C-9754 | HAZARDOUS |
| coverslips | VWR | 48366-227 | No. 1 1/2 |
| dextran sulfate | Various | ||
| DMSO | Various | ||
| EGTA | Various | ||
| ethanol | Various | ||
| forceps | Ted Pella, Inc. | 5622 | Dumont tweezers high precision grade style 5 |
| formamide | Sigma | 47670-250ML-F | |
| glass slides | VWR | 48312-003 | |
| glucose | Various | ||
| graduated 1.5 ml tubes | Various | ||
| HEPES | VWR | EM-5330 | available from several venders |
| Hoechst 33342 | Various | ||
| magnesium chloride | Various | ||
| methanol | Various | ||
| large mesh (~1,500 µm) | VWR | AA43657-NK | variety of formats and other suppliers, 12 or 14 mesh |
| small mesh (~300 µm) | Spectrum labs | 146 424 | variety of formats, e.g., 146 422 or 146 486 |
| nutator | Various | ||
| Pasteur pipets | Various | ||
| potassium acetate | Various | ||
| Cacodylic acid | Sigma | C0125 | HAZARDOUS; alternatively, sodium cacodylate may be substituted |
| potassium hydroxide | Various | ||
| sodium acetate | Various | ||
| sodium chloride | Various | ||
| sodium citrate | Various | ||
| sodium hydroxide | Various | ||
| sucrose | Various | ||
| taxol (paclitaxel) | Sigma | T1912 | HAZARDOUS |
| Triton X-100 | Fisher | PI-28314 | |
| Tween 20 | Fisher | PI-28320 | |
| vortex | Various |
Ссылки
- Bridges, C. B. Non-disjunction as proof of the chromosome theory of heredity. Genetics. 1 (1), 1-52 (1916).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Theurkauf, W. E., Hawley, R. S. Meiotic spindle assembly in Drosophila females: behavior of nonexchange chromosomes and the effects of mutations in the nod kinesin-like protein. J Cell Biol. 116 (5), 1167-1180 (1992).
- Zou, J., Hallen, M. A., Yankel, C. D., Endow, S. A. A microtubule-destabilizing kinesin motor regulates spindle length and anchoring in oocytes. J Cell Biol. 180 (3), 459-466 (2008).
- Dernburg, A. F., Sedat, J. W., Hawley, R. S. Direct evidence of a role for heterochromatin in meiotic chromosome segregation. Cell. 86 (1), 135-146 (1996).
- Gilliland, W. D., Hughes, S. F., Vietti, D. R., Hawley, R. S. Congression of achiasmate chromosomes to the metaphase plate in Drosophila melanogaster oocytes. Dev Biol. 325 (1), 122-128 (2009).
- Gilliland, W. D., et al. Hypoxia transiently sequesters mps1 and polo to collagenase-sensitive filaments in Drosophila prometaphase oocytes. PLoS One. 4 (10), e7544(2009).
- Sullivan, W., Ashburner, M., Hawley, R. S. Drosophila Protocols. , Cold Spring Harbor Laboratory Press. (2000).
- Radford, S. J., Hoang, T. L., Głuszek, A. A., Ohkura, H., McKim, K. S. Lateral and End-On Kinetochore Attachments Are Coordinated to Achieve Bi-orientation in Drosophila Oocytes. PLoS Genet. 11 (10), e1005605(2015).
- Smurnyy, Y., Toms, A. V., Hickson, G. R., Eck, M. J., Eggert, U. S. Binucleine 2, an isoform-specific inhibitor of Drosophila Aurora B kinase, provides insights into the mechanism of cytokinesis. ACS Chem Biol. 5 (11), 1015-1020 (2010).
- Mahowald, A. P., Goralski, T. J., Caulton, J. H. In vitro activation of Drosophila eggs. Dev Biol. 98 (2), 437-445 (1983).
- Page, A. W., Orr-Weaver, T. L. Activation of the meiotic divisions in Drosophila oocytes. Dev Biol. 183 (2), 195-207 (1997).
- Tavosanis, G., Llamazares, S., Goulielmos, G., Gonzalez, C. Essential role for gamma-tubulin in the acentriolar female meiotic spindle of Drosophila. EMBO J. 16 (8), 1809-1819 (1997).
- Endow, S. A., Komma, D. J. Spindle dynamics during meiosis in Drosophila oocytes. J Cell Biol. 137 (6), 1321-1336 (1997).
- Matthies, H. J., Clarkson, M., Saint, R. B., Namba, R., Hawley, R. S. Drosophila Protocols. Sullivan, W., Ashburner, M., Hawley, R. S. , Cold Spring Harbor Laboratory Press. 67-85 (2000).
- Colombié, N., et al. Dual roles of Incenp crucial to the assembly of the acentrosomal metaphase spindle in female meiosis. Development. 135 (19), 3239-3246 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены