Method Article
고정의 이미지 Prometaphase 및 중기 감수 분열의 I위한 기술
요약
We present protocols for the collection, preparation, and imaging of mature Drosophila oocytes. These methods allow the visualization of chromosome behavior and spindle assembly and function during meiosis.
초록
Chromosome segregation in human oocytes is error prone, resulting in aneuploidy, which is the leading genetic cause of miscarriage and birth defects. The study of chromosome behavior in oocytes from model organisms holds much promise to uncover the molecular basis of the susceptibility of human oocytes to aneuploidy. Drosophila melanogaster is amenable to genetic manipulation, with over 100 years of research, community, and technique development. Visualizing chromosome behavior and spindle assembly in Drosophila oocytes has particular challenges, however, due primarily to the presence of membranes surrounding the oocyte that are impenetrable to antibodies. We describe here protocols for the collection, preparation, and imaging of meiosis I spindle assembly and chromosome behavior in Drosophila oocytes, which allow the molecular dissection of chromosome segregation in this important model organism.
서문
The study of meiosis is sometimes described as the "genetics of genetics". This is because the fundamental properties of chromosome inheritance and independent assortment are carried out through the segregation of chromosomes during gamete production. An important demonstration of the chromosome theory of inheritance came in 1916 from the work of Calvin Bridges in Drosophila melanogaster1. This and other classical genetics studies in Drosophila contributed greatly to our understanding of genetics. Cytological examination of meiotic chromosomes in Drosophila oocytes, however, has been challenging. This is primarily because immunofluorescence of late-stage Drosophila oocytes, when the spindle assembles and chromosomes are oriented for segregation, is hampered by the presence of membranes that render the oocyte impenetrable to antibodies.
Despite this challenge, Drosophila oocytes remain an attractive model for the study of chromosome behavior and spindle assembly. This is because of the powerful genetic tools available in Drosophila, but also because the oocytes arrest at metaphase I, when the chromosomes are oriented and the spindle is fully formed. This facilitates the collection and examination of large numbers of oocytes at this important stage of cell division. In addition, a simple model organism that is amenable to genetic manipulation for the study of oocyte chromosome segregation can provide an important contribution to our understanding of human reproductive health. Errors in chromosome number are the leading genetic cause of miscarriage and birth defects in humans2. A majority of these errors can be traced to the oocyte and are correlated with increasing maternal age. The average age of mothers in the U.S. has been increasing, making this a major public health concern.
We describe here methods for the cytological examination of Drosophila oocytes, including a demonstration of how to remove the oocyte membranes. These methods are modifications of protocols first described by Theurkauf and Hawley3, Zou et al.4, and Dernburg et al.5. We also include methods for the enrichment of different stages of oocytes, based on a protocol first described by Gilliland et al.6. Finally, we add instructions for the drug treatment of Drosophila oocytes. Together, these methods allow the cytological investigation of oocyte chromosome segregation and spindle assembly in Drosophila.
프로토콜
주 : 달리 명시되지 않는 절차는 실온에서 수행된다. 온도 제어 창업 보육 센터는 비행 양육에 대한 온도를 유지하는 데 사용 달리 명시하지 않는 한 교차된다.
1. 준비
- 파리를 준비합니다.
- 난자 수집을 Prometaphase 강화.
- 지우기 성인 건강, 젊은 주식 또는 상호 문화에서 파리. 25 ° C에서 이틀 동안 나이 병입니다.
참고 : 일반적으로이 건강한 병 충분합니다, 더 많은 일부 상호 문화에 대한 필요 수도있다. - 이일 후, 병에서 (이 시점에서 0 ~ 2 일 오래된) ~ 100 (300)에 여성를 수집합니다. 암컷은 처녀 일 필요는 없습니다. 유리 병의 측면에 효모 붙여 넣기의 명인을 추가하고 30 명의 여성과 yeasted 유리 병에 10 ~ 15 명의 남성을 각각 배치합니다. 25 ° C에서 이틀 동안 시대의 유리 병.
- 지우기 성인 건강, 젊은 주식 또는 상호 문화에서 파리. 25 ° C에서 이틀 동안 나이 병입니다.
- 난자 컬렉션 중기는 강화.
- 주식 또는 크로스 cultur에서 100 ~ 300 명의 여성을 수집에스. 유리 병의 측면에 효모 붙여 넣기의 명인을 추가하고 30 명의 여성을 배치 할 yeasted 유리 병에 (추가없이 남성)와 각. 25 ℃에서 3 ~ 5 일 시대 유리 병.
- 난자 수집을 Prometaphase 강화.
- 솔루션을 준비합니다.
주 : 달리 언급하지 않는 한 용액을 실온에서 무기한으로 저장 될 수있다.- 롭의 버퍼를 수정를 준비 (5 배) : 500 mM의 HEPES, 500 mM의 수 크로스, 275 mM의 아세트산 나트륨, 200 mM의 아세트산 칼륨, 50 mM의 포도당 6 mM의 염화 마그네슘, 및 5mM의 염화칼슘. 7.4으로 산도를 가지고 수산화 칼륨 : 8 수산화 나트륨 : 10 N (11)를 사용합니다. 여과 소독; 오토 클레이브하지 않습니다. -20 ° C에서 보관하십시오. ~ 1 배 롭의 난자 당 준비 200 ㎖를 준비하기 위해 필요에 따라 해동.
- 고정 솔루션.
- 옵션 # 1 : 포름 알데히드 / 헵탄 고정을 준비합니다. 고정 버퍼를 준비 : 1X 인산 완충 식염수 (PBS) 플러스 150 MM의 자당을. 사용하려면, 687.5 ㎕의 고정 버퍼 및 312.5 μL 16 % 포름 알데히드와 신선한 확인난자 준비 당.
주의 : 흄 후드에서 포름 알데히드 솔루션을 사용하는 동안 장갑을 착용 할 것. 제도적 지침에 따라 폐기물을 폐기하십시오. - 옵션 # 2 : 포름 알데히드 / cacodylate 고정을 준비합니다. 수정 혼합 준비 : 250 mM의 수 크로스, 100 mM 칼륨 아세테이트 (PH 7.5), 25 mM의 아세트산 나트륨 (PH 7.0), 25 mM의 EGTA (PH 8.0). 사용하려면, 400 μL와 신선한 믹스를 해결하기 위해선, 100 ㎕의 칼륨 cacodylate (1 M, pH를 7.2)와 난자 준비 당 500 ㎕의 16 % 포름 알데히드.
주의 : 칼륨 cacodylate는 비소가 포함되어 있습니다.
- 옵션 # 1 : 포름 알데히드 / 헵탄 고정을 준비합니다. 고정 버퍼를 준비 : 1X 인산 완충 식염수 (PBS) 플러스 150 MM의 자당을. 사용하려면, 687.5 ㎕의 고정 버퍼 및 312.5 μL 16 % 포름 알데히드와 신선한 확인난자 준비 당.
- 1X PBS 플러스 1 % 또는 0.05 % 트리톤 X-100 : PBS / 트리톤 X-100을 준비합니다. 4 ℃에서 보관하십시오.
- 1X PBS (/ V w) 0.5 % BSA 및 0.1 % 트윈 20-PBS 트윈 20 - 소 혈청 알부민 (BSA) (PTB)을 준비한다. 일주일 동안 4 ° C에 저장 될 수있다.
- 제자리 교잡 (FISH) 솔루션에서 형광.
- 준비 20X 염화나트륨 - 시트르산 나트륨 (SSC) 3 M 염화나트륨 및 0.3 M 시트르산 나트륨.
- 준비 2 × SSC-트윈 -20 (SSCT) : 2 × SSC 플러스 0.1 % 트윈 -20. 난자 준비마다 신선한 ~ 20 ㎖를 확인합니다.
- 포름 아미드 솔루션을 준비 : 배 SSC, 0.1 % 트윈 20, 플러스 포름 아미드를. 1 ml의 20 % 포름 아미드, 0.5 ml의 40 % 포름 아미드, 및 난자 사전에 2 ml의 50 % 포름 아미드, 신선한 만든다.
주의 : 흄 후드에서 포름 아미드 솔루션을 사용하는 동안 장갑을 착용 할 것. 제도적 지침에 따라 폐기물을 폐기하십시오. - (V / w) 2 × SSC, 50 % 포름 아미드, 10 % 덱스 트란 설페이트 : 혼성화 용액을 제조한다. 4 ℃에서 보관하십시오.
- FISH 프로브.
- 주문 HPLC 정제와 올리고 뉴클레오티드 (서열 표 1 참조)는 5 '형광 변형 (예를 Cy3 또는 Cy5에)를 원하는. 50 NG / μL에서 트리스 - EDTA (TE)에 재현 탁.
참고 : 항상 빛 노출 올리고를 보호합니다.
- 주문 HPLC 정제와 올리고 뉴클레오티드 (서열 표 1 참조)는 5 '형광 변형 (예를 Cy3 또는 Cy5에)를 원하는. 50 NG / μL에서 트리스 - EDTA (TE)에 재현 탁.
늦게 단계 초파리 난 모세포 2. 컬렉션
- 같이 플라스틱 및 유리에 충실합니다 양막 초파리 난자, 프리 코트 한 5 ML 튜브와 PTB와 난자 준비 당 하나의 파스퇴르 피펫의 내부.
- 이산화탄소 모든 ~ 100 300 yeasted 파리를 마취하고 ~ 100 ml의 1 배 롭의 버퍼를 포함하는 믹서에 추가 할 수 있습니다. 펄스 세 번 (~ 1 초 각). 활성화를 방지하기 위해 <20 분 롭의에서 난자를 유지합니다.
참고 : 또는 난자는 여성의 손으로 해부 할 수있다. 이 방법의 장점은 작은 여성이 필요하다는 것이다. 그러나,주의 7 저산소증과 연관된 아티팩트들을 피하기 위해 단지 몇 분으로 이산화탄소에 노출을 제한하기 위해 취해 져야한다. - 큰 신체 부위를 제거하기 위해 250 ml의 비이커에 큰 메쉬 (~ 1,500 μm의)를 통해 필터링합니다. 많은 그대로 복부 다시 메쉬, 재 분쇄 추가 롭의 버퍼 사용 재료 및 필터에 남아있는 경우. 다음 가능한 한 많은 신체 부위의 많은 제거, 상위 레이어를 대기음 ~ 2 분 정착하자.
- 인터넷250 ml의 비이커에 작은 메쉬 (~ 300 μm의)를 통해 LTER. 추가 롭의 및 코팅 파스퇴르 피펫을 사용하여 첫 번째 비커 밖으로 남아있는 난자를 씻어. 정착이 ~ 3 분하자; 난자는 침전됩니다. 기음 오프를 제외한 모든 ~ 10ml를.
- 코팅 5 ML 튜브에 맞는로 10 ㎖가 많이 붓는다. , 정착 액체를 제거하고 나머지를 반복 할 수 있습니다. 추가 롭의 및 코팅 파스퇴르 피펫을 사용하여 비커에서 남아있는 난자를 씻어. 3-5 분 ~ 5 ML 튜브에 정착하자.
3. 약물 치료 (선택 사항)
- 코트 각각의 난자 준비를위한 PTB와 두 번째 5 ML 튜브. 1 ml의 롭의 각각의 난자 준비를위한 각 (표 2)에 적당한 용매 (제어) 또는 약물을 추가합니다.
- 두 번째 코팅 5 ML 튜브로 분할 난자. , 정착하자 액체를 제거하고, 하나의 튜브에 1 ㎖의 롭의 플러스 용매를 추가하고 1 ml의 롭의 플러스 약 2 튜브로. 약물 치료 (표 2) 시간의 적절한 금액 Nutate. 엘등이 정착.
4. 고정
- 기음 떨어져 모든 액체 및 즉시 1 ml의 수정을 추가합니다.
- 옵션 # 1 : 포름 알데히드 / 헵탄 고정 (고정 버퍼 플러스 5 %의 포름 알데히드).
- nutator에 2.5 분 수정. 1 ML의 헵탄 소용돌이 1 분을 추가합니다. 정착 ~ 1 분을 보자.
- 모든 액체를 제거하고 PBS 1X 1ml를 추가합니다. 소용돌이 30 초. 정착 ~ 1 분을 보자.
- 모든 액체를 제거하고 1X PBS로 튜브를 입력합니다.
주 : 난 모세포 즉시 사용 또는 실온에서 몇 시간 동안 nutator에 보관 될 수있다.
- 옵션 # 2 : 포름 알데히드 / cacodylate 고정은 (믹스 플러스 8 % 포름 알데히드와 100 밀리미터 cacodylate 수정).
- nutator에 6 분 수정. 2 분 정착하자. 액체를 제거하고 1X PBS로 튜브를 입력합니다.
주 : 난 모세포 즉시 사용 또는 실온에서 몇 시간 동안 nutator에 보관 될 수있다.
- nutator에 6 분 수정. 2 분 정착하자. 액체를 제거하고 1X PBS로 튜브를 입력합니다.
5. 막 분리 ( "롤링")
- 코팅 파스퇴르 피펫을 사용하여 유리 슬라이드의 프로스트 (샌드 블라스트) 부분에 ~ 500 1,000 난자를 추가합니다. 모든 신체 부위와 관계없는 재료를 사용하여 집게를 제거합니다. 난자가 건조하게하지 마십시오 필요에 따라 1X PBS를 추가합니다.
- , 정기적으로 현미경으로 진행 상황을 확인 (. 가장 적합한 난자에 걸쳐 커버 슬립의 가장자리를 드래그) 제거 모든 세포막 때까지 난자 조심스럽게 "롤"난 모세포의 상단에 커버 슬립을 놓고 필요에 따라 더 1X PBS를 추가. 난자를 파괴 할 것이다 너무 많은 압력이주의하십시오.
참고 : 면역 형광 만, (면역 형광 유무에 관계없이) FISH를 들어 6 단계를 계속 들어, 7 단계를 계속합니다.
초파리 난 모세포의 6 항체 염색
- 추출 및 차단
- ~ 15 ml의 PBS / 1 % 트리톤 X-100을 포함하는 15 ML 원뿔 튜브에 압연 난자를 씻어. 만큼이나 1.5 시간 동안이 용액과 2 개 이하의 시간에 Nutate 모세포.이 단계는 항체 침투 할 수 있습니다.
- 난자가 ~ 2 분 정착하자. 가능한 한 많은 막과 함께 액체를 제거하고 PBS를 추가 / 0.05 % 트리톤 X-100.
참고 : 막 압연 난자보다 느리게 해결됩니다. - 난자가 ~ 2 분을 해결하자, 모든하지만 ~ 1 ml의 액체를 제거합니다. 로 전송 난자 1.5 ML 튜브를 졸업하고 남은 액체를 제거합니다. 1 시간 동안 차단 및 nutate 1 ml의 PTB를 추가합니다.
- 항체 염색
- 배아에 대한 이차 항체의 사전 흡수.
참고 :이 단계는 초파리 단백질과 비 특이 항체의 상호 작용에서 배경 얼룩을 제거한다.- 수집하고 일반적인 절차 (8) 당 초파리 배아 (~ 25 μl를) 수정. -20 ° C에서 메탄올 저장합니다.
- 배아에서 메탄올을 제거 15 분 동안 800 ㎕의 메탄올 플러스 PBS 1 배 200 μL 및 nutate를 추가합니다. 상층 액 500 μl를 제거하고 PBS 1 배 500 μL로 교체. 그런 다음 15 분 동안 nutate. (세척의 ~ 1 시간 총)을 두 번 반복 한 다음 PTB에서 마무리합니다.
참고 : 배아는 즉시 사용 또는 실온에서 몇 시간에 대한 nutator에 보관 될 수있다. - 액체를 제거 난자 준비 당 200 μL에 PTB 채우기, 적절한 희석에 형광 표지 된 이차 항체를 추가 (최종 부피는 300 μL 될 것이라고 염두에두고,. 단계 7.4 참조) Nutate를 4 ° C에서 하룻밤 (바람직한) 또는 3 내지 4 시간 동안 실온에서 첨가 하였다.
참고 : 미리 흡수 항체 단계 6.2.4에서 사용됩니다.
참고 :만큼 가능한 형광 항체가 추가 된 후 어둠 속에서 샘플을 보관하십시오.
- , 난 모세포에서 액체를 제거 300 μL에 PTB 채우기, 적절한 희석에 차 항체를 추가합니다. 4 ° C에서 Nutate 하룻밤 (바람직) 또는 3 ~ 4 시간 동안 실온에서.
- 세척은 1 ml의 PTB 15 분마다 네 번 난자.
- 없애다난자에서 액체, 배아 (보조 항체를 미리 흡수)에서 상층 액 200 μl를 추가합니다. 그 후 300 μL에 PTB와 함께 입력합니다. 3 ~ 4 시간 (바람직한) 또는 밤새 4 ° C의 실온에서 Nutate.
- 1 ml의 PTB와 15 분 동안 한 번 난 모세포를 씻어 액체를 제거합니다. 그리고 7 분 0.5 μL의 Hoechst 33342 500 μL의 PTB와 nutate를 추가합니다.
- 1 ml의 PTB와 15 분 각각 두 번 난자를 씻으십시오.
주 : 난자 즉시 슬라이드에 부착 될 수 있거나 또는 이미지를 위해 준비 될 때까지 39 ° C에서 PTB에 저장 될 수있다.
- 배아에 대한 이차 항체의 사전 흡수.
7. FISH (위의 5 단계에서 계속)
- ~ 15 ml의 2 배 SSCT를 포함하는 15 ML 원뿔 튜브에 압연 난자를 씻어. 난자가 ~ 2 분 정착하자. 0.5 ml의 액체 가능한 한 많은 막과 함께 모든하지만 ~를 제거합니다.
참고 : 막 압연 난자보다 느리게 해결됩니다. - 전송 0.5 ML 튜브에 난자 남아있는 액체를 제거합니다. 계속해서 추가하고 500 μl를 제거20 %, 40 %, 50 % 포름 아미드 용액은, 각각의 용액을 10 분 동안 하향 경사.
참고 : 난 모세포는 포름 아미드의 높은 비율로 느리게 해결됩니다. - 다음 1 내지 5 시간 동안 37 ℃에서 500 μL의 50 % 포름 아미드 용액 및 nutate 추가 액체를 제거한다.
참고 : 긴 배양 더 나은 프로브 침투 초래한다. - 더 이상 100 ~보다 μL 난자 남겨두고, 액체를 제거하고 36 μl의 하이브리드 솔루션 플러스 프로브의 2 μL (50 NG / μL), 물 2 μL 또는 2 차 프로브 (표 1)의 2 μl를 추가합니다.
- 하룻밤 37 ° C 형 수조에서 배양 한 다음 3 분 (FISH 만 해당) 또는 20 분 (FISH 플러스 면역 형광) 80 ° C, 91 ° C에서 품어.
주의 :이 단계는 열 순환기에서 수행 될 수있다. - 액체를 제거하지 마십시오. 1 시간 동안 37 ° C에서 500 ㎕의 50 %에게 포름 아미드 용액 nutate을 추가합니다.
- 액체를 제거, 정착하자 500 μL 50 % 포름 아미드 솔루션을 추가하십시오1 시간 동안 37 ° C에서 D의 nutate.
- 액체를 제거 정착하자 10 분 동안 실온에서 500 ㎕의 20 % 포름 아미드 용액 및 nutate 추가.
- (반복을 여러 번 반전, 다음 액체를 추가, 제거, 정착을 할 수 있습니다.) 500 ㎕의 2 배 SSCT 세 빠른 세척을 수행 정착하자, 액체를 제거하고 4 시간 동안 500 μL의 PTB와 nutate를 추가합니다.
8. 항체 염색 FISH 후
- , 난 모세포에서 액체를 제거 300 μL에 PTB 채우기 및 FITC에 접합 10 μl를 방지 α-tubulin에 항체를 추가합니다. 또는, 다른 항체를 상기 프로토콜에 따라 사용될 수있다. 실온에서 밤새 Nutate.
- 다음 7 분 0.5 μL의 Hoechst 33342 500 μL의 PTB와 nutate를 추가, 액체를 제거, 500 ㎕의 PTB와 15 분 동안 한 번 난자를 씻으십시오.
- 500 μL PTB 15 분 각각 두 번 난자를 씻으십시오.
주 : 난 모세포 즉시 슬라이드에 부착 될 수 있거나 위해 준비 될 때까지 39 ° C에서 PTB에 저장 될 수있다영상. 많은 가능한 형광 항체가 추가 된 후 어둠 속에서 난자를 보관하십시오.
| 반복 이름 | 염색체 | 올리고 순서 * |
| 359 | 엑스 | GGGATCGTTAGCACTGGTAATTAGCTGC |
| AACAC | 이 | AACACAACACAACACAACACAACACAACACAACACAACAC |
| 도데 카 | 삼 | CCCGTACTGGTCCCGTACTCGGTCCCGTACTCGGT |
| 1.686 | 2 + 3 | AATAACATAGAATAACATAGAATAACATAG |
| AATAT | 4 (+ Y) | AATATAATATAATATAATATAATATAATAT |
| * 에릭 조이스, 개인 통신, 설리반 등의 다른 시퀀스에서 359 시퀀스입니다. (8) | ||
표 1 : 초파리 센트로 미어 반복에 대한 FISH 프로브.
| 약 | 용제 | 주식 농도 | 최종 농도 | 처리 시간 | 효과 |
| 콜히친 | 에탄올 | 125 밀리미터 | 150 μM | 10 분 또는 30 분 | 비 동원체 (10 분) (9) 또는 전부 (30 분) 미 세관 불안정 |
| 파클리탁셀 | DMSO | 10 mM의 | 10 μM | 10 분 | 마이크를 안정화rotubules |
| Binucleine 2 | DMSO | 25 mM의 | 25 μM | 20 분 | 오로라 B 키나제 (10)을 억제 |
표 2 : 약물 치료.
결과
우리가 여기서 설명하는 한 방법은 감수 분열의 세 단계 (그림 1)를 나타내는 늦게 단계 초파리 난자의 컬렉션에 발생합니다. 의향에 난자가 karyosome (도 1A)을 둘러싸는 영역에서 튜 불린 신호의 부족에 의해 표시 핵막의 존재에 의해 구별된다. Prometaphase 핵 봉투 고장시 스핀들 조립 후 기간입니다. prometaphase 동안, karyosome는 독특한 형태를 가정 주 karyosome 질량 (그림 1B)에서 떨어져 4 번째 염색체 자주 연장되는 것을. Prometaphase는 초파리의 난자는 자연적으로 배란까지 체포하는 중기와칩니다. 중기 난자에서 karyosome는 둥근 모양 (그림 1C)로 후퇴했다.
우리는 여기서 m 설명ethods은 prometaphase 또는 중기에 하나 난자에 대해 풍부하게 초파리 암컷의 알을 낳는의 속도를 조작합니다. 거의 알을 낳는를 제거 처녀 초파리 암컷에서 중기 풍부한 컬렉션 또는 컬렉션, 주로 라운드 karyosome (그림 2B)를 표시하면서 prometaphase 풍부한 컬렉션에서 난 모세포는 자주 긴 karyosome (그림 2A)를 보여줍니다. 흥미롭게도, prometaphase 풍부한 컬렉션은 보통 초파리에서 prometaphase와 중기 사이의 karyosome 스핀들 변화 모두 9 난자 것을 제안, 훨씬 더 강력한 스핀들을 보여줍니다.
그림 3은 여기에 설명 된 두 개의 프로토콜 대표 이미지를 보여줍니다. , CENP-C (중심절을 표시하기 위해), 및 INCENP가 (중앙 스핀들을 표시하기 위해) 난자에 사용 된 α-tubulin에 대한 항체 (스핀들을 표시하기 위해) FO 고정rmaldehyde / 헵탄 (도 3A). 2 차 염색체 (AACAC) 및 제 3 염색체 (도데 카)의 반복적 인 센트로 미어 시퀀스 프로브는 포름 알데히드 / cacodylate 및 고정 난자에 사용 된 FISH 프로토콜 (그림 3B)에 따른 α-tubulin의 항체와 공동 스테인드. 도데 카 프로브는 염색체 당 하나의 초점으로 나타납니다 동안 AACAC 프로브는 여러 클러스터 초점 나타납니다. 10 분 동안 150 μM의 콜히친 처리 된 난자는 포름 알데히드 / 헵탄 (그림 3C)로 고정 하였다. 이 치료는 센트로 표지 초점에서 DNA를 접촉하는 모든 미세 소관에서 발생하는 대부분의 비 동원체 - 미세 소관을 제거합니다. 난 모세포 스핀들 미세 소관 (도 3D) 10 μM의 세포질에서 10 분 쇼 과도한 미세 소관 용 파클리탁셀하지만 거의 영향으로 처리 하였다. 20 분 동안 25 μM Binucleine이 처리 난자 오로라 B 키나제 쇼 완전한 손실을 억제 할스핀들 미세 소관 (그림 3E).
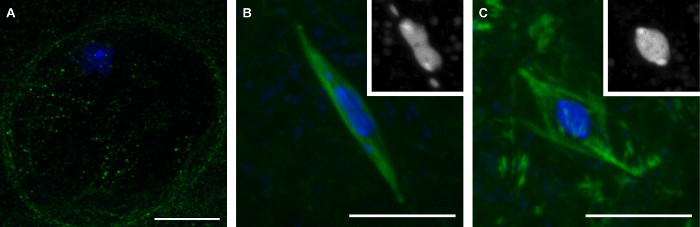
그림 1 : 성숙한 초파리 난자의 세 단계 :. 의향이 Prometaphase 및 중기 의향에 초파리 난자의 공 초점 이미지 (A), prometaphase (B), 및 감수 분열의 I.의 DNA의 중기 (C)가 파란색으로 표시되며, 튜 불린이 병합 된 이미지에서 녹색으로 표시. (B) 및 (C)의 세트는 흰색의 DNA를 나타낸다. 스케일 바는 10 μm의 =. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 :초파리 난자의 Prometaphase- 대 중기 풍부한 컬렉션. prometaphase 강화 (A)에서 초파리 난자의 공 초점 이미지 나 중기 강화 (B) 컬렉션. DNA는 청색으로 표시되고 튜 불린은 녹색으로 표시된다. 스케일 바는 10 μm의 =. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
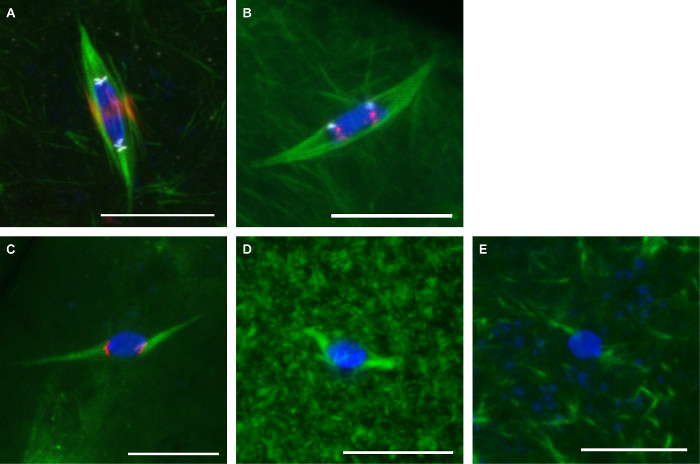
그림 3 : 초파리 난자의 항체 염색, 물고기, 약물 치료 녹색에서 파란색 DNA와 튜 불린와 초파리 난자의 공 초점 이미지.. 스케일 바는 10 μm의 =. 폼알데하이드의 (A) 면역 형광빨간색 INCENP (중심 축)과 흰색 CENP-C (중심절)와 전자 / 헵탄 고정. 흰색에 표시된 빨간색과 도데 카에 도시 AACAC와 포름 알데히드 / cacodylate 고정의 (B) FISH. 빨간색으로 표시 CENP-C와 10 분 동안 150 μM의 콜히친와 (C) 치료. 20 분 (E) 10 분 (D) 또는 25 μM Binucleine이 10 μM의 파클리탁셀과 치료. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
초파리 난 모세포를 준비
긴 karyosome 자주 중기의 난 모세포에서 prometaphase 구분하기 karyosome 모양을 사용하여, prometaphase 난자에서 볼 수 있지만 문제가 될 수 있습니다. prometaphase 동안 karyosome은 원형으로의 신장을 시작하고 난 모세포는 중기 정지에 접근 라운드 형상으로 후퇴. 이것은 많은 prometaphase 난자가 긴 karyosome이없는 것을 의미한다. 돌연변이 또는 약물 처리 된 난자가 조사하는 경우 또한, karyosome 모양 난자를 준비하기 위해이 방법을 사용 배제, 영향을받을 수 있습니다. 다른 마커 이러한 단계를 현재 사용할 수 없습니다 구분하기 때문에, 우리는 prometaphase 또는 중기에 하나 난자에 대해 풍부하게 초파리 암컷의 알을 낳는의 속도를 조작하는 상기 한 방법을 사용합니다. 이론적 근거는 그 난자는 prometaphase에서 특정 시간, 시간 도착의 무기한 금액을 지출하는 경우느린 달걀 누워는 중기에 대한 풍부하게하는 동안 알을 낳는 후 더 빠른 달걀 누워까지 지속 중기에 ested는 prometaphase 난자의 높은 비율을 향해 왜곡됩니다. 처녀 여성을 수집하거나 길리 랜드 등에 의해 설명 된 바와 같이 2 일보다 짧은 기간에 걸쳐 여성을 수집합니다. (6)에 필요한 노력의 양, prometaphase 난자에 상당한 증가에 의해 보상되지 않습니다. 는 등의 부속이 막과 함께 제거 할 때이 프로토콜 준비 난자를 준비하는 등의 부속을 사용하는 것도 불가능하다. 이이 방법을 사용하여 100 % 확실성 개별 난자를 준비하는 것은 불가능하지만, 행 데이터 prometaphase 농축 또는 중기 농후 모음은 이들 다양한 단계 9에 대해 결론을 함께 촬영 될 수있다.
그들이 난관을 통과 할 때까지 초파리 난자가 수정 된되지 않습니다 따라서, 난자 번째 수집 때문에여기에 설명 된 전자 프로토콜 달걀 누워하기 전에 촬영 된 난자를 조사,이 난자가 수정 된되지 않았다. 수란관을 통과 또한 활성화 및 세포주기 진행을 재개 난자시킨다. I 11, 12가 존재하지만,이 프로토콜의 범위를 벗어난다 중기 이후 방법은 세포주기 스테이지를 조사.
고정 방법 고려
우리는 늦게 단계 초파리 난자의 고정을위한 두 개의 별도의 방법을 설명합니다. 포름 알데히드 / cacodylate 고정 방법은 제 Theurkauf 및 홀리 (3)과 포름 알데히드 / 헵탄 고정 방법에 의해 설명되었다 먼저 Zou의 외. (4)에 의해 설명되었다. 또한, 세 번째 방법 (메탄올 고정)의 일부 (13)에 의해 사용되지만, 여기에서 설명하지 않는다. 포름 알데히드 / 헵탄 고정 포름 알데히드 / cacodylate 비교 후 난자의 세포막의 제거는 다소 어렵다. 이 달려 있기 때문에 "롤링"입니다커버 슬립과 난자, 포름 알데히드 / 헵탄 고정 사이의 마찰에의는 난자가 더 미끄러운 수 있습니다. 우리가 시도 항체의 대부분에 가장 적합한 때문에 추가 어려움에도 불구하고, 새로운 항체를 테스트 고정 방법의 우리의 첫 번째 선택은 포름 알데히드 / 헵탄입니다. 포름 알데히드 / 헵탄 고정도 성공 하였지만, 반면에, 우리는 주로 막 제거의 용이성을 위해, FISH 포름 알데히드 / cacodylate 고정을 선호한다. 두 방법 모두 메탄올 고정보다 더 난자의 형태를 유지, 따라서 우리는 포름 알데히드 기반의 고정 방법에 내화있는 항체의 경우에는 메탄올 고정하는 것이 좋습니다.
여기에 설명 된 프로토콜 즉 난자의 세포막의 제거를 통해 항체 침투 의무 성숙한 초파리 난자를 렌더링하기위한 효과적인 방법을 설명하기 위하여, 고정 된 이미지에 초점을 맞춘다. 막 레모을위한 다른 방법발 가능하다 (겸자 (14) 또는 초음파 (13)를 사용하여); 그러나, 우리는 가장 효율적이고 신뢰할 수있는 방법으로 "롤링"찾을 수 있습니다. 라이브 이미징 기술은 또한 다른 곳에서 14-16을 설명하고이 프로토콜의 범위를 벗어난다되었습니다.
FISH 권장
초파리의 난자에서 FISH는 원래 Dernburg 등. (5)에 의해 설명되었다. 이 프로토콜은 축합 난자 염색체 프로브 혼성화에 대한 최적의 조건을 제공하도록 설계되었지만 원래 프로토콜 면역 최적 아니었다. 위에서 설명한 방법은 우리가 주로 물고기를 수행 할 때 우리는 무엇을 사용 α-tubulin에의 항체 염색을 향상시키기 위해 만든 적응을 포함한다. 80 ° C에서 변성 단계 (단계 7.5)의 온도를 낮추는 다른 항체 필요할 수있다.
여기에 나열된 프로브는위한중심절 근처의 이질 염색질의 반복 서열. 이러한 서열이 고도로 반복적이기 때문에, 프로브는 다수의 장소와 어닐링 집합 신호들은 상당히 강하다. 응축 된 karyosome에 포함 동안 우리는 가능성이 있기 때문에 염색체의 독특한 구조는 euchromatin의 시퀀스 프로브와 작은 성공을 거두었습니다.
영상
성숙한 초파리의 난자는 대부분의 유기체의 난자와 같은, 큰, 하나의 세포이다. 즉, 하나의 핵을 포함 세포질 대량가 존재한다는 것을 의미한다. 그것은 일반적으로 단지 피질에 가까운 지느러미 부속 아래에있는대로 다행히, 또한 초파리에서 karyosome로 알려진이 핵은 쉽게 식별 할 수 있습니다. 지느러미 부속은 난자의 세포막과 함께 제거되지만 karyosome는 여전히 난자 피질에있는 작은 잔디를 찾아 찾을 수 있습니다 어디 부속 오후부이었다. 가장 좋은 이미지는이 목적에 karyosome 가장 가까운 장소부터 coverslip에 직면이 잔디에 장착 된 난자에서 얻을 수 있습니다. 그것은 종래 실장이 방향으로 난자를 배치하는 것이 가능할 수 있지만, 우리는 여러 무작위 난자를 탑재하고 바람직한 방향에게 슬라이드를 검색하는 것을 선호한다.
미래의 응용 프로그램
장래에 확실 prometaphase I 및 중기 I 스핀들 구별 마커를 식별하는 것이 중요 할 것이다. 보다 확실하게 이러한 또한 준비 문제가 단계 강화 된 난자 또는 라이브 이미징, 많은 수의 이미징과 같은보다 노동 집약적 대안에 대한 의존도를 줄일 수 난자를 준비 할 수있는. 이 방법은 새로운 도구를 수정하거나 유전자 제품을 노크하는 것이 가능하게 될 초파리 유전학의 발전을 활용하는 데 사용할 수있는 기본적인 방법입니다. 이 방법을 포함한다직접 새로운 약물이나 대상 분해 전략 단백질 활성을 대상으로합니다. 또한, 이러한 방법은 감수 스핀들 촬상에 한정되지 않는다. 난자 내의 임의의 구조, 예컨대 액틴 세포 골격, 이러한 방법을 이용하여 분석 될 수있다.
공개
The authors have nothing to disclose.
감사의 말
We thank Christian Lehner for providing the CENP-C antibody and Eric Joyce for recommendations on FISH. Work in the McKim lab was funded by a grant from NIH (GM101955).
자료
| Name | Company | Catalog Number | Comments |
| 15 ml conical tubes | Various | ||
| 16% formaldehyde | Ted Pella, Inc. | 18505 | HAZARDOUS; once opened, discard after one month |
| 250 ml beakers | Various | ||
| 5 ml tubes | Various | ||
| active dry yeast | Various | mix with water to make a paste the consistency of peanut butter | |
| anti-α-tubulin antibody conjugated to FITC | Sigma | F2168 | clone DM1A |
| Binucleine 2 | Sigma | B1186 | HAZARDOUS |
| blender | Various | ||
| bovine serum albumin | Sigma | A4161 | |
| calcium chloride | Various | ||
| colchicine | Sigma | C-9754 | HAZARDOUS |
| coverslips | VWR | 48366-227 | No. 1 1/2 |
| dextran sulfate | Various | ||
| DMSO | Various | ||
| EGTA | Various | ||
| ethanol | Various | ||
| forceps | Ted Pella, Inc. | 5622 | Dumont tweezers high precision grade style 5 |
| formamide | Sigma | 47670-250ML-F | |
| glass slides | VWR | 48312-003 | |
| glucose | Various | ||
| graduated 1.5 ml tubes | Various | ||
| HEPES | VWR | EM-5330 | available from several venders |
| Hoechst 33342 | Various | ||
| magnesium chloride | Various | ||
| methanol | Various | ||
| large mesh (~1,500 µm) | VWR | AA43657-NK | variety of formats and other suppliers, 12 or 14 mesh |
| small mesh (~300 µm) | Spectrum labs | 146 424 | variety of formats, e.g., 146 422 or 146 486 |
| nutator | Various | ||
| Pasteur pipets | Various | ||
| potassium acetate | Various | ||
| Cacodylic acid | Sigma | C0125 | HAZARDOUS; alternatively, sodium cacodylate may be substituted |
| potassium hydroxide | Various | ||
| sodium acetate | Various | ||
| sodium chloride | Various | ||
| sodium citrate | Various | ||
| sodium hydroxide | Various | ||
| sucrose | Various | ||
| taxol (paclitaxel) | Sigma | T1912 | HAZARDOUS |
| Triton X-100 | Fisher | PI-28314 | |
| Tween 20 | Fisher | PI-28320 | |
| vortex | Various |
참고문헌
- Bridges, C. B. Non-disjunction as proof of the chromosome theory of heredity. Genetics. 1 (1), 1-52 (1916).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Theurkauf, W. E., Hawley, R. S. Meiotic spindle assembly in Drosophila females: behavior of nonexchange chromosomes and the effects of mutations in the nod kinesin-like protein. J Cell Biol. 116 (5), 1167-1180 (1992).
- Zou, J., Hallen, M. A., Yankel, C. D., Endow, S. A. A microtubule-destabilizing kinesin motor regulates spindle length and anchoring in oocytes. J Cell Biol. 180 (3), 459-466 (2008).
- Dernburg, A. F., Sedat, J. W., Hawley, R. S. Direct evidence of a role for heterochromatin in meiotic chromosome segregation. Cell. 86 (1), 135-146 (1996).
- Gilliland, W. D., Hughes, S. F., Vietti, D. R., Hawley, R. S. Congression of achiasmate chromosomes to the metaphase plate in Drosophila melanogaster oocytes. Dev Biol. 325 (1), 122-128 (2009).
- Gilliland, W. D., et al. Hypoxia transiently sequesters mps1 and polo to collagenase-sensitive filaments in Drosophila prometaphase oocytes. PLoS One. 4 (10), e7544(2009).
- Sullivan, W., Ashburner, M., Hawley, R. S. Drosophila Protocols. , Cold Spring Harbor Laboratory Press. (2000).
- Radford, S. J., Hoang, T. L., Głuszek, A. A., Ohkura, H., McKim, K. S. Lateral and End-On Kinetochore Attachments Are Coordinated to Achieve Bi-orientation in Drosophila Oocytes. PLoS Genet. 11 (10), e1005605(2015).
- Smurnyy, Y., Toms, A. V., Hickson, G. R., Eck, M. J., Eggert, U. S. Binucleine 2, an isoform-specific inhibitor of Drosophila Aurora B kinase, provides insights into the mechanism of cytokinesis. ACS Chem Biol. 5 (11), 1015-1020 (2010).
- Mahowald, A. P., Goralski, T. J., Caulton, J. H. In vitro activation of Drosophila eggs. Dev Biol. 98 (2), 437-445 (1983).
- Page, A. W., Orr-Weaver, T. L. Activation of the meiotic divisions in Drosophila oocytes. Dev Biol. 183 (2), 195-207 (1997).
- Tavosanis, G., Llamazares, S., Goulielmos, G., Gonzalez, C. Essential role for gamma-tubulin in the acentriolar female meiotic spindle of Drosophila. EMBO J. 16 (8), 1809-1819 (1997).
- Endow, S. A., Komma, D. J. Spindle dynamics during meiosis in Drosophila oocytes. J Cell Biol. 137 (6), 1321-1336 (1997).
- Matthies, H. J., Clarkson, M., Saint, R. B., Namba, R., Hawley, R. S. Drosophila Protocols. Sullivan, W., Ashburner, M., Hawley, R. S. , Cold Spring Harbor Laboratory Press. 67-85 (2000).
- Colombié, N., et al. Dual roles of Incenp crucial to the assembly of the acentrosomal metaphase spindle in female meiosis. Development. 135 (19), 3239-3246 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유