Method Article
Técnicas de imagem Prometáfase e Metaphase da meiose I em Fixed
Neste Artigo
Resumo
We present protocols for the collection, preparation, and imaging of mature Drosophila oocytes. These methods allow the visualization of chromosome behavior and spindle assembly and function during meiosis.
Resumo
Chromosome segregation in human oocytes is error prone, resulting in aneuploidy, which is the leading genetic cause of miscarriage and birth defects. The study of chromosome behavior in oocytes from model organisms holds much promise to uncover the molecular basis of the susceptibility of human oocytes to aneuploidy. Drosophila melanogaster is amenable to genetic manipulation, with over 100 years of research, community, and technique development. Visualizing chromosome behavior and spindle assembly in Drosophila oocytes has particular challenges, however, due primarily to the presence of membranes surrounding the oocyte that are impenetrable to antibodies. We describe here protocols for the collection, preparation, and imaging of meiosis I spindle assembly and chromosome behavior in Drosophila oocytes, which allow the molecular dissection of chromosome segregation in this important model organism.
Introdução
The study of meiosis is sometimes described as the "genetics of genetics". This is because the fundamental properties of chromosome inheritance and independent assortment are carried out through the segregation of chromosomes during gamete production. An important demonstration of the chromosome theory of inheritance came in 1916 from the work of Calvin Bridges in Drosophila melanogaster1. This and other classical genetics studies in Drosophila contributed greatly to our understanding of genetics. Cytological examination of meiotic chromosomes in Drosophila oocytes, however, has been challenging. This is primarily because immunofluorescence of late-stage Drosophila oocytes, when the spindle assembles and chromosomes are oriented for segregation, is hampered by the presence of membranes that render the oocyte impenetrable to antibodies.
Despite this challenge, Drosophila oocytes remain an attractive model for the study of chromosome behavior and spindle assembly. This is because of the powerful genetic tools available in Drosophila, but also because the oocytes arrest at metaphase I, when the chromosomes are oriented and the spindle is fully formed. This facilitates the collection and examination of large numbers of oocytes at this important stage of cell division. In addition, a simple model organism that is amenable to genetic manipulation for the study of oocyte chromosome segregation can provide an important contribution to our understanding of human reproductive health. Errors in chromosome number are the leading genetic cause of miscarriage and birth defects in humans2. A majority of these errors can be traced to the oocyte and are correlated with increasing maternal age. The average age of mothers in the U.S. has been increasing, making this a major public health concern.
We describe here methods for the cytological examination of Drosophila oocytes, including a demonstration of how to remove the oocyte membranes. These methods are modifications of protocols first described by Theurkauf and Hawley3, Zou et al.4, and Dernburg et al.5. We also include methods for the enrichment of different stages of oocytes, based on a protocol first described by Gilliland et al.6. Finally, we add instructions for the drug treatment of Drosophila oocytes. Together, these methods allow the cytological investigation of oocyte chromosome segregation and spindle assembly in Drosophila.
Protocolo
Nota: Os procedimentos são realizados à temperatura ambiente a menos que indicado de outra maneira. incubadoras de temperatura controlada são usados para manter as temperaturas para criação mosca e cruza salvo indicação em contrário.
1. Preparações
- Prepare Moscas.
- Prometáfase enriquecido coleções de ovócitos.
- Limpar moscas adultas a partir saudáveis, jovens de ações ou transversais culturas. garrafas de idade para dois dias a 25 ° C.
Nota: Geralmente duas garrafas saudáveis serão suficientes, embora mais podem ser necessários para algumas culturas cruzadas. - Após dois dias, recolher ~ 100 a 300 (fêmeas que são 0 a 2 dias de idade, neste ponto) de garrafas. As fêmeas não precisa ser virgens. Adicionar uma pincelada de pasta de levedura para o lado de um frasco e colocá-30 fêmeas e 10 machos e 15 cada um em frascos yeasted. frascos de idade para dois dias a 25 ° C.
- Limpar moscas adultas a partir saudáveis, jovens de ações ou transversais culturas. garrafas de idade para dois dias a 25 ° C.
- Metaphase enriquecido ovócitos Collections.
- Recolha ~ 100 a 300 fêmeas de estoque ou cross cultures. Adicionar uma pincelada de pasta de levedura para o lado de um frasco e colocar cada 30 fêmeas (sem machos adicionados) para dentro de frascos yeasted. frascos de idade para três a cinco dias a 25 ° C.
- Prometáfase enriquecido coleções de ovócitos.
- Prepare Solutions.
Nota: As soluções podem ser armazenadas indefinidamente à temperatura ambiente, a menos que indicado de outra maneira.- Preparar tampão de modificação de Robb (5x): 500 mM de HEPES, 500 mM de sacarose, acetato de sódio 275 mM, acetato de potássio 200 mM, glicose 50 mM, cloreto de magnésio a 6 mM, e cloreto de cálcio 5 mM. Use 10 N 11: 8 de hidróxido de sódio: hidróxido de potássio para trazer o pH para 7,4. Esterilizar por filtração; Não autoclave. Armazenar a -20 ° C. Descongelar conforme necessário para preparar ~ 200 ml de 1x Robb por ovócitos prep.
- Fixação Solutions.
- Opção # 1: Prepare formaldeído / fixação heptano. Preparar tampão de fixação: solução salina tamponada 1x com fosfato (PBS), mais 150 mM de sacarose. Para usar, faça fresco com 687,5 ul Fixação de buffer e 312,5 mL de 16% de formaldeídopor prep oócito.
CUIDADO: Use luvas enquanto estiver usando soluções de formaldeído em um exaustor. Descarte de resíduos de acordo com as diretrizes institucionais. - Opção # 2: Preparar o formaldeído / fixação cacodilato. Prepare a mistura Fix: sacarose 250 mM, acetato de potássio 100 mM (pH 7,5), acetato de sódio 25 mM (pH 7,0), e EGTA 25 mM (pH 8,0). Para usar, faça fresco com 400 ul Fix Mix, 100 cacodilato ul de potássio (1 M, pH 7,2), e 500 mL de 16% de formaldeído por prep oócito.
CUIDADO: cacodilato de potássio contém arsênico.
- Opção # 1: Prepare formaldeído / fixação heptano. Preparar tampão de fixação: solução salina tamponada 1x com fosfato (PBS), mais 150 mM de sacarose. Para usar, faça fresco com 687,5 ul Fixação de buffer e 312,5 mL de 16% de formaldeídopor prep oócito.
- Prepare PBS / Triton X-100: 1x PBS mais 1% ou 0,05% de Triton X-100. Armazenar a 4 ° C.
- Prepare PBS-Tween 20 Albumina de Soro Bovino (BSA) (PTB): 1x PBS, BSA a 0,5% (w / v) e 0,1% de Tween-20. Pode ser armazenado a 4 ° C durante uma semana.
- A fluorescência in situ fluorescente (FISH) Soluções.
- Prepara-cloreto de sódio 20X Citrato de sódio (SSC): 3 M de cloreto de sódio e citrato de sódio 0,3 M.
- Prepare 2x SSC-Tween-20 (SSCT): 2 x SSC mais 0,1% de Tween-20. Faça frescas, ~ 20 ml por prep oócito.
- Preparar soluções de formamida: 2 x SSC, 0,1% de Tween-20, além de formamida. Adicione fresco, 1 ml de 20% de formamida, 0,5 ml de formamida a 40%, e 2 ml de formamida a 50% por preparação de oócitos.
CUIDADO: Use luvas enquanto estiver usando soluções de formamida em um exaustor. Descarte de resíduos de acordo com as diretrizes institucionais. - Preparar a solução de hibridização: 2 x SSC, formamida a 50%, e 10% de sulfato de dextrano (w / v). Armazenar a 4 ° C.
- Sondas peixe.
- Oligonucleotídeos ordem (ver Tabela 1 para sequências) com HPLC e desejado 5 'modificação fluorescente (por exemplo, Cy3 ou Cy5). Ressuspender em Tris-EDTA (TE) a 50 ng / ul.
NOTA: Proteja oligos da exposição à luz em todos os momentos.
- Oligonucleotídeos ordem (ver Tabela 1 para sequências) com HPLC e desejado 5 'modificação fluorescente (por exemplo, Cy3 ou Cy5). Ressuspender em Tris-EDTA (TE) a 50 ng / ul.
2. Recolha de tarde-estágio Drosophila Oócitos
- Como oócitos de Drosophila com membranas íntegras vai ficar com plástico e vidro, pré-revestir o interior de um tubo de 5 ml e uma pipeta de Pasteur por prep ovócito com PTB.
- Anestesiar todos os ~ 100 a 300 moscas yeasted com dióxido de carbono e adicionar a um misturador contendo ~ 100 ml de 1X tampão de Robb. Pulso três vezes (~ 1 segundo cada). Mantenha oócitos em Robb para <20 min para evitar a activação.
NOTA: Como alternativa, os oócitos podem ser mão-dissecados das fêmeas. A vantagem deste método é que ele exige menos fêmeas. No entanto, os cuidados devem ser tomadas para limitar a exposição ao dióxido de carbono para apenas alguns minutos para evitar erros associados à hipóxia 7. - Filtrar através de malha grande (~ 1.500 mm) em 250 ml copo para remover partes do corpo grandes. Se muitos abdomens intactas permanecer no material de malha, re-moagem usando adicional buffer de Robb e filtro novamente. Vamos resolver ~ 2 min, em seguida, aspirar off camada superior, removendo como muitos dos grandes partes do corpo quanto possível.
- Filtro através de malha pequena (~ 300 uM) para uma proveta de 250 ml. Lavar ovócitos restantes fora do primeiro copo usando adicional de Robb e revestido Pasteur pipeta. Vamos settle ~ 3 min; oócitos vai resolver fora. Aspirar off todos, mas ~ 10 ml.
- Despeje o máximo de 10 ml como se encaixam em revestido tubo de 5 ml. Vamos resolver, remover o líquido, e repita com o restante. Lavar ovócitos restantes fora do copo usando Pasteur pipeta adicional de Robb e revestido. Vamos resolver em 5 ml tubo para ~ 3-5 min.
3. Os tratamentos medicamentosos (Opcional)
- Revestimento de um segundo tubo de 5 ml com PTB para cada prep oócito. Adicionar solvente apropriado (controle) ou de drogas para 1 ml de Robb cada oócito para cada preparação (Tabela 2).
- oócitos dividida em segunda revestido tubo de 5 ml. Vamos Settle, remover o líquido e adicionar 1 ml Robb das mais solventes em um tubo e 1 ml Robb de mais droga no segundo tubo. Nutar para a quantidade de tempo apropriado para o tratamento de drogas (Tabela 2). euet resolver.
4. Fixação
- Aspirar off todo o líquido e imediatamente adicionar 1 ml Fix.
- Opção # 1: Formaldeído / fixação heptano (Tampão de Fixação mais 5% de formaldeído).
- Fixar para 2.5 min em um nutator. Adicionar 1 ml de heptano e vortex 1 min. Vamos settle ~ 1 min.
- Retire todo o líquido e, em seguida adicionar 1 ml 1x PBS. Vortex 30 seg. Vamos settle ~ 1 min.
- Retire todo o líquido e, em seguida, preencher tubo com 1x PBS.
NOTA: Os oócitos podem ser utilizadas imediatamente ou mantidas no nutator durante várias horas à temperatura ambiente.
- Opção # 2: fixação de formaldeído / cacodilato (Fix Mix mais 8% formaldeído e cacodilato 100 mM).
- Correção para 6 min em um nutator. Vamos contentar 2 min. Remover o líquido e, em seguida, preencher tubo com 1x PBS.
NOTA: Os oócitos podem ser utilizadas imediatamente ou mantidas no nutator durante várias horas à temperatura ambiente.
- Correção para 6 min em um nutator. Vamos contentar 2 min. Remover o líquido e, em seguida, preencher tubo com 1x PBS.
5. Removendo membranas ( "Rolling")
- Usando revestido pipeta de Pasteur, adicione ~ 500 a 1.000 oócitos para a parte fosco (jacto de areia) de uma lâmina de vidro. Remover todas as partes do corpo e materiais usando uma pinça estranhos. Não deixe oócitos secar; adicionar 1x PBS conforme necessário.
- Coloque uma lamela em cima dos oócitos e gentilmente oócitos "Roll" até que todas as membranas são removidos (arrastando a borda da lamela entre os oócitos funciona melhor.) Verifique periodicamente o progresso sob o microscópio, adicionando mais 1x PBS, conforme necessário. Tome cuidado como muita pressão irá destruir os ovócitos.
NOTA: Para imunofluorescência somente, continue com o Passo 6. Para peixes (com ou sem imunofluorescência), continue na Etapa 7.
6. Coloração de anticorpos de Drosophila Oócitos
- Extração e Bloqueio
- Lavar oócitos enroladas em um tubo cónico de 15 mL contendo ~ 15 mL de PBS / 1% de Triton X-100. oócitos nutar nesta solução por não menos do que 1,5 horas e não mais do que 2 h.Este passo permite a penetração do anticorpo.
- Vamos oócitos resolver ~ 2 min. Remover o líquido, juntamente com o maior número de membranas quanto possível, em seguida, adicionar PBS / 0,05% de Triton X-100.
NOTA: Membranas vai resolver mais lento do que oócitos laminados. - Deixe oócitos resolver ~ 2 min, em seguida, remover todos, mas ~ 1 ml de líquido. oócitos de transferência para se formou 1,5 tubo ml e remover o líquido remanescente. Adicionar 1 ml de TBP para o bloqueio e nutar durante 1 h.
- coloração de anticorpos
- Pré-absorção de anticorpos secundários contra embriões.
NOTA: Este passo elimina a coloração de fundo a partir de interações de anticorpos não específicos com proteínas de Drosophila.- Recolher e corrigir embriões de Drosophila (~ 25 ul) por típico procedimento 8. Armazenar em metanol a -20 ° C.
- Remover o metanol a partir de embriões, adicionar 800 mL de metanol, com 200 ul de 1x PBS, e nutar durante 15 min. Retirar 500 ul de sobrenadante e substituir com 500 ul de PBS 1x. Então nutar para 15 min. Repita duas vezes (para um total de ~ 1 hr de lavagens), e depois terminar no PTB.
NOTA: Os embriões podem ser utilizadas imediatamente ou mantidas no nutator por várias horas à temperatura ambiente. - Remover o líquido, encher com PTB para 200 mL por prep oócito, e adicionar anticorpos secundários fluorescente-etiquetados em diluições adequadas (tendo em mente que o volume final será de 300 ul;. Consulte o passo 7.4) nutar a 4 ° C durante a noite (preferível) ou à temperatura ambiente durante 3 a 4 horas.
NOTA: Os anticorpos pré-absorvida irá ser utilizado no Passo 6.2.4.
NOTA: Manter as amostras no escuro, tanto quanto possível, uma vez anticorpos fluorescentes foram adicionados.
- Remover o líquido a partir de oócitos, encher com PTB até 300 ml, e adicionar anticorpos primários nas diluições apropriadas. Nutar a 4 ° C durante a noite (preferível) ou à temperatura ambiente durante 3 a 4 horas.
- Lavar oócitos quatro vezes durante 15 minutos cada um com 1 ml PTB.
- Removerlíquido a partir de oócitos, adicionar 200 ul de sobrenadante a partir de embriões pré-absorvida (anticorpos secundários). Em seguida, preencha com PTB para 300 l. Nutar à temperatura ambiente durante 3 a 4 horas (preferivelmente) ou a 4 ° C durante a noite.
- Lavar oócitos uma vez durante 15 min com 1 ml PTB, remover o líquido. Em seguida, adicione 0,5 mL Hoechst 33342 e 500 ul PTB e nutar para 7 min.
- Lavar oócitos duas vezes durante 15 minutos cada um com 1 ml PTB.
NOTA: Os oócitos pode ser montada numa lamela imediatamente ou pode ser armazenada na TBP a 4 ° C até estar pronto para a imagiologia.
- Pré-absorção de anticorpos secundários contra embriões.
7. FISH (Continue a partir do passo 5 acima)
- Lavar oócitos enroladas em um tubo cônico de 15 ml contendo ~ 15 ml 2x SSCT. Vamos oócitos resolver ~ 2 min. Remova todos, mas ~ 0,5 ml de líquido, juntamente com o maior número de membranas quanto possível.
NOTA: Membranas vai resolver mais lento do que oócitos laminados. - Transferência de oócitos para 0,5 tubo ml e remover o líquido remanescente. Sucessivamente adicionar e remover 500 mL20%, 40%, 50% e soluções de formamida, de nutação durante 10 minutos em cada solução.
NOTA: Os oócitos vai resolver mais lento com maiores percentagens de formamida. - Remover o líquido, em seguida, adicionar solução de formamida a 500 ul de 50%, e nutar a 37 ° C durante 1 a 5 horas.
NOTA: Longer incubações resultar em uma melhor penetração da sonda. - Remover o líquido, deixando para trás nada mais do que ~ 100 ul de oócitos, e adicionar 36 ul de solução de hibridação mais 2 ul de sonda (50 ng / mL) e 2 mL de água ou 2 mL de uma sonda 2 ND (Tabela 1).
- Incubar a 91 ° C durante 3 min (apenas FISH) ou 80 ° C durante 20 min (FISH e de imunofluorescência), seguido por incubação num banho de água a 37 ° C durante a noite.
NOTA: Estes passos podem ser efectuados num termociclador. - Não remover o líquido. Adicionar 500 ul de solução a 50% de formamida e nutar a 37 ° C durante 1 h.
- Vamos Settle, remover o líquido, adicione a solução de formamida 500 mL de 50%, umd nutar a 37 ° C durante 1 h.
- Vamos assentar, remover o líquido, adicionar solução de formamida a 500 ul de 20%, e nutar à temperatura ambiente durante 10 min.
- Execute três lavagens rápidas em 500 ul 2x SSCT (vamos Settle, remover, em seguida, adicione o líquido, inverter várias vezes, repetir.) Vamos Settle, remover o líquido, em seguida, adicionar 500 mL PTB e nutar durante 4 h.
8. Coloração de anticorpos após FISH
- Remover o líquido a partir de oócitos, encher com 300 uL de TBP, e adicionar anticorpo anti-tubulina α 10 ul conjugado com FITC. Alternativamente, outros anticorpos podem ser utilizados, seguindo o protocolo acima. Nutar à temperatura ambiente durante a noite.
- Lavar oócitos uma vez durante 15 min com 500 uL PTB, remover o líquido, em seguida, junta-se 0,5 ul de Hoechst 33342 e 500 ul PTB e nutar durante 7 min.
- Lavar oócitos duas vezes durante 15 minutos cada um com 500 ul PTB.
NOTA: Os oócitos pode ser montada numa lamela imediatamente ou pode ser armazenada na TBP a 4 ° C até pronto para serimagiologia. Mantenha oócitos no escuro, tanto quanto possível, uma vez anticorpos fluorescentes foram adicionados.
| Repita Nome | Cromossoma | Seqüência Oligo * |
| 359 | X | GGGATCGTTAGCACTGGTAATTAGCTGC |
| AACAC | 2 | AACACAACACAACACAACACAACACAACACAACACAACAC |
| dodeca | 3 | CCCGTACTGGTCCCGTACTCGGTCCCGTACTCGGT |
| 1.686 | 2 + 3 | AATAACATAGAATAACATAGAATAACATAG |
| AATAT | 4 (+ Y) | AATATAATATAATATAATATAATATAATAT |
| * 359 sequência de Eric Joyce, comunicação pessoal, outras sequências de Sullivan et al. 8 | ||
Tabela 1: sondas de peixe para repete centroméricas de Drosophila.
| Droga | Solvente | da concentração | A concentração final | Tempo de tratamento | Efeito |
| colchicina | etanol | 125 mM | 150 uM | 10 min ou 30 min | desestabilizar não cinetocoro (10 min), 9 ou todos os microtúbulos (30 min) |
| paclitaxel | DMSO | 10 mM | 10 uM | 10 min | estabilizar microtubules |
| Binucleine 2 | DMSO | 25 mM | 25 uM | 20 min | inibir Aurora B quinase 10 |
Tabela 2: O tratamento medicamentoso.
Resultados
Os métodos que descrevemos aqui resultará na coleta de oócitos em estágio final de Drosophila representam três fases da meiose (Figura 1). Os oócitos na profase distinguem-se pela presença do envelope nuclear, que é visível pela falta de sinal de tubulina na região em torno do cariossomo (Figura 1A). Prometáfase é o período após nuclear quebra envelope durante o qual os monta fuso. Durante prometáfase, o cariossomo assume uma forma distinta, tornando-se alongado muitas vezes com o 4º cromossomos Além dos principais massa cariossomo (Figura 1B). Prometáfase conclui com metáfase, na qual oócitos Drosophila naturalmente prender até a ovulação. Em oócitos metafase, o cariossomo tenha se retratado em uma forma redonda (Figura 1C).
Descrevemos aqui métodos para manipular a velocidade de postura de ovos das fêmeas de Drosophila para enriquecer oócitos quer em prometáfase ou metáfase. Oócitos de prometáfase enriquecidas coleções com freqüência mostram a cariossomo alongada (Figura 2A), enquanto coleções metafásicas enriquecido ou coleções de fêmeas virgens de Drosophila, que eliminam quase completamente postura de ovos, mostram principalmente o cariossomo round (Figura 2B). Curiosamente, prometáfase enriquecidas coleções mostram também tipicamente muito mais robusto fusos, sugerindo que tanto a mudança cariossomo eo eixo entre prometáfase e metaphase em Drosophila oócitos 9.
A Figura 3 mostra imagens representativas dos dois protocolos descritos aqui. Os anticorpos contra α-tubulina (para mostrar o eixo), CENP-C (para mostrar centrómeros), e INCENP (para mostrar o eixo central) foram utilizados em oócitos fixo com formaldehyde / heptano (Figura 3A). As sondas para as sequências centroméricos repetitivas no cromossoma 2 ND (AACAC) e 3 rd cromossoma (Dodeca) foram usadas em oócitos fixas com formaldeído / cacodilato e co-coradas com um anticorpo α-tubulina de acordo com o protocolo de FISH (Figura 3B). A sonda AACAC aparece como vários focos de cluster enquanto a sonda dodeca aparece como um único foco por cromossomo. Os oócitos tratados com colchicina 150 uM durante 10 min foram fixados com formaldeído / heptano (Figura 3C). Este tratamento elimina a maioria dos não-cinetócoro-microtúbulos, o que resulta em todos os microtúbulos em contacto com o ADN em focos marcado com centrómero. Os oócitos tratados com paclitaxel a 10 uM durante 10 min mostrar microtúbulos excessivas no citoplasma, mas pouco efeito sobre os microtúbulos do fuso (Figura 3D). Oócitos tratados com 25 mM Binucleine 2 por 20 min para inibir a perda de Aurora B quinase show completo demicrotúbulos fusiformes (Figura 3E).
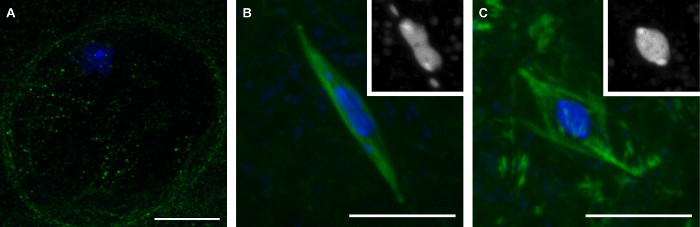
Figura 1: Três fases de oócitos maduros Drosophila:. Prophase, Prometáfase e Metaphase imagens confocal de oócitos de Drosophila em prophase (A), prometáfase (B) e metáfase (C) do DNA da meiose I. é mostrado em azul e tubulina é mostrado em verde em imagens fundidas. As inserções em (B) e (C) mostram ADN em branco. Barras de escala = 10 mm. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2:Prometaphase- vs. coleções metafásicas enriquecido de oócitos de Drosophila. Imagens confocal de oócitos de Drosophila de prometáfase enriquecido (A) ou coleções enriquecido em metáfase (B). DNA é mostrado em azul e tubulina é mostrado em verde. Barras de escala = 10 mm. Por favor clique aqui para ver uma versão maior desta figura.
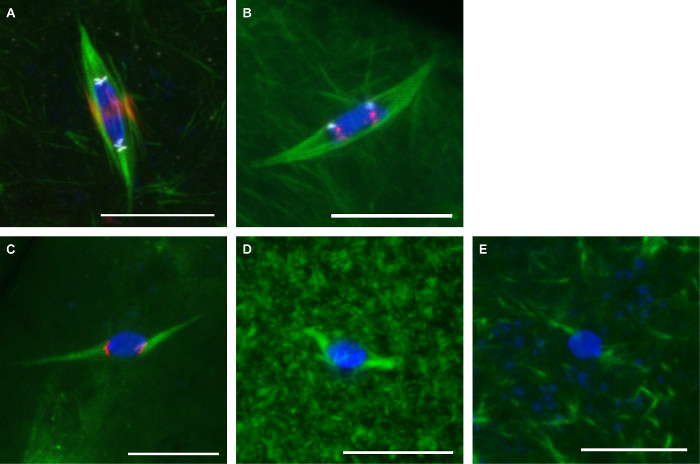
Figura 3: coloração de anticorpos, peixe e drogas tratamentos de oócitos Drosophila imagens confocal de oócitos de Drosophila com DNA em azul e tubulina no verde.. Barras de escala = 10 uM. (A) Imunofluorescência em formaldehyde / heptano fixação com INCENP (eixo central) em vermelho e CENP-C (centrômeros) em branco. (B) FISH na fixação de formaldeído / cacodilato com AACAC mostrado na dodeca vermelho e mostrado em branco. (C) O tratamento com 150 colchicina M para 10 min com CENP-C mostrada em vermelho. O tratamento com paclitaxel 10 mM durante 10 min (D) ou 25 mM Binucleine 2 para 20 min (E). Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Staging Drosophila Oócitos
Embora um cariossomo alongada é muitas vezes visto em oócitos prometáfase, usando cariossomo forma de distinguir prometáfase a partir de oócitos metafase pode ser problemático. Durante prometáfase, o cariossomo começa como uma forma redonda, alonga, e, em seguida, se retrai para uma forma redonda como o oócito se aproxima da prisão metáfase. Isto significa que muitos oócitos prometáfase não tem uma cariossomo alongado. Além disso, se os oócitos mutantes ou tratados com fármaco são examinados, cariossomo forma pode ser afectada, se opõe a utilização deste método para a fase oócitos. Uma vez que outros marcadores para distinguir estas fases não estão disponíveis no momento, que utiliza o método acima descrito para manipular a velocidade de postura de ovos de fêmeas de Drosophila para enriquecer em oócitos quer em prometáfase ou metafase. O raciocínio é que, se oócitos passar um determinado período de tempo em prometáfase, e uma quantidade indefinida de tempo arrresse em metáfase, que dura até de postura, então mais rápido postura de ovos irá inclinar em direção a uma maior percentagem de oócitos prometáfase, enquanto mais lento postura de ovos irá enriquecer para metáfase. A quantidade de esforço necessário para recolher fêmeas virgens ou coletar mulheres ao longo de um período de tempo mais curto do que 2 dias, como descrito por Gilliland et al. 6, não é recompensado por um aumento apreciável em oócitos prometáfase. Também é impossível usar os apêndices dorsais para encenar oócitos preparados com este protocolo como apêndices dorsais são removidos juntamente com as membranas. Embora não seja possível para a fase oócitos individuais com 100% de certeza utilizando este método, os dados de prometáfase enriquecido ou colecções enriquecido em metafase pode ser tomados em conjunto para tirar conclusões sobre estas diferentes fases 9.
Oócitos de Drosophila não são fertilizados até que eles passam através do oviducto; portanto, porque os ovócitos recolhidos para the protocolos descritos aqui examinar oócitos tomadas antes postura de ovos, esses ovócitos não foram fertilizados. A passagem através do oviducto também faz com que o oócito para activar e retomar a progressão do ciclo celular. Métodos para examinar as fases do ciclo celular após metaphase eu existo 11,12, mas estão fora do âmbito deste protocolo.
Considerações método de fixação
Nós descrevemos dois métodos distintos para a fixação do estágio final de ovócitos de Drosophila. O método de fixação de formaldeído / cacodilato foi primeiramente descrita por Theurkauf e Hawley 3 e o método de fixação de formaldeído / heptano foi primeiramente descrita por Zou et al. 4. Além disso, um terceiro método (fixação metanol) é usado cerca de 13, mas não descritas aqui. A remoção das membranas de oócitos é um pouco mais difícil após fixação formaldeído / heptano em relação ao formaldeído / cacodilato. Isto porque "rolling" dependerás no atrito entre a lamela e de oócitos, e formaldeído fixação / heptano faz com que os oócitos mais escorregadia. Apesar desta dificuldade adicional, a nossa primeira escolha do método de fixação ao testar novos anticorpos é formaldeído / heptano porque ele funciona melhor para a maioria dos anticorpos que temos tentado. Por outro lado, prefere-se o formaldeído / cacodilato de fixação para os peixes, primeiramente para a facilidade de remoção da membrana, embora a fixação de formaldeído / heptano também tem sido bem sucedida. Ambos os métodos preservar a morfologia do oócito melhor do que a fixação de metanol, e, portanto, recomendamos a fixação metanol apenas nos casos de anticorpos que são refratários ao métodos de fixação à base de formaldeído.
Os protocolos descritos aqui em foco de imagem fixa, de modo a demonstrar métodos eficazes para render oócitos maduros Drosophila passíveis de penetração de anticorpos, ou seja, através da remoção das membranas de oócitos. Métodos alternativos para a remo membranaval (usando uma pinça 14 ou sonicação 13) são possíveis; No entanto, encontramos "rolar" a ser o método mais eficiente e confiável. Técnicas de imagem ao vivo também têm sido descritos em outros lugares 14-16 e estão fora do âmbito deste protocolo.
Recomendações PEIXES
FISH em oócitos de Drosophila foi descrito originalmente por Dernburg et al. 5. Este protocolo foi concebido para proporcionar condições ideais para a hibridação sonda para os cromossomas de ovócitos condensadas, mas o protocolo original não era ideal para imunofluorescência. O método descrito acima inclui adaptações que fizemos para aumentar a coloração de anticorpos de α-tubulina, que é essencialmente o que usamos na realização de FISH. Para outros anticorpos, diminuindo a temperatura do passo de desnaturação (Passo 7.5) a partir de 80 ° C pode ser necessário.
As sondas são listadas aqui para oseqüências repetitivas no heterocromatina perto dos centrômeros. Porque estas sequências são altamente repetitiva, as sondas emparelhar com vários lugares e os sinais coletivos são bastante fortes. Temos tido pouco sucesso com sondas para sequências na eucromatina, possivelmente devido à estrutura única dos cromossomas, enquanto contida na cariossomo condensado.
imagiologia
Oócitos Drosophila maduros, como os ovócitos da maioria dos organismos, são células grandes, único. Isto significa que existe um grande volume de citoplasma que contém um único núcleo. Felizmente, este núcleo, também conhecido como um cariossomo em Drosophila, pode ser prontamente identificado uma vez que está normalmente localizado a apenas sob os apêndices dorsais junto ao córtex. Os apêndices dorsal são removidos juntamente com as membranas de oócitos, mas o cariossomo ainda pode ser localizado encontrando o pequeno torrão no córtex oócito onde os apêndices ódno foram. As melhores imagens são obtidas a partir de oócitos que foram montados com este torrão de frente para a lamela uma vez que este coloca o cariossomo mais próximo do objectivo. Embora possa ser possível organizar os oócitos Nesta orientação antes da montagem, prefere-se montar muitos oócitos aleatoriamente e então procurar o diapositivo para aqueles na orientação preferida.
Aplicações futuras
No futuro, será importante para identificar marcadores que distinguir de forma confiável prometáfase I e metaphase fusos I. Ser capaz de organizar de forma mais confiável os oócitos irá reduzir a dependência de mais alternativas de trabalho intensivo, tais como imagiologia grande número de oócitos enriquecido em palco ou imagens ao vivo, o que também tem os seus problemas de teste. Este método é um método de base, que pode ser usado para tirar partido dos avanços no campo da genética de Drosophila como novas ferramentas tornam-se disponíveis para modificar ou knock out produtos de genes. Isto inclui métodosde alvejar diretamente a atividade da proteína com novas drogas ou estratégias de degradação alvejados. Além disso, estes métodos não estão limitados a imagiologia de eixos meióticos. Qualquer estrutura dentro do oócito, tais como o citoesqueleto de actina, podem ser analisados utilizando estes métodos.
Divulgações
The authors have nothing to disclose.
Agradecimentos
We thank Christian Lehner for providing the CENP-C antibody and Eric Joyce for recommendations on FISH. Work in the McKim lab was funded by a grant from NIH (GM101955).
Materiais
| Name | Company | Catalog Number | Comments |
| 15 ml conical tubes | Various | ||
| 16% formaldehyde | Ted Pella, Inc. | 18505 | HAZARDOUS; once opened, discard after one month |
| 250 ml beakers | Various | ||
| 5 ml tubes | Various | ||
| active dry yeast | Various | mix with water to make a paste the consistency of peanut butter | |
| anti-α-tubulin antibody conjugated to FITC | Sigma | F2168 | clone DM1A |
| Binucleine 2 | Sigma | B1186 | HAZARDOUS |
| blender | Various | ||
| bovine serum albumin | Sigma | A4161 | |
| calcium chloride | Various | ||
| colchicine | Sigma | C-9754 | HAZARDOUS |
| coverslips | VWR | 48366-227 | No. 1 1/2 |
| dextran sulfate | Various | ||
| DMSO | Various | ||
| EGTA | Various | ||
| ethanol | Various | ||
| forceps | Ted Pella, Inc. | 5622 | Dumont tweezers high precision grade style 5 |
| formamide | Sigma | 47670-250ML-F | |
| glass slides | VWR | 48312-003 | |
| glucose | Various | ||
| graduated 1.5 ml tubes | Various | ||
| HEPES | VWR | EM-5330 | available from several venders |
| Hoechst 33342 | Various | ||
| magnesium chloride | Various | ||
| methanol | Various | ||
| large mesh (~1,500 µm) | VWR | AA43657-NK | variety of formats and other suppliers, 12 or 14 mesh |
| small mesh (~300 µm) | Spectrum labs | 146 424 | variety of formats, e.g., 146 422 or 146 486 |
| nutator | Various | ||
| Pasteur pipets | Various | ||
| potassium acetate | Various | ||
| Cacodylic acid | Sigma | C0125 | HAZARDOUS; alternatively, sodium cacodylate may be substituted |
| potassium hydroxide | Various | ||
| sodium acetate | Various | ||
| sodium chloride | Various | ||
| sodium citrate | Various | ||
| sodium hydroxide | Various | ||
| sucrose | Various | ||
| taxol (paclitaxel) | Sigma | T1912 | HAZARDOUS |
| Triton X-100 | Fisher | PI-28314 | |
| Tween 20 | Fisher | PI-28320 | |
| vortex | Various |
Referências
- Bridges, C. B. Non-disjunction as proof of the chromosome theory of heredity. Genetics. 1 (1), 1-52 (1916).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Theurkauf, W. E., Hawley, R. S. Meiotic spindle assembly in Drosophila females: behavior of nonexchange chromosomes and the effects of mutations in the nod kinesin-like protein. J Cell Biol. 116 (5), 1167-1180 (1992).
- Zou, J., Hallen, M. A., Yankel, C. D., Endow, S. A. A microtubule-destabilizing kinesin motor regulates spindle length and anchoring in oocytes. J Cell Biol. 180 (3), 459-466 (2008).
- Dernburg, A. F., Sedat, J. W., Hawley, R. S. Direct evidence of a role for heterochromatin in meiotic chromosome segregation. Cell. 86 (1), 135-146 (1996).
- Gilliland, W. D., Hughes, S. F., Vietti, D. R., Hawley, R. S. Congression of achiasmate chromosomes to the metaphase plate in Drosophila melanogaster oocytes. Dev Biol. 325 (1), 122-128 (2009).
- Gilliland, W. D., et al. Hypoxia transiently sequesters mps1 and polo to collagenase-sensitive filaments in Drosophila prometaphase oocytes. PLoS One. 4 (10), e7544(2009).
- Sullivan, W., Ashburner, M., Hawley, R. S. Drosophila Protocols. , Cold Spring Harbor Laboratory Press. (2000).
- Radford, S. J., Hoang, T. L., Głuszek, A. A., Ohkura, H., McKim, K. S. Lateral and End-On Kinetochore Attachments Are Coordinated to Achieve Bi-orientation in Drosophila Oocytes. PLoS Genet. 11 (10), e1005605(2015).
- Smurnyy, Y., Toms, A. V., Hickson, G. R., Eck, M. J., Eggert, U. S. Binucleine 2, an isoform-specific inhibitor of Drosophila Aurora B kinase, provides insights into the mechanism of cytokinesis. ACS Chem Biol. 5 (11), 1015-1020 (2010).
- Mahowald, A. P., Goralski, T. J., Caulton, J. H. In vitro activation of Drosophila eggs. Dev Biol. 98 (2), 437-445 (1983).
- Page, A. W., Orr-Weaver, T. L. Activation of the meiotic divisions in Drosophila oocytes. Dev Biol. 183 (2), 195-207 (1997).
- Tavosanis, G., Llamazares, S., Goulielmos, G., Gonzalez, C. Essential role for gamma-tubulin in the acentriolar female meiotic spindle of Drosophila. EMBO J. 16 (8), 1809-1819 (1997).
- Endow, S. A., Komma, D. J. Spindle dynamics during meiosis in Drosophila oocytes. J Cell Biol. 137 (6), 1321-1336 (1997).
- Matthies, H. J., Clarkson, M., Saint, R. B., Namba, R., Hawley, R. S. Drosophila Protocols. Sullivan, W., Ashburner, M., Hawley, R. S. , Cold Spring Harbor Laboratory Press. 67-85 (2000).
- Colombié, N., et al. Dual roles of Incenp crucial to the assembly of the acentrosomal metaphase spindle in female meiosis. Development. 135 (19), 3239-3246 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados