Method Article
Techniques for Imaging Prometaphase und Metaphase der Meiose I in fester
In diesem Artikel
Zusammenfassung
We present protocols for the collection, preparation, and imaging of mature Drosophila oocytes. These methods allow the visualization of chromosome behavior and spindle assembly and function during meiosis.
Zusammenfassung
Chromosome segregation in human oocytes is error prone, resulting in aneuploidy, which is the leading genetic cause of miscarriage and birth defects. The study of chromosome behavior in oocytes from model organisms holds much promise to uncover the molecular basis of the susceptibility of human oocytes to aneuploidy. Drosophila melanogaster is amenable to genetic manipulation, with over 100 years of research, community, and technique development. Visualizing chromosome behavior and spindle assembly in Drosophila oocytes has particular challenges, however, due primarily to the presence of membranes surrounding the oocyte that are impenetrable to antibodies. We describe here protocols for the collection, preparation, and imaging of meiosis I spindle assembly and chromosome behavior in Drosophila oocytes, which allow the molecular dissection of chromosome segregation in this important model organism.
Einleitung
The study of meiosis is sometimes described as the "genetics of genetics". This is because the fundamental properties of chromosome inheritance and independent assortment are carried out through the segregation of chromosomes during gamete production. An important demonstration of the chromosome theory of inheritance came in 1916 from the work of Calvin Bridges in Drosophila melanogaster1. This and other classical genetics studies in Drosophila contributed greatly to our understanding of genetics. Cytological examination of meiotic chromosomes in Drosophila oocytes, however, has been challenging. This is primarily because immunofluorescence of late-stage Drosophila oocytes, when the spindle assembles and chromosomes are oriented for segregation, is hampered by the presence of membranes that render the oocyte impenetrable to antibodies.
Despite this challenge, Drosophila oocytes remain an attractive model for the study of chromosome behavior and spindle assembly. This is because of the powerful genetic tools available in Drosophila, but also because the oocytes arrest at metaphase I, when the chromosomes are oriented and the spindle is fully formed. This facilitates the collection and examination of large numbers of oocytes at this important stage of cell division. In addition, a simple model organism that is amenable to genetic manipulation for the study of oocyte chromosome segregation can provide an important contribution to our understanding of human reproductive health. Errors in chromosome number are the leading genetic cause of miscarriage and birth defects in humans2. A majority of these errors can be traced to the oocyte and are correlated with increasing maternal age. The average age of mothers in the U.S. has been increasing, making this a major public health concern.
We describe here methods for the cytological examination of Drosophila oocytes, including a demonstration of how to remove the oocyte membranes. These methods are modifications of protocols first described by Theurkauf and Hawley3, Zou et al.4, and Dernburg et al.5. We also include methods for the enrichment of different stages of oocytes, based on a protocol first described by Gilliland et al.6. Finally, we add instructions for the drug treatment of Drosophila oocytes. Together, these methods allow the cytological investigation of oocyte chromosome segregation and spindle assembly in Drosophila.
Protokoll
Anmerkung: Verfahren bei Raumtemperatur durchgeführt, sofern nicht anders angegeben. Die temperaturgeregelte Inkubatoren verwendet werden Temperaturen für das Fliegenzucht zu halten und Kreuze, sofern nicht anders vermerkt.
1. Vorbereitungen
- Bereiten Sie Flies.
- Oozyten Sammlungen Prometaphase angereicherte.
- Klar erwachsenen Fliegen von gesunden, jungen Aktien oder Quer Kulturen. Alter Flaschen für zwei Tage bei 25 ° C.
HINWEIS: In der Regel zwei gesunde Flaschen genügt, wenn auch für einige Quer Kulturen benötigt werden. - Nach zwei Tagen sammeln ~ 100 bis 300 Frauen (die zu diesem Zeitpunkt 0 bis 2 Tage alt sind) aus den Flaschen. Die Weibchen müssen nicht Jungfrauen zu sein. Fügen Sie einen Klecks Hefe-Paste auf die Seite eines Fläschchens und legen 30 Frauen und 10 bis 15 Männer jeweils in die yeasted Fläschchen. Alter Phiolen für zwei Tage bei 25 ° C.
- Klar erwachsenen Fliegen von gesunden, jungen Aktien oder Quer Kulturen. Alter Flaschen für zwei Tage bei 25 ° C.
- Metaphase angereicherte Oozyten Kollektionen.
- Sammeln Sie ~ 100 bis 300 Frauen ab Lager oder Quer cultures. Fügen Sie einen Klecks Hefe-Paste auf die Seite eines Fläschchens und legen 30 Frauen jeweils (ohne Männchen hinzugefügt) in die yeasted Fläschchen. Alter Phiolen für drei bis fünf Tage bei 25 ° C.
- Oozyten Sammlungen Prometaphase angereicherte.
- Bereiten Sie Lösungen.
Hinweis: Die Lösungen werden bei Raumtemperatur unbegrenzt gelagert, wenn nicht anders angegeben.- Prepare Modifizierte Robb-Puffer (5x): 500 mM HEPES, 500 mM Sucrose, 275 mM Natriumacetat, 200 mM Kaliumacetat, 50 mM Glucose, 6 mM Magnesiumchlorid und 5 mM Calciumchlorid. Verwenden 10 N 11: 8 Natriumhydroxid: Kaliumhydroxid pH auf 7,4 zu bringen. Sterilisieren durch Filtration; nicht im Autoklaven. Lagerung bei -20 ° C. nach Bedarf auftauen ~ 200 ml 1x Robb prep pro Eizelle vorzubereiten.
- Fixation Solutions.
- Option # 1: Vorbereiten Formaldehyd / Heptan-Fixierung. Vorbereitung Fixation Buffer: 1x phosphatgepufferter Kochsalzlösung (PBS) plus 150 mM Saccharose. Verwenden zu können, machen frisch mit 687,5 ul Fixation Buffer und 312,5 ul 16% Formaldehydpro Eizelle prep.
ACHTUNG: Handschuhe tragen bei der Verwendung von Formaldehydlösungen in einem Abzug. Entsorgen von Abfällen gemäß gültiger Richtlinien. - Option # 2: Vorbereiten Formaldehyd / Cacodylat Fixierung. Vorbereitung Fix Mix: 250 mM Sucrose, 100 mM Kaliumacetat (pH 7,5), 25 mM Natriumacetat (pH 7,0) und 25 mM EGTA (pH 8,0). Zur Verwendung machen frisch mit 400 ul Fix-Mix, 100 ul Kaliumcacodylat (1 M, pH 7,2) und 500 & mgr; l 16% Formaldehyd pro Eizelle prep.
ACHTUNG: Kaliumcacodylat enthält Arsen.
- Option # 1: Vorbereiten Formaldehyd / Heptan-Fixierung. Vorbereitung Fixation Buffer: 1x phosphatgepufferter Kochsalzlösung (PBS) plus 150 mM Saccharose. Verwenden zu können, machen frisch mit 687,5 ul Fixation Buffer und 312,5 ul 16% Formaldehydpro Eizelle prep.
- Bereiten PBS / Triton X-100: 1x PBS plus 1% oder 0,05% Triton X-100. Lagerung bei 4 ° C.
- Bereiten PBS-Tween 20-Rinderserumalbumin (BSA) (PTB): 1x PBS, 0,5% BSA (w / v) und 0,1% Tween-20. Kann für eine Woche bei 4 ° C gelagert werden.
- Fluoreszenz in situ Hybridisierung (FISH) Lösungen.
- Bereiten 20X Natriumchlorid-Natriumcitrat (SSC): 3 M Natriumchlorid und 0,3 M Natriumcitrat.
- Bereiten 2x SSC-Tween-20 (SSCT): 2x SSC plus 0,1% Tween-20. Machen Sie frische, ~ 20 ml pro Eizelle prep.
- Bereiten Formamid-Lösungen: 2 x SSC, 0,1% Tween-20, sowie Formamid. Machen Sie frische, 1 ml 20% Formamid, 0,5 ml 40% Formamid und 2 ml 50% Formamid pro Eizelle prep.
ACHTUNG: Handschuhe tragen, während Formamid Lösungen in einem Abzug mit. Entsorgen von Abfällen gemäß gültiger Richtlinien. - Bereiten Hybridisierungslösung: 2x SSC, 50% Formamid und 10% Dextransulfat (w / v). Lagerung bei 4 ° C.
- FISH-Sonden.
- Bestellen Oligonukleotide (Tabelle 1 für Sequenzen sehen) mit HPLC - Reinigung und Wunsch 5 'fluoreszierende Modifikation (zB Cy3 oder Cy5). Resuspendieren in Tris-EDTA (TE) bei 50 ng / & mgr; l.
Hinweis: Schützen Sie Oligos von Lichtexposition zu allen Zeiten.
- Bestellen Oligonukleotide (Tabelle 1 für Sequenzen sehen) mit HPLC - Reinigung und Wunsch 5 'fluoreszierende Modifikation (zB Cy3 oder Cy5). Resuspendieren in Tris-EDTA (TE) bei 50 ng / & mgr; l.
2. Sammlung der Late-Stage Drosophila Oozyten
- Wie Drosophila Oozyten mit Membranen intakt haften auf Kunststoff und Glas, Pre-Beschichtung der Innenseite einer 5 - ml - Röhrchen und einer Pasteur - Pipette pro Eizelle prep mit PTB.
- Anesthetize alle ~ 100 bis 300 yeasted Fliegen mit Kohlendioxid und fügen Sie in einen Mischer enthält ~ 100 ml 1x Robb Buffer. Pulse dreimal (~ 1 Sekunde pro Stück). Halten Sie Eizellen in Robb für <20 min Aktivierung zu vermeiden.
HINWEIS: Alternativ Eizellen von Frauen von Hand präpariert werden können. Der Vorteil dieses Verfahrens ist, dass es weniger Weibchen erfordert. Allerdings ist darauf zu Exposition gegenüber Kohlendioxid nur wenige Minuten in Anspruch zu nehmen Artefakte mit Hypoxie assoziiert 7 zu vermeiden. - Filter durch große Netz (~ 1500 & mgr; m) in 250-ml-Becher große Körperteile zu entfernen. Wenn viele intakte abdomens bleiben auf Mesh, Nachschliff Material zusätzliche Robb Puffer und Filter wieder. Lassen Sie siedeln ~ 2 min, dann obere Schicht absaugen, da viele der großen Körperteile wie möglich zu entfernen.
- Filter durch kleine Maschen (~ 300 & mgr; m) in einen 250-ml-Becher. Spülen restlichen Eizellen aus den ersten Becher mit zusätzlichen Robb und beschichteten Pasteur-Pipette. Lassen Sie settle ~ 3 min; Eizellen werden absetzen. Aspirieren aber ~ 10 ml ab.
- Gießen Sie so viel von den 10 ml wie in beschichteten 5-ml-Röhrchen passen. Lassen Sie, Entfernen Flüssigkeit, und wiederholen Sie mit Rest. Spülen restlichen Eizellen aus Becherglas mit zusätzlichen Robb und beschichteten Pasteur-Pipette. Lassen Sie siedeln in 5-ml-Tube für ~ 3-5 min.
3. Behandlungen mit Arzneimitteln (Optional)
- Mantel ein zweites 5-ml-Röhrchen mit PTB für jede Eizelle prep. Hinzufügen geeigneten Lösungsmittel (Kontrolle) oder Arzneimittel zu 1 ml Robbs jeweils für jede Oocyte prep (Tabelle 2).
- Split Eizellen in die zweite beschichtete 5-ml-Tube. Lassen Sie, Entfernen Flüssigkeit und 1 ml Robb plus Lösungsmittel in ein Röhrchen und 1 ml Robb plus Medikament in die zweite Röhre. Nutation für entsprechende Menge an Zeit für die Arzneimittelbehandlung (Tabelle 2). Let begleichen.
4. Fixation
- Absaugen alle Flüssigkeit und fügen sofort 1 ml Fix.
- Option 1: Formaldehyd / Heptan Fixation (Fixation Buffer plus 5% Formaldehyd).
- Fix für 2,5 min auf einer Nutator. 1 ml Heptan und Wirbel 1 min. Lassen Sie settle ~ 1 min.
- Entfernen Sie alle Flüssigkeit, und fügen Sie dann 1 ml 1x PBS. Vortex 30 Sekunden. Lassen Sie settle ~ 1 min.
- Entfernen Sie alle Flüssigkeit, und dann füllen Rohr mit 1x PBS.
HINWEIS: Die Oocyten können sofort oder gehalten auf der Nutator mehrere Stunden bei Raumtemperatur verwendet werden.
- Option 2: Formaldehyd / Cacodylat Fixierung (Fix Mix plus 8% Formaldehyd und 100 mM Cacodylat).
- Fix für 6 min auf einem Nutator. Lassen Sie 2 Minuten absetzen. Entfernen Sie Flüssigkeit, und dann füllen Rohr mit 1x PBS.
HINWEIS: Die Oocyten können sofort oder gehalten auf der Nutator mehrere Stunden bei Raumtemperatur verwendet werden.
- Fix für 6 min auf einem Nutator. Lassen Sie 2 Minuten absetzen. Entfernen Sie Flüssigkeit, und dann füllen Rohr mit 1x PBS.
5. Die Membranen Entfernen ( "Rolling")
- Mit beschichteten Pasteur-Pipette, fügen ~ 500 bis 1.000 Eizellen zur mattiert (sandgestrahlte) Teil eines Glasträger. Entfernen Sie alle Körperteile und Fremdmaterial mit einer Pinzette. Lassen Sie sich nicht Eizellen austrocknen; 1x PBS bei Bedarf hinzufügen.
- Legen Sie ein Deckglas auf der Eizellen und sanft "rollen" Eizellen, bis alle Membranen werden entfernt (Ziehen der Kante des Deckglases über die Eizellen am besten funktioniert.) Überprüfen Sie regelmäßig die Fortschritte unter dem Mikroskop, das Hinzufügen von mehr 1x PBS wie nötig. Achten Sie darauf, wie zu viel Druck wird die Eizellen zerstören.
HINWEIS: Nur für Immunofluoreszenz mit 6. Schritt weiter für Fische (mit oder ohne Immun), fahren Sie mit Schritt 7.
6. Antikörper - Färbung von Drosophila Oozyten
- Extraktion und Blockierung
- Spülen gewalzten Oozyten in ein 15 ml konisches Röhrchen mit ~ 15 ml PBS / 1% Triton X-100. Nutation Oozyten in dieser Lösung nicht weniger als 1,5 Stunden und nicht mehr als 2 Stunden.Dieser Schritt ermöglicht Antikörper Penetration.
- Lassen Sie Eizellen absetzen ~ 2 min. Entfernen Flüssigkeit zusammen mit so vielen Membranen wie möglich, dann fügen PBS / 0,05% Triton X-100.
HINWEIS: Die Membranen werden siedeln langsamer als gerollt Eizellen. - Lassen Eizellen absetzen ~ 2 min, dann entfernen Sie alle, aber ~ 1 ml Flüssigkeit. Transfer-Oozyten abgestuft bis 1,5-ml-Röhrchen und restliche Flüssigkeit zu entfernen. 1 ml der PTB für die Sperrung und Nutation für 1 Stunde.
- Antikörper-Färbung
- Pre-Absorption von sekundären Antikörpern gegen Embryonen.
HINWEIS: Dieser Schritt eliminiert Hintergrundfärbung von nicht-spezifischen Antikörper - Wechselwirkungen mit Drosophila - Proteine.- Sammeln und beheben Drosophila - Embryos (~ 25 & mgr; l) pro typisches Verfahren 8. Speichern in Methanol bei -20 ° C.
- Entfernen von Methanol aus Embryonen, fügen Sie 800 ul Methanol plus 200 ul 1x PBS und Nutation für 15 min. Entfernen Sie 500 ul Überstand und ersetzen mit 500 ul 1x PBS. Dann nutiert für 15 min. Wiederholen Sie zweimal (für insgesamt ca. 1 Stunde von Waschungen) und dann in der PTB zu beenden.
HINWEIS: Die Embryonen verwendet werden können, sofort oder auf der Nutator für mehrere Stunden bei Raumtemperatur gehalten. - Entfernen Sie Flüssigkeit füllen mit PTB bis 200 & mgr; l pro Eizelle prep, und fügen Sie fluoreszenzmarkierten sekundären Antikörper in geeigneten Verdünnungen (wenn man bedenkt, dass das endgültige Volumen von 300 & mgr; l wird, vgl. Schritt 7.4) Nutation bei 4 ° C über Nacht (bevorzugt) oder bei Raumtemperatur für 3 bis 4 Stunden.
HINWEIS: Die vorge absorbierte Antikörper werden in Schritt 6.2.4 verwendet werden.
HINWEIS: Bewahren Sie Proben im Dunkeln, so viel wie möglich, sobald fluoreszierende Antikörper hinzugefügt wurden.
- Entfernen von Flüssigkeit aus Oozyten, füllen mit PTB bis 300 & mgr; l, und fügen Sie primären Antikörper bei geeigneten Verdünnungen. Nutiert bei 4 ° C über Nacht (bevorzugt) oder bei Raumtemperatur für 3 bis 4 Stunden.
- Wasch Oozyten viermal für jeweils 15 min mit 1 ml PTB.
- EntfernenFlüssigkeit aus Oozyten wurden 200 ul Überstand von Embryonen (vorabsorbiert Sekundärantikörper) hinzuzufügen. Dann füllen sich mit PTB bis 300 & mgr; l. über Nacht nutiert für 3 bis 4 h (bevorzugt) oder bei 4 ° C bei Raumtemperatur.
- Waschen Sie Eizellen einmal für 15 Minuten mit 1 ml PTB, entfernen Flüssigkeit. Dann fügen 0,5 ul Hoechst 33342 und 500 ul PTB und Nutation für 7 min.
- Waschen Oozyten zweimal für jeweils 15 min mit 1 ml PTB.
HINWEIS: Die Oocyten können unmittelbar an einem Schlitten montiert werden, oder kann für die Bildgebung in PTB bei 4 ° C bis bereit gespeichert werden.
- Pre-Absorption von sekundären Antikörpern gegen Embryonen.
7. FISH (weiter von Schritt 5 oben)
- Spülen Sie rollte Eizellen in eine 15 ml konischen Röhrchen mit ~ 15 ml 2x SSCT-. Lassen Sie Eizellen absetzen ~ 2 min. Entfernen Sie alle ~ 0,5 ml Flüssigkeit zusammen mit so vielen Membranen wie möglich.
HINWEIS: Die Membranen werden siedeln langsamer als gerollt Eizellen. - Transfer-Oozyten bis 0,5-ml-Röhrchen und entfernen restliche Flüssigkeit. Nacheinander hinzufügen und 500 ul entfernen20%, 40% und 50% Formamid-Lösungen, Taumel für 10 min in jeder Lösung.
HINWEIS: Die Oozyten werden mit einem höheren Prozentsatz an Formamid langsamer absetzen. - Entfernen Sie Flüssigkeit, fügen Sie dann 500 ul 50% Formamid-Lösung und Nutation bei 37 ° C für 1 bis 5 Stunden.
HINWEIS: Längere Inkubationen führen zu einer besseren Sonde Penetration. - Entfernen Flüssigkeit und hinterlässt nicht mehr als ~ 100 & mgr; l - Oozyten und fügen 36 ul Hybridisierungslösung plus 2 & mgr; l Sonde (50 ng / ul) und 2 ul Wasser oder 2 & mgr; l einer 2 nd Sonde (Tabelle 1).
- bei 91 ° C inkubieren 3 min (FISH only) oder 80 ° C für 20 min (FISH und Immunofluoreszenz), gefolgt von einer Inkubation über Nacht in einem Wasserbad 37 ° C.
Hinweis: diese Schritte in einem Thermocycler durchgeführt werden. - Entfernen Sie nicht flüssig. Hinzufügen 500 ul 50% Formamid-Lösung und nutiert bei 37 ° C für 1 Stunde.
- Lassen Sie, Entfernen Flüssigkeit, 500 & mgr; l 50% Formamid-Lösung eind nutiert bei 37 ° C für 1 Stunde.
- Lassen Sie, Entfernen Flüssigkeit, 500 & mgr; l 20% Formamid-Lösung und Nutation bei Raumtemperatur für 10 min.
- Führen Sie drei schnelle Waschungen in 500 ul 2x SSCT- (lassen, Entfernen dann Flüssigkeit hinzufügen, kehren mehrmals wiederholen.) Lassen Sie, Entfernen Flüssigkeit, dann fügen Sie 500 ul PTB und Nutation für 4 Stunden.
8. Antikörper-Färbung nach FISH
- Entfernen von Flüssigkeit aus Oozyten, füllen mit PTB bis 300 & mgr; l, und dann werden 10 & mgr; l anti-α-Tubulin-Antikörper an FITC konjugiert. Alternativ können auch andere Antikörper verwendet werden, nach oben Protokoll. über Nacht bei Raumtemperatur Nutation.
- Waschen Sie Eizellen einmal für 15 Minuten mit 500 ul PTB, entfernen Flüssigkeit, dann fügen 0,5 ul Hoechst 33342 und 500 ul PTB und Nutation für 7 min.
- Waschen Oozyten zweimal für 15 min mit jeweils 500 ul PTB.
HINWEIS: Die Oocyten können unmittelbar an einem Schlitten montiert werden, oder sie können für in PTB bei 4 ° C bis bereit gespeichert werdenBildgebung. Halten Sie Eizellen im Dunkeln, so viel wie möglich, sobald fluoreszierende Antikörper hinzugefügt wurden.
| Wiederholen Sie Namen | Chromosom | Oligo Sequenz * |
| 359 | X | GGGATCGTTAGCACTGGTAATTAGCTGC |
| AACAC | 2 | AACACAACACAACACAACACAACACAACACAACACAACAC |
| dodeca | 3 | CCCGTACTGGTCCCGTACTCGGTCCCGTACTCGGT |
| 1,686 | 2 + 3 | AATAACATAGAATAACATAGAATAACATAG |
| AATAT | 4 (+ Y) | AATATAATATAATATAATATAATATAATAT |
| * 359 - Sequenz von Eric Joyce, persönliche Kommunikation, andere Sequenzen von Sullivan et al. 8 | ||
Tabelle 1: FISH - Sonden für Drosophila zentromerischen wiederholt.
| Droge | Lösungsmittel | Auf Konzentration | Die Endkonzentration | Behandlungszeit | Bewirken |
| Colchicin | Ethanol | 125 mM | 150 & mgr; M | 10 min oder 30 min | destabilisieren nicht kinetochore (10 min) 9 oder alle (30 min) Mikrotubuli |
| Paclitaxel | DMSO | 10 mM | 10 & mgr; M | 10 Minuten | stabilisieren microtubules |
| Binucleine 2 | DMSO | 25 mM | 25 & mgr; M | 20 Minuten | hemmen Aurora B - Kinase 10 |
Tabelle 2: Die medikamentöse Behandlung.
Ergebnisse
Die Methoden , die wir hier beschrieben haben , in der Sammlung von Spätstadium der Drosophila - Oozyten , die drei Stadien der Meiose (Abbildung 1) wird zur Folge haben . Oozyten in Prophase werden durch das Vorhandensein der Kernhülle aus, die durch das Fehlen von Tubulin - Signal in der Region um die karyosome (1A) sichtbar ist. Prometaphase ist die Zeit, nach der Kernhülle Zusammenbruch während der die Spindel montiert. Während Prometaphase nimmt der karyosome eine unverwechselbare Form, immer oft länglich mit den 4 - ten Chromosomen abgesehen von der Haupt karyosome Masse (1B). Prometaphase schließt mit Metaphase, bei der Drosophila Eizellen natürlich bis zur Ovulation verhaften. In der Metaphase Eizellen hat die karyosome in eine runde Form (1C) zurückgezogen.
Wir beschreiben hier mETHODEN die Geschwindigkeit der Eiablage von Drosophila Frauen zu manipulieren für Eizellen entweder in Prometaphase oder Metaphase zu bereichern. Oozyten von Prometaphase angereicherten Sammlungen zeigen häufig die längliche karyosome (2A) , während der Metaphase angereicherten Sammlungen oder Sammlungen von jungfräulichen Weibchen Drosophila, die fast vollständig Eiablage beseitigen, zeigen in erster Linie die Runde karyosome (2B). Interessanterweise Prometaphase angereicherten Sammlungen zeigen auch in der Regel sehr viel robuster Spindeln, was darauf hindeutet , dass sowohl die karyosome und Spindelwechsel zwischen Prometaphase und Metaphase in Drosophila 9 Oozyten.
Abbildung 3 zeigt repräsentative Bilder aus den beiden Protokollen hier beschrieben. Antikörper gegen α-Tubulin (die Spindel zu zeigen), CENP-C (Romeren zu zeigen) und INCENP (die zentrale Spindel zu zeigen) auf Eizellen verwendet wurden mit fo fixiertrmaldehyde / Heptan (3A). Sonden für die sich wiederholenden Zentromer - Sequenzen auf dem 2. Chromosom (AACAC) und 3. Chromosom (dodeca) wurden auf Oozyten verwendet fixiert mit Formaldehyd / Cacodylat et gefärbt mit einem α-Tubulin - Antikörper gemäß der FISH - Protokoll (3B). Die AACAC Sonde erscheint als mehrere gruppierte Herde, während die dodeca Sonde als einzelnen Fokus pro Chromosom erscheint. Oozyten mit 150 uM Colchicin behandelt für 10 min wurden mit Formaldehyd / Heptan (3C) fixiert. Diese Behandlung eliminiert die meisten nicht-kinetochore-Mikrotubuli, die in allen Mikrotubuli führt die DNA an Zentromer-markierten Foci kontaktieren. Oocyten für 10 übermäßige Mikrotubuli im Zytoplasma, aber wenig Wirkung auf die Mikrotubuli Spindel (3D) min Show mit 10 uM Paclitaxel behandelt. behandelt Oozyten mit 25 uM Binucleine 2 für 20 min Aurora B-Kinase zeigen vollständigen Verlust der zu hemmenSpindel Mikrotubuli (Abbildung 3E).
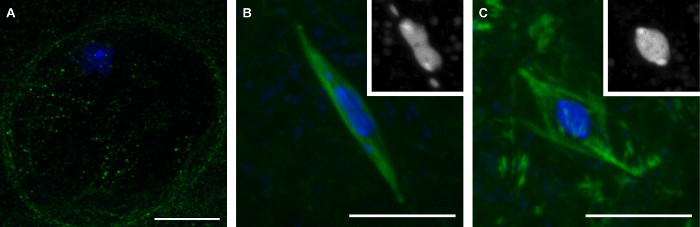
Abbildung 1: Drei Stufen der reifen Drosophila Oozyten. Prophase, Prometaphase und Metaphase Konfokalbilder von Drosophila Oozyten in Prophase (A), Prometaphase (B), und die Metaphasezellen (C) der Meiose I. DNA wird in blau dargestellt und Tubulin ist in grün in fusionierten Bilder gezeigt. Die Einschübe in (B) und (C) zeigen DNA in weiß. Maßstabsbalken = 10 & mgr; m. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Figur 2:Prometaphase- vs. Metaphase angereicherten Sammlungen von Drosophila Oozyten. Konfokale Bilder von Drosophila Oozyten aus Prometaphase angereicherten (A) oder Metaphase angereicherte (B) Sammlungen. DNA wird in blau dargestellt und Tubulin wird in grün dargestellt. Maßstabsbalken = 10 & mgr; m. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
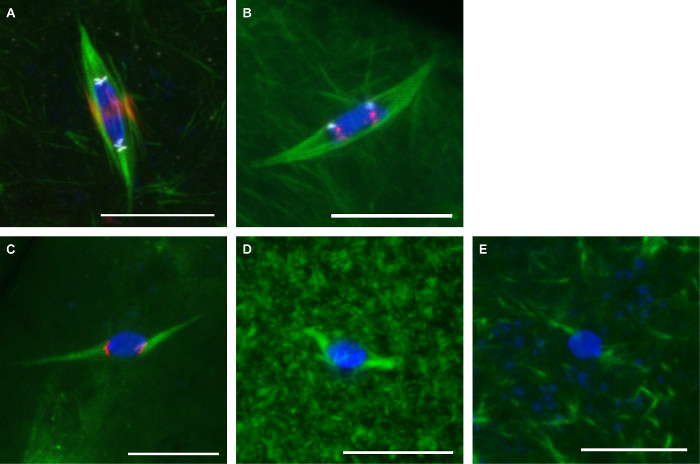
Abbildung 3: Antikörper - Färbung, Fisch und medikamentöse Behandlungen von Drosophila - Oozyten Konfokalbilder von Drosophila Oozyten , die mit DNA in blau und Tubulin in grün.. Maßstabsbalken = 10 um. (A) Immunofluoreszenz in formaldehyde / Heptan Fixierung mit INCENP (Zentralspindel) in rot und CENP-C (Romeren) in weiß. (B) FISH in Formaldehyd / Cacodylat Fixierung mit AACAC in rot und dodeca in weiß dargestellt. (C) Die Behandlung mit 150 & mgr; M Colchicin für 10 min mit CENP-C in rot dargestellt. Die Behandlung mit 10 uM Paclitaxel für 10 min (D) oder 25 uM Binucleine 2 für 20 min (E). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Staging Drosophila Oozyten
Obwohl ein längliches karyosome oft in der Prometaphase Oocyten gesehen wird, karyosome Form unter Verwendung von Metaphase Prometaphase Oozyten unterscheiden kann problematisch sein. Während Prometaphase beginnt die karyosome als eine runde Form, längt, und zieht dann in eine runde Form wie die Eizelle die Verhaftung Metaphase nähert. Dies bedeutet, dass viele der Prometaphase Oozyten keine längliche karyosome haben. Darüber hinaus, wenn Mutante oder mit Arzneimittel behandelten Oozyten untersucht werden, kann karyosome Form beeinflusst werden, ausschließt dieser Methode Oozyten zu Stufe. Da andere Markierungen diese Phasen zu unterscheiden sind derzeit nicht verfügbar ist , verwenden wir das oben beschriebene Verfahren die Geschwindigkeit der Eiablage von Drosophila Frauen zu manipulieren für Eizellen zu bereichern entweder in Prometaphase oder Metaphase. Der Grund ist, dass wenn Oozyten verbringen eine bestimmte Menge an Zeit, in der Prometaphase und eine unbestimmte Zeitspanne arrsierten in der Metaphase, die bis zum Eierlegen, dann schnellere Eiablage dauert wird schräg zu einem höheren Prozentsatz der Prometaphase Eizellen, während langsamer Eiablage für Metaphase bereichern wird. Der Aufwand erforderlich ist, um jungfräulichen Weibchen sammeln oder sammeln Weibchen über einen kürzeren Zeitrahmen als 2 Tage, wie von Gilliland et al. 6 wird nicht durch eine spürbare Zunahme der Prometaphase Eizellen belohnt. Es ist auch nicht möglich, die Rückenanhänge zu verwenden Eizellen mit diesem Protokoll bereit zu inszenieren als Rückenanhänge zusammen mit den Membranen entfernt werden. Auch wenn es nicht möglich ist , einzelne Eizellen mit 100% iger Sicherheit zu Stufe kann mit dieser Methode, die Daten aus der Prometaphase angereicherten oder Metaphase angereicherten Sammlungen zusammen Schlussfolgerungen 9 über die verschiedenen Stufen zu ziehen genommen werden.
Drosophila Eizellen befruchtet werden nicht , bis sie durch den Eileiter passieren; deshalb, weil die Eizellen für th gesammelte Protokolle hier Eizellen vor der Eiablage getroffene Maßnahme beschrieben, haben diese Eizellen nicht befruchtet worden. Passage durch den Eileiter verursacht auch die Oozyte zu aktivieren, und die Zellzyklusprogression fortzusetzen. Methoden Zellzyklus - Stadien zu untersuchen nach Metaphase I 11,12 existieren, aber nicht in den Geltungsbereich dieses Protokolls sind.
Fixationsmethode Überlegungen
Wir beschreiben zwei separate Verfahren zur Fixierung von Spätstadium der Drosophila - Oozyten. Das Formaldehyd / Cacodylat Fixierungsverfahren wurde zuerst von Theurkauf und Hawley 3 und dem Formaldehyd / Heptan Fixierungsverfahren beschrieben wurde zuerst von Zou et al. 4 beschrieben. Zusätzlich ist ein drittes Verfahren (Methanol Fixierung) von etwa 13 verwendet, aber hier nicht beschrieben. Die Entfernung der Eizelle Membranen ist etwas schwieriger, nach Formaldehyd / Heptan Fixierung im Vergleich zu Formaldehyd / Cacodylat. Dies liegt daran, "Rollen" abhängens auf die Reibung zwischen dem Deckglas und Eizelle und Formaldehyd / Heptan Fixierung macht die Eizellen mehr rutschig. Trotz dieser zusätzlichen Schwierigkeit, unsere erste Wahl der Fixationsmethode, wenn neue Antikörper testen, Formaldehyd / Heptan, weil es am besten für die Mehrheit von Antikörpern arbeitet, die wir versucht haben. Auf der anderen Seite bevorzugen wir Formaldehyd / Cacodylat Fixierung für FISH, in erster Linie für die einfache Entfernung der Membran, obwohl Formaldehyd / Heptan Fixierung auch erfolgreich war. Beide Methoden erhalten bessere Oozyten Morphologie als Methanol Fixierung und daher empfehlen wir Methanol Fixierung nur in den Fällen von Antikörpern, die auf Formaldehyd-Basis refraktär sind Fixationsmethoden.
Die Protokolle hier beschriebenen konzentrieren sich auf feste Bildgebung, um für die Darstellung von reifen Drosophila Oozyten zugänglich Antikörper Penetration, und zwar durch die Entfernung der Oozyten - Membranen wirksame Methoden zu demonstrieren. Alternative Methoden zur Membran removal (mit einer Pinzette 14 oder Beschallung 13) möglich sind; aber wir "Rollen" zu sein, die effizienteste und zuverlässigste Methode finden. Techniken für die Echtzeit- Bildgebung wurden auch anderswo 14-16 und liegen außerhalb des Umfangs dieses Protokolls beschrieben.
FISH Empfehlungen
FISH in Drosophila Oozyten wurde ursprünglich von Dern et al. 5. Dieses Protokoll wurde entwickelt, um die kondensierte Oozyten Chromosomen zu optimalen Bedingungen für die Sondenhybridisierung zu liefern, aber das ursprüngliche Protokoll war nicht optimal für Immunofluoreszenz. Das oben beschriebene Verfahren umfasst Anpassungen wir gemacht haben, Antikörperfärbung von α-Tubulin zu verbessern, die in erster Linie ist das, was wir verwenden, wenn FISH durchführt. Für andere Antikörper kann die Temperatur des Denaturierungsschritt (Schritt 7.5) von 80 ° C Absenkung erforderlich.
Die Sonden hier aufgeführten sind für dierepetitive Sequenzen im Heterochromatin in der Nähe der Zentromer. Da diese Sequenzen stark repetitiven sind, anlagern die Sonden an mehreren Stellen und die kollektiven Signale sind ziemlich stark. Wir haben für die Sequenzen in der Euchromatin wenig Erfolg mit Sonden hatten, möglicherweise aufgrund der einzigartigen Struktur der Chromosomen während der kondensierte karyosome enthalten.
Imaging
Ältere Drosophila Oozyten, wie die Eizellen von den meisten Organismen sind große, einzelne Zellen. Das bedeutet, dass es eine große Menge an Zytoplasma ist, der einen einzelnen Kern enthält. Glücklicherweise ist dieser Kern auch als karyosome in Drosophila bekannt sind , können leicht identifiziert werden , da sie typischerweise nur unter die dorsale Anhängseln Nähe des Kortex befindet. Die Rückenanhänge werden zusammen mit den Oozyten Membranen entfernt, aber die noch karyosome kann durch Auffinden der kleinen divot in der Eizelle Kortex befinden, wo die Ansätze once waren. Die besten Bilder werden aus Eizellen gewonnen, die das Deckglas mit Blick auf, da dies stellt die karyosome am nächsten zum Ziel mit diesem Divot montiert wurden. Obwohl es möglich sein kann, die Eizellen in dieser Ausrichtung vor der Montage zu ordnen, ziehen wir viele Eizellen zufällig zu montieren und dann die Folie für die in der bevorzugten Orientierung suchen.
Zukünftige Anwendungen
In der Zukunft wird es wichtig sein, Marker zu identifizieren, die zuverlässig Prometaphase I und Metaphase I Spindeln unterscheiden. Die Möglichkeit, zuverlässiger die Eizellen Phase wird die Abhängigkeit von arbeitsintensiver Alternativen, wie zum Beispiel die Abbildung einer großen Anzahl von Phase angereicherten Eizellen oder die Live-Darstellung reduzieren, was auch seine Inszenierung Probleme hat. Diese Methode ist eine grundlegende Methode , die verwendet werden , können die Vorteile der Fortschritte in der Drosophila Genetik zu nehmen als neue Werkzeuge zur Verfügung stehen zu modifizieren oder Genprodukte knock out. Dazu gehören Methodendirekt Proteinaktivität mit neuen Medikamenten oder gezielte Abbau Strategien zielen. Darüber hinaus sind diese Verfahren nicht beschränkt meiotischen Spindeln Bildgebung. Jede Struktur innerhalb der Oozyte wie das Aktin-Zytoskelett konnte mit diesen Methoden analysiert werden.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
We thank Christian Lehner for providing the CENP-C antibody and Eric Joyce for recommendations on FISH. Work in the McKim lab was funded by a grant from NIH (GM101955).
Materialien
| Name | Company | Catalog Number | Comments |
| 15 ml conical tubes | Various | ||
| 16% formaldehyde | Ted Pella, Inc. | 18505 | HAZARDOUS; once opened, discard after one month |
| 250 ml beakers | Various | ||
| 5 ml tubes | Various | ||
| active dry yeast | Various | mix with water to make a paste the consistency of peanut butter | |
| anti-α-tubulin antibody conjugated to FITC | Sigma | F2168 | clone DM1A |
| Binucleine 2 | Sigma | B1186 | HAZARDOUS |
| blender | Various | ||
| bovine serum albumin | Sigma | A4161 | |
| calcium chloride | Various | ||
| colchicine | Sigma | C-9754 | HAZARDOUS |
| coverslips | VWR | 48366-227 | No. 1 1/2 |
| dextran sulfate | Various | ||
| DMSO | Various | ||
| EGTA | Various | ||
| ethanol | Various | ||
| forceps | Ted Pella, Inc. | 5622 | Dumont tweezers high precision grade style 5 |
| formamide | Sigma | 47670-250ML-F | |
| glass slides | VWR | 48312-003 | |
| glucose | Various | ||
| graduated 1.5 ml tubes | Various | ||
| HEPES | VWR | EM-5330 | available from several venders |
| Hoechst 33342 | Various | ||
| magnesium chloride | Various | ||
| methanol | Various | ||
| large mesh (~1,500 µm) | VWR | AA43657-NK | variety of formats and other suppliers, 12 or 14 mesh |
| small mesh (~300 µm) | Spectrum labs | 146 424 | variety of formats, e.g., 146 422 or 146 486 |
| nutator | Various | ||
| Pasteur pipets | Various | ||
| potassium acetate | Various | ||
| Cacodylic acid | Sigma | C0125 | HAZARDOUS; alternatively, sodium cacodylate may be substituted |
| potassium hydroxide | Various | ||
| sodium acetate | Various | ||
| sodium chloride | Various | ||
| sodium citrate | Various | ||
| sodium hydroxide | Various | ||
| sucrose | Various | ||
| taxol (paclitaxel) | Sigma | T1912 | HAZARDOUS |
| Triton X-100 | Fisher | PI-28314 | |
| Tween 20 | Fisher | PI-28320 | |
| vortex | Various |
Referenzen
- Bridges, C. B. Non-disjunction as proof of the chromosome theory of heredity. Genetics. 1 (1), 1-52 (1916).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Theurkauf, W. E., Hawley, R. S. Meiotic spindle assembly in Drosophila females: behavior of nonexchange chromosomes and the effects of mutations in the nod kinesin-like protein. J Cell Biol. 116 (5), 1167-1180 (1992).
- Zou, J., Hallen, M. A., Yankel, C. D., Endow, S. A. A microtubule-destabilizing kinesin motor regulates spindle length and anchoring in oocytes. J Cell Biol. 180 (3), 459-466 (2008).
- Dernburg, A. F., Sedat, J. W., Hawley, R. S. Direct evidence of a role for heterochromatin in meiotic chromosome segregation. Cell. 86 (1), 135-146 (1996).
- Gilliland, W. D., Hughes, S. F., Vietti, D. R., Hawley, R. S. Congression of achiasmate chromosomes to the metaphase plate in Drosophila melanogaster oocytes. Dev Biol. 325 (1), 122-128 (2009).
- Gilliland, W. D., et al. Hypoxia transiently sequesters mps1 and polo to collagenase-sensitive filaments in Drosophila prometaphase oocytes. PLoS One. 4 (10), e7544(2009).
- Sullivan, W., Ashburner, M., Hawley, R. S. Drosophila Protocols. , Cold Spring Harbor Laboratory Press. (2000).
- Radford, S. J., Hoang, T. L., Głuszek, A. A., Ohkura, H., McKim, K. S. Lateral and End-On Kinetochore Attachments Are Coordinated to Achieve Bi-orientation in Drosophila Oocytes. PLoS Genet. 11 (10), e1005605(2015).
- Smurnyy, Y., Toms, A. V., Hickson, G. R., Eck, M. J., Eggert, U. S. Binucleine 2, an isoform-specific inhibitor of Drosophila Aurora B kinase, provides insights into the mechanism of cytokinesis. ACS Chem Biol. 5 (11), 1015-1020 (2010).
- Mahowald, A. P., Goralski, T. J., Caulton, J. H. In vitro activation of Drosophila eggs. Dev Biol. 98 (2), 437-445 (1983).
- Page, A. W., Orr-Weaver, T. L. Activation of the meiotic divisions in Drosophila oocytes. Dev Biol. 183 (2), 195-207 (1997).
- Tavosanis, G., Llamazares, S., Goulielmos, G., Gonzalez, C. Essential role for gamma-tubulin in the acentriolar female meiotic spindle of Drosophila. EMBO J. 16 (8), 1809-1819 (1997).
- Endow, S. A., Komma, D. J. Spindle dynamics during meiosis in Drosophila oocytes. J Cell Biol. 137 (6), 1321-1336 (1997).
- Matthies, H. J., Clarkson, M., Saint, R. B., Namba, R., Hawley, R. S. Drosophila Protocols. Sullivan, W., Ashburner, M., Hawley, R. S. , Cold Spring Harbor Laboratory Press. 67-85 (2000).
- Colombié, N., et al. Dual roles of Incenp crucial to the assembly of the acentrosomal metaphase spindle in female meiosis. Development. 135 (19), 3239-3246 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten