Method Article
Técnicas de Imagen y Prometafase metafase de la meiosis I en fijo
En este artículo
Resumen
We present protocols for the collection, preparation, and imaging of mature Drosophila oocytes. These methods allow the visualization of chromosome behavior and spindle assembly and function during meiosis.
Resumen
Chromosome segregation in human oocytes is error prone, resulting in aneuploidy, which is the leading genetic cause of miscarriage and birth defects. The study of chromosome behavior in oocytes from model organisms holds much promise to uncover the molecular basis of the susceptibility of human oocytes to aneuploidy. Drosophila melanogaster is amenable to genetic manipulation, with over 100 years of research, community, and technique development. Visualizing chromosome behavior and spindle assembly in Drosophila oocytes has particular challenges, however, due primarily to the presence of membranes surrounding the oocyte that are impenetrable to antibodies. We describe here protocols for the collection, preparation, and imaging of meiosis I spindle assembly and chromosome behavior in Drosophila oocytes, which allow the molecular dissection of chromosome segregation in this important model organism.
Introducción
The study of meiosis is sometimes described as the "genetics of genetics". This is because the fundamental properties of chromosome inheritance and independent assortment are carried out through the segregation of chromosomes during gamete production. An important demonstration of the chromosome theory of inheritance came in 1916 from the work of Calvin Bridges in Drosophila melanogaster1. This and other classical genetics studies in Drosophila contributed greatly to our understanding of genetics. Cytological examination of meiotic chromosomes in Drosophila oocytes, however, has been challenging. This is primarily because immunofluorescence of late-stage Drosophila oocytes, when the spindle assembles and chromosomes are oriented for segregation, is hampered by the presence of membranes that render the oocyte impenetrable to antibodies.
Despite this challenge, Drosophila oocytes remain an attractive model for the study of chromosome behavior and spindle assembly. This is because of the powerful genetic tools available in Drosophila, but also because the oocytes arrest at metaphase I, when the chromosomes are oriented and the spindle is fully formed. This facilitates the collection and examination of large numbers of oocytes at this important stage of cell division. In addition, a simple model organism that is amenable to genetic manipulation for the study of oocyte chromosome segregation can provide an important contribution to our understanding of human reproductive health. Errors in chromosome number are the leading genetic cause of miscarriage and birth defects in humans2. A majority of these errors can be traced to the oocyte and are correlated with increasing maternal age. The average age of mothers in the U.S. has been increasing, making this a major public health concern.
We describe here methods for the cytological examination of Drosophila oocytes, including a demonstration of how to remove the oocyte membranes. These methods are modifications of protocols first described by Theurkauf and Hawley3, Zou et al.4, and Dernburg et al.5. We also include methods for the enrichment of different stages of oocytes, based on a protocol first described by Gilliland et al.6. Finally, we add instructions for the drug treatment of Drosophila oocytes. Together, these methods allow the cytological investigation of oocyte chromosome segregation and spindle assembly in Drosophila.
Protocolo
Nota: Los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario. incubadoras de temperatura controlada se utilizan para mantener las temperaturas para la cría de mosca y cruces a menos que se indique lo contrario.
1. Preparativos
- Preparar moscas.
- Prometafase enriquecido con colecciones de ovocitos.
- Claro moscas adultas jóvenes a partir de valores o transversales cultivos sanos,. botellas de edad para los dos días a 25 ° C.
NOTA: Por lo general dos botellas sanas serán suficientes, aunque más pueden ser necesarios para algunas culturas cruzadas. - Después de dos días, recoger ~ 100 a 300 mujeres (que son de 0 a 2 días de edad en este punto) de las botellas. Las hembras no tienen que ser vírgenes. Añadir una pequeña cantidad de pasta de levadura a un lado de un vial y colocar 30 hembras y 10 machos y 15 cada uno en los viales yeasted. viales de edad para los dos días a 25 ° C.
- Claro moscas adultas jóvenes a partir de valores o transversales cultivos sanos,. botellas de edad para los dos días a 25 ° C.
- Metafase-enriquecido ovocitos Colecciones.
- Recoger ~ 100 a 300 hembras de valores o cruz culturES. Añadir una pequeña cantidad de pasta de levadura a un lado de un vial y colocar cada 30 hembras (sin machos añadidos) en los viales yeasted. viales de edad para los tres a cinco días a 25 ° C.
- Prometafase enriquecido con colecciones de ovocitos.
- Preparar soluciones.
Nota: Las soluciones se pueden almacenar indefinidamente a temperatura ambiente, a menos que se indique lo contrario.- Prepárese Modificado Buffer de Robb (5x): mM HEPES 500, sacarosa 500 mM, acetato de sodio 275 mM, acetato de potasio 200 mM, glucosa 50 mM, cloruro de magnesio 6 mM, y cloruro de calcio 5 mM. Utilice 10 N 11: 8 de hidróxido de sodio: hidróxido de potasio para llevar el pH a 7,4. Esterilizar por filtración; No esterilizar en autoclave. Almacenar a -20 ° C. Descongelar según sea necesario para preparar ~ 200 ml de 1x de Robb por oocito de preparación.
- Soluciones de fijación.
- Opción # 1: Preparar la fijación de formaldehído / heptano. Preparar Fijación Buffer: solución salina tamponada con fosfato 1x (PBS) más sacarosa 150 mM. Para utilizar, hacer fresco con 687,5 l Fijación de amortiguamiento y 312,5 l 16% de formaldehídopor la preparación de los ovocitos.
PRECAUCIÓN: Use guantes durante el uso de soluciones de formaldehído en una campana de humos. Eliminar los residuos de acuerdo con las directrices institucionales. - Opción # 2: Preparar la fijación de formaldehído / cacodilato. Preparar la mezcla Fix: sacarosa 250 mM, 100 mM de acetato de potasio (pH 7,5), acetato de sodio 25 mM (pH 7,0), y EGTA 25 mM (pH 8,0). Para utilizar, hacen fresco con 400 l Fix Mix, 100 l de cacodilato de potasio (1 M, pH 7,2), y 500 l 16% de formaldehído por la preparación de los ovocitos.
PRECAUCIÓN: cacodilato de potasio contiene arsénico.
- Opción # 1: Preparar la fijación de formaldehído / heptano. Preparar Fijación Buffer: solución salina tamponada con fosfato 1x (PBS) más sacarosa 150 mM. Para utilizar, hacer fresco con 687,5 l Fijación de amortiguamiento y 312,5 l 16% de formaldehídopor la preparación de los ovocitos.
- Preparar PBS / Triton X-100: 1x PBS más 1% o 0,05% de Triton X-100. Almacenar a 4 ° C.
- Preparar PBS-Tween 20-albúmina de suero bovino (BSA) (PTB): 1x PBS, 0,5% BSA (w / v), y 0,1% de Tween-20. Puede ser almacenado a 4 ° C durante una semana.
- La hibridación in situ con fluorescencia (FISH) Soluciones.
- Preparar cloruro de sodio-20X citrato de sodio (SSC): cloruro de sodio 3 M y citrato de sodio 0,3 M.
- Preparar 2x SSC-Tween-20 (SSCT): 2x SSC más 0,1% de Tween-20. Hacer frescas, ~ 20 ml por la preparación de los ovocitos.
- Preparar soluciones de formamida: 2x SSC, 0,1% de Tween-20, además de formamida. Hacer fresca, 1 ml 20% de formamida, 0,5 ml 40% de formamida, y 2 ml 50% de formamida por prep ovocito.
PRECAUCIÓN: Use guantes durante el uso de soluciones de formamida en una campana de humos. Eliminar los residuos de acuerdo con las directrices institucionales. - Preparar la solución de hibridación: 2 x SSC, formamida al 50%, y 10% de sulfato de dextrano (w / v). Almacenar a 4 ° C.
- Las sondas FISH.
- Oligonucleótidos orden (véase la Tabla 1 para las secuencias) con la purificación por HPLC y la deseada 5 'modificación fluorescente (por ejemplo, Cy3 o Cy5). Resuspender en tampón Tris-EDTA (TE) a 50 ng / l.
NOTA: Proteja oligos de exposición a la luz en todo momento.
- Oligonucleótidos orden (véase la Tabla 1 para las secuencias) con la purificación por HPLC y la deseada 5 'modificación fluorescente (por ejemplo, Cy3 o Cy5). Resuspender en tampón Tris-EDTA (TE) a 50 ng / l.
2. Recolección de etapa tardía de Drosophila ovocitos
- Como ovocitos Drosophila con membranas intactas se pegue a plástico y vidrio, pre-recubrir el interior de un tubo de 5 ml y una pipeta Pasteur por prep ovocito con PTB.
- Anestesiar a todos ~ 100 a 300 moscas yeasted con dióxido de carbono y añadir a un mezclador que contenía ~ 100 ml 1x Buffer de Robb. Pulso tres veces (~ 1 seg cada uno). Mantener en ovocitos de Robb para <20 min para evitar la activación.
NOTA: Como alternativa, los ovocitos pueden ser a mano disecados de las hembras. La ventaja de este método es que requiere menos hembras. Sin embargo, se debe tener cuidado para limitar la exposición a dióxido de carbono a unos pocos minutos para evitar artefactos asociados con la hipoxia 7. - Se filtra a través de malla grande (~ 1.500 m) en 250 ml vaso de precipitados para eliminar grandes partes del cuerpo. Si muchos abdómenes intactos permanecen en material de malla, re-molienda usando tampón adicional de Robb, y el filtro de nuevo. Dejar reposar ~ 2 min, luego aspirar fuera de la capa superior, la eliminación de la mayor cantidad de grandes partes del cuerpo como sea posible.
- Fifiltro a través de malla pequeña (~ 300 micras) en un vaso de precipitados de 250 ml. Enjuague ovocitos restantes de cada primer vaso de precipitados utilizando adicional de Robb y recubiertos pipeta Pasteur. Dejar reposar ~ 3 min; ovocitos se asentarán. Aspirar todos, pero ~ 10 ml.
- Verter la mayor cantidad de 10 ml como se ajusta a revestida tubo de 5 ml. Dejar reposar, remover el líquido, y repetir con residuo. Enjuague oocitos restantes de vaso de precipitados utilizando adicional pipeta Pasteur de Robb y revestido. Deje asentarse en 5 ml tubo por unos 3-5 minutos.
3. Tratamientos farmacológicos (Opcional)
- Escudo un segundo tubo de 5 ml con PTB para cada preparación de los ovocitos. Añadir disolvente apropiado (control) o el medicamento a 1 ml de Robb cada uno para cada preparación de ovocitos (Tabla 2).
- ovocitos divididos en un segundo tubo recubierto de 5 ml. Dejar reposar, eliminar el líquido, y añadir 1 ml de Robb más disolvente en un tubo y 1 ml de Robb más fármaco en segundo tubo. Inclinar la cabeza para la cantidad de tiempo apropiado para el tratamiento de drogas (Tabla 2). Let asiente.
4. Fijación
- Aspirar todo el líquido e inmediatamente añadir 1 ml Fix.
- Opción # 1: El formaldehído / heptano fijación (fijación de búfer más el 5% de formaldehído).
- Fijar durante 2,5 minutos en un nutator. Añadir 1 ml de heptano y agitar 1 min. Dejar reposar ~ 1 min.
- Eliminar todo el líquido, y luego agregar 1 ml de PBS 1x. Vortex 30 seg. Dejar reposar ~ 1 min.
- Eliminar todo el líquido, y luego llenar el tubo con PBS 1x.
NOTA: Los ovocitos se pueden utilizar inmediatamente o mantenerse en el nutator durante varias horas a temperatura ambiente.
- Opción # 2: la fijación de formaldehído / cacodilato (Fix Mix Plus 8% de formaldehído y cacodilato 100 mM).
- Fijar durante 6 minutos en un nutator. Dejar reposar 2 min. Retire el líquido, y luego llenar el tubo con PBS 1x.
NOTA: Los ovocitos se pueden utilizar inmediatamente o mantenerse en el nutator durante varias horas a temperatura ambiente.
- Fijar durante 6 minutos en un nutator. Dejar reposar 2 min. Retire el líquido, y luego llenar el tubo con PBS 1x.
5. Extracción de Membranas ( "Rolling")
- Usando recubierto pipeta Pasteur, añadir ~ 500 a 1000 ovocitos a la parte esmerilado (chorro de arena) de un portaobjetos de vidrio. Retirar todas las partes del cuerpo y materiales extraños con unas pinzas. No deje que se sequen los ovocitos; añadir 1x PBS como sea necesario.
- Colocar un cubreobjetos en la parte superior de los ovocitos y suavemente ovocitos "rollo" hasta que todas las membranas se retiran (arrastrando el borde del cubreobjetos a través de los ovocitos que funciona mejor.) Controlar periódicamente el progreso bajo el microscopio, la adición de más 1x PBS como sea necesario. Tenga cuidado puesto que demasiada presión va a destruir los ovocitos.
NOTA: Por inmunofluorescencia solamente, continúe con el paso 6. Para los peces (con o sin inmunofluorescencia), continúe con el paso 7.
6. Anticuerpo La tinción de Drosophila ovocitos
- Extracción y bloqueo
- Enjuague ovocitos enrollado en un tubo cónico de 15 ml que contiene 15 ~ ml de PBS / 1% de Triton X-100. ovocitos inclinar la cabeza en esta solución durante no menos de 1,5 horas y no más de 2 horas.Este paso permite la penetración de anticuerpos.
- Deje que los ovocitos se asientan ~ 2 min. Retire el líquido junto con el mayor número de membranas como sea posible, a continuación, añadir PBS / 0,05% de Triton X-100.
NOTA: Las membranas se asentarán más lento que los ovocitos laminados. - Deje que los ovocitos se asientan ~ 2 minutos, luego retire todos menos ~ 1 ml de líquido. ovocitos de transferencia a graduaron tubo de 1,5 ml y eliminar el líquido residual. Añadir 1 ml PTB para el bloqueo y inclinar la cabeza durante 1 hora.
- La tinción de anticuerpos
- Pre-absorción de anticuerpos secundarios contra embriones.
NOTA: Este paso elimina la tinción de fondo de las interacciones de anticuerpos no específicos con proteínas de Drosophila.- Recoger y fijar embriones de Drosophila (~ 25 l) por procedimiento típico 8. Almacenar en metanol a -20 ° C.
- Eliminar el metanol a partir de embriones, añadir 800 l de metanol más 200 l de 1x PBS, y inclinar la cabeza durante 15 minutos. Retire 500 l de sobrenadante y reemplazar con 500 l de PBS 1x. Luego inclinar la cabeza durante 15 minutos. Repetir dos veces (para un total de ~ 1 hr de lavados), y luego terminar en el PTB.
NOTA: Los embriones se puede usar inmediatamente o mantenerse en el nutator para varias horas a temperatura ambiente. - Retire el líquido, se llenan de PTB a 200 l por la preparación de los ovocitos, y añadir anticuerpos secundarios marcados con fluorescencia a las diluciones apropiadas (teniendo en cuenta que el volumen final será de 300 l;. Véase el paso 7.4) titubear a 4 ° C durante la noche (preferible) o a temperatura ambiente durante 3-4 h.
NOTA: Los anticuerpos pre-absorción se utilizó en el paso 6.2.4.
NOTA: Mantener las muestras en la oscuridad tanto como sea posible una vez que los anticuerpos fluorescentes se han añadido.
- Retire el líquido a partir de ovocitos, se llenan de PTB a 300 l, y añadir anticuerpos primarios en diluciones adecuadas. Inclinar la cabeza a 4 ° C durante la noche (preferible) o a temperatura ambiente durante 3-4 h.
- Lavar los ovocitos cuatro veces durante 15 minutos cada uno con 1 ml PTB.
- retirarlíquido de ovocitos, añadir 200 l de sobrenadante a partir de embriones (pre-absorción anticuerpos secundarios). Luego llene con PTB para 300 l. Inclinar la cabeza a temperatura ambiente durante 3-4 h (preferible) o a 4 ° C durante la noche.
- Lavar los ovocitos de una vez por 15 min con 1 ml PTB, eliminar el líquido. A continuación, añadir 0,5 l Hoechst 33342 y 500 l PTB y inclinar la cabeza durante 7 minutos.
- Lavar los ovocitos dos veces durante 15 minutos cada uno con 1 ml PTB.
NOTA: Los ovocitos se pueden montar en un portaobjetos inmediatamente o se pueden almacenar en PTB a 4 ° C hasta el momento de formación de imágenes.
- Pre-absorción de anticuerpos secundarios contra embriones.
7. FISH (Continúe desde el paso 5 anterior)
- Enjuague ovocitos enrollados en un tubo cónico de 15 ml que contiene 15 ml ~ 2x ECSS. Deje que los ovocitos se asientan ~ 2 min. Deje únicamente ~ 0,5 ml de líquido junto con el mayor número posible de las membranas.
NOTA: Las membranas se asentarán más lento que los ovocitos laminados. - Transferencia de ovocitos a 0,5 ml tubo y remover el líquido remanente. Sucesivamente añadir y eliminar 500 l20%, 40%, y 50% de formamida soluciones, nutación para 10 min en cada solución.
NOTA: Los ovocitos se asentarán más lento con porcentajes más altos de formamida. - Retire el líquido, a continuación, añadir la solución de formamida 500 l 50%, y de inclinar la cabeza a 37 ° C durante 1 a 5 horas.
NOTA: El aumento de las incubaciones dan como resultado una mejor penetración de la sonda. - Retire el líquido, dejando tras de no más de ~ 100 ovocitos mu l, y añadir 36 l solución de hibridación más 2 l de sonda (50 ng / l) y 2 l de agua o 2 l de una sonda de 2 nd (Tabla 1).
- Incubar a 91 ° C durante 3 min (FISH solamente) o 80 ° C durante 20 min (FISH además de inmunofluorescencia), seguido de incubación en un baño de agua a 37 ° durante la noche.
NOTA: Estos pasos pueden llevarse a cabo en un termociclador. - No eliminar el líquido. Añadir 500 l 50% de solución de formamida y inclinar la cabeza a 37 ° C durante 1 hr.
- Dejar reposar, eliminar el líquido, añadir solución de formamida 500 l 50%, unad inclinar la cabeza a 37 ° C durante 1 hora.
- Dejar reposar, eliminar el líquido, añadir solución de formamida 500 l 20%, y de inclinar la cabeza a temperatura ambiente durante 10 min.
- Realizar tres lavados rápidos en 500 l 2x ECSS (dejar reposar, desenchufar y añadir líquido, invertir varias veces, repetir.) Dejar reposar, eliminar el líquido, a continuación, añadir 500 l PTB y inclinar la cabeza durante 4 horas.
8. tinción de anticuerpos después de FISH
- Retire el líquido a partir de ovocitos, se llenan de PTB a 300 l, y añadir 10 l de anticuerpo anti-α-tubulina conjugado con FITC. Alternativamente, otros anticuerpos se pueden utilizar, siguiendo el protocolo anteriormente. Inclinar la cabeza a temperatura ambiente durante la noche.
- Lavar los ovocitos una vez durante 15 minutos con 500 l PTB, eliminar el líquido, a continuación, añadir 0,5 l Hoechst 33342 y 500 l PTB y inclinar la cabeza durante 7 minutos.
- Lavar los ovocitos dos veces durante 15 minutos cada uno con 500 l PTB.
NOTA: Los ovocitos se pueden montar en un portaobjetos inmediatamente o se pueden almacenar en PTB a 4 ° C hasta el momento deformación de imágenes. Mantenga ovocitos en la oscuridad tanto como sea posible una vez que los anticuerpos fluorescentes se han añadido.
| Repetir Nombre | Cromosoma | Oligo Secuencia * |
| 359 | x | GGGATCGTTAGCACTGGTAATTAGCTGC |
| AACAC | 2 | AACACAACACAACACAACACAACACAACACAACACAACAC |
| dodecaedro | 3 | CCCGTACTGGTCCCGTACTCGGTCCCGTACTCGGT |
| 1,686 | 2 + 3 | AATAACATAGAATAACATAGAATAACATAG |
| AATAT | 4 (+ Y) | AATATAATATAATATAATATAATATAATAT |
| * 359 secuencia de Eric Joyce, comunicación personal, otras secuencias de Sullivan et al. 8 | ||
Tabla 1: sondas FISH para repeticiones centroméricas Drosophila.
| Droga | Solvente | de la concentración | La concentración final | Tiempo de tratamiento | Efecto |
| colchicina | etanol | 125 mM | 150 M | 10 min o 30 min | desestabilizar no cinetocoro (10 min) 9 o todos los microtúbulos (30 min) |
| paclitaxel | DMSO | 10 mM | 10 micras | 10 minutos | estabilizar micrófonorotubules |
| Binucleine 2 | DMSO | 25 mM | 25 M | 20 minutos | inhibir la quinasa Aurora B 10 |
Tabla 2: El tratamiento con medicamentos.
Resultados
Los métodos que hemos descrito aquí, dará lugar a la colección de la última etapa de ovocitos Drosophila representan tres etapas de la meiosis (Figura 1). Los ovocitos en profase se distinguen por la presencia de la envoltura nuclear, que es visible por la falta de señal de la tubulina en la región que rodea el cariosoma (Figura 1A). Prometafase es el período posterior rotura de la envuelta nuclear durante el cual los ensambles de cabezal. Durante prometaphase, el cariosoma asume una forma distintiva, llegando a ser alargada a menudo con la 4ª cromosomas, aparte de la masa principal cariosoma (Figura 1B). Prometafase concluye con la metafase, en la que los ovocitos Drosophila natural detienen hasta la ovulación. En ovocitos en metafase, la cariosoma ha retraído en una forma redonda (Figura 1C).
Se describe aquí métodos para manipular la velocidad de la puesta de huevos de las hembras de Drosophila para enriquecer en ovocitos ya sea en prometaphase o metafase. Los ovocitos procedentes de colecciones enriquecidas prometaphase-muestran con frecuencia la cariosoma alargada (figura 2A), mientras que las colecciones-metafase enriquecido o colecciones de hembras vírgenes de Drosophila, que eliminan casi por completo la puesta de huevos, muestran principalmente la ronda cariosoma (Figura 2B). Curiosamente, las colecciones enriquecidas prometaphase-también muestran típicamente mucho más robusto husillos, lo que sugiere que tanto la cariosoma y el husillo de cambio entre prometaphase y metafase en Drosophila ovocitos 9.
La Figura 3 muestra imágenes representativas de los dos protocolos descritos aquí. Los anticuerpos contra la α-tubulina (para mostrar el husillo), se utilizaron (para mostrar centrómeros) CENP-C, y INCENP (para mostrar el eje central) en ovocitos fijaron con formaldehyde / heptano (Figura 3A). Las sondas para las secuencias centroméricas repetitivas en el cromosoma 2 nd (AACAC) y 3 rd cromosoma (dodeca) fueron utilizados en los ovocitos fijadas con formaldehído / cacodilato y co-tiñeron con un anticuerpo α-tubulina de acuerdo con el protocolo FISH (Figura 3B). La sonda AACAC aparece como varios focos agrupado mientras que la sonda dodeca aparece como un solo foco por cromosoma. Los ovocitos tratados con 150 colchicina mu M durante 10 min se fijaron con formaldehído / heptano (Figura 3C). Este tratamiento elimina la mayoría de los no kinetochore-microtúbulos, lo que resulta en todos los microtúbulos en contacto con el ADN en focos centrómero marcado. Los ovocitos tratados con paclitaxel 10 M durante 10 min Mostrar microtúbulos excesivos en el citoplasma, pero poco efecto sobre los microtúbulos del huso (Figura 3D). Los ovocitos tratados con 25 mM Binucleine 2 durante 20 min para inhibir la pérdida de Aurora B quinasa espectáculo completo demicrotúbulos del huso (Figura 3E).
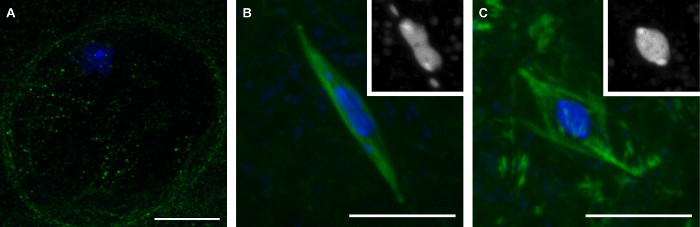
Figura 1: Tres etapas de ovocitos maduros de Drosophila:. Profase, Prometafase, y Metafase Confocal imágenes de ovocitos Drosophila en la profase (A), prometaphase (B) y metafase (C) de la meiosis I. ADN se muestra en azul y tubulina es se muestra en verde en las imágenes fusionadas. Inserciones en (B) y (C) muestran DNA en blanco. Las barras de escala = 10 micras. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 2:Prometaphase- vs. colecciones-metafase enriquecida de ovocitos Drosophila. Confocal de imágenes de ovocitos Drosophila enriquecido de prometaphase-(A) o colecciones metafase enriquecida (B). ADN se muestra en azul y tubulina se muestra en verde. Las barras de escala = 10 micras. Por favor, haga clic aquí para ver una versión más grande de esta figura.
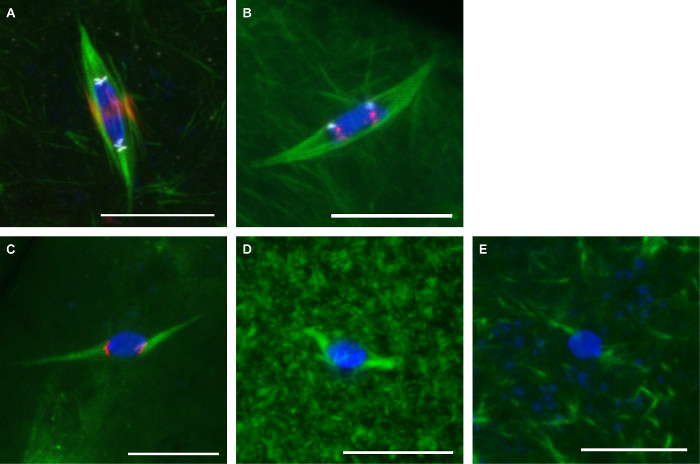
Figura 3: La tinción de anticuerpos, el pescado y los tratamientos de drogas de ovocitos Drosophila Confocal imágenes de ovocitos Drosophila con ADN en azul y verde. Tubulina en. Barras de escala = 10 m. (A) La inmunofluorescencia en Formaldehyd/ Heptano fijación e con INCENP (husillo central) en rojo y CENP-C (centrómeros) en blanco. (B) los peces en la fijación de formaldehído / cacodilato con AACAC dodecaedro se muestra en rojo y muestra en blanco. (C) El tratamiento con colchicina 150 M durante 10 min con CENP-C se muestra en rojo. El tratamiento con paclitaxel 10 M durante 10 min (D) o 25 mM Binucleine 2 durante 20 minutos (E). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Puesta en escena de Drosophila ovocitos
Aunque un cariosoma alargado se ve a menudo en los ovocitos prometaphase, utilizando cariosoma forma de distinguir a partir de ovocitos en metafase prometaphase puede ser problemático. Durante prometaphase, el cariosoma comienza como una forma redonda, se alarga, y se retira a una forma redonda como el ovocito se aproxima a la detención en metafase. Esto significa que muchos ovocitos prometaphase no tienen un cariosoma alargada. Además, si se examinan ovocitos mutantes o tratados con fármaco, cariosoma forma puede verse afectada, lo que impide el uso de este método a la etapa ovocitos. Debido a que otros marcadores para distinguir estas etapas no están actualmente disponibles, utilizamos el método descrito anteriormente para manipular la velocidad de la puesta de huevos de las hembras de Drosophila para enriquecer en ovocitos ya sea en prometaphase o metafase. La razón es que si los ovocitos pasan una cantidad específica de tiempo en prometaphase, y un período indefinido de tiempo arrEsted en la metafase, que dura hasta la puesta de huevos, a continuación, más rápida será la puesta de huevos sesgar hacia un mayor porcentaje de ovocitos prometaphase, mientras más lenta puesta de huevos enriquecerá de metafase. La cantidad de esfuerzo requerido para recoger las hembras vírgenes o recoger las hembras durante un período de tiempo más corto de 2 días, según lo descrito por Gilliland et al. 6, no es recompensado por un aumento apreciable de los ovocitos prometaphase. También es posible utilizar los apéndices dorsales a la etapa ovocitos preparados con este protocolo como apéndices dorsales se eliminan junto con las membranas. Aunque no es posible a la etapa ovocitos individuales con 100% de certeza con este método, los datos de prometaphase-enriquecido o colecciones metafase enriquecido se pueden tomar juntos para sacar conclusiones acerca de estas diferentes etapas 9.
Ovocitos Drosophila no son fertilizados hasta que pasan a través del oviducto; Por lo tanto, debido a que los ovocitos recogidos para el thprotocolos e descritos aquí examinan ovocitos tomadas antes de la puesta de huevos, estos ovocitos no han sido fertilizados. El paso a través del oviducto también hace que el ovocito para activar y reanudar la progresión del ciclo celular. Métodos para examinar las fases del ciclo celular después de la metafase 11,12 existo, pero están fuera del alcance de este protocolo.
Consideraciones de fijación Método
Se describen dos métodos diferentes para la fijación de la fase tardía de los ovocitos de Drosophila. El método de fijación de formaldehído / cacodilato fue descrita por primera vez por Theurkauf y Hawley 3 y el método de fijación de formaldehído / heptano fue descrito por primera vez por Zou et al. 4. Además, un tercer método (fijación metanol) es utilizado por algunos 13, pero no se describe aquí. La eliminación de las membranas de ovocitos es algo más difícil después de la fijación de formaldehído / heptano comparación con formaldehído / cacodilato. Esto se debe a "rodar" dependes en la fricción entre el cubreobjetos y ovocito, y formaldehído fijación / heptano hace que los ovocitos más resbaladizo. A pesar de esta dificultad añadida, nuestra primera elección del método de fijación al probar nuevos anticuerpos es el formaldehído / heptano, ya que funciona mejor para la mayoría de los anticuerpos que hemos tratado. Por otra parte, preferimos formaldehído fijación / cacodilato para peces, principalmente para la facilidad de eliminación de la membrana, aunque la fijación de formaldehído / heptano también ha tenido éxito. Ambos métodos preservar la morfología de los ovocitos mejor que la fijación de metanol, y por lo que recomendamos fijación con metanol sólo en los casos de anticuerpos que son refractarios a los métodos de fijación a base de formaldehído.
Los protocolos descritos aquí se centran en la formación de imágenes fijas, con el fin de demostrar los métodos eficaces para la prestación de ovocitos maduros de Drosophila susceptibles a la penetración de anticuerpos, es decir, a través de la eliminación de las membranas de ovocitos. Los métodos alternativos para remo membranaval (utilizando pinzas 14 o sonicación 13) son posibles; Sin embargo, nos encontramos con "rodar" para ser el método más eficiente y confiable. Las técnicas para la formación de imágenes en vivo también se han descrito en otra parte 14-16 y están fuera del alcance de este protocolo.
Recomendaciones de FISH
FISH en oocitos de Drosophila fue descrito originalmente por Dernburg et al. 5. Este protocolo fue diseñado para proporcionar las condiciones óptimas para la sonda de hibridación a los cromosomas condensados de ovocitos, pero el protocolo original no era óptima para inmunofluorescencia. El método descrito anteriormente incluye adaptaciones que hemos hecho para mejorar la tinción de anticuerpos de α-tubulina, que es principalmente lo que usamos al realizar FISH. Para otros anticuerpos, bajando la temperatura de la etapa de desnaturalización (Paso 7.5) a partir de 80 ° C puede ser necesario.
Las sondas se enumeran aquí son para elsecuencias repetitivas en la heterocromatina cerca de los centrómeros. Debido a que estas secuencias son altamente repetitivas, las sondas se hibridan a múltiples lugares y las señales colectivas son bastante fuertes. Hemos tenido poco éxito con sondas para las secuencias en la eucromatina, posiblemente debido a la estructura única de los cromosomas, mientras que figura en el cariosoma condensada.
Imaging
Ovocitos maduros de Drosophila, al igual que los oocitos de la mayoría de los organismos, son células grandes, individuales. Eso significa que hay un gran volumen de citoplasma que contiene un solo núcleo. Afortunadamente, este núcleo, también conocido como un cariosoma en Drosophila, se puede identificar fácilmente ya que normalmente se encuentra justo debajo de los apéndices dorsales cerca de la corteza. Los apéndices dorsales se eliminan junto con las membranas de ovocitos, pero el cariosoma todavía se pueden localizar mediante la búsqueda de la pequeña agujero en la corteza de los ovocitos en los apéndices ona vez que eran. Las mejores imágenes se obtienen a partir de oocitos que han sido montados con este divot frente al cubreobjetos ya que esto coloca el cariosoma más cercano al objetivo. Aunque puede ser posible disponer los ovocitos en esta orientación antes del montaje, preferimos montar muchos ovocitos al azar y después buscar la corredera para aquellos en la orientación preferida.
Las aplicaciones futuras
En el futuro será importante para identificar marcadores que distinguen de manera fiable prometaphase I ejes I y metafase. Ser capaz de organizar de forma más fiable los ovocitos se reducirá la dependencia de las alternativas más mano de obra, como las imágenes un gran número de ovocitos etapa enriquecida o imágenes en vivo, que también tiene sus problemas de puesta en escena. Este método es un método básico que se puede utilizar para tomar ventaja de los avances en la genética de Drosophila como nuevas herramientas estén disponibles para modificar o eliminar productos génicos. Esto incluye métodospara apuntar directamente la actividad de la proteína con los nuevos medicamentos o estrategias de degradación específicos. Además, estos métodos no se limitan a la formación de imágenes husos meióticos. Cualquier estructura dentro del ovocito, tales como el citoesqueleto de actina, se podría analizar el uso de estos métodos.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We thank Christian Lehner for providing the CENP-C antibody and Eric Joyce for recommendations on FISH. Work in the McKim lab was funded by a grant from NIH (GM101955).
Materiales
| Name | Company | Catalog Number | Comments |
| 15 ml conical tubes | Various | ||
| 16% formaldehyde | Ted Pella, Inc. | 18505 | HAZARDOUS; once opened, discard after one month |
| 250 ml beakers | Various | ||
| 5 ml tubes | Various | ||
| active dry yeast | Various | mix with water to make a paste the consistency of peanut butter | |
| anti-α-tubulin antibody conjugated to FITC | Sigma | F2168 | clone DM1A |
| Binucleine 2 | Sigma | B1186 | HAZARDOUS |
| blender | Various | ||
| bovine serum albumin | Sigma | A4161 | |
| calcium chloride | Various | ||
| colchicine | Sigma | C-9754 | HAZARDOUS |
| coverslips | VWR | 48366-227 | No. 1 1/2 |
| dextran sulfate | Various | ||
| DMSO | Various | ||
| EGTA | Various | ||
| ethanol | Various | ||
| forceps | Ted Pella, Inc. | 5622 | Dumont tweezers high precision grade style 5 |
| formamide | Sigma | 47670-250ML-F | |
| glass slides | VWR | 48312-003 | |
| glucose | Various | ||
| graduated 1.5 ml tubes | Various | ||
| HEPES | VWR | EM-5330 | available from several venders |
| Hoechst 33342 | Various | ||
| magnesium chloride | Various | ||
| methanol | Various | ||
| large mesh (~1,500 µm) | VWR | AA43657-NK | variety of formats and other suppliers, 12 or 14 mesh |
| small mesh (~300 µm) | Spectrum labs | 146 424 | variety of formats, e.g., 146 422 or 146 486 |
| nutator | Various | ||
| Pasteur pipets | Various | ||
| potassium acetate | Various | ||
| Cacodylic acid | Sigma | C0125 | HAZARDOUS; alternatively, sodium cacodylate may be substituted |
| potassium hydroxide | Various | ||
| sodium acetate | Various | ||
| sodium chloride | Various | ||
| sodium citrate | Various | ||
| sodium hydroxide | Various | ||
| sucrose | Various | ||
| taxol (paclitaxel) | Sigma | T1912 | HAZARDOUS |
| Triton X-100 | Fisher | PI-28314 | |
| Tween 20 | Fisher | PI-28320 | |
| vortex | Various |
Referencias
- Bridges, C. B. Non-disjunction as proof of the chromosome theory of heredity. Genetics. 1 (1), 1-52 (1916).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Theurkauf, W. E., Hawley, R. S. Meiotic spindle assembly in Drosophila females: behavior of nonexchange chromosomes and the effects of mutations in the nod kinesin-like protein. J Cell Biol. 116 (5), 1167-1180 (1992).
- Zou, J., Hallen, M. A., Yankel, C. D., Endow, S. A. A microtubule-destabilizing kinesin motor regulates spindle length and anchoring in oocytes. J Cell Biol. 180 (3), 459-466 (2008).
- Dernburg, A. F., Sedat, J. W., Hawley, R. S. Direct evidence of a role for heterochromatin in meiotic chromosome segregation. Cell. 86 (1), 135-146 (1996).
- Gilliland, W. D., Hughes, S. F., Vietti, D. R., Hawley, R. S. Congression of achiasmate chromosomes to the metaphase plate in Drosophila melanogaster oocytes. Dev Biol. 325 (1), 122-128 (2009).
- Gilliland, W. D., et al. Hypoxia transiently sequesters mps1 and polo to collagenase-sensitive filaments in Drosophila prometaphase oocytes. PLoS One. 4 (10), e7544(2009).
- Sullivan, W., Ashburner, M., Hawley, R. S. Drosophila Protocols. , Cold Spring Harbor Laboratory Press. (2000).
- Radford, S. J., Hoang, T. L., Głuszek, A. A., Ohkura, H., McKim, K. S. Lateral and End-On Kinetochore Attachments Are Coordinated to Achieve Bi-orientation in Drosophila Oocytes. PLoS Genet. 11 (10), e1005605(2015).
- Smurnyy, Y., Toms, A. V., Hickson, G. R., Eck, M. J., Eggert, U. S. Binucleine 2, an isoform-specific inhibitor of Drosophila Aurora B kinase, provides insights into the mechanism of cytokinesis. ACS Chem Biol. 5 (11), 1015-1020 (2010).
- Mahowald, A. P., Goralski, T. J., Caulton, J. H. In vitro activation of Drosophila eggs. Dev Biol. 98 (2), 437-445 (1983).
- Page, A. W., Orr-Weaver, T. L. Activation of the meiotic divisions in Drosophila oocytes. Dev Biol. 183 (2), 195-207 (1997).
- Tavosanis, G., Llamazares, S., Goulielmos, G., Gonzalez, C. Essential role for gamma-tubulin in the acentriolar female meiotic spindle of Drosophila. EMBO J. 16 (8), 1809-1819 (1997).
- Endow, S. A., Komma, D. J. Spindle dynamics during meiosis in Drosophila oocytes. J Cell Biol. 137 (6), 1321-1336 (1997).
- Matthies, H. J., Clarkson, M., Saint, R. B., Namba, R., Hawley, R. S. Drosophila Protocols. Sullivan, W., Ashburner, M., Hawley, R. S. , Cold Spring Harbor Laboratory Press. 67-85 (2000).
- Colombié, N., et al. Dual roles of Incenp crucial to the assembly of the acentrosomal metaphase spindle in female meiosis. Development. 135 (19), 3239-3246 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados