Method Article
成像前中期和减数分裂中期的我固定技术
摘要
We present protocols for the collection, preparation, and imaging of mature Drosophila oocytes. These methods allow the visualization of chromosome behavior and spindle assembly and function during meiosis.
摘要
Chromosome segregation in human oocytes is error prone, resulting in aneuploidy, which is the leading genetic cause of miscarriage and birth defects. The study of chromosome behavior in oocytes from model organisms holds much promise to uncover the molecular basis of the susceptibility of human oocytes to aneuploidy. Drosophila melanogaster is amenable to genetic manipulation, with over 100 years of research, community, and technique development. Visualizing chromosome behavior and spindle assembly in Drosophila oocytes has particular challenges, however, due primarily to the presence of membranes surrounding the oocyte that are impenetrable to antibodies. We describe here protocols for the collection, preparation, and imaging of meiosis I spindle assembly and chromosome behavior in Drosophila oocytes, which allow the molecular dissection of chromosome segregation in this important model organism.
引言
The study of meiosis is sometimes described as the "genetics of genetics". This is because the fundamental properties of chromosome inheritance and independent assortment are carried out through the segregation of chromosomes during gamete production. An important demonstration of the chromosome theory of inheritance came in 1916 from the work of Calvin Bridges in Drosophila melanogaster1. This and other classical genetics studies in Drosophila contributed greatly to our understanding of genetics. Cytological examination of meiotic chromosomes in Drosophila oocytes, however, has been challenging. This is primarily because immunofluorescence of late-stage Drosophila oocytes, when the spindle assembles and chromosomes are oriented for segregation, is hampered by the presence of membranes that render the oocyte impenetrable to antibodies.
Despite this challenge, Drosophila oocytes remain an attractive model for the study of chromosome behavior and spindle assembly. This is because of the powerful genetic tools available in Drosophila, but also because the oocytes arrest at metaphase I, when the chromosomes are oriented and the spindle is fully formed. This facilitates the collection and examination of large numbers of oocytes at this important stage of cell division. In addition, a simple model organism that is amenable to genetic manipulation for the study of oocyte chromosome segregation can provide an important contribution to our understanding of human reproductive health. Errors in chromosome number are the leading genetic cause of miscarriage and birth defects in humans2. A majority of these errors can be traced to the oocyte and are correlated with increasing maternal age. The average age of mothers in the U.S. has been increasing, making this a major public health concern.
We describe here methods for the cytological examination of Drosophila oocytes, including a demonstration of how to remove the oocyte membranes. These methods are modifications of protocols first described by Theurkauf and Hawley3, Zou et al.4, and Dernburg et al.5. We also include methods for the enrichment of different stages of oocytes, based on a protocol first described by Gilliland et al.6. Finally, we add instructions for the drug treatment of Drosophila oocytes. Together, these methods allow the cytological investigation of oocyte chromosome segregation and spindle assembly in Drosophila.
研究方案
注意:程序在室温下,除非另有说明进行。温度控制的恒温箱用于维持温度为蝇饲养和跨越除非另有说明。
1.准备
- 准备苍蝇。
- 前中期富集的卵母细胞的集合。
- 清除成年健康,年轻的股票或跨文化的苍蝇。年龄瓶在25℃两天。
注:一般两个健康的瓶子就足够了,但更多的可能需要一些交叉文化。 - 两天后,收集来自瓶〜100〜300位女性(谁在这一点上是0〜2日龄)。女性并不需要是处女。酵母膏的轻拍添加到小瓶的侧面,并放置30名女性和每次10〜15雄性成yeasted小瓶中。年龄小瓶中在25℃两天。
- 清除成年健康,年轻的股票或跨文化的苍蝇。年龄瓶在25℃两天。
- 中期富集的卵母细胞集合。
- 收集股票或跨文化性〜100〜300位女性上课。酵母膏的轻拍添加到小瓶的侧面,并放置30位女性的每个(与没有添加男性)插入yeasted小瓶中。年龄小瓶为三到五天在25℃。
- 前中期富集的卵母细胞的集合。
- 准备解决方案。
注意:溶液可无限期地在室温下保存,除非另有说明。- 制备改性罗伯的缓冲液(5×):500毫米的HEPES,500mM的蔗糖,275 mM乙酸钠,200mM的乙酸钾,50mM葡萄糖,6mM氯化镁,和5mM氯化钙。使用10 N 11:8氢氧化钠:氢氧化钾,使pH值至7.4。通过过滤消毒;不要高压。储存于-20℃。根据需要准备〜200毫升1X罗伯的每卵母细胞准备的解冻。
- 固定解决方案。
- 选项1:准备甲醛/庚烷固定。准备固定缓冲液:1×磷酸盐缓冲盐水(PBS)加150毫蔗糖。要使用,请与687.5微升固定缓冲液和312.5微升16%的甲醛清新每个卵母细胞准备。
注意事项:当在通风橱中使用甲醛溶液戴手套。根据机构指引的废弃物处理。 - 选项#2:准备甲醛/二甲胂固定。准备修复混合:250mM蔗糖,100mM乙酸钾(pH7.5)中,25 mM乙酸钠(pH 7.0),和25mM EGTA(pH 8.0)中。使用,使新鲜用400μl修复混合,加入100μl二甲胂酸钾(1M,pH7.2)中,并每卵母细胞制备500μl的16%的甲醛。
注意:二甲胂酸钾含有砷。
- 选项1:准备甲醛/庚烷固定。准备固定缓冲液:1×磷酸盐缓冲盐水(PBS)加150毫蔗糖。要使用,请与687.5微升固定缓冲液和312.5微升16%的甲醛清新每个卵母细胞准备。
- 制备PBS /的Triton X-100:1×PBS加1%或0.05%的Triton X-100。保存在4℃。
- 制备PBS-吐温20牛血清白蛋白(BSA)(PTB):1×PBS中,0.5%BSA(重量/体积)和0.1%吐温-20。可以被存储在4℃下一周。
- 荧光原位杂交(FISH)解决方案。
- 制备20X氯化钠-柠檬酸钠(SSC):3M氯化钠和0.3M的柠檬酸钠。
- 制备2×SSC-吐温20(SSCT):2×SSC加0.1%吐温-20。让每个卵母细胞准备新鲜,〜20毫升
- 制备酰胺的解决方案:2X SSC,0.1%吐温-20,加甲酰胺。使新鲜,将1ml 20%的甲酰胺加入0.5ml 40%的甲酰胺,和每卵母细胞制备2毫升50%甲酰胺。
注意事项:当在通风橱中使用甲酰胺的解决方案戴上手套。根据机构指引的废弃物处理。 - 制备杂交溶液:2×SSC,50%甲酰胺,和10%硫酸葡聚糖(重量/体积)。保存在4℃。
- FISH探针。
- 为了寡核苷酸(见序列表1)用HPLC纯化和所需的5'荧光修改( 例如 ,Cy3标记或Cy5的)。重悬在Tris-EDTA(TE),在50毫微克/微升。
注:在任何时候都曝光保护寡核苷酸。
- 为了寡核苷酸(见序列表1)用HPLC纯化和所需的5'荧光修改( 例如 ,Cy3标记或Cy5的)。重悬在Tris-EDTA(TE),在50毫微克/微升。
2.晚期果蝇卵母细胞的收集
- 如果蝇卵母细胞的膜完整会粘到塑料和玻璃,预涂层1个五毫升管和每卵母细胞制备1巴斯德吸管与PTB的内部。
- 所有的麻醉约100至300 yeasted苍蝇与二氧化碳,并添加到含有约100ml 1X罗伯的缓冲搅拌机。脉冲三次(〜每1秒)。请罗布的卵母细胞<20分钟,以避免激活。
注:另外,卵母细胞可从女性手工解剖。这种方法的优点是,它需要较少的女性。但是,必须小心,以暴露于二氧化碳限制为仅几分钟,以避免与缺氧7相关联的伪影。 - 通过大目(〜1500微米)到容量250ml的烧杯过滤器除去大的身体部位。如果许多完好的腹部仍然在使用额外的罗伯的缓冲滤网,再研磨材料,并再次。让定居〜2分钟,然后吸掉上层,删除尽可能多的大的身体部位尽可能的。
- 网络连接滤波器通过小目(〜300微米)到250ml烧杯中。冲洗剩余的卵母细胞出使用额外的罗伯的和涂层巴斯德吸管第一烧杯中。让落户〜3分钟;卵母细胞会沉淀下来。吸掉所有,但〜10毫升
- 倒尽可能多的10毫升与适合涂5毫升管。让我们平静下来,去除液体,并用剩下的重复。冲洗剩余的卵母细胞出使用额外的罗伯的和涂层巴斯德吸管烧杯中。让定居在5毫升试管〜3-5分钟。
3.药物治疗(可选)
- 大衣2个5毫升管与PTB每个卵母细胞的准备。合适的溶剂(对照)或药物添加到1ml罗布的每一个用于每个卵母细胞制备( 表2)。
- 卵母细胞分裂成第二涂层5毫升管。让我们平静下来,除去液体,加入1 ml罗伯的加溶剂到一个试管和1ml罗布的加药物进入第二管。章动的时间为药物治疗( 表2)适当的量。大号等安顿。
4.固定
- 吸掉所有的液体,并立即加入1ml修复。
- 选项1:甲醛/庚烷固定(固定缓冲液加5%甲醛)。
- 修正了一个章动器2.5分钟。加入1 ml庚烷和涡旋1分钟。让沉降〜1分钟。
- 删除所有的液体,然后再加入1 ml 1X PBS。旋涡30秒。让沉降〜1分钟。
- 删除所有的液体,然后填写管1X PBS。
注:卵母细胞可以立即使用或保存在章动器在室温下几个小时。
- 选项2:甲醛/二甲胂固定(固定混合加8%的甲醛和100毫米二甲砷酸盐)。
- 修正了一个章动器6分钟。让定居2分钟。去除液体,然后填写管1X PBS。
注:卵母细胞可以立即使用或保存在章动器在室温下几个小时。
- 修正了一个章动器6分钟。让定居2分钟。去除液体,然后填写管1X PBS。
5.去除膜("滚动")
- 使用涂覆巴斯德吸管,添加〜500〜1000的卵母细胞于载玻片的磨砂(喷砂)的一部分。删除所有身体部位和外来物质的使用镊子。不要让卵母细胞干出来的;加1×PBS中是必要的。
- 放置在卵母细胞,并轻轻"滚"卵母细胞中,直到所有的膜的顶部上的盖玻片除去(拖动盖玻片边缘穿过卵母细胞的效果最好。)定期检查显微镜下进展,根据需要加入更多的1倍PBS中。小心为过大的压力会破坏卵母细胞。
注:对于只免疫,继续步骤6鱼(有或无免疫),请继续第7步。
6. 果蝇卵母细胞的抗体染色
- 提取和阻塞
- 冲洗轧制的卵母细胞成含有约15毫升的PBS / 1%的Triton X-100的15毫升锥形管中。章动的卵母细胞在该溶液中不低于1.5小时,不超过2小时。此步骤允许抗体渗透。
- 让卵母细胞定居〜2分钟。与尽可能多的膜尽量沿去除液体,再加入PBS / 0.05%的Triton X-100。
注:膜将比推出的卵母细胞定居慢。 - 让卵母细胞定居〜2分钟,然后取出所有,但约1毫升的液体。转移卵母细胞毕业1.5mL管中,并去除残留液体。加入1ml的PTB用于阻断和章动1小时。
- 抗体染色
- 抗胚胎次级抗体的预吸收。
注:此步骤从果蝇蛋白的非特异性抗体相互作用消除了背景染色。- 收集和固定每个典型的程序8 果蝇胚胎(〜25微升)。在-20℃储存在甲醇。
- 从胚胎中除去甲醇,加入800微升甲醇加200微升1×PBS中,并且章动15分钟。除去500μl的上清液,用500μl1×PBS中替换。然后章动15分钟。重复两次(总共洗涤约1小时的),然后在PTB完成。
注:胚胎可以立即使用或保存在章动器在室温下几个小时。 - 除去液体,用PTB填充到每卵母细胞制备200微升,并在适当的稀释液添加荧光标记的二抗(牢记最终体积为300微升;参见步骤7.4)在4℃章动过夜(优选)或在室温下进行3至4小时。
注意:预吸收抗体将在步骤6.2.4使用。
注意:保持样品在黑暗中尽可能一次荧光抗体已被添加。
- 从卵母细胞除去液体,具有PTB补到300微升,并在适当的稀释液添加的主要抗体。章动于4℃过夜(优选),或在室温下搅拌3至4小时。
- 洗涤卵母细胞四次用1ml PTB每次15分钟。
- 去掉从卵母细胞的液体,从胚胎(预吸收,二次抗体)加入200μl上清液。然后用PTB填充到300微升。章动在室温下搅拌3〜4小时(优选),或在4℃下过夜。
- 15分钟洗一次卵母细胞用1毫升PTB,去除液体。然后添加0.5微升的Hoechst 33342和500μl的PTB和章动7分钟。
- 洗的卵母细胞两次,每次15分钟,用1ml PTB。
注:卵母细胞可以立即安装在滑动或可在4℃储存在PTB直至准备成像。
- 抗胚胎次级抗体的预吸收。
7. FISH(从上面的步骤5继续)
- 冲洗轧制的卵母细胞成含有〜15毫升2×SSCT 15毫升锥形管中。让卵母细胞定居〜2分钟。删除所有,但约0.5毫升的液体随着许多膜越好。
注:膜将比推出的卵母细胞定居慢。 - 卵母细胞转移到0.5毫升管和去除残留液体。先后添加和删除500微升20%,40%,和50%甲酰胺溶液,章动在每个溶液10分钟。
注:卵母细胞将落户较慢甲酰胺的比例较高。 - 除去液体,然后在37℃下加入500μl50%甲酰胺溶液,并章动进行1至5小时。
注意:长时间孵育带来更好的探头渗透。 - 去除液体,留下不超过〜100微升的卵母细胞,并加入36微升的杂交溶液加2微升探针(50毫微克/微升)和2微升的水或2微升第二探针( 表1)。
- 孵育91℃3分钟(FISH只),或80℃20分钟(FISH加免疫荧光),接着温育在37℃水浴中过夜。
注:可在热循环中执行这些步骤。 - 不要去除液体。加入500微升50%甲酰胺溶液和章动,在37℃1小时。
- 让我们平静下来,去除液体,加入500μl50%甲酰胺溶液中,在37℃下1小时ð章动。
- 让沉降,除去液体,在室温下加入500μl20%甲酰胺溶液,并章动10分钟。
- 在500微升2倍SSCT执行三个快速冲洗(让落户,取出然后加液,颠倒几次,重复。)让定居,去除液体,然后加入500μlPTB和章动4小时。
8.抗体染色后鱼
- 从卵母细胞去掉液体,具有PTB补至300微升,并加入缀合至FITC 10微升抗α微管蛋白抗体。可替代地,其它抗体,可以使用按照上述的协议。章动在室温下过夜。
- 对于用500μlPTB 15分钟洗的卵母细胞后,除去液体,再加入0.5微升的Hoechst 33342和500μl的PTB和章动7分钟。
- 与500微升PTB每次15分钟洗涤两次卵母细胞。
注:卵母细胞可以立即安装在滑动或可在4℃储存在PTB直至准备成像。保持卵母细胞在黑暗中尽可能一次荧光抗体已被添加。
| 重复名称 | 染色体 | 寡核苷酸序列* |
| 359 | X | GGGATCGTTAGCACTGGTAATTAGCTGC |
| AACAC | 2 | AACACAACACAACACAACACAACACAACACAACACAACAC |
| 十二 | 3 | CCCGTACTGGTCCCGTACTCGGTCCCGTACTCGGT |
| 1.686 | 2 + 3 | AATAACATAGAATAACATAGAATAACATAG |
| AATAT | 4(+ Y) | AATATAATATAATATAATATAATATAATAT |
| *从埃里克·乔伊斯,个人通信,沙利文等其他序列359序列。8 | ||
表1:FISH 探针果蝇 着丝粒重复。
| 药物 | 溶剂 | 股权集中度 | 最终浓度 | 治疗时间 | 影响 |
| 秋水仙碱 | 乙醇 | 125毫米 | 150μM | 10分钟或30分钟 | 破坏非着丝粒(10分钟)9或所有(30分钟)的微管 |
| 紫杉醇 | DMSO | 10毫 | 10μM | 10分钟 | 稳定话筒rotubules |
| Binucleine 2 | DMSO | 25毫米 | 25μM | 20分钟 | 抑制极光酶b激酶10 |
表2:药物治疗。
结果
将导致较减数分裂的三个阶段( 图1)的后期果蝇卵母细胞的集合中,我们在这里描述的方法。在前期的卵母细胞通过核膜的存在,这是由在karyosome( 图1A)周围区域缺乏微管蛋白信号的可见区别。前中期是核膜破裂期间,主轴组装后的时期。期间前中期,所述karyosome呈现独特的形状,成为与从主karyosome质量( 图1B)的第 4 次分开的染色体细长常。前中期总结与中期,在该果蝇卵母细胞的自然逮捕,直到排卵。在中期的卵母细胞中,karyosome已经缩回成圆形状( 图1C)。
我们在这里描述米编制方法操纵果蝇雌性产卵的速度,丰富了无论是在早中期或中期的卵母细胞。从中期样的丰富藏品的卵母细胞经常表现出细长的karyosome( 图2A),而从处女蝇女性,几乎完全消除产蛋中期富集的集合或收藏,主要展现一轮karyosome( 图2B)。有趣的是,前中期富集集合还通常显示更健壮的主轴,这表明在果蝇前中期和中期之间既karyosome和主轴改变卵母细胞9。
图3示出了从此处描述的两个协议的代表图像。针对α微管蛋白抗体(显示主轴),CENP-C(显示着丝粒),并INCENP(显示中央主轴)的卵母细胞用于固定FOrmaldehyde /庚烷( 图3A)。根据鱼协议( 图3B)的第二染色体(AACAC)和第3 次染色体(十二)上的重复着丝粒序列探针在固定有甲醛/二甲胂酸盐和卵母细胞用于共染色与α微管蛋白抗体。而十二探头显示为每个染色体的一个焦点的AACAC探头出现几个聚集焦点。用150μM的秋水仙素处理10分钟的卵母细胞用甲醛固定/庚烷( 图3C)。这种处理消除了大部分的非动粒 - 微管,这导致在着丝粒标记病灶的DNA接触所有的微管。卵母细胞与10μM的紫杉醇在细胞质中10分钟节目过度微管,但影响不大纺锤体微管( 图3D)处理。 25μMBinucleine 2处理20分钟,卵母细胞,以抑制极光酶b激酶节目完全丧失纺锤体微管( 图3E)。
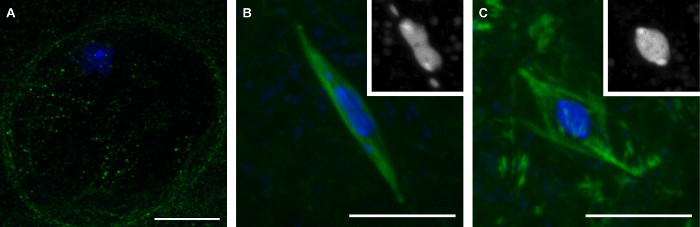
图1: 果蝇 成熟 卵母细胞 的三个阶段 :前期,前中期,中期和前期果蝇卵母细胞的共聚焦图像(A),前中期(B),和减数分裂I. DNA的中期(C)显示在蓝色和微管蛋白是在绿色的合并图像显示。在(B)和(C)的插图显示在白色的DNA。比例尺= 10微米。 请点击此处查看该图的放大版本。

图2:果蝇 卵母细胞 Prometaphase-与中期富集的集合 。早中期富集的(A) 果蝇卵母细胞的共聚焦图像或中期富集的(B)的集合。 DNA是蓝色显示,微管蛋白显示为绿色。比例尺= 10微米。 请点击此处查看该图的放大版本。
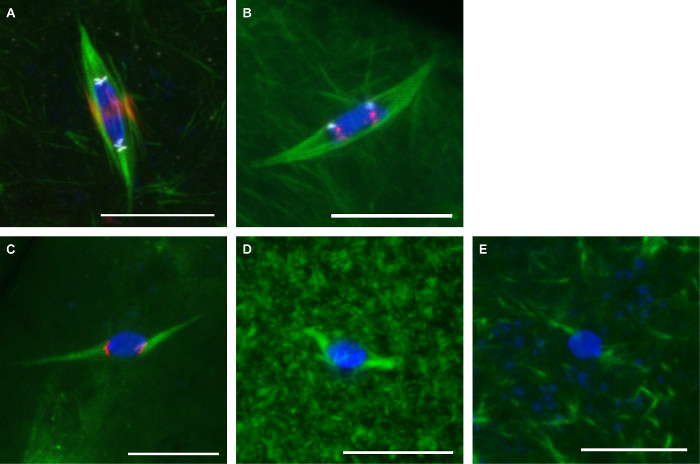
图3: 果蝇 卵母细胞 的抗体染色,鱼,和药物治疗 ,在蓝色的DNA和微管蛋白在绿色果蝇卵母细胞的共聚焦图像。比例尺= 10微米。 (A)的甲醛免疫E /庚烷固定与INCENP(中央主轴)以红色和白色CENP-C(丝粒)。在AACAC甲醛/二甲胂固定(B)FISH在显示白色和红色表示十二。 ( 三 )治疗150μM秋水仙碱与CENP-C 10分钟以红色显示。 10μM紫杉醇10分钟(D)或25μMBinucleine 2 20分钟(E)的治疗。 请点击此处查看该图的放大版本。
讨论
分期果蝇卵母细胞
虽然细长karyosome常见于前中期的卵母细胞,用karyosome形状从中期的卵母细胞前中期区分可能会有问题。期间前中期,所述karyosome开始表现为圆形,伸长,然后作为卵母细胞接近中期阻滞缩回到圆形。这意味着许多前中期的卵母细胞不具有细长karyosome。此外,如果被检查体或药物处理的卵母细胞,karyosome形状可能受到影响,使用这种方法阶段的卵母细胞排除。因为其他标记来区分这些阶段是当前不可用,我们使用上述操纵果蝇雌性产卵的速度,丰富了无论是在早中期或中期的卵母细胞的方法。理由是,如果花的卵母细胞的前中期时间的具体数额和时间的ARR无限期相关捐资在中期,这持续到产卵,然后更快速产卵将歪斜朝向前中期的卵母细胞的比例更高,而较慢的产卵将富集中期。的努力来收集的处女雌性或收集女性超过超过2天的时间较短帧,如由吉利兰等人所述。6所需的时间量,不是由前中期的卵母细胞明显增加奖励。另外,也不能使用背附属物作为背附属物与膜一起除去到阶段与此方案制备的卵母细胞。尽管这是不可能用这种方法到阶段100%的把握个人卵母细胞,从数据前中期富集或中期富集集合可以一起得出关于这些不同阶段9的结论。
果蝇卵母细胞没有受精,直到他们通过输卵管;因此,因为卵母细胞收集日这里描述Ë协议检查产蛋前拍摄的卵母细胞,卵母细胞,这些未受精。穿过输卵管也导致卵母细胞活化并恢复细胞周期进程。方法中期后,我的存在11,12,但该协议的范围之内检测细胞周期的各个阶段。
固定方法的注意事项
我们描述了晚期果蝇卵母细胞的固定两个分离的方法。甲醛/二甲胂定影方法首先由Theurkauf和霍利3和甲醛/庚烷定影方法中描述首先由4 Zou 等人描述。此外,第三种方法(甲醇固定)是由大约13个使用的,但在这里不再描述。后甲醛/庚烷定影相比甲醛/二甲胂的卵母细胞的膜的去除是较为困难的。这是因为,"滚动"依赖S于盖玻片和卵母细胞和甲醛/庚烷固定之间的摩擦,使卵母细胞更滑。尽管这样增加难度,测试新的抗体,当我们的固定方法的第一选择是甲醛/庚烷,因为它最适合我们已经尝试了广大抗体。另一方面,我们优选甲醛/二甲胂固定为FISH,主要是为便于膜除去,虽然甲醛/庚烷定影也是成功的。这两种方法都保存的卵母细胞的形态优于甲醇固定,因此,我们建议在甲醇固定仅在抗体是难治基于甲醛的固定方法的情况下。
这里描述的方案集中在固定的成像,以展示用于呈现成熟果蝇卵母细胞适合于抗体的渗透,即通过除去卵母细胞的膜的有效方法。用于膜雷莫替代方法VAL(使用镊子14或超声处理13)是可能的;然而,我们发现"滚动"是最有效和可靠的方法。实时成像技术也被其他地方描述14-16,并且是该协议的范围之内。
FISH建议
FISH在果蝇卵母细胞最初由Dernburg 等人 5说明。该协议的目的是要为探针杂交到冷凝的卵母细胞的染色体提供最佳条件,但原始协议不是最佳的免疫荧光测定。上述的方法包括:我们已提升α微管蛋白,这主要是我们所进行的FISH时使用的抗体染色适应。对于其他抗体,从80℃降低变性步骤(步骤7.5)的温度可能是必要的。
这里列出的探针是用于在着丝粒附近的异染色质重复序列。由于这些序列是高度重复,探针退火到多个地方与集体信号是相当强劲。我们曾在常染色质与探针收效甚微的序列,可能是因为染色体的独特结构,而包含在冷凝karyosome。
成像
成熟的卵母细胞果蝇一样,大多数生物的卵母细胞,大,单个细胞。这意味着,有一个大的体积细胞质包含单个核。幸运的是,此核,也被称为在果蝇一个karyosome,可以容易地识别,因为它典型地位于正下方靠近皮质背侧附属物。背附属物与卵母细胞的膜一起删除,但karyosome仍然可以通过在卵母细胞皮层发现小草皮位于那里的附属物ØNCE者。最好图像从已搭载有本草皮面向盖玻片因为这放置karyosome最接近目标的卵母细胞获得。虽然有可能在这个方向的卵母细胞中安装前安排,我们宁愿随机装入许多卵母细胞,然后搜索那些在优选的取向的幻灯片。
未来应用
在未来,重要的是要找出可靠地区分前中期我和中期我锭标记。能够更可靠地阶段的卵母细胞将减少对更多的劳动密集的替代品,如成像大量级富集的卵母细胞或实时成像,它也有其分段的问题的依赖。该方法是可用于利用在果蝇遗传学进展的新的工具可用来修改或敲除基因产物的基本方法。这包括方法直接瞄准新的药物或有针对性的退化战略蛋白的活性。此外,这些方法不限于成像减数分裂主轴。卵母细胞内的任何结构,如肌动蛋白细胞骨架,可以使用这些方法进行分析。
披露声明
The authors have nothing to disclose.
致谢
We thank Christian Lehner for providing the CENP-C antibody and Eric Joyce for recommendations on FISH. Work in the McKim lab was funded by a grant from NIH (GM101955).
材料
| Name | Company | Catalog Number | Comments |
| 15 ml conical tubes | Various | ||
| 16% formaldehyde | Ted Pella, Inc. | 18505 | HAZARDOUS; once opened, discard after one month |
| 250 ml beakers | Various | ||
| 5 ml tubes | Various | ||
| active dry yeast | Various | mix with water to make a paste the consistency of peanut butter | |
| anti-α-tubulin antibody conjugated to FITC | Sigma | F2168 | clone DM1A |
| Binucleine 2 | Sigma | B1186 | HAZARDOUS |
| blender | Various | ||
| bovine serum albumin | Sigma | A4161 | |
| calcium chloride | Various | ||
| colchicine | Sigma | C-9754 | HAZARDOUS |
| coverslips | VWR | 48366-227 | No. 1 1/2 |
| dextran sulfate | Various | ||
| DMSO | Various | ||
| EGTA | Various | ||
| ethanol | Various | ||
| forceps | Ted Pella, Inc. | 5622 | Dumont tweezers high precision grade style 5 |
| formamide | Sigma | 47670-250ML-F | |
| glass slides | VWR | 48312-003 | |
| glucose | Various | ||
| graduated 1.5 ml tubes | Various | ||
| HEPES | VWR | EM-5330 | available from several venders |
| Hoechst 33342 | Various | ||
| magnesium chloride | Various | ||
| methanol | Various | ||
| large mesh (~1,500 µm) | VWR | AA43657-NK | variety of formats and other suppliers, 12 or 14 mesh |
| small mesh (~300 µm) | Spectrum labs | 146 424 | variety of formats, e.g., 146 422 or 146 486 |
| nutator | Various | ||
| Pasteur pipets | Various | ||
| potassium acetate | Various | ||
| Cacodylic acid | Sigma | C0125 | HAZARDOUS; alternatively, sodium cacodylate may be substituted |
| potassium hydroxide | Various | ||
| sodium acetate | Various | ||
| sodium chloride | Various | ||
| sodium citrate | Various | ||
| sodium hydroxide | Various | ||
| sucrose | Various | ||
| taxol (paclitaxel) | Sigma | T1912 | HAZARDOUS |
| Triton X-100 | Fisher | PI-28314 | |
| Tween 20 | Fisher | PI-28320 | |
| vortex | Various |
参考文献
- Bridges, C. B. Non-disjunction as proof of the chromosome theory of heredity. Genetics. 1 (1), 1-52 (1916).
- Hassold, T., Hunt, P. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Theurkauf, W. E., Hawley, R. S. Meiotic spindle assembly in Drosophila females: behavior of nonexchange chromosomes and the effects of mutations in the nod kinesin-like protein. J Cell Biol. 116 (5), 1167-1180 (1992).
- Zou, J., Hallen, M. A., Yankel, C. D., Endow, S. A. A microtubule-destabilizing kinesin motor regulates spindle length and anchoring in oocytes. J Cell Biol. 180 (3), 459-466 (2008).
- Dernburg, A. F., Sedat, J. W., Hawley, R. S. Direct evidence of a role for heterochromatin in meiotic chromosome segregation. Cell. 86 (1), 135-146 (1996).
- Gilliland, W. D., Hughes, S. F., Vietti, D. R., Hawley, R. S. Congression of achiasmate chromosomes to the metaphase plate in Drosophila melanogaster oocytes. Dev Biol. 325 (1), 122-128 (2009).
- Gilliland, W. D., et al. Hypoxia transiently sequesters mps1 and polo to collagenase-sensitive filaments in Drosophila prometaphase oocytes. PLoS One. 4 (10), e7544(2009).
- Sullivan, W., Ashburner, M., Hawley, R. S. Drosophila Protocols. , Cold Spring Harbor Laboratory Press. (2000).
- Radford, S. J., Hoang, T. L., Głuszek, A. A., Ohkura, H., McKim, K. S. Lateral and End-On Kinetochore Attachments Are Coordinated to Achieve Bi-orientation in Drosophila Oocytes. PLoS Genet. 11 (10), e1005605(2015).
- Smurnyy, Y., Toms, A. V., Hickson, G. R., Eck, M. J., Eggert, U. S. Binucleine 2, an isoform-specific inhibitor of Drosophila Aurora B kinase, provides insights into the mechanism of cytokinesis. ACS Chem Biol. 5 (11), 1015-1020 (2010).
- Mahowald, A. P., Goralski, T. J., Caulton, J. H. In vitro activation of Drosophila eggs. Dev Biol. 98 (2), 437-445 (1983).
- Page, A. W., Orr-Weaver, T. L. Activation of the meiotic divisions in Drosophila oocytes. Dev Biol. 183 (2), 195-207 (1997).
- Tavosanis, G., Llamazares, S., Goulielmos, G., Gonzalez, C. Essential role for gamma-tubulin in the acentriolar female meiotic spindle of Drosophila. EMBO J. 16 (8), 1809-1819 (1997).
- Endow, S. A., Komma, D. J. Spindle dynamics during meiosis in Drosophila oocytes. J Cell Biol. 137 (6), 1321-1336 (1997).
- Matthies, H. J., Clarkson, M., Saint, R. B., Namba, R., Hawley, R. S. Drosophila Protocols. Sullivan, W., Ashburner, M., Hawley, R. S. , Cold Spring Harbor Laboratory Press. 67-85 (2000).
- Colombié, N., et al. Dual roles of Incenp crucial to the assembly of the acentrosomal metaphase spindle in female meiosis. Development. 135 (19), 3239-3246 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。