Method Article
Fare Hipokampal Doku Ex Utero Elektroporasyon ve Organotipik Dilim Kültür
Bu Makalede
Özet
Here we present a protocol providing a tool to examine regulatory mechanisms of specific genes during hippocampal development. Employing ex utero electroporation and organotypic slice culture allows the up- and down-regulation of the expression of genes of interest in single cells and follow their fate during development.
Özet
Mouse genetics offers a powerful tool determining the role of specific genes during development. Analyzing the resulting phenotypes by immunohistochemical and molecular methods provides information of potential target genes and signaling pathways. To further elucidate specific regulatory mechanisms requires a system allowing the manipulation of only a small number of cells of a specific tissue by either overexpression, ablation or re-introduction of specific genes and follow their fate during development. To achieve this ex utero electroporation of hippocampal structures, especially the dentate gyrus, followed by organotypic slice culture provides such a tool. Using this system to generate mosaic deletions allows determining whether the gene of interest regulates cell-autonomously developmental processes like progenitor cell proliferation or neuronal differentiation. Furthermore it facilitates the rescue of phenotypes by re-introducing the deleted gene or its target genes. In contrast to in utero electroporation the ex utero approach improves the rate of successfully targeting deeper layers of the brain like the dentate gyrus. Overall ex utero electroporation and organotypic slice culture provide a potent tool to study regulatory mechanisms in a semi-native environment mirroring endogenous conditions.
Giriş
hipokampus bir hafıza ve öğrenmede önemli rol yanı sıra duygusal davranış oynar. Bir ana işlevi sinir sisteminin yüksek plastisite gerektiren uzun süreli belleğe kısa süreli hafıza konsolidasyon oluşur. hipokampus dentat girus giriş bilgileri için birincil ağ geçidi gibi davranır ve yetişkinlik 1,2 genelinde de devam eden nöron iki beyin bölgelerinden biri olduğunu. Hipokampal yapının geliştirilmesi geç embriyojenez sırasında ve özellikle de ilk 3-4 hafta postnatal 3 sırasında meydana gelir. Dentate erken gelişimi sırasında kök hücre havuzu yetişkin nöron 4 yanı sıra postnatal için gerekli kurdu olan gyrus. Gelişmekte nöronlar postnatal yanı sıra yetişkin nöron sırasında olgunlaşmamış ve nihayet olgun nöron progenitör hücrelerin çeşitli aşamalardan kök hücreden, çeşitli aşamalardan geçer. Nöron ifadesi farklı aşamalarındaBelirli genler hipokampal devresi 5,6 içine olgunlaşmasını ve yeni nöronların entegrasyonu sağlamak için gereklidir.
Bu genlerin çoğunun ifade desen ve fonksiyon tanımlayan izin fare genetik ve immünohistokimyasal olarak fenotip analizinin yanı sıra moleküler yöntemler kullanılarak. Ilave mikroarray analizi gibi kromatin immunoprecipitation (ChIP) potansiyel doğrudan ve dolaylı hedef genlerin 7,8 hakkında bilgi verdi. Ancak, kıvrımlarının gelişiminde özellikle hipokampal gelişim düzenleyici mekanizmaları ile ilgili pek çok açık sorular, hala vardır. Aşağı veya yukarı-regülasyonu faiz ve / veya hedef genlerin ve gelişim sırasında kaderlerini takip geninin spesifik genlerin hücre az sayıda manipülasyon izin gerekli bir sistem nasıl düzenlendiği ileri fikir edinmek için. Utero elektroporasyon shRNAs, ilgi veya Cre recombina genlerinin cDNAse böyle bir araç sağlar. Elektroporasyon için kullanılmalıdır arzu edilen DNA ya da küçük RNA'ların sentezleme plazmidlerin varlığını sağlamak. Bu yaklaşım çok başarılı nedeniyle derin beyin tabakalarında hipokampal yapıların konumuna dentat girus gelişimini inceleyen bir daha zorlu bir yaklaşım kortikal gelişimini 9,10 okuyan uygulanan, ancak mesafesindedir.
Organotipik dilim kültür ardından Ex utero elektroporasyon bu sorunu aşmak 11,12 bir yaklaşımdır. Aksine utero elektroporasyon değil bütün embriyo ancak kafa nedenle hipokampus ve dentat girus doğru shRNA / DNA doğrudan daha uygun bir şekilde elektrotlar yerleştirmek için izin kullanılan mi. Grubumuz başarıyla dentat girus gelişimi 8 sırasında transkripsiyon faktörü Bcl11b rolünü incelemek için ex utero elektroporasyon istihdam. Bcl11b r tarafından dentat girus gelişiminde ikili bir rolü vardırimmünohistokimya ile gösterilmiş olduğu üzere, progenitör hücre çoğalması aynı zamanda farklılaşma egulating. Bundan başka, bu işlemlerde Bcl11b katılımı için bir mekanizma olarak tanımlamak için, Polleux grubunun 11,12 protokoller, protokol bölümünde aşağıda anlatıldığı gibi dentat girus çalışma ayarlanmıştır. İlk yaklaşımda soru Bcl11b özerk nöronal hücre farklılaşması hücre düzenleyen olup olmadığını ele alındı. İkinci bir yaklaşım Desmoplakin, Bcl11b doğrudan hedef gen, Bcl11b fenotip kurtarmak için yeterli olup olmadığı incelenmiştir.
Protokol
NOT: Tüm hayvan deneyleri Alman yasalarına uygun olarak yürütülmüştür ve Tübingen devlet daireleri tarafından onaylandı.
Mikropipetler, Çözümler ve Membran 1. Hazırlık
- Mikropipetler hazırlanması
- Aşağıdaki program ile bir mikropipet çektirmenin kullanarak cam mikropipetler çekin: Heat: 540, Pull: 125, Hız: 20 ve Gecikme: 140. iğne uzunluğu miktarda 5,5 cm.
- Bir microgrinder kullanılarak Konik iğneleri 4 mm, uygun bir uç boyutu elde edildi. Ipuçları zarar görmemesi için bir kutu ya da 15 cm Petri kabındaki iğneler saklayın.
- Çözümler hazırlanması
- Plazmid DNA Çözelti
- Üreticinin protokolüne göre bir Endotoksin serbest Maxi prep kiti kullanarak istenen cDNA, konstrüktünü ihtiva eden plazmid DNA hazırlanması.
- DNA (GFP başak vektör olmaksızın) 3 ug / ul nihai konsantrasyona kadar çözelti veya 4 ayarlama ug /ul endotoksinde (GFP başak vektörünün 1 ug) Hızlı Green (nihai konsantrasyon% 0.05) ihtiva eden Tris-EDTA tampon maddesi boşaltın.
- Laminin Stok çözümü
- 1 ml'lik bir son hacme kadar steril su içinde laminin, 1 mg eritin. -80 ° C'de 100 ul alikotları ve mağaza hazırlayın.
- Poli-L-Lizin Stok Çözeltisi
- 1 mg / ml'lik nihai bir konsantrasyona kadar steril su, 50 ml poli-L-lisin, 50 mg eritin. -20 ° C'de 1 ml'lik numuneler hazırlayın ve mağaza hazırlayın.
- Hank Dengeli Tuz Çözeltisi doldurun (Tam HBSS)
- CaCl2, 10 mi, 100 mM MgSO 4 10x HBSS 100 mi, 1 M HEPES tamponu, 2.5 ml (pH 7.4), 1 M, D-glikoz, 30 mi, 100 mM, 10 ml birleştirilerek tam HBSS hazırlayın ve 4 1 ml M NaHCO 3. 4 ° C'de 1 L ve saklamak için steril su ekleyin.
NOT: Otoklav tüm çözümler 1 M HEPES tampon bekliyoruz ve 1 M D-glikoz, fil vardırter sterilize.
- CaCl2, 10 mi, 100 mM MgSO 4 10x HBSS 100 mi, 1 M HEPES tamponu, 2.5 ml (pH 7.4), 1 M, D-glikoz, 30 mi, 100 mM, 10 ml birleştirilerek tam HBSS hazırlayın ve 4 1 ml M NaHCO 3. 4 ° C'de 1 L ve saklamak için steril su ekleyin.
- Dilim Kültür Orta
- Bazal Orta Eagle 35 ml tam HBSS 12.9 mi (1.2.4), 1 M, D-glikoz, 1.35 ml, 200 mM L-glutamin, 250 ul ve 500 ul ekleyerek dilim kültür ortamı hazırlayın penisilin-streptomisin 50 ml'lik bir nihai hacim elde etmek. 4 ° C'de bir son% 5 konsantrasyon ve saklamak için at serumu ekleyin.
- Düşük bir erime noktası (SAT) Agaroz
- Agaroz yüksek güçte 1-2 dakika boyunca bir mikrodalga fırın içinde ısıtılması ve ardından tam HBSS, 50 ml (1.2.4) LMP 2 g ekleyerek% 4 LMP agaroz çözelti hazırlayın. 39 ° C - 37 ° C'deki bir su banyosu içinde, bu çözüm tutun. 4 ° C ve yeniden de çözüm saklayın.
- Paraformaldehyde Çözüm
- Bir çeker ocak içinde 1 x PBS, 100 ml paraformaldeid 4 g ekleyerek% 4 paraformaldehit (PFA) solüsyon hazırlanır. 60 ° C'ye ısıtın çözeltisi ve çözelti C olana kadar, 1 N NaOH ile bir kaç damlaemizle.
- Permeabilizasyon Çözüm
- 4 ° C'de% 0.3 Triton X-100 ve mağaza içeren 1x PBS 300 ml BSA, 9 g eritin. Uzun süreli depolama için% 10 sodyum azid ekleyin.
- Plazmid DNA Çözelti
- Membran Ek'lerin Kaplama
- 12 ml'lik bir son hacme kadar laminin stok çözeltisi (1.2.2) ve steril su içinde poli-L-lisin stok çözeltisi (1.2.3) bir alikotu bir kısım seyreltin.
- Steril su içeren her 2 ml 6 yuvalı plakalara membran geçme yerleştirin. Zarın üzerine kaplama solüsyonu 1 ml ilave edilir ve bir% 5 CO2 inkübatöründe 37 ° C'de O / N inkübe edin.
- İnkübasyondan sonra membran steril su ve kuru, 1 ml ile üç kez ekler yıkayın. Kuru 6 oyuklu bir plaka içerisinde dört hafta boyunca 4 ° C'de aynı gün ya da mağaza Kaplanmış zar, monte edilmelidir.
2. DNA Enjeksiyon ve E15.5 Elektroporasyon ve E18.5 Embriyolar
- % 5 izofluran ile doyurulmuş ve bir buharlaştıncıya bağlı bir anestezi bölmesi içine yerleştirilerek dişi fare şeklindeki bir saat anestezisi. 1 L / dakikalık bir hızda, izofluran ve oksijen sirküle. 2-4 dakika ya da fare pençeleri arasında sıkıştırarak test edildiği bilinçsiz kadar kutuya hayvan tutun.
- Embriyonik gün servikal dislokasyon (E) 15.5 18.5 veya tarafından bilinçsiz fare Euthanize. Embriyoları 13 içeren rahim inceleyin ve soğuk komple HBSS 15-20 ml içeren bir Petri kabı içine yerleştirin.
NOT: Bu noktadan itibaren, buz üzerinde embriyo ve dokuları tutmak. - Soğuk tam HBSS içeren ikinci bir Petri kabı içine uterin boynuz ve yerden her embriyo ayırmak için bir makas kullanın.
- Bir mikroskop altında, rahim kas duvarı ve ince forseps (# 55) ve bir makas kullanarak plasentayı sever. Dikkatle sarısı kesesi embriyo serbest bırakın.
- Decapitat Bonn bir makas kullanınSadece 60 ° açıyla ön ayakları üzerinde e embriyolar. Deney embriyoların genotipleme gerektiriyorsa, genomik DNA izolasyonu için bir doku numunesi (kuyruk küçük bir parça) toplar.
- Temiz ve kuru bir Petri kabı baş aktarın. Kafası 60 ° açı decapitated olmuştu Çünkü sırt tarafı yukarı yerleştirildiğinde, baş bir tarafa eğin gerekir.
- Bregmaya hemisfer yakın ortasına dikkatli bir iğne yerleştirin (Şekil 1A, B). 5-8 bakliyat uygulayarak, darbe başına 10-15 milisaniye süresince basınç 30 £ kullanarak Picospritzer III pedala basarak DNA çözüm (3 veya 4 ug / ul at) yaklaşık 2-3 ul enjekte edilir. puls süresi ve sayısı, daha fazla zaman gerektiren küçük açıklıklar iğne açıklığının çapına bağlıdır. Her darbe arasındaki aralık 1 sn tutarlar.
- Elektrotlar yerleştirerek önce EMBR kafasına tam HBSS birkaç damla uygulamakyo. "Negatif" terminali enjekte ventrikül ve embriyonun kafasının (Şekil 1C, D) kulak altına enjekte ventrikül karşı tarafında "pozitif" elektrod ile aynı tarafta kalacak şekilde elektrotlar yerleştirin. 50 V 5 bakliyat uygulayın
- E 18.5 için E 15.5 için 3 mm elektrotları ve 5 mm elektrotları kullanın.
Beyin 3. Diseksiyon
- Elektroporasyondan sonra, ince forseps bir çift yardımı ile baş deri soyulabilir. Yay makas kullanılarak kafatasının orta hat beyincik ortasında küçük bir kesi yapmak.
- Kesi içine yaylı makas yerleştirin ve sagital sütür boyunca uzunlamasına kesin. Kafatasını kalkmasına ve ince forseps kullanarak kafatası beyni ayırın. 15-20 ml soğuk komple HBSS çözeltisi içine bütün beyin aktarın.
- Bu arada,% 4 LMP agaroz dökünAyrılabilen uzak kalıp içine, bir su banyosu içinde 37-39 ° C'de tutuldu.
- Küçük kepçe spatula ile tam HBSS dışarı beyin alın ve ince doku kağıt veya Kimwipes kullanarak HBSS aşırı boşaltın.
- Agaroz içine yavaşça bütün beyin yerleştirin ve ince bir iğne ile konumunu ayarlamak. Agaroz katılaşmış ve blok (koronal bölümleri için koku ampuller kadar gelin) kesitli kadar buz üzerinde kalıp tutun.
4. Vibratome Kesit ve Dilim Kültür
- LMP agaroz blokları Trim ve 'süper tutkal' kullanarak numune aşamasına tutkal onları. Tutkal sonra kuru transfer vibratome tampon tepsiye örnek aşamasıdır ve blok çözeltisi batırılır kadar HBSS tamamlamak soğuk buz ile doldurun.
NOT: kesit önce% 70 etanol ile tüm enstrüman ve ekipman yüzeyleri sterilize edin. - Takip gibi yeni bir bıçak kullanarak 250 mikron kalınlığında vibratome bölümleri hazırlayın.
- Blok wi TrimAşağıdaki ayarları inci; Frekans - 60 Hz, genlik - 0.7 mikron, hız 16-18 mm / sn. Yavaş hızda (9 mm / sn) yukarıdaki ayarlarla istenilen doku içeren bölümleri kesin. Beyin gelen kesit başlayarak, beyin 5-7 bölümleri toplamak.
- Bükük spatula yardımı ile HBSS tamamlamak ve tüm bölümleri (Şekil 1E) tahsil edilene kadar buz üzerinde tutmak soğuk buz 5 ml içeren bir temiz 6 kuyu kültür çanak bölümleri aktarın.
- Bölümlerin yönelimleri için, zar üzerinde bölümleri yerleştirmeden önce tam HBSS 100 ul ile çapraz bir şekilde membran ıslatın.
- (Membran üzerine bölümüne itmek için forseps kullanabilir sonra forseps ile bölümün bir köşesini pick up ve spatula üzerine çekin ve) membran üzerine bükülmüş bir spatula kullanarak bölümleri aktarın. Bir zar üzerinde beş bölümden kadar yerleştirin ve (forseps kullanarak Şekil 1F düzenlemek). Birbirleri ile bölümleri üst üste etmeyin.
- Bir pipet kullanarak zarın kapalı HBSS fazlalığı alın. Burada kullanılan özel membranları ve çerçeveye bağlı olarak doku temas ancak orta kapsamadığı sağlar doku kültür plakasının içine yerleştirilir.
- Dilim kültür ortamında (1.2.5) (Şekil 1G, lH), 1.8 ml su ihtiva eden bir 6 yuvalı plaka halinde membran geçme yerleştirin. 11 DIV veya 14 DIV için% 5 CO2 ile 37 ° C 'de kültür kaplarına inkübe edin. Yarım orta (0,9 ml), her ikinci gün değiştirin.
NOT: Bu aşamada, bromodeoksiüridin gibi reaktifler ekleyerek (BrdU 10 uM nihai konsantrasyon) Etiketleme kültür zaman, ilk 20 saat boyunca ortama hücreler proliferasyon için.
İmmünofloresan Boyama Ardından Bölüm 5. Sabitleme
- Kesmek için temiz ve keskin neşter bıçağı kullanın ve yönüne bağlı olarak membranlar Döşemebölümler.
- % 4 PFA (1.2.7) 1 ml ihtiva eden bir 24 yuvalı plaka zar ile birlikte bölümleri aktarın. 15 dakika her biri için 1 x PBS ile 3 kez yıkanmasından sonra, oda sıcaklığında 1 saat boyunca bölümler inkübe edin. Hafifçe çalkalama ile 4 ° C'de permeabilizasyon çözeltisi ile bölümleri O / N inkübe edin.
- Ertesi gün, permeabilizasyon çözeltisi içinde seyreltilmiş uygun primer antikorlar ile bölümleri inkübe O / N veya yumuşak çalkalama ile 4 ° C'de 48 saat karıştırıldı.
- 1x PBS ile 15 dakika boyunca bölümleri 3 kez yıkayın ve permeabilizasyon çözeltisi içinde seyreltilmiş uygun ikincil antikorlar ile 4 ° C'de O / N inkübe edin.
- Sekonder antikor ile inkübe edildikten sonra, 10 dakika süre ile DAPI lekelemesi yoluyla, ardından 15 dakika boyunca 1 x PBS ile bir kez bölümleri yıkayın.
- 15 dakika her biri için bölümleri 1x PBS ile 3 kez yıkayın ve slaytlar mikroskop transfer. ImmunoMount ekleyin ve yavaşça bölümlerin üstüne bir lamel. 4 ° C ve se de slaytlar O / N kurulayınoje ile ark.
NOT: Her zaman 4 ° C'de slaytlar tutun.- Konfokal mikroskopi (Şekil 1I) tarafından dilim kültürleri analiz.
Sonuçlar
Transkripsiyon faktörü Bcl11b ablasyonu projenitör hücre çoğalması ve azaltılmış dentat girus boyutu ve hücre sayısı ile sonuçlanan nöronal farklılaşma kayıplarına neden olur. Ayrıca mutant nöronlar öğrenme ve bellek bozukluğu 8 neden hipokampal devresine entegre başarısız. Eski utero elektroporasyon kullanılmıştır bu süreçlerde Bcl11b düzenleyici mekanizma (lar) ile ilgili soruları cevaplamak için.
Soru hitaben Bcl11b hücre-özerk E15.5 Bcl11b flox / flox hipokamplar içine, Bcl11b mozaik silmeler bir GFP- Cre rekombinaz yapı veya tek başına GFP 11 ex utero elektroporasyon tarafından oluşturulan nöronal hücre farklılaşmasını düzenleyen Organotipik dilim kültürü kadar takip edip elektroporasyon sonra 18 gün (Şekil 2A, B; bu Şekil 8'den değiştirildi). Bcl11 olup olmadığını belirlemek içinB hücre-bağımsız imüno-lekeleme GFP hem de NeuroD tanıyan özel antikorlar kullanılarak gerçekleştirilmiştir granül hücrelerin farklılaşmasını regüle eder. NeuroD mitotik aşamaları 2b / 3 ve erken postmitotik hücreler 14 olarak ifade edilir. Bu NeuroD pozitif hücre sayısı önemli ölçüde nöronal farklılaşma 8 tutuklama gösteren Bcl11b koşullu mutantlar artar, daha önce göstermiştir. Tek başına GFP pozitif hücrelerin ve GFP / NeuroD pozitif hücrelerin sayısı NeuroD pozitif hücrelerde belirgin bir artış hücrelerin Cre rekombinaz aldığı dentat girus gözlendi kontrolü ve mutan hücrelerde farklılık ise (Şekil 2C, bu şekil değiştirilmiş 8 ila). Cre rekombinaz aldığı hücreler değil, aynı zamanda, vahşi tür hücrelerinde sadece NeuroD pozitif hücrelerini bulma dolaylı mekanizmalar nöronal hücre farklılaşmasının Bcl11b düzenlenmesinde rol oynadığını göstermiştir. Bu verilerden, ancak, additBcl11b bölgesinin uğratarak hücre otonom işlevleri göz ardı edilemez.
Daha önce, Desmoplakin Bcl11b 8 doğrudan bir hedef gen olarak belirlenmiştir. Ayrıca Desmoplakin progenitör hücre çoğalması ve keratinositler 15 farklılaşmasının düzenlenmesinde dahil olduğu gösterilmiştir. Desmoplakin tek başına ya da CMV promoterinin kontrolü altında GFP ve Desmoplakin kontrol ve Bcl11b mutan beyinleri (Şekil 3A elektroporasyona tabi tutulmuştur GFP ifade dentat girus plazmid DNA projenitör hücre çoğalması ve / veya nöronal farklılaşmasının düzenlenmesinde yer olup olmadığını göstermek için, - C; bu rakam 8 den modifiye edilmiştir). Beyin dilimleri BrdU (10 uM son konsantrasyon) varlığında, ilk 20 saat boyunca kültürlenmiştir. Elektroporasyondan sonra 11. günde de dilim kültürlerinin BrdU immunosteyn ardından tespit edildi ve BrdU pozitif hücrelerin sayısı tespit edilmiştir. Mutant Tissu'nun Bcl11bkontrol dokusuna kıyasla GFP ile elektropore E, sadece önemli ölçüde daha az BrdU pozitif hücreleri içermekteydi. (Bu rakam 8 modifiye edilmiş Şekil 3B) Bununla birlikte, GFP ve Desmoplakin eş elektroporasyon seviyesini kontrol etmek için BrdU pozitif hücrelerin sayısını kurtarıldı. Birlikte ele alındığında bu veriler, bundan başka, bir doğrudan hedef Bcl11b gen ve projenitör hücre çoğalmasının düzenlenmesinde de önemli bir rol olarak Desmoplakin teyit etmektedir.

E15.5 ex utero elektroporasyon ve organotipik dilim kültürünün Şekil 1. Set-up. (A) DNA enjeksiyonu bir yarımkürede içine. (B) DNA enjeksiyonu şematik çizimi. Elektrotlar (C) Konumlandırma. (D) şematik elektrot yerleştirme çizimi. (E) Vibratome kesit hkıvrımlarının beyin kesitlerinin andling. (F) belirli bir membran beyin bölümleri yerleştirilmesi. (Gl) parlak-alan (G) ve flöresanlı (lH, GFP) elektroporasyon sonra gün 1 'dilim kültürlerinin analizi. (I)' Konfokal görüntü 11. günde DAPI ve GFP lekelemesi kullanılarak elektroporasyon sonra. Kesikli çizgi dentat girus gösterir. Ölçek çubuğu = 100 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Eski utero elektroporasyon ve (8 değiştirilmiş) Organotipik dilim kültür ile Bcl11b Şekil 2. Mozaik silme. Kontrol vektörü pCIG2 tek başına (A) ve pCIG2- Cre con elektroporasyonu18 gün boyunca Organotipik dilim kültür ardından E15.5 dentat girus içine yapı (B). Bölümler GFP (yeşil) ve NeuroD (kırmızı) tanıyan kullanarak antikorlar ile boyama yapıldı. Konumlar Cre -recombinase ifade eden hücrelerde Bcl11b ifade kaybı göstermek için daha yüksek bir büyütmede GFP (yeşil) ve Bcl11b (kırmızı) boyama gösterir. (C), GFP ve GFP NeuroD / NeuroD pozitif hücrelerin istatistiksel analizi. Kesikli çizgiler dentat girus göstermektedir. t-testi, * p <0.005; Hata çubukları, sd; n = 5. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
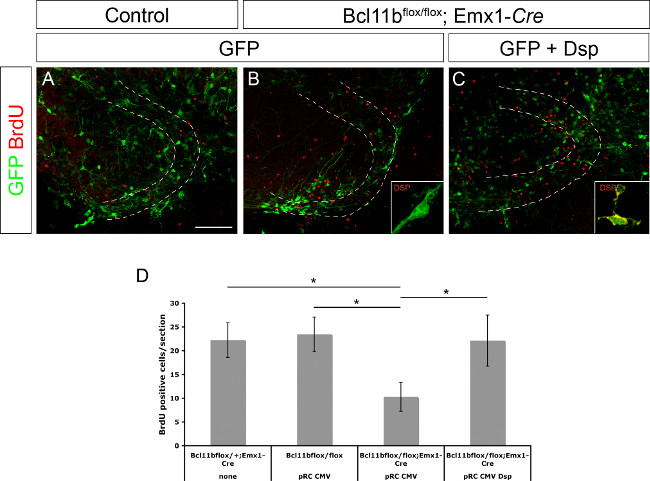
Şekil 3. Bcl11b fenotip (8 değiştirilmiş) Desmoplakin yeniden giriş tarafından kurtarılır. GFP sadece (A, B), aynı zamanda, GFP ve Desmoplakin (C), (A) kontrolü ve mutant dentat girus elektroporasyona (B, E15.5 C) beyinler 11 gün Organotipik dilim kültüre edilmesini, takiben. Bölümler GFP (yeşil) ve BrdU (kırmızı). (D) BrdU pozitif hücrelerin istatistiksel analizi tanıyan kullanılarak antikorlar ile boyama yapıldı. Kesikli çizgiler dentat girus göstermektedir. Konumlar yüksek büyütmede Desmoplakin boyama (yeşil) gösterir. t-testi, * p <0.01; hata çubuğu, sem; n = 4. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
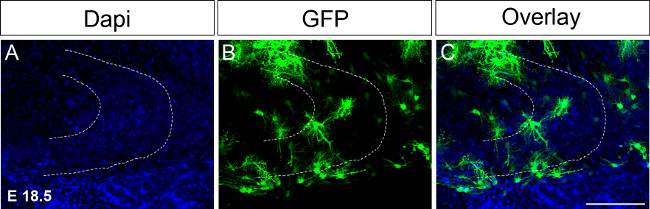
E 18.5 de Şekil 4. Ex utero elektroporasyon organotipik dilim kültürü izledi.Elektroporasyondan sonra 16. günde de imüno-boyama ile ve ardından bir yarım küreye GFP ifade eden DNA enjeksiyonu, (A) DAPI boyama;. (B) GFP boyanması, (C) bir görüntü birleşti. Kesikli çizgi dentat girus gösterir. Ölçek çubuğu = 100 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
hipokampus öğrenme ve hafızada önemli bir işleve sahiptir. dentat girus da nöron gelişimi sırasında aynı zamanda yetişkinlik boyunca sadece oluşur iki beyin bölgelerinden biridir. Doğum sonrası ve bir çok yaygın faktörleri söz konusu eden benzer bir şekilde, yetişkin hipokampal nöron ilerler. Bu faktörlerin düzenleyici mekanizmaların tanımlanması da yeni tedaviler ve önleyici tedbirlere yol açacaktır nörodejeneratif hastalıkların anlaşılmasında çok yararlı olacaktır. Bu bilgiyi edinmek için bir tek hücre manipüle ve Organotipik dilim kültürü ardından eski utero elektroporasyon gösterdiği gibi kendi doğal ortamında onları gözlemlemek için bir sistem gerektirir.
Eski utero elektroporasyon başarıyla korteks gelişiminin 11,16 okuyan ilk uygulandı. Hipokampal gelişme Bcl11b rolünü inceleyerek Bildiğimiz kadarıyla D ilk açıklayan eski utero elektroporasyon olduğunuDentate içine NA doku 8 gyrus. Biz korteks gelişiminin 11,12 okuyan Polleux grubu tarafından yayınlanan yöntemleri bizim protokol tabanlı. Başarıyla boyut ve elektrotların konumu ayarlanabilir vardı dentat girus incelemek için bu yöntemi uygulamak için. Enjeksiyon yerinde ve kulak altındaki ters yerinde pozitif elektrot yakın korteks negatif elektrot yerleştirilmesi elektroporasyon kutuplarını değiştirdi ve kıvrımlarının hücrelerin içine DNA'nın başardı. Doğru elektrotlar yerleştirerek ve mA tatmin edici elektroporasyon sonuçlar elde etmek çok önemli adımlar olduğu ortaya çıktı 0,06-0,08 bir akım uygulayarak. Yukarıda açıklandığı gibi en uygun akım elektrotları doğru yerleştirme esas bağlıdır edinin. Protokolün Ek kritik adımlar ventrikül içine malzeme enjekte yanı sıra vibratome kesit sonra dilimleri kullanımı vardır. Beyin dokusu tüm işlem boyunca sabit değildir veekimi için membran üzerine vibratome gelen aktarırken, bu nedenle doku çok yumuşak ve kolay tahrip olduğunu. Bölümler de immün başlatırken büyük bir özenle ele alınması gerekir. Bu değişiklikler ve kıvrımlarının tek hücre hususlar manipülasyonlar başarıyla erken hipokampus geliştirme Bcl11b düzenlenmesine ilişkin soruları (; bu rakamlar 8 değiştirilmiş olan Şekil 2 ve 3) yanıtlayan gerçekleştirilir edildi.
Tek hücre manipüle yukarıda bahsedilen ve gözlemlemek gibi onların kaderi eski utero elektroporasyon büyük bir avantajdır. Utero elektroporasyon ile karşılaştırıldığında ex utero yaklaşımın önemli bir dezavantajı kültüründe dilim tutmak için sınırlı zaman. Bu eski utero yetiştirme koşulları gelişiminde gecikmeye neden olabilir, aynı zamanda mümkündür. Deneylerde bugüne kadar kültür dilimleri tutmak başardık uP14 yaşına karşılık gelen p 18 gün. Bu zamanın ötesine organotipik dilim yetiştirmesi dokusunun parçalanmasına yol açar. Eski in utero yaklaşımın bir başka dezavantajı, anne başına elektroporasyona embriyoların kısıtlı olmasıdır. En fazla 8 embriyolar, bu dizi tedavi edilebilir utero elektroporasyon aksine eski uterus yaklaşım 4 embriyolar ile sınırlıdır. Embriyolar, elektroporasyon, vibratome kesit ve kültür koşullarına dilim transferi Diseksiyon başarılı dilim kültürlerinin sağlamak için, kısa bir zamanda da gerçekleştirilebilir edilmesi gerekir.
Dentat girus gelişme önemli olaylar P14 ve P30 arasında meydana Çünkü uzun süreler boyunca kültürde organotipik dilimleri tutmak için gerekli olacaktır. Kültür uzatmak için bir ilk denemede, zaman electroporations buna göre şartlarını ayarlamak E 18.5 yapıldı (Şekil 4; protokolü). Th electroporatingzaman noktası örneğin E 15.5, karşılaştırıldığında hipokampal formasyon ayrıca E 18.5 olarak geliştirilen ek olarak P17 ya da 18 kültür kadar beyin bölümleri tutmak sağlar olduğu, hipokampal yapılar zaten oluşmuş ve daha kolay tanınabilir vardır. Gelecekte biz P30 kadar dentat girus gelişimi sırasında değişiklikleri incelemek için P4, örneğin, hatta daha sonraki zaman noktalarında P0 ex utero elektroporasyon gerçekleştirmek istiyorum.
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
This work was supported by grants from the Deutsche Forschungsgemeinschaft to SB (BR-2215; SFB 497/A9).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Flaming/ Brown Micropipette Puller | Sutter Instruments Company (USA) | P-97 | |
| Fine Glass Pipettes | Warner Instruments | G100F-4 | |
| Microgrinder | Narishige, Japan | EG-44 | |
| Anesthetic Bracket unit | Harvard Apparatus | PY2 34-0412 | |
| Halovet Vaporizer | Harvard Apparatus | PY2 34-0398 | |
| Fluovac System | Harvard Apparatus | PY2 34-0387 | |
| IMS Fluosorber | Harvard Apparatus | PY2 34-0415 | |
| Anesthetizing Chamber | Harvard Apparatus | PY2 34-0460 | |
| Electroporator | BEX Company | CUY21 EDIT | |
| Tweezers with disk electrodes | BEX Company | LF650P3 | 3 mm electrodes for E15.5 |
| Tweezers with disk electrodes | BEX Company | LF650P5 | 5 mm electrodes for E18.5 |
| Picospritzer III | Parker Hannifin Corporation | P/N 052-0500-900 | |
| HM 650 V Vibrating Blade Microtome, 230 V | Thermo Scientific | 920120 | |
| Dissection Microscope | Carl Zeiss Microscopy Gmbh | Stemi SV8 | |
| Inverted Microscope | Leica | Leica DM IL LED | |
| Confocal Microscope | Leica | Sp5II | |
| 6 well dish | BD Falcon | #353502 | |
| 6 well dish | CELLSTAR | #657160 | |
| Tissue culture inserts | BD Falcon | #353090 | |
| Fast Green | Sigma | F7252 | |
| Laminin | Sigma | #L2020 | |
| Poly-L-lysine | Sigma | #P5899 | |
| Spring scissors | Fine Science Tools | 15003-08 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Forceps | Dumont #55 | 11255-20 Inox | |
| HBSS 10x | Life Technology | 14180-046 | |
| BME | Life Technology | 41010-26 |
Referanslar
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends Neurosci. 27, 447-452 (2004).
- Frotscher, M., Zhao, S., Forster, E. Development of cell and fiber layers in the dentate gyrus. Prog Brain Res. 163, 133-142 (2007).
- Muramatsu, R., Ikegaya, Y., Matsuki, N., Koyama, R. Neonatally born granule cells numerically dominate adult mice dentate gyrus. Neuroscience. 148, 593-598 (2007).
- Li, G., Pleasure, S. J. Morphogenesis of the dentate gyrus: what we are learning from mouse mutants. Dev Neurosci. 27, 93-99 (2005).
- Hsieh, J. Orchestrating transcriptional control of adult neurogenesis. Genes Dev. 26, 1010-1021 (2012).
- Li, G., Pleasure, S. J. Genetic regulation of dentate gyrus morphogenesis. Prog Brain Res. 163, 143-152 (2007).
- Collas, P. The current state of chromatin immunoprecipitation. Mol Biotechnol. 45, 87-100 (2010).
- Simon, R., et al. A dual function of Bcl11b/Ctip2 in hippocampal neurogenesis. Embo J. 31, 2922-2936 (2012).
- Pilaz, L. J., Silver, D. L. Live imaging of mitosis in the developing mouse embryonic cortex. J Vis Exp. (88), (2014).
- Pacary, E., et al. Visualization and genetic manipulation of dendrites and spines in the mouse cerebral cortex and hippocampus using in utero electroporation. J Vis Exp. (65), (2012).
- Hand, R., et al. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-62 (2005).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal development. Sci STKE. (136), 19 (2002).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. J Vis Exp. (2), (2007).
- Sugiyama, T., Osumi, N., Katsuyama, Y. The germinal matrices in the developing dentate gyrus are composed of neuronal progenitors at distinct differentiation stages. Dev Dyn. 242, 1442-1453 (2013).
- Lechler, T., Fuchs, E. Desmoplakin: an unexpected regulator of microtubule organization in the epidermis. J Cell Biol. 176, 147-154 (2007).
- Nichols, A. J., O'Dell, R. S., Powrozek, T. A., Olson, E. C. Ex utero electroporation and whole hemisphere explants: a simple experimental method for studies of early cortical development. J Vis Exp. (74), (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır