Method Article
Ex utero elettroporazione e Organotipica Fetta Cultura del mouse ippocampale Tissue
In questo articolo
Riepilogo
Here we present a protocol providing a tool to examine regulatory mechanisms of specific genes during hippocampal development. Employing ex utero electroporation and organotypic slice culture allows the up- and down-regulation of the expression of genes of interest in single cells and follow their fate during development.
Abstract
Mouse genetics offers a powerful tool determining the role of specific genes during development. Analyzing the resulting phenotypes by immunohistochemical and molecular methods provides information of potential target genes and signaling pathways. To further elucidate specific regulatory mechanisms requires a system allowing the manipulation of only a small number of cells of a specific tissue by either overexpression, ablation or re-introduction of specific genes and follow their fate during development. To achieve this ex utero electroporation of hippocampal structures, especially the dentate gyrus, followed by organotypic slice culture provides such a tool. Using this system to generate mosaic deletions allows determining whether the gene of interest regulates cell-autonomously developmental processes like progenitor cell proliferation or neuronal differentiation. Furthermore it facilitates the rescue of phenotypes by re-introducing the deleted gene or its target genes. In contrast to in utero electroporation the ex utero approach improves the rate of successfully targeting deeper layers of the brain like the dentate gyrus. Overall ex utero electroporation and organotypic slice culture provide a potent tool to study regulatory mechanisms in a semi-native environment mirroring endogenous conditions.
Introduzione
L'ippocampo gioca un ruolo importante nella memoria e dell'apprendimento e comportamento emotivo. Una funzione principale consiste consolidamento della memoria a breve termine in memoria a lungo termine, che richiede alta plasticità del sistema nervoso. Il giro dentato dell'ippocampo agisce come gateway principale per le informazioni in ingresso ed è anche una delle due regioni cerebrali con la neurogenesi in corso in tutta l'età adulta 1,2. Lo sviluppo della struttura dell'ippocampo si verifica durante l'embriogenesi tardiva e in particolare durante la prima 3 a 4 settimane postnatale 3. Durante lo sviluppo iniziale del giro dentato un pool di cellule staminali è istituito a richiesta per postnatale e adulta neurogenesi 4. Neuroni in via di sviluppo passano attraverso varie fasi, dalla cellule staminali attraverso diverse fasi di cellule progenitrici per la immatura e, infine, il neurone maturo durante postnatale e neurogenesi adulta. Alle diverse fasi della neurogenesi l'espressione digeni specifici è necessario per consentire la maturazione e l'integrazione dei nuovi neuroni nei circuiti dell'ippocampo 5,6.
Utilizzando genetica del topo e analisi fenotipo mediante immunoistochimica e metodi molecolari consentiti definire il pattern di espressione e la funzione di molti di questi geni. Inoltre l'analisi microarray e immunoprecipitazione della cromatina (ChIP) fornito informazioni sui potenziali geni bersaglio diretti e indiretti 7,8. Tuttavia, ci sono ancora molte questioni aperte riguardanti i meccanismi di regolazione dello sviluppo dell'ippocampo, in particolare lo sviluppo del giro dentato. Per ottenere una visione di come i geni specifici sono regolati è necessario un sistema che permette la manipolazione di un piccolo numero di cellule da down o up-regolazione del gene di interesse e / o dei suoi geni bersaglio e seguire il loro destino durante lo sviluppo. In utero elettroporazione di shRNAs, cDNA di geni di interesse o Cre recombinase fornisce un tale strumento. Per assicurare la presenza del DNA desiderato o piccoli RNA plasmidi di espressione dovrebbe essere utilizzato per elettroporazione. Questo approccio è implementata con successo in studio dello sviluppo corticale 9,10, ma è un approccio più impegnativo esaminando lo sviluppo del giro dentato causa della posizione delle strutture ippocampali negli strati più profondi del cervello.
Elettroporazione utero Ex seguita dalla cultura fetta organotipica è un approccio per aggirare questo problema 11,12. In contrasto in utero non elettroporazione tutta dell'embrione ma solo la testa è usato permettendo quindi di posizionare gli elettrodi in modo più favorevole per dirigere la shRNA / DNA verso l'ippocampo e giro dentato. Il nostro gruppo impiegato con successo ex utero elettroporazione per studiare il ruolo del fattore di trascrizione Bcl11b durante lo sviluppo giro dentato 8. Bcl11b ha un duplice ruolo in sviluppo giro dentato per regulating proliferazione delle cellule progenitrici nonché la differenziazione come è stato dimostrato da immunoistochimica. Per definire ulteriormente un meccanismo di coinvolgimento Bcl11b in questi processi, protocolli del gruppo Polleux 11,12 sono stati adeguati per studiare giro dentato come descritto di seguito nella sezione del protocollo. In un primo approccio alla questione è stata affrontata se Bcl11b regolamenta autonomamente cellule differenziamento delle cellule neuronali. Un secondo approccio esaminato se desmoplakin, un gene bersaglio diretto di Bcl11b, è sufficiente per salvare il fenotipo Bcl11b.
Protocollo
NOTA: Tutti gli esperimenti sugli animali sono stati eseguiti in conformità con la legge tedesca e sono stati approvati dagli uffici governativi di Tübingen.
1. Preparazione di Micropipette, soluzioni e membrane
- Preparazione di Micropipette
- Tirare micropipette di vetro con un estrattore micropipetta con il seguente programma: Heat: 540, Pull: 125, Velocità: 20 e Delay: 140. Gli importi lunghezza dell'ago a 5,5 centimetri.
- Aghi conici con un Micromacinatore per ottenere un formato di punta adeguata di 4 mm. Conservare gli aghi in una scatola o 15 centimetri piastra di Petri per evitare di danneggiare le punte.
- Preparazione delle soluzioni
- Soluzione DNA plasmidico
- Preparare DNA plasmide contenente il costrutto cDNA desiderato utilizzando un kit Maxi-prep gratuito Endotoxin secondo il protocollo del produttore.
- Regolare soluzione plasmide DNA per una concentrazione finale di 3 mg / mL (senza GFP spike vettoriale) o 4 mg /pl (con 1 mg di GFP picco vettore) in endotossine liberare tampone Tris-EDTA contenente verde veloce (concentrazione finale 0,05%).
- Soluzione laminina Archivio
- Sciogliere 1 mg di laminina in acqua sterile fino ad un volume finale di 1 ml. Preparare aliquote di 100 microlitri e conservare a -80 ° C.
- Poly-L-lisina soluzione Stock
- Sciogliere 50 mg di poli-L-lisina in 50 ml di acqua sterile ad una concentrazione finale di 1 mg / ml. Preparare 1 ml aliquote e conservare a -20 ° C.
- Completa soluzione salina bilanciata di Hank (HBSS Complete)
- Preparare Complete HBSS combinando 100 ml di 10x HBSS, 2,5 ml di buffer di 1 M HEPES (pH 7.4), 30 ml di 1 M D-glucosio, 10 ml di 100 mM CaCl 2, 10 ml di 100 mm MgSO 4, e 4 ml di 1 M NaHCO 3. Aggiungere acqua sterile fino a 1 L e conservare a 4 ° C.
NOTA: Autoclave tutte le soluzioni tampone aspettarsi 1 M HEPES e 1 M D-glucosio, che sono filter sterilizzato.
- Preparare Complete HBSS combinando 100 ml di 10x HBSS, 2,5 ml di buffer di 1 M HEPES (pH 7.4), 30 ml di 1 M D-glucosio, 10 ml di 100 mM CaCl 2, 10 ml di 100 mm MgSO 4, e 4 ml di 1 M NaHCO 3. Aggiungere acqua sterile fino a 1 L e conservare a 4 ° C.
- Fetta Cultura Media
- Preparare fetta mezzo di coltura con l'aggiunta di 35 ml di basale medio Aquila, 12,9 ml di completo HBSS (1.2.4), 1,35 ml di 1 M D-glucosio, 250 ml di 200 mM L-glutammina, e 500 ml di penicillina streptomicina per ottenere un volume finale di 50 ml. Aggiungi siero di cavallo a una concentrazione finale di 5% e conservare a 4 ° C.
- Low-Punto di fusione (LMP) Agarose
- Preparare una soluzione di agarosio al 4% LMP aggiungendo 2 g di agarosio LMP a 50 ml di HBSS completa (1.2.4) seguita da riscaldamento in un forno a microonde per 1-2 minuti ad alta potenza. Conservare la soluzione in un bagno di acqua a 37-39 ° C. Conservare la soluzione a 4 ° C e il riutilizzo.
- Paraformaldeide Solution
- In una cappa preparare una soluzione al 4% paraformaldeide (PFA) aggiungendo 4 g di paraformaldeide a 100 ml di PBS 1x. Riscaldare la soluzione a 60 ° C e aggiungere qualche goccia di NaOH 1 N fino a quando la soluzione diventa clear.
- Permeabilization Solution
- Sciogliere 9 g di BSA in 300 ml di 1x PBS contenente 0,3% Trition X-100 e conservare a 4 ° C. Aggiungere 10% di sodio azide per la conservazione a lungo termine.
- Soluzione DNA plasmidico
- Rivestimento di membrana Inserti
- Diluire un'aliquota di soluzione laminina magazzino (1.2.2) ed una aliquota della soluzione madre poli-L-lisina (1.2.3) in acqua sterile per un volume finale di 12 ml.
- Mettere inserti di membrana in 6 pozzetti con ogni ben contenente 2 ml di acqua sterile. Aggiungere 1 ml di soluzione di rivestimento sulla parte superiore della membrana e incubare O / N a 37 ° C in un incubatore CO 2 5%.
- Dopo incubazione lavare la membrana inserisce tre volte con 1 ml di acqua sterile e asciutta. Utilizzare inserti membrana rivestiti nello stesso giorno o conservare a 4 ° C per un massimo di quattro settimane in un 6 piastra ben asciutta.
2. iniezione DNA ed elettroporazione di E15.5 e E18.5 embrioni
- Anestetizzare volta accoppiato topo femmina ponendolo in una camera anestetizzante saturata con 5% isoflurano e collegato ad un vaporizzatore. Circolare isoflurano e ossigeno ad una velocità di 1 L / min. Tenere l'animale in scatola per 2-4 minuti o fino a quando inconscia che viene testato da pizzicare tra le zampe del mouse.
- Euthanize il mouse inconscio dislocazione cervicale giorno embrionale (E) 15.5 o 18.5. Sezionare l'utero contenente gli embrioni 13 e metterlo in una capsula di Petri contenente 15-20 ml di freddo completo HBSS.
NOTA: Da questo punto in poi, a mantenere gli embrioni e tessuti su ghiaccio. - Utilizzare un paio di forbici per separare ogni embrione dal corno uterino e posto in un secondo piatto di Petri contenente freddo completa HBSS.
- Sotto un microscopio da dissezione, recidere la parete muscolare dell'utero e la placenta con un paio di pinze sottili (# 55) e forbici. Staccare con cautela l'embrione dal sacco vitellino.
- Utilizzare un paio di forbici a Bonn decapitate gli embrioni appena sopra gli arti anteriori ad un angolo di 60 °. Se l'esperimento richiede genotipizzazione degli embrioni, raccogliere un campione di tessuto per l'isolamento del DNA genomico (un piccolo pezzo di coda).
- Trasferire la testa di una capsula di Petri pulita e asciutta. Perché la testa era stata decapitata in un angolo di 60 °, la testa deve inclinarsi da un lato, quando sono immessi dorsale verso l'alto.
- Inserire un ago con attenzione in mezzo dell'emisfero vicino al bregma (Figura 1A, B). Iniettare circa 2-3 microlitri (a 3 o 4 mg / mL) di soluzione di DNA dal passo sul pedale del picospritzer III utilizzando 30 libbre di pressione per la durata del 10-15 msec per impulso, applicando impulsi di 5-8. La durata e il numero degli impulsi dipende dal diametro dell'apertura dell'ago con aperture più piccole che richiedono più tempo. L'intervallo tra ogni impulso è pari a 1 sec.
- Prima di posizionare gli elettrodi, applicare alcune gocce di completo HBSS sulla testa del embryo. Posizionare gli elettrodi in modo tale che il terminale 'negativo' è sullo stesso lato come il ventricolo iniettato e l'elettrodo 'positiva' sul lato opposto del ventricolo iniettato sotto l'orecchio della testa dell'embrione (Figura 1C, D). Applicare 5 impulsi di 50 V.
- Utilizzare 3 elettrodi mm per E 15,5 e 5 elettrodi mm per E 18,5.
3. La dissezione del cervello
- Dopo l'elettroporazione, staccare la pelle dalla testa con l'aiuto di un paio di pinze sottili. Utilizzando un paio di forbici molla fare una piccola incisione nel mezzo del cervelletto alla linea mediana del cranio.
- Inserire le forbici primavera nell'incisione e tagliare longitudinalmente lungo la sutura sagittale. Staccare il cranio e staccare il cervello dal cranio, utilizzando una pinza sottile. Trasferire l'intero cervello in 15-20 ml fredda soluzione completa HBSS.
- Nel frattempo, versate 4% LMP agarosio,mantenuti a 37-39 ° C in un bagno d'acqua, in uno stampo pelabile.
- Prendete il cervello dalla completa HBSS da una piccola paletta spatola e drenare l'eccesso di HBSS utilizzando carta velina fine o Kimwipes.
- Posizionare l'intero cervello delicatamente nel agarosio e regolarne la posizione con un ago sottile. Mantenere lo stampo in ghiaccio fino al agarosio è solidificato e il blocco viene sezionato (per le sezioni coronali bulbi olfattivi punto up).
4. Vibratome Sezioni e Slice Cultura
- Tagliare i blocchi agarosio LMP e incollarli alla fase provino con 'super colla'. Dopo che la colla è secca la fase di trasferimento del campione al vassoio buffer vibratome e riempire con ghiaccio freddo completare HBSS finché il blocco viene immerso nella soluzione.
NOTA: Sterilizzare tutte le superfici degli strumenti e macchinari con il 70% di etanolo prima sezionamento. - Preparare 250 micron sezioni vibratome spesse con una nuova lama come seguito.
- Tagliare il blocco with le seguenti impostazioni; Frequenza - 60 Hz, ampiezza - 0,7 micron, velocità 16-18 mm / sec. Tagliare le sezioni contenenti il tessuto desiderato con le impostazioni di cui sopra a bassa velocità (9 mm / sec). Avvio del sezionamento del hindbrain, raccogliere 5-7 sezioni del cervello.
- Trasferire le sezioni per un piatto di cultura 6 ben pulito contenente 5 ml di ghiaccio freddo completare HBSS con l'aiuto di una spatola piegata e tenere in ghiaccio fino a tutte le sezioni sono raccolte (Figura 1E).
- Bagnare la membrana in modo incrociato con 100 ml di HBSS completa prima di sezioni sulla membrana, per facilitare l'orientamento delle sezioni.
- Trasferire le sezioni usando una spatola piegata sulla membrana (prendere un angolo della sezione con una pinza e tirare sulla spatola e poi usare il forcipe per spingere la sezione sulla membrana). Luogo fino a cinque sezioni su una membrana e di organizzare, utilizzando una pinza (Figura 1F). Non sovrapporre le sezioni tra loro.
- Prendere l'eccesso di HBSS fuori della membrana con una pipetta. Le membrane specifici utilizzati qui sono fissati ad un telaio e inserite nella piastra di coltura tissutale, che permette il tessuto di essere in contatto, ma non coperti dal mezzo.
- Posizionare gli inserti membrana in una piastra da 6 pozzetti contenenti 1,8 ml di terreno di coltura fetta (1.2.5) (Figura 1G, H). Incubare la piastra di coltura a 37 ° C con 5% di CO 2 per 11 o 14 DIV DIV. Cambiare metà del mezzo (0,9 ml) a giorni alterni.
NOTA: In questa fase, aggiungere i reagenti come Bromodeossiuridina (BrdU; 10 micron concentrazione finale) per l'etichettatura cellule proliferanti ai media per il primo 20 ore del tempo di cultura.
5. Fissazione delle Sezioni Seguito da immunofluorescenza colorazione
- Utilizzare una lama di bisturi pulito e affilato per tagliare e tagliare le membrane a seconda dell'orientamento disezioni.
- Trasferire sezioni con la membrana ad una piastra 24 pozzetti contenenti 1 ml di 4% PFA (1.2.7). Incubare le sezioni per 1 ora a RT seguito da 3 lavaggi con PBS 1x per 15 min ciascuno. Incubare sezioni O / N con la soluzione di permeabilizzazione a 4 ° C con agitazione.
- Il giorno seguente, incubare le sezioni con anticorpi primari appropriati, diluito in soluzione permeabilizzazione, O / N o per 48 ore a 4 ° C con agitazione.
- Lavare le sezioni 3 volte per 15 min con 1x PBS e incubare O / N a 4 ° C con gli opportuni anticorpi secondari diluito in soluzione permeabilizzazione.
- Dopo l'incubazione con anticorpi secondari, lavare una volta con sezioni 1x PBS per 15 minuti seguita da colorazione DAPI per 10 min.
- Lavare le sezioni 3 volte con 1x PBS per 15 minuti ciascuno e trasferire al microscopio diapositive. Aggiungere ImmunoMount e delicatamente posto un coprioggetto sopra le sezioni. Asciugare il slides O / N a 4 ° C e seal con smalto.
NOTA: Mantenere le diapositive sempre a 4 ° C.- Analizzare le culture fetta di microscopia confocale (Figura 1I).
Risultati
Ablazione del fattore di trascrizione Bcl11b causa la perdita di valore della proliferazione delle cellule progenitrici e la differenziazione neuronale con conseguente dimensioni giro dentato ridotto e il numero di cellule. Inoltre neuroni mutanti non riescono a integrarsi nel circuito dell'ippocampo causando l'apprendimento e la memoria di valore 8. Per rispondere alle domande riguardanti il meccanismo di regolazione (s) di Bcl11b in questi processi ex elettroporazione utero è stato impiegato.
Affrontare la questione se Bcl11b cellulare autonomamente regola il differenziamento delle cellule neuronali, delezioni mosaico di Bcl11b sono stati generati da ex utero elettroporazione di un ricombinasi costrutto o solo GFP 11 GFP Cre in Bcl11b flox / flox ippocampi a E15.5 seguita dalla cultura fetta organotipica up a 18 giorni dopo l'elettroporazione (Figura 2A, B, questa figura è stata modificata da 8). Per determinare se Bcl11b regola differenziazione delle cellule granulari cellule autonomamente colorazione immunofluorescenza è stata eseguita utilizzando anticorpi specifici che riconoscono NeuroD nonché GFP. NeuroD è espresso in stadi mitotici 2b / 3 e prime cellule postmitotici 14. Abbiamo dimostrato precedentemente che il numero di cellule positive NeuroD è significativamente aumentata nei mutanti condizionali Bcl11b indicano un arresto di differenziazione neuronale 8. Mentre il numero delle sole cellule GFP positive e / NeuroD cellule GFP positive non differiva in cellule di controllo e mutanti di un significativo aumento delle cellule positive NeuroD è stata osservata nel giro dentato dove le cellule avevano ricevuto Cre ricombinasi (Figura 2C, questa cifra è stata modificata da 8). Trovare cellule positive NeuroD non solo nelle cellule che avevano ricevuto Cre ricombinasi ma anche in cellule wild-type ha suggerito che i meccanismi indiretti sono coinvolti nella regolazione Bcl11b della differenziazione delle cellule neuronali. Da questi dati, tuttavia, AdditNon si possono escludere le funzioni delle cellule-autonomous ionale di Bcl11b.
In precedenza, desmoplakin stato determinato come un gene bersaglio diretto di Bcl11b 8. E 'stato anche dimostrato che desmoplakin è coinvolto nella regolazione della proliferazione delle cellule progenitrici e la differenziazione dei cheratinociti 15. Per dimostrare se desmoplakin è coinvolto nella regolazione della proliferazione delle cellule progenitrici e / o differenziazione neuronale del dentato DNA giro plasmide che esprime GFP solo o GFP e desmoplakin sotto il controllo del promotore CMV è stato elettroporate in controllo e Bcl11b cervelli mutanti (figura 3A - C, questa cifra è stata modificata da 8). Le fette di cervello sono state coltivate per la prima 20 h in presenza di BrdU (concentrazione finale 10 uM). Al giorno 11 dopo l'elettroporazione le culture fetta sono stati fissati seguiti da BrdU immunostaining e il numero di cellule positive BrdU è stata determinata. Bcl11b tissu mutantee elettroporate con GFP conteneva solo significativamente minor numero di cellule positive BrdU rispetto al tessuto di controllo. Tuttavia, co-elettroporazione di GFP e desmoplakin salvato il numero di cellule positive BrdU per controllare i livelli (Figura 3D, questa figura è stata modificata da 8). Presi insieme questi dati confermano ulteriormente desmoplakin come gene bersaglio diretto di Bcl11b e il suo ruolo nella regolazione della proliferazione delle cellule progenitrici.

Figura 1. Set-up di ex utero elettroporazione e la cultura fetta organotipica a E15.5. (A) iniezione di DNA in un emisfero. (B) Schema di iniezione DNA. (C) Posizionamento degli elettrodi. (D) Schema disegno di posizionamento degli elettrodi. (E) Vibratome sezionamento e hGe stione di sezioni di cervello. (F) Posizionamento sezioni di cervello sulle membrane specifiche. (GI) Bright-campo (G) e la fluorescenza (H, GFP) analisi delle culture fetta il giorno 1 dopo l'elettroporazione. (I) immagine confocale del giro dentato al giorno 11 dopo l'elettroporazione utilizzando DAPI e GFP colorazione. La linea tratteggiata indica giro dentato. Scala bar = 100 micron. Cliccate qui per vedere una versione più grande di questa figura.

Figura 2. Mosaico cancellazione di Bcl11b dall'ex elettroporazione utero e cultura fetta organotipica (modificato da 8). Elettroporazione di controllo vettoriale pCIG2 solo (A) e pCIG2- Cre construct (B) nel giro dentato a E15.5 seguita dalla cultura fetta organotipica per 18 giorni. Le sezioni sono state immunostained da utilizzando anticorpi che riconoscono GFP (green) e NeuroD (rosso). Inserti visualizzare GFP (green) e Bcl11b (rosso) colorazione a maggiore ingrandimento per dimostrare la perdita di espressione Bcl11b in cellule che esprimono Cre -recombinase. (C) Analisi statistica di GFP, NeuroD e / NeuroD cellule GFP positive. Le linee tratteggiate indicano giro dentato. t-test, * p <0,005; barre di errore, sd; n = 5. Cliccate qui per vedere una versione più grande di questa figura.
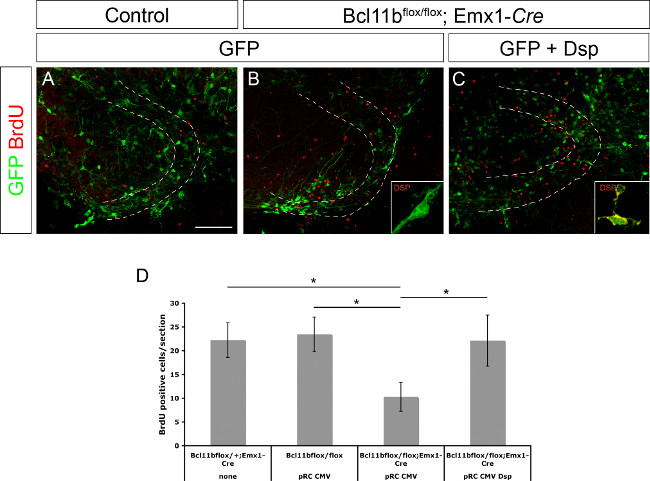
Figura 3. Bcl11b fenotipo è salvato da re-introduzione di desmoplakin (modificato da 8). Solo GFP (A, B), nonché GFP e desmoplakin (C) sono stati elettroporate nel giro dentato di controllo (A) e mutante (B, C) il cervello a E15.5 seguita dalla cultura fetta organotipica per 11 giorni. Le sezioni sono state immunostained da utilizzando anticorpi che riconoscono GFP (green) e BrdU (rosso). (D) Analisi statistica di cellule positive BrdU. Le linee tratteggiate indicano giro dentato. Inserti visualizzare desmoplakin colorazione (verde) a maggiore ingrandimento. t-test, * p <0.01; barra di errore, sem; n = 4. Cliccate qui per vedere una versione più grande di questa figura.
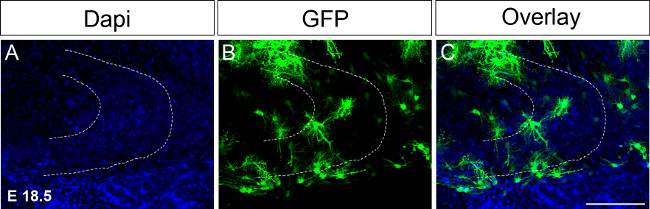
Figura 4. Ex utero elettroporazione a E 18,5 seguita dalla cultura fetta organotipica.L'iniezione di DNA che esprimono GFP in un emisfero seguito da immunocolorazione al giorno 16 dopo l'elettroporazione (A) colorazione DAPI;. (B) GFP colorazione; (C) fusa immagine. La linea tratteggiata indica giro dentato. Scala bar = 100 micron. Cliccate qui per vedere una versione più grande di questa figura.
Discussione
L'ippocampo ha una funzione importante nell'apprendimento e nella memoria. Il giro dentato è anche una delle due regioni del cervello in cui si verifica la neurogenesi non solo durante lo sviluppo, ma anche in età adulta. Postnatale e adulti procede neurogenesi dell'ippocampo in modo simile che coinvolge molti fattori comuni. Definizione dei meccanismi regolatori di questi fattori sarà molto utile per capire le malattie neurodegenerative che a sua volta portare a nuove terapie e misure preventive. Per ottenere queste informazioni si richiede un sistema per manipolare le cellule singole e osservarli nel loro ambiente nativo come dimostrato dalla elettroporazione ex utero seguita dalla cultura fetta organotipica.
Ex utero elettroporazione è stato applicato con successo in studio dello sviluppo della corteccia 11,16. A nostra conoscenza esaminando il ruolo di Bcl11b in sviluppo dell'ippocampo è la prima che descrive ex utero elettroporazione di DNA in giro dentato tessuti 8. Abbiamo basato il nostro protocollo sui metodi pubblicati dal gruppo di studio dello sviluppo della corteccia Polleux 11,12. Per applicare con successo questo metodo per studiare giro dentato le dimensioni e la posizione degli elettrodi dovevano essere regolato. Posizionando l'elettrodo negativo corteccia vicino al sito di iniezione e l'elettrodo positivo al lato opposto sotto l'orecchio cambiato la polarità della elettroporazione e riuscirono a introdurre DNA in cellule del giro dentato. Posizionamento degli elettrodi correttamente e applicando una corrente di 0,06-0,08 mA rivelato essere passi molto importanti per ottenere risultati soddisfacenti elettroporazione. Per ottenere la corrente più adeguata dipende principalmente dal corretto posizionamento degli elettrodi come descritto sopra. Ulteriori passaggi critici del protocollo stanno iniettando il materiale nel ventricolo e gestire le fette dopo vibratome sezionamento. Il tessuto cerebrale non è fisso durante l'intera procedura equindi il tessuto è molto morbido e facilmente distruttibili durante il trasferimento dal vibratome sulla membrana per la coltivazione. Le sezioni devono anche essere trattati con grande cura quando si avvia il immunocolorazione. Con queste modifiche e considerazioni manipolazioni di cellule singole di giro dentato sono stati correttamente effettuati sulla risposta alle domande relative regolamentazione Bcl11b dello sviluppo dell'ippocampo precoce (Figura 2 e 3; questi dati sono stati modificati da 8).
Come accennato in precedenza manipolare cellule singole e osservare loro destino è il principale vantaggio di ex elettroporazione utero. Un grave inconveniente dell'approccio ex utero in confronto con in utero elettroporazione è il tempo limitato per mantenere fette in coltura. E 'anche possibile che le condizioni di coltura ex utero potrebbero causare un ritardo nello sviluppo. Nei nostri esperimenti finora siamo stati in grado di tenere le fette nella cultura up a 18 giorni che corrisponde all'età di P14. Coltivazione di fette organotipiche oltre tale termine portare alla disintegrazione del tessuto. Un ulteriore svantaggio dell'approccio ex utero è il numero limitato di embrioni che possono essere elettroporate per madre. A differenza di elettroporazione in utero dove fino a 8 embrioni possono essere trattati questo numero è limitato a 4 embrioni nell'approccio ex utero. Dissezione degli embrioni, elettroporazione, vibratome sezionamento e il trasferimento delle fette in condizioni di coltura devono essere eseguiti in tempi brevi per garantire culture fetta di successo.
Perché i grandi eventi dello sviluppo giro dentato si verificano tra P14 e P30, sarebbe necessario mantenere fette organotipiche in coltura per periodi di tempo prolungati. In un primo tentativo di estendere la cultura electroporations tempo sono stati eseguiti a E 18,5 regolando le condizioni di conseguenza (Figura 4; vedi protocollo). Electroporating a Thè punto di tempo permette di mantenere le sezioni di cervello in coltura fino a P17 o 18. Inoltre la formazione dell'ippocampo è ulteriormente sviluppato a E 18,5 rispetto al 15,5 E, ad esempio, le strutture dell'ippocampo sono già formati e più facilmente riconoscibili. In futuro vorremmo effettuare ex utero elettroporazione in anche più tardi punti di tempo, ad esempio, P0 a P4 per esaminare i cambiamenti durante lo sviluppo giro dentato fino a P30.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
This work was supported by grants from the Deutsche Forschungsgemeinschaft to SB (BR-2215; SFB 497/A9).
Materiali
| Name | Company | Catalog Number | Comments |
| Flaming/ Brown Micropipette Puller | Sutter Instruments Company (USA) | P-97 | |
| Fine Glass Pipettes | Warner Instruments | G100F-4 | |
| Microgrinder | Narishige, Japan | EG-44 | |
| Anesthetic Bracket unit | Harvard Apparatus | PY2 34-0412 | |
| Halovet Vaporizer | Harvard Apparatus | PY2 34-0398 | |
| Fluovac System | Harvard Apparatus | PY2 34-0387 | |
| IMS Fluosorber | Harvard Apparatus | PY2 34-0415 | |
| Anesthetizing Chamber | Harvard Apparatus | PY2 34-0460 | |
| Electroporator | BEX Company | CUY21 EDIT | |
| Tweezers with disk electrodes | BEX Company | LF650P3 | 3 mm electrodes for E15.5 |
| Tweezers with disk electrodes | BEX Company | LF650P5 | 5 mm electrodes for E18.5 |
| Picospritzer III | Parker Hannifin Corporation | P/N 052-0500-900 | |
| HM 650 V Vibrating Blade Microtome, 230 V | Thermo Scientific | 920120 | |
| Dissection Microscope | Carl Zeiss Microscopy Gmbh | Stemi SV8 | |
| Inverted Microscope | Leica | Leica DM IL LED | |
| Confocal Microscope | Leica | Sp5II | |
| 6 well dish | BD Falcon | #353502 | |
| 6 well dish | CELLSTAR | #657160 | |
| Tissue culture inserts | BD Falcon | #353090 | |
| Fast Green | Sigma | F7252 | |
| Laminin | Sigma | #L2020 | |
| Poly-L-lysine | Sigma | #P5899 | |
| Spring scissors | Fine Science Tools | 15003-08 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Forceps | Dumont #55 | 11255-20 Inox | |
| HBSS 10x | Life Technology | 14180-046 | |
| BME | Life Technology | 41010-26 |
Riferimenti
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends Neurosci. 27, 447-452 (2004).
- Frotscher, M., Zhao, S., Forster, E. Development of cell and fiber layers in the dentate gyrus. Prog Brain Res. 163, 133-142 (2007).
- Muramatsu, R., Ikegaya, Y., Matsuki, N., Koyama, R. Neonatally born granule cells numerically dominate adult mice dentate gyrus. Neuroscience. 148, 593-598 (2007).
- Li, G., Pleasure, S. J. Morphogenesis of the dentate gyrus: what we are learning from mouse mutants. Dev Neurosci. 27, 93-99 (2005).
- Hsieh, J. Orchestrating transcriptional control of adult neurogenesis. Genes Dev. 26, 1010-1021 (2012).
- Li, G., Pleasure, S. J. Genetic regulation of dentate gyrus morphogenesis. Prog Brain Res. 163, 143-152 (2007).
- Collas, P. The current state of chromatin immunoprecipitation. Mol Biotechnol. 45, 87-100 (2010).
- Simon, R., et al. A dual function of Bcl11b/Ctip2 in hippocampal neurogenesis. Embo J. 31, 2922-2936 (2012).
- Pilaz, L. J., Silver, D. L. Live imaging of mitosis in the developing mouse embryonic cortex. J Vis Exp. (88), (2014).
- Pacary, E., et al. Visualization and genetic manipulation of dendrites and spines in the mouse cerebral cortex and hippocampus using in utero electroporation. J Vis Exp. (65), (2012).
- Hand, R., et al. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-62 (2005).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal development. Sci STKE. (136), 19 (2002).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. J Vis Exp. (2), (2007).
- Sugiyama, T., Osumi, N., Katsuyama, Y. The germinal matrices in the developing dentate gyrus are composed of neuronal progenitors at distinct differentiation stages. Dev Dyn. 242, 1442-1453 (2013).
- Lechler, T., Fuchs, E. Desmoplakin: an unexpected regulator of microtubule organization in the epidermis. J Cell Biol. 176, 147-154 (2007).
- Nichols, A. J., O'Dell, R. S., Powrozek, T. A., Olson, E. C. Ex utero electroporation and whole hemisphere explants: a simple experimental method for studies of early cortical development. J Vis Exp. (74), (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon