Method Article
마우스 해마 조직의 예 자궁 Electroporation에와 Organotypic 슬라이스 문화
요약
Here we present a protocol providing a tool to examine regulatory mechanisms of specific genes during hippocampal development. Employing ex utero electroporation and organotypic slice culture allows the up- and down-regulation of the expression of genes of interest in single cells and follow their fate during development.
초록
Mouse genetics offers a powerful tool determining the role of specific genes during development. Analyzing the resulting phenotypes by immunohistochemical and molecular methods provides information of potential target genes and signaling pathways. To further elucidate specific regulatory mechanisms requires a system allowing the manipulation of only a small number of cells of a specific tissue by either overexpression, ablation or re-introduction of specific genes and follow their fate during development. To achieve this ex utero electroporation of hippocampal structures, especially the dentate gyrus, followed by organotypic slice culture provides such a tool. Using this system to generate mosaic deletions allows determining whether the gene of interest regulates cell-autonomously developmental processes like progenitor cell proliferation or neuronal differentiation. Furthermore it facilitates the rescue of phenotypes by re-introducing the deleted gene or its target genes. In contrast to in utero electroporation the ex utero approach improves the rate of successfully targeting deeper layers of the brain like the dentate gyrus. Overall ex utero electroporation and organotypic slice culture provide a potent tool to study regulatory mechanisms in a semi-native environment mirroring endogenous conditions.
서문
해마는 기억과 학습에 중요한 역할뿐만 아니라 감정적 인 행동을한다. 하나의 주 기능은 신경계의 높은 소성을 필요로 장기 메모리로 단기 메모리의 통합으로 구성. 해마의 치아 이랑 (dentate gyrus)는 입력 정보에 대한 기본 게이트웨이 역할을하고 성인이 1, 2를 통해 또한 지속적인 신경 두 개의 뇌 영역 중 하나입니다. 해마 구조의 개발이 늦은 배아 발생 동안, 특히 제 3-4주 산후 3 중에 발생한다. 치아의 초기 개발 과정에서 줄기 세포 풀이 성인 신경 4뿐만 아니라 산후에 필요한 설립 이랑. 생후 개발 뉴런뿐만 아니라 성인 신경시 미성숙 최종적 성숙한 신경 전구 세포에 대한 여러 단계를 통해 줄기 세포에서 다양한 단계를 통과. 신경의 발현의 다른 단계에서특정 유전자는 해마 회로 5,6에 성숙하고 새로운 뉴런의 통합을 허용 할 필요가있다.
이 유전자의 많은의 발현 패턴과 함수를 정의 허용 마우스 유전학과 면역 조직 화학 염색에 의한 표현형 분석뿐만 아니라 분자 방법을 사용. 또한 마이크로 어레이 분석뿐만 아니라 크로 마틴 면역 침강 (에 칩)에서 잠재적 인 직접 및 간접 표적 유전자 7,8에 대한 정보를 제공합니다. 그러나, 치아 이랑의 특정 개발에 해마 개발의 규제 메커니즘에 관한 많은 오픈 질문은 여전히 존재한다. 하향 또는 상향 조절 (up-regulation)의 관심 및 / 또는 표적 유전자 개발 중에 그들의 운명을 따르의 유전자 중 특정 유전자가 세포의 적은 수의 조작을 허용하는 필요한 시스템을 조절하는 방법을 추가 통찰력을 얻기 위해. 자궁 일렉트로에서 shRNA를, 관심 또는 Cre 호텔 recombina의 유전자의 cDNA그 자체는 도구를 제공합니다. 전기 천공에 사용되어야 원하는 DNA 또는 RNA를 작은 발현 플라스미드의 존재를 확인한다. 이 접근법은 매우 성공적으로 인해 깊은 뇌 해마 레이어 구조의 위치로 치아 이랑의 개발을 검토 더 도전 접근법을 개발 피질 9,10 공부에서 구현되지만된다.
Organotypic 슬라이스 문화 다음 예 자궁 전기는이 문제 (11, 12)을 우회하는 한 방법입니다. 대조적으로 자궁 전기가 아닌 전체 배아 만 머리 따라서 해마 치아 이랑 (dentate gyrus)을 향해 shRNA를 / DNA를 직접 할 수있는 더 유리한 방법으로 전극을 배치 할 수 있도록 사용됩니다에서. 우리 그룹은 성공적으로 치아 이랑 (dentate gyrus) 개발 (8) 중에 전사 인자 Bcl11b의 역할을 연구하기 위해 전 자궁 전기를 사용. Bcl11b는 R로 치아 이랑 (dentate gyrus) 개발의 이중 역할을면역 조직 화학에 의해 입증 된 바와 같이 선조 세포의 증식뿐 아니라 분화 egulating. 이러한 과정에서 상기 Bcl11b 관여하는 구조를 정의한, Polleux 기 11,12의 프로토콜은 프로토콜 부분에서 후술하는 바와 같이 치아 이랑 (dentate gyrus)을 연구하기 위해 조절 하였다. 첫번째 접근법에서 질문 Bcl11b 자율적 신경 세포 분화 세포를 조절할지 여부를 해결 하였다. 두 번째 방법은 Desmoplakin, Bcl11b의 직접적인 표적 유전자가, Bcl11b 표현형을 구출 할만큼 충분한 지 여부를 조사했다.
프로토콜
참고 : 모든 동물 실험은 독일의 법에 따라 수행하고, 튀빙겐에있는 정부 기관에 의해 승인되었다.
마이크로 피펫, 솔루션 및 막 1. 준비
- 마이크로 피펫의 준비
- 다음 프로그램으로 마이크로 피펫 풀러를 사용하여 유리 마이크로 피펫을 당겨 : 열을 : (540), 당기 : 125, 속도 : 20 및 지연 : (140) 바늘 길이의 양을 5.5 cm에.
- microgrinder를 이용하여 베벨 바늘 4mm의 적절한 크기의 팁을 얻었다. 팁의 손상을 방지하기 위해 상자 또는 15cm 페트리 접시에 바늘을 저장합니다.
- 솔루션의 준비
- 플라스미드 DNA 솔루션
- 제조사의 프로토콜에 따라 엔도톡신을 준비 자유 맥시 키트를 이용하여 소망하는 cDNA 구조체를 포함하는 플라스미드 DNA를 준비한다.
- 플라스미드 DNA (GFP 스파이크 벡터 없음) 3 ㎍ / ㎕의 최종 농도로 용액을 조정 또는 4 ㎍ /μl의 독소에 (GFP 스파이크 벡터의 1 μg의와) 빠른 그린 (최종 농도 0.05 %)를 포함 트리스 - EDTA 버퍼를 확보.
- 라미닌 원액
- 1 ml의 최종 용적에 멸균 수 라미닌 1mg을 녹인다. -80 ° C에서 100 ㎕를 분주하고 저장을 준비합니다.
- 폴리 -L- 라이신 원액
- 1 mg / ml의 최종 농도로 멸균 물 50 ㎖ 중의 폴리 L 리신 50mg을 녹인다. -20 ° C에서 1 분취 량 및 저장을 준비합니다.
- 행크의 균형 소금 솔루션을 완료 (전체 HBSS)
- CaCl2를 10 ㎖의 100 mM이 황산을 10 배 HBSS 100 ㎖, 1 M HEPES 완충액 2.5 ml를 (PH 7.4), 1 M D 글루코스 30 ㎖, 100 mM의 10ml를 조합하여 완전한 HBSS를 준비하고, (4) 1 ml의 M의 NaHCO3. 4 ° C에서 1 L 및 저장에 멸균 업을 추가합니다.
참고 : 오토 클레이브는 모든 솔루션은 1 M HEPES 버퍼링 기대 한 M D-포도당, FIL 있습니다터 멸균.
- CaCl2를 10 ㎖의 100 mM이 황산을 10 배 HBSS 100 ㎖, 1 M HEPES 완충액 2.5 ml를 (PH 7.4), 1 M D 글루코스 30 ㎖, 100 mM의 10ml를 조합하여 완전한 HBSS를 준비하고, (4) 1 ml의 M의 NaHCO3. 4 ° C에서 1 L 및 저장에 멸균 업을 추가합니다.
- 슬라이스 문화 매체
- 에 기초 배지 이글 35 ㎖, 완전한 HBSS 12.9 ㎖ (1.2.4), 1 M D 글루코스 1.35 ㎖, 200 mM의 L- 글루타민, 250 μL, 그리고 500 μL 첨가함으로써 슬라이스 배양 배지를 준비 페니실린 - 스트렙토 마이신 50 ㎖의 최종 부피를 얻었다. 4 ° C에서 최종 5 %의 농도와 저장소에 말 혈청을 추가합니다.
- 낮은 녹는 점 (LMP) 아가로 오스
- 아가로 높은 전력에서 1~2 분 동안 전자 레인지에서 가열 하였다 완전한 HBSS 50 ㎖ (1.2.4)에 LMP의 2g을 첨가하여 4 % LMP 아가 용액을 준비한다. 39 °의 C - 37에서 물을 욕조에이 솔루션을 유지합니다. 4 ° C와 재사용의 솔루션을 저장합니다.
- 파라 포름 알데히드 솔루션
- 흄 후드에서 1X PBS 100 ㎖에 파라 포름 알데히드 4g을 첨가하여 4 % 파라 포름 알데히드 (PFA) 용액을 제조 하였다. 60 ° C로 가열하고 용액 용액 C가 될 때까지 1 N NaOH를 몇 방울을 가하여리어.
- 투과성으로 해결
- 4 ℃에서 0.3 % Trition X-100을 함유하는 저장소와 1X PBS 300 ㎖의 BSA의 9g 녹인다. 장기간 보관시 10 % 아 지드 화 나트륨을 추가한다.
- 플라스미드 DNA 솔루션
- 막 삽입의 코팅
- 12 ml의 최종 부피 라미닌 스톡 용액 (1.2.2)와 멸균 수 폴리 -L- 라이신 스톡 용액 (1.2.3)의 일 분취 한 분취 량을 희석.
- 멸균의 각 웰 포함 2 ml로 6 웰 플레이트에 막 삽입을 놓습니다. 멤브레인 위에 코팅 용액 1 ㎖를 첨가하고, 5 % CO 2 인큐베이터에서 37 ℃에서 O / N을 배양한다.
- 배양 후 막을 멸균 건조 1 ㎖로 3 회 삽입 씻는다. 마른 6 웰 플레이트에서 4 주 4 ° C에서 같은 날 또는 저장소의 코팅 막 삽입을 사용합니다.
2. DNA 주입 및 E15.5의 일렉트로와 E18.5 태아
- 5 % 이소 플루 란 포화 기화기에 접속 마취 챔버 내에 배치하여 암컷 마우스를 교배 시간 마취. 1 L / min의 속도로 이소 플루 란과 산소를 순환. 2-4 분 동안 또는 마우스의 발 사이에 집어 테스트하는 의식이 될 때까지 상자에 동물을 유지합니다.
- 배아 일에 자궁 경부 전위 (E) 15.5 또는 18.5에 의해 무의식 마우스를 안락사. 배아 (13)를 포함하는 자궁을 해부 차가운 완벽한 HBSS의 15 ~ 20 ml의를 포함하는 페트리 접시에 놓습니다.
참고 : 이후이 시점에서, 얼음의 배아와 조직을 유지. - 차가운 완벽한 HBSS를 포함하는 두 번째 페트리 접시에 자궁 뿔과 장소에서 각각의 배아를 분리하는 가위를 사용합니다.
- 해부 현미경, 자궁 근육의 벽과 미세 집게 (# 55)와 가위를 사용하여 태반을 끊다. 조심스럽게 난황에서 배아를 놓습니다.
- decapitat에 본의 가위를 사용하여단지 60 ° 각도로 앞다리 위의 전자 배아. 실험은 배아의 유전자형을 필요로하는 경우, 게놈 DNA의 분리를위한 조직 샘플 (꼬리의 작은 조각)를 수집합니다.
- 깨끗하고 건조한 페트리 접시에 머리를 전송합니다. 머리가 60 ° 각도에서 참수되었다 때문에 지느러미 쪽을 배치 할 때, 머리는 한쪽으로 기울해야합니다.
- 브레 그마에 반구 주변의 중앙으로 조심스럽게 바늘을 놓습니다 (그림 1A, B). 5-8 펄스를인가, 펄스 당 10 ~ 15 msec의 지속 기간 동안 압력을 30 파운드를 사용 picospritzer III의 페달을 밟아 DNA 용액 (3 또는 4 ㎍ / μL로) 약 2-3 μl를 주입한다. 펄스의 지속 시간과 수는 더 많은 시간을 필요로하는 작은 개구를 가진 바늘 개구의 직경에 의존한다. 각 펄스 사이의 간격은 1 초에 달한다.
- 전극을 배치하기 전에, EMBR의 머리에 완전한 HBSS 몇 방울을 적용요. '음'말단은 주입 뇌실 태아의 머리 (도 1C, D)의 귀 아래 주입 심실의 반대측 '긍정적 인'전극과 동일한 측에있는 방식으로 전극을 배치. 50 V. 5 펄스를 적용
- E 18.5에 대한 E 15.5에 대한 3mm 전극과 5mm 전극을 사용합니다.
뇌의 해부 (3)
- 전기 천공 후, 미세 포셉 쌍의 도움으로 헤드로부터 피부를 떼어. 스프링 가위를 사용하여 두개골의 정중선 소뇌의 중간에 작은 절개 부위를 만든다.
- 절개에 봄 가위를 삽입하고 시상 봉합을 따라 길이 방향으로 절단. 두개골을 벗겨 미세 집게를 사용하여 두개골에서 뇌를 분리합니다. 15 ~ 20 ml의 차가운 완벽한 HBSS 용액에 뇌 전체를 전송합니다.
- 한편, 4 % LMP 아가 부어껍질 멀리 금형에, 물을 욕조에 37 ~ 39 ℃로 유지했다.
- 작은 국자를 주걱으로 전체 HBSS 중 뇌를 타고 고급 티슈 또는 Kimwipes를 사용하여 HBSS를 초과하는 드레인.
- 아가로 오스에 부드럽게 뇌 전체를 놓고 미세 바늘의 위치를 조정합니다. 아가로 오스가 응고하고 블록 (관상 섹션의 후각 전구가 포인트) 절단 될 때까지 얼음에 금형을 보관하십시오.
4.에 vibratome 단면 및 슬라이스 문화
- LMP 아가로 오스 블록을 잘라 내고 '강력 접착제'를 이용하여 시편 단계에 붙입니다. 접착제는 전사 후 건조에 vibratome의 버퍼 트레이 표본 스테이지이고 블록이 용액에 침지를 완료 할 때까지 HBSS 차가운 얼음 채우기.
참고 : 단면 전에 70 % 에탄올로 모든 악기 및 장비 표면을 소독. - 다음과 같은 새로운 블레이드를 사용하여 250 μm의 두께에 vibratome 섹션을 준비합니다.
- 블록 위스콘신 트림다음 설정 번째; 주파수 - 60 Hz의 진폭 - 0.7 μm의 속도 16-18mm / 초. 느린 속도 (9mm / 초)에서 위의 설정으로 원하는 조직을 포함하는 부분을 잘라. 후뇌에서 절편 시작, 대뇌에서 5-7 섹션을 수집합니다.
- 구부러진 주걱의 도움으로 HBSS를 완료하고 모든 섹션 (그림 1E) 수집까지 얼음 계속 차가운 얼음 5 mL를 함유 한 깨끗한 6 웰 배양 접시에 섹션을 전송합니다.
- 섹션의 배향을 용이하게하기 위해, 멤브레인 부분을 배치하기 전에 완전한 HBSS 100 ㎕와 교차 방식으로 멤브레인 적셔.
- (막에 섹션을 밀어 집게를 사용하여 다음 집게로 부분의 모서리를 선택하고 주걱에 끌어와) 막에 구부러진 주걱을 사용하여 섹션을 전송합니다. 한 막에 5 절까지 놓고 (집게를 사용하여 그림 1 층을 마련). 서로 절을 중복하지 마십시오.
- 피펫을 사용하여 막 떨어져 HBSS의 초과를 가져 가라. 여기에 사용 된 특정 멤브레인들은 프레임에 부착되고, 티슈 접촉하지만 매체에 의해 커버 할 수없는 조직 배양 플레이트에 삽입된다.
- 슬라이스 배양 배지 (1.2.5) (그림 1G, H)의 1.8 ml를 포함하는 6 웰 플레이트에 막 삽입을 놓습니다. 11 DIV 14 DIV 5 % CO 2와 37 ° C에서 배양 접시를 품어. 절반 매체 (0.9 ml)을 격일로 변경합니다.
주 :이 단계에서 브로 모데 옥시 우리 딘 시약을 추가 (BrdU의 10 μM 최종 농도)를 라벨링 배양 시간의 처음 20 시간 동안 미디어에 대한 세포 증식.
면역 형광 염색법에 이어 섹션 5. 고정
- 잘라 깨끗하고 날카로운 메스 블레이드를 사용하여의 방향에 따라 막 트림섹션.
- 4 % PFA (1.2.7) 1 ㎖를 함유하는 24 웰 플레이트에 막과 함께 전송 섹션. 15 분 각 1X PBS로 3 회 세척 한 다음 실온에서 1 시간 동안 섹션을 품어. 부드러운 교반과 함께 4 ° C에서 투과성으로 솔루션 섹션 O / N을 품어.
- 다음 날, 투과성으로 용액에 희석 적절한 차 항체와 섹션을, 부화, O / N 또는 교반과 4 ° C에서 48 시간 동안.
- 1X PBS로 15 분간 섹션 3 회 세척하고 투과성으로 용액에 희석 적절한 보조 항체와 4 ° C에서 O / N을 품어.
- 이차 항체와 배양 후, 10 분 동안 DAPI 염색 한 다음 15 분 동안 1X PBS로 한 번 섹션을 씻는다.
- 15 분 각각의 섹션을 1X PBS로 3 회 세척하고 슬라이드를 현미경에 전송합니다. ImmunoMount를 추가하고 부드럽게 섹션의 상단에 커버 슬립을 배치합니다. 4 ° C와 자체에서 슬라이드 O / N을 건조매니큐어와 알.
참고 : 항상 4 ° C에서 슬라이드를 유지합니다.- 공 초점 현미경 (그림 1I)에 의해 슬라이스 문화를 분석합니다.
결과
전사 인자의 Bcl11b 삭마 전구 세포 증식 및 치아 이랑 (dentate gyrus)의 감소 된 크기와 셀 번호의 결과 신경 세포 분화의 손상을 야기한다. 또한 돌연변이 신경 세포는 학습과 기억 손상 (8)의 원인이되는 해마 회로에 통합하는 데 실패. 전 자궁의 전기가 사용되었다 이러한 과정에서 Bcl11b의 규제 메커니즘 (들)에 대한 질문에 대답합니다.
문제를 해결하는 데는 Bcl11b 세포 자율적으로 E15.5에 Bcl11b 플록스 / 플록스 해마로, Bcl11b의 모자이크 삭제를 GFP- Cre 호텔 재조합 효소의 구조 나 혼자 GFP (11)의 전 자궁 전기에 의해 생성 된 신경 세포 분화를 조절 Organotypic 슬라이스 문화까지 다음 여부 전기로부터 18 일 (그림 2A, B,이 그림 8에서 수정 된). Bcl11 있는지 여부를 확인하려면B 세포는 면역 형광 염색 자율적 GFP뿐만 아니라 NeuroD 인식 특이 적 항체를 사용하여 수행 하였다 과립 세포의 분화를 조절한다. NeuroD는 유사 분열 단계 2B / 3 초 postmitotic 전지 (14)로 표현된다. 우리는 NeuroD 양성 세포의 수가 현저히 신경 세포 분화 (8)의 구속 조건을 나타내는 돌연변이 Bcl11b 증가된다 미리 보여 주었다. 혼자 GFP 양성 세포 및 GFP / NeuroD 양성 세포의 수는 NeuroD 양성 세포의 유의 한 증가는 세포가 Cre 호텔 재조합 효소를받은 치아 이랑에서 관찰되었다 제어 및 돌연변이 세포에서 차이를 보이지 않았지만 (그림 2C는,이 그림은 수정 된 8에서). Cre 호텔 재조합 효소를받은 세포에서뿐만 아니라 야생 형 세포에서뿐만 아니라 NeuroD 양성 세포를 찾는 것은 간접 메커니즘 신경 세포 분화의 Bcl11b 조절에 관여하는 것을 제안했다. 이 자료에서, 그러나,와 TBcl11b의하는 ional 세포 자율 기능을 배제 할 수 없다.
이전 Desmoplakin Bcl11b 8은 직접적인 표적 유전자로 하였다. 또한 Desmoplakin가 전구 세포의 증식 및 (15)의 각질 형성 세포 분화의 조절에 관여하는 것으로 나타났다. Desmoplakin 단독 또는 CMV 프로모터의 조절하에 GFP 및 Desmoplakin가 제어 Bcl11b 돌연변이 뇌 (도 3a에 electroporation 된 GFP를 발현하는 치아 이랑 플라스미드 DNA의 전구 세포의 증식 및 / 또는 신경 세포의 분화 조절에 관여되는지 여부를 설명하기 위해 - C,이 수치는 8에서 수정 된). 뇌 조각은 BrdU의 (최종 농도 10 μM)의 존재 하에서 제 20 시간 동안 배양 하였다. 전기 천공 후 11 일째에서 슬라이스 배양 된 BrdU 면역 염색 하였다 고정시키고 및 BrdU의 양성 세포의 수를 측정 하였다. 돌연변이 tissu Bcl11b제어 조직에 비해 GFP와 일렉트로 E 만 상당히 적은의 BrdU 양성 세포를 함유 하였다. (,이도 8에서 수정 된도 3d) 그러나, GFP 및 Desmoplakin 공동은 전기 준위도 조절할의 BrdU 양성 세포의 수를 구출. 이와 함께 이들 데이터는 또한 직접 Bcl11b 대상의 유전자 및 전구 세포 증식의 조절에서의 역할로서 Desmoplakin 확인.

E15.5에서 전 자궁 전기 및 Organotypic 슬라이스 문화 그림 1. 설정입니다. (A) DNA의 주입 한 반구에. (B) DNA 주입의 개략도. 전극 (C) 위치. (D) 도식 전극 배치의 도면. (E)에 vibratome는 단면 및 시간치아 이랑의 뇌 부분의 andling. (F) 특정 막에 뇌 섹션을 배치. (GI) 밝은 필드 (G) 및 형광 (H, GFP) 전기 후 1 일에 슬라이스 문화의 분석. (I) 공 초점 이미지 하루에 11에서 DAPI와 GFP 염색을 이용하여 전기 후. 점선은 치아 이랑을 나타냅니다. 스케일 바 = 100 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

전 자궁 내 전기 및 (8에서 수정) Organotypic 슬라이스 문화에 의해 Bcl11b 그림 2. 모자이크 삭제. 제어 벡터 pCIG2 혼자 (A) 및 pCIG2- Cre 호텔 콘의 전기18 일 대한 Organotypic 슬라이스 문화 다음 E15.5에서 치아 이랑 (dentate gyrus)에 구조체 (B). 섹션은 GFP (녹색) 및 NeuroD (빨간색)를 인식하여 항체로 면역 염색 하였다. 세트는 Cre 호텔 -recombinase을 발현하는 세포의 Bcl11b 표현의 손실을 보여 높은 배율에서 GFP (녹색)과 Bcl11b (빨간색) 염색을 표시합니다. (C) GFP, NeuroD 및 GFP / NeuroD 양성 세포의 통계 분석. 점선은 치아 이랑을 나타냅니다. t-test를, *의 P <0.005; 오차 막대, SD; N = 5. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
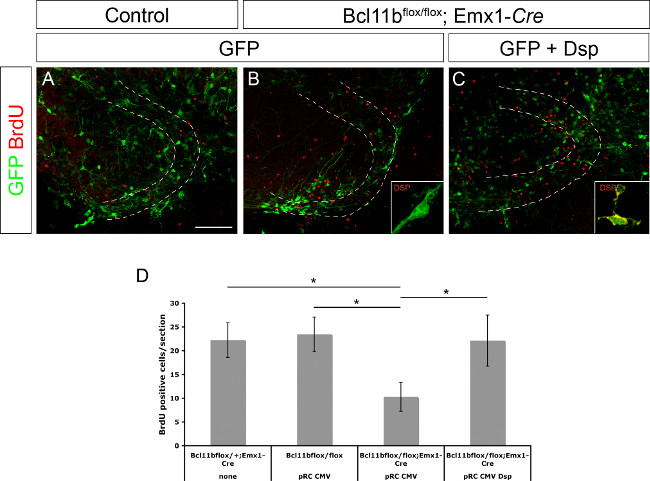
그림 3. Bcl11b 표현형은 (8에서 수정) Desmoplakin의 재 도입에 의해 구출된다. GFP 만 (A, B)뿐만 아니라 GFP 및 Desmoplakin (C)의 제어 (A)와 돌연변이의 치아 이랑 (dentate gyrus)에 electroporation 하였다 (B는 E15.5에서 C) 두뇌 11 일 Organotypic 슬라이스 문화 하였다. 섹션은 GFP (녹색)과 BrdU의 (빨간색). (D)의 BrdU 양성 세포의 통계 분석을 인식하여 항체로 면역 염색 하였다. 점선은 치아 이랑을 나타냅니다. 세트는 높은 배율에서 Desmoplakin 염색 (녹색)을 표시합니다. t 검정, * P는 <0.01; 오류 바, SEM; N = 4. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
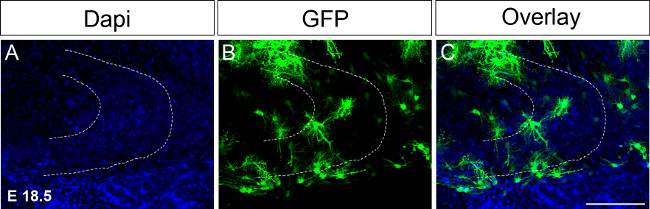
E 18.5에서 그림 4. 예를 자궁 전기는 Organotypic 슬라이스 문화 하였다.전기 천공 후 16 일에 면역 염색 한 다음 반구로 GFP를 발현하는 DNA의 주입 (A) DAPI 염색]. (B) 염색 GFP (C)는 이미지를 합병. 점선은 치아 이랑 (dentate gyrus)를 나타냅니다. 스케일 바 = 100 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
해마는 학습과 기억에 중요한 기능을 가지고있다. 치아 이랑도 신경이 개발하는 동안뿐만 아니라 성인기에 걸쳐뿐만 아니라 발생 두 뇌 영역 중 하나입니다. 산후 많은 공통 요소를 포함하는 유사한 방식으로 성인 해마 신경 진행한다. 이러한 요소의 규제 메커니즘을 정의하는 것은 다시 새로운 치료법 및 예방 조치로 이어질 것입니다 신경 퇴행성 질환을 이해하는데 매우 도움이 될 것입니다. 이 정보를 얻으려면 하나의 세포를 조작하고 Organotypic 슬라이스 문화 뒤에 전 자궁 내 전기에 의해 입증 된 바와 같이 그 나라의 환경에서 관찰 할 수있는 시스템이 필요합니다.
예 자궁 전기가 성공적으로 피질 개발 11,16 공부에 처음 적용되었다. 해마 개발 Bcl11b의 역할을 검사 우리가 알기로는 D의 첫 번째 설명 전직 자궁 전기입니다치아에 NA 조직 8 이랑. 우리는 피질 개발 (11, 12)을 공부 Polleux 그룹에 의해 출판 된 방법에 우리의 프로토콜을 기반으로. 성공적으로 크기와 전극의 위치 조정이 있었다 치아 이랑 (dentate gyrus)을 연구하는이 방법을 적용합니다. 주사 부위의 귀 및 아래 대향 부위에서 양극 근처 피질에서 음극을 배치하는 전기의 극성을 변경 및 치아 이랑 (dentate gyrus)의 세포 내로 DNA를 도입하는데 성공. 정확하게 전극을 배치하고 mA 만족 일렉트로 포 레이션 결과를 달성하기 위해 매우 중요한 단계로 판명 0.06-0.08의 전류를인가. 전술 한 바와 같이 가장 적절한 전류가 전극의 정확한 배치에 주로 의존 얻었다. 프로토콜의 추가 중요한 단계는 뇌실에 주입 물질뿐만 아니라에 vibratome의 절편 후 조각을 처리한다. 뇌 조직은 전체 공정에 걸쳐 일정하지 않으므로재배 막에에 vibratome에서 전송할 때 따라서 조직은 매우 부드럽고 쉽게 파괴 할 수 있습니다. 섹션은 또한 면역 염색을 시작할 때 매우 세 심하게 다루어 져야한다. 이러한 수정 및 치아 이랑 (dentate gyrus)의 단일 세포의 고려 조작으로 성공적으로 초기 해마 개발 Bcl11b 규제에 대한 질문 (,이 수치는 8에서 수정 된 그림 2와 3) 응답 하였다.
단일 세포를 조작 위에서 언급 한 관찰로 그들의 운명은 전 자궁 전기의 주요 장점이다. 자궁 전기에 비해 전 자궁 접근 방식의 가장 큰 단점은 문화에 조각을 유지하기 위해 제한 시간입니다. 이는 자궁 전 배양 조건 개발이 지연 될 수 있다는 것도 가능하다. 우리의 실험에서 지금까지 우리는 문화의 조각을 유지 할 수 있었다 UP14의 나이에 해당 페이지에 십팔일. 이 시간 이후의 Organotypic 조각의 재배는 조직의 붕괴로 이어집니다. 전직 자궁 접근 방식의 또 다른 단점은 어머니 당 일렉트로 할 수 배아의 수는 제한되어있다. 최대 8 개의 배아가이 번호를 처리 할 수 자궁 내 전기와는 달리 전 자궁 접근 방식 4 배아로 제한됩니다. 배아, 전기,에 vibratome 절편 및 배양 조건에 조각의 전송의 해부 성공 슬라이스 문화를 위해 짧은 시간에 수행해야합니다.
치아 이랑 (dentate gyrus) 개발의 주요 행사는 P14과 P30 사이에 발생하기 때문에 장시간 시간 동안 문화의 Organotypic 조각을 유지하기 위해 필요하다. 문화를 확장하는 첫 번째 시도에서 시간 electroporations 그에 따라 조건을 조정 E 18.5에서 수행 하였다 (그림 4, 프로토콜 참조). 일에 Electroporating시점은 예 E 15.5에 비해 해마 형성 (hippocampal formation)는 상기 E 18.5에서 개발되고 또한 P17 또는 (18)에 배양까지 뇌 단면을 유지있게되어, 해마 구조는 이미 형성된보다 쉽게 인식된다. 앞으로 우리는 P30까지 치아 이랑 (dentate gyrus) 개발 중에 변경을 검토 P4로, 예를 들어, 심지어 나중에 지점에서 P0을 전 자궁 전기를 수행하고 싶습니다.
공개
The authors declare that they have no competing financial interests.
감사의 말
This work was supported by grants from the Deutsche Forschungsgemeinschaft to SB (BR-2215; SFB 497/A9).
자료
| Name | Company | Catalog Number | Comments |
| Flaming/ Brown Micropipette Puller | Sutter Instruments Company (USA) | P-97 | |
| Fine Glass Pipettes | Warner Instruments | G100F-4 | |
| Microgrinder | Narishige, Japan | EG-44 | |
| Anesthetic Bracket unit | Harvard Apparatus | PY2 34-0412 | |
| Halovet Vaporizer | Harvard Apparatus | PY2 34-0398 | |
| Fluovac System | Harvard Apparatus | PY2 34-0387 | |
| IMS Fluosorber | Harvard Apparatus | PY2 34-0415 | |
| Anesthetizing Chamber | Harvard Apparatus | PY2 34-0460 | |
| Electroporator | BEX Company | CUY21 EDIT | |
| Tweezers with disk electrodes | BEX Company | LF650P3 | 3 mm electrodes for E15.5 |
| Tweezers with disk electrodes | BEX Company | LF650P5 | 5 mm electrodes for E18.5 |
| Picospritzer III | Parker Hannifin Corporation | P/N 052-0500-900 | |
| HM 650 V Vibrating Blade Microtome, 230 V | Thermo Scientific | 920120 | |
| Dissection Microscope | Carl Zeiss Microscopy Gmbh | Stemi SV8 | |
| Inverted Microscope | Leica | Leica DM IL LED | |
| Confocal Microscope | Leica | Sp5II | |
| 6 well dish | BD Falcon | #353502 | |
| 6 well dish | CELLSTAR | #657160 | |
| Tissue culture inserts | BD Falcon | #353090 | |
| Fast Green | Sigma | F7252 | |
| Laminin | Sigma | #L2020 | |
| Poly-L-lysine | Sigma | #P5899 | |
| Spring scissors | Fine Science Tools | 15003-08 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Forceps | Dumont #55 | 11255-20 Inox | |
| HBSS 10x | Life Technology | 14180-046 | |
| BME | Life Technology | 41010-26 |
참고문헌
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends Neurosci. 27, 447-452 (2004).
- Frotscher, M., Zhao, S., Forster, E. Development of cell and fiber layers in the dentate gyrus. Prog Brain Res. 163, 133-142 (2007).
- Muramatsu, R., Ikegaya, Y., Matsuki, N., Koyama, R. Neonatally born granule cells numerically dominate adult mice dentate gyrus. Neuroscience. 148, 593-598 (2007).
- Li, G., Pleasure, S. J. Morphogenesis of the dentate gyrus: what we are learning from mouse mutants. Dev Neurosci. 27, 93-99 (2005).
- Hsieh, J. Orchestrating transcriptional control of adult neurogenesis. Genes Dev. 26, 1010-1021 (2012).
- Li, G., Pleasure, S. J. Genetic regulation of dentate gyrus morphogenesis. Prog Brain Res. 163, 143-152 (2007).
- Collas, P. The current state of chromatin immunoprecipitation. Mol Biotechnol. 45, 87-100 (2010).
- Simon, R., et al. A dual function of Bcl11b/Ctip2 in hippocampal neurogenesis. Embo J. 31, 2922-2936 (2012).
- Pilaz, L. J., Silver, D. L. Live imaging of mitosis in the developing mouse embryonic cortex. J Vis Exp. (88), (2014).
- Pacary, E., et al. Visualization and genetic manipulation of dendrites and spines in the mouse cerebral cortex and hippocampus using in utero electroporation. J Vis Exp. (65), (2012).
- Hand, R., et al. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-62 (2005).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal development. Sci STKE. (136), 19 (2002).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. J Vis Exp. (2), (2007).
- Sugiyama, T., Osumi, N., Katsuyama, Y. The germinal matrices in the developing dentate gyrus are composed of neuronal progenitors at distinct differentiation stages. Dev Dyn. 242, 1442-1453 (2013).
- Lechler, T., Fuchs, E. Desmoplakin: an unexpected regulator of microtubule organization in the epidermis. J Cell Biol. 176, 147-154 (2007).
- Nichols, A. J., O'Dell, R. S., Powrozek, T. A., Olson, E. C. Ex utero electroporation and whole hemisphere explants: a simple experimental method for studies of early cortical development. J Vis Exp. (74), (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유