Method Article
Ex Utero Elektroporation und Organotypischen Kultur der Maus Hippocampus-Gewebe
In diesem Artikel
Zusammenfassung
Here we present a protocol providing a tool to examine regulatory mechanisms of specific genes during hippocampal development. Employing ex utero electroporation and organotypic slice culture allows the up- and down-regulation of the expression of genes of interest in single cells and follow their fate during development.
Zusammenfassung
Mouse genetics offers a powerful tool determining the role of specific genes during development. Analyzing the resulting phenotypes by immunohistochemical and molecular methods provides information of potential target genes and signaling pathways. To further elucidate specific regulatory mechanisms requires a system allowing the manipulation of only a small number of cells of a specific tissue by either overexpression, ablation or re-introduction of specific genes and follow their fate during development. To achieve this ex utero electroporation of hippocampal structures, especially the dentate gyrus, followed by organotypic slice culture provides such a tool. Using this system to generate mosaic deletions allows determining whether the gene of interest regulates cell-autonomously developmental processes like progenitor cell proliferation or neuronal differentiation. Furthermore it facilitates the rescue of phenotypes by re-introducing the deleted gene or its target genes. In contrast to in utero electroporation the ex utero approach improves the rate of successfully targeting deeper layers of the brain like the dentate gyrus. Overall ex utero electroporation and organotypic slice culture provide a potent tool to study regulatory mechanisms in a semi-native environment mirroring endogenous conditions.
Einleitung
Der Hippocampus spielt eine wichtige Rolle im Gedächtnis und Lernen sowie emotionales Verhalten. Eine Hauptfunktion besteht in der Konsolidierung des Kurzzeitgedächtnisses in das Langzeitgedächtnis, die hohe Plastizität des Nervensystems erfordert. Der Gyrus dentatus des Hippocampus wirkt als primäre Gateway für Eingabeinformation und ist auch einer der beiden Hirnregionen mit laufenden Neurogenese im Erwachsenenalter 1,2. Die Entwicklung der hippocampalen Struktur tritt während der späten Embryogenese und insbesondere während der ersten 3 bis 4 Wochen nach der Geburt 3. Während der frühen Entwicklung des Gyrus dentatus eine Stammzellpools hergestellt für postnatale erforderlich sowie adulte Neurogenese 4. Entwicklung von Nervenzellen durchlaufen verschiedene Stadien, von der Stammzelle über mehrere Stufen der Vorläuferzellen in die unreifen und schließlich reifen Neuronen während der postnatalen und adulten Neurogenese. In verschiedenen Stadien der Neurogenese die Expressionspezifische Gene erforderlich ist, um die Reifung und Integration neuer Neuronen in Hippocampus-Schaltung 5,6 erlauben.
Verwendung Mausgenetik und Phänotypanalyse immunhistochemisch sowie molekulare Methoden erlaubt die Definition der Expressionsmuster und Funktion vieler dieser Gene. Neben Microarray-Analyse sowie Chromatinimmunpräzipitation (ChIP) zur Verfügung gestellten Informationen über potenzielle direkte und indirekte Zielgene 7,8. Allerdings gibt es noch viele offene Fragen über die Regulierungsmechanismen der Hippocampus-Entwicklung, insbesondere die Entwicklung des Gyrus dentatus. Um einen tieferen Einblick, wie spezifische Gene reguliert ein System erforderlich erlaubt die Manipulation von einer kleinen Anzahl von Zellen durch Down- oder Hochregulierung des Gens von Interesse und / oder seinen Zielgenen und folgen ihr Schicksal während der Entwicklung zu erhalten. In utero Elektroporation von shRNAs, cDNA der Gene von Interesse oder Cre recombinase stellt ein solches Werkzeug. Um das Vorhandensein der gewünschten DNA oder kleine RNAs Expressionsplasmide sollte für die Elektroporation verwendet werden, zu gewährleisten. Dieser Ansatz ist erfolgreich bei der Untersuchung kortikalen Entwicklung 9,10 ein herausfordernder Ansatz Untersuchung der Entwicklung des Gyrus dentatus auf Grund der Position der hippocampalen Strukturen tiefer Gehirnschichten implementiert, aber ist.
Ex utero Elektroporation gefolgt von organotypischen Kultur ist ein Ansatz, um dieses Problem zu umgehen 11,12. Im Gegensatz zu den in utero Elektroporation nicht den gesamten Embryo aber nur der Kopf verwendet ermöglicht es daher, die Elektroden in einer günstigeren Weise, die shRNA / DNA Richtung Hippocampus und Gyrus dentatus direkt auszulösen. Unsere Gruppe erfolgreich eingesetzt ex utero Elektroporation, um die Rolle des Transkriptionsfaktors BCL11B im Gyrus dentatus Entwicklung 8 studieren. BCL11B hat eine doppelte Funktion Gyrus dentatus Entwicklung regulating Vorläuferzellproliferation und Differenzierung wurde durch Immunhistochemie nachgewiesen. Um einen Mechanismus für BCL11B Einbindung in diesen Prozessen weiter zu definieren, wurden Protokolle des Polleux Gruppe 11,12 eingestellt, um den Gyrus dentatus, wie unten in dem Protokoll beschrieben untersuchen. In einem ersten Ansatz wurde die Frage angesprochen, ob BCL11B regelt neuronalen Zelldifferenzierung Zelle autonom. Ein zweiter Ansatz untersucht, ob Desmoplakin, Direkt Zielgen BCL11B, genügt, um die BCL11B Phänotyp retten.
Protokoll
HINWEIS: Alle Tierversuche wurden in Übereinstimmung mit dem deutschen Recht durchgeführt und wurden von den Regierungsstellen in Tübingen genehmigt.
1. Herstellung der Mikropipetten, Lösungen und Membranen
- Herstellung von Mikropipetten
- Ziehen Glasmikropipetten mit einer Mikropipette Abzieher mit folgendem Programm: Wärme: 540, Ziehen: 125, Geschwindigkeit: 20 und Delay: 140. Die Nadellänge beträgt 5,5 cm.
- Kegel Nadeln mit einem microgrinder einen geeigneten Spitzengröße von 4 mm zu erhalten. Speichern die Nadeln in einer Box oder 15 cm Petrischale werden Beschädigungen an den Spitzen.
- Zubereitung der Lösungen
- Plasmid-DNA-Lösung
- Vorbereitung von Plasmid-DNA, die die gewünschte cDNA-Konstrukts unter Verwendung eines Endotoxin-freien Maxi-Prep-Kit nach Herstellerprotokoll.
- Einzustellen Plasmid-DNA-Lösung auf eine Endkonzentration von 3 & mgr; g / & mgr; l (ohne GFP Spike vector) oder 4 & mgr; g /ul (mit 1 ug GFP Spike Vektor) in endotoxinfreiem Tris-EDTA-Puffer, der Fast Green (Endkonzentration 0,05%).
- Laminin Stammlösung
- Man löst 1 mg Laminin in sterilem Wasser bis zu einem Endvolumen von 1 ml. Bereiten Sie 100 ul Aliquots und bei -80 ° C.
- Poly-L-Lysin-Stammlösung
- Man löst 50 mg Poly-L-Lysin in 50 ml sterilem Wasser bis zu einer Endkonzentration von 1 mg / ml. Bereiten Sie 1 ml Aliquots und lagern in -20 ° C.
- Füllen Hanks Balanced Salt Solution (Complete HBSS)
- Bereiten komplette HBSS durch Kombination von 100 ml 10x HBSS, 2,5 ml 1 M HEPES-Puffer (pH 7,4), 30 ml 1 M D-Glucose, 10 ml 100 mM CaCl 2, 10 ml von 100 mM MgSO 4 und 4 ml 1 M NaHCO 3. In sterilem Wasser bis zu 1 l und bei 4 ° C.
HINWEIS: Autoklav alle Lösungen erwarten, 1 M HEPES-Puffer und 1 M D-Glucose, die fil sindter sterilisiert.
- Bereiten komplette HBSS durch Kombination von 100 ml 10x HBSS, 2,5 ml 1 M HEPES-Puffer (pH 7,4), 30 ml 1 M D-Glucose, 10 ml 100 mM CaCl 2, 10 ml von 100 mM MgSO 4 und 4 ml 1 M NaHCO 3. In sterilem Wasser bis zu 1 l und bei 4 ° C.
- Slice-Kultur-Medium
- Bereiten Scheibe Kulturmedium durch Zugabe von 35 ml von Basal Medium Eagle, 12,9 ml komplettem HBSS (1.2.4), 1,35 ml 1 M D-Glucose, 250 & mgr; l von 200 mM L-Glutamin und 500 & mgr; l Penicillin-Streptomycin erhalten ein Endvolumen von 50 ml. Hinzufügen Pferdeserum auf eine Endkonzentration von 5% und bei 4 ° C.
- Mit niedrigem Schmelzpunkt (LMP) Agarosegel
- Vorbereiten einer 4% LMP Agarose-Lösung durch Zugabe von 2 g des LMP-Agarose auf 50 ml komplettem HBSS (1.2.4), gefolgt von Erhitzen in einer Mikrowelle für 1-2 min bei hoher Leistung. Diese Lösung wird in einem Wasserbad bei 37 bis 39 ° C. Die Lösung ist bei 4 ° C und Wiederverwendung.
- Paraformaldehydlösung
- In einem Abzug bereiten eine 4% Paraformaldehyd (PFA) Lösung durch Zugabe von 4 g Paraformaldehyd in 100 ml 1x PBS. Die Lösung wird auf 60 ° C und ein paar Tropfen 1 N NaOH, bis die Lösung cLear.
- Permeabilisierung Lösung
- Man löst 9 g BSA in 300 ml 1x PBS, enthaltend 0,3% Trition X-100 und bei 4 ° C. Zugabe von 10% Natriumazid für eine Langzeitspeicherung.
- Plasmid-DNA-Lösung
- Beschichtung der Membraneinsätze
- Verdünne ein Aliquot von Laminin-Stammlösung (1.2.2) und ein Aliquot von Poly-L-Lysin-Stammlösung (1.2.3) in sterilem Wasser auf ein Endvolumen von 12 ml.
- Platzieren Membraneinsätze in Platten mit 6 Vertiefungen mit jeweils gut mit 2 ml sterilem Wasser. 1 ml der Beschichtungslösung auf die Oberseite der Membran und inkubieren O / N bei 37 ° C in einem 5% CO 2 -Inkubator.
- Nach Inkubation die Membraneinsätze dreimal mit 1 ml sterilem Wasser und trocken. Verwenden beschichteten Membran-Einsätze am selben Tag oder bei 4 ° C für bis zu vier Wochen in einem trockenen 6-Well-Platte.
2. DNA-Injektion und Elektroporation von E15.5 und E18.5 Embryonen
- Anesthetize eine Zeit gepaart weiblichen Maus, indem Sie es in eine betäubende Kammer mit 5% Isofluran gesättigten und einem Verdampfer verbunden. Zirkulieren Isofluran und Sauerstoff mit einer Rate von 1 L / min. Halten Sie das Tier in der Box für 2-4 Minuten oder bis zum Unbewussten, die durch Zusammendrücken zwischen den Pfoten der Maus getestet wird.
- Euthanize den bewusstlosen Maus durch Genickbruch an embryonalen Tag (E) 15,5 oder 18,5. Präparieren Sie die Gebärmutter, die die Embryonen 13 und legen Sie sie in eine Petrischale mit 15 bis 20 ml kaltem komplette HBSS.
HINWEIS: Von diesem Punkt an, halten Sie die Embryonen und Gewebe auf Eis. - Verwenden Sie eine Schere, um jeden Embryo aus dem Uterushorn und Ort in eine zweite Petrischale mit kaltem HBSS komplett zu trennen.
- Unter einem Binokular, trennen die Uterusmuskulatur Wand und die Plazenta mit einer feinen Pinzette (# 55) und eine Schere. Vorsichtig lösen, den Embryo aus dem Dottersack.
- Verwenden Sie ein Paar Bonn Schere decapitate die Embryonen gerade oberhalb der Vorderbeine bei einem Winkel von 60º. Wenn das Experiment erfordert Genotypisierung der Embryonen, sammeln eine Gewebeprobe für die Isolierung genomischer DNA (ein kleines Stück Schwanz).
- Übertragen Sie den Kopf, um eine saubere und trockene Petrischale. Da der Kopf war in einem Winkel von 60 ° enthauptet wurde, sollte der Kopf zur Seite neigen, wenn platziert dorsalen Seite nach oben.
- Platzieren einer Nadel vorsichtig in der Mitte der Halbkugel in der Nähe der Bregma (1A, B). Injizieren etwa 2-3 & mgr; l (bei 3 oder 4 ug / ul) DNA-Lösung, indem er auf das Pedal des Picospritzer III unter Verwendung von 30 Pfund Druck für die Dauer von 10-15 ms pro Impuls Aufbringen 5-8 Impulsen. Die Dauer und die Anzahl der Impulse ist abhängig vom Durchmesser des Nadelöffnung mit kleineren Öffnungen mehr Zeit erfordern. Der Abstand zwischen jedem Impuls beträgt 1 sec.
- Vor dem Einsetzen der Elektroden, ein paar Tropfen von kompletten HBSS auf den Kopf des embryo. Die Elektroden werden in der Weise, daß die "negative" Klemme auf der gleichen Seite wie das injizierte Herzkammer und der "positive" Elektrode, die auf der gegenüberliegenden Seite des eingespritzten Ventrikel unter dem Ohr des Embryos Kopf (1C, D). Bewerben 5 Impulse von 50 V.
- Verwenden Sie 3 mm Elektroden für E 15.5 und 5 mm Elektroden für E 18.5.
3. Präparation des Gehirns
- Nach der Elektroporation, beim Abziehen der Haut von dem Kopf mit Hilfe einer feinen Pinzette. Verwendung eines Paares von Feder Schere einen kleinen Einschnitt in der Mitte des Kleinhirns an der Mittellinie des Schädels.
- Setzen Sie die Feder Schere in den Einschnitt und geschnitten längs entlang der Pfeilnaht. Ziehen Sie die Schädel und lösen das Gehirn aus dem Schädel durch die Verwendung einer feinen Pinzette. Übertragen Sie das gesamte Gehirn in 15-20 ml kaltem HBSS komplette Lösung.
- Inzwischen pour 4% LMP-Agarose,bei 37-39 ° C in einem Wasserbad gehalten wird, in eine Abzieh-Form.
- Nehmen Sie das Gehirn aus dem kompletten HBSS von einer kleinen Schaufel Spachtel und Abfluss über HBSS mit Hilfe feiner Seidenpapier oder Kimwipes.
- Stellen Sie das gesamte Gehirn sanft in die Agarose und stellen Sie ihre Position mit einer feinen Nadel. Halten Sie die Form auf Eis, bis die Agarose verfestigte und der Block wird geschnitten (für Koronalschnitte die Riechkolben nach oben zeigen).
4. Vibratom Schnitte und Slice-Kultur-
- Schneiden Sie die LMP-Agarose-Blöcke und kleben sie auf dem Probentisch mit "Superkleber". Nach der Kleber trocken Übertragung der Probentisch in die Pufferwanne des Vibratom und füllen mit eiskaltem HBSS abzuschließen, bis der Block in die Lösung eingetaucht.
HINWEIS: Sterilisieren Sie alle Instrumenten- und Geräteoberflächen mit 70% Ethanol vor dem Schneiden. - Bereiten 250 um dicken Vibratom Abschnitte mit einer neuen Klinge wie folgt.
- Schneiden Sie die Block with folgenden Einstellungen; Frequenz - 60 Hz, Amplitude - 0,7 um, Geschwindigkeit 16-18 mm / sek. Schneiden Sie die Abschnitte, die mit den obigen Einstellungen bei niedriger Geschwindigkeit (9 mm / s) das gewünschte Gewebe. Ab der Schnitt aus dem Hinterhirn, sammeln 5-7 Abschnitte aus dem Großhirn.
- Übertragen Sie die Teile auf ein sauberes 6 Well-Kulturschale mit 5 ml eiskaltem HBSS mit Hilfe eines gebogenen Spatel zu vollenden und zu halten auf dem Eis, bis alle Abschnitte werden gesammelt (1E).
- Feuchten Sie die Membran in einem Quer Mode mit 100 ul HBSS komplette, bevor die Abschnitte auf der Membran, um die Ausrichtung der Abschnitte zu erleichtern.
- Übertragen Sie die Abschnitte mit einem gebogenen Spatel auf die Membran (abholen eine Ecke des Abschnitts mit einer Pinzette und ziehen auf den Spatel und dann mit der Zange, um den Abschnitt auf die Membran zu drücken). Legen Sie bis zu fünf Abschnitte auf einer Membran und vereinbaren Sie mit einer Pinzette (1F). Nicht überlappen die Abschnitte miteinander.
- Nehmen Sie die überschüssigen HBSS von der Membran mit einer Pipette. Die spezifischen Membranen hier sind an einem Rahmen befestigt ist und in das Gewebekulturplatte, die das Gewebe in Kontakt zu sein, aber nicht durch das Mittel bedeckt ermöglicht eingefügt.
- Setzen Sie die Membraneinsätze in einen 6 Well-Platte mit 1,8 ml Stück Kulturmedium (1.2.5) (Abbildung 1 G, H). Inkubieren der Kulturschale bei 37 ° C mit 5% CO 2 für 11 oder 14 DIV DIV. Ändern Sie die Hälfte des Mediums (0,9 ml) jeden zweiten Tag.
HINWEIS: In diesem Stadium hinzu Reagenzien wie Bromdesoxyuridin (BrdU; 10 & mgr; M Endkonzentration) für die Kennzeichnung von proliferierenden Zellen zu den Medien für die ersten 20 Stunden der Kulturzeit.
5. Fixierung der Sektionen durch Immunfluoreszenzfärbungen Gefolgt
- Verwenden Sie eine saubere und scharfe Skalpellklinge zu schneiden und trimmen die Membranen in Abhängigkeit von der Ausrichtung derdie Abschnitte.
- Übertragen der Abschnitte zusammen mit der Membran auf eine Platte mit 24 Vertiefungen, die 1 ml 4% PFA (1.2.7). Inkubiere die Abschnitte für 1 h bei RT, gefolgt von 3 Waschungen mit 1x PBS für je 15 min. Inkubieren der Abschnitte O / N bei Permeabilisierung Lösung bei 4 ° C unter leichtem Schütteln.
- Am folgenden Tag, Inkubation der Schnitte mit geeigneten primären Antikörper, in Permeabilisierung Lösung verdünnt, O / N oder für 48 Stunden bei 4 ° C unter leichtem Schütteln.
- 3 Mal Waschen Sie die Teile für 15 min mit 1x PBS und Inkubation O / N bei 4 ° C mit den entsprechenden Sekundärantikörper in Permeabilisierung Lösung verdünnt.
- Nach der Inkubation mit sekundären Antikörpern, waschen Sie die Teile einmal mit 1x PBS für 15 min, gefolgt von DAPI-Färbung für 10 min.
- 3 mal mit 1x PBS Waschen Sie die Teile für 15 min je und übertragen auf Objektträger. Fügen ImmunoMount und sanft legen Sie eine Deckglas Sektionen. Trocknen Sie die Dias O / N bei 4 ° C und seal mit Nagellack.
HINWEIS: Halten Sie die Folien immer bei 4 ° C.- Analysieren Sie die Schnittkulturen durch konfokale Mikroskopie (Abbildung 1E).
Ergebnisse
Ablation des Transkriptionsfaktors BCL11B verursacht die Beeinträchtigung der Vorläuferzellproliferation und neuronalen Differenzierung, was zu einer reduzierten Gyrus dentatus Größe und die Zellzahl. Darüber mutierten Neuronen nicht in die Hippocampus-Schaltung verursacht Lern- und Gedächtnisstörungen 8 zu integrieren. Um Fragen bezüglich der regulatorischen Mechanismus (n) des BCL11B in diesen Prozessen ex utero Elektroporation beschäftigt war zu beantworten.
Antworten auf die Frage, ob BCL11B zell autonom regelt neuronalen Zelldifferenzierung, wurden Mosaik Deletionen BCL11B durch ex utero Elektroporation eines GFP-Cre-Rekombinase-Konstrukt oder GFP allein 11 erzeugt wird, in BCL11B flox / flox hippocampi bei E15.5 von organotypischen Kultur verfolgt bis 18 Tage nach der Elektroporation (2A, B, das Bild wurde von 8 verändert wurde). Um festzustellen, ob Bcl11b regelt Differenzierung der Körnerzellen zell autonom Immunfluoreszenzfärbung erfolgte mit spezifischen Antikörpern, die NeuroD sowie GFP. NeuroD in mitotischen Stufen 2b / 3 und frühen postmitotischen Zellen 14 zum Ausdruck gebracht. Wir haben gezeigt, zuvor, dass die Zahl der NeuroD positiven Zellen deutlich in BCL11B bedingte Mutanten zeigt eine Verhaftung der neuronalen Differenzierung 8 erhöht. Während die Anzahl der GFP-positiven Zellen allein und GFP / NeuroD positive Zellen nicht in der Steuerung und Mutantenzellen eine signifikante Erhöhung NeuroD positiven Zellen im Gyrus dentatus denen Zellen hatte Cre Rekombinase erhielten, beobachtet unterscheiden (2C; diese Zahl wurde modifiziert von 8). Finden NeuroD positiven Zellen nicht nur in Zellen, die Cre-Rekombinase erhalten hatte, sondern auch in Wildtyp-Zellen vorgeschlagen, dass indirekte Mechanismen sind in BCL11B Regulierung der neuronalen Zelldifferenzierung beteiligt. Aus diesen Daten wird jedoch additional zellautonome Funktionen BCL11B können nicht ausgeschlossen werden.
Zuvor war Desmoplakin als direkte Zielgens der BCL11B 8 bestimmt. Es wurde auch gezeigt, dass Desmoplakin ist an der Regulation der Vorläuferzellproliferation und Differenzierung von Keratinozyten 15 beteiligt. Um zu zeigen, ob Desmoplakin ist an der Regulation von Vorläuferzellproliferation und / oder die neuronale Differenzierung des Gyrus dentatus Plasmid DNA beteiligt GFP allein oder GFP und Desmoplakin unter der Kontrolle des CMV-Promotors wurde in Kontroll- und BCL11B Mutante Gehirnen (3A elektroporiert exprimieren - C; diese Zahl wurde von 8 verändert wurde). Die Gehirnschnitte wurden für die ersten 20 Stunden in Gegenwart von BrdU (10 & mgr; M Endkonzentration) kultiviert. Am Tag 11 nach der Elektroporation wurden die Scheibe Kulturen wurden durch Immunfärbung BrdU festen gefolgt und die Anzahl der BrdU-positiven Zellen bestimmt. BCL11B Mutante tissue mit GFP elektroporiert enthielt nur deutlich weniger BrdU-positiven Zellen im Vergleich zu Kontrollgewebe. Allerdings Co-Elektroporation von GFP und Desmoplakin rettete die Anzahl der BrdU-positiven Zellen auf ein Niveau zu steuern (Abbildung 3D, diese Zahl wurde von 8 verändert wurde). Zusammengenommen werden diese Daten weiter Desmoplakin bestätigen als direkte Zielgen BCL11B und ihre Rolle bei der Regulation der Vorläuferzellproliferation.

Abbildung 1. Set-up von ex utero Elektroporation und organotypischen Kultur an E15.5. (A) Die Injektion von DNA in einer Hemisphäre. (B) Schematische Darstellung der DNA-Injektion. (C) Elektrodenanlage. (D) Schematische Zeichnung der Platzierung der Elektroden. (E) Vibratom Schneiden und hHandhabung von Hirnschnitten. (F) Platzieren von Hirnschnitten auf bestimmte Membranen. (GI) Hellfeld (G) und Fluoreszenz (H, GFP) Analyse der Schnittkulturen am Tag 1 nach der Elektroporation. (I) konfokale Bild des Gyrus dentatus an Tag 11 nach der Elektroporation mit DAPI und GFP-Färbung. Eine gestrichelte Linie zeigt den Gyrus dentatus. Maßstabsbalken = 100 & mgr; m. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 2. Mosaic Löschung von BCL11B durch ex utero Elektroporation und organotypischen Kultur (8 modifiziert). Elektroporation von Steuervektor pCIG2 allein (A) und pCIG2- Cre conStruktur (B) in den Gyrus dentatus an E15.5 gefolgt von organotypischen Kultur für 18 Tage. Die Schnitte wurden unter Verwendung von Antikörpern, die GFP (grün) und NeuroD (rot) immungefärbt. Einsätze angezeigt GFP (grün) und BCL11B (rot) Färbung bei höherer Vergrößerung um den Verlust von BCL11B Expression in Zellen Cre -recombinase Ausdruck zu demonstrieren. (C) Die statistische Analyse der GFP, NeuroD und GFP / NeuroD positiven Zellen. Eine gestrichelte Linien zeigen die Gyrus dentatus. t-Test, * p <0,005; Fehlerbalken, sd; n = 5. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
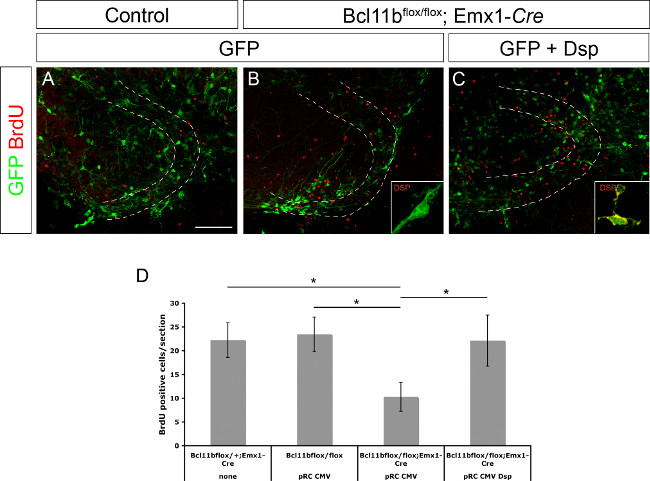
Abbildung 3. BCL11B Phänotyp durch Wiedereinführung der Desmoplakin (von 8 modifiziert) gerettet. GFP nur (A, B) sowie GFP und Desmoplakin (C) in den Gyrus dentatus der Kontrolle (A) und mutierten elektroporiert (B, C) Gehirne bei E15.5 von organotypischen Kultur folgte für 11 Tage. Die Schnitte wurden unter Verwendung von Antikörpern, die GFP (grün) und BrdU (rot). (D) Eine statistische Analyse der BrdU-positiven Zellen immunhistochemisch. Eine gestrichelte Linien zeigen die Gyrus dentatus. Einsätze angezeigt Desmoplakin Färbung (grün) bei höherer Vergrößerung. t-Test, * p <0,01; Fehlerbalken, sem; n = 4. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
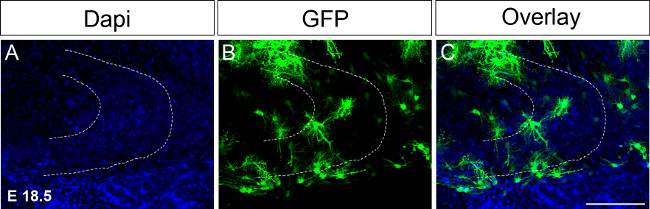
Abbildung 4. Ex utero Elektroporation bei E 18,5, gefolgt von organotypischen Kultur.Die Injektion von DNA, die GFP in einer Hemisphäre gefolgt von Immunfärbung am Tag 16 nach der Elektroporation (A) DAPI-Färbung;. (B) GFP-Färbung, (C) Mischbild. Eine gestrichelte Linie zeigt Gyrus dentatus. Maßstabsbalken = 100 & mgr; m. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
Diskussion
Der Hippocampus hat eine wichtige Funktion bei Lernen und Gedächtnis. Gyrus dentatus ist auch einer der beiden Hirnregionen, wo die Neurogenese tritt nicht nur während der Entwicklung, sondern auch im Erwachsenenalter. Die postnatale und adulte Neurogenese erfolgt in ähnlicher Weise mit vielen Gemeinsamkeiten. Definition der Regulierungsmechanismen dieser Faktoren wird sehr hilfreich für das Verständnis neurodegenerativer Erkrankungen, die wiederum zu neuen Therapien und präventive Maßnahmen zu führen. Um diese Informationen zu erhalten, einen erfordert ein System, um einzelne Zellen zu manipulieren und zu beobachten, sie in ihrer natürlichen Umgebung, wie ex utero Elektroporation gefolgt von organotypischen Kultur demonstriert.
Ex utero Elektroporation wurde zuerst erfolgreich bei der Untersuchung Cortex Entwicklung 11,16 angewendet. Nach unserer Kenntnis Überprüfung der Rolle der BCL11B in Hippocampus-Entwicklung ist die erste Beschreibung von ex utero Elektroporation von DNA in Gyrus dentatus Gewebe 8. Wir basieren unser Protokoll über die von der Polleux Gruppe Studium Cortex Entwicklung 11,12 veröffentlichten Verfahren. Um diese Methode zu den Gyrus dentatus die Größe und Position der Elektroden angepasst werden mussten studieren erfolgreich anzuwenden. Anordnen der negativen Elektrode an der Hirnrinde nahe der Injektionsstelle und der positiven Elektrode an der gegenüberliegenden Seite unterhalb des Ohres verändert die Polarität der Elektroporation und konnte die Einführung von DNA in Zellen des Gyrus dentatus. Korrekte Platzierung der Elektroden und Anlegen eines Stroms von 0,06 bis 0,08 mA erwies sich als sehr wichtige Schritte, um zufriedenstellende Ergebnisse zu erzielen Elektroporation. Zu erhalten, die eine geeignete Strömung hängt hauptsächlich von der richtigen Plazierung der Elektroden, wie oben beschrieben. Weitere wichtige Schritte des Protokolls sind Einspritzen des Materials in die Herzkammer sowie die Handhabung der Scheiben nach dem Vibratom Schnitte. Das Hirngewebe wird nicht während des gesamten Verfahrens festgelegt unddaher das Gewebe ist sehr weich und leicht zerstörbar bei der Übertragung von der Vibratom auf die Membran für den Anbau. Bereiche müssen auch mit Sorgfalt beim Start der Immunfärbung behandelt werden. Mit diesen Änderungen und Überlegungen Manipulationen an Einzelzellen des Gyrus dentatus wurden erfolgreich durchgeführt Beantwortung von Fragen in Bezug auf BCL11B Regulierung der frühen Entwicklung Hippocampus (Abbildung 2 und 3; diese Zahlen sind 8 verändert wurde).
Wie oben erwähnt, die Manipulation einzelner Zellen und beobachten ihr Schicksal ist der große Vorteil von ex utero Elektroporation. Ein Hauptnachteil der ex utero-Ansatz im Vergleich zu in utero Elektroporation ist die begrenzte Zeit, um Scheiben in Kultur zu halten. Es ist auch möglich, dass ex utero Kultivierungsbedingungen kann eine Verzögerung bei der Entwicklung verursachen. In unseren Experimenten bisher konnten wir die Scheiben in Kultur zu halten up bis 18 Tagen, die bis zum Alter von P14 entspricht. Kultivierung von organotypischen Slices über diese Zeit hinaus, um den Zerfall des Gewebes führen. Ein zusätzlicher Nachteil des ex utero-Ansatz ist die begrenzte Anzahl der Embryonen, die pro Mutter elektroporiert werden kann. Im Gegensatz zu den in utero Elektroporation in denen bis zu 8 Embryonen können diese Nummer behandelt werden ist auf 4 Embryonen in der ex utero Ansatz. Dissektion der Embryonen, Elektroporation Vibratom Schnitte und den Transfer der Scheiben in Kulturbedingungen haben, in einer kurzen Zeit durchgeführt werden, um erfolgreiche Schnittkulturen sicherzustellen.
Da Großveranstaltungen des Gyrus dentatus Entwicklung zwischen P14 und P30 auftreten, es wäre notwendig, organotypischen Slices in Kultur über längere Zeiträume zu halten. In einem ersten Versuch, die Kultur zu erweitern wurden Zeit Elektroporationen bei E 18,5 geführt Einstellen der Bedingungen entsprechend (Abbildung 4, siehe Protokoll). Elektroporation in thwird Zeitpunkt ermöglicht halten die Hirnschnitte in Kultur bis P17 oder 18. Zusätzlich die Hippocampus weiter bei E 18,5 entwickelt im Vergleich zu E 15.5, zum Beispiel sind hippocampale Strukturen bereits gebildet und leicht zu erkennen. In Zukunft möchten wir ex utero Elektroporation bei noch späteren Zeitpunkten auf P4 durchführen, beispielsweise P0 um Schäden während der Gyrus dentatus Entwicklung bis P30 zu untersuchen.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
This work was supported by grants from the Deutsche Forschungsgemeinschaft to SB (BR-2215; SFB 497/A9).
Materialien
| Name | Company | Catalog Number | Comments |
| Flaming/ Brown Micropipette Puller | Sutter Instruments Company (USA) | P-97 | |
| Fine Glass Pipettes | Warner Instruments | G100F-4 | |
| Microgrinder | Narishige, Japan | EG-44 | |
| Anesthetic Bracket unit | Harvard Apparatus | PY2 34-0412 | |
| Halovet Vaporizer | Harvard Apparatus | PY2 34-0398 | |
| Fluovac System | Harvard Apparatus | PY2 34-0387 | |
| IMS Fluosorber | Harvard Apparatus | PY2 34-0415 | |
| Anesthetizing Chamber | Harvard Apparatus | PY2 34-0460 | |
| Electroporator | BEX Company | CUY21 EDIT | |
| Tweezers with disk electrodes | BEX Company | LF650P3 | 3 mm electrodes for E15.5 |
| Tweezers with disk electrodes | BEX Company | LF650P5 | 5 mm electrodes for E18.5 |
| Picospritzer III | Parker Hannifin Corporation | P/N 052-0500-900 | |
| HM 650 V Vibrating Blade Microtome, 230 V | Thermo Scientific | 920120 | |
| Dissection Microscope | Carl Zeiss Microscopy Gmbh | Stemi SV8 | |
| Inverted Microscope | Leica | Leica DM IL LED | |
| Confocal Microscope | Leica | Sp5II | |
| 6 well dish | BD Falcon | #353502 | |
| 6 well dish | CELLSTAR | #657160 | |
| Tissue culture inserts | BD Falcon | #353090 | |
| Fast Green | Sigma | F7252 | |
| Laminin | Sigma | #L2020 | |
| Poly-L-lysine | Sigma | #P5899 | |
| Spring scissors | Fine Science Tools | 15003-08 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Forceps | Dumont #55 | 11255-20 Inox | |
| HBSS 10x | Life Technology | 14180-046 | |
| BME | Life Technology | 41010-26 |
Referenzen
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends Neurosci. 27, 447-452 (2004).
- Frotscher, M., Zhao, S., Forster, E. Development of cell and fiber layers in the dentate gyrus. Prog Brain Res. 163, 133-142 (2007).
- Muramatsu, R., Ikegaya, Y., Matsuki, N., Koyama, R. Neonatally born granule cells numerically dominate adult mice dentate gyrus. Neuroscience. 148, 593-598 (2007).
- Li, G., Pleasure, S. J. Morphogenesis of the dentate gyrus: what we are learning from mouse mutants. Dev Neurosci. 27, 93-99 (2005).
- Hsieh, J. Orchestrating transcriptional control of adult neurogenesis. Genes Dev. 26, 1010-1021 (2012).
- Li, G., Pleasure, S. J. Genetic regulation of dentate gyrus morphogenesis. Prog Brain Res. 163, 143-152 (2007).
- Collas, P. The current state of chromatin immunoprecipitation. Mol Biotechnol. 45, 87-100 (2010).
- Simon, R., et al. A dual function of Bcl11b/Ctip2 in hippocampal neurogenesis. Embo J. 31, 2922-2936 (2012).
- Pilaz, L. J., Silver, D. L. Live imaging of mitosis in the developing mouse embryonic cortex. J Vis Exp. (88), (2014).
- Pacary, E., et al. Visualization and genetic manipulation of dendrites and spines in the mouse cerebral cortex and hippocampus using in utero electroporation. J Vis Exp. (65), (2012).
- Hand, R., et al. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-62 (2005).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal development. Sci STKE. (136), 19 (2002).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. J Vis Exp. (2), (2007).
- Sugiyama, T., Osumi, N., Katsuyama, Y. The germinal matrices in the developing dentate gyrus are composed of neuronal progenitors at distinct differentiation stages. Dev Dyn. 242, 1442-1453 (2013).
- Lechler, T., Fuchs, E. Desmoplakin: an unexpected regulator of microtubule organization in the epidermis. J Cell Biol. 176, 147-154 (2007).
- Nichols, A. J., O'Dell, R. S., Powrozek, T. A., Olson, E. C. Ex utero electroporation and whole hemisphere explants: a simple experimental method for studies of early cortical development. J Vis Exp. (74), (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten