Method Article
Ex Utero electroporación y organotípicos rebanada Cultura de ratón Hipocampo Tissue
En este artículo
Resumen
Here we present a protocol providing a tool to examine regulatory mechanisms of specific genes during hippocampal development. Employing ex utero electroporation and organotypic slice culture allows the up- and down-regulation of the expression of genes of interest in single cells and follow their fate during development.
Resumen
Mouse genetics offers a powerful tool determining the role of specific genes during development. Analyzing the resulting phenotypes by immunohistochemical and molecular methods provides information of potential target genes and signaling pathways. To further elucidate specific regulatory mechanisms requires a system allowing the manipulation of only a small number of cells of a specific tissue by either overexpression, ablation or re-introduction of specific genes and follow their fate during development. To achieve this ex utero electroporation of hippocampal structures, especially the dentate gyrus, followed by organotypic slice culture provides such a tool. Using this system to generate mosaic deletions allows determining whether the gene of interest regulates cell-autonomously developmental processes like progenitor cell proliferation or neuronal differentiation. Furthermore it facilitates the rescue of phenotypes by re-introducing the deleted gene or its target genes. In contrast to in utero electroporation the ex utero approach improves the rate of successfully targeting deeper layers of the brain like the dentate gyrus. Overall ex utero electroporation and organotypic slice culture provide a potent tool to study regulatory mechanisms in a semi-native environment mirroring endogenous conditions.
Introducción
El hipocampo desempeña un papel importante en la memoria y el aprendizaje, así como el comportamiento emocional. Una función principal consiste en la consolidación de la memoria a corto plazo en memoria a largo plazo, lo que requiere una alta plasticidad del sistema nervioso. El giro dentado del hipocampo actúa como puerta de entrada principal de información de entrada y es también una de las dos regiones del cerebro con la neurogénesis continua a lo largo de la edad adulta 1,2. El desarrollo de la estructura del hipocampo se produce durante la embriogénesis tardía y en particular durante los primeros 3 a 4 semanas después del parto 3. Durante el desarrollo temprano de la circunvolución dentada de un grupo de células madre está establecido requiere para postnatal, así como la neurogénesis adulta 4. Las neuronas en desarrollo pasan a través de diversas etapas, desde la célula madre a través de varias etapas de células progenitoras a los inmaduros y, finalmente, la neurona madura durante postnatal así como la neurogénesis adulta. En diferentes etapas de la neurogénesis la expresión degenes específicos se requiere para permitir la maduración y la integración de nuevas neuronas en los circuitos del hipocampo 5,6.
Usando la genética del ratón y análisis de fenotipo por inmunohistoquímica así como los métodos moleculares permitió definir el patrón de expresión y la función de muchos de estos genes. Además el análisis de microarrays, así como la cromatina immunoprecipitation (CHIP) proporcionado información sobre posibles genes diana directos e indirectos 7,8. Sin embargo, todavía hay muchas preguntas abiertas acerca de los mecanismos de regulación del desarrollo del hipocampo, en particular el desarrollo del giro dentado. Para obtener una mayor comprensión de cómo los genes específicos se regulan un sistema es necesario permitir la manipulación de un pequeño número de células por abajo o sobre regulación del gen de interés y / o de sus genes diana y seguir su destino durante el desarrollo. En electroporación in utero de shRNAs, cDNA de genes de interés o Cre recombinase proporciona una herramienta de este tipo. Para asegurar la presencia del ADN deseado o ARNs pequeños plásmidos de expresión se debe utilizar para la electroporación. Este enfoque se implementa con mucho éxito en el estudio del desarrollo cortical 9,10, pero es un enfoque más difícil examinar el desarrollo de la circunvolución dentada debido a la posición de las estructuras del hipocampo en las capas más profundas del cerebro.
Electroporación utero Ex seguido por cultivo de cortes organotípicos es un enfoque para evitar este problema 11,12. En contraste con la electroporación en el útero no todo el embrión, pero sólo la cabeza se utiliza permitiendo por lo tanto para colocar los electrodos de una manera más favorable para dirigir el shRNA / ADN hacia el hipocampo y la circunvolución dentada. Nuestro grupo emplea con éxito fuera del útero de la electroporación para estudiar el papel del factor de transcripción Bcl11b durante el desarrollo del giro dentado 8. Bcl11b tiene un doble papel en el desarrollo giro dentado por regulating proliferación de células progenitoras, así como la diferenciación como quedó demostrado por inmunohistoquímica. Para definir además un mecanismo para la participación Bcl11b en estos procesos, protocolos del grupo Polleux 11,12 se ajustaron para estudiar la circunvolución dentada como se describe a continuación en la sección de protocolo. En una primera aproximación a la cuestión se abordó si Bcl11b está regulando la diferenciación celular de las células neuronales de forma autónoma. Un segundo enfoque examinó si Desmoplakin, un gen diana directa de Bcl11b, es suficiente para rescatar el fenotipo Bcl11b.
Protocolo
NOTA: Todos los experimentos con animales se llevaron a cabo de acuerdo con la ley alemana y fueron aprobados por las oficinas gubernamentales en Tübingen.
1. Preparación de Micropipetas, Soluciones y Membranas
- Preparación de Micropipetas
- Tire micropipetas de vidrio con un extractor micropipeta con el siguiente programa: Heat: 540, Pull: 125, Velocidad: 20 y Delay: 140. Las cantidades longitud de la aguja a 5,5 cm.
- Agujas de bisel utilizando un microgrinder para obtener un tamaño de la punta adecuada de 4 mm. Almacenar las agujas en una caja o 15 cm placa de Petri que se eviten daños de las puntas.
- Preparación de Soluciones
- Solución de ADN plasmídico
- Preparar ADN de plásmido que contiene el constructo de ADNc deseado utilizando un kit Maxi-prep libre de endotoxina de acuerdo con el protocolo del fabricante.
- Ajuste solución de ADN plasmídico a una concentración final de 3 g / l (sin pico GFP vector) o 4 g /l (con 1 g de GFP pico vector) libre de endotoxinas en tampón Tris-EDTA que contiene verde rápido (concentración final 0,05%).
- Solución de laminina Stock
- Disolver 1 mg de laminina en agua estéril hasta un volumen final de 1 ml. Preparar alícuotas de 100 ly se almacena a -80 ° C.
- Poli-L-Lisina solución Stock
- Disolver 50 mg de poli-L-lisina en 50 ml de agua estéril a una concentración final de 1 mg / ml. Preparar alícuotas de 1 ml y se guardan en -20 ° C.
- Completa solución salina equilibrada de Hank (HBSS completo)
- Preparar completa HBSS mediante la combinación de 100 ml de HBSS 10x, 2,5 ml de 1 M de tampón HEPES (pH 7,4), 30 ml de 1 M D-glucosa, 10 ml de 100 mM CaCl 2, 10 ml de 100 mM MgSO 4, y 4 ml de 1 M de NaHCO3. Añadir agua estéril hasta 1 L y se almacena a 4 ° C.
NOTA: Autoclave todas las soluciones de esperar tampón HEPES 1 M y 1 M D-glucosa, que son filter esterilizado.
- Preparar completa HBSS mediante la combinación de 100 ml de HBSS 10x, 2,5 ml de 1 M de tampón HEPES (pH 7,4), 30 ml de 1 M D-glucosa, 10 ml de 100 mM CaCl 2, 10 ml de 100 mM MgSO 4, y 4 ml de 1 M de NaHCO3. Añadir agua estéril hasta 1 L y se almacena a 4 ° C.
- Rebanada medio de cultivo
- Preparar medio de cultivo rebanada mediante la adición de 35 ml de medio basal de Eagle, 12,9 ml de HBSS completo (1.2.4), 1,35 ml de 1 M D-glucosa, 250 l de 200 mM de L-glutamina, y 500 l de penicilina-estreptomicina a obtener un volumen final de 50 ml. Añadir suero de caballo a una concentración final de 5% y se almacena a 4 ° C.
- Punto de bajo punto de fusión (LMP) de agarosa
- Preparar una solución de agarosa LMP 4% mediante la adición de 2 g de agarosa LMP a 50 ml de HBSS completo (1.2.4), seguido por calentamiento en un horno de microondas durante 1-2 minutos a alta potencia. Mantener esta solución en un baño de agua a 37-39 ° C. Guarde la solución a 4 ° C y la reutilización.
- Solución de paraformaldehído
- En una campana de humos preparar una solución de 4% de paraformaldehído (PFA) mediante la adición de 4 g de paraformaldehído a 100 ml de PBS 1x. Calentar la solución a 60 ° C y añadir unas gotas de NaOH 1 N hasta que la solución se convierte en clear.
- Solución de permeabilización
- Disolver 9 g de BSA en 300 ml de 1x PBS que contenía 0,3% Triton X-100 y se almacena a 4 ° C. Añadir 10% de azida de sodio para almacenamiento a largo plazo.
- Solución de ADN plasmídico
- Recubrimiento de insertos de membrana
- Diluir una alícuota de solución de stock laminina (1.2.2) y una parte alícuota de solución madre de poli-L-lisina (1.2.3) en agua estéril hasta un volumen final de 12 ml.
- Coloque los insertos de membrana en placas de 6 pocillos conteniendo cada pocillo 2 ml de agua estéril. Añadir 1 ml de solución de recubrimiento en la parte superior de la membrana y se incuba O / N a 37 ° C en un incubador de CO2 5%.
- Después de la incubación se lava la membrana inserta tres veces con 1 ml de agua estéril y seco. Use protectores de membrana recubiertos en el mismo día o se almacena a 4 ° C durante un máximo de cuatro semanas en una placa bien seco 6.
2. Inyección de ADN y la electroporación de E15.5 y E18.5 embriones
- Anestesie la vez acoplado hembra de ratón colocándolo en una cámara de anestesiante saturado con 5% de isoflurano y conectado a un vaporizador. Circular isoflurano y oxígeno a una velocidad de 1 L / min. Mantenga el animal en el cuadro de 2-4 minutos o hasta inconsciente que se prueba apretando entre las patas del ratón.
- La eutanasia del ratón inconsciente por dislocación cervical en el día embrionario (E) 15.5 o 18.5. Diseccionar el útero contiene los embriones 13 y colocarlo en una placa de Petri que contiene 15 a 20 ml de HBSS frío completa.
NOTA: A partir de este punto en adelante, mantener los embriones y tejidos en el hielo. - Use un par de tijeras para separar cada embrión a partir del cuerno uterino y el lugar en una segunda placa de Petri que contiene HBSS fría completa.
- Bajo un microscopio de disección, cortar la pared muscular uterina y la placenta usando un par de pinzas finas (# 55) y tijeras. Suelte con cuidado el embrión desde el saco vitelino.
- Use un par de tijeras de Bonn de decapitate los embriones justo por encima de las patas delanteras en un ángulo de 60 °. Si el experimento requiere el genotipado de los embriones, se recoge una muestra de tejido para el aislamiento de ADN genómico (un pequeño trozo de la cola).
- Transferir la cabeza a un plato limpio y seco Petri. Debido a que la cabeza había sido decapitado en un ángulo de 60 °, la cabeza debe incline hacia un lado cuando se coloca dorsal hacia arriba.
- Coloque una aguja cuidadosamente en el centro del hemisferio cerca de la bregma (Figura 1A, B). Inyectar aproximadamente 2-3 l (en 3 o 4 g / l) de solución de ADN pisando el pedal del Picospritzer III usando 30 libras de presión para la duración de 10-15 ms por impulso, aplicando 5-8 pulsos. La duración y el número de los impulsos depende del diámetro de la abertura de la aguja con aberturas más pequeñas que requieren más tiempo. El intervalo entre cada pulso asciende a 1 seg.
- Antes de colocar los electrodos, aplique unas gotas de HBSS completo en la cabeza del embryo. Coloque los electrodos de tal manera que el terminal "negativo 'está en el mismo lado que el ventrículo inyectado y el electrodo" positiva "en el lado opuesto del ventrículo inyectada debajo de la oreja de la cabeza del embrión (Figura 1C, D). Aplicar 5 pulsos de 50 V.
- Utilice 3 electrodos mm para E 15.5 y 5 mm para electrodos E 18.5.
3. La disección del cerebro
- Después de la electroporación, retire la piel de la cabeza con la ayuda de un par de pinzas finas. El uso de un par de tijeras de primavera hacer una pequeña incisión en el medio del cerebelo en la línea media del cráneo.
- Inserte las tijeras de primavera en la incisión y cortar longitudinalmente a lo largo de la sutura sagital. Despegar la calavera y separar el cerebro del cráneo mediante el uso de unas pinzas finas. Transfiera todo el cerebro en 15-20 solución HBSS completa ml frío.
- Mientras tanto, se vierte 4% de agarosa LMP,se mantiene a 37-39 ° C en un baño de agua, en un molde de desprendimiento.
- Tome el cerebro de la completa HBSS por una espátula pequeña pala y drenar el exceso de HBSS usando un pañuelo de papel fino o Kimwipes.
- Coloque todo el cerebro suavemente en la agarosa y ajuste su posición con una aguja fina. Mantener el molde en hielo hasta que la agarosa se solidifica y el bloque se secciona (para secciones coronales los bulbos olfativos apuntan hacia arriba).
4. Vibratome Seccionamiento y rebanada Cultura
- Recorte los bloques de agarosa LMP y pegarlas en la platina utilizando 'pegamento'. Después de que el pegamento se seca la fase de transferencia de la muestra a la bandeja de amortiguamiento de la vibratome y llene de hielo frío completar HBSS hasta que el bloque se encuentra inmersa en la solución.
NOTA: Esterilizar todas las superficies de instrumentos y equipos con etanol al 70% antes de la sección. - Preparar 250 micras vibratome secciones gruesas utilizando una nueva hoja de la siguiente manera.
- Recorte el wi bloqueº los siguientes ajustes; frecuencia - 60 Hz, amplitud - 0.7 micras, velocidad 16 a 18 mm / seg. Cortar las secciones que contienen el tejido deseado con los ajustes anteriores a velocidad lenta (9 mm / seg). Inicio del seccionamiento de la parte posterior del cerebro, recoger 5-7 secciones del cerebro.
- Transferencia de las secciones a una placa de cultivo de 6 pocillos limpia que contiene 5 ml de HBSS enfriado con hielo completar con la ayuda de una espátula doblada y mantener en hielo hasta que todas las secciones se recogen (Figura 1E).
- Humedecer la membrana de una manera cruzada con 100 l de HBSS completo antes de colocar las secciones en la membrana, para facilitar la orientación de las secciones.
- Transferir las secciones usando una espátula doblada sobre la membrana (recoger un rincón de la sección con unas pinzas y tire a la espátula y luego usar el fórceps para empujar la sección sobre la membrana). Coloque un máximo de cinco secciones en una membrana y organizar mediante el uso de fórceps (Figura 1F). No superponga las secciones entre sí.
- Tome el exceso de HBSS fuera de la membrana utilizando una pipeta. Las membranas específicas utilizadas aquí están unidos a un bastidor y se insertan en la placa de cultivo de tejido, lo que permite que el tejido esté en contacto pero no cubierto por el medio.
- Coloque los insertos de membrana en una placa de 6 pocillos que contiene 1,8 ml de medio de cultivo slice (1.2.5) (Figura 1G, H). Incubar la placa de cultivo a 37 ° C con 5% de CO2 durante 11 o 14 DIV DIV. Cambiar la mitad del medio (0,9 ml) cada segundo día.
NOTA: En esta etapa, añadir los reactivos como bromodesoxiuridina (BrdU; 10 mM concentración final) para el etiquetado de la proliferación de células a los medios de comunicación por primera 20 horas del tiempo de cultivo.
5. Fijación de las Secciones Seguido por inmunofluorescencia tinción
- Utilice una hoja de bisturí limpio y afilado para cortar y recortar las membranas, dependiendo de la orientación delas secciones.
- Transferencia de las secciones, junto con la membrana a una placa de 24 pocillos que contenía 1 ml de PFA al 4% (1.2.7). Incubar las secciones durante 1 hora a RT seguido de 3 lavados con PBS 1x durante 15 min cada uno. Incubar las secciones O / N con solución de permeabilización a 4 ° C con agitación suave.
- El día siguiente, se incuban las secciones con anticuerpos primarios apropiados, diluidos en solución de permeabilización, O / N o durante 48 horas a 4 ° C con agitación suave.
- Lávese las secciones 3 veces durante 15 minutos con PBS 1x y se incuba O / N a 4 ° C con los anticuerpos secundarios apropiados diluido en solución de permeabilización.
- Después de la incubación con anticuerpos secundarios, lavar las secciones una vez con 1x PBS durante 15 min seguido de tinción con DAPI durante 10 min.
- Lávese las secciones 3 veces con 1x PBS durante 15 minutos cada uno y traslado al microscopio. Añadir ImmunoMount y colocar suavemente un cubreobjetos en la parte superior de las secciones. Seque el portaobjetos O / N a 4 ° C y seal con esmalte de uñas.
NOTA: Mantenga siempre las diapositivas a 4 ° C.- Analizar los cultivos de corte por microscopía confocal (Figura 1I).
Resultados
La ablación del factor de transcripción Bcl11b hace que el deterioro de la proliferación de células progenitoras y la diferenciación neuronal que resulta en un tamaño giro dentado reducida y número de células. Además neuronas mutantes no pueden integrarse en los circuitos del hipocampo causando el aprendizaje y el deterioro de la memoria 8. Para responder a preguntas sobre el mecanismo regulador (s) de Bcl11b en estos procesos se empleó electroporación ex utero.
Abordar la cuestión de si Bcl11b células de manera autónoma regula la diferenciación de las células neuronales, las supresiones de mosaico de Bcl11b fueron generados por fuera del útero de la electroporación de una construcción de la recombinasa Cre GFP o GFP solo 11 en Bcl11b flox / flox hipocampos en E15.5 seguido por cultivo de cortes organotípicos arriba 18 días después de la electroporación (Figura 2A, B, cifra que se ha modificado a partir de 8). Para determinar si Bcl11b regula la diferenciación de las células granulares células de manera autónoma la tinción de inmunofluorescencia se realizó usando anticuerpos específicos que reconocen NeuroD, así como GFP. NeuroD se expresa en las etapas mitóticas 2b / 3 y las células postmitotic primeros 14. Hemos demostrado previamente que el número de células positivas NeuroD es significativamente mayor en Bcl11b mutantes condicionales que indican una detención de la diferenciación neuronal 8. Mientras que el número de células positivas GFP sola y células positivas / NeuroD GFP no fue diferente en las células control y mutantes se observó un aumento significativo en las células NeuroD positivos en el giro dentado donde las células habían recibido la recombinasa Cre (Figura 2C; esta figura se ha modificado de 8). Encontrar células positivas NeuroD no sólo en las células que habían recibido la recombinasa Cre, sino también en las células de tipo salvaje sugiere que los mecanismos indirectos están involucrados en la regulación de la diferenciación celular Bcl11b neuronal. A partir de estos datos, sin embargo, Additfunciones de las células autónomas ional de Bcl11b no pueden ser excluidas.
Anteriormente, Desmoplakin se determinó como un gen diana directa de Bcl11b 8. También se demostró que la JUP, está involucrado en la regulación de la proliferación de células progenitoras y la diferenciación de los queratinocitos 15. Para demostrar si Desmoplakin está implicado en la regulación de la proliferación de células progenitoras y / o diferenciación neuronal del ADN plásmido giro dentado que expresan GFP solo o GFP y Desmoplakin bajo el control del promotor de CMV se sometió a electroporación en control y Bcl11b cerebros mutantes (Figura 3A - C, cifra que se ha modificado de 8). Los cortes de cerebro se cultivaron durante la primera 20 hr en la presencia de BrdU (concentración final 10 mM). En el día 11 después de la electroporación los cultivos de corte se fija seguida de BrdU inmunotinción y se determinó el número de células BrdU positivas. Bcl11b tissu mutantee electroporación con GFP sólo contenía significativamente menos células BrdU positivas en comparación con el tejido control. Sin embargo, co-electroporación de GFP y Desmoplakin rescató el número de células BrdU positivas para controlar los niveles (Figura 3D; esta figura se ha modificado a partir de 8). Tomados en conjunto estos datos confirman además JUP, como un gen diana directa de Bcl11b y su papel en la regulación de la proliferación de células progenitoras.

Figura 1. Configuración del ex utero electroporación y cultivo de cortes organotípicos en E15.5. (A) La inyección de ADN en un hemisferio. (B) Esquema de la inyección de ADN. (C) Colocación de los electrodos. (D) Esquema dibujo de colocación de los electrodos. (E) Vibratome seccionar y hANIPULACIÓN de las secciones del cerebro. (F) La colocación de secciones de cerebro en membranas específicas. (GI) de campo brillante (G) y de fluorescencia (H, GFP) el análisis de cultivos de cortes en el día 1 después de la electroporación. (I) imagen confocal del giro dentado en el día 11 después de la electroporación mediante DAPI y las buenas prácticas agrarias. La línea de puntos indica el giro dentado. Barra de escala = 100 micras. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Mosaico eliminación de Bcl11b mediante electroporación in utero ex y la cultura rebanada organotípico (modificado de 8). La electroporación de control de vectores pCIG2 sola (A) y pCIG2- Cre construct (B) en el giro dentado en E15.5 seguido por cultivo de cortes organotípicos durante 18 días. Las secciones se immunostained utilizando anticuerpos que reconocen GFP (verde) y NeuroD (rojo). Inserciones muestran GFP (verde) y Bcl11b (rojo) tinción a mayor aumento para demostrar la pérdida de expresión Bcl11b en células que expresan Cre -recombinase. (C) El análisis estadístico de GFP, NeuroD y células positivas / NeuroD GFP. Las líneas discontinuas indican el giro dentado. t-test, * p <0,005; barras de error, sd; n = 5. Haga clic aquí para ver una versión más grande de esta figura.
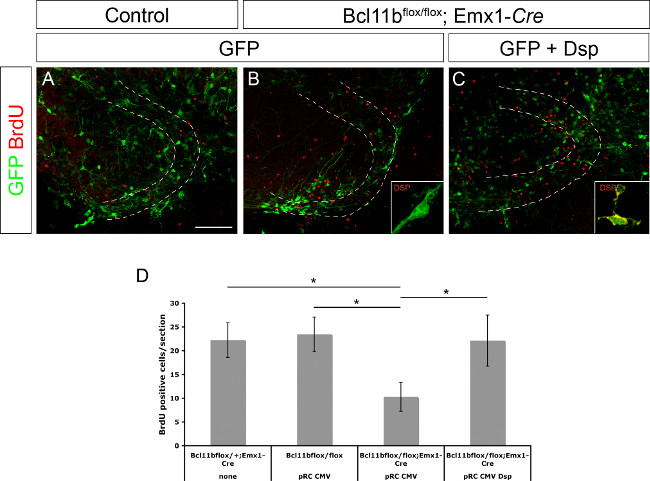
Figura 3. Bcl11b fenotipo es rescatado por la re-introducción de la JUP (modificado de 8). Sólo GFP (A, B), así como GFP y Desmoplakin (C) se sometieron a electroporación en la circunvolución dentada de control (A) y mutante (B, C) cerebros en E15.5 seguido por cultivo de cortes organotípicos durante 11 días. Las secciones se inmunotiñeron utilizando anticuerpos que reconocen GFP (verde) y BrdU (rojo). (D) Análisis estadístico de las células BrdU positivas. Las líneas discontinuas indican el giro dentado. Inserciones muestran tinción JUP (verde) a mayor aumento. t-test, * p <0,01; barra de error, sem; n = 4. Haga clic aquí para ver una versión más grande de esta figura.
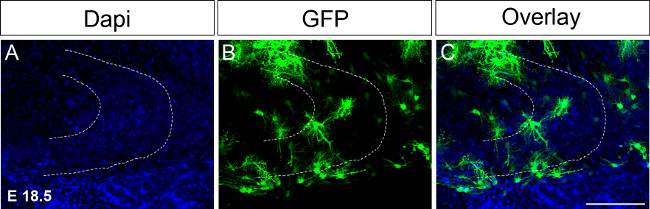
Figura 4. Ex electroporación in utero en E 18.5 seguido por cultivo de cortes organotípicos.La inyección de ADN que expresa GFP en un hemisferio seguido de inmunotinción en el día 16 después de la electroporación (A) tinción DAPI;. (B) Tinción GFP; (C) se fusionó imagen. La línea de puntos indica el giro dentado. Barra de escala = 100 micras. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El hipocampo tiene una función importante en el aprendizaje y la memoria. El giro dentado es también una de las dos regiones del cerebro donde se produce la neurogénesis no sólo durante el desarrollo sino también durante la edad adulta. Postnatal y adulto neurogénesis del hipocampo procede de manera similar que implica muchos factores comunes. La definición de los mecanismos de regulación de estos factores va a ser muy útil en la comprensión de las enfermedades neurodegenerativas que a su vez dará lugar a nuevas terapias y medidas preventivas. Para obtener esta información se requiere un sistema para manipular células individuales y observarlos en su entorno nativo como se demuestra por electroporación ex utero seguido por cultivo de cortes organotípicos.
Electroporación in utero Ex se aplicó por primera vez con éxito en el estudio de desarrollo de la corteza 11,16. Por lo que sabemos que examina el papel de Bcl11b en el desarrollo del hipocampo es el primero que describe la electroporación ex utero de DNA en giro dentado tejido 8. Basamos nuestro protocolo sobre los métodos publicados por el grupo Polleux estudio del desarrollo cortical 11,12. Para aplicar con éxito este método para estudiar el giro dentado del tamaño y la posición de los electrodos tuvieron que ser ajustados. La colocación del electrodo negativo en la corteza cerca del sitio de inyección y el electrodo positivo en el sitio opuesto debajo de la oreja cambió la polaridad de la electroporación y tuvieron éxito en la introducción de ADN en las células de la circunvolución dentada. La colocación de los electrodos correctamente y aplicando una corriente de 0,06-0,08 mA resultó ser pasos muy cruciales para lograr resultados satisfactorios de electroporación. Para obtener la corriente más adecuada depende principalmente de la correcta colocación de los electrodos como se describe anteriormente. Pasos críticos adicionales del protocolo están inyectando el material en el ventrículo, así como el manejo de las rodajas después de seccionamiento vibratome. El tejido cerebral no es fija durante todo el procedimiento yPor lo tanto, el tejido es muy suave y fácilmente destructible cuando se transfiere de la vibratome sobre la membrana para el cultivo. Las secciones también tienen que ser manejados con mucho cuidado cuando se inicia la inmunotinción. Con estas modificaciones y consideraciones manipulaciones de las células individuales de la circunvolución dentada fueron realizadas con éxito respondiendo a las preguntas relativas a la regulación Bcl11b de desarrollo temprano hipocampo (Figura 2 y 3; estas cifras se han modificado de 8).
Como se mencionó anteriormente la manipulación de células individuales y observar su destino es la principal ventaja de la electroporación ex utero. Un inconveniente importante del enfoque ex utero en comparación con la electroporación en el útero es el tiempo limitado para mantener las rebanadas en cultivo. También es posible que las condiciones de cultivo ex utero pueden provocar un retraso en el desarrollo. En nuestros experimentos hasta ahora hemos sido capaces de mantener las rebanadas en la cultura up a 18 días lo que corresponde a la edad de P14. El cultivo de las rebanadas organotípicos más allá de este tiempo conducen a la desintegración del tejido. Una desventaja adicional del enfoque ex utero es el limitado número de embriones que se pueden electroporación según la madre. En contraste con electroporación en el útero donde hasta 8 embriones se pueden tratar este número está limitado a 4 embriones en el enfoque ex utero. Disección de los embriones, la electroporación, vibratome seccionamiento y la transferencia de las rebanadas en condiciones de cultivo tienen que realizarse en un corto tiempo para asegurar cultivos de cortes de éxito.
Debido a los grandes eventos de desarrollo giro dentado se producen entre P14 y P30 que sería necesario mantener las rebanadas organotípicos en cultivo durante períodos de tiempo prolongados. En un primer intento de extender la cultura electroporaciones de tiempo se realizaron a E 18,5 ajuste de las condiciones en consecuencia (Figura 4; véase el protocolo). Electroporación en el thes punto de tiempo permite mantener las secciones del cerebro en la cultura hasta P17 o 18. Además, la formación del hipocampo se desarrolla más en E 18.5 en comparación con 15.5 E, por ejemplo, las estructuras del hipocampo ya están formados y más fácilmente reconocible. En el futuro nos gustaría llevar a cabo fuera del útero de la electroporación en incluso posteriores puntos de tiempo, por ejemplo, P0 a P4 para examinar los cambios durante el desarrollo del giro dentado hasta P30.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
This work was supported by grants from the Deutsche Forschungsgemeinschaft to SB (BR-2215; SFB 497/A9).
Materiales
| Name | Company | Catalog Number | Comments |
| Flaming/ Brown Micropipette Puller | Sutter Instruments Company (USA) | P-97 | |
| Fine Glass Pipettes | Warner Instruments | G100F-4 | |
| Microgrinder | Narishige, Japan | EG-44 | |
| Anesthetic Bracket unit | Harvard Apparatus | PY2 34-0412 | |
| Halovet Vaporizer | Harvard Apparatus | PY2 34-0398 | |
| Fluovac System | Harvard Apparatus | PY2 34-0387 | |
| IMS Fluosorber | Harvard Apparatus | PY2 34-0415 | |
| Anesthetizing Chamber | Harvard Apparatus | PY2 34-0460 | |
| Electroporator | BEX Company | CUY21 EDIT | |
| Tweezers with disk electrodes | BEX Company | LF650P3 | 3 mm electrodes for E15.5 |
| Tweezers with disk electrodes | BEX Company | LF650P5 | 5 mm electrodes for E18.5 |
| Picospritzer III | Parker Hannifin Corporation | P/N 052-0500-900 | |
| HM 650 V Vibrating Blade Microtome, 230 V | Thermo Scientific | 920120 | |
| Dissection Microscope | Carl Zeiss Microscopy Gmbh | Stemi SV8 | |
| Inverted Microscope | Leica | Leica DM IL LED | |
| Confocal Microscope | Leica | Sp5II | |
| 6 well dish | BD Falcon | #353502 | |
| 6 well dish | CELLSTAR | #657160 | |
| Tissue culture inserts | BD Falcon | #353090 | |
| Fast Green | Sigma | F7252 | |
| Laminin | Sigma | #L2020 | |
| Poly-L-lysine | Sigma | #P5899 | |
| Spring scissors | Fine Science Tools | 15003-08 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Forceps | Dumont #55 | 11255-20 Inox | |
| HBSS 10x | Life Technology | 14180-046 | |
| BME | Life Technology | 41010-26 |
Referencias
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends Neurosci. 27, 447-452 (2004).
- Frotscher, M., Zhao, S., Forster, E. Development of cell and fiber layers in the dentate gyrus. Prog Brain Res. 163, 133-142 (2007).
- Muramatsu, R., Ikegaya, Y., Matsuki, N., Koyama, R. Neonatally born granule cells numerically dominate adult mice dentate gyrus. Neuroscience. 148, 593-598 (2007).
- Li, G., Pleasure, S. J. Morphogenesis of the dentate gyrus: what we are learning from mouse mutants. Dev Neurosci. 27, 93-99 (2005).
- Hsieh, J. Orchestrating transcriptional control of adult neurogenesis. Genes Dev. 26, 1010-1021 (2012).
- Li, G., Pleasure, S. J. Genetic regulation of dentate gyrus morphogenesis. Prog Brain Res. 163, 143-152 (2007).
- Collas, P. The current state of chromatin immunoprecipitation. Mol Biotechnol. 45, 87-100 (2010).
- Simon, R., et al. A dual function of Bcl11b/Ctip2 in hippocampal neurogenesis. Embo J. 31, 2922-2936 (2012).
- Pilaz, L. J., Silver, D. L. Live imaging of mitosis in the developing mouse embryonic cortex. J Vis Exp. (88), (2014).
- Pacary, E., et al. Visualization and genetic manipulation of dendrites and spines in the mouse cerebral cortex and hippocampus using in utero electroporation. J Vis Exp. (65), (2012).
- Hand, R., et al. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-62 (2005).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal development. Sci STKE. (136), 19 (2002).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. J Vis Exp. (2), (2007).
- Sugiyama, T., Osumi, N., Katsuyama, Y. The germinal matrices in the developing dentate gyrus are composed of neuronal progenitors at distinct differentiation stages. Dev Dyn. 242, 1442-1453 (2013).
- Lechler, T., Fuchs, E. Desmoplakin: an unexpected regulator of microtubule organization in the epidermis. J Cell Biol. 176, 147-154 (2007).
- Nichols, A. J., O'Dell, R. S., Powrozek, T. A., Olson, E. C. Ex utero electroporation and whole hemisphere explants: a simple experimental method for studies of early cortical development. J Vis Exp. (74), (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados