Method Article
小鼠海马组织的前子宫内电和器官切片文化
摘要
Here we present a protocol providing a tool to examine regulatory mechanisms of specific genes during hippocampal development. Employing ex utero electroporation and organotypic slice culture allows the up- and down-regulation of the expression of genes of interest in single cells and follow their fate during development.
摘要
Mouse genetics offers a powerful tool determining the role of specific genes during development. Analyzing the resulting phenotypes by immunohistochemical and molecular methods provides information of potential target genes and signaling pathways. To further elucidate specific regulatory mechanisms requires a system allowing the manipulation of only a small number of cells of a specific tissue by either overexpression, ablation or re-introduction of specific genes and follow their fate during development. To achieve this ex utero electroporation of hippocampal structures, especially the dentate gyrus, followed by organotypic slice culture provides such a tool. Using this system to generate mosaic deletions allows determining whether the gene of interest regulates cell-autonomously developmental processes like progenitor cell proliferation or neuronal differentiation. Furthermore it facilitates the rescue of phenotypes by re-introducing the deleted gene or its target genes. In contrast to in utero electroporation the ex utero approach improves the rate of successfully targeting deeper layers of the brain like the dentate gyrus. Overall ex utero electroporation and organotypic slice culture provide a potent tool to study regulatory mechanisms in a semi-native environment mirroring endogenous conditions.
引言
海马起着记忆和学习中起重要作用,以及情感行为。其中一个主要功能包括整合的短期记忆转化为长期记忆,这需要神经系统的可塑性高的。海马的齿状回充当用于输入信息的主网关,也是两个脑区与正在进行的神经发生1整个成年期1,2。海马结构的发育过程中胚胎发育后期,尤其在最初3〜4周,产后3时。在齿状的早期发展回中需要设一个干细胞库是用于产后以及成年神经4。显影神经元产后以及成年神经发生过程中通过各种阶段,从干细胞通过祖细胞向未成熟和最后的成熟神经元的几个阶段。在神经发生中的表达的不同阶段特定的基因是必需的,以允许成熟和集成新的神经元的进海马电路5,6。
用小鼠遗传学和免疫表型分析,以及允许定义许多这些基因的表达模式和功能分子方法。在另外的微阵列分析,以及染色质免疫沉淀(ChIP)提供关于潜在的直接和间接的靶基因7,8-信息。然而,仍然有关于海马发育的调控机制许多悬而未决的问题,在齿状回尤其是发展。通过向下或向上调节的兴趣和/或它的靶基因和发育过程中按照它们的命运的基因的进一步了解如何特定基因调节的系统是必需的,允许小数量的单元的操作, 在子宫内电的shRNA,利息或Cre重组酶毒素重组基因的cDNA的本身提供了这样一种工具。以确保所希望的DNA或小RNA表达质粒应当用于电穿孔的存在。这种做法是非常成功实施的研究皮质发育9,10,但它是一个更具挑战性的方法检查齿状回中的发展,由于海马结构的更深层次的脑的位置。
前子宫内电后器官切片文化是一种方法来解决这个问题11,12。与此相反,以在子宫内电不是整个胚胎但只有头部被用于允许因此放置电极以更有利的方式直接向海马和齿状回shRNA的/ DNA。我们的团队成功地采用前子宫内电齿状回中的发展过程中8,研究转录因子BCL11B的作用。 BCL11B在齿状回中的发展为r的双重角色egulating祖细胞的增殖和分化的证明了免疫组化。进一步定义了一种机制,BCL11B参与这些过程中,Polleux组11,12的协议进行了调整,以研究在协议部分下面描述的齿状回。在第一种方法的问题是解决BCL11B是否自主调节神经细胞分化的细胞。第二种方法检查桥粒,BCL11B的直接靶基因是否足以拯救BCL11B表型。
研究方案
注:所有的动物进行了实验,按照德国法律,并批准了在图宾根的政府部门。
1.准备微量移液器,解决方案和膜的
- 微量移液器的制备
- 使用微量拉马与以下程序拉玻璃微:热量:540,拉:125,速度:20和延迟:140针长度达5.5公分。
- 使用microgrinder斜角针来获得4mm的合适的喷嘴尺寸。保存在盒子或15厘米培养皿针,以防止损坏的提示。
- 溶液的制备
- 质粒DNA溶液
- 制备含有根据制造商的协议使用不含内毒素马克西-prep试剂盒的所需的cDNA构建体的质粒DNA。
- 调整质粒DNA溶液至3微克/微升的最终浓度(不GFP穗载体)或4微克/μL(含1微克GFP秒杀载体)中的内毒素释放含固绿(终浓度为0.05%)的Tris-EDTA缓冲。
- 层粘连蛋白原液
- 溶解1毫克的层粘连蛋白在无菌水中,以1毫升的最终体积。制备100微升等分试样并储存在-80℃。
- 聚L-赖氨酸原液
- 溶解在50ml无菌水中50毫克聚L-赖氨酸,以1毫克/毫升的最终浓度。准备1ml等份并储存在-20℃。
- 完成Hank氏平衡盐溶液(HBSS完成)
- 准备完成的HBSS通过将100毫升10×HBSS,2.5毫升的1M HEPES缓冲液(pH7.4)中,加入30ml的1M D-葡萄糖,加入10ml的100mM的氯化钙 ,将10毫升的100mM的硫酸镁 ,和4毫升的1M的NaHCO 3。加无菌水至1升,并储存在4℃。
注:高压灭菌的所有解决方案期望的1M HEPES缓冲液和1M D-葡萄糖,这是FIL器消毒。
- 准备完成的HBSS通过将100毫升10×HBSS,2.5毫升的1M HEPES缓冲液(pH7.4)中,加入30ml的1M D-葡萄糖,加入10ml的100mM的氯化钙 ,将10毫升的100mM的硫酸镁 ,和4毫升的1M的NaHCO 3。加无菌水至1升,并储存在4℃。
- 切片培养基
- 通过加入35毫升基础培养基鹰,12.9毫升完整的HBSS(1.2.4),1.35毫升的1M D-葡萄糖,250微升200mM的L-谷氨酰胺,和500微升制备切片培养基青霉素 - 链霉素,以获得50 ml的终体积。添加马血清至5%的终浓度,并储存在4℃。
- 低熔点(LMP)琼脂糖
- 通过加入2克LMP琼脂糖至50ml完整的HBSS(1.2.4),随后加热在微波中以高功率1-2分钟制备4%LMP琼脂糖溶液。保持此解决方案在水浴在37 - 39℃。存储所述溶液在4℃和重用。
- 多聚甲醛溶液
- 在通风橱中通过加入4g多聚甲醛至100毫升的1×PBS中制备的4%多聚甲醛(PFA)的解决方案。加热该溶液至60℃并加入几滴1N的NaOH直至溶液变成C李尔。
- 通透的解决方案
- 溶解9克的BSA在300毫升的1×PBS中含有0.3%Trition X-100和储存在4℃。加10%的叠氮化钠于长期贮存。
- 质粒DNA溶液
- 插入膜涂层
- 稀释的层粘连蛋白原液(1.2.2)和在无菌水中聚L-赖氨酸原液(1.2.3)一个等份等分试样1到12 ml的终体积。
- 放置膜插入到6孔板每孔含有2毫升无菌水中。加入1毫升的涂料溶液在膜的顶部,并在5%CO 2的培养箱中孵育O / N在37℃。
- 温育后洗涤膜插入三次用1ml无菌水,干燥。在干燥6孔板用在同一天或商店涂布的膜插入物在4℃下长达四个星期。
2. DNA注入和E15.5的电穿孔和E18.5胚胎
- 通过将其放置到饱和,用5%异氟醚,并且连接到一个蒸发器的麻醉箱麻醉交配雌性小鼠一次。流通的异氟烷和氧气以1升/分钟的速率。保持在箱子的动物为2-4分钟,或直至无意识其由鼠标的爪子之间夹持测试。
- 通过对胚胎天颈椎脱位(E)15.5 18.5安乐死无意识鼠标。解剖含13胚胎在子宫并将其放入含有15-20毫升冷HBSS完整的培养皿。
注意:从这时开始,保持胚胎和组织上的冰块。 - 用剪刀从子宫角和地点每个胚胎中分离到含有完整的冷HBSS第二个培养皿中。
- 在解剖显微镜下,切断子宫肌壁,用一对细镊子(#55)和剪刀的胎盘。仔细释放从卵黄囊胚胎。
- 使用一对波恩剪刀来decapitatE中的胚胎刚刚前肢在60°角以上。如果实验需要的胚胎基因分型,收集的基因组DNA分离的组织样品(一小块尾巴)。
- 头转移到一个干净,干燥的培养皿。因为头部被断头在一个60°角,当置于背侧的头应该倾斜到一侧。
- 小心地注入了一针半球接近前囟门的中间( 图1A,B)。通过步进用30磅的压力为每脉冲10-15毫秒的持续时间的picospritzerⅢ的踏板上,施加5-8脉冲注入约2-3微升(在3或4微克/微升)DNA溶液。脉冲的持续时间和数量取决于针开口与较小的开口,需要更多的时间的直径。每个脉冲之间的间隔等于1秒。
- 前放置电极,应用几滴完整的HBSS对电磁制动的头哟。放置电极以这样一种方式,"负"终端是在同一侧的注入脑室和对胚胎的头部( 图1C,D) 的耳下方注入脑室的相对侧的"正面"电极。应用5脉冲50 V.
- 使用3毫米电极对于E 15.5 5毫米的电极对于E 18.5。
3.解剖的大脑
- 在电穿孔后,撕下从头部有一对细镊子的帮助下皮肤。利用一对弹簧剪刀作一小切口在小脑的中部在颅骨的中线。
- 将弹簧剪刀插入切口切开纵向沿矢状缝。剥离头骨,并通过使用细镊子取下从头骨的大脑。转让全脑入15-20毫升冷HBSS完整的解决方案。
- 与此同时,倒入4%LMP琼脂糖,保持在37-39℃的水浴中,进一剥离式模具。
- 取脑出完整的HBSS通过小铲子铲,并通过使用细棉纸或的Kimwipes排出多余的HBSS。
- 轻轻地放在全脑入琼脂糖,并调整其用细针的位置。保持在冰上的模具,直到琼脂糖是固化和块被分段(对于冠状切片嗅球指向向上)。
4.的vibratome切片和切片培养
- 修剪LMP琼脂糖块和胶水他们使用"超级胶"的样品台。胶后的干式转印试样阶段到的vibratome的缓冲盘和填充用冰冷的HBSS完成直到该块被浸在溶液中。
注:切片前消毒所有的仪器和设备表面用70%乙醇。 - 使用新的刀片准备250微米厚的切片的vibratome作为紧随其后。
- 修剪块无线个以下设置;频率 - 60赫兹,振幅 - 0.7微米,速度16〜18毫米/秒。切割含有与低速(9毫米/秒)的上述设置的期望的组织的部分。开始从后脑切片,收集5-7部分来自大脑。
- 该部分转移到含有5ml冰冷的HBSS完成与弯曲锅铲的帮助,并保持在冰上,直到所有的部分都收集( 图1E)干净的6孔培养皿。
- 滋润在用100μl完全的HBSS的横时尚膜放置部分上的膜之前,以促进各部分的取向。
- 传送用的弯曲刮铲的部分到膜(拿起部的角与钳和拉入刮刀,然后使用镊子的部分推到膜上)。放置最多五个部分上的一个膜,并通过使用镊子安排( 图1F)。不相互重叠的部分。
- 取过量的HBSS断使用移液管的膜。此处所使用的具体膜附连到框架,并插入到组织培养板,其允许组织是在接触,但不包括在介质。
- 将膜插入到含有1.8毫升切片培养基(1.2.5)( 图1G,H)的一个6孔板中。孵化培养皿在37℃,5%CO 2的11格或14格。改变一半的中等(0.9毫升)每隔一天。
注:在此阶段,加入试剂像溴脱氧尿苷(BrdU的;最终浓度10μM)用于标记增殖细胞的培养基的第20小时的培养时间。
5.固定的章节其次是免疫荧光染色
- 使用干净和锋利的手术刀刀片切割和修剪视的取向膜的章节。
- 沿着与膜传送部分以含有1ml 4%PFA(1.2.7)的24孔板。孵育切片1小时,在室温随后3次洗涤用1×PBS,每次15分钟。孵育切片O / N与透液在4℃下温和搅拌。
- 翌日,孵育适当的一抗的章节中,稀释于透化溶液,O / N或48小时,在4℃下温和搅拌。
- 洗第3次15分钟,用1×PBS孵育O / N在4℃下与稀释在透化溶液中的合适的二级抗体。
- 与第二抗体的温育后,用1×PBS洗涤一次的部分15分钟,然后用DAPI染色10分钟。
- 洗切片3次用1×PBS,每次15分钟,并转移到显微镜载玻片上。添加ImmunoMount,轻轻放在段顶部盖玻片。干幻灯片O / N在4°C和SE人与指甲油。
注意:保持幻灯片始终在4℃。- 分析切片文化共聚焦显微镜( 图1I)。
结果
转录因子BCL11B消融导致的祖细胞增殖并导致降低的齿状回的大小和细胞数目的神经元分化的损害。此外突变的神经元无法融入海马电路引起的学习记忆障碍8。要回答有关BCL11B在这些过程中的前子宫内电被采用的监管机制(S)的问题。
解决这个问题是否BCL11B细胞自主调节神经细胞分化,分 别由GFP-Cre重组酶结构或单独GFP 11的前子宫内电产生BCL11B马赛克缺失成BCL11B FLOX / FLOX海马在E15.5随后器官切片文化了以电经过18天( 图2A,B,该图已被修改,从8)。要确定是否Bcl11B调控细胞中自主使用识别NEUROD以及GFP特异性抗体进行免疫荧光染色颗粒细胞分化的影响。 NEUROD表达在有丝分裂阶段的2B / 3和早期有丝分裂后的细胞14。我们已经表明先前那个NEUROD阳性细胞的数目显著在BCL11B有条件的突变体表示神经元分化8的阻滞增加。而单独的GFP阳性细胞和GFP / NEUROD阳性细胞的数目在对照和突变的细胞中NEUROD阳性细胞则显著上升观察到在齿状回,其中细胞已接收的Cre重组没有差异( 图2C;这个数字已被修改从8)。发现NEUROD阳性细胞不仅在其中已收到Cre重组细胞,而且在野生型细胞中建议间接机制参与神经元细胞分化BCL11B调节。从这些数据,但是,ADDITBCL11B的有理细胞自主功能不能被排除。
先前,桥粒斑蛋白被确定为BCL11B 8的直接靶基因。它也表明,桥粒斑蛋白是参与的祖细胞的增殖和角化细胞15的分化的调节。为了证明桥粒斑蛋白是否参与的祖细胞增殖的齿状回的质粒DNA和/或神经元分化的调节单独或GFP和桥粒斑蛋白在CMV启动子的控制下被电穿孔入控制和BCL11B突变大脑( 图3A表达GFP - C:这个数字已经被修改8)。脑切片中培养的第20小时中的BrdU(10μM终浓度)的存在。在电穿孔后第11天固定,随后在切片培养物的BrdU免疫染色和BrdU阳性细胞的数目进行测定。 BCL11B突变Tissu酒店Ë电穿孔用GFP仅当相比对照组织所含显著较少的BrdU阳性细胞。然而,共电穿孔的GFP和桥粒斑蛋白的获救的BrdU阳性细胞的数目,以控制水平( 图3D;这个数字已经被修改8)。总之,这些数据进一步证实桥粒为BCL11B的直接靶基因及其祖细胞的增殖调控作用。

图1.建立前子宫内电和器官切片文化的E15.5的。(A)注射DNA到一个半球。(B)的DNA注射示意图。电极(C)定位。(D)示意图电极位置图。 (E)的vibratome切片和h齿状回andling的脑切片。(F)将脑切片在特定的膜。(GI)明视场(G)和荧光(H,GFP)上电后第1天切片文化分析。(I)共焦图像在11天之后,使用DAPI和GFP染色电。虚线表示的齿状回。比例尺= 100微米。 请点击此处查看该图的放大版本。

图2.马赛克删除BCL11B由前子宫内电和器官切片文化(8修改)。控制向量pCIG2单独(A)和pCIG2- 的Cre CON电结构(B)进入齿状回在E15.5随后器官切片培养18天。切片用抗体识别的GFP(绿色)和NEUROD(红色)通过免疫染色。插图显示GFP(绿色)和BCL11B(红色)染色以较高的放大倍率来演示BCL11B表达在细胞中表达Cre -recombinase损失。(C)的绿色荧光蛋白,NEUROD和GFP / NEUROD阳性细胞的统计分析。虚线表示的齿状回。 t检验,* P <0.005;误差棒,SD; N = 5。 请点击此处查看该图的放大版本。
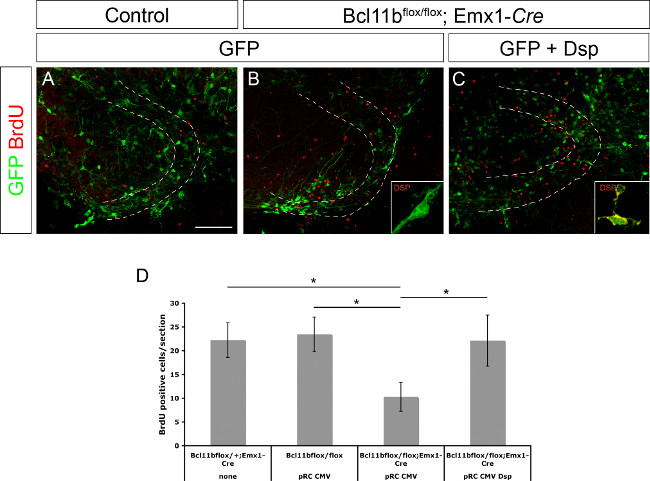
图3. BCL11B表型是通过重新引入桥粒(来自8修改)获救 。只有GFP(A,B),以及GFP和桥粒(C)被电到的控制(A)和突变的齿状回(B,C)的大脑在E15.5随后器官切片培养11天。切片用抗体识别的GFP(绿色)和BrdU(红色)。(D)中的BrdU阳性细胞的统计分析通过免疫染色。虚线表示的齿状回。插图在更高的放大倍率显示桥粒染色(绿色)。 t检验,* P <0.01;误差线,扫描电镜; N = 4。 请点击此处查看该图的放大版本。
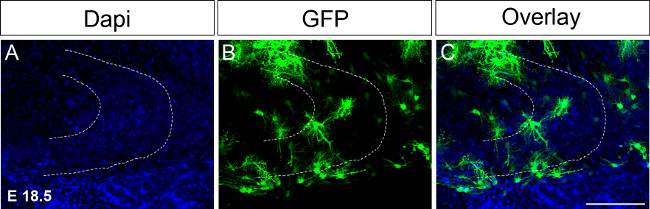
图4. 前子宫内电达E 18.5其次器官切片文化。注射DNA表达GFP成一个半球随后的免疫染色在电穿孔后第16天的(A)的 DAPI染色;(B)中的GFP染色;(C)的合并的图像。虚线表示齿状回。比例尺= 100微米。 请点击此处查看该图的放大版本。
讨论
海马在学习和记忆的重要功能。齿状回也是在那里发生神经不仅在发展,而且在整个成年期2脑区之一。产后和成人海马神经发生的收益在涉及许多共同的因素类似的方式。限定这些因素的调节机制将在理解神经变性疾病这又会导致新的治疗和预防措施非常有益的。要获得此信息的一个需要一个系统来操纵单个细胞,并就证明了前子宫内电后器官切片文化观察他们在家乡的环境。
前子宫内电首次成功地在研究皮质发育11,16应用。据我们所知,研究BCL11B在海马发展中的作用是D的第一个描述前子宫内电NA成齿状回组织8。我们根据我们的协议由Polleux组研究皮质发育11,12公布的方法。成功地应用本方法来研究的齿状回的尺寸和电极的位置必须加以调整。放置负极在注射部位附近,并在耳下面的相反站点正极皮质改变了电的极性,并成功地将DNA导入齿状回的细胞。正确地放置电极和施加的0.06〜0.08毫安原来是非常关键的步骤,以达到满意的电穿孔的结果的电流。为了获得最适当的电流主要取决于正确放置电极,如上所述。该协议的额外的关键步骤是注入材料进入心室以及处理所述切片的vibratome切片后。脑组织是不固定的整个过程和因此,从所述的vibratome转印到膜上种植当组织是非常柔软和容易销毁的。部分也必须非常小心启动免疫时处理。这些修改和单细胞齿状回的考虑操作均成功地完成回答关于早期海马发展BCL11B调节问题( 图2和3;此数字已被修改8)。
上述操纵单个细胞,观察他们的命运是前子宫内电的主要优势。相比前宫内方法的主要缺点在子宫内电是在有限的时间,以保持切片文化。它也有可能是子宫外培养条件可能会导致在显影的延迟。在我们的实验中,到目前为止,我们能够保持切片文化üP至18天,这相当于P14的年龄。栽培超出此时器官切片导致组织的瓦解。 前子宫内的方法的一个附加的缺点是,可以为每个母被电穿孔的胚胎的数量有限。与此相反,以在子宫内电有多达8胚胎可以治疗这种数目限制为4的胚胎在子宫外的方法。胚胎,电穿孔的vibratome切片和转移的切片成培养条件的夹层都以在很短的时间内进行,以确保成功的切片培养物。
因为齿状回发展的重大事件P14和P30之间发生,有必要保持器官切片中培养用于延长的时间段。在第一次尝试延长培养时间进行电穿孔达E 18.5进行相应调整的条件( 图4,见协议)。在电穿孔次在时间点允许在保持向上的文化的脑切片,以P17或18.除了海马结构的进一步发展达E 18.5相比到E 15.5, 如海马结构已经形成,更容易辨认。在未来,我们希望在更晚的时间点执行前子宫内电, 例如 ,P0至P4检查齿状回发展到P30中的变化。
披露声明
The authors declare that they have no competing financial interests.
致谢
This work was supported by grants from the Deutsche Forschungsgemeinschaft to SB (BR-2215; SFB 497/A9).
材料
| Name | Company | Catalog Number | Comments |
| Flaming/ Brown Micropipette Puller | Sutter Instruments Company (USA) | P-97 | |
| Fine Glass Pipettes | Warner Instruments | G100F-4 | |
| Microgrinder | Narishige, Japan | EG-44 | |
| Anesthetic Bracket unit | Harvard Apparatus | PY2 34-0412 | |
| Halovet Vaporizer | Harvard Apparatus | PY2 34-0398 | |
| Fluovac System | Harvard Apparatus | PY2 34-0387 | |
| IMS Fluosorber | Harvard Apparatus | PY2 34-0415 | |
| Anesthetizing Chamber | Harvard Apparatus | PY2 34-0460 | |
| Electroporator | BEX Company | CUY21 EDIT | |
| Tweezers with disk electrodes | BEX Company | LF650P3 | 3 mm electrodes for E15.5 |
| Tweezers with disk electrodes | BEX Company | LF650P5 | 5 mm electrodes for E18.5 |
| Picospritzer III | Parker Hannifin Corporation | P/N 052-0500-900 | |
| HM 650 V Vibrating Blade Microtome, 230 V | Thermo Scientific | 920120 | |
| Dissection Microscope | Carl Zeiss Microscopy Gmbh | Stemi SV8 | |
| Inverted Microscope | Leica | Leica DM IL LED | |
| Confocal Microscope | Leica | Sp5II | |
| 6 well dish | BD Falcon | #353502 | |
| 6 well dish | CELLSTAR | #657160 | |
| Tissue culture inserts | BD Falcon | #353090 | |
| Fast Green | Sigma | F7252 | |
| Laminin | Sigma | #L2020 | |
| Poly-L-lysine | Sigma | #P5899 | |
| Spring scissors | Fine Science Tools | 15003-08 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Forceps | Dumont #55 | 11255-20 Inox | |
| HBSS 10x | Life Technology | 14180-046 | |
| BME | Life Technology | 41010-26 |
参考文献
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends Neurosci. 27, 447-452 (2004).
- Frotscher, M., Zhao, S., Forster, E. Development of cell and fiber layers in the dentate gyrus. Prog Brain Res. 163, 133-142 (2007).
- Muramatsu, R., Ikegaya, Y., Matsuki, N., Koyama, R. Neonatally born granule cells numerically dominate adult mice dentate gyrus. Neuroscience. 148, 593-598 (2007).
- Li, G., Pleasure, S. J. Morphogenesis of the dentate gyrus: what we are learning from mouse mutants. Dev Neurosci. 27, 93-99 (2005).
- Hsieh, J. Orchestrating transcriptional control of adult neurogenesis. Genes Dev. 26, 1010-1021 (2012).
- Li, G., Pleasure, S. J. Genetic regulation of dentate gyrus morphogenesis. Prog Brain Res. 163, 143-152 (2007).
- Collas, P. The current state of chromatin immunoprecipitation. Mol Biotechnol. 45, 87-100 (2010).
- Simon, R., et al. A dual function of Bcl11b/Ctip2 in hippocampal neurogenesis. Embo J. 31, 2922-2936 (2012).
- Pilaz, L. J., Silver, D. L. Live imaging of mitosis in the developing mouse embryonic cortex. J Vis Exp. (88), (2014).
- Pacary, E., et al. Visualization and genetic manipulation of dendrites and spines in the mouse cerebral cortex and hippocampus using in utero electroporation. J Vis Exp. (65), (2012).
- Hand, R., et al. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-62 (2005).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal development. Sci STKE. (136), 19 (2002).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. J Vis Exp. (2), (2007).
- Sugiyama, T., Osumi, N., Katsuyama, Y. The germinal matrices in the developing dentate gyrus are composed of neuronal progenitors at distinct differentiation stages. Dev Dyn. 242, 1442-1453 (2013).
- Lechler, T., Fuchs, E. Desmoplakin: an unexpected regulator of microtubule organization in the epidermis. J Cell Biol. 176, 147-154 (2007).
- Nichols, A. J., O'Dell, R. S., Powrozek, T. A., Olson, E. C. Ex utero electroporation and whole hemisphere explants: a simple experimental method for studies of early cortical development. J Vis Exp. (74), (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。