Method Article
子宮外エレクトロポレーションおよびマウスの海馬組織の器官型スライス培養
要約
Here we present a protocol providing a tool to examine regulatory mechanisms of specific genes during hippocampal development. Employing ex utero electroporation and organotypic slice culture allows the up- and down-regulation of the expression of genes of interest in single cells and follow their fate during development.
要約
Mouse genetics offers a powerful tool determining the role of specific genes during development. Analyzing the resulting phenotypes by immunohistochemical and molecular methods provides information of potential target genes and signaling pathways. To further elucidate specific regulatory mechanisms requires a system allowing the manipulation of only a small number of cells of a specific tissue by either overexpression, ablation or re-introduction of specific genes and follow their fate during development. To achieve this ex utero electroporation of hippocampal structures, especially the dentate gyrus, followed by organotypic slice culture provides such a tool. Using this system to generate mosaic deletions allows determining whether the gene of interest regulates cell-autonomously developmental processes like progenitor cell proliferation or neuronal differentiation. Furthermore it facilitates the rescue of phenotypes by re-introducing the deleted gene or its target genes. In contrast to in utero electroporation the ex utero approach improves the rate of successfully targeting deeper layers of the brain like the dentate gyrus. Overall ex utero electroporation and organotypic slice culture provide a potent tool to study regulatory mechanisms in a semi-native environment mirroring endogenous conditions.
概要
海馬は記憶や学習に重要な役割だけでなく、感情的な行動を果たしている。一つの主な機能は、神経系の高い可塑性を必要とする長期記憶に短期記憶の統合、から構成されている。海馬の歯状回は、入力された情報のための主要なゲートウェイとして機能し、また成人期1,2を通じて継続的なニューロン新生と2脳領域の一つです。海馬の構造の開発が遅れて胚形成の間、特に最初の3〜4週間の生後3中に発生します。歯の早期開発中の幹細胞プールは、出生後だけでなく、大人の神経発生4に必要な確立されている回。現像ニューロンは、生後ならびに成体神経発生の間に、未成熟し、最終的に成熟したニューロンの前駆細胞のいくつかの段階を経て幹細胞から、様々なステージを通過する。神経発生の異なる段階での発現特定の遺伝子が海馬の回路5,6に新しい神経細胞の成熟と統合を可能にするために必要とされている。
免疫組織化学により、マウス遺伝学および表現型分析を用いて、ならびに分子的方法は、これらの遺伝子の多くの発現パターンおよび機能を定義することができた。さらにマイクロアレイ分析、ならびにクロマチン免疫沈降法(ChIP)の潜在的な直接的および間接的な標的遺伝子7,8についての情報を提供した。しかし、歯状回の特定の開発における海馬開発の調節機構に関する多くの未解決の問題は、まだあります。さらなる洞察を得るためにダウンや、興味のある遺伝子及び/又はその標的遺伝子のアップレギュレーションおよび開発中に、それらの運命を追跡する少数の細胞の操作を可能にする必要とされるどの特定の遺伝子系を規制されている。 子宮内エレクトロポレーションで shRNAは、目的の遺伝子のcDNAまたはCreリコンビナーゼのrecombinaSEはそのようなツールを提供しています。確実にするために、所望のDNAまたは低分子RNAの発現プラスミドの存在は、エレクトロポレーションのために使用されるべきである。このアプローチは非常に成功した皮質の開発9,10の勉強に実装されますが、より深い脳の層における海馬の構造の位置に起因する歯状回の開発を検討し、より挑戦的なアプローチです。
器官スライス培養に続いて子宮外エレクトロポレーションは、この問題11,12を回避する一つの方法です。 子宮内エレクトロポレーションではない全胚とは対照的にのみヘッドしたがって、海馬および歯状回に向けたshRNA / DNAを指示するためのより有利な方法で電極を配置することを可能に用いられる。私たちのグループは正常に歯状回の開発8時の転写因子Bcl11bの役割を研究するために子宮外エレクトロポレーションを採用。 Bcl11bは、rによる歯状回開発の二重の役割を持っている免疫組織化学によって実証されたように、前駆細胞の増殖ならびに分化をegulating。さらに、これらのプロセスにおけるBcl11bの関与のためのメカニズムを定義するには、Polleuxグループ11,12のプロトコルは、プロトコルセクションに下記のように歯状回を研究するために調整した。最初のアプローチでの質問はBcl11bが自律神経細胞分化細胞を規制されているかどうかに対処した。第二のアプローチは、デスモプラキン、Bcl11bの直接の標的遺伝子は、Bcl11b表現型を救出するのに十分であるかどうかを検討した。
プロトコル
注:全ての動物実験は、ドイツの法律に基づいて実施し、テュービンゲンの政府のオフィスによって承認された。
マイクロピペット、ソリューションおよび膜の作製
- マイクロピペットの作製
- プル、540:125、ベロシティを:熱:以下のプログラムでマイクロピペットプラーを用いてガラスマイクロピペットを引いて20とディレイ:140針の長さは5.5センチメートルにのぼる。
- microgrinderを用いてベベル針は4mmの適切なチップサイズを取得する。先端の損傷を防ぐために、ボックス内の針または15センチメートルペトリ皿に保管してください。
- 溶液の調製
- プラスミドDNAソリューション
- 製造業者のプロトコルに従ってエンドトキシンフリーマキシプレップキットを用いて、所望のcDNA構築物を含むプラスミドDNAを調製する。
- (GFPスパイクベクトルなし)/μL3または4μg/最終濃度をプラスミドDNA溶液を調整しますファストグリーン(最終濃度0.05%)を含有するエンドトキシンフリーのTris-EDTA緩衝液中で(GFPスパイクベクター1μgを有する)ずつ。
- ラミニン原液
- 最終容量1mlに滅菌水でラミニン1mgを溶解させる。 -80℃で100μlのアリコートとストアを準備します。
- ポリ-L-リシンストック溶液
- 1mg / mlの最終濃度に滅菌水50ml中のポリ-L-リジン50mgを溶解する。 -20℃で1ミリリットルアリコートとストアを準備します。
- ハンクス液を完了します(完全HBSS)
- のCaCl 2を10mlの100mMの硫酸マグネシウムを 10×HBSS 100mlを、1 M HEPES緩衝液を2.5ml(pH7.4)中、1 M D-グルコースを30ml、100ミリモル、10mlのを組み合わせることにより、完全なHBSSを作成し、4 1 mlのMのNaHCO 3。 4℃で1 Lとストアに滅菌水を上に追加します。
NOTE:フィルであるオートクレーブ全ての溶液を1M HEPES緩衝液、1MのD-グルコースを期待TERは、滅菌した。
- のCaCl 2を10mlの100mMの硫酸マグネシウムを 10×HBSS 100mlを、1 M HEPES緩衝液を2.5ml(pH7.4)中、1 M D-グルコースを30ml、100ミリモル、10mlのを組み合わせることにより、完全なHBSSを作成し、4 1 mlのMのNaHCO 3。 4℃で1 Lとストアに滅菌水を上に追加します。
- スライス培養培地
- 基礎培地イーグル35mlの完全HBSS(1.2.4)12.9 mlの1 M D-グルコース、200mMのL-グルタミンを250μl、およびペニシリン - ストレプトマイシンを500μlの1.35を加えて、スライス培養培地を調製50ミリリットルの最終容量を得る。 4℃で最終濃度5%とストアにウマ血清を加える。
- 低融点(LMP)アガロース
- ハイパワーで1〜2分間電子レンジで加熱して完全なHBSS(1.2.4)の50ミリリットルにアガロースLMPの2グラムを追加することで、4%LMPアガロース溶液を準備します。 39℃ - 37℃の水浴中でこのソリューションを保管してください。 4℃と再利用で溶液を保管してください。
- パラホルムアルデヒド溶液
- ドラフト内で1×PBS 100mlにパラホルムアルデヒドを4g添加することにより、4%パラホルムアルデヒド(PFA)溶液を調製する。 60°Cまで溶液を加熱し、溶液をcになるまで1 NのNaOHを数滴加えるリア。
- 透過処理ソリューション
- 4℃で0.3%Trition X-100およびストアを含む1×PBS 300mlにBSAを9gに溶解する。長期保存のために10%のアジ化ナトリウムを加える。
- プラスミドDNAソリューション
- メンブレンインサートのコーティング
- ラミニンストック溶液(1.2.2)の一方のアリコートおよび12 mlの最終容積に滅菌水でポリ-L-リシンストック溶液(1.2.3)のいずれかのアリコートを希釈する。
- 滅菌水を含む各ウェル2mlで6ウェルプレートに膜インサートを配置します。膜の上にコーティング液1 mLを加え、5%CO 2インキュベーター中、37℃でO / Nインキュベートする。
- インキュベーション後、膜が滅菌水とドライの1ミリリットルで三回を挿入洗う。ドライ6ウェルプレートに4週間まで4℃で同日またはストア上にコーティング膜インサートを使用してください。
2. DNA注入及びE15.5のエレクトロポレーションおよびE18.5胚
- 5%イソフルランで飽和させ、気化器に接続された麻酔ケースにそれを置くことによって、雌マウスを交配時間を麻酔。 1 L /分の速度でイソフルランと酸素を循環させる。マウスの足の間でつまんでテストされて2-4分間または無意識になるまでボックスに動物を保管してください。
- 胚日(E)15.5または18.5に頸椎脱臼によって無意識のマウスを安楽死させる。胚13を含む子宮を解剖し、冷たい完全なHBSS 15〜20 mlを含有するペトリ皿に入れてください。
注:この時点以降から、氷上で胚組織を保つ。 - 冷たい完全なHBSSを含む第二のペトリ皿に子宮角と場所から各胚を分離するためにハサミを使用してください。
- 解剖顕微鏡下では、子宮筋壁と細かい鉗子(#55)とハサミを使用して胎盤を断つ。慎重に卵黄嚢から胚をリリース。
- decapitatするボンハサミを使用してくださいちょうど60°の角度で前肢上記電子胚。実験は、胚の遺伝子型決定を必要とする場合、ゲノムDNAの単離のための組織試料(尾の小片)を収集する。
- 清潔で乾燥したペトリ皿に頭を転送します。ヘッドは60°の角度で断頭されていたので、背側を上に置かれたとき、頭が片側に傾けなければならない。
- ブレグマに半球近いの中央に慎重に針を置きます( 図1A、B)。 5-8パルスを印加する、パルスあたり10〜15ミリ秒の間、圧力の30ポンドを使用してpicospritzer IIIのペダルを踏んでDNA溶液の(3または4μgの/μLで)約2〜3μLを注入。パルスの持続時間及び数は、より多くの時間を必要とする小さな開口部を有する針開口部の直径に依存する。各パルスの間隔は1秒に達する。
- 電極を配置する前に、EMBRの頭の上に完全なHBSSの数滴を適用ヨーヨー。 「負」の端末が注入心室および胚の頭部( 図1C、D)の耳の下に注入された心室の反対側に「正」電極と同じ側になるように電極を配置する。 50 Vの5パルスを適用します
- E 18.5のためのE 15.5と5ミリメートル電極用の3mmの電極を使用してください。
脳の3.解剖
- エレクトロポレーション後、細かいピンセットの助けを借りて、頭から皮膚をはがし。春のハサミを使用すると、頭蓋骨の正中線での小脳の真ん中に小さな切開を作る。
- 切開部に春のはさみを挿入し、矢状縫合に沿って縦に切断。頭蓋骨をはがし、微細な鉗子を使用して頭蓋骨から脳を切り離す。 15〜20ミリリットル冷たい完全なHBSS溶液中に脳全体を転送します。
- 一方、4%LMPアガロースを注ぐ剥ぎ取り金型に、水浴中で37〜39℃に保った。
- 小さなスクープスパチュラで完全なHBSSの中から脳を取り、細かいティッシュペーパーやキムワイプを使用してHBSSの過剰を排出。
- アガロースに優しく全脳を置き、細い針との位置を調整します。アガロースが固化され、ブロックは(冠状切片のために嗅球はポイントアップ)区分されるまで氷上に金型を保管してください。
4.ビブラトームセクショニングとスライス文化
- LMPアガロースブロックをトリミングし、「スーパーグルー」を使用して試料ステージにそれらを接着。ブロックが溶液に浸漬されるまでHBSSを完了コールドグルーの後ビブラトームのバッファトレイに試料ステージ乾式転写され、氷で埋める。
注:セクショニング前に70%エタノールですべての楽器や機器の表面を滅菌する。 - 続いて、新しいブレードを使用して250μmの厚さのビブラトーム切片を準備します。
- ブロックのWiトリム以下の設定番目。周波数 - 60Hzの、振幅 - 0.7μmで、速度16〜18ミリメートル/秒。低速(9ミリメートル/秒)での上記の設定で所望の組織を含むセクションをカット。後脳から切片を開始し、大脳から5-7のセクションを集める。
- 曲がったへらの助けを借りてHBSSを完了し、すべてのセクションが( 図1E)を収集するまで氷上に保つの氷冷5ミリリットルを含むクリーンな6ウェル培養皿にセクションを転送します。
- セクションの向きを容易にするために、膜上のセクションを配置する前に完全なHBSS100μlのクロスファッションで膜を湿らせます。
- (鉗子でセクションのコーナーをピックアップし、へらの上に引っ張ると、膜上にセクションをプッシュする鉗子を使用してください)メンブレン上に曲がったへらを使用してセクションを転送します。 1膜上の5つのセクションにまで配置し、鉗子を使用して手配します( 図1F)。互いに部分を重複しない。
- ピペットを用いて膜からHBSSの過剰を取る。ここで使用される特定の膜は、フレームに取り付けられ、組織が接触することを可能にするが、媒体によって覆われていない組織培養プレートに挿入される。
- スライス培養培地の1.8ミリリットル(1.2.5)( 図1G、H)を含む6ウェルプレートに膜インサートを配置します。 11 DIVまたは14 DIV 5%CO 2、37℃で培養皿をインキュベートする。半分培地(0.9ミリリットル)ごとに二日を変更します。
注:;標識は培養時間の最初の20時間のメディアに増殖している細胞については、この段階では、ブロモデオキシウリジン(10μM最終濃度のBrdU)のような試薬を追加します。
免疫蛍光染色したセクションの5.固定
- の向きに応じて膜をカットしてトリミングするクリーンでシャープなメスの刃を使用して、セクション。
- 4%PFA(1.2.7)の1ミリリットルを含む24ウェルプレートに膜と一緒にセクションを転送します。 15分ごとに、1×PBSで3回洗浄し、室温で1時間のセクションをインキュベートします。静かに撹拌しながら4℃で透過処理溶液でのセクションのO / Nをインキュベートする。
- 翌日、透過処理溶液中に希釈された適切な一次抗体と共に切片をインキュベートし、O / Nまたは穏やかに撹拌しながら4℃で48時間。
- 1×PBSで15分間、切片を3回洗浄し、透過処理溶液中に希釈された適切な二次抗体と共に4℃でO / Nインキュベートする。
- 二次抗体とのインキュベーション後、10分間DAPI染色に続いて15分間1×PBSで一回のセクションを洗う。
- セクション15分間1X PBSで3回ずつ洗浄し、スライドを顕微鏡に移す。 ImmunoMountを加え、穏やかにセクションの上にカバースリップを配置。 4℃、それ自体でスライドO / Nを乾かしマニキュアとアル。
注:常に4℃でスライドしてください。- 共焦点顕微鏡( 図1I)でスライス培養を分析します。
結果
転写因子Bcl11bのアブレーションは、前駆細胞の増殖および減少歯状回のサイズと細胞数を生じる神経分化の障害を引き起こす。さらに、変異体ニューロンは、学習と記憶障害8を引き起こして海馬回路に統合することができない。 子宮外これらのプロセスでBcl11bの調節機構(複数可)に関する質問に答えるためにエレクトロポレーションを用いた。
質問に対処することBcl11b細胞自律的にE15.5でBcl11b FLOX / FLOX海馬に、Bcl11bのモザイク削除がGFP- Creリコンビナーゼ構築物またはGFP単独11の子宮外エレクトロポレーションによって生成された神経細胞分化を調節する器官スライス培養アップが続くのかどうかエレクトロポレーション後の18日に( 図2A、B;この図は、8から変更されている)。 Bcl11かどうかを判断するにはbは、細胞自律的免疫蛍光染色はGFPと同様のNeuroDを認識する特異的抗体を用いて行った顆粒細胞の分化を調節する。 NeuroDのは、有糸分裂のステージ2bの/ 3を早期分裂終了細胞14中で発現される。我々は、NeuroDの陽性細胞の数は、神経分化8の停止を示すBcl11b条件突然変異体において有意に増加することが以前に示されている。一人でGFP陽性細胞とGFP / NeuroDの陽性細胞の数はNeuroDの陽性細胞の有意な増加は、細胞がCreリコンビナーゼを受けていた歯状回において観察されたコントロールと変異細胞では差がなかったものの( 図2Cは 、この数字が変更されました8から)。 Creリコンビナーゼを受けた細胞においても野生型細胞だけでなくNeuroDの陽性細胞を見つけることは、間接的なメカニズムは、神経細胞分化のBcl11bの調節に関与することが示唆された。これらのデータから、しかし、ADDITBcl11bのional細胞自律機能は除外することはできません。
以前は、デスモプラキンはBcl11b 8の直接の標的遺伝子として決定した。また、デスモプラキンケラチノサイト15の前駆細胞の増殖および分化の調節に関与していることが示された。デスモプラキンは、CMVプロモーターの制御下でGFP単独またはGFPとデス モプラキンを発現する前駆細胞の増殖及び/又は歯状回のプラスミドDNAの神経分化の調節に関与しているかどうかを示すためには、コントロールにエレクトロポレーションし、Bcl11b変異体の脳( 図3A - C;この図は)8から変更されている。脳切片は、BrdUを(最終濃度10μM)の存在下で最初の20時間培養した。 11日目でのエレクトロポレーション後スライス培養は、BrdUの免疫染色に続いて固定し、BrdU陽性細胞の数を測定した。変異体TISSU Bcl11b対照組織と比較した場合、GFPでエレクトロ電子のみ有意に少ないBrdU陽性細胞を含んでいた。 (;この数字は8から変更されている図3D)。しかし、GFPおよびデスモプラキンの共同エレクトロポレーションは、レベルを制御するためのBrdU陽性細胞の数を救出。まとめると、これらのデータはさらに、直接標的Bcl11bの遺伝子および前駆細胞増殖の調節におけるその役割としてデスモプラキンを確認する。

E15.5での子宮外エレクトロポレーションおよび器官型スライス培養の図1セットアップ。DNAの(A)注射一方の半球に、DNA注入(B)概念図。電極(C)位置(D)概略電極配置の図面。 (E)切片ビブラトームおよびh歯状回の脳切片のandling。(F)特定の膜上で脳切片を置く。(GI)明視野(G)および蛍光(H、GFP)、エレクトロポレーション後の1日目の切片培養の分析。(I)の共焦点画像DAPIおよびGFP染色を用いてエレクトロポレーション後11日目。破線は、歯状回を示している。スケールバー=100μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。

子宮外エレクトロポレーションおよび(8から修正された)器官スライス培養によるBcl11b図2.モザイクの削除 。制御ベクトルpCIG2単独(A)とpCIG2- のCre CONのエレクトロポレーション18日間の器官型スライス培養したE15.5における歯状回への構造体(B)。切片を、GFP(緑色)およびNeuroDの(赤)を認識する抗体を用いて免疫染色した。インセットは、Creの -recombinaseを発現する細胞におけるBcl11b発現の喪失を実証するために高倍率でGFP(緑)、Bcl11b(赤)染色を示す。(C)GFP、あるNeuroDおよびGFP / NeuroDの陽性細胞の統計的分析。破線は、歯状回を示している。 t検定、* P <0.005。エラーバー、SD。 N = 5。 この図の拡大版をご覧になるにはこちらをクリックしてください。
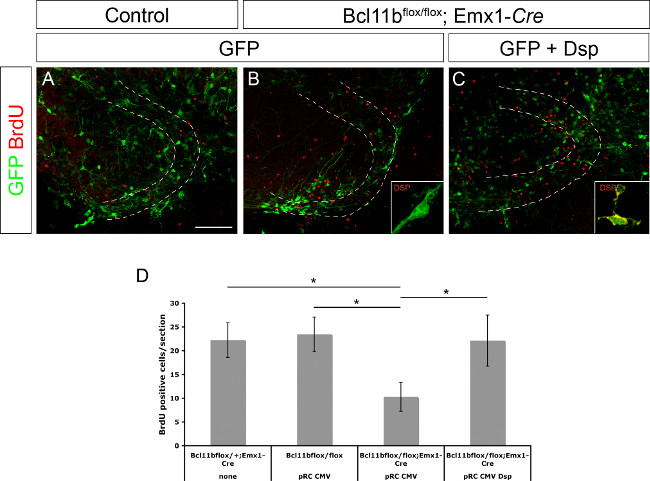
図3. Bcl11b表現型はデスモプラキン(8から修正された)の再導入によって救出されている 。 GFPのみ(A、B)ならびにGFP及びデスモプラキン(C)は、歯状回のコントロール(A)および11日間の器官型スライス培養したE15.5での変異体(B、C)脳にエレクトロポレーションした。切片を、GFP(緑色)およびBrdU(赤)を認識する抗体を用いて免疫染色した。BrdU陽性細胞の(D)統計解析。破線は、歯状回を示している。挿入図は高倍率でデスモプラキン染色(緑)を表示。 t検定、*はp <0.01。エラーバー、SEM。 N = 4。 この図の拡大版をご覧になるにはこちらをクリックしてください。
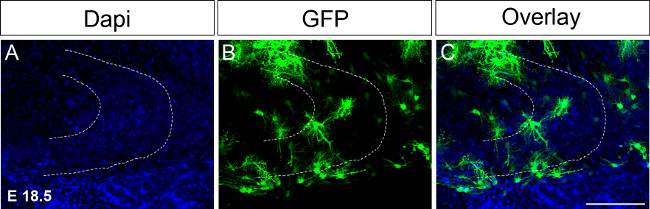
器官スライス培養に続いてE 18.5で、図4 のEx子宮内エレクトロポレーション。エレクトロポレーション後16日目での免疫染色が続く一方の半球にGFPを発現するDNAの注入(A)DAPI染色;(B)のGFP染色;(C)は 、画像を統合しました。破線は歯状回を示している。スケールバー=100μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
海馬は、学習および記憶において重要な機能を有している。歯状回も神経発生は、開発中だけでなく、成人期を通じてだけでなく、発生した2脳領域の一つです。産後と多くの共通の要因が関与する類似の方法で、大人の海馬の神経新生が進行する。これらの要因の調節機構を定義すると、今度は新たな治療法や予防措置につながる神経変性疾患を理解する上で非常に参考になります。この情報を得るために一つの単一細胞を操作し、器官型スライス培養に続いて子宮外エレクトロポレーションによって示されるように、その天然の環境でそれらを観察するシステムが必要である。
子宮外エレクトロポレーションは、最初に正常皮質発達11,16を研究に適用した。我々の知る限りでは海馬の開発にBcl11bの役割を調べると、Dの最初の記述のEX子宮内エレクトロポレーションで歯状回組織8にNA。私たちは、大脳皮質の発達11,12を研究Polleuxグループによって発表された方法で私たちのプロトコルをベース。成功した大きさと電極の位置を調整する必要があった歯状回を研究するためにこの方法を適用する。耳下の反対のサイトで注射部位と正極近い皮質で負極を配置すると、エレクトロポレーションの極性を変更し、歯状回のDNAを細胞に導入することに成功した。正確に電極を配置し、ミリアンペア良好エレクトロポレーションの結果を達成するために非常に重要なステップであることが判明した0.06〜0.08の電流を印加する。上記のように最も適切な電流を得るためには、電極の正しい配置に主に依存します。プロトコルの追加の重要なステップは、心室に材料を注入するだけでなく、ビブラトーム切片の後にスライスを処理している。脳組織は、手順全体を通して固定されておらず、かつ栽培のための膜の上にビブラトームから転送する際に、したがって組織は非常に柔らかく、簡単に破壊可能である。セクションは、また免疫染色を開始する際に細心の注意を払って処理する必要があり。これらの変更と配慮した歯状回の単一細胞の操作は、成功した初期の海馬の発達のBcl11bレギュレーション(;この数字は8から変更されている。図2及び3)に関する質問に答える行った。
単一細胞を操作し、上述したと観察したよう彼らの運命は、ex子宮内エレクトロポレーションの大きな利点である。 子宮内エレクトロポレーションでと比較して子宮外アプローチの主な欠点は、培養中のスライスを維持するための限られた時間である。これは、 子宮外の栽培条件は開発の遅れの原因となる可能性があることも可能である。我々の実験ではこれまでのところ、我々は、培養中のスライスを維持することができましたUP14の時代に対応したp〜18日。この時間を超えた器官スライスの栽培は、組織の崩壊につながる。 子宮外アプローチの追加の欠点は、母親ごとにエレクトロポレーションすることができた胚の数が限られている。最大8胚を、この数を扱うことができる子宮内エレクトロポレーションとは対照的に子宮外アプローチで4胚に制限されています。培養条件への胚を、エレクトロポレーション、ビブラトーム切片スライスの転送の切開が成功スライス培養を保証するために、短時間で実行されなければならない。
歯状回の開発の主要なイベントは、P14とP30の間で発生するので、長期の期間、培養中の器官のスライスを維持することが必要であろう。文化を拡張する最初の試みでは、時間のエレクトロポレーションは、それに応じて条件を調整するE 18.5で行った( 図4;プロトコルを参照のこと)。目にエレクトロポレーション時点は、 例えば E 15.5と比較した場合、海馬体、さらにE 18.5で開発され、海馬の構造がすでに形成され、より容易に認識されているほかP17または18までの培養中の脳切片を維持できている。将来的には、 例えば 、P4にP0はP30までの歯状回の開発中の変化を調べるために、でも後の時点で子宮外エレクトロポレーションを実行したいと思います。
開示事項
The authors declare that they have no competing financial interests.
謝辞
This work was supported by grants from the Deutsche Forschungsgemeinschaft to SB (BR-2215; SFB 497/A9).
資料
| Name | Company | Catalog Number | Comments |
| Flaming/ Brown Micropipette Puller | Sutter Instruments Company (USA) | P-97 | |
| Fine Glass Pipettes | Warner Instruments | G100F-4 | |
| Microgrinder | Narishige, Japan | EG-44 | |
| Anesthetic Bracket unit | Harvard Apparatus | PY2 34-0412 | |
| Halovet Vaporizer | Harvard Apparatus | PY2 34-0398 | |
| Fluovac System | Harvard Apparatus | PY2 34-0387 | |
| IMS Fluosorber | Harvard Apparatus | PY2 34-0415 | |
| Anesthetizing Chamber | Harvard Apparatus | PY2 34-0460 | |
| Electroporator | BEX Company | CUY21 EDIT | |
| Tweezers with disk electrodes | BEX Company | LF650P3 | 3 mm electrodes for E15.5 |
| Tweezers with disk electrodes | BEX Company | LF650P5 | 5 mm electrodes for E18.5 |
| Picospritzer III | Parker Hannifin Corporation | P/N 052-0500-900 | |
| HM 650 V Vibrating Blade Microtome, 230 V | Thermo Scientific | 920120 | |
| Dissection Microscope | Carl Zeiss Microscopy Gmbh | Stemi SV8 | |
| Inverted Microscope | Leica | Leica DM IL LED | |
| Confocal Microscope | Leica | Sp5II | |
| 6 well dish | BD Falcon | #353502 | |
| 6 well dish | CELLSTAR | #657160 | |
| Tissue culture inserts | BD Falcon | #353090 | |
| Fast Green | Sigma | F7252 | |
| Laminin | Sigma | #L2020 | |
| Poly-L-lysine | Sigma | #P5899 | |
| Spring scissors | Fine Science Tools | 15003-08 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Forceps | Dumont #55 | 11255-20 Inox | |
| HBSS 10x | Life Technology | 14180-046 | |
| BME | Life Technology | 41010-26 |
参考文献
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends Neurosci. 27, 447-452 (2004).
- Frotscher, M., Zhao, S., Forster, E. Development of cell and fiber layers in the dentate gyrus. Prog Brain Res. 163, 133-142 (2007).
- Muramatsu, R., Ikegaya, Y., Matsuki, N., Koyama, R. Neonatally born granule cells numerically dominate adult mice dentate gyrus. Neuroscience. 148, 593-598 (2007).
- Li, G., Pleasure, S. J. Morphogenesis of the dentate gyrus: what we are learning from mouse mutants. Dev Neurosci. 27, 93-99 (2005).
- Hsieh, J. Orchestrating transcriptional control of adult neurogenesis. Genes Dev. 26, 1010-1021 (2012).
- Li, G., Pleasure, S. J. Genetic regulation of dentate gyrus morphogenesis. Prog Brain Res. 163, 143-152 (2007).
- Collas, P. The current state of chromatin immunoprecipitation. Mol Biotechnol. 45, 87-100 (2010).
- Simon, R., et al. A dual function of Bcl11b/Ctip2 in hippocampal neurogenesis. Embo J. 31, 2922-2936 (2012).
- Pilaz, L. J., Silver, D. L. Live imaging of mitosis in the developing mouse embryonic cortex. J Vis Exp. (88), (2014).
- Pacary, E., et al. Visualization and genetic manipulation of dendrites and spines in the mouse cerebral cortex and hippocampus using in utero electroporation. J Vis Exp. (65), (2012).
- Hand, R., et al. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-62 (2005).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal development. Sci STKE. (136), 19 (2002).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. J Vis Exp. (2), (2007).
- Sugiyama, T., Osumi, N., Katsuyama, Y. The germinal matrices in the developing dentate gyrus are composed of neuronal progenitors at distinct differentiation stages. Dev Dyn. 242, 1442-1453 (2013).
- Lechler, T., Fuchs, E. Desmoplakin: an unexpected regulator of microtubule organization in the epidermis. J Cell Biol. 176, 147-154 (2007).
- Nichols, A. J., O'Dell, R. S., Powrozek, T. A., Olson, E. C. Ex utero electroporation and whole hemisphere explants: a simple experimental method for studies of early cortical development. J Vis Exp. (74), (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved