Method Article
Ex Utero Eletroporação e Organotípicas Cultura Slice of Mouse Hippocampal Tissue
Neste Artigo
Resumo
Here we present a protocol providing a tool to examine regulatory mechanisms of specific genes during hippocampal development. Employing ex utero electroporation and organotypic slice culture allows the up- and down-regulation of the expression of genes of interest in single cells and follow their fate during development.
Resumo
Mouse genetics offers a powerful tool determining the role of specific genes during development. Analyzing the resulting phenotypes by immunohistochemical and molecular methods provides information of potential target genes and signaling pathways. To further elucidate specific regulatory mechanisms requires a system allowing the manipulation of only a small number of cells of a specific tissue by either overexpression, ablation or re-introduction of specific genes and follow their fate during development. To achieve this ex utero electroporation of hippocampal structures, especially the dentate gyrus, followed by organotypic slice culture provides such a tool. Using this system to generate mosaic deletions allows determining whether the gene of interest regulates cell-autonomously developmental processes like progenitor cell proliferation or neuronal differentiation. Furthermore it facilitates the rescue of phenotypes by re-introducing the deleted gene or its target genes. In contrast to in utero electroporation the ex utero approach improves the rate of successfully targeting deeper layers of the brain like the dentate gyrus. Overall ex utero electroporation and organotypic slice culture provide a potent tool to study regulatory mechanisms in a semi-native environment mirroring endogenous conditions.
Introdução
O hipocampo desempenha um papel importante na memória e aprendizagem, bem como o comportamento emocional. Uma função principal consiste na consolidação da memória de curto prazo em memória de longo prazo, que requer alta plasticidade do sistema nervoso. O giro denteado do hipocampo actua como primário para a porta de entrada de informação de entrada e é também uma das duas regiões do cérebro com a neurogénese contínuo ao longo da idade adulta 1,2. O desenvolvimento da estrutura do hipocampo ocorre durante a embriogénese tardia e particularmente durante os primeiros 3 a 4 semanas pós-natal 3. Durante o desenvolvimento inicial do giro denteado um pool de células-tronco é estabelecida necessário para pós-natal, bem como a neurogênese adulta 4. Neurônios em desenvolvimento passam por várias etapas, desde a célula-tronco por várias fases de células progenitoras para os imaturos e, finalmente, o neurônio maduro durante a pós-natal, bem como neurogênese adulta. Em diferentes estádios da neurogénese a expressão degenes específicos é necessária para permitir a maturação e integração de novos neurónios do hipocampo para o circuito 5,6.
Usando mouse genética e análise de fenótipo por imuno-histoquímica, bem como métodos moleculares permitiu definir o padrão de expressão e função de muitos destes genes. Além análise microarray, bem como imunoprecipitação da cromatina (CHIP) forneceram informações sobre possíveis genes alvos diretos e indiretos 7,8. No entanto, ainda há muitas questões em aberto sobre os mecanismos de regulação do desenvolvimento do hipocampo, em particular o desenvolvimento do giro denteado. Para obter mais conhecimentos específicos como os genes são regulados de um sistema é necessário permitir que a manipulação de um pequeno número de células por jusante ou a sobre-regulação do gene de interesse e / ou dos seus genes-alvo e seguir o seu destino durante o desenvolvimento. No útero electroporação de shRNAs, cDNA de genes de interesse ou Cre recombinase oferece essa ferramenta. Para assegurar a presença do DNA desejado ou pequenos RNAs de plasmídeos de expressão deve ser utilizado para a electroporação. Esta abordagem é implementado com muito sucesso no estudo do desenvolvimento cortical 9,10, mas é uma abordagem mais difícil de examinar o desenvolvimento do giro denteado, devido à posição das estruturas do hipocampo em camadas mais profundas do cérebro.
Eletroporação utero Ex seguido de cultura fatia organotípica é uma abordagem para contornar esse problema 11,12. Em contraste no útero não electroporação todo o embrião, mas apenas a cabeça é usada, permitindo, por conseguinte, para colocar os eléctrodos de um modo mais favorável para dirigir o shRNA / DNA para o hipocampo e giro dentado. Nosso grupo empregada com sucesso ex utero eletroporação para estudar o papel do fator de transcrição Bcl11b durante o desenvolvimento do giro denteado 8. Bcl11b tem um duplo papel no desenvolvimento do giro denteado por regulating proliferação de células progenitoras, bem como a diferenciação como foi demonstrado por imuno-histoquímica. Para definir ainda um mecanismo para o envolvimento Bcl11b nestes processos, os protocolos do grupo Polleux 11,12 foram ajustados para estudar o giro denteado, conforme descrito abaixo na secção de protocolo. Numa primeira abordagem, a questão foi abordada se Bcl11b está regulando celular diferenciação de células neuronais de forma autônoma. A segunda abordagem examinou se desmoplakin, um gene alvo direto de Bcl11b, é suficiente para recuperar o fenótipo Bcl11b.
Protocolo
NOTA: Todas as experiências com animais foram realizados em conformidade com a lei alemã e foram aprovados pelos escritórios do governo em Tübingen.
1. Preparação de Micropipetas, Soluções e Membranas
- Preparação de micropipetas
- Puxe micropipetas de vidro usando um extrator micropipeta com o seguinte programa: Calor: 540, Pull: 125, Velocidade: 20 e Delay: 140. Os valores comprimento da agulha para 5,5 cm.
- Agulhas cônicas usando um microgrinder para obter um tamanho adequado ponta de 4 mm. Armazene as agulhas em uma caixa ou 15 centímetros de Petri para evitar danos das dicas.
- Preparação de Soluções
- O plasmídeo de DNA Solução
- Preparar DNA de plasmídeo contendo a construção de ADNc desejado utilizando um kit Maxi-prep livre de endotoxina de acordo com o protocolo do fabricante.
- Ajuste a solução de DNA do plasmídeo para uma concentração final de 3 mg / mL (GFP sem espigão vector) ou 4 ug /ul (com 1 ug de vector de GFP pico) em endotoxina libertar tampão Tris-EDTA contendo Fast Green (concentração final 0,05%).
- A laminina da solução
- Dissolve-se 1 mg de laminina em água estéril até um volume final de 1 ml. Prepare 100 mL alíquotas e armazenar a -80 ° C.
- A poli-L-lisina da Solução
- Dissolve-se 50 mg de poli-L-lisina em 50 ml de água estéril para uma concentração final de 1 mg / ml. Preparar alíquotas de 1 ml e loja em -20 ° C.
- Conclua solução salina equilibrada de Hank (HBSS completa)
- Prepare completa HBSS combinando 100 ml de HBSS 10x, 2,5 ml de 1 M de tampão HEPES (pH 7,4), 30 ml de 1 M de D-glucose, 10 ml de 100 mM CaCl 2, 10 ml de 100 mM de MgSO4, e 4 ml de 1 M de NaHCO3. Adicionar água estéril até 1 L e armazenar a 4 ° C.
NOTA: Autoclave todas as soluções tampão de esperar de HEPES 1 M e 1 M de D-glicose, que são filter esterilizado.
- Prepare completa HBSS combinando 100 ml de HBSS 10x, 2,5 ml de 1 M de tampão HEPES (pH 7,4), 30 ml de 1 M de D-glucose, 10 ml de 100 mM CaCl 2, 10 ml de 100 mM de MgSO4, e 4 ml de 1 M de NaHCO3. Adicionar água estéril até 1 L e armazenar a 4 ° C.
- Slice Meio de Cultura
- Prepare fatia meio de cultura pela adição de 35 ml de Meio Basal de Eagle, 12,9 ml de HBSS completo (1.2.4), 1,35 ml de 1 M de D-glucose, 250 ul de 200 mM de L-glutamina, e 500 ul de penicilina-estreptomicina a obter um volume final de 50 ml. Adicionar soro de cavalo a uma concentração final de 5% e armazenar a 4 ° C.
- Low-Ponto de fusão (LMP) Agarose
- Prepara-se uma solução de agarose a 4% LMP por adição de 2 g de agarose LMP a 50 ml de HBSS completo (1.2.4), seguido por aquecimento num forno de microondas durante 1-2 minutos, a alta energia. Manter a solução num banho de água a 37-39 ° C. Guardar a solução a 4 ° C e reutilização.
- Solução paraformaldeído
- Numa hotte preparar uma solução a 4% de paraformaldeído (PFA) por adição de 4 g de paraformaldeído a 100 ml de PBS 1x. Aquece-se a solução para 60 ° C e adiciona-se algumas gotas de NaOH 1 N até que a solução se torna clear.
- Solução permeabilização
- Dissolve-se 9 g de BSA em 300 mL de PBS 1x contendo 0,3% Triton X-100 e armazenar a 4 ° C. Adicionar azeto de sódio a 10% para armazenamento a longo prazo.
- O plasmídeo de DNA Solução
- Revestimento de Membrana inserções
- Dilui-se uma alíquota da solução de reserva de laminina (1.2.2) e uma aliquota de solução mãe de poli-L-lisina (1.2.3) em água estéril para um volume final de 12 ml.
- Coloque inserções de membrana em placas de 6 poços com cada poço contendo 2 ml de água estéril. Adicionar 1 ml de solução de revestimento por cima da membrana e incubar O / N a 37 ° C numa atmosfera de 5% de CO2.
- Após a incubação, lavar a membrana insere três vezes com 1 ml de água estéril e seco. Use pastilhas membrana revestida no mesmo dia ou armazenar a 4 ° C por até quatro semanas em um seco placa de 6 poços.
2. Injecção de ADN e electroporação de embriões E15.5 e E18.5
- Anestesiar uma vez acoplado rato fêmea, colocando-a dentro de uma câmara de anestesia saturado com 5% de isoflurano e ligado a um vaporizador. Circule isoflurano e oxigênio a uma taxa de 1 L / min. Mantenha o animal na caixa de 2-4 min ou até inconsciente, que é testada por beliscar entre as patas do mouse.
- Eutanásia o mouse inconsciente por deslocamento cervical no dia embrionário (E) 15,5 ou 18,5. Dissecar o útero contendo os embriões 13 e colocá-lo em uma placa de Petri contendo 15-20 ml de frio HBSS completa.
NOTA: A partir deste ponto em diante, manter os embriões e tecidos no gelo. - Use um par de tesouras para separar cada embrião do corno uterino e lugar para uma segunda placa de Petri contendo frio HBSS completa.
- Sob um microscópio de dissecação, cortar a parede do músculo uterino e da placenta, usando um par de fórceps finos (# 55) e tesoura. Solte cuidadosamente o embrião a partir do saco vitelino.
- Use um par de tesouras de Bona para decapitate os embriões só acima dos membros anteriores em um ângulo de 60 °. Se a experiência requer genotipagem dos embriões, recolher uma amostra de tecido para isolamento de ADN genómico (um pequeno pedaço da cauda).
- Transfira a cabeça para um prato limpo e seco Petri. Porque a cabeça tinha sido decapitado em um ângulo de 60 °, a cabeça deve inclinar para um lado quando colocado dorsal para cima.
- Coloque uma agulha cuidadosamente para o meio do hemisfério perto da bregma (Figura 1A, B). Injectar cerca de 2-3 ul (em 3 ou 4 ug / uL) de solução de ADN por pisar o pedal do Picospritzer III usando 30 libras de pressão durante o período de 10-15 ms por impulso, aplicando impulsos de 5-8. A duração e número dos impulsos depende do diâmetro da abertura de agulha com aberturas menores que precisam de mais tempo. O intervalo entre cada pulso corresponde a 1 seg.
- Antes da colocação dos eletrodos, aplique algumas gotas de HBSS completa sobre a cabeça do embryo. Colocar os eléctrodos de tal maneira que o terminal de "negativo" é no mesmo lado que o ventrículo injectado e o eléctrodo "positivo", no lado oposto do ventrículo injectado abaixo da orelha da cabeça do embrião (figura 1C, D). Aplicar 5 pulsos de 50 V.
- Use 3 eletrodos mm para 15,5 E e 5 mm para eletrodos E 18.5.
3. Dissecção do Cérebro
- Após a electroporação, descasca a pele da cabeça, com a ajuda de um par de fórceps finos. Utilizando um par de tesouras de mola fazer uma pequena incisão no meio do cerebelo na linha média do crânio.
- Insira a tesoura primavera na incisão e cortar longitudinalmente ao longo da sutura sagital. Retire o crânio e separar o cérebro do crânio usando uma pinça fina. Transferir todo o cérebro em 15-20 ml frio solução HBSS completa.
- Enquanto isso, coloque 4% LMP agarose,mantida a 37-39 ° C num banho de água, para um molde de casca-de distância.
- Leve o cérebro para fora do HBSS completa por uma pequena espátula colher e drenar o excesso de HBSS usando lenço de papel fino ou Kimwipes.
- Coloque todo o cérebro suavemente para dentro da agarose e ajustar a sua posição com uma agulha fina. Mantenha o molde em gelo até a agarose é solidificada e o bloco é segmentado (por cortes coronais os bulbos olfatórios apontar para cima).
4. Vibratome Seccionamento e Cultura Slice
- Apare os blocos de agarose LMP e cola-los para o palco amostra usando 'super cola ". Depois de a cola de transferência é seca a fase espécime para a bandeja de tampão de vibratome e encher com gelo frio completar HBSS até que o bloco está imerso na solução.
NOTA: Esterilizar todas as superfícies de instrumentos e equipamentos com etanol a 70% antes do corte. - Prepare 250 mm seções vibratome grossas usando uma lâmina nova como seguida.
- Apare o wi blocoth as seguintes configurações; freqüência - 60 Hz, amplitude - 0,7 mm, velocidade de 16-18 mm / sec. Corte as seções que contêm o tecido desejado com as configurações acima em velocidade lenta (9 mm / seg). Iniciando o seccionamento do cérebro posterior, recolher 5-7 seções do cérebro.
- Transfira as seções para uma placa de cultura de 6 bem limpo contendo 5 ml de gelo frio completar HBSS com a ajuda de uma espátula dobrado e manter em gelo até que todas as seções são coletados (Figura 1E).
- Humedecer a membrana de forma cruzada com 100 ul de HBSS completa antes de colocar as secções sobre a membrana, a fim de facilitar a orientação das secções.
- Transfira as seções usando uma espátula dobrado sobre a membrana (pegar um canto da seção com uma pinça e puxe para a espátula e, em seguida, use a pinça para empurrar a seção sobre a membrana). Coloque até cinco seções em uma membrana e organizar por usando uma pinça (Figura 1F). Não sobreponha as seções com os outros.
- Tirar o excesso de HBSS fora da membrana utilizando uma pipeta. As membranas específicas utilizadas aqui estão ligados a uma armação e inserido na placa de cultura de tecido, o que permite que o tecido estar em contacto, mas não coberta pelo meio.
- Coloque as inserções de membrana numa placa de 6 poços contendo 1,8 ml de meio de cultura de fatia (1.2.5) (Figura 1G, H). Incubar a placa de cultura a 37 ° C com 5% de CO 2 por 11 ou 14 DIV DIV. Mudar metade do meio (0,9 ml) a cada segundo dia.
NOTA: Nesta fase, adicionar reagentes como bromodeoxiuridina (BrdU; 10 mM concentração final) para a rotulagem proliferação de células para a mídia pela primeira 20 horas do tempo de cultura.
5. A fixação das Seções Seguido por Imunofluorescência Coloração
- Use uma lâmina de bisturi limpa e afiada para cortar e aparar as membranas, dependendo da orientação doas seções.
- Transferem-se as secções em conjunto com a membrana de uma placa de 24 poços contendo 1 ml de 4% PFA (1.2.7). Incubam-se as secções durante 1 hora à t.a., seguido por 3 lavagens com 1x PBS durante 15 min cada. Incubar as secções O / N com uma solução de permeabilização a 4 ° C com agitação suave.
- No dia seguinte, incubar as secções com anticorpos primários apropriados, diluídos em solução de permeabilização, S / N ou durante 48 horas a 4 ° C com agitação suave.
- Lavam-se as secções 3 vezes durante 15 min com PBS 1x e incubar O / N a 4 ° C com os anticorpos secundários apropriados diluídos em solução de permeabilização.
- Após a incubação com os anticorpos secundários, lavar uma vez as secções com 1x PBS, durante 15 minutos, seguido por coloração com DAPI durante 10 min.
- Lave as seções 3 vezes com PBS 1x por 15 min cada, e transferir para lâminas de microscópio. Adicionar ImmunoMount e coloque delicadamente uma lamela em cima das seções. Secar as lâminas O / N a 4 ° C e seal com unha polonês.
NOTA: Mantenha os slides sempre a 4 ° C.- Analisar as culturas fatia por microscopia confocal (Figura 1-I).
Resultados
A ablação do factor de transcrição Bcl11b provoca a diminuição da proliferação de células progenitoras e a diferenciação neuronal resultando numa redução do tamanho do giro denteado e o número de células. Além disso neurônios mutantes não conseguem integrar-se no circuito do hipocampo causando aprendizagem e memória comprometimento 8. Para responder a perguntas sobre o mecanismo de regulação (s) de Bcl11b nestes processos eletroporação ex utero foi empregado.
Dirigindo-se à questão de saber se Bcl11b célula-autonomamente regula a diferenciação celular neuronal, supressões mosaico de Bcl11b foram gerados por ex utero eletroporação de uma construção recombinase GFP Cre ou GFP sozinho 11 em Bcl11b Flox / Flox hipocampos em E15.5 seguido por fatia cultura organotípica up até 18 dias após a eletroporação (Figura 2A, B; este valor tenha sido modificado a partir 8). Para determinar se Bcl11b regula a diferenciação de células de grânulos de células-autonomamente imunofluorescência foi realizada com anticorpos específicos que reconhecem NeuroD, bem como GFP. NeuroD é expresso em fases mitóticas 2b / 3 e células pós-mitóticas primeiros 14. Nós mostramos anteriormente que o número de células positivas NeuroD é significativamente aumentada em Bcl11b mutantes condicionais indicando uma prisão de diferenciação neuronal 8. Embora o número de células positivas para GFP sozinho e células positivas / NeuroD GFP não diferiram em células de controlo e mutantes foi observado um aumento significativo em células positivas NeuroD no giro dentado, onde as células tinham recebido a recombinase Cre (Figura 2C; esta figura foi modificado de 8). Encontrar células positivas NeuroD não apenas em células que tinham recebido a recombinase Cre, mas também em células de tipo selvagem sugerem que mecanismos indirectos estão envolvidos na regulação Bcl11b de diferenciação de células neuronais. A partir destes dados, no entanto, additfunções das células-autônoma ional de Bcl11b não pode ser excluída.
Anteriormente, desmoplaquina foi determinada como um gene alvo directo de Bcl11b 8. Mostrou-se também que desmoplakin está envolvido na regulação da proliferação e diferenciação de queratinócitos 15 células progenitoras. Para demonstrar se desmoplaquina está envolvido na regulação da proliferação de células progenitoras e / ou a diferenciação neuronal do ADN giro denteado plasmídeo expressando GFP ou GFP sozinho e desmoplakin sob o controlo do promotor de CMV foi electroporado em cérebros de controlo e Bcl11b mutantes (Figura 3A - C; este valor tenha sido modificado a partir 8). As fatias de cérebro foram cultivadas durante a primeira 20 horas na presença de BrdU (10 uM de concentração final). No dia 11 após a electroporação as culturas foram fixadas fatia seguido de imunocoloração com BrdU e o número de células positivas para BrdU foi determinada. Bcl11b tissu mutantee electroporadas com GFP apenas continham significativamente menos células positivas para BrdU, quando comparados com o tecido de controlo. No entanto, a co-electroporação de GFP e desmoplakin resgatou o número de células positivas para BrdU para controlar os níveis (Figura 3D; nesta figura foi modificado a partir de 8). Tomados em conjunto, estes dados confirmam adicionalmente desmoplaquina como um gene alvo directo de Bcl11b e o seu papel na regulação da proliferação de células progenitoras.

Figura 1. Set-up do ex utero eletroporação e cultura fatia organotípica em E15.5. (A) A injeção de DNA em um hemisfério. (B) Desenho esquemático da injeção de DNA. (C) Posicionamento dos eletrodos. (D) Schematic desenho de colocação do eletrodo. (E) Vibratome seccionamento e handling de secções do cérebro. (F) Colocar secções cerebrais específicas em membranas. (GI) de campo brilhante (L) e fluorescência (H, GFP) análise de culturas de fatias no dia 1 após a electroporação. (I) imagem confocal do giro dentado no dia 11 após a electroporação utilizando DAPI e GFP coloração. A linha tracejada indica giro dentado. Scale bar = 100 um. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 2. exclusão de Mosaic Bcl11b por eletroporação utero ex e cultura fatia organotípica (modificado de 8). Eletroporação de controle de vetores pCIG2 sozinho (A) e pCIG2- Cre conestrutura (B) no giro dentado em E15.5 seguido por cultura fatia organotípicas durante 18 dias. As secções foram marcadas usando anticorpos que reconhecem pelo GFP (verde) e NeuroD (vermelho). As inserções exibir GFP (verde) e Bcl11b (vermelho) coloração em maior ampliação para demonstrar a perda de expressão Bcl11b em células que expressam Cre -recombinase. (C) A análise estatística da GFP, NeuroD e células positivas / NeuroD GFP. As linhas tracejadas indicam giro dentado. t-teste, * p <0,005; barras de erro, sd; n = 5. Por favor, clique aqui para ver uma versão maior desta figura.
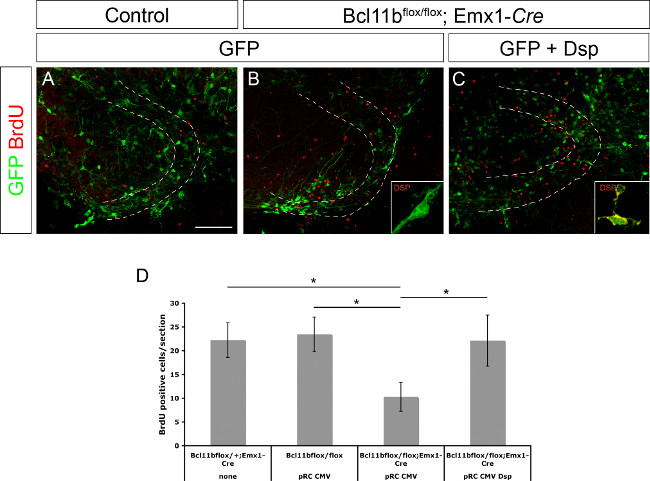
Figura 3. Bcl11b fenótipo é resgatado por re-introdução de desmoplakin (modificado de 8). Apenas GFP (A, B), bem como GFP e desmoplakin (C) foram electroporadas em giro dentado de controlo (A) e mutante (B, C) cérebros em E15.5 seguido por cultura fatia organotípicas durante 11 dias. As secções foram marcadas usando anticorpos que reconhecem pelo GFP (verde) e de BrdU (vermelho). (D) A análise estatística de células positivas para BrdU. As linhas tracejadas indicam giro dentado. Insets exibir coloração desmoplakin (verde) em maior ampliação. t-teste, * p <0,01; barra de erro, sem; n = 4. Por favor, clique aqui para ver uma versão maior desta figura.
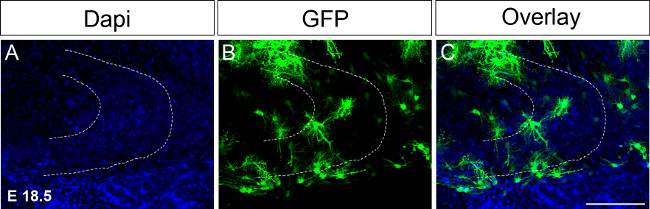
Figura 4. Ex eletroporação utero em 18,5 E seguido de cultura fatia organotípica.A injecção de ADN expressando GFP em um hemisfério seguido de coloração imunológica no dia 16 após a electroporação (A) coloração DAPI;. Coloração (B) GFP; (C) fundidos imagem. A linha tracejada indica giro denteado. Scale bar = 100 um. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
O hipocampo tem uma função importante na aprendizagem e memória. O giro dentado é também uma das duas regiões do cérebro onde ocorre a neurogénese não só durante o desenvolvimento, mas também ao longo da idade adulta. Pós-natal e neurogênese adulta rendimentos do hipocampo de uma forma semelhante envolvendo muitos fatores comuns. Definir os mecanismos de regulação desses fatores vai ser muito útil para a compreensão das doenças neurodegenerativas, que por sua vez levará a novas terapias e medidas preventivas. Para obter essas informações um requer um sistema para manipular células individuais e observá-los em seu ambiente nativo como demonstrado por eletroporação ex utero seguido de cultura fatia organotípica.
Ex eletroporação utero foi aplicada pela primeira vez com sucesso em estudo do desenvolvimento do córtex 11,16. Para o nosso conhecimento analisar o papel dos Bcl11b no desenvolvimento do hipocampo é o primeiro descrevendo eletroporação ex utero de DNA no giro denteado tecido 8. Baseamos nosso protocolo sobre os métodos publicados pelo grupo Polleux estudar o desenvolvimento do córtex 11,12. Para aplicar este método com êxito para estudar o giro denteado do tamanho e posição dos eléctrodos tiveram de ser ajustados. A colocação do eléctrodo negativo no córtex próximo do local da injecção e o eléctrodo positivo no local oposto abaixo da orelha mudou a polaridade da electroporação e teve sucesso na introdução de ADN em células do giro denteado. A colocação dos eletrodos corretamente e aplicando uma corrente de 0,06-0,08 mA acabou por ser passos muito importantes para alcançar resultados satisfatórios eletroporação. Para obter a corrente mais adequada depende principalmente da correcta colocação dos eléctrodos, tal como descrito acima. Passos críticos adicionais do protocolo são injectar o material no interior do ventrículo, bem como manusear as fatias após vibratome seccionamento. O tecido cerebral não é fixada ao longo de todo o procedimento eportanto, o tecido é muito macio e facilmente destrutível ao transferir do vibratome sobre a membrana para o cultivo. Seções também tem que ser tratado com muito cuidado quando se inicia o immunostaining. Com estas alterações e considerações manipulações de células individuais do giro dentado foram realizados com sucesso responder questões relativas à regulamentação Bcl11b de desenvolvimento hipocampo precoce (Figura 2 e 3, o que figuras foram modificados a partir de 8).
Como mencionado acima manipulação de células individuais e observar o seu destino é a grande vantagem da eletroporação ex utero. Uma grande desvantagem da abordagem ex utero em comparação com in utero electroporação é o tempo limitado para manter fatias em cultura. É também possível que as condições de cultura ex utero pode provocar um atraso no desenvolvimento. Em nossos experimentos, até agora, fomos capazes de manter as fatias em cultura up a 18 dias o que corresponde à idade de P14. Cultivo de fatias organotypic além desta vez levar à desintegração do tecido. Uma desvantagem adicional da abordagem ex útero é o número limitado de embriões que podem ser electroporadas por mãe. Em contraste com o in utero eletroporação onde até 8 embriões podem ser tratados esse número é limitado a 4 embriões na abordagem ex utero. A dissecção da embriões, electroporação, e transferência vibratome seccionamento das fatias em condições de cultura tem que ser realizado em pouco tempo para assegurar fatia culturas bem sucedidas.
Devido grandes eventos de desenvolvimento giro dentado ocorrer entre P14 e P30 que seria necessário para manter fatias organotípicas em cultura por períodos de tempo prolongados. Numa primeira tentativa de estender o tempo de cultura electroporações foram realizadas em E 18,5 ajustando as condições em conformidade (Figura 4; ver protocolo). Electroporating no thé ponto de tempo permite manter as seções cerebrais em cultura até P17 ou 18. Além disso, a formação do hipocampo é desenvolvido em 18,5 E quando comparado com 15,5 E, por exemplo, as estruturas do hipocampo já estão formados e mais facilmente reconhecíveis. No futuro, gostaríamos de realizar ex utero eletroporação no mesmo mais tarde pontos de tempo, por exemplo, P0 a P4 para examinar as mudanças durante o desenvolvimento do giro denteado até P30.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
This work was supported by grants from the Deutsche Forschungsgemeinschaft to SB (BR-2215; SFB 497/A9).
Materiais
| Name | Company | Catalog Number | Comments |
| Flaming/ Brown Micropipette Puller | Sutter Instruments Company (USA) | P-97 | |
| Fine Glass Pipettes | Warner Instruments | G100F-4 | |
| Microgrinder | Narishige, Japan | EG-44 | |
| Anesthetic Bracket unit | Harvard Apparatus | PY2 34-0412 | |
| Halovet Vaporizer | Harvard Apparatus | PY2 34-0398 | |
| Fluovac System | Harvard Apparatus | PY2 34-0387 | |
| IMS Fluosorber | Harvard Apparatus | PY2 34-0415 | |
| Anesthetizing Chamber | Harvard Apparatus | PY2 34-0460 | |
| Electroporator | BEX Company | CUY21 EDIT | |
| Tweezers with disk electrodes | BEX Company | LF650P3 | 3 mm electrodes for E15.5 |
| Tweezers with disk electrodes | BEX Company | LF650P5 | 5 mm electrodes for E18.5 |
| Picospritzer III | Parker Hannifin Corporation | P/N 052-0500-900 | |
| HM 650 V Vibrating Blade Microtome, 230 V | Thermo Scientific | 920120 | |
| Dissection Microscope | Carl Zeiss Microscopy Gmbh | Stemi SV8 | |
| Inverted Microscope | Leica | Leica DM IL LED | |
| Confocal Microscope | Leica | Sp5II | |
| 6 well dish | BD Falcon | #353502 | |
| 6 well dish | CELLSTAR | #657160 | |
| Tissue culture inserts | BD Falcon | #353090 | |
| Fast Green | Sigma | F7252 | |
| Laminin | Sigma | #L2020 | |
| Poly-L-lysine | Sigma | #P5899 | |
| Spring scissors | Fine Science Tools | 15003-08 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Forceps | Dumont #55 | 11255-20 Inox | |
| HBSS 10x | Life Technology | 14180-046 | |
| BME | Life Technology | 41010-26 |
Referências
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends Neurosci. 27, 447-452 (2004).
- Frotscher, M., Zhao, S., Forster, E. Development of cell and fiber layers in the dentate gyrus. Prog Brain Res. 163, 133-142 (2007).
- Muramatsu, R., Ikegaya, Y., Matsuki, N., Koyama, R. Neonatally born granule cells numerically dominate adult mice dentate gyrus. Neuroscience. 148, 593-598 (2007).
- Li, G., Pleasure, S. J. Morphogenesis of the dentate gyrus: what we are learning from mouse mutants. Dev Neurosci. 27, 93-99 (2005).
- Hsieh, J. Orchestrating transcriptional control of adult neurogenesis. Genes Dev. 26, 1010-1021 (2012).
- Li, G., Pleasure, S. J. Genetic regulation of dentate gyrus morphogenesis. Prog Brain Res. 163, 143-152 (2007).
- Collas, P. The current state of chromatin immunoprecipitation. Mol Biotechnol. 45, 87-100 (2010).
- Simon, R., et al. A dual function of Bcl11b/Ctip2 in hippocampal neurogenesis. Embo J. 31, 2922-2936 (2012).
- Pilaz, L. J., Silver, D. L. Live imaging of mitosis in the developing mouse embryonic cortex. J Vis Exp. (88), (2014).
- Pacary, E., et al. Visualization and genetic manipulation of dendrites and spines in the mouse cerebral cortex and hippocampus using in utero electroporation. J Vis Exp. (65), (2012).
- Hand, R., et al. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-62 (2005).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal development. Sci STKE. (136), 19 (2002).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. J Vis Exp. (2), (2007).
- Sugiyama, T., Osumi, N., Katsuyama, Y. The germinal matrices in the developing dentate gyrus are composed of neuronal progenitors at distinct differentiation stages. Dev Dyn. 242, 1442-1453 (2013).
- Lechler, T., Fuchs, E. Desmoplakin: an unexpected regulator of microtubule organization in the epidermis. J Cell Biol. 176, 147-154 (2007).
- Nichols, A. J., O'Dell, R. S., Powrozek, T. A., Olson, E. C. Ex utero electroporation and whole hemisphere explants: a simple experimental method for studies of early cortical development. J Vis Exp. (74), (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados