Method Article
Ex Utero L'électroporation et organotypiques Slice culture de souris hippocampe Tissue
Dans cet article
Résumé
Here we present a protocol providing a tool to examine regulatory mechanisms of specific genes during hippocampal development. Employing ex utero electroporation and organotypic slice culture allows the up- and down-regulation of the expression of genes of interest in single cells and follow their fate during development.
Résumé
Mouse genetics offers a powerful tool determining the role of specific genes during development. Analyzing the resulting phenotypes by immunohistochemical and molecular methods provides information of potential target genes and signaling pathways. To further elucidate specific regulatory mechanisms requires a system allowing the manipulation of only a small number of cells of a specific tissue by either overexpression, ablation or re-introduction of specific genes and follow their fate during development. To achieve this ex utero electroporation of hippocampal structures, especially the dentate gyrus, followed by organotypic slice culture provides such a tool. Using this system to generate mosaic deletions allows determining whether the gene of interest regulates cell-autonomously developmental processes like progenitor cell proliferation or neuronal differentiation. Furthermore it facilitates the rescue of phenotypes by re-introducing the deleted gene or its target genes. In contrast to in utero electroporation the ex utero approach improves the rate of successfully targeting deeper layers of the brain like the dentate gyrus. Overall ex utero electroporation and organotypic slice culture provide a potent tool to study regulatory mechanisms in a semi-native environment mirroring endogenous conditions.
Introduction
L'hippocampe joue un rôle important dans la mémoire et l'apprentissage ainsi que le comportement émotionnel. Une fonction principale consiste en la consolidation de la mémoire à court terme en mémoire à long terme, qui exige une forte plasticité du système nerveux. Le gyrus denté de l'hippocampe joue le rôle de passerelle principale pour obtenir des informations d'entrée et est également l'une des deux régions du cerveau avec la neurogenèse continue à l'âge adulte 1,2. Le développement de la structure de l'hippocampe se produit à la fin de l'embryogenèse et en particulier pendant la première 3 à 4 semaines après la naissance 3. Au début du développement de la gyrus denté un pool de cellules souches est établi nécessaire pour postnatale ainsi que la neurogenèse adulte 4. Les neurones en développement passent par différentes étapes, à partir de la cellule souche à travers plusieurs stades de cellules progénitrices immatures au neurone et enfin la maturité pendant postnatal ainsi que la neurogenèse adulte. À différentes étapes de la neurogenèse l'expression degènes spécifiques est nécessaire pour permettre la maturation et l'intégration de nouveaux neurones dans les circuits de l'hippocampe 5,6.
En utilisant la génétique de souris et analyse phénotypique par immunohistochimie ainsi que des méthodes moléculaires a permis de définir le profil d'expression et la fonction d'un grand nombre de ces gènes. Dans l'analyse des microréseaux d'addition ainsi que immunoprécipitation de la chromatine (ChIP) fourni des informations sur les gènes cibles potentiels directs et indirects 7,8. Cependant, il ya encore beaucoup de questions ouvertes concernant les mécanismes de régulation de développement de l'hippocampe, en particulier le développement du gyrus denté. Pour mieux comprendre comment les gènes spécifiques sont réglementés un système est nécessaire permettant la manipulation d'un petit nombre de cellules par le bas ou vers le haut-régulation du gène d'intérêt et / ou de ses gènes cibles et suivre leur sort au cours du développement. In utero électroporation des shRNA, ADNc de gènes d'intérêt ou Cre recombinaSE fournit un tel outil. Pour garantir la présence de l'ADN désiré ou petits ARN des plasmides d'expression doit être utilisée pour l'électroporation. Cette approche est mise en œuvre avec succès dans l'étude du développement cortical 9,10, mais est une approche plus difficile l'examen de l'évolution de la gyrus denté en raison de la position des structures de l'hippocampe dans les couches plus profondes du cerveau.
Électroporation in utero Ex suivie par la culture organotypique est une approche pour contourner ce problème 11,12. Contrairement à électroporation in utero pas l'embryon entier, mais seule la tête est utilisée permet donc de placer les électrodes d'une manière plus favorable pour diriger le shRNA / ADN vers l'hippocampe et le gyrus denté. Notre groupe a utilisé avec succès l'électroporation ex utero pour étudier le rôle de facteur de transcription Bcl11b cours du développement du gyrus denté 8. Bcl11b a un double rôle dans le développement de gyrus denté par regulating prolifération de cellules souches ainsi que la différenciation comme cela a été démontré par immunohistochimie. Pour définir plus précisément un mécanisme d'engagement Bcl11b dans ces procédés, les protocoles du groupe Polleux 11,12 ont été ajustés pour étudier le gyrus denté comme décrit ci-dessous dans la section de protocole. Dans une première approche de la question a été posée de savoir si Bcl11b réglemente neuronale cellule de la différenciation cellulaire autonome. Une deuxième approche a examiné si Desmoplakine, un gène cible directe de Bcl11b, est suffisante pour sauver le phénotype Bcl11b.
Protocole
NOTE: Toutes les expériences sur les animaux ont été effectuées en conformité avec la loi allemande et ont été approuvés par les bureaux du gouvernement à Tübingen.
1. Préparation de Micropipettes, Solutions et Membranes
- Préparation de Micropipettes
- Tirez micropipettes de verre à l'aide d'un extracteur micropipette avec le programme suivant: chaleur: 540, Pull: 125, vitesse: 20 et Delay: 140. Les montants de longueur d'aiguille à 5,5 cm.
- Aiguilles coniques en utilisant un micromoteur pour obtenir une taille de la pointe appropriée de 4 mm. Conserver les aiguilles dans une boîte ou 15 cm boîte de Petri à éviter d'endommager des conseils.
- Préparation des solutions
- L'ADN plasmidique Solution
- Préparer l'ADN plasmidique contenant la construction d'ADNc souhaité en utilisant un kit Maxi-prep exempt d'endotoxine selon le protocole du fabricant.
- Ajuster la solution de plasmide d'ADN à une concentration finale de 3 ug / ul (sans vecteur de pointe de la GFP) ou de 4 ug /pi (avec 1 ug de vecteur de pic de la GFP) dans endotoxine tampon Tris-EDTA contenant vert rapide (concentration finale de 0,05%).
- Laminine Stock solution
- Dissoudre 1 mg de laminine dans de l'eau stérile jusqu'à un volume final de 1 ml. Préparer des aliquotes de 100 pi et conserver à -80 ° C.
- Poly-L-lysine Stock Solution
- Dissoudre 50 mg de poly-L-lysine dans 50 ml d'eau stérile à une concentration finale de 1 mg / ml. Préparer aliquotes de 1 ml et en magasin -20 ° C.
- Remplissez solution saline équilibrée de Hank (HBSS complet)
- Préparer HBSS complètes en combinant 100 ml de HBSS 10x, 2,5 ml de tampon HEPES 1 M (pH 7,4), 30 ml de 1 M de D-glucose, 10 ml de 100 mM de CaCl2, 10 ml de 100 mM de MgSO 4, et 4 ml de 1 M de NaHCO 3. Ajouter de l'eau stérile jusqu'à 1 L et conserver à 4 ° C.
REMARQUE: Autoclave toutes les solutions attendre tampon HEPES 1 M et 1 M D-glucose, qui sont filter stérilisée.
- Préparer HBSS complètes en combinant 100 ml de HBSS 10x, 2,5 ml de tampon HEPES 1 M (pH 7,4), 30 ml de 1 M de D-glucose, 10 ml de 100 mM de CaCl2, 10 ml de 100 mM de MgSO 4, et 4 ml de 1 M de NaHCO 3. Ajouter de l'eau stérile jusqu'à 1 L et conserver à 4 ° C.
- Slice milieu de culture
- Préparer un milieu de culture de tranche en ajoutant 35 ml de milieu de base de Eagle, 12,9 ml de HBSS complet (1.2.4), 1,35 ml de 1 M de D-glucose, 250 ul de 200 mM de L-glutamine et 500 ul de pénicilline-streptomycine à obtenir un volume final de 50 ml. Ajouter du sérum de cheval à une concentration finale de 5% et stocker à 4 ° C.
- Bas point de fusion (LMP) Agarose
- Préparer une solution à 4% d'agarose LMP par addition de 2 g d'agarose LMP à 50 ml de HBSS complet (1.2.4), suivi par un chauffage dans un micro-ondes pendant 1 à 2 min à puissance élevée. Conserver cette solution dans un bain d'eau à 37-39 ° C. Conserver la solution à 4 ° C et la réutilisation.
- Solution Paraformaldéhyde
- Dans une hotte préparer une 4% de paraformaldehyde (PFA) solution par addition de 4 g de paraformaldehyde dans 100 ml de 1 x PBS. Chauffer la solution à 60 ° C et ajouter quelques gouttes de NaOH 1 N jusqu'à ce que la solution devienne cLear.
- Perméabilisation Solution
- Dissoudre 9 g de BSA dans 300 ml de PBS 1x contenant 0,3% Triton X-100 et conserver à 4 ° C. Ajouter de l'azide de sodium à 10% pour stockage à long terme.
- L'ADN plasmidique Solution
- Revêtement de la membrane Inserts
- Diluer une aliquote de solution laminine de stock (1.2.2) et une aliquote de solution stock poly-L-lysine (1.2.3) dans de l'eau stérile pour un volume final de 12 ml.
- Placez des pièces de membrane en plaques de 6 puits par puits contenant 2 ml d'eau stérile. Ajouter 1 ml de solution de revêtement sur le dessus de la membrane et laisser incuber O / N à 37 ° C dans un incubateur à CO2 à 5%.
- Après incubation laver la membrane insère trois fois avec 1 ml d'eau stérile et sec. Utiliser des inserts de membrane revêtue le même jour ou conserver à 4 ° C pendant jusqu'à quatre semaines dans une plaque à 6 sec.
2. ADN injection et l'électroporation d'embryons E15.5 et a 18,5
- Anesthetize une fois accouplés souris femelle en le plaçant dans une chambre d'anesthésiant saturé avec 5% d'isoflurane et relié à un évaporateur. Faire circuler l'isoflurane et de l'oxygène à un taux de 1 L / min. Gardez l'animal dans la boîte pour 2-4 min ou jusqu'à ce que l'inconscient qui est testé par pincement entre les pattes de la souris.
- Euthanasier la souris inconsciente par dislocation cervicale au jour embryonnaire (E) 15,5 18,5. Disséquer l'utérus contenant les embryons 13 et le placer dans une boîte de Pétri contenant de 15 à 20 ml de froid HBSS complet.
NOTE: A partir de là, de garder les embryons et les tissus sur la glace. - Utilisez une paire de ciseaux pour séparer chaque embryon de la corne de l'utérus et le lieu dans une seconde boîte de Pétri contenant froide HBSS complet.
- Sous un microscope de dissection, rompre le mur du muscle utérin et le placenta en utilisant une paire de pinces fines (N ° 55) et des ciseaux. Relâcher doucement l'embryon de la vésicule ombilicale.
- Utilisez une paire de ciseaux à Bonn decapitate les embryons juste au-dessus des pattes avant à un angle de 60 °. Si l'expérience nécessite le génotypage des embryons, recueillir un échantillon de tissu pour l'isolement d'ADN génomique (un petit morceau de la queue).
- Transférer la tête pour une boîte de Petri propre et sec. Parce que la tête avait été décapité dans un angle de 60 °, la tête doit se incliner d'un côté lorsqu'il est placé dorsale vers le haut.
- Placer une aiguille avec précaution dans le milieu de l'hémisphère à proximité du bregma (figure 1A, B). Injecter environ 3/2 pl (à 3 ou 4 ug / ul) de solution d'ADN en appuyant sur la pédale de l'Picospritzer III en utilisant 30 livres de pression pour la durée de 10 à 15 ms par impulsion, en appliquant des impulsions 5-8. La durée et le nombre des impulsions est fonction du diamètre de l'ouverture de l'aiguille avec des ouvertures plus petites qui nécessitent plus de temps. L'intervalle entre chaque impulsion se élève à une seconde.
- Avant de placer les électrodes, appliquer quelques gouttes de HBSS complet sur la tête de la Bryo. Placer les électrodes de manière à ce que la borne "négative" est sur le même côté que le ventricule injecté et l'électrode «positive» sur la face opposée du ventricule injecté au-dessous de l'oreille de la tête de l'embryon (figure 1C, D). Appliquer cinq impulsions de 50 V.
- Utilisez trois électrodes mm pour E 15,5 et 5 électrodes mm E 18,5.
3. Dissection du cerveau
- Après l'électroporation, décoller la peau de la tête à l'aide d'une paire de pinces fines. En utilisant une paire de ciseaux à ressort effectuer une petite incision dans le milieu du cervelet sur la ligne médiane du crâne.
- Insérer les ciseaux à ressort dans l'incision et couper longitudinalement le long de la suture sagittale. Décoller le crâne et le cerveau se détacher du crâne à l'aide de pinces fines. Transférer l'ensemble du cerveau dans 15-20 ml solution froide HBSS complet.
- Pendant ce temps, versez 4% agarose LMP,maintenue à 37-39 ° C dans un bain d'eau, dans un moule de pelage.
- Prenez le cerveau de la HBSS complète par une petite spatule de scoops et drainer l'excès de HBSS en utilisant du papier de soie amende ou Kimwipes.
- Placez l'ensemble du cerveau doucement dans l'agarose et ajuster sa position avec une aiguille fine. Conserver sur de la glace du moule jusqu'à ce que l'agarose est solidifiée et le bloc est sectionné (pour les coupes coronales bulbes olfactifs pointent vers le haut).
4. Vibratome coupe et tranche Culture
- Couper les blocs d'agarose LMP et les coller sur la platine à l'aide 'super glue. Après la colle est sèche transfert la platine sur le plateau de tampon du vibratome et remplir avec de la glace froid HBSS complet jusqu'à ce que le bloc est immergé dans la solution.
NOTE: Stériliser toutes les surfaces de l'instrument et l'équipement avec 70% d'éthanol avant la coupe. - Préparer 250 um sections vibratome épais en utilisant une nouvelle lame comme suit.
- Coupez le bloc wie les paramètres suivants; fréquence - 60 Hz, amplitude - 0,7 um, la vitesse de 16 à 18 mm / sec. Couper les sections contenant le tissu désiré avec les paramètres ci-dessus à vitesse lente (9 mm / sec). Démarrage du sectionnement du cerveau postérieur, recueillir 5-7 sections de cerveau.
- Transférez les sections à une boîte de culture à 6 puits propre contenant 5 ml de glace froid compléter HBSS avec l'aide d'une spatule coudée et garder sur la glace jusqu'à ce que toutes les sections sont collectées (figure 1E).
- Humidifier la membrane d'une manière croisée avec 100 pi de HBSS complet avant de placer les articles sur la membrane, afin de faciliter l'orientation des sections.
- Transférez les sections à l'aide d'une spatule coudée sur la membrane (ramasser un coin de la section avec une pince et tirez sur la spatule et ensuite utiliser la pince pour pousser la section sur la membrane). Placez jusqu'à cinq sections sur une membrane et d'organiser en utilisant une pince (figure 1F). Ne chevauchent pas les uns avec les autres sections.
- Prenez l'excès de HBSS au large de la membrane à l'aide d'une pipette. Les membranes spécifiques utilisées ici sont fixés à un cadre et insérés dans la plaque de culture de tissu, ce qui permet au tissu d'être en contact mais ne sont pas couverts par le milieu.
- Placer les inserts de membrane dans une plaque de 6 puits contenant 1,8 ml de milieu de culture de tranche (1.2.5) (figure 1G, H). Incuber la boîte de culture à 37 ° C avec 5% de CO2 pendant 11 ou 14 DIV DIV. Changer la moitié du milieu (0,9 ml) tous les deux jours.
NOTE: A ce stade, ajouter des réactifs comme Bromodeoxyuridine (BrdU; 10 uM concentration finale) pour l'étiquetage des cellules proliférantes aux médias pour les 20 premières heures de la durée de la culture.
5. Fixation des sections Suivi par immunofluorescence
- Utilisez une lame de scalpel propre et tranchant pour couper et tailler les membranes en fonction de l'orientation deles sections.
- Transférer les sections le long de la membrane à une plaque de 24 puits contenant 1 ml de 4% PFA (1.2.7). Incuber les sections pendant 1 heure à la température ambiante suivie par trois lavages avec 1 x PBS pendant 15 min chacun. Incuber les sections O / N avec une solution de perméabilisation à 4 ° C avec agitation douce.
- Le jour suivant, incuber les sections avec des anticorps primaires appropriées, dilués dans une solution de perméabilisation, O / N ou pendant 48 heures à 4 ° C avec agitation douce.
- Laver les sections 3 fois pendant 15 min avec 1x PBS et incuber O / N à 4 ° C avec les anticorps secondaires appropriées dilué dans une solution de perméabilisation.
- Après l'incubation avec des anticorps secondaires, laver une fois avec les sections 1x PBS pendant 15 min suivi par coloration DAPI pendant 10 min.
- Laver les sections 3 fois avec 1x PBS pendant 15 min chacun et transfert à lames de microscope. Ajouter ImmunoMount et placer délicatement une lamelle sur le dessus des sections. Sécher les lames O / N à 4 ° C et soial vernis à ongles.
NOTE: Gardez les diapositives toujours à 4 ° C.- Analyser les cultures tranche par microscopie confocale (figure 1I).
Résultats
L'ablation du facteur de transcription Bcl11b provoque l'altération de la prolifération de cellules progénitrices et de la différenciation neuronale résultant en une taille de corps godronné et réduit le nombre de cellules. En outre neurones mutants ne parviennent pas à se intégrer dans les circuits de l'hippocampe provoquant apprentissage et troubles de la mémoire 8. Pour répondre aux questions concernant le mécanisme (s) de réglementation des Bcl11b dans ces processus ex utero électroporation a été employé.
Se adressant à la question de savoir si Bcl11b cellule autonome régule la différenciation des cellules neuronales, suppressions mosaïque de Bcl11b ont été générés par ex utero électroporation d'une recombinase construction ou GFP seule 11 GFP Cre dans Bcl11b flox / flox hippocampes à E15.5 suivie par la culture organotypique de tranche jusqu'à 18 jours après l'électroporation (Figure 2A, B, cette figure a été modifié depuis 8). Pour déterminer si Bcl11b régule la différenciation de cellules granulaires cellule autonome coloration par immunofluorescence a été effectuée en utilisant des anticorps spécifiques reconnaissant NeuroD ainsi que la GFP. NeuroD est exprimé dans les stades mitotiques 2b / 3 et les cellules postmitotiques début 14. Nous avons montré précédemment que le nombre de cellules positives NeuroD est significativement augmentée dans Bcl11b mutants conditionnels indiquant un arrêt de la différenciation neuronale 8. Alors que le nombre de cellules positives GFP seule et cellules positives / de NeuroD GFP ne différait pas dans les cellules de contrôle et mutantes une augmentation significative de cellules positives NeuroD a été observée dans le gyrus denté où les cellules avaient reçu la recombinase Cre (figure 2C; ce chiffre a été modifié de 8). Trouver des cellules positives Neurod non seulement dans les cellules qui avaient reçu la Cre recombinase, mais aussi dans des cellules de type sauvage a suggéré que des mécanismes indirects sont impliqués dans la régulation de Bcl11b différenciation des cellules neuronales. A partir de ces données, cependant, Additfonctions cellulaires-autonome ional de Bcl11b ne peuvent être exclues.
Auparavant, Desmoplakine a été déterminée comme un gène cible directe de Bcl11b 8. Il a également été démontré que Desmoplakine est impliqué dans la régulation de la prolifération des cellules progénitrices et la différenciation des kératinocytes 15. Pour démontrer si Desmoplakine est impliqué dans la régulation de la prolifération de cellules progénitrices et / ou de la différenciation neuronale de l'ADN gyrus plasmide denté exprimant la GFP seule ou GFP et Desmoplakine sous le contrôle du promoteur du CMV a été électroporé dans le contrôle et Bcl11b cerveaux mutants (Figure 3A - C; ce chiffre a été modifié depuis 8). Les tranches de cerveau ont été cultivées pendant la 20 première heure en présence de BrdU (10 pM concentration finale). Au jour 11 après l'électroporation des cultures de tranches ont été fixés suivis par immunocoloration BrdU et le nombre de cellules positives à la BrdU a été déterminée. Bcl11b tissu mutante électroporés avec GFP ne contenait beaucoup moins de cellules BrdU positives par rapport au tissu témoin. Cependant, la co-électroporation de la GFP et Desmoplakine sauvé le nombre de cellules positives BrdU pour contrôler les niveaux (Figure 3D; ce chiffre a été modifié depuis 8). Pris ensemble, ces données confirment en outre Desmoplakine comme un gène cible directe de Bcl11b et son rôle dans la régulation de la prolifération de cellules progénitrices.

Figure 1. Mise en place de l'ex utero électroporation et la culture organotypique à E15.5. (A) Injection d'ADN dans un hémisphère. (B) Représentation schématique de l'injection d'ADN. (C) de positionnement des électrodes. (D) Schéma dessin du placement des électrodes. (E) Vibratome sectionnement et hANUTENTION de coupes de cerveau. (F) Mise en place des coupes de cerveau sur des membranes spécifiques. (GI) à champ clair (G) et de fluorescence (H, GFP) l'analyse des cultures tranche au jour 1 après l'électroporation. (I) l'image confocale du gyrus denté au jour 11 après l'électroporation utilisant DAPI et GFP coloration. La ligne pointillée indique le gyrus denté. Barre d'échelle = 100 um. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2. Mosaïque suppression de Bcl11b par ex électroporation in utero et la culture organotypique (modifié à partir de 8). Électroporation de la lutte antivectorielle pCIG2 seul (A) et pCIG2- Cre construct (B) dans le gyrus denté à E15.5 suivie par culture organotypique de tranche pendant 18 jours. Les articles ont été immunocolorées en utilisant des anticorps reconnaissant la GFP (vert) et NeuroD (rouge). Encarts affichent GFP (vert) et Bcl11b (rouge) coloration à plus fort grossissement pour démontrer la perte d'expression Bcl11b dans les cellules exprimant Cre -recombinase. (C) L'analyse statistique de la GFP, NeuroD et les cellules positives / de NeuroD GFP. Les lignes pointillées indiquent les gyrus denté. test t, * p <0,005; barres d'erreur, sd; n = 5. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
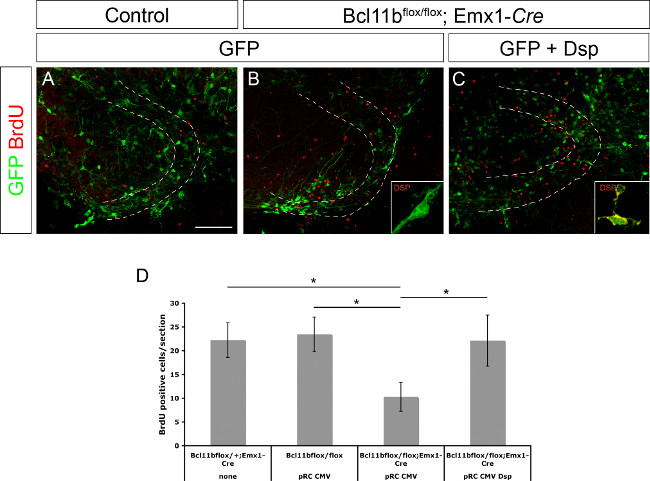
Figure 3. Bcl11b phénotype est sauvé par la réintroduction de Desmoplakine (modifié à partir de 8). GFP seulement (A, B) ainsi que la GFP et Desmoplakine (C) ont été électroporés dans le gyrus denté de commande (A) et mutant (B, C) dans des cerveaux E15.5 suivie par culture organotypique de tranche pendant 11 jours. Les articles ont été immunocolorées en utilisant des anticorps reconnaissant la GFP (vert) et BrdU (rouge). (D) Analyse statistique des cellules positives BrdU. Les lignes pointillées indiquent les gyrus denté. Encarts affichent Desmoplakine coloration (verte) à plus fort grossissement. test t, * p <0,01; barre d'erreur, sem; n = 4. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
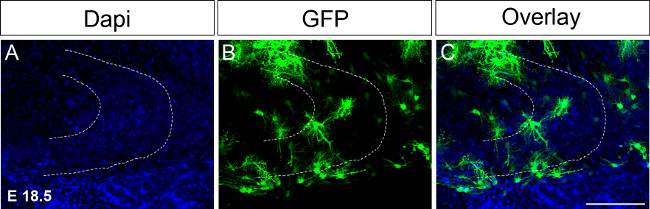
Figure 4. Ex utero électroporation à E 18,5 suivie par la culture organotypique.L'injection d'ADN exprimant la GFP dans une hémisphère suivie par immunocoloration à 16 jours après l'électroporation (A) coloration DAPI;. (B) coloration GFP; (C) fusionné image. La ligne pointillée indique gyrus denté. Barre d'échelle = 100 um. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
L'hippocampe joue un rôle important dans l'apprentissage et la mémoire. Le gyrus denté est aussi l'une des deux régions du cerveau où se produit la neurogenèse non seulement au cours du développement, mais aussi à l'âge adulte. Postnatale et adultes produit neurogenèse hippocampique d'une manière similaire impliquant de nombreux facteurs communs. Définir les mécanismes de régulation de ces facteurs sera très utile dans la compréhension des maladies neurodégénératives qui à son tour conduire à de nouvelles thérapies et des mesures préventives. Pour obtenir cette information, on a besoin d'un système pour manipuler des cellules individuelles et de les observer dans leur environnement natif comme l'a démontré par électroporation ex utero suivie par la culture organotypique.
Ex utero électroporation a été appliquée avec succès dans l'étude du développement du cortex 11,16. À notre connaissance examinant le rôle de Bcl11b au développement de l'hippocampe est le premier décrivant ex utero électroporation de DNA en gyrus denté tissus 8. Nous avons basé notre protocole sur les méthodes publiées par le groupe Polleux l'étude du développement du cortex 11,12. Pour appliquer avec succès cette méthode pour étudier le gyrus denté de la taille et la position des électrodes ont dû être ajustés. Placer l'électrode négative au niveau du cortex à proximité du site d'injection et l'électrode positive sur le site ci-dessous l'oreille opposée changé la polarité de l'électroporation et ont réussi à introduire de l'ADN dans des cellules du gyrus denté. Placer les électrodes correctement et appliquer un courant de 0,06 à 0,08 mA se est avéré être des mesures très cruciaux pour obtenir des résultats satisfaisants d'électroporation. Pour obtenir le courant le plus approprié dépend essentiellement de la mise en place correcte des électrodes de la manière décrite ci-dessus. Étapes critiques supplémentaires du protocole sont injecter le matériau dans le ventricule ainsi que la manipulation des tranches après vibratome sectionnement. Le tissu cérébral est pas fixe tout au long de la procédure entière etdonc le tissu est très doux et facilement destructible lors du transfert de la vibratome sur la membrane pour la culture. Les articles doivent également être manipulés avec le plus grand soin lors du démarrage du immunocoloration. Avec ces modifications et manipulations considérations de cellules individuelles du gyrus denté ont été effectuées avec succès répondre aux questions concernant la réglementation de Bcl11b du développement de l'hippocampe précoce (Figure 2 et 3; cette chiffres ont été modifiés à partir de 8).
Comme mentionné ci-dessus la manipulation des cellules individuelles et d'observer leur destin est l'avantage majeur d'ex utero électroporation. Un inconvénient majeur de l'approche ex utero en comparaison avec électroporation in utero est le temps limité pour garder des tranches dans la culture. Il est également possible que les conditions de culture ex utero peuvent provoquer un retard dans le développement. Dans nos expériences jusqu'à présent, nous avons réussi à garder les tranches dans la culture up à 18 jours, ce qui correspond à l'âge de P14. La culture de tranches organotypiques delà de cette durée conduit à la désintégration du tissu. Un inconvénient supplémentaire de l'approche ex utero est le nombre limité d'embryons qui peuvent être électroporation par mère. Contrairement à électroporation in utero où jusqu'à huit embryons peuvent être traités ce nombre est limité à quatre embryons dans l'approche ex utero. Dissection du embryons, électroporation, vibratome sectionnement et le transfert des tranches dans des conditions de culture doivent être effectuées dans un court laps de temps pour assurer les cultures tranche succès.
Parce que les grands événements de développement de gyrus denté se produisent entre P14 et P30 il serait nécessaire de garder des tranches organotypiques en culture pendant des périodes de temps prolongées. Dans une première tentative d'étendre la culture électroporations de temps ont été effectuées à E 18,5 ajustant les conditions en conséquence (Figure 4; voir le protocole). Électroporation au eest point dans le temps permet de maintenir les sections de cerveau dans la culture jusqu'à P17 ou 18. En outre, la formation hippocampique est développée à E 18,5 par rapport à 15,5 E, par exemple, les structures hippocampiques sont déjà formés et plus facilement reconnaissable. Dans l'avenir, nous aimerions effectuer ex utero électroporation au même points de temps après, par exemple, P0 à P4 pour examiner les changements au cours du développement de gyrus denté jusqu'à P30.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
This work was supported by grants from the Deutsche Forschungsgemeinschaft to SB (BR-2215; SFB 497/A9).
matériels
| Name | Company | Catalog Number | Comments |
| Flaming/ Brown Micropipette Puller | Sutter Instruments Company (USA) | P-97 | |
| Fine Glass Pipettes | Warner Instruments | G100F-4 | |
| Microgrinder | Narishige, Japan | EG-44 | |
| Anesthetic Bracket unit | Harvard Apparatus | PY2 34-0412 | |
| Halovet Vaporizer | Harvard Apparatus | PY2 34-0398 | |
| Fluovac System | Harvard Apparatus | PY2 34-0387 | |
| IMS Fluosorber | Harvard Apparatus | PY2 34-0415 | |
| Anesthetizing Chamber | Harvard Apparatus | PY2 34-0460 | |
| Electroporator | BEX Company | CUY21 EDIT | |
| Tweezers with disk electrodes | BEX Company | LF650P3 | 3 mm electrodes for E15.5 |
| Tweezers with disk electrodes | BEX Company | LF650P5 | 5 mm electrodes for E18.5 |
| Picospritzer III | Parker Hannifin Corporation | P/N 052-0500-900 | |
| HM 650 V Vibrating Blade Microtome, 230 V | Thermo Scientific | 920120 | |
| Dissection Microscope | Carl Zeiss Microscopy Gmbh | Stemi SV8 | |
| Inverted Microscope | Leica | Leica DM IL LED | |
| Confocal Microscope | Leica | Sp5II | |
| 6 well dish | BD Falcon | #353502 | |
| 6 well dish | CELLSTAR | #657160 | |
| Tissue culture inserts | BD Falcon | #353090 | |
| Fast Green | Sigma | F7252 | |
| Laminin | Sigma | #L2020 | |
| Poly-L-lysine | Sigma | #P5899 | |
| Spring scissors | Fine Science Tools | 15003-08 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Forceps | Dumont #55 | 11255-20 Inox | |
| HBSS 10x | Life Technology | 14180-046 | |
| BME | Life Technology | 41010-26 |
Références
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends Neurosci. 27, 447-452 (2004).
- Frotscher, M., Zhao, S., Forster, E. Development of cell and fiber layers in the dentate gyrus. Prog Brain Res. 163, 133-142 (2007).
- Muramatsu, R., Ikegaya, Y., Matsuki, N., Koyama, R. Neonatally born granule cells numerically dominate adult mice dentate gyrus. Neuroscience. 148, 593-598 (2007).
- Li, G., Pleasure, S. J. Morphogenesis of the dentate gyrus: what we are learning from mouse mutants. Dev Neurosci. 27, 93-99 (2005).
- Hsieh, J. Orchestrating transcriptional control of adult neurogenesis. Genes Dev. 26, 1010-1021 (2012).
- Li, G., Pleasure, S. J. Genetic regulation of dentate gyrus morphogenesis. Prog Brain Res. 163, 143-152 (2007).
- Collas, P. The current state of chromatin immunoprecipitation. Mol Biotechnol. 45, 87-100 (2010).
- Simon, R., et al. A dual function of Bcl11b/Ctip2 in hippocampal neurogenesis. Embo J. 31, 2922-2936 (2012).
- Pilaz, L. J., Silver, D. L. Live imaging of mitosis in the developing mouse embryonic cortex. J Vis Exp. (88), (2014).
- Pacary, E., et al. Visualization and genetic manipulation of dendrites and spines in the mouse cerebral cortex and hippocampus using in utero electroporation. J Vis Exp. (65), (2012).
- Hand, R., et al. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-62 (2005).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal development. Sci STKE. (136), 19 (2002).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. J Vis Exp. (2), (2007).
- Sugiyama, T., Osumi, N., Katsuyama, Y. The germinal matrices in the developing dentate gyrus are composed of neuronal progenitors at distinct differentiation stages. Dev Dyn. 242, 1442-1453 (2013).
- Lechler, T., Fuchs, E. Desmoplakin: an unexpected regulator of microtubule organization in the epidermis. J Cell Biol. 176, 147-154 (2007).
- Nichols, A. J., O'Dell, R. S., Powrozek, T. A., Olson, E. C. Ex utero electroporation and whole hemisphere explants: a simple experimental method for studies of early cortical development. J Vis Exp. (74), (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon